Жидкость глушения скважин на основе отработанного абсорбента ди-оксида углерода — Промысловая химия
Призабойная зона скважин (ПЗС) является важнейшей областью пласта, от состояния которой во многом зависят условия фильтрации и притока пластовой жидкости к забою, потенциал отдельно взятой скважины и, в конечном счете, коэффициент извлечения нефти из месторождения. Основное негативное влияние на ПЗС оказывают технологические операции, проводимые в скважинах, и свойства жидкостей, которые при этом применяются.
Глушение является наиболее массовым видом воздействия на скважины и представляет собой комплекс мероприятий по выбору, приготовлению и закачке в пласт специальных жидкостей глушения (ЖГ), обеспечивающих безопасное и безаварийное проведение профилактических работ. В ходе геолого-промысловых работ каждая скважина подвергается глушению не реже одного раза в год из-за необходимости проведения подземных ремонтов, смены насосного оборудования, промывки забоя от загрязнений и т. д. [1;2].
д. [1;2].
Основной задачей операции глушения продуктивных пластов является обеспечение безопасных условий работы буровых и ремонтных бригад в стволе скважины путем предотвращения выброса нефти или газа из пласта. Решение данной задачи возможно при условии применения специальных механических отсекателей, противовыбросового оборудования либо с помощью различных составов глушения пластов, создающих на забое скважин давление выше пластового.
Все известные жидкости глушения условно делят на 2 группы:
-
на водной основе, в том числе пены, пресные и пластовые воды; растворы минеральных солей; глинистые растворы; гидрогели; прямые эмульсии;
-
на углеводородной основе, в виде товарной или загущенной нефти или обратных эмульсий с содержанием водной фазы до 70% [3 – 5].
В группе ЖГ на водной основе ведущая роль принадлежит растворам минеральных солей или чистым рассолам, не содержащим твердой фазы.
Годовая потребность отрасли в технологических жидкостях глушения в широком диапазоне плотностей исчисляется сотнями тысяч тонн. Использование таких составов ограничено узким ассортиментом применяемых солей.
Особое место среди ЖГ занимают тяжелые рассолы, широкое применение которых обусловлено стремлением обеспечить максимальную степень сохранения коллекторских свойств продуктивных пластов, характеризующихся повышенными давлениями.
Жидкости глушения на водной основе являются наиболее технологичными, наименее токсичными и экологически безопасными. К числу основных компонентов для приготовления рассолов плотностью 1350–1800 кг/м3 относятся хлорид кальция, бромиды калия, натрия, кальция, карбонат и формиат калия, нитрат кальция, хлорид цинка.
Большой практический интерес представляют сегодня рассолы на основе водных растворов смеси CaCl При этом плотности насыщенных растворов отдельно взятых хлорида кальция и нитрата кальция не превышают 1420 кг/м3 и 1560 кг/м3, соответственно, тогда как для композиции на их основе она равна 1780 кг/м3 [6].
При этом плотности насыщенных растворов отдельно взятых хлорида кальция и нитрата кальция не превышают 1420 кг/м3 и 1560 кг/м3, соответственно, тогда как для композиции на их основе она равна 1780 кг/м3 [6].
Осложняющие факторы при глушении скважин минеральными солями:
-
кольматация в результате взаимодействие воды и растворов солей с глинистыми минералами;
-
образование малорастворимых солей;
-
формирование водонефтяных эмульсий;
-
возникновение водной блокады.
Жидкость глушения должна отвечать следующим требованиям:
-
оказывать минимальное воздействие на загрязнение окружающей среды [7];
-
плотность ее должна быть достаточной для обеспечения необходимого противодавления на пласт;
-
максимально сохранять коллекторские свойства продуктивного пласта;
-
быть технологичной в приготовлении и использовании;
-
не оказывать коррозионно-агрессивного воздействия на обсадные трубы и технологическое оборудование;
-
быть совместимой с другими технологическими жидкостями, используемыми при ремонте скважин, в том числе с пластовой водой;
-
сохранять термостабильность в конкретных условиях ее применения;
технологические свойства должны быть регулируемыми в широких пределах горно-геологических условий эксплуатации скважин [8];
-
соответствовать современным требованиям к охране труда рабочего персонала, а также взрыво- и пожаробезопасности [9].

Достаточно полно большинству из перечисленных требований отвечает жидкость глушения, содержащая хлориды калия и кальция, а также продукт НГ-1, разработанная Санкт-Петербургским государственным горным университетом [10].
Включённый в её состав гидрофобизатор НГ-1 предназначен для обработки призабойной зоны пластов с целью ограничения водопритока и увеличения нефтеотдачи пластов.
Он представляет собой смесь продуктов реакции триэтаноламина с жирными кислотами таллового масла либо с высококипящими фракциями синтетических жирных кислот с растворителями и добавками, в качестве которых используются ароматические углеводороды — сольвенты, эфиро- и спиртосодержащие смеси, продукты оксиэтилирования и алкилирования технических спиртов, парафинов и др., растворители и добавки, которые обеспечивают технологичность применения реагента, усиливают его диспергируемость в водной среде.
В большинстве случаев плотность закачиваемой композиции является главным фактором, который учитывает величину давления на забое скважин. В общем случае забойное давление рассчитывается по формуле
В общем случае забойное давление рассчитывается по формуле
Рзаб. = Нс* ρжг* g* cos
Нс — длина ствола скважины, м;
ρжг — плотность жидкости глушения, кг/м3;
g — ускорение свободного падения, м/с2;
α — угол отклонения ствола скважины от вертикали, град.
В процессах добычи нефти и газа в качестве жидкости глушения рекомендованы солевые составы без твердой фазы (не содержащие частицы размером более 2 мкм) на основе поташа, КСl, так как они не только сохраняют, но и увеличивают естественную проницаемость кернового материала.
По нашему мнению, в качестве ЖГ могут быть также использованы некоторые поташсодержащие крупнотоннажные отходы химических производств. Одним из них является отработанный раствор « Бенфилд» (или Карсол), используемый на узле очистки диоксида углерода на агрегатах аммиака типа Кемико. Необходимость его переработки возникает при накоплении хлоридов и вспенивании, что негативно отражается на производительности узла абсорбции диоксида углерода.
Одним из них является отработанный раствор « Бенфилд» (или Карсол), используемый на узле очистки диоксида углерода на агрегатах аммиака типа Кемико. Необходимость его переработки возникает при накоплении хлоридов и вспенивании, что негативно отражается на производительности узла абсорбции диоксида углерода.
Он содержит в своем составе карбонат и гидрокарбонат калия ихарактеризуется следующими параметрами (Табл.1).
Таблица 1. Характеристика отработанных поташных растворов с агрегатов аммиака.
|
Показатели |
Значение |
|
Плотность, не менее г/см3 |
1,210 |
|
рН, не более |
10,5 |
|
Хлориды, не менее, мг/л |
100,0 |
|
К2СО3, % масс. |
14 — 17 |
|
КНСО3, % масс. |
13 – 1 5 |
|
Пятиокись ванадия, не более % масс. |
0,5 |
|
Активатор АСТ или диэтаноламин, менее, % масс. |
1,0 |
|
Механические примеси, не более, г/л |
0,100 |
|
Вода |
остальное |
Такой выбор вовсе не случаен, так как водный раствор на основе чистого карбоната калия способствует повышению естественной проницаемости пород. Проведенные в «ВНИИКРнефть» исследования на искусственных кернах (спрессованная смесь песка, 0,5 % глины, 3 % мела) показали, что значения коэффициента восстановления проницаемости для нефти у растворов KCl, Na2SO4
Проведенные в «ВНИИКРнефть» исследования на искусственных кернах (спрессованная смесь песка, 0,5 % глины, 3 % мела) показали, что значения коэффициента восстановления проницаемости для нефти у растворов KCl, Na2SO4
Этот результат объясняется высокой активностью ионов калия и относительно небольшим (например, по сравнению с ионом хлора у KCl) гидратным числом у анионов СО32—.Поэтому, при ионообмене с глинистыми минералами K2CO3 образует более тонкие, чем хлорид калия, гидратные оболочки на глинистых частицах. В результате этого обеспечивается повышение пористости и, соответственно, проницаемости заглинизированных песчаников.
В силу изложенного была апробирована композиция, включающая отработанный раствор «Бенфилд» с агрегатов аммиака типа «Кемико» следующего состава (Табл. 2).
2).
Таблица 2. Характеристика жидкости глушения марки ЖГ «Дельта».
|
Наименование показателей |
Результаты анализа |
|
Плотность*) раствора («Бенфильд» или «Карсол»), кг/м3 |
1,210 ÷ 1,290 |
|
рН |
8,5 ÷ 10,5 |
|
Многофункциональный реагент «МЛ-Супер», % масс. |
0,5 ÷ 1 |
|
Динамическая вязкость при 20оС, мПа*с |
6 ÷ 8 |
*) При необходимости может быть увеличена добавлением поташа
Присутствующий в ней ПАВ «МЛ-СУПЕР» по ТУ 2383-002-51881692-2000, разработанный ООО «Дельта-пром инновации», выполняет не только функции гидрофобизатора, но и позволяет снижать межфазное натяжение на границе раздела фаз и предотвращать образование высоковязких водонефтяных эмульсий.
Предложенный состав не содержит частиц твердой фазы размером более 2 мкм и не оказывает отрицательного влияния на фильтрацию терригенных коллекторов. Напротив, он способствует увеличению естественной проницаемости кернового материала. Общее содержание механических примесей не превышает в нем 100 мг/л. Жидкость глушения проявляет одновременно и свойства ингибитора коррозии, способна связывать Н2S благодаря присутствию в её составе K2CO3. Этот эффект усиливается вследствие наличия в ней диэтаноламина и пятиокиси ванадия. Оксидное соединение пассивирует металлическую поверхность скважин благодаря образованию стойкой к коррозии плёнки.
Приготовление жидкости глушения осуществляется путем интенсивного перемешивания используемых компонентов. Высокие качественные показатели достигаются с применением стационарных установок, работающих на принципах вибрационно-магнитной активации.
С целью определения влияния на проницаемость ПЗС выполнен обширный комплекс лабораторных и опытно-промысловых исследований. Оптимизация указанного в таблице 2 состава жидкости глушения произведена с учетом требуемых технологических параметров, учитывающих температуру окружающей среды и геолого-технические характеристики ремонтируемых скважин.
Оптимизация указанного в таблице 2 состава жидкости глушения произведена с учетом требуемых технологических параметров, учитывающих температуру окружающей среды и геолого-технические характеристики ремонтируемых скважин.
В частности, испытание на совместимость с пластовыми водами осуществлялось с применением минерализованных водных растворов (имитатов), приготовленных растворением в литре воды 11,36 мг сернокислого кальция, 78,12 мг гидрокарбоната натрия, 138600 мг хлористого натрия, 41600 мг хлористого кальция, 40700 мг двухводного хлористого магния и 560 мг двухводного хлористого бария. Температура имитата доводилась до 90оС (температура внутри пласта) и в него добавлялись различные количества жидкости глушения для оценки совместимости.
В ходе эксперимента не выявлено выпадение осадка и образования коллойдных солевых систем. На примере нефтей Первомайского и Опалихинского месторождений также не подтверждено формирование стойких водонефтяных эмульсий при подаче в пласт ЖГ, содержащей 1,0 % масс. реагента «МЛ-СУПЕР» (Табл. 3).
реагента «МЛ-СУПЕР» (Табл. 3).
Таблица 3. Влияние ЖГ и пластовых вод на образование и свойства водо-нефтяных образований
|
месторождение
|
Характеристика нефти |
Характеристика водо-нефтяных образований |
|||||
|
с пластовой водой |
с ЖГ |
||||||
|
ρ*), г/см3 |
вязкость. мПа*с |
ρ, г/см3 |
межфазное натяжение, мН/м |
характер эмульсии |
вязкость, мПа*с |
межфазное натяжение, мН/м |
|
|
Первомайское |
0,905 |
48,37 |
1,05 |
35 |
плотная и вязкая |
365 |
0,516 |
|
1,19 |
30 |
296 |
0,870 |
||||
|
Опалихинское |
0,906 |
39,51 |
1,05 |
20 |
вязкая и устойчивая |
153 |
0,293 |
|
1,19 |
22 |
132 |
0,578 |
||||
*) плотность.
Достаточно высоким (свыше 100 %) оказался и коэффициент проницаемости пластов после их обработки указанной жидкостью глушения, что свидетельствует о подавлении всех нежелательных процессов.
Таким образом, в результате исследований ЖГ «Дельта» на основе отработанного раствора «Бенфилд» подтверждено, что широкое внедрение созданной композиции позволит решить такие важные задачи, как:
-
снижение межфазного натяжения на границе углеводород — вода;
-
подавление процессов глинонабухания;
-
сохранение первоначальных коллекторских характеристик пласта;
-
уменьшение затрат, связанных с освоением и выходом на режим скважин в послеремонтный период;
-
повышение дебита по нефти и коэффициента продуктивности скважин за счет разрушения водонефтяных эмульсий и улучшения фильтрационных характеристик призабойной зоны пласта;
На основе проведенных исследований составлены и введены в действие технические условия (ТУ 2458-011-67048683-2015) на концентрат ЖГ «Дельта» с целью его применения в процессах нефтегазодобычи [11].
Данная разработка важна для многих предприятий газохимии, использующих в технологических процессах получения аммиака поташные растворы «Бенфилд» и «Карсол».
Список литературы
1.Афанасьев С.В. Волков В.А. Жидкость глушения нефтяных скважин на основе отходов агрегатов аммиака // Химическая техника. Межотраслевой журнал для главных специалистов предприятий. 2016. №9. С. 43 – 44.
2.Патент на изобретение RU №2279462.Жидкость глушения нефтегазовой скважины/ Опубл. 2006 г.
3.Паршукова А.Р., Овчинников В.П., Леонтьев Д.С. Жидкости и технологии глушения скважин. Учебное пособие. – Тюмень. Тюм. ГНГУ. 2013. – 96 с.
4.Патент на изобретение RU №2203919. Жидкость для глушения скважин /Опубл. 2002 г.
5.Пономарёва И.Н., Илюшин П.Ю., Мартюшев Д.А., Рахимзянов Р.М. Результаты исследований в области повышения эффективности глушения скважин// Нефтяное хозяйство. 2017.№1. С.62 – 65.
2017.№1. С.62 – 65.
6.Шишкин А.В. Отечественные решения для глушения скважин с аномально высокими пластовыми давлениями // Территория нефтегаз. 2015. №11. С. 68 – 71.
7.Трифонов К.И. Афанасьев С.В. Катышев С.В. Естественные и техногенные источники загрязнения биосферы. Учебник. – Самара. Сам. научн. центр. РАН. 2014.–148 с.
8.Атвиновская Т.В. Роль жидкостей глушения в процессе ремонта скважин // Вестник ГГТУ им. П.О. Сухого. 2018.№2. С.34 – 41.
9.Афанасьев С.В. Пожарная безопасность технологических процессов. Учебное пособие. – Самара. Сам. научн. центр РАН. 2015. – 521 с.
10.Гладков П.Д. Рогачев М.К. Выбор технологической жидкости для глушения скважин перед подземным ремонтом на приобском нефтяном месторождении//Электронный научный журнал «Нефтегазовое дело». 2012. №2; http://www.ogbus.ru.
11. Афанасьев С.В., Волков В.А., Долгополов М.В., Филатов В.А. Жидкость глушения нефтяных скважин на основе поташных растворов «Бенфилд»// Нефть. Газ. Новации. Научно-технический журнал. 2016.№8. С.52 –54.
Газ. Новации. Научно-технический журнал. 2016.№8. С.52 –54.
Keywords: absorbent of carbon dioxide, the liquid damping, genealogyj, hydrophobizator, permeability of layers, corrosion inhibition
Статья «Жидкость глушения скважин на основе отработанного абсорбента ди-оксида углерода» опубликована в журнале «Neftegaz.RU» (№10, Октябрь 2020)
ОФС.1.3.0002.15 Титрованные растворы | Фармакопея.рф
Содержимое (Table of Contents)
- 1 ОФС.1.3.0002.15 Титрованные растворы
- 1.1 Исходные стандартные вещества для титрованных растворов
- 1.1.1 Калия бромат РО
- 1.1.2 Калия гидрофталат РО
- 1.1.3 Калия дихромат РО
- 1.1.4 Кислота бензойная РО
- 1.1.5 Мышьяка оксид РО
- 1.1.6 Натрия карбонат безводный РО
- 1.1.7 Натрия хлорид РО
- 1.1.8 Сульфаниловая кислота РО
- 1.1.9 Цинк РО
- 1.2 Титрованные растворы
- 1.2.1 1 М раствор азотной кислоты
- 1.
 2.2 0,1 М раствор аммония тиоцианата
2.2 0,1 М раствор аммония тиоцианата - 1.2.3 0,01 М раствор аммония тиоцианата
- 1.2.4 0,1 М раствор аммония церия нитрата
- 1.2.5 0,01 М раствор аммония церия нитрата
- 1.2.6 0,1 М раствор аммония церия сульфата
- 1.2.7 0,01 М раствор аммония церия сульфата
- 1.2.8 0,05 М раствор бария перхлората
- 1.2.9 0,025 М раствор бария перхлората
- 1.2.10 0,1 М раствор бария хлорида
- 1.2.11 0,004 М раствор бензэтония хлорида
- 1.2.12 0,0167 М (0,1 н.) раствор бромид-бромата
- 1.2.13 0,1 М раствор железа(III) аммония сульфата
- 1.2.14 0,1 М раствор железа(II) сульфата
- 1.2.15 0,5 М (1 н.) раствор йода
- 1.2.16 0,1 М (0,2 н.) раствор йода
- 1.2.17 0,05 М (0,1 н.) раствор йода
- 1.2.18 0,01 М (0,02 н.) раствор йода
- 1.2.19 0,1 М раствор йода монохлорида (для определения йодного числа)
- 1.2.20 0,033 М (0,2 н.) раствор калия бромата
- 1.2.21 0,02 М (0,12 н.) раствор калия бромата
- 1.
 2.22 0,0167 М (0,1 н.) раствор калия бромата
2.22 0,0167 М (0,1 н.) раствор калия бромата - 1.2.23 0,0083 М (0,05 н.) раствор калия бромата
- 1.2.24 1 М раствор калия гидроксида
- 1.2.25 0,1 М раствор калия гидроксида
- 1.2.26 0,5 М раствор калия гидроксида в спирте 60 % (об/об)
- 1.2.27 0,5 М раствор калия гидроксида спиртовой
- 1.2.28 0,1 М раствор калия гидроксида спиртовой
- 1.2.29 0,01 М раствор калия гидроксида спиртовой
- 1.2.30 0,1 М раствор калия гидрофталата
- 1.2.31 0,0167 М (0,1 н.) раствор калия дихромата
- 1.2.32 0,05 М раствор калия йодата
- 1.2.33 0,0167 М (0,1 н.) раствор калия йодата
- 1.2.34 0,001 М раствор калия йодида
- 1.2.35 0,02 М раствор калия перманганата
- 1.2.36 0,1 М раствор лития метоксида
- 1.2.37 0,05 М раствор магния сульфата
- 1.2.38 0,1 М раствор магния хлорида
- 1.2.39 0,02 М раствор меди сульфата
- 1.2.40 0,1 М раствор натрия арсенита
- 1.2.41 0,025 М раствор натрия арсенита
- 1.
 2.42 0,001 М раствор натрия додецилсульфата
2.42 0,001 М раствор натрия додецилсульфата - 1.2.43 1 М раствор натрия гидроксида
- 1.2.44 0,5 М раствор натрия гидроксида
- 1.2.45 0,1 М раствор натрия гидроксида
- 1.2.46 0,05 М раствор натрия гидроксида
- 1.2.47 0,02 М раствор натрия гидроксида
- 1.2.48 0,01 М раствор натрия гидроксида
- 1.2.49 0,1 М раствор натрия гидроксида этанольный
- 1.2.50 0,1 М раствор натрия гидроксида в смеси метанола и бензола
- 1.2.51 0,1 М раствор натрия метоксида
- 1.2.52 0,1 М раствор натрия нитрита
- 1.2.53 0,1 М раствор натрия перйодата
- 1.2.54 0,1 М раствор натрия тиосульфата
- 1.2.55 0,005 М раствор натрия тиосульфата
- 1.2.56 0,1 М раствор натрия эдетата
- 1.2.57 0,05 М раствор натрия эдетата
- 1.2.58 0,02 М раствор натрия эдетата
- 1.2.59 0,05 М (0,1 н.) раствор ртути(II) нитрата
- 1.2.60 0,1 М раствор серебра нитрата
- 1.2.61 0,01 М раствор серебра нитрата
- 1.2.62 0,001 М раствор серебра нитрата
- 1.
 2.63 0,5 М (1 н.) раствор серной кислоты
2.63 0,5 М (1 н.) раствор серной кислоты - 1.2.64 0,05 М (0,1 н.) раствор серной кислоты
- 1.2.65 0,1 М раствор свинца(II) нитрата
- 1.2.66 0,05 М раствор свинца(II) нитрата
- 1.2.67 0,1 М раствор тетрабутиламмония гидроксида
- 1.2.68 0,1 М раствор тетрабутиламмония гидроксида в 2-пропаноле
- 1.2.69 0,01 М раствор тетрабутиламмония йодида
- 1.2.70 0,1 М раствор тетраэтиламмония гидроксида
- 1.2.71 1 М раствор хлористоводородной кислоты
- 1.2.72 0,5 М раствор хлористоводородной кислоты
- 1.2.73 0,1 М раствор хлористоводородной кислоты
- 1.2.74 0,01 М раствор хлористоводородной кислоты
- 1.2.75 0,1 М раствор хлористоводородной кислоты спиртовой
- 1.2.76 0,1 М раствор хлорной кислоты
- 1.2.77 0,05 М раствор хлорной кислоты
- 1.2.78 0,1 М раствор хлорной кислоты в метаноле
- 1.2.79 0,1 М раствор хлорной кислоты в нитрометане
- 1.2.80 0,1 М раствор уксусной кислоты
- 1.2.81 0,1 М раствор церия(IV) сульфата
- 1.
 2.82 0,05 М раствор цинка хлорида
2.82 0,05 М раствор цинка хлорида - 1.2.83 0,1 М раствор цинка сульфата
- 1.2.84 Поделиться ссылкой:
- 1.1 Исходные стандартные вещества для титрованных растворов
Титрованными растворами называются растворы точно известной концентрации, предназначенные для целей титриметрического анализа.
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Титрованные растворы ОФС.1.3.0002.15
Взамен ГФ XII, 1ч., ОФС 42-0071-07
Титрованными растворами называются растворы точно известной концентрации, предназначенные для целей титриметрического анализа.
Концентрация титрованного раствора (титранта) обычно выражается его молярной концентрацией, титром или титром по определяемому веществу.
Молярная концентрация (молярность) – это выраженное в молях количество растворённого вещества, содержащееся в 1 л раствора. Молярность вычисляется как отношение количества растворенного вещества к объему раствора:
СМ = М/V ,
где
СМ – молярная концентрация, моль/л;
М — количество растворённого вещества, моль;
V — общий объём раствора, л.
Раствор, содержащий x моль вещества в 1 л раствора, обозначают x М раствором.
Титр – это выраженная в миллиграммах масса растворенного вещества, содержащаяся в 1 мл раствора (размерность – мг/мл).
Титр титранта по определяемому веществу – это выраженная в миллиграммах масса определяемого вещества, эквивалентная 1 мл данного титранта. Титр титранта по определяемому веществу вычисляют, исходя из молярной концентрации или титра титранта с учётом стехиометрических коэффициентов уравнения химической реакции, протекающей при титровании, и молярных масс реагирующих веществ (размерность – мг/мл).
Иногда концентрацию раствора выражают числом грамм-эквивалентов вещества в 1 л раствора. Такие растворы называются нормальными и обозначаются символом «н.». Грамм-эквивалентом называется число граммов вещества, равное его эквиваленту. Эквивалент вещества – это такое количество вещества, которое может присоединять, высвобождать или другим способом быть эквивалентным катиону водорода в кислотно-основных (ионообменных) реакциях или электрону в окислительно-восстановительных реакциях. Величина эквивалентной массы вещества определяется исходя из его химической формулы, принадлежности к тому или иному классу химических соединений, а также химической реакции, протекающей между определяемым веществом и титрованным раствором.
Величина эквивалентной массы вещества определяется исходя из его химической формулы, принадлежности к тому или иному классу химических соединений, а также химической реакции, протекающей между определяемым веществом и титрованным раствором.
Для приготовления титрованных растворов применяют химически чистые вещества или промышленного производства стандарт-титры для титриметрии. Допускается приготовление титрованного раствора несколько большей концентрации, чем требуется по расчету, который при необходимости можно довести до нужной концентрации путем разбавления.
Для приготовления титрованных растворов используют мерные ёмкости исключительно класса А.
Приготовленные титрованные растворы стандартизуют двумя способами: по стандартному титрованному раствору или по точной навеске соответствующего стандартного образца. Перед стандартизацией титрованный раствор необходимо тщательно перемешать. Концентрацию титрованных растворов определяют путем достаточного количества титрований (не менее трех).
При ручном титровании используют бюретки с ценой деления в пределах 0,01 – 0,05 мл.
Если титрованный раствор используют в количественном анализе, в котором конечную точку титрования определяют электрометрическим методом (например, методом амперометрии или потенциометрии), раствор стандартизуют тем же методом. Состав среды, в которой стандартизуют титрованный раствор, должен быть таким же, как и тот, в котором он будет использован.
Для определения точной концентрация приготовленного титрованного раствора вычисляют поправочный коэффициент (К), представляющий собой отношение фактически полученной концентрации титрованного раствора к теоретически заданной. Поправочный коэффициент рассчитывают с точностью до четвёртого знака после запятой.
Вычисление поправочного коэффициента производят одним из указанных ниже способов.
Способ 1 – по навеске соответствующего стандартного образца:
где
а – навеска вещества, по которому устанавливают титр, мг;
Т – количество вещества, по которому устанавливается титр, соответствующее 1 мл раствора заданной молярной концентрации (титр титранта по определяемому веществу), мг/мл;
V – объем приготовленного раствора, израсходованный на титрование, мл.
Способ 2 – по титрованному раствору известной концентрации:
где
V0 – объем титрованного раствора, по которому устанавливается титр, мл;
V – объем приготовленного титрованного раствора, израсходованный на титрование, мл;
K0 – поправочный коэффициент титрованного раствора, по которому устанавливается титр.
Коэффициент К должен находиться в пределах от 0,98 до 1,02. Если коэффициент К отличается от указанных пределов (более чем на ± 2 %), то раствор следует разбавить или укрепить на основании следующего расчета.
В случае разбавления раствора из величины К вычитают единицу и полученную разность умножают на 1000. Результат умножения соответствует количеству воды в миллилитрах, которое следует прибавить к каждому литру разбавляемого раствора. В случае укрепления из единицы вычитают коэффициент К и разность умножают на количество граммов исходного вещества, взятое для приготовления 1 л раствора. Полученное количество добавляют на каждый литр раствора. После этого раствор тщательно перемешивают.
Полученное количество добавляют на каждый литр раствора. После этого раствор тщательно перемешивают.
Относительное стандартное отклонение при определении коэффициента К не должно превышать 0,2 %.
Титрованные растворы меньшей молярной концентрации можно приготовить посредством точного разведения более концентрированных титрованных растворов водой, свободной от углерода диоксида. Поправочные коэффициенты полученных разбавленных растворов такие же, как у исходных растворов. Исключение составляют титрованные растворы для окислительно-восстановительного титрования, которые после разбавления нуждаются в повторной установке титра. Методика установки титра должна быть приведена в фармакопейной статье.
Растворы с молярной концентрацией ниже 0,1 М готовят непосредственно перед использованием.
Так как при хранении концентрация титрованного раствора может изменяться, необходимо перепроверять поправочные коэффициенты титрованных растворов в соответствии с установленными для них сроками хранения.
Титрованные растворы, в которых при хранении появились хлопья или осадок, применять нельзя.
Титрованные растворы хранят при комнатной температуре, защищая их, при необходимости, от воздействия углерода диоксида, влаги воздуха и прямых солнечных лучей.
Рекомендуется готовить, стандартизовать и использовать титрованные растворы при одной и той же температуре.
Исходные стандартные вещества для титрованных растворовИсходные стандартные вещества для установки концентрации титрованных растворов обозначают буквами РО (реактив основной) и готовят следующим образом.
Калия бромат РОКBrO3. (М.м. 167,00).
Калия бромат перекристаллизовывают из кипящей воды. Кристаллы собирают и сушат до постоянной массы при температуре 180 ºС.
Калия гидрофталат РОС8Н5КО4. (М.м. 204,22).
Калия гидрофталат перекристаллизовывают из кипящей воды. Кристаллы собирают при температуре выше 35 ºС и сушат до постоянной массы при температуре 120 ºС.
Кристаллы собирают при температуре выше 35 ºС и сушат до постоянной массы при температуре 120 ºС.
K2Cr2O7. (М.м. 294,19).
Калия дихромат перекристаллизовывают из горячей воды. Кристаллы сушат до постоянной массы при температуре от 130 до 150 °С и растирают.
Кислота бензойная РОС7Н6О2. (М.м. 122,12).
Кислоту бензойную сублимируют.
Мышьяка оксид РОАs2О3. (М.м. 197,84).
Мышьяка оксид сублимируют.
Хранят над силикагелем безводным.
Натрия карбонат безводный РОNa2CO3. (М.м. 106,01).
Насыщенный раствор натрия карбоната фильтруют при комнатной температуре. Через фильтрат медленно пропускают поток углерода диоксида при постоянном охлаждении и перемешивании. Через 2 ч осадок собирают на стеклянном фильтре, промывают фильтр ледяной водой, насыщенной углерода диоксидом. Сушат при температуре от 100 до 105 ºС и прокаливают до постоянной массы при температуре от 270 до 300 ºС, периодически перемешивая.
Через 2 ч осадок собирают на стеклянном фильтре, промывают фильтр ледяной водой, насыщенной углерода диоксидом. Сушат при температуре от 100 до 105 ºС и прокаливают до постоянной массы при температуре от 270 до 300 ºС, периодически перемешивая.
NaCl. (М.м. 58,44).
К 1 объёму насыщенного раствора натрия хлорида прибавляют 2 объема хлористоводородной кислоты концентрированной. Полученные кристаллы собирают и промывают хлористоводородной кислотой 25 %, которую удаляют нагреванием на кипящей водяной бане. Прокаливают до постоянной массы при температуре 300 ºС.
Сульфаниловая кислота РОС6Н7NO3S. (М.м. 173,19).
Сульфаниловую кислоту перекристаллизовывают из кипящей воды, фильтруют и сушат до постоянной массы при температуре от 100 до 105 ºС.
Цинк РОZn. (А.м. 65,37).
Используют цинк с содержанием не менее 99,9 % Zn.
1 М раствор азотной кислоты
96,9 мл азотной кислоты концентрированной доводят водой до объёма 1000,0 мл.
Установка титра. 1,000 г натрия карбоната безводного РО растворяют в 50 мл воды, прибавляют 0,1 мл 0,1 % раствора метилового оранжевого и титруют приготовленным раствором азотной кислоты до красновато-жёлтого окрашивания; кипятят в течение 2 мин, раствор снова приобретает жёлтую окраску, охлаждают и продолжают титрование до красновато-жёлтого окрашивания.
1 мл 1 М раствора азотной кислоты соответствует 53,00 мг Na2CO3.
0,1 М раствор аммония тиоцианата0,1 М раствор аммония роданида.
7,612 г аммония тиоцианата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл 0,1 М раствора серебра нитрата прибавляют 25 мл воды, 2 мл 2 М раствора азотной кислоты, 2 мл 10 % раствора железа аммония сульфата и титруют приготовленным раствором аммония тиоцианата до появления красновато-желтого окрашивания.
1 мл 0,1 М раствора серебра нитрата соответствует 7,612 мг NH4SCN.
0,01 М раствор аммония тиоцианата0,01 М раствор аммония роданида.
100,0 мл 0,1 М раствора аммония тиоцианата разбавляют водой до объёма 1000,0 мл.
Установка титра. К 20,0 мл 0,01 М раствора серебра нитрата прибавляют 25 мл воды, 2 мл 2 М раствора азотной кислоты, 2 мл 10 % раствора железа аммония сульфата и далее поступают, как указано при установке титра 0,1 М раствора аммония тиоцианата.
1 мл 0,01 М раствора серебра нитрата соответствует 0,7612 мг NH4SCN.
0,1 М раствор аммония церия нитратаРаствор, содержащий 56 мл серной кислоты концентрированной и 54,82 г аммония церия нитрата, взбалтывают в течение 2 мин, прибавляют последовательно 5 порций, по 100 мл каждая, воды, перемешивая после каждого прибавления. Доводят объем раствора водой до 1000,0 мл. Титр полученного раствора устанавливают через 10 сут.
Установка титра. К 25,0 мл полученного раствора прибавляют 2 г калия йодида и 150 мл воды. Немедленно титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала.
1 мл 0,1 М раствора натрия тиосульфата соответствует 54,82 мг
(NH4)2Cе(NО3)6.
Хранят в защищенном от света месте.
0,01 М раствор аммония церия нитратаК 100,0 мл 0,1 М раствора аммония церия нитрата прибавляют при охлаждении 30 мл серной кислоты концентрированной и доводят объем раствора водой до 1000,0 мл.
0,1 М раствор аммония церия сульфата65,0 г аммония церия сульфата растворяют в смеси 500 мл воды и 30 мл серной кислоты концентрированной, охлаждают и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 25,0 мл полученного раствора прибавляют 2 г калия йодида и 150 мл воды. Немедленно титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала.
1 мл 0,1 М раствора натрия тиосульфата соответствует 63,26 мг
2 (NH4)2SO4 · Cе(SО4)2 · 2 H2O.
К 100,0 мл 0,1 М раствора аммония церия сульфата прибавляют при охлаждении 30 мл серной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
0,05 М раствор бария перхлората15,8 г бария гидроксида растворяют в смеси 75 мл воды и 7,5 мл хлорной кислоты, доводят рН раствора до 3,0 хлорной кислотой и фильтруют, если необходимо. Прибавляют 150 мл спирта 96 %, доводят объём раствора водой до 250 мл, затем доводят объём раствора буферным раствором рН 3,7 до 1000,0 мл.
Установка титра. К 5,0 мл 0,05 М раствора серной кислоты прибавляют 5 мл воды, 50 мл буферного раствора рН 3,7 и 0,5 мл 0,1 % раствора ализарина S; титруют приготовленным раствором бария перхлората до появления оранжево-красного окрашивания. Определение титра проводят непосредственно перед использованием.
Определение титра проводят непосредственно перед использованием.
1 мл 0,05 М раствора серной кислоты соответствует 16,81 мг Ba(ClO4)2.
0,025 М раствор бария перхлората500,0 мл 0,05 М раствора бария перхлората доводят ацетатным буферным раствором рН 3,7 до объёма 1000,0 мл.
0,1 М раствор бария хлорида24,4 г бария хлорида растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 10,0 мл приготовленного раствора бария хлорида прибавляют 60 мл воды, 3 мл аммиака раствора концентрированного 25 %, от 0,5 до 1,0 мг фталеинового пурпурного и титруют 0,1 М раствором натрия эдетата. Когда окраска раствора начнет ослабевать, прибавляют 50 мл спирта 96 % и продолжают титрование до исчезновения синевато-фиолетового окрашивания.
1 мл 0,1 М раствора натрия эдетата соответствует 24,43 мг BaCl2 · 2 H2O.
0,004 М раствор бензэтония хлорида1,792 г бензэтония хлорида, предварительно высушенного до постоянной массы при температуре от 100 до 105 ºС, растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Установка титра. Вычисляют молярность раствора, исходя из содержания С27Н42СlNO2 в высушенном бензэтония хлориде, определенного следующим образом. 0,350 г высушенного вещества растворяют в 30 мл уксусной кислоты безводной, прибавляют 6 мл 3,19 % раствора ртути (II) ацетата и титруют 0,1 М раствором хлорной кислоты, используя в качестве индикатора 0,05 мл 0,5 % раствора кристаллического фиолетового. Параллельно проводят контрольный опыт.
1 мл 0,1 М раствора хлорной кислоты соответствует 44,81 мг С27Н42СlNO2.
0,0167 М (0,1 н.) раствор бромид-бромата0,05 М раствор брома.
2,7835 г калия бромата РО и 13 г калия бромида растворяют в воде и доводят объем раствора водой до 1000,0 мл.
0,1 М раствор железа(III) аммония сульфата50,0 г железа(III) аммония сульфата растворяют в смеси 300 мл воды и 6 мл серной кислоты концентрированной и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 25,0 мл приготовленного раствора железа(III) аммония сульфата прибавляют 3 мл хлористоводородной кислоты концентрированной, 2 г калия йодида и через 10 мин титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала.
1 мл 0,1 М раствора натрия тиосульфата соответствует 48,22 мг
FeNH4(SO4)2 · 12 H2O.
27,80 г железа(II) сульфата растворяют в 500 мл серной кислоты разведенной 9,8 % и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 25,0 мл приготовленного раствора железа(II) сульфата прибавляют 3 мл фосфорной кислоты концентрированной и тотчас титруют 0,02 М раствором калия перманганата. Определение титра проводят непосредственно перед использованием.
1 мл 0,02 М раствора калия перманганата соответствует 27,80 мг
FeSO4 · 7 H2O.
127,0 г йода и 200 г калия йодида растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 2,0 мл полученного раствора прибавляют 1 мл 2 М раствора уксусной кислоты и 50 мл воды. Титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1% раствора крахмала.
1 мл 0,1 М раствора натрия тиосульфата соответствует 12,69 мг I2.
Хранят в защищенном от света месте.
0,1 М (0,2 н.) раствор йодаОколо 25,5 г йода и 40 г калия йодида растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 10,0 мл полученного раствора прибавляют 1 мл 2 М раствора уксусной кислоты и 40 мл воды. Далее поступают, как указано при установке титра 0,5 М раствора йода.
1 мл 0,1 М раствора натрия тиосульфата соответствует 12,69 мг I2.
Хранят в защищенном от света месте.
20 г калия йодида растворяют в минимальном количестве воды, прибавляют 12,7 г йода, растворяют при перемешивании и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл полученного раствора прибавляют 1 мл 2 М раствора уксусной кислоты и 30 мл воды. Далее поступают, как указано при установке титра 0,5 М раствора йода.
1 мл 0,1 М раствора натрия тиосульфата соответствует 12,69 мг I2.
Хранят в защищенном от света месте.
0,01 М (0,02 н.) раствор йода0,3 г калия йодида растворяют в 20,0 мл 0,05 М раствора йода и доводят объем раствора водой до 100,0 мл.
Установка титра. К 25,0 мл полученного раствора прибавляют 1 мл 2 М раствора уксусной кислоты и 25 мл воды и титруют 0,01 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала.
1 мл 0,01 М раствора натрия тиосульфата соответствует 1,269 мг I2.
11,06 г калия йодида и 7,10 г калия йодата помещают в склянку с притертой пробкой, прибавляют 50 мл воды и 50 мл концентрированной хлористоводородной кислоты, закрывают пробкой и встряхивают до полного растворения образующегося при реакции йода. Раствор переносят в делительную воронку и взбалтывают с 10 мл хлороформа. Если хлороформный слой окрашивается в фиолетовый цвет, то прибавляют при сильном взбалтывании по каплям 1 % раствор калия йодата до обесцвечивания хлороформного слоя. Если же хлороформный слой остается бесцветным, то прибавляют по каплям 1 % раствор калия йодида до появления бледно-розовой окраски. После отстаивания водный слой сливают в мерную колбу и доводят объем раствора водой до 1000,0 мл. Приготовленный раствор должен иметь лимонно-желтый цвет.
Установка титра. 25,0 мл приготовленного раствора йода монохлорида помещают в колбу с притертой пробкой, прибавляют 1 г калия йодида и оставляют в защищенном от света месте на 15 мин. Выделившийся йод титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора
Выделившийся йод титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора
0,5 – 1 мл 1 % раствора крахмала.
1 мл 0,1 М раствора натрия тиосульфата соответствует 12,69 мг I2.
Титр раствора устанавливают каждый раз перед применением.
Хранят в сосудах темного стекла с притертыми пробками в защищенном от света месте.
0,033 М (0,2 н.) раствор калия бромата5,5110 г калия бромата РО растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 10,0 мл полученного раствора прибавляют 50 мл воды, 10 мл 16,6 % раствора калия йодида и 5 мл 7 М раствора хлористоводородной кислоты. Титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала. Индикатор прибавляют в конце титрования.
1 мл 0,1 М раствора натрия тиосульфата соответствует 2,783 мг KBrO3.
0,02 М (0,12 н.) раствор калия бромата3,340 г калия бромата РО растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 15,0 мл полученного раствора прибавляют 45 мл воды. Далее поступают, как указано при установке титра 0,033 М раствора калия бромата.
1 мл 0,1 М раствора натрия тиосульфата соответствует 2,783 мг KBrO3.
0,0167 М (0,1 н.) раствор калия бромата0,1 н. раствор калия бромата.
2,7889 г калия бромата PO растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл полученного раствора прибавляют 40 мл воды. Далее поступают, как указано при установке титра 0,033 М раствора калия бромата.
1 мл 0,1 М раствора натрия тиосульфата соответствует 2,783 мг KBrO3.
0,0083 М (0,05 н.) раствор калия бромата250,0 мл 0,033 М раствора калия бромата доводят водой до объёма 1000,0 мл.
Установка титра. К 40,0 мл полученного раствора добавляют 20 мл воды. Далее поступают, как указано при установке титра 0,033 М раствора калия бромата.
1 мл 0,1 М раствора натрия тиосульфата соответствует 2,783 мг KBrO3.
1 М раствор калия гидроксида
60 г калия гидроксида растворяют в воде, свободной от углерода диоксида, и доводят объем раствора водой, свободной от углерода диоксида, до 1000,0 мл.
Установка титра. 20,0 мл приготовленного раствора калия гидроксида титруют 1 М раствором хлористоводородной кислоты, используя в качестве индикатора 0,5 мл 0,1 % раствора фенолфталеина.
1 мл 1 М раствора хлористоводородной кислоты соответствует 56,11 мг KOH.
0,1 М раствор калия гидроксида6 г калия гидроксида растворяют в воде, свободной от углерода диоксида, и доводят объем раствора тем же растворителем до 1000,0 мл.
Установка титра. 20,0 мл приготовленного раствора калия гидроксида титруют 0,1 М раствором хлористоводородной кислоты, используя в качестве индикатора 0,5 мл 0,1 % раствора фенолфталеина.
1 мл 0,1 М раствора хлористоводородной кислоты соответствует 5,611 мг KOH.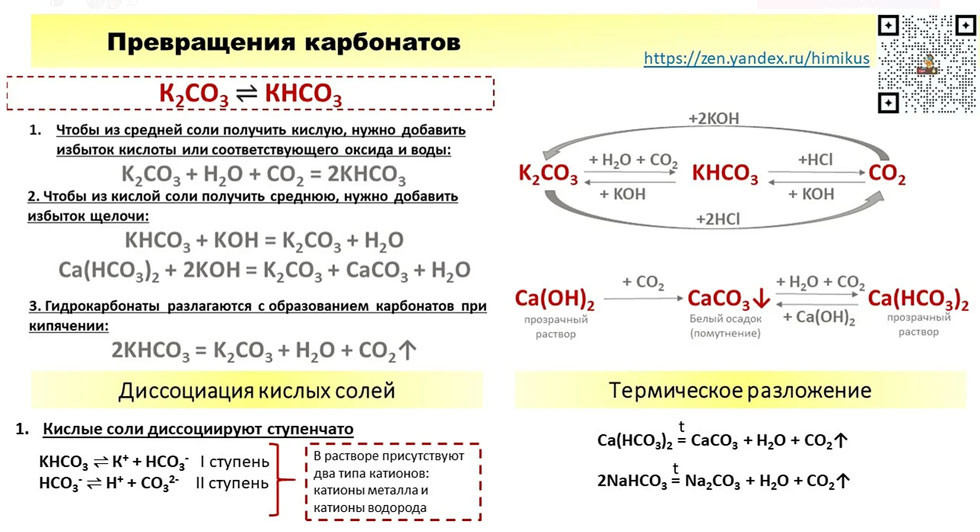
3 г калия гидроксида растворяют в спирте 60 % (об/об), свободном от альдегидов, и доводят объём раствора тем же растворителем до 100,0 мл.
Установка титра. 20,0 мл приготовленного раствора калия гидроксида в спирте 60 % (об/об) титруют 0,5 М раствором хлористоводородной кислоты, используя в качестве индикатора 0,5 мл 0,1 % раствора фенолфталеина.
1 мл 0,5 М раствора хлористоводородной кислоты соответствует 28,06 мг KOH.
0,5 М раствор калия гидроксида спиртовой0,5 М раствор кали едкого спиртовой.
3 г калия гидроксида растворяют в 5 мл воды и доводят объем раствора спиртом 96 %, свободным от альдегидов, до 100,0 мл.
Установка титра. 20,0 мл приготовленного раствора калия гидроксида спиртового титруют 0,5 М раствором хлористоводородной кислоты, используя в качестве индикатора 0,5 мл 0,1 % раствора фенолфталеина.
1 мл 0,5 М раствора хлористоводородной кислоты соответствует 28,06 мг KOH.
0,1 М раствор калия гидроксида спиртовой0,1 М раствор кали едкого спиртовоый.
20,0 мл 0,5 М раствора калия гидроксида спиртового доводят спиртом 96 %, свободным от альдегидов, до объёма 100,0 мл.
Установка титра. 20,0 мл полученного раствора титруют 0,1 М раствором хлористоводородной кислоты, используя в качестве индикатора 0,5 мл 0,1 % раствора фенолфталеина.
1 мл 0,1 М раствора хлористоводородной кислоты соответствует 5,611 мг KOH.
0,01 М раствор калия гидроксида спиртовой2,0 мл 0,5 М раствора калия гидроксида спиртового доводят спиртом 96 %, свободным от альдегидов, до объёма 100,0 мл.
0,1 М раствор калия гидрофталата20,42 г калия гидрофталата PO растворяют в 800 мл уксусной кислоты безводной, полученный раствор нагревают на водяной бане до растворения, защищая от действия влаги. Охлаждают до температуры 20 ºС и доводят объём раствора уксусной кислотой безводной до 1000,0 мл.
Охлаждают до температуры 20 ºС и доводят объём раствора уксусной кислотой безводной до 1000,0 мл.
4,90 г калия дихромата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл приготовленного раствора калия дихромата прибавляют 1 г калия йодида, 7 мл хлористоводородной кислоты разведенной 7,3 %, 250 мл воды и титруют 0,1 М раствором натрия тиосульфата до перехода окраски от синей к светло-зеленой, используя в качестве индикатора 3 мл 0,1 % раствора крахмала.
1 мл 0,1 М раствора натрия тиосульфата соответствует 4,903 мг K2Cr2O7.
0,05 М раствор калия йодата10,7 г калия йодата растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. 25,0 мл приготовленного раствора калия йодата доводят водой до объема 100,0 мл. К 20,0 мл полученного раствора прибавляют 2 г калия йодида, 10 мл серной кислоты разведенной 9,8 %, и титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала. Индикатор прибавляют в конце титрования.
Индикатор прибавляют в конце титрования.
1 мл 0,1 М раствора натрия тиосульфата соответствует 3,567 мг KIO3.
0,0167 М (0,1 н.) раствор калия йодата3,567 г калия йодата растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. 20,0 мл приготовленного раствора калия йодата помещают в колбу с притертой пробкой, прибавляют 100 мл воды, 25 мл серной кислоты разведенной 9,8 %, 2 г калия йодида и оставляют на 10 мин в защищенном от света месте. Выделившийся йод титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала. Индикатор прибавляют в конце титрования.
1 мл 0,1 М раствора натрия тиосульфата соответствует 3,567 мг KIO3.
Хранят в сосудах темного стекла с притертыми пробками в защищенном от света месте.
0,001 М раствор калия йодида10,0 мл раствора калия йодида 166 г/л доводят водой до объема 100,0 мл. 5,0 мл полученного раствора доводят водой до объема 500,0 мл.
5,0 мл полученного раствора доводят водой до объема 500,0 мл.
0,1 н. раствор калия перманганата.
3,2 г калия перманганата растворяют в воде и доводят объем раствора водой до 1000,0 мл; полученный раствор нагревают на водяной бане в течение 1 ч, охлаждают и фильтруют через стеклянный фильтр.
Установка титра. К 20,0 мл приготовленного раствора калия перманганата прибавляют 2 г калия йодида, 10 мл серной кислоты разведенной 9,8 % и титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала. Индикатор прибавляют в конце титрования.
1 мл 0,1 М раствора тиосульфата натрия соответствует 3,161 мг KMnO4.
Титр устанавливают непосредственно перед использованием.
Хранят в защищенном от света месте.
0,1 М раствор лития метоксида0,694 г лития небольшими порциями растворяют в 150 мл метанола безводного и доводят объем раствора толуолом до 1000,0 мл.
Установка титра. К 10,0 мл диметилформамида прибавляют 0,05 мл 0,3 % раствора тимолового синего в метаноле и титруют приготовленным раствором лития метоксида до получения синего окрашивания раствора. Немедленно прибавляют 0,200 г бензойной кислоты РО, перемешивают до растворения и титруют приготовленным раствором лития метоксида до повторного получения синего окрашивания раствора. Во время титрования раствор защищают от атмосферного углерода диоксида. Титр раствора лития метоксида устанавливают по объему титранта, израсходованного в повторном титровании.
1 мл 0,1 М раствора лития метоксида соответствует 12,21 мг С7Н6О2.
Титр устанавливают непосредственно перед использованием.
0,05 М раствор магния сульфата12,5 г магния сульфата растворяют в достаточном количестве воды и доводят объем раствора водой до 1000,0 мл.
Установка титра. 40,0 мл полученного раствора доводят водой до объёма 300 мл. Прибавляют 10 мл аммонийного буфера pH 10,0 и 50 мг тритурации эриохрома черного. Нагревают до 40 ºС и титруют при этой температуре 0,1 М раствором натрия эдетата до перехода окраски от фиолетовой к синей.
Прибавляют 10 мл аммонийного буфера pH 10,0 и 50 мг тритурации эриохрома черного. Нагревают до 40 ºС и титруют при этой температуре 0,1 М раствором натрия эдетата до перехода окраски от фиолетовой к синей.
1 мл 0,1 М раствора натрия эдетата соответствует 24,65 мг MgSO4 ∙ 7 H2O.
0,1 М раствор магния хлорида20,33 г магния хлорида растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. 25,0 мл полученного раствора доводят водой до 300 мл. Прибавляют 10 мл аммонийного буфера pH 10,0 и 50 мг тритурации эриохрома черного. Нагревают до 40 ºС и титруют при этой температуре 0,1 М раствором натрия эдетата до перехода окраски от фиолетовой к синей.
1 мл 0,1 М раствора натрия эдетата соответствует 20,33 мг MgCl2 ∙ 6 H2O.
0,02 М раствор меди сульфата5,0 г меди сульфата растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл полученного раствора меди сульфата прибавляют 2 г натрия ацетата, 0,1 мл 0,1 % раствора пиридилазонафтола и титруют 0,02 М раствором натрия эдетата до перехода окраски от фиолетово-синей до ярко-зеленой; вблизи точки эквивалентности титруют медленно.
1 мл 0,02 М раствора натрия эдетата соответствует 4,994 мг СuSO4 × 5 H2O.
0,1 М раствор натрия арсенита4,946 г мышьяка оксида РО растворяют в смеси 20 мл 10 М раствора натрия гидроксида и 20 мл воды, доводят объем раствора водой до 400,0 мл и нейтрализуют хлористоводородной кислотой разведенной 7,3 % по лакмусовой бумаге. Растворяют в полученном растворе 2,0 г натрия гидрокарбоната и доводят объем раствора водой до 500,0 мл.
0,025 М раствор натрия арсенита25 мл 0,1 М раствор натрия арсенита доводят водой до 100 мл.
0,001 М раствор натрия додецилсульфата0,2884 г натрия додецилсульфата, в пересчете на высушенное вещество (105 ºС в течение 2 ч), растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 50,0 мл полученного раствора прибавляют 15 мл хлороформа, 10 мл 1 М раствора серной кислоты и 1 мл раствора, содержащего по 0,003 % диметилового желтого и орацетового синего В в хлороформе. Титруют 0,004 М раствором бензэтония хлорида при энергичном встряхивании и разделении слоев после каждого добавления титранта до тех пор, пока хлороформный слой не приобретет постоянный (неисчезающий) зеленый цвет.
1 мл 0,004 М раствора бензэтония хлорида соответствует 1,154 мг C12H25NaO4S.
1 М раствор натрия гидроксида1 М раствор натра едкого.
42 г натрия гидроксида растворяют в воде, свободной от углерода диоксида, и доводят объем раствора водой до 1000,0 мл.
Проверка на содержание карбонатов. 45,0 мл 1 М раствора хлористоводородной кислоты титруют приготовленным раствором натрия гидроксида (индикатор – фенолфталеин). К оттитрованному раствору прибавляют по каплям 1 М раствор хлористоводородной кислоты до исчезновения розового окрашивания и упаривают при кипячении до объема ~ 20 мл. В процессе кипячения при возникновении розового окрашивания прибавляют 1 М раствор хлористоводородной кислоты до обесцвечивания. Раствор охлаждают и, при наличии розовой окраски, прибавляют 1 М раствор хлористоводородной кислоты до обесцвечивания. Суммарное количество прибавленного 1 М раствора хлористоводородной кислоты не должно превышать 0,1 мл.
В процессе кипячения при возникновении розового окрашивания прибавляют 1 М раствор хлористоводородной кислоты до обесцвечивания. Раствор охлаждают и, при наличии розовой окраски, прибавляют 1 М раствор хлористоводородной кислоты до обесцвечивания. Суммарное количество прибавленного 1 М раствора хлористоводородной кислоты не должно превышать 0,1 мл.
Установка титра (1). 20,0 мл 1 М раствора хлористоводородной кислоты титруют полученным раствором натрия гидроксида, используя в качестве индикатора 0,5 – 1,0 мл 1 % раствора фенолфталеина.
1 мл 1 М раствора хлористоводородной кислоты соответствует 40,00 мг NaOH.
Установка титра (2). Около 5,00 г (точная навеска) калия гидрофталата PO, предварительного тонко измельченного и высушенного при температуре 120 ºС в течение 2 ч, растворяют в 75 мл воды и титруют приготовленным раствором натра едкого (индикатор – фенолфталеин).
1 мл 1 М раствора натрия гидроксида соответствует 204,22 мг C8H5KO4.
Титр устанавливают непосредственно перед использованием.
Хранить в плотно закрытых ёмкостях из тёмного стекла.
0,5 М раствор натрия гидроксида0,5 М раствор натра едкого.
21 г натрия гидроксида растворяют в воде, свободной от углерода диоксида, и доводят объем раствора той же водой до 1000,0 мл.
Проверка на содержание карбонатов. Проводят, как описано при приготовлении 1 М раствора натрия гидроксида. Для определения берут 45,0 мл 0,5 М раствора хлористоводородной кислоты.
Установка титра (1). 10,0 мл 0,5 М раствора хлористоводородной кислоты титруют, как указано при определении титра 1 М раствора натрия гидроксида.
1 мл 0,5 М раствора хлористоводородной кислоты соответствует 20,00 мг NaOH.
Установка титра (2). Около 2,50 г (точная навеска) калия гидрофталата PO, предварительно тонко измельченного и высушенного при температуре 120 ºС в течение 2 ч, растворяют в 50 мл воды. Далее поступают, как указано при установке титра 1 М раствора натрия гидроксида.
Далее поступают, как указано при установке титра 1 М раствора натрия гидроксида.
1 мл 0,5 М раствора натрия гидроксида соответствует 102,11 мг C8H5KO4.
Хранить в плотно закрытых ёмкостях из тёмного стекла.
0,1 М раствор натрия гидроксида0,1 М раствор натра едкого.
100,0 мл 1 М раствора натрия гидроксида доводят водой, свободной от углерода диоксида, до объема 1000,0 мл.
Проверка на содержание карбонатов. Проводят, как описано при приготовлении 1 М раствора натрия гидроксида. Для определения берут 45 мл 0,1 М раствора хлористоводородной кислоты.
Установка титра (1). 10,0 мл 0,1 М раствора хлористоводородной кислоты титруют, как указано при определении титра 1 М раствора натрия гидроксида.
1 мл 0,1 М раствора хлористоводородной кислоты соответствует 4,00 мг NaOH.
Установка титра (2). Около 0,50 г (точная навеска) калия гидрофталата PO, предварительно тонко измельченного и высушенного при температуре 120 ºС в течение 2 ч, растворяют в 30 мл воды. Далее поступают, как указано при установке титра 1 М раствора натрия гидроксида.
Далее поступают, как указано при установке титра 1 М раствора натрия гидроксида.
1 мл 0,1 М раствора натрия гидроксида соответствует 20,42 мг C8H5KO4.
Хранить в плотно закрытых ёмкостях из тёмного стекла.
0,05 М раствор натрия гидроксида0,05 М раствор натра едкого.
50,0 мл 1 М раствора натрия гидроксида доводят водой, свободной от углерода диоксида, до объема 1000,0 мл.
Проверка на содержание карбонатов. Проводят, как описано при приготовлении 1 М раствора натрия гидроксида. Для определения берут 45 мл 0,05 М раствора хлористоводородной кислоты.
Установка титра (1). 10,0 мл 0,05 М раствора хлористоводородной кислоты титруют, как указано при определении титра 1 М раствора натрия гидроксида.
Установка титра (2). Около 0,25 г (точная навеска) калия гидрофталата PO, предварительно тонко измельченного и высушенного при температуре 120 ºС в течение 2 ч, растворяют в 30 мл воды. Далее поступают, как указано при установке титра 1 М раствора натрия гидроксида.
Далее поступают, как указано при установке титра 1 М раствора натрия гидроксида.
1 мл 0,05 М раствора натрия гидроксида соответствует 10,21 мг C8H5KO4.
Хранить в плотно закрытых ёмкостях из тёмного стекла.
0,02 М раствор натрия гидроксида0,02 М раствор натра едкого.
20,0 мл 1 М раствора натрия гидроксида доводят водой, свободной от углерода диоксида, до объема 1000,0 мл.
Проверка на содержание карбонатов. Проводят, как описано при приготовлении 1 М раствора натрия гидроксида. Для определения берут 45 мл 0,02 М раствора хлористоводородной кислоты.
Установка титра. Около 0,10 г (точная навеска) калия гидрофталата PO, предварительно тонко измельченного и высушенного при температуре 120 ºС в течение 2 ч, растворяют в 30 мл воды. Далее поступают, как указано при установке титра 1 М раствора натрия гидроксида.
1 мл 0,02 М раствора натрия гидроксида соответствует 4,084 мг C8H5KO4.
Хранить в плотно закрытых ёмкостях из тёмного стекла.
0,01 М раствор натрия гидроксида0,01 М раствор натра едкого.
10,0 мл 1 М раствора натрия гидроксида доводят водой, свободной от углерода диоксида, до объема 1000,0 мл.
Проверка на содержание карбонатов. Проводят, как описано при приготовлении 1 М раствора натрия гидроксида. Для определения берут 45 мл 0,01 М раствора хлористоводородной кислоты.
Установка титра. Около 0,05 г (точная навеска) калия гидрофталата PO, предварительно тонко измельченного и высушенного при температуре 120 ºС в течение 2 ч, растворяют в 30 мл воды. Далее поступают, как указано при установке титра 1 М раствора натрия гидроксида.
1 мл 0,01 М раствора натрия гидроксида соответствует 2,042 мг C6H5KO4.
Хранить в плотно закрытых ёмкостях из тёмного стекла.
0,1 М раствор натрия гидроксида этанольныйК 250 мл этанола безводного (спирт абсолютированный) прибавляют 3,3 г 10 М раствора натрия гидроксида.
Установка титра. 0,200 г (точная навеска) бензойной кислоты PO растворяют в 2 мл воды и 10 мл спирта 96 % и титруют приготовленным раствором натрия гидроксида этанольным, используя в качестве индикатора 0,2 мл 0,1 % раствора тимолфталеина.
1 мл 0,1 М раствора натрия гидроксида этанольного соответствует 12,21 мг C7H6O2.
Титр устанавливают непосредственно перед использованием.
Хранить в плотно закрытых ёмкостях из тёмного стекла.
0,1 М раствор натрия гидроксида в смеси метанола и бензола4,2 г натрия гидроксида растворяют в 100 мл метанола в мерной колбе вместимостью 1000,0 мл. Объем раствора доводят бензолом и метанолом до метки, прибавляя их попеременно при помешивании. Соотношение метанола и бензола при приготовлении раствора должно быть примерно 1:4.
Примечание. В случае получения непрозрачного раствора его оставляют на 12 ч, после чего прозрачную жидкость быстро сливают с осадка.
Установка титра. Около 0,100 г (точная навеска) бензойной кислоты PO растворяют в 20 мл диметилформамида, нейтрализованного непосредственно перед титрованием по 1 % раствору тимолового синего в диметилформамиде, и титруют приготовленным раствором натрия гидроксида в присутствии того же индикатора до перехода окраски от желтой к синей.
1 мл 0,1 М раствора натрия гидроксида соответствует 12,21 мг C7H6O2.
Титр устанавливают непосредственно перед использованием.
Примечание. Установку титра следует проводить в тщательно закрытых сосудах. Титрование рекомендуется проводить в атмосфере инертного газа.
Хранить в плотно закрытых ёмкостях из тёмного стекла.
0,1 М раствор натрия метоксида175 мл метанола безводного охлаждают в ледяной воде и прибавляют небольшими порциями около 2,5 г свеженарезанного натрия; когда металл растворится, доводят объём раствора толуолом до 1000,0 мл.
Установка титра. К 10 мл диметилформамида прибавляют 0,05 мл 0,3 % раствора тимолового синего в метаноле и титруют приготовленным раствором натрия метоксида до синего окрашивания. Тотчас прибавляют 0,200 г (точная навеска) бензойной кислоты РО, перемешивают до растворения и титруют приготовленным раствором натрия метоксида до повторного получения синего окрашивания. Во время титрования раствор защищают от атмосферного углерода диоксида. Титр раствора натрия метоксида устанавливают по объему титранта, израсходованного в повторном титровании.
1 мл 0,1 М раствора натрия метоксида соответствует 12,21 мг С7Н6О2.
Титр устанавливают непосредственно перед использованием.
0,1 М раствор натрия нитрита7,5 г натрия нитрита растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. 0,300 г (точная навеска) сульфаниловой кислоты РО растворяют в 50 мл 2 М раствора хлористоводородной кислоты, прибавляют 3 г калия бромида и охлаждают в бане со льдом. Полученный раствор титруют приготовленным раствором натрия нитрита, устанавливая конечную точку титрования электрометрически, используя в качестве индикаторного платиновый электрод, а в качестве электрода сравнения – хлорсеребряный или насыщенный каломельный, или с помощью внутренних индикаторов и внешнего индикатора (йодкрахмальная бумага). Титрование с тропеолином 00 проводят до перехода окраски от красной к желтой, со смесью тропеолина 00 с метиленовым синим – от красно-фиолетовой к голубой, с нейтральным красным – от красно-фиолетовой к синей. Выдержку в конце титрования с нейтральным красным увеличивают до 2 мин.
Полученный раствор титруют приготовленным раствором натрия нитрита, устанавливая конечную точку титрования электрометрически, используя в качестве индикаторного платиновый электрод, а в качестве электрода сравнения – хлорсеребряный или насыщенный каломельный, или с помощью внутренних индикаторов и внешнего индикатора (йодкрахмальная бумага). Титрование с тропеолином 00 проводят до перехода окраски от красной к желтой, со смесью тропеолина 00 с метиленовым синим – от красно-фиолетовой к голубой, с нейтральным красным – от красно-фиолетовой к синей. Выдержку в конце титрования с нейтральным красным увеличивают до 2 мин.
Титрование с йодкрахмальной бумагой ведут до тех пор, пока капля титруемого раствора, взятая через 1 мин после прибавления раствора нитрита натрия, не будет немедленно вызывать синее окрашивание на бумаге. Параллельно проводят контрольный опыт. В некоторых случаях выдержка может быть увеличена, о чем должно быть указано в фармакопейной статье.
1 мл 0,1 М раствора натрия нитрита соответствует 17,32 мг С6Н7 NО3S.
21,4 г натрия перйодата растворяют в 500 мл воды и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл приготовленного раствора прибавляют 5 мл хлорной кислоты, закрывают колбу пробкой и перемешивают. Доводят рН раствора до 6,4 насыщенным раствором натрия гидрокарбоната. Прибавляют 10 мл 16,6 % раствора калия йодида, закрывают пробкой, перемешивают, выдерживают 2 мин и титруют 0,025 М раствором натрия арсенита до слабо-желтого окрашивания, затем прибавляют 2 мл раствора крахмала и титруют до обесцвечивания раствора.
1 мл 0,025 М раствора натрия арсенита соответствует 5,348 мг NaIO4.
0,1 М раствор натрия тиосульфата25 г натрия тиосульфата и 0,2 г натрия карбоната растворяют в воде, свободной от углерода диоксида, и доводят объем раствора той же водой до 1000,0 мл.
Установка титра.
Способ 1. К 20,0 мл 0,0167 М раствора калия бромата прибавляют 40 мл воды, 10 мл 16,6 % раствора калия йодида, 5 мл 7 М раствора хлористоводородной кислоты и титруют приготовленным раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала. Индикатор прибавляют в конце титрования.
К 20,0 мл 0,0167 М раствора калия бромата прибавляют 40 мл воды, 10 мл 16,6 % раствора калия йодида, 5 мл 7 М раствора хлористоводородной кислоты и титруют приготовленным раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала. Индикатор прибавляют в конце титрования.
1 мл 0,1 М раствора натрия тиосульфата соответствует 2,784 мг КВrO3.
Способ 2. Около 0,15 г (точная навеска) калия дихромата РО растворяют в 50 мл воды в колбе с притертой пробкой, прибавляют 2 г калия йодида, 5 мл хлористоводородной кислоты 25 %, закрывают пробкой, смоченной 10 % раствором калия йодида, и оставляют в защищенном от света месте на 10 мин. Прибавляют 100 мл воды, промывая пробку водой, и титруют приготовленным раствором натрия тиосульфата до зеленовато-желтого окрашивания. Затем прибавляют 2 мл раствора крахмала и продолжают титровать до перехода синей окраски в светло-зеленую.
1 мл 0,1 М раствора натрия тиосульфата соответствует 4,903 мг K2Cr2O7.
Хранят в сосудах темного стекла с притертыми пробками в защищенном от света и углекислоты месте.
0,005 М раствор натрия тиосульфата25,0 мл 0,1 М раствора натрия тиосульфата доводят водой, свободной от углерода диоксида, до объема 500,0 мл.
Используют свежеприготовленный раствор.
Установка титра.
Способ 1. К 5,0 мл 0,0083 М раствора калия бромата прибавляют 35 мл воды, 10 мл 16,6 % раствора калия йодида, 5 мл 7 М раствора хлористоводородной кислоты и титруют приготовленным раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала. Индикатор прибавляют в конце титрования.
1 мл 0,005 М раствора натрия тиосульфата соответствует 0,139 мг КBrО3.
Способ 2. Около 0,15 г (точная навеска) калия дихромата РО растворяют в воде в мерной колбе вместимостью 250 мл, доводят объем раствора водой до метки и перемешивают. 25 мл полученного раствора калия дихромата помещают в колбу с притертой пробкой, прибавляют 0,2 г калия йодида, 3 мл хлористоводородной кислоты 25 %, закрывают пробкой, смоченной 10 % раствором калия йодида, и оставляют в защищенном от света месте на 10 мин. Прибавляют 50 мл воды, промывая пробку водой, и титруют как описано при установке титра 0,1 М раствора натрия тиосульфата по способу 2.
Прибавляют 50 мл воды, промывая пробку водой, и титруют как описано при установке титра 0,1 М раствора натрия тиосульфата по способу 2.
1 мл 0,005 М раствора натрия тиосульфата соответствует 0,2452 мг K2Cr2O7.
0,1 М раствор натрия эдетата0,1 М раствор трилона Б.
37,5 г натрия эдетата растворяют в 500 мл воды, прибавляют 100 мл 1 М раствора натрия гидроксида и доводят объем раствора водой до 1000,0 мл.
Установка титра. 0,120 г цинка РО растворяют в 4 мл 7 М раствора хлористоводородной кислоты и прибавляют 0,1 мл бромной воды; избыток брома удаляют кипячением, прибавляют 2 М раствор натрия гидроксида до слабокислой или нейтральной реакции, разбавляют водой до 200 мл, прибавляют 50 мг индикаторной смеси ксиленолового оранжевого и достаточное количество гексаметилентетрамина до фиолетово-розового окрашивания, прибавляют ещё 2 г гексаметилентетрамина и титруют приготовленным раствором натрия эдетата до изменения окраски от фиолетово-розовой к жёлтой.
1 мл 0,1 М раствора натрия эдетата соответствует 6,54 мг Zn.
0,05 М раствор натрия эдетата0,05 М раствор трилона Б.
18,6 г натрия эдетата растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. 0,060 г цинка РО растворяют в 4 мл 7 М раствора хлористоводородной кислоты и добавляют 0,1 мл бромной воды. Далее поступают, как указано при установке титра 0,1 М раствора натрия эдетата.
1 мл 0,05 М раствора натрия эдетата соответствует 3,269 мг Zn.
0,02 М раствор натрия эдетата7,444 г натрия эдетата растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. 0,030 г цинка РО растворяют в 4 мл 7 М раствора хлористоводородной кислоты и добавляют 0,1 мл бромной воды. Далее поступают, как указано при установке титра 0,1 М раствора натрия эдетата.
1 мл 0,02 М раствора натрия эдетата соответствует 1,308 мг Zn.
0,05 М раствор ртути окисной нитрата.
17,2 г ртути(II) нитрата растворяют в 50 мл 1 М раствора азотной кислоты и разбавляют водой до 1000,0 мл.
Установка титра. 0,150 г (точная навеска) натрия хлорида РО растворяют в 50 мл воды и титруют приготовленным раствором ртути(II) нитрата, используя в качестве индикатора 0,5 мл 1 % спиртового раствора дифенилкарбазона.
1 мл 0,05 М раствора ртути окисной нитрата соответствует 5,844 мг NaCl.
0,1 М раствор серебра нитрата17,0 г серебра нитрата растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра.
Способ 1. 0,150 г (точная навеска) натрия хлорида РО растворяют в 50 мл воды и титруют приготовленным раствором серебра нитрата до появления красноватого осадка, используя в качестве индикатора 5 % раствор калия хромата. Параллельно проводят контрольный опыт.
Параллельно проводят контрольный опыт.
1 мл 0,1 М раствора серебра нитрата соответствует 5,844 мг NaCl.
Способ 2. 0,100 г (точная навеска) натрия хлорида РО растворяют в 30 мл воды и титруют потенциометрически приготовленным раствором нитрата серебра. Параллельно проводят контрольный опыт.
1 мл 0,1 М раствора нитрата серебра соответствует 5,844 мг NaCl.
Хранят в защищенном от света месте.
0,01 М раствор серебра нитрата50,0 мл 0,1 М раствора серебра нитрата разбавляют водой до объёма 500,0 мл.
0,001 М раствор серебра нитрата5,0 мл 0,1 М раствора серебра нитрата доводят водой до объёма 500,0 мл.
0,5 М (1 н.) раствор серной кислоты30 мл серной кислоты концентрированной осторожно вливают в воду и доводят объем раствора водой до 1000,0 мл.
Установка титра. 1,000 г (точная навеска) натрия карбоната безводного РО растворяют в 50 мл воды, прибавляют 0,1 мл 0,1 % раствора метилового оранжевого (раствор окрашивается в жёлтый цвет). Титруют приготовленным раствором серной кислоты до красновато-жёлтого окрашивания. Кипятят около 2 мин (раствор снова приобретает жёлтое окрашивание), охлаждают и титруют вновь до повторного появления красновато-жёлтого окрашивания.
Титруют приготовленным раствором серной кислоты до красновато-жёлтого окрашивания. Кипятят около 2 мин (раствор снова приобретает жёлтое окрашивание), охлаждают и титруют вновь до повторного появления красновато-жёлтого окрашивания.
1 мл 0,5 М раствора серной кислоты соответствует 53,00 мг Na2CO3.
0,05 М (0,1 н.) раствор серной кислоты100,0 мл 0,5 М раствора серной кислоты доводят водой до объёма 1000,0 мл.
0,1 М раствор свинца(II) нитрата33 г свинца(II) нитрата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл приготовленного раствора свинца нитрата прибавляют 300 мл воды, 50 мг тритурации ксиленолового оранжевого и достаточное количество гексаметилентетрамина до появления фиолетово-розового окрашивания. Титруют 0,1 М раствором натрия эдетата до появления жёлтого окрашивания.
1 мл 0,1 М раствора натрия эдетата соответствует 33,12 мг Рb(NO3)2.
0,05 М раствор свинца(II) нитрата16,5 г свинца(II) нитрата растворяют в достаточном количестве воды и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 50,0 мл приготовленного раствора добавляют 300 мл воды. Далее поступают, как указано в установке титра 0,1 М раствора свинца нитрата.
0,1 М раствор тетрабутиламмония гидроксида40 г тетрабутиламмония йодида растворяют в 90 мл метанола безводного, прибавляют 20 г тонко измельченного серебра оксида и энергично встряхивают в течение 1 ч. Центрифугируют несколько миллилитров смеси и проводят испытание жидкости над осадком на йодиды. При получении положительной реакции дополнительно прибавляют 2 г серебра оксида и встряхивают в течение последующих 30 мин; эту процедуру повторяют до тех пор, пока жидкость не будет свободна от йодидов. Смесь фильтруют через стеклянный фильтр, промывают реакционный сосуд и фильтр 3 порциями, по 50 мл каждая, толуола. К полученному фильтрату прибавляют промывной толуол и доводят объем раствора толуолом до 1000,0 мл. Через раствор пропускают сухой азот, свободный от углерода диоксида, в течение 5 мин.
Смесь фильтруют через стеклянный фильтр, промывают реакционный сосуд и фильтр 3 порциями, по 50 мл каждая, толуола. К полученному фильтрату прибавляют промывной толуол и доводят объем раствора толуолом до 1000,0 мл. Через раствор пропускают сухой азот, свободный от углерода диоксида, в течение 5 мин.
Установка титра. К 10 мл диметилформамида прибавляют 0,05 мл 0,3 % раствора тимолового синего в метаноле и титруют приготовленным раствором тетрабутиламмония гидроксида до чистого синего окрашивания. Тотчас прибавляют 0,200 г (точная навеска) бензойной кислоты РО, перемешивают до растворения и продолжают титрование до синего окрашивания. Титр раствора тетрабутиламмония гидроксида устанавливают по объему титранта, израсходованного в повторном титровании.
1 мл 0,1 М раствора тетрабутиламмония гидроксида соответствует 12,21 мг C7H6O2.
Титр устанавливают непосредственно перед использованием.
0,1 М раствор тетрабутиламмония гидроксида в 2-пропанолеРаствор готовят, как указано для 0,1 М раствора тетрабутиламмония гидроксида, используя в качестве растворителя 2-пропанол вместо толуола.
Установка титра. Титр устанавливают, как указано для 0,1 М раствора тетрабутиламмония гидроксида.
0,01 М раствор тетрабутиламмония йодида4 г тетрабутиламмония йодида растворяют в достаточном количестве воды и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 25,0 мл приготовленного раствора прибавляют 50 мл 0,01 М раствора серебра нитрата, 0,5 мл 2 М раствора азотной кислоты и титруют избыток серебра нитрата 0,01 М раствором аммония тиоцианата, используя в качестве индикатора 0,5 мл 0,2 % раствора железа(III) аммония сульфата.
1 мл 0,01 М раствора серебра нитрата соответствует 3,694 мг C16H36IN.
0,1 М раствор тетраэтиламмония гидроксида30 г тетраэтиламмония йодида растворяют в 200 мл метанола и встряхивают в течение 1 ч с 25 г тонко измельченного серебра оксида в стеклянном сосуде с притертой пробкой. По окончании встряхивания центрифугируют несколько миллилитров смеси и раствор испытывают на присутствие йодидов. При положительной реакции к основному раствору прибавляют еще 5 г серебра оксида и снова встряхивают 30 мин; эту процедуру повторяют до тех пор, пока жидкость не будет свободна от йодидов; смесь фильтруют через стеклянный фильтр. Реакционную колбу ополаскивают 3 порциями, по 50 мл каждая, сухого бензола, бензольный раствор фильтруют через тот же фильтр и прибавляют к фильтрату. Фильтрат доводят бензолом до объема 1000,0 мл. Через полученный раствор пропускают сухой азот, свободный от углерода диоксида, в течение 5 мин.
При положительной реакции к основному раствору прибавляют еще 5 г серебра оксида и снова встряхивают 30 мин; эту процедуру повторяют до тех пор, пока жидкость не будет свободна от йодидов; смесь фильтруют через стеклянный фильтр. Реакционную колбу ополаскивают 3 порциями, по 50 мл каждая, сухого бензола, бензольный раствор фильтруют через тот же фильтр и прибавляют к фильтрату. Фильтрат доводят бензолом до объема 1000,0 мл. Через полученный раствор пропускают сухой азот, свободный от углерода диоксида, в течение 5 мин.
Установка титра. К смеси 5 мл метанола и 20 мл ацетона прибавляют 0,05 мл 0,3 % раствора тимолового синего в метаноле и титруют приготовленным раствором тетраэтиламмония гидроксида до чистого синего окрашивания. Сразу же прибавляют 0,200 г (точная навеска) бензойной кислоты РО, перемешивают до растворения и продолжают титрование до синего окрашивания. Титр устанавливают по объему титранта, израсходованного при повторном титровании.
1 мл 0,1 М раствора тетраэтиламмония гидроксида соответствует 12,21 мг С7Н6О2.
87,0 мл хлористоводородной кислоты концентрированной доводят водой до объёма 1000,0 мл.
Установка титра. 1,000 г (точная навеска) натрия карбоната безводного РО растворяют в 50 мл воды, прибавляют 0,1 мл 0,1 % раствора метилового оранжевого (раствор окрашивается в жёлтый цвет) и титруют приготовленным раствором хлористоводородной кислоты до красновато-жёлтого окрашивания. Кипятят в течение 2 мин (раствор снова приобретает жёлтое окрашивание), охлаждают и продолжают титрование до красновато-жёлтого окрашивания.
1 мл 1 М раствора хлористоводородной кислоты соответствует 53,00 мг Na2CO3.
0,5 М раствор хлористоводородной кислоты43,5 мл концентрированной хлористоводородной кислоты доводят водой до объёма 1000,0 мл.
Установка титра. 0,600 г (точная навеска) натрия карбоната безводного РО растворяют в 100 мл воды. Далее поступают, как при установке титра 1 М раствора хлористоводородной кислоты.
Далее поступают, как при установке титра 1 М раствора хлористоводородной кислоты.
1 мл 0,5 М раствора хлористоводородной кислоты соответствует 26,50 мг Na2CO3.
0,1 М раствор хлористоводородной кислоты100,0 мл 1 М раствора хлористоводородной кислоты доводят водой до объёма 1000,0 мл.
1 мл 0,1 М раствора хлористоводородной кислоты соответствует 5,30 мг Na2CO3.
0,01 М раствор хлористоводородной кислоты10,0 мл 1 М раствора хлористоводородной кислоты доводят водой до объёма 1000,0 мл.
1 мл 0,01 М раствора хлористоводородной кислоты соответствует 0,53 мг Na2CO3.
0,1 М раствор хлористоводородной кислоты спиртовой9,0 мл хлористоводородной кислоты концентрированной доводят спиртом 96 %, свободным от альдегидов, до объёма 1000,0 мл.
0,1 М раствор хлорной кислотыК 900 мл уксусной кислоты ледяной прибавляют 8,5 мл 70 % или 11 мл 60 % раствора хлорной кислоты, перемешивают, добавляют 30 мл уксусного ангидрида и доводят объем раствора уксусной кислотой ледяной до 1000,0 мл, перемешивают и оставляют на 24 ч. Содержание воды определяют методом К. Фишера без добавления метанола и, если необходимо, прибавляют воду или уксусный ангидрид до содержания воды от 0,1 до 0,2 %. Оставляют на 24 ч.
Содержание воды определяют методом К. Фишера без добавления метанола и, если необходимо, прибавляют воду или уксусный ангидрид до содержания воды от 0,1 до 0,2 %. Оставляют на 24 ч.
Установка титра. 0,350 г (точная навеска) калия гидрофталата РО растворяют в 50 мл уксусной кислоты безводной, если необходимо, осторожно нагревая, охлаждают и титруют приготовленным раствором хлорной кислоты, используя в качестве индикатора 0,05 мл 0,5 % раствора кристаллического фиолетового, до перехода фиолетовой окраски раствора в голубовато-зелёную.
1 мл 0,1 М раствора хлорной кислоты соответствует 20,42 мг C8H5KO4.
Примечание. Если температура, при которой проводится количественное определение, отличается от температуры, при которой был установлен титр 0,1 М раствора хлорной кислоты, то вводят температурную поправку. Объем (Vc), необходимый для количественного определения, вычисляют по формуле:
Vc = V [1 + (t1 – t2) 0,0011],
где t1 – температура, при которой устанавливают титр;
t2 – температура, при которой проводят количественное определение;
V – объём, израсходованный на титрование фактически, мл.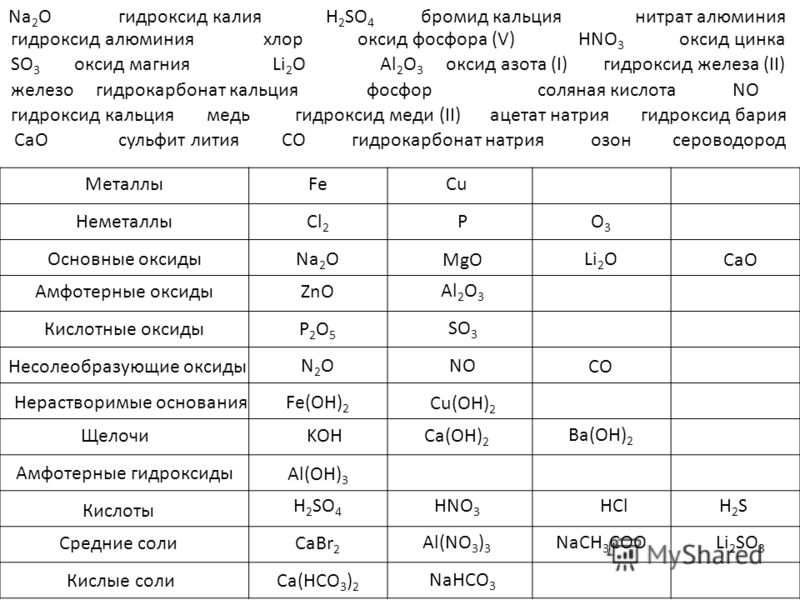
50,0 мл 0,1 М раствора хлорной кислоты доводят уксусной кислотой безводной до объема 100,0 мл.
0,1 М раствор хлорной кислоты в метанолеК 11 мл 60 % или 8,5 мл 70 % раствора хлорной кислоты прибавляют 500 мл метанола, очищенного от карбонилсодержащих соединений, и доводят объём раствора тем же метиловым спиртом до 1000,0 мл.
Установка титра. Около 0,1 г натрия салицилата (точная навеска), предварительно дважды перекристаллизованного из спирта 96 % и высушенного до постоянной массы, растворяют в 10 мл метанола, прибавляют равный объём ацетона, 2 капли 0,3 % раствора тимолового синего в метаноле и титруют приготовленным раствором хлорной кислоты до перехода окраски от жёлтой к розовой.
1 мл 0,1 М раствора хлорной кислоты соответствует 16,01 мг С7Н5NaO3.
0,1 М раствор хлорной кислоты в нитрометанеК 11 мл 60 % или 8,5 мл 70 % раствора хлорной кислоты прибавляют 500 мл нитрометана и доводят объём раствора нитрометаном до 1000,0 мл.
Установка титра. Как описано при установке титра 0,1 М раствора хлорной кислоты.
0,1 М раствор уксусной кислоты6,0 г уксусной кислоты ледяной доводят водой до объема 1000,0 мл.
Установка титра. К 25,0 мл приготовленного раствора уксусной кислоты прибавляют 0,5 мл 0,1 % раствора фенолфталеина и титруют 0,1 М раствором натрия гидроксида.
1 мл 0,1 М раствора натрия гидроксида соответствует 6,01 мг С2Н4О2.
0,1 М раствор церия(IV) сульфата40,4 г церия(IV) сульфата растворяют в смеси 500 мл воды и 50 мл серной кислоты концентрированной; охлаждают и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 25,0 мл приготовленного раствора церия(IV) сульфата прибавляют 2,0 г калия йодида, 150 мл воды и тотчас титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала.
1 мл 0,1 М раствора натрия тиосульфата соответствует 40,43 мг Се(SO4)2 × 4 H2O.
0,05 М раствор цинка хлорида6,82 г цинка хлорида растворяют в воде. Если необходимо, по каплям прибавляют хлористоводородную кислоту разведенную 7,3 % до исчезновения опалесценции и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл приготовленного раствора цинка хлорида прибавляют 5 мл 2 М раствора уксусной кислоты, разбавляют до 200 мл водой, добавляют 50 мг тритурации ксиленолового оранжевого и достаточное количество гексаметилентетрамина до появления фиолетово-розового окрашивания, добавляют еще 2 г гексаметилентетрамина и титруют 0,1 М раствором натрия эдетата до перехода окрашивания от фиолетово-розового до жёлтого.
1 мл 0,1 М раствора натрия эдетата соответствует 13,63 мг ZnCl2.
0,1 М раствор цинка сульфата29 г цинка сульфата растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл приготовленного раствора цинка сульфата прибавляют 5 мл 2 М раствора уксусной кислоты, разбавляют водой до 200 мл. Далее поступают, как при установке титра 0,05 М раствора цинка хлорида.
1 мл 0,1 М раствора натрия эдетата соответствует 28,75 мг ZnSO4 · 7 H2O.
Скачать в PDF ОФС.1.3.0002.15 Титрованные растворы
Вдовенко В. М. Химия урана и трансурановых элементов. — 1960 — Электронная библиотека «История Росатома»
Вдовенко В. М. Химия урана и трансурановых элементов. — 1960 — Электронная библиотека «История Росатома»Главная → Указатель произведений
ЭлектроннаябиблиотекаИстория Росатома
Ничего не найдено.
Загрузка результатов…
Закладки
Обложка123456789101112131415161718192021222324252627282930313233343536373839404142434445464748495051525354555657585960616263646566676869707172737475767778798081828384858687888990919293949596979899100101102103104105106107108109110111112113114115116117118119120121122123124125126127128129130131132133134135136137138139140141142143144145146147148149150151152153154155156157158159160161162163164165166167168169170171172173174175176177178179180181182183184185186187188189190191192193194195196197198199200201202203204205206207208209210211212213214215216217218219220221222223224225226227228229230231232233234235236237238239240241242243244245246247248249250251252253254255256257258259260261262263264265266267268269270271272273274275276277278279280281282283284285286287288289290291292293294295296297298299300301302303304305306307308309310311312313314315316317318319320321322323324325326327328329330331332333334335336337338339340341342343344345346347348349350351352353354355356357358359360361362363364365366367368369370371372373374375376377378379380381382383384385386387388389390391392393394395396397398399400401402403404405406407408409410411412413414415416417418419420421422423424425426427428429430431432433434435436437438439440441442443444445446447448449450451452453454455456457458459460461462463464465466467468469470471472473474475476477478479480481482483484485486487488489490491492493494495496497498499500501502503504505506507508509510511512513514515516517518519520521522523524525526527528529530531532533534535536537538539540541542543544544 вкл. 1544 вкл. 2545546547548549550551552553554555556557558559560561562563564565566567568569570571572573574575576577578579580581582583584585586587588589590591592593594595596597598599600601602603604605606607608609610611612613614615616617618619620621622623624625626627628629630631632633634635636637638639640641642643644645646647648649650651652653654655656657658659660661662663664665666667668669670671672673674675676677678679680681682683684685686687688689690691692693694695696697698699700
1544 вкл. 2545546547548549550551552553554555556557558559560561562563564565566567568569570571572573574575576577578579580581582583584585586587588589590591592593594595596597598599600601602603604605606607608609610611612613614615616617618619620621622623624625626627628629630631632633634635636637638639640641642643644645646647648649650651652653654655656657658659660661662663664665666667668669670671672673674675676677678679680681682683684685686687688689690691692693694695696697698699700
Увеличить/уменьшить масштаб
По ширине страницы
По высоте страницы
Постранично/Разворот
Поворот страницы
Навигация по документу
Закладки
Поиск в издании
Структура документа
Скопировать текст страницы
(работает в Chrome 42+,
Microsoft Internet Explorer и Mozilla FireFox
c установленным Adobe Flash Player)
Добавить в закладки
Текущие страницы выделены рамкой.
Содержание
ОбложкаОбложка
1Титульные листы
3Предисловие
5Глава I. Химия урана
51. Введение
72. Об основных радиоактивных постоянных
93. Изотопный состав и виды радиоактивного распада трансурановых элементов
114. Изотопы урана
115. Нахождение урана в природе
366. Методы переработки урановых руд
507. Комплексное использование урановых руд
50[Введение]
50Извлечение урана
52Извлечение радия
53Извлечение иония и протактиния
54Разделение протактиния и иония
558. Получение металлического урана
55[Введение]
55Восстановление окислов и галогенидов урана щелочными и щелочноземельными металлами
59Термическое разложение галогенидов урана
599. Свойства металлического урана
59Физические свойства
61Химические свойства
6510. Соединения урана
65Система уран—водород
68Окислы урана и их гидраты
78Соединения урана с серой, селеном и теллуром
80Нитриды, фосфиды, арсениды и антимониды урана
82Бориды, карбиды и силициды урана
87Диффузия урана через графит
89Боргидрид урана (IV) U(BH4)4
92О получении гексакарбонила урана
95Галогениды урана
127Смешанные галогениды урана
130Оксигалогениды урана
143Энергетика твердых соединений урана в свете принципа замещения
148Уранаты и перуранаты
153Соли урана
156Соли уранила
174Соединения урана с органическими веществами
18011. Химия урана в водных растворах
Химия урана в водных растворах
180[Введение]
180Окислительные состояния урана в растворе
185Гидролиз солей урана в водных растворах
189Комплексообразование в растворах солей урана
19812. Химия урана в певодпых растворах
198Растворимость уранилнитрата в органических растворителях
201Электропроводность уранилнитрата в органических растворителях
202Степень гидратации уранилнитрата в органических растворителях
203Взаимная растворимость в тройных системах уранилнитрат—вода—органический растворитель
205О механизме растворимости уранилнитрата в органических растворителях
209Теплоты растворения гидратов уранилнитрата в органических растворителях
211Растворимость других солей урана
214Глава II. Химия трансурановых элементов
2141. Введение
2192. Нептуний
219История открытия и изотопы нептуния
222Металлический нептуний
223Соединения нептуния
228Окислы нептуния
229Перекись нептуния, гидроокиси и нептунаты
229Соединения нептуния с серой
230Соединения нептуния с азотом и фосфором
231Соединения нептуния с углеродом и кремнием
232Соли нептуния
235Химия водных растворов нептуния
2483. Плутоний
Плутоний
248[Введение]
249История открытия и изотопы плутония
254Нахождение плутония в природе
255Металлический плутоний
274Соединения плутония
276Галогениды и оксигалогениды плутония
296Окислы плутония и их гидраты
301Плутониты и плутонаты
302Соединения плутония с серой
304Соединения плутония с элементами пятой группы
309Соединения плутония с элементами четвертой группы
315Соединения плутония с некоторыми металлами
317Комплексные соединения плутония с органическими аддендами
321Плутоний в водных растворах
324Гидролиз ионов плутония
328Комплексные ионы плутония
351Влияние α-излучения на валетное состояние плутония в растворах
354Потенциалы, равновесия и окислительно-восстановительные реакции плутония
3654. Америций
365История открытия и изотопы америция
367Металлический америций
369Соединения америция
376Америций в водных растворах
388Радиолитическое восстановление пятивалентного и шестивалентного америция
3905. Кюрий
Кюрий
390История открытия и изотопы кюрия
392Получение и методы очистки кюрия
395Кюрий в водных растворах
396Спектры поглощения Cm (III)
3976. Транскюриевые элементы
4247. Магнетохимия тория, урана и трансурановых элементов
424Характеристика основных методов и величин
432Магнетохимические данные для отдельных элементов
455Глава III. Научные основы химии ядерного горючего
4551. Введение
4622. Критические массы делящихся веществ
4733. Тепловыделяющие элементы
4784. Водные урановые взвеси
4805. Растворение горючего ядерных реакторов
4836. Эффективность химической очистки металлов
4847. Экстракционные процессы
484Химические основы экстракционных процессов
488Экстракция эфирами и кетонами
505Экстракция фосфорорганическими соединениями
519Экстракция аминами
538Экстракция хелатообразующими веществами
5418. Технологический процесс переработки облученного урана экстракционным методом с применением гексона на химическом заводе в штате Айдахо
5569. Отделение урана и плутония от продуктов деления экстракцией смесью дибутилового эфира и четыреххлористого углерода
Отделение урана и плутония от продуктов деления экстракцией смесью дибутилового эфира и четыреххлористого углерода
56410. Очистка урана и плутония от продуктов деления экстракцией трибутилфосфатом
56911. Переработка облученных тепловыделяющих элементов первой атомной электростанции СССР
57412. Осадительные процессы
574Химические основы осадительных процессов
590Лантансульфатный процесс
593Висмутфосфатный процесс
596Лантанфторидный процесс
598Циркониевофосфатный процесс
59913. Электролитическое выделение малых количеств урана, нептуния и плутония
60514. Ионообменные процессы
62115. Безводные процессы
621Новые перспективные методы химии ядерного горючего
623Дробная дистилляция фторидов
638Сухой метод регенерации облученного урана — вакуумная возгонка
640Экстракция расплавленными металлами
653Экстракция расплавленными солями
659Окислительное шлакование
663Электрорафинирование
670Литература
698Оглавление
700Концевая страница
Обращаясь к сайту «История Росатома — Электронная библиотека»,
я соглашаюсь с условиями использования представленных там материалов.
Правила сайта (далее – Правила)
- Общие положения
- Настоящие правила определяют порядок и условия использования материалов, размещенных на сайте www.biblioatom.ru (далее именуется Сайт), а также правила использования материалов Сайтом и порядок взаимодействия с Администрацией Сайта.
- Любые материалы, размещенные на Сайте, являются объектами интеллектуальной собственности (объектами авторского права или смежных прав, а также прав на средства индивидуализации). Права Администрации Сайта на указанные материалы охраняются законодательством о правах на результаты интеллектуальной деятельности.
- Использование материалов, размещенных на Сайте, допускается только с письменного согласия Администрации Сайта или иного правообладателя, прямо указанного на конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
- Права на использование и разрешение использования материалов, размещенных на Сайте, принадлежащих иным правообладателям, нежели Администрация Сайта, допускается с разрешения таких правообладателей
или в соответствии с условиями, установленными такими правообладателями.
 Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на
конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на
конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
- Настоящие Правила распространяют свое действие на следующих пользователей: информационные агентства, электронные и печатные средства массовой информации, любые физические и юридические лица, а также индивидуальные предприниматели (далее — «Пользователи»).
- Использование материалов. Виды использования
- Под использованием материалов Сайта понимается воспроизведение, распространение, публичный показ, сообщение в эфир, сообщение по кабелю, перевод, переработка, доведение до всеобщего сведения и иные способы использования, предусмотренные действующим законодательством Российской Федерации.
- Использование материалов Сайта без получения разрешения от Администрации Сайта не допустимо.

- Внесение каких-либо изменений и/или дополнений в материалы Сайта запрещено.
- Использование материалов Сайта осуществляется на основании договоров с Администрацией Сайта, заключенных в письменной форме, или на основании письменного разрешения, выданного Администрацией Сайта.
- Запрещается любое использование (бездоговорное/без разрешения) фото-, графических, видео-, аудио- и иных материалов, размещенных на Сайте, принадлежащих Администрации Сайта и иным правообладателям (третьим лицам).
- Стоимость использования каждого конкретного материала или выдача разрешения на его использование согласуется Пользователем и Администрацией Сайта в каждом конкретном случае.
- В случае необходимости использования материалов Сайта, права на которые принадлежат третьим лицам (иным правообладателям, нежели Администрация Сайта, о чем прямо указано на таких материалах либо в
непосредственной близости от них), Пользователи обязаны обращаться к правообладателям таких материалов для получения разрешения на использование материалов.

- Обязанности Пользователей при использовании материалов Сайта
- 3.1. При использовании материалов Сайта в любых целях при наличии разрешения Администрации Сайта, ссылка на Сайт обязательна и осуществляется в следующем виде:
- в печатных изданиях или в иных формах на материальных носителях Пользователи обязаны в каждом случае использования материалов указать источник – электронная библиотека «История Росатома» (www.biblioatom.ru)
- в интернете или иных формах использования в электронном виде не на материальных носителях, Пользователи в каждом случае использования материалов обязаны разместить гиперссылку на Сайт —
электронная
библиотека «История Росатома» (www.biblioatom.ru), гиперссылка должна являться активной и прямой, при нажатии на которую Пользователь переходит на конкретную страницу Сайта, с которой заимствован
материал.

- Ссылка на источник или гиперссылка, указанные в пп. 3.1.1 и 3.1.2. настоящих Правил, должны быть помещены Пользователем в начале используемого текстового материала, а также непосредственно под используемым аудио-, видео-, фотоматериалом, графическим материалом Администрации Сайта.
- Размеры шрифта ссылки на источник или гиперссылки не должны быть меньше размера шрифта текста, в котором используются материалы Сайта, либо размера шрифта текста Пользователя, сопровождающего аудио-, видео-, фотоматериалы и графические материалы Сайта, а также цвет ссылки должен быть идентичен цветам ссылок на Сайте и должен быть видимым Пользователю.
- Использование материалов с Сайта, полученных из вторичных источников (от иных правообладателей, нежели Администрация Сайта, о чем прямо указано на таких материалах либо в непосредственной близости от
них), возможно только со ссылкой на эти источники и, в случае необходимости, установленной такими источниками (правообладателями), — с их разрешения.

- Не допускается переработка оригинального материала (произведения), взятого с Сайта, в том числе сокращение материала, иная его переработка, в том числе приводящая к искажению его смысла.
- 3.1. При использовании материалов Сайта в любых целях при наличии разрешения Администрации Сайта, ссылка на Сайт обязательна и осуществляется в следующем виде:
- Права на материалы третьих лиц, урегулирование претензий
- Материалы, права на которые принадлежат третьим лицам, размещенные на Сайте, размещены либо с разрешения правообладателя, полученного Администрацией Сайта, либо, в случае, если таковое использование прямо не запрещено правообладателем, в соответствии с Законодательством РФ в информационных целях с обязательным указанием имени автора, материал которого используется, и источника заимствования.
- В случае, если в обозначении авторства материалов в соответствии с п. 4.1. настоящих Правил содержится ошибка, или в случае использования материала с предполагаемым или реальным нарушением прав
третьих лиц, или в иных спорных случаях использования объектов интеллектуальной собственности, размещенных на Сайте, в том числе в случае, когда права третьего лица тем или иным образом нарушаются с
использованием Сайта, применяется следующая схема урегулирования претензий третьих лиц к Администрации Сайта:
- в адрес Администрации Сайта по электронной почте на адрес info@biblioatom.
 ru направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем. В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
ru направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем. В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
- Администрация Сайта обязуется рассмотреть надлежаще оформленную претензию в срок не менее 5 (пяти) рабочих дней с даты ее получения по электронной почте.
 Администрация Сайта обязуется
уведомить
заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес,
указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация
Сайта
вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все
возможные
меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии;
Администрация Сайта обязуется
уведомить
заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес,
указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация
Сайта
вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все
возможные
меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии;
- Администрация Сайта в любом случае предпринимает все возможные меры к скорейшему удовлетворению обоснованных претензий третьих лиц и стремиться к максимально скорому урегулированию всех
спорных
вопросов.

- в адрес Администрации Сайта по электронной почте на адрес info@biblioatom.
- Прочие условия
- Администрация Сайта оставляет за собой право изменять настоящие Правила в одностороннем порядке в любое время без уведомления Пользователей. Любые изменения будут размещены на Сайте. Изменения вступают в силу с момента их опубликования на Сайте.
- По всем вопросам использования материалов Сайта Пользователи могут обращаться к Администрации Сайта по следующим координатам: [email protected]
- Во всем, что не урегулировано настоящими Правилами в отношении вопросов использования материалов на Сайте, стороны руководствуются положениями Законодательства РФ.
СогласенНе согласен
Реальный ЕГЭ по химии 2021. Задание 34 (№33 в ЕГЭ 2022)
Чтобы поделиться, нажимайте
Реальный ЕГЭ по химии 2021. Задание 34
Представляем вашему вниманию реальный ЕГЭ по химии 2021 — задания 34 из реального ЕГЭ 2021 (основная волна 31 мая 2021 года) с подробными видео-объяснениями, и (или) с ответами. (будет дополнено позже)
(будет дополнено позже)
ВНИМАНИЕ — в ЕГЭ 2022 года это будет задание 33
В этом году в разных регионах были задачи, включающие разные типы решения. В основном это были задачи на растворы (массовую долю) плюс:
- 1. Электролиз + система уравнений
- 2. Электролиз + кристаллогидраты + растворимость
- 3. Задачи на атомистику + вывод формул + электролиз + кристаллогидраты
- 4. На соотношение атомов (атомистика) + система уравнений + кислые/средние соли
- 5. На разделение раствора на несколько колб (частей).
Задачи на электролиз + система уравнений
1. Через 520 г 16,1%-ного раствора сульфата цинка пропускали электрический ток до тех пор, пока объем газа, выделившегося на катоде, не стал равен объему газа, выделившемуся на аноде. При этом массовая доля сульфата цинка понизилась до 10,3%. К полученному раствору добавили 212 г 10% раствора карбоната натрия. Вычислите массовую долю сульфата цинка в полученном растворе.
Решение: смотри видео
2. Через 400 г 36%-ного раствора нитрата железа (II) пропустили электрический ток до момента, когда объём газа, выделившегося на катоде, не стал в 2 раза меньше объёма газа, выделившегося на аноде. В полученном растворе массовая доля нитрата железа (II) уменьшилась до 10,19%. К полученному раствору прилили 120 г 40%-ного раствора карбоната аммония. Определите массовую долю нитрата железа (II) в конечном растворе. (Окислением ионов железа 2+ и их осаждением в прикатодном пространстве пренебречь.)
Решение:
(АНАЛОГИЧНАЯ ПРЕДЫДУЩЕЙ, поэтому к этой задаче прилагается только ответ. Если у вас не получается её решить, то смотрите предыдущее видео и решайте по анологии)
Задачи на электролиз + кристаллогидраты + растворимость
3. Электролиз 5%-ного раствора нитрата бария массой 522 г проводили до тех пор, пока на аноде не выделилось 8,4 л газа. К образовавшему раствору прилили насыщенный раствор, полученный при растворении 96,6 г глауберовой соли (Na2SO4∙10H2O) в воде. В результате массовая доля сульфата натрия уменьшилась в 4,5 раза. Определите растворимость безводного сульфата натрия на 100г воды.
Электролиз 5%-ного раствора нитрата бария массой 522 г проводили до тех пор, пока на аноде не выделилось 8,4 л газа. К образовавшему раствору прилили насыщенный раствор, полученный при растворении 96,6 г глауберовой соли (Na2SO4∙10H2O) в воде. В результате массовая доля сульфата натрия уменьшилась в 4,5 раза. Определите растворимость безводного сульфата натрия на 100г воды.
Решение: смотри видео
4. Электролиз 10%-ного раствора нитрата бария массой 522 г проводили до тех пор, пока 4,2 моля воды не ушли. К образовавшему раствору прилили насыщенный раствор, полученный при растворении 100 г медного купороса (CuSO4∙5H2O) в воде. В результате массовая доля сульфата меди (II) уменьшилась в 4 раза. Определите растворимость безводного сульфата меди (II) на 100г воды.
В результате массовая доля сульфата меди (II) уменьшилась в 4 раза. Определите растворимость безводного сульфата меди (II) на 100г воды.
Решение:
(АНАЛОГИЧНАЯ ПРЕДЫДУЩЕЙ, поэтому к этой задаче прилагается только ответ. Если у вас не получается её решить, то смотрите предыдущее видео и решайте по анологии)
Задачи на атомистику + вывод формул + электролиз + кристаллогидраты
5. Кристаллогидрат сульфата алюминия, в котором массовая доля серы в 5 раз меньше массовой доли кислорода, растворили в воде. При этом образовался раствор массой 722,4 г. Через полученный раствор пропускали электрический ток до тех пор, пока на аноде не выделилось 35,84 л газа. Затем к образовавшемуся растврору прилили раствор карбоната натрия массой 424 г с массовой долей соли 10%. При этом массовая доля карбоната натрия уменьшилась в 10 раз. Вычислите массу растворенного кристаллогидрата.
Задачи на атомистику (на соотношение атомов) + система уравнений + кислые/средние соли
6. Смесь оксида фосфора (V) и оксида калия, в которой соотношение числа атомов кислорода к числу атомов фосфора равно 14,5 : 4, сплавили, а затем образовавшуюся смесь растворили в воде. В результате получили 447,4г раствора, в котором массовая доля атомов водорода равна 7,6%. Определите массу фосфата калия в полученном растворе.
Решение: смотри видео
7. Смесь оксида натрия и оксида фосфора (V), в которой соотношение числа атомов фосфора к числу атомов натрия равно 7 : 18, нагрели и растворили в горячей воде. В результате получили 312,5 г раствора, в котором массовая доля атомов водорода равна 7,36%. Определите массу фосфата натрия в полученном растворе.
Смесь оксида натрия и оксида фосфора (V), в которой соотношение числа атомов фосфора к числу атомов натрия равно 7 : 18, нагрели и растворили в горячей воде. В результате получили 312,5 г раствора, в котором массовая доля атомов водорода равна 7,36%. Определите массу фосфата натрия в полученном растворе.
Решение:
(АНАЛОГИЧНАЯ ПРЕДЫДУЩЕЙ, поэтому к этой задаче прилагается только ответ. Если у вас не получается её решить, то смотрите предыдущее видео и решайте по анологии)
Задачи на разделение раствора на несколько колб (частей):
8. Смесь, состоящую из нитрата цинка, нитрата меди (II) и нитрата серебра, растворили в воде. При этом получили раствор, в котором массовая доля нитрата цинка составила 18,9%, а массовая доля нитрата меди (II) – 9,4%. В первую колбу налили 500 г этого раствора и внесли медную проволоку. После окончания реакции массовая доля нитрата меди (II) в колбе составила 25,5%. (Возможной реакцией избытка меди с нитратом меди (II) пренебречь. ) Во вторую колбу налили 200 г исходного раствора и добавили избыток порошка цинка. Вычислите массовую долю соли в конечном растворе во второй колбе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
) Во вторую колбу налили 200 г исходного раствора и добавили избыток порошка цинка. Вычислите массовую долю соли в конечном растворе во второй колбе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение: смотри видео
9. Раствор нитрата меди (II) массой 1760 г с массовой долей нитрата меди (II) 18,8%, содержащий в качестве примеси нитрат серебра (I) разлит на 2 колбы в соотношении 1:2. В первую колбу, содержащую меньшую часть раствора, опустили медную проволку. После завершения реакции проволку извлекли из раствора. При этом массовая доля нитрата меди(II) в первой колбе составила 20%. (Возможной реакцией избытка меди с нитратом меди (II) пренебречь.) В раствор во второй колбе внесли избыток порошок цинка, в результате получили бесцветный раствор. Вычислите массовую долю соли в конечном растворе во второй колбе.
При этом массовая доля нитрата меди(II) в первой колбе составила 20%. (Возможной реакцией избытка меди с нитратом меди (II) пренебречь.) В раствор во второй колбе внесли избыток порошок цинка, в результате получили бесцветный раствор. Вычислите массовую долю соли в конечном растворе во второй колбе.
Решение:
(АНАЛОГИЧНАЯ ПРЕДЫДУЩЕЙ, поэтому к этой задаче прилагается только ответ. Если у вас не получается её решить, то смотрите предыдущее видео и решайте по анологии)
10. Смесь бромида кальция и хлорида меди (II) растворили в воде, а образовавшийся раствор разделили на 3 колбы. В первую колбу, содержащую 200 г раствора, добавили 785 г 30% раствора нитрата серебра (I), в результате чего массовая доля нитрата серебра (I) уменьшилась вдвое. Во вторую колбу, содержащую 340 г исходного раствора солей, добавили избыток йодида калия, при этом в осадок выпала соль массой 64,94 г. Определите массовые доли солей в третьей колбе.
Решение: смотри видео
11. Смесь бромида калия и йодида калия растворили в воде. Образовавшийся раствор разделили на 3 колбы. В первую колбу с раствором массой 250 г прилили раствор массой 430 г 40%-ного нитрата серебра (I). После реакции массовая доля нитрата серебра (I) в растворе уменьшилась до 8,44%. Во вторую колбу с раствором массой 300 г прилили избыток раствора нитрата меди (II), в результате чего выпало 28,65 г осадка. Найдите массовые доли солей в третьей колбе колбе.
Решение:
(АНАЛОГИЧНАЯ ПРЕДЫДУЩЕЙ, поэтому к этой задаче прилагается только ответ. Если у вас не получается её решить, то смотрите предыдущее видео и решайте по анологии)
12. Смесь гидроксида и хлорида бария растворили в воде. Раствор разлили на три колбы. В первую колбу, масса раствора в которой равна 520 г, добавили избыток серной кислоты, при этом выпало 163,1 г осадка. К 130 г раствора во второй колбе добавили 166,5 г 20% раствора соляной кислоты, при этом массовая доля кислоты уменьшилась в 2 раза. Найдите массовые доли веществ в третьей колбе.
Раствор разлили на три колбы. В первую колбу, масса раствора в которой равна 520 г, добавили избыток серной кислоты, при этом выпало 163,1 г осадка. К 130 г раствора во второй колбе добавили 166,5 г 20% раствора соляной кислоты, при этом массовая доля кислоты уменьшилась в 2 раза. Найдите массовые доли веществ в третьей колбе.
Решение: смотри видео
13. Смесь хлоридов бария и алюминия растворили в воде. Полученный раствор разделили на 3 колбы. К 300 г раствора в первой колбе прилили 164 г 10% раствора фосфата натрия, в результате чего все исходные вещества прореагировали полностью. К 120 г раствора второй колбы добавили 155,61 г 20 % раствора сульфата натрия, при этом массовая доля сульфата натрия в конечном растворе оказалась в 2 раза меньше, чем в исходном. Определите массовые доли веществ в третьей колбе. Гидролизом солей пренебречь.
Определите массовые доли веществ в третьей колбе. Гидролизом солей пренебречь.
Решение: смотри видео
14. Хлорид алюминия и хлорид магния смешали и растворили в воде. Образовавшийся раствор разделили на 3 колбы. В первую колбу с раствором массой 300 г добавили 164 г 10%-ного раствора фосфата натрия. Причём соль прореагировала полностью. Во вторую колбу с раствором массой 120 г прилили 155,64 г 20%-ного раствора сульфата натрия. Причём массовая доля сульфата натрия в исходном растворе была в два раза больше, чем массовая доля в конечном растворе. Определите массовые доли солей в третьей колбе. Гидролизом пренебречь.
Решение:
(АНАЛОГИЧНАЯ ПРЕДЫДУЩЕЙ, поэтому к этой задаче прилагается только ответ. Если у вас не получается её решить, то смотрите предыдущее видео и решайте по анологии)
Если у вас не получается её решить, то смотрите предыдущее видео и решайте по анологии)
15. Смесь сульфата железа (II) и хлорида цинка растворили в воде. Полученный раствор разделили на 3 колбы. К 800 г раствора в первой колбе прилили избыток раствора нитрата бария, при этом выпал осадок массой 116,5 г. К 320 г раствора второй колбы добавили 462 г 40 %-ного раствора гидроксида натрия без доступа воздуха, при этом массовая доля щёлочи уменьшилась в два раза. Определите массовые доли веществ в третьей колбе. Гидролизом солей пренебречь.
Решение: смотри видео
16. Смесь нитрата алюминия и хлорида магния растворили в воде. Образовавшийся раствор разделили на 3 колбы. В первую колбу с раствором массой 750 г добавили раствор нитрата серебра (I), в результате чего выпал осадок массой 114,8 г. Во вторую колбу с раствором массой 300 г прилили 868,54 г 20%-ного раствора гидроксида натрия. Причём массовая доля щёлочи уменьшилась в 1,6 раз. Определите массовые доли солей в третьей колбе. Гидролизом пренебречь.
Образовавшийся раствор разделили на 3 колбы. В первую колбу с раствором массой 750 г добавили раствор нитрата серебра (I), в результате чего выпал осадок массой 114,8 г. Во вторую колбу с раствором массой 300 г прилили 868,54 г 20%-ного раствора гидроксида натрия. Причём массовая доля щёлочи уменьшилась в 1,6 раз. Определите массовые доли солей в третьей колбе. Гидролизом пренебречь.
Решение:
(АНАЛОГИЧНАЯ ПРЕДЫДУЩЕЙ, поэтому к этой задаче прилагается только ответ. Если у вас не получается её решить, то смотрите предыдущее видео и решайте по анологии)
Ответы:
Реальный ЕГЭ по химии 2021. Задание 34
1. 7,3%
2. 7,98%
3. 21,3 г
4.
5. 66,6 г
6. 42,4 г
7. 65,6 г
8. 46,8%
9.
10. 13,5% CuCl2 и 10% CaBr2
11.
12. 6,6% Ba(OH)2 и 20% BaCl2
13. 5,2% BaCl2 и 2,2% AlCl3
14.
15. 9,5% FeSO4 и 4,25% ZnCl2
16.
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk.com/id30891697 или на электронную почту [email protected]
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет (реальные, пробные и тренировочные задания) вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
Задачи на электролиз | CHEMEGE.RU
При электролизе расплавов или водных растворов солей протекают окислительно-восстановительные реакции на электродах (аноде и катоде). В статье рассмотрены расчетные задачи, в которых основной химической реакцией является электролиз — основные приемы и типы решения таких задач.
В статье рассмотрены расчетные задачи, в которых основной химической реакцией является электролиз — основные приемы и типы решения таких задач.
Какие именно процессы протекают при электролизе и как составлять уравнения химических реакций, протекающих при электролизе, вы можете узнать из статьи.
При решении задач на электролиз необходимо учитывать, что растворенное вещество может подвергнуться электролизу не полностью. Если вещество полностью разложилось под действием тока, далее может протекать электролиз воды по уравнению:
2H2O → O2 + 2H2
При действии тока на растворы некоторых веществ (например, соли активных металлов и кислородсодержащих кислот, щелочи, кислородсодержащие кислоты) количество этих веществ фактически не меняется, т.к. протекающие на катоде и аноде процессы приводят к электролизу воды.
Электролиза с растворимыми электродами в ЕГЭ по химии пока нет.
1. Провели электролиз водного раствора нитрата серебра с инертным анодом. Масса восстановленного на катоде серебра оказалась равной 2,16 г. Какой объём газа (н.у.) выделился на аноде? Вычислите массовую долю кислоты в полученном растворе, если масса раствора 250 г.
2. Провели полный электролиз 200 г раствора хлорида калия с ω(KCl) = 7,45%. К полученному раствору добавили 50 г раствора фосфорной кислоты с ω(H3PO4) = 19,6%. Определите формулу образовавшейся при этом соли.
3. В процессе электролиза 500 мл раствора гидроксида натрия с ω(NaОН) = 4,6% (ρ = 1,05 г/мл) массовая доля NaОН в растворе увеличилась до 10%. Вычислите объёмы газов (н.у.), выделившихся на электродах.
4. При электролизе (с инертным анодом) 235 г раствора нитрата меди (II) с ω(Cu(NO3)2) = 20% на катоде выделилось 9,6 г металла. Вычислите объём газа (н.у.), выделившегося на аноде, и массовые доли кислоты и соли в оставшемся растворе.
5.При электролизе раствора хлорида натрия на катоде выделилось 13,44 л водорода (н.у.). Хлор, выделившийся на аноде, поглотили горячим раствором гидроксида калия. Рассчитайте количества солей – хлорида калия и хлората калия, − образовавшихся в растворе в результате реакции.
6. В результате электролиза раствора хлорида натрия получили раствор, содержащий 20 г гидроксида натрия. Газ, выделившийся на аноде, полностью прореагировал с 500 мл раствора йодида калия. Рассчитайте объём газа (н.у.), выделившегося на аноде и массовую долю йодида калия в растворе.
7. При электролизе 200 г раствора хлорида натрия с массовой долей соли 17,55% из раствора выделилось 3,36 л хлора (н.у.). Определите массовые доли веществ в растворе после прекращения электролиза.
8. При проведении электролиза 500 г 16% раствора сульфата меди (II) процесс прекратили, когда на аноде выделилось 1,12 л газа. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Решение.
Во-первых, составляем уравнение реакции электролиза раствора сульфата меди. Как это делать, подробно описано в статье Электролиз.
2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
Находим массу чистого сульфата меди:
m(CuSO4) = mраствора*ω(CuSO4) = 500*0,16 = 80 г
Количество вещества сульфата меди:
n(CuSO4) = m/M = 80/160 = 0,5 моль
Видно, что на аноде должно выделиться 0,25 моль газа, или 5,6 л.
Однако, в условии сказано, что выделилось только 1,12 л газа. Следовательно, сульфат меди прореагировал не полностью, а только частично.
Находим количество и массу кислорода, который выделился на аноде:
n(O2) = V/Vm = 1,12/22,4 = 0,05 моль,
m(O2) = n*M = 0,05*32 = 1,6 г.
Следовательно, в электролиз вступило 0,1 моль сульфата меди.
В растворе осталось 0,4 моль сульфата меди. При этом образовалось 0,1 моль серной кислоты массой 9,8 г и 0,1 моль меди выпало в осадок (масса меди 6,4 г).
При этом масса полученного раствора после электролиза mр-ра2 равна:
mр-ра2= 500 – 1,6 – 6,4 = 492 г
Из полученного раствора отобрали порцию массой 98,4 г. При этом количество растворенных веществ поменялось. Зато не поменялась их массовая доля. Найдем массовую долю сульфата меди ω(CuSO4)2 и серной кислоты ω(H2SO4) в растворе, который остался после электролиза:
m(CuSO4)ост = n*M = 0,4*160 = 64 г
ω(CuSO4)2 = m(CuSO4)2/*mр-ра2 = 64/492 = 0,13 = 13%
ω(H2SO4) = m(H2SO4)/*mр-ра2 = 9,8/492 = 0,02 = 2%
Найдем массу и количество серной кислоты и массу сульфата меди в порции массой mр-ра3 = 98,4 г, которую мы отобрали:
m(CuSO4)3 = ω(CuSO4)2*mр-ра3 = 0,13*98,4 = 12,79 г
m(H2SO4)2 = ω(H2SO4)*mр-ра3 = 0,02*98,4 = 1,97 г
n(CuSO4) = m/M = 12,79/160 = 0,08 моль
n(H2SO4) = m/M = 1,97/98 = 0,02 моль
Чтобы осадить ионы меди, гидроксид натрия должен прореагировать и с серной кислотой в растворе, и с сульфатом меди:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
CuSO4 + 2NaOH = Cu(OH)2 + 2H2O
В первой реакции израсходуется 0,04 моль гидроксида натрия, во второй реакции 0,16 моль гидроксида натрия. Всего потребуется 0,2 моль гидроксида натрия. Или 8 г чистого NaOH, что соответствует 40 г 20%-ного раствора.
Всего потребуется 0,2 моль гидроксида натрия. Или 8 г чистого NaOH, что соответствует 40 г 20%-ного раствора.
Ответ: масса раствора 40 г.
Решение и ответ
Свернуть
Задача из досрочного ЕГЭ по химии-2020 на электролиз:
9. Через 640 г 15%-ного раствора сульфата меди(II) пропускали электрический ток до тех пор, пока на аноде не выделилось 11,2 л (н.у.) газа. К образовавшемуся раствору добавили 665,6 г 25%-ного раствора хлорида бария. Определите массовую долю хлорида бария в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения
искомых физических величин).
Уравнения реакций:
2CuSO4 + 2H2O = 2Cu↓ + 2H2SO4 + O2↑ (электролиз)
2H2O = 2H2↑ + O2↑ (электролиз)
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Количество вещества реагентов и масса продуктов реакций:
m(CuSO4) = 640 · 0,15 = 96 г n(CuSO4 ) = 96 / 160 = 0,6 моль
n(O2) = 11,2 / 22,4 = 0,5 моль
n(Cu) = n(CuSO4) = 0,6 моль
m(Cu) = 0,6 · 64 = 38,4 г
n(H2SO4) = n(CuSO4 ) = 0,6 моль
n(O2 [1]) = 0,5n(CuSO4) = 0,3 моль
n(O2 [2]) = 0,5 – 0,3 = 0,2 моль
n(H2O прореаг. ) = 2n(O2 [2]) = 0,4 моль
) = 2n(O2 [2]) = 0,4 моль
m(H2O прореаг.) = 0,4 · 18 = 7,2 г
m(O2 [1]) = 32 · 0,3 = 9,6 г
m(BaCl2) = 665,6 · 0,25 = 166,4 г
n(BaCl2) = 166,4 / 208 = 0,8 моль
n(BaCl2 прореаг.) = n(H2SO4) = 0,6 моль
n(BaCl2 осталось) = 0,8 – 0,6 = 0,2 моль
m(BaCl2 осталось) = 0,2 · 208 = 41,6 г
n(BaSO4) = n(BaCl2 прореаг.) = 0,6 моль
m(BaSO4) = 0,6 · 233 = 139,8 г
Массовая доля хлорида бария в растворе:
m(р-ра) = 640 + 665,6 – 38,4 – 7,2 – 139,8 – 9,6 = 1110,6 г
ω(BaCl2) = 41,6 / 1110,6 = 0,037, или 3,7 %
Ответ: ω(BaCl2) = 3,7 %
Решение и ответ
Свернуть
10. В результате электролиза раствора хлорида натрия получили раствор, содержащий 20 г гидроксида натрия. Газ, выделившийся на аноде, полностью прореагировал с 500 мл раствора иодида калия. Рассчитайте объём газа (н.у.) и молярную концентрацию использованного раствора иодида калия.
В результате электролиза раствора хлорида натрия получили раствор, содержащий 20 г гидроксида натрия. Газ, выделившийся на аноде, полностью прореагировал с 500 мл раствора иодида калия. Рассчитайте объём газа (н.у.) и молярную концентрацию использованного раствора иодида калия.
11. При электролизе 200 г раствора гидроксида натрия с ω(NaОН) = 4% на аноде выделилось 44,8 л (н.у.) кислорода. Какой объём водорода выделился на катоде, и какой стала массовая доля NaOH в растворе после электролиза?
12. При электролизе 200 г раствора хлорида натрия с массовой долей соли 17,55% из раствора выделилось 3,36 л хлора (н.у.). Определите массовые доли веществ в растворе после прекращения электролиза.
13. При электролизе (с инертным анодом) 235 г раствора нитрата меди(II) с ω(Cu(NO3)2) = 20% на катоде выделилось 9,6 г металла. Вычислите объём газа (н.у.), выделившегося на аноде, и массовые доли кислоты и соли в оставшемся
растворе.
14. При электролизе 900г 3%-ного раствора нитрата натрия на аноде выделилось 90л (н.у.) кислорода. Определите массовую долю нитрата натрия в растворе после окончания электролиза.
15. Какую массу свинца можно получить при электролизе 200г раствора нитрата свинца с массовой долей 10%?
16. Для нейтрализации кислоты, образовавшейся после электролиза нитрата серебра, потребовалось 145,5мл 10%-ного раствора гидроксида натрия с плотностью 1,1г/мл. Определите массу выделившегося на катоде серебра.
Ответ: 43,2г
17. После электролиза 500г водного раствора сульфата меди масса раствора уменьшилась на 8г. Оставшийся раствор нацело прореагировал с 8,96л (н.у.) сероводорода. Определите массовую долю сульфата серебра в исходном растворе и массовые доли веществ, оставшихся в растворе после электролиза.
18. После электролиза с инертными электродами 500г водного раствора сульфата меди с массовой долей 16% масса раствора уменьшилась на 16г. Определите массу меди, выделившейся на катоде и массовые доли веществ, оставшихся в растворе после электролиза.
Определите массу меди, выделившейся на катоде и массовые доли веществ, оставшихся в растворе после электролиза.
19. После электролиза 250 г раствора нитрата ртути (II) с массовой долей соли 19,5% масса раствора уменьшилась на 20,22%. Определите массы веществ, выделившихся на электродах, и молярную концентрацию веществ в конечном растворе, если его плотность составила 1,06 мл.
20. В результате электролиза 400мл 20%-ного раствора CuSO4 с плотностью 1,2г/мл на аноде выделилось 4,48л (н.у.) газа. Определите массы веществ, выделившихся на электродах и массовые доли веществ в конечном растворе.
21. После электролиза 200г 2%-ного водного раствора гидроксида натрия массовая доля гидроксида натрия увеличилась на 0,44%. Определите количества веществ, выделившихся на катоде и аноде.
22. При электролизе соли металла, проявляющего в своих соединениях степени окисления +2 и +3, на катоде было получено 2,6 г металла, а на аноде выделился 1,68 л (н. у.) газа с плотностью по водороду 35,5. Определите формулу соли, которая подверглась электролизу.
у.) газа с плотностью по водороду 35,5. Определите формулу соли, которая подверглась электролизу.
Ответ: CrCl3
23. 150 г раствора, содержащего 8% сульфата меди (II) и 11,7% хлорида натрия, подвергли электролизу. Электролиз прекратили, когда на катоде выделилось 1,12л (н.у.) водорода. Определите, какие вещества находятся в растворе после электролиза, а также их количество.
24. Раствор, содержащий по 0,2 моль нитрата меди (II), хлорида калия и сульфата рубидия, подвергли электролизу до полного выделения меди. Определите объёмы газов, выделившихся на электродах, и количества веществ в полученном растворе. Какова среда конечного раствора?
25. Раствор, содержащий 0,1моль нитрата ртути (II), 0,3 моль хлорида калия и 0,2моль сульфата натрия подвергли электролизу до полного выделения хлора. Определите объёмы газов, выделившихся на электродах и количества веществ в полученном растворе. Какова среда полученного раствора?
Другие задачи на электролиз:
26. Электролиз 282 г 40%-ного раствора нитрата меди (II) остановили после того, когда масса раствора уменьшилась на 32 г. К образовавшемуся раствору добавили 140 г 40%-ного раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
Электролиз 282 г 40%-ного раствора нитрата меди (II) остановили после того, когда масса раствора уменьшилась на 32 г. К образовавшемуся раствору добавили 140 г 40%-ного раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
27. При проведении электролиза 340 г 20%-ного раствора нитрата серебра (I) процесс прекратили, когда на аноде выделилось 1, 12 л газа. Из полученного раствора отобрали порцию массой 79,44 г. Вычислите массу 10%-ного раствора хлорида натрия, необходимого для полного осаждении ионов серебра из отобранной порции раствора.
28. При проведении электролиза 312 г 15%-ного раствора хлорида натрия процесс прекратили, когда на катоде выделилось 6,72 л газа. Из полученного раствора отобрали порцию массой 58,02 г. Вычислите массу 20%-ного раствора сульфата меди (II), необходимого для полного осаждения гидроксид-ионов из отобранной порции раствора.
29. Электролиз 640 г 15%-ного раствора сульфата меди (II) остановили после того, когда масса раствора уменьшилась на 32 г. К образовавшемуся раствору добавили 400 г 20%-ного раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
К образовавшемуся раствору добавили 400 г 20%-ного раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
30. При проведении электролиза 360 г 18,75% раствора хлорида меди (II) процесс прекратили, когда на аноде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 22,2 г. Вычислите массу 20 %-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
31. При проведении электролиза 624 г 10%-ного раствора хлорида бария процесс прекратили, когда на катоде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 91,41 г. Вычислите массу 10%-ного раствора карбоната натрия, необходимого для полного осаждения ионов бария из отобранной порции раствора.
32. При проведении электролиза 500 г 16%-ного раствора сульфата меди (II) процесс прекратили, когда на аноде выделилось 1,12 л газа. К образовавшемуся раствору прибавили 53 г 10%-ного раствора карбоната натрия. Определите массовую долю сульфата меди (II) в полученном растворе.
Определите массовую долю сульфата меди (II) в полученном растворе.
33. Через 200 г раствора поваренной соли, содержащего 17,55 мас. % NaСl, некоторое время пропускали постоянный ток. Выделилось 3,36 л хлора (н.у.). Определите концентрации веществ в мaс.% в полученном растворе.
34. При электролизе 188 г 50 мас. % раствора нитрата меди (II) на катоде выделилось 19,2 г металла. Найти объем газа (н.у.), выделившегося на аноде, и концентрации кислоты и соли в массовых процентах в электролизере.
35. После электролиза 250 г раствора нитрата ртути (II) с массовой долей соли 19,5 % масса раствора уменьшилась на 10,85 г. Определите количества веществ, выделившихся на электродах и массовые доли веществ в оставшемся растворе.
36. 50 г водного раствора сульфата меди подвергли электролизу, при этом на аноде выделилось 2,8 л газа (н.у.). Определите массовую долю сульфата меди в исходном растворе, если известно, что после электролиза масса раствора составила 42,4 г.
37. Определите состав раствора (в массовых долях), полученного в результате электролиза 100 г раствора сульфата меди, если известно, что во время электролиза на аноде выделилось 2,8 л газа (н.у.), а масса раствора после электролиза составила 92,4 г.
38. 117 г раствора хлорида натрия с массовой долей соли 5 % в течение некоторого времени подвергали электролизу. При этом на электродах выделилось 8,96 л газов (н.у.). Определите состав раствора после электролиза (в массовых долях).
39. Для проведения электролиза (на инертных электродах) взяли 500 г 16%-ного раствора сульфата меди(II). После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 53 г 10%-ного раствора карбоната натрия. Определите массовую долю сульфата меди(II) в полученном растворе.
40. Для проведения электролиза (на инертных электродах) взяли 500 г 16%-ного раствора сульфата меди(II). После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-ного раствора гидроксида натрия, который нужно добавить к отобранной порции раствора до полного осаждения ионов меди.
После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-ного раствора гидроксида натрия, который нужно добавить к отобранной порции раствора до полного осаждения ионов меди.
41. Для проведения электролиза (на инертных электродах) взяли 135 г 40%-ного раствора хлорида меди(II). После того как масса раствора уменьшилась на 27 г, процесс остановили. К образовавшемуся раствору добавили 160 г 30%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
42. Для проведения электролиза (на инертных электродах) взяли 390 г 15%-ного раствора хлорида натрия. После того как масса раствора уменьшилась на 21,9 г, процесс остановили. К образовавшемуся раствору добавили 160 г 20%-ного раствора сульфата меди(II). Определите массовую долю хлорида натрия в полученном растворе.
43. Для проведения электролиза (на инертных электродах) взяли 340 г 20%-ного раствора нитрата серебра. После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 79,44 г. Вычислите массу 10%-ного раствора хлорида натрия, необходимого для полного осаждения ионов серебра из отобранной порции раствора.
После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 79,44 г. Вычислите массу 10%-ного раствора хлорида натрия, необходимого для полного осаждения ионов серебра из отобранной порции раствора.
44. Для проведения электролиза (на инертных электродах) взяли 170 г 40%-ного раствора нитрата серебра. После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 175,5 г 10%-ного раствора хлорида натрия. Определите массовую долю хлорида натрия в полученном растворе.
45. Для проведения электролиза (на инертных электродах) взяли 282 г 40%-ного раствора нитрата меди(II). После того как масса раствора уменьшилась на 32 г, процесс остановили. К образовавшемуся раствору добавили 140 г 40%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
46. Для проведения электролиза (на инертных электродах) взяли 640 г 15%-ного раствора сульфата меди(II). После того как масса раствора уменьшилась на 32 г, процесс остановили. К образовавшемуся раствору добавили 400 г 20%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
Для проведения электролиза (на инертных электродах) взяли 640 г 15%-ного раствора сульфата меди(II). После того как масса раствора уменьшилась на 32 г, процесс остановили. К образовавшемуся раствору добавили 400 г 20%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
47. Для проведения электролиза (на инертных электродах) взяли 234 г 20%-ного раствора хлорида натрия. После того как на катоде выделилось 6,72 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 160 г 20%-ного раствора сульфата меди(II). Определите массовую долю щёлочи в полученном растворе.
48. Для проведения электролиза (на инертных электродах) взяли 470 г 20%-ного раствора нитрата меди(II). После того как масса раствора уменьшилась на 24 г, процесс остановили. К образовавшемуся раствору добавили 212 г 10%-ного раствора карбоната натрия. Определите массовую долю нитрата меди(II) в полученном растворе.
49. Для проведения электролиза (на инертных электродах) взяли 360 г 18,75%-ного раствора хлорида меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили и отобрали порцию полученного раствора массой 22,2 г. Вычислите массу 20%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
50. Для проведения электролиза (на инертных электродах) взяли 376 г 30%-ного раствора нитрата меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 224 г 25%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
51. Для проведения электролиза (на инертных электродах) взяли 624 г 10%-ного раствора хлорида бария. После того как на катоде выделилось 4,48 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 91,41 г. Вычислите массу 10%-ного раствора карбоната натрия, необходимого для полного осаждения ионов бария из отобранной порции раствора.
Вычислите массу 10%-ного раствора карбоната натрия, необходимого для полного осаждения ионов бария из отобранной порции раствора.
52. Для проведения электролиза (на инертных электродах) взяли 312 г 15%-ного раствора хлорида натрия. После того как на катоде выделилось 6,72 л (н.у.) газа, процесс остановили и отобрали порцию полученного раствора массой 58,02 г. Вычислите массу 20%-ного раствора сульфата меди(II), необходимого для полного осаждения гидроксид-ионов из отобранной порции раствора.
53. Для проведения электролиза (на инертных электродах) взяли 340 г 20%-ного раствора нитрата серебра. После того как масса раствора уменьшилась на 23,2 г, процесс остановили. К образовавшемуся раствору добавили 175,5 г 20%-ного раствора хлорида натрия. Определите массовую долю хлорида натрия в полученном растворе.
53. Для проведения электролиза (на инертных электродах) взяли 270 г 20%-ного раствора хлорида меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 120 г 20%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 120 г 20%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
54. Для проведения электролиза (на инертных электродах) взяли 360 г 15%-ного раствора хлорида меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 66,6 г. Вычислите массу 10%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
55. Для проведения электролиза (на инертных электродах) взяли 170 г 15%-ного раствора хлорида лития. После того как на аноде выделилось 2,24 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 410 г 16%-ного раствора фосфата натрия. Определите массовую долю фосфата натрия в полученном растворе.
56. Для проведения электролиза (на инертных электродах) взяли 624 г 10%-ного раствора хлорида бария. После того как на катоде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся раствору добавили 265 г 20%-ного раствора карбоната натрия. Определите массовую долю карбоната натрия в полученном растворе.
Для проведения электролиза (на инертных электродах) взяли 624 г 10%-ного раствора хлорида бария. После того как на катоде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся раствору добавили 265 г 20%-ного раствора карбоната натрия. Определите массовую долю карбоната натрия в полученном растворе.
57. Для проведения электролиза (на инертных электродах) взяли 240 г 40%-ного раствора сульфата меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 665,6 г 25%-ного раствора хлорида бария. Определите массовую долю хлорида бария в полученном растворе.
58. Для проведения электролиза (на инертных электродах) взяли 372,5 г 20%-ного раствора хлорида калия. После того как масса раствора уменьшилась на 29,2 г, процесс остановили. К образовавшемуся раствору добавили 152 г 20%-ного раствора сульфата железа(II). Определите массовую долю хлорида калия в полученном растворе.
59. Для проведения электролиза (на инертных электродах) взяли 80 г 20%-ного раствора сульфата меди(II). После того как на аноде выделилось 0,896 л (н.у.) газа, процесс остановили. К образовавшемуся раствору добавили 28 г порошка железа. Определите массовую долю сульфата железа(II) в полученном растворе.
60. Для проведения электролиза (на инертных электродах) взяли 340 г 40%-ного раствора нитрата серебра. После того как масса раствора уменьшилась на 46,4 г, процесс остановили. К образовавшемуся раствору добавили 207,5 г 40%-ного раствора иодида калия. Определите массовую долю иодида калия в полученном растворе.
61. Для проведения электролиза (на инертных электродах) взяли 180 г 37,5%-ного раствора хлорида меди(II). После того как на аноде выделилось 6,72 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 55,8 г. Вычислите массу 10%-ного раствора сульфида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
62. Для проведения электролиза (на инертных электродах) взяли 270 г 20%-ного раствора хлорида меди(II). После того как масса раствора уменьшилась на 40,5 г, процесс остановили. К образовавшемуся раствору добавили 70 г 40%-ного раствора гидроксида калия. Определите массовую долю щёлочи в полученном растворе.
63. Для проведения электролиза (на инертных электродах) взяли 640 г 20%-ного раствора сульфата меди(II). После того как на аноде выделилось 5,6 л (н.у.) газа, процесс остановили. К образовавшемуся раствору добавили 65 г порошка цинка. Определите массовую долю сульфата цинка в полученном растворе.
Понравилось это:
Нравится Загрузка…
404 Cтраница не найдена
Размер:
AAA
Изображения Вкл. Выкл.
Обычная версия сайта
К сожалению запрашиваемая страница не найдена.
Но вы можете воспользоваться поиском или картой сайта ниже
|
|
Вода | Бесплатный полнотекстовый | Характеристики удаления нитратов из водного раствора модифицированным металлургическим шлаком
1.
 Введение
Введение В настоящее время большие площади поверхностных и подземных вод подвержены риску загрязнения нитратами в различных странах и регионах. В основном это связано с непрерывным увеличением промышленных сточных вод, химических удобрений, бытовых сточных вод и отходов навоза, поверхностных осадков и других источников загрязнения воды [1]. Высокая концентрация нитратов в воде может повлиять на здоровье человека и создать экологические риски, которые могут вызвать рак человека, эвтрофикацию поверхностных вод и уничтожение биоразнообразия в регионе [2,3,4,5,6,7]. Среди многих методов удаления нитратов преимущества адсорбционных методов заключаются в простоте эксплуатации, низком потреблении энергии и коротком цикле очистки. Поэтому очень важно выбрать подходящий материал для адсорбции нитратов [8,9].]. Многие материалы, такие как активированный уголь, сепиолит, хитозан и ионообменная смола [8, 10, 11, 12], могут удалять нитраты из воды, но большинство из этих соединений имеют высокие производственные затраты, сложные процессы синтеза или их трудно регенерировать. Соответственно, они не подходят для обработки больших площадей воды, загрязненной нитратами.
Соответственно, они не подходят для обработки больших площадей воды, загрязненной нитратами.
В последние годы все большее внимание привлекает использование дешевых промышленных и сельскохозяйственных отходов в качестве адсорбента для очистки сточных вод [13]. Металлургический шлак представляет собой твердые отходы, образующиеся в металлургической промышленности. Он имеет рыхлую и пористую структуру, высокую плотность, быстро оседает в воде, короткий цикл разделения твердой и жидкой фаз, содержит щелочной оксид и большое количество железа и кремния. Эти особенности делают стальной шлак возможностью адсорбции загрязняющих веществ в сточных водах [14]. Многие исследования показали, что стальной шлак является недорогим адсорбентом сточных вод, который может эффективно удалять фосфаты, аммиак, вредные металлы и другие загрязняющие вещества в водном растворе путем химической реакции и адсорбции [15,16,17]. Однако нитраты почти полностью растворимы в воде по сравнению с ионами фосфатов, ионами аммония и фторид-ионами и т. д., и образование различных нерастворимых веществ, закрепленных на поверхности адсорбента, затруднено и их удаление затруднено [18]. ,19]. По сравнению с некоторыми промышленными синтетическими адсорбентами стальной шлак представляет собой тип сложной системы CaO-MgO-Al 2 O 3 -SiO 2 , поверхность которой соединяется с некоторыми второстепенными элементами в процессе кристаллизации или стеклования, что может влияют на его адсорбционную функцию [20], так что внутренний химический состав не может быть эффективно использован. Поэтому эффективность адсорбции стального шлака по нитратам относительно ограничена [7,21]. По сравнению с Fe 3+ , загруженным хитозаном (8,35 мг/г), нанооксидом алюминия (4 мг/г) и активированным углем (1,22 мг/г) [22, 23, 24], максимальная адсорбционная способность стального шлака по нитратам составляет 2,83 мг/г в водном растворе на основании предыдущих исследований [7]. Следовательно, необходимо улучшить эффективность удаления нитратов модифицированным способом.
д., и образование различных нерастворимых веществ, закрепленных на поверхности адсорбента, затруднено и их удаление затруднено [18]. ,19]. По сравнению с некоторыми промышленными синтетическими адсорбентами стальной шлак представляет собой тип сложной системы CaO-MgO-Al 2 O 3 -SiO 2 , поверхность которой соединяется с некоторыми второстепенными элементами в процессе кристаллизации или стеклования, что может влияют на его адсорбционную функцию [20], так что внутренний химический состав не может быть эффективно использован. Поэтому эффективность адсорбции стального шлака по нитратам относительно ограничена [7,21]. По сравнению с Fe 3+ , загруженным хитозаном (8,35 мг/г), нанооксидом алюминия (4 мг/г) и активированным углем (1,22 мг/г) [22, 23, 24], максимальная адсорбционная способность стального шлака по нитратам составляет 2,83 мг/г в водном растворе на основании предыдущих исследований [7]. Следовательно, необходимо улучшить эффективность удаления нитратов модифицированным способом.
Исследователи применяли различные методы активации для улучшения адсорбционной способности стального шлака по отношению к другим загрязнителям [25,26,27], что сделало стальной шлак недорогим адсорбентом сточных вод. Согласно предыдущим исследованиям, гидроксид алюминия (Al(OH) 3 ) успешно применялся в качестве модификатора адсорбентов при очистке сточных вод для повышения эффективности их адсорбции [19,20,26,28]. Дуан и др. [19] показали, что эффективность удаления азота и фосфора была значительно улучшена при использовании Al(OH) 3 для модификации сталелитейного шлака, а активированный оксид алюминия (Al 2 O 3 ), образующийся в процессе модификации, играл важную роль в удалении загрязняющих веществ. Активированный оксид алюминия (Al 2 O 3 ) имеет высокую удельную поверхность и амфотерные свойства, которые показывают хорошие результаты при удалении нитратов из воды [18,29,30]. Однако эффективность удаления нитратов из водного раствора с помощью МСС не изучалась.
Таким образом, это исследование предназначалось для модификации сталелитейного шлака для получения нового типа недорогого адсорбента для снижения загрязнения воды нитратами. В этом исследовании стальной шлак Al(OH) 3 и деионизированную воду смешивали в определенной пропорции и активировали при высокой температуре для повышения эффективности удаления нитратов из стального шлака в водном растворе. Было обнаружено, что этот способ модификации может улучшить эффективность удаления нитратов за счет увеличения пористости и свойств поверхности, количества активных веществ и положительного заряда на поверхности стального шлака в значительной степени. Кроме того, эксперименты по регенерации показали, что MSS после регенерации по-прежнему обладает способностью удалять нитраты.
2. Материалы и методы
2.1. Подготовка материалов
В этом исследовании стальной шлак (полученный от Iron & Steel Co., Ltd, Нанкин, Китай) измельчали, измельчали и просеивали, чтобы он прошел через сито 60 меш (0,25 мм). Образцы промывали деионизированной водой и сушили при 105 ± 0,5 °С в течение 4 ч, а затем охлаждали до комнатной температуры в эксикаторе. Этот стальной шлак был определен как исходный стальной шлак (OSS).
Образцы промывали деионизированной водой и сушили при 105 ± 0,5 °С в течение 4 ч, а затем охлаждали до комнатной температуры в эксикаторе. Этот стальной шлак был определен как исходный стальной шлак (OSS).
Процедуры приготовления адсорбента (МСС) были следующими: сухой шлак, деионизированная вода и гидроксид алюминия (Институт тонких химических исследований, Тяньцзинь, Китай) полностью смешивали при комнатной температуре в соответствии со следующими массовыми соотношениями для пяти групп. (3:2:0,15, 3:2:0,30, 3:2:0,45, 3:2:0,60, 3:2:0,75). После выдержки при комнатной температуре в течение 10 ч и сушки при температуре 105 ± 0,5 °С в течение 2 ч их нагревали при 600, 700, 800 и 900 °С в течение 2 ч соответственно и охлаждают до комнатной температуры. Затем 20 типов MSS (таблица 1) измельчали для прохождения через сито 60 меш и хранили в эксикаторе. Всего 2 г вышеуказанных 20 адсорбентов помещали в ряд конических колб объемом 250 мл, в каждую коническую колбу добавляли раствор нитрата калия (100 мл) с концентрацией нитрата 300 мг/л и затем встряхивали при 25°С. С в течение 180 мин.
С в течение 180 мин.
Все используемые химические вещества имеют аналитическую чистоту. Точное количество нитрата калия растворяли в деионизированной воде для приготовления основного раствора нитрата калия, а другие концентрации раствора готовили путем разбавления основного раствора. рН раствора регулировали 0,1 М раствором HCl и 0,1 М раствором NaOH. Все растворы в каждой группе были свежеприготовленными.
2.2. Характеристика, методы испытаний и оборудование
Основные химические компоненты образцов измеряли с помощью рентгенофлуоресцентного спектрометра (XRF-1800, Shimadzu, Japan). Рентгеновские дифрактограммы (XRD) образцов были получены с использованием рентгеновского дифрактометра Ultima IV (D8 ADVANCE, Bruker, Германия), работающего с источником излучения Cu-Kα, отфильтрованным графическим монохроматором (λ = 1,5406) для раскрыть информацию о кристаллографическом строении. Угол 2-Тета (2θ) варьировался в пределах 10–90° с размером шага 0,02° и скоростью сканирования 1°/мин. Морфологию поверхности образцов измеряли с помощью сканирующего электронного микроскопа (S-4800, HITACHI, Япония). Удельную поверхность образцов рассчитывали по изотермам сорбции N 2 при 196 °С по методу Брунауэра, Эммета и Теллера (БЭТ), а распределение пор образцов по размерам определяли по методу Беарретта-Джойнера-Халенда ( BJH) с помощью устройства ASAP 2020 (Micromeritics, Norcross, GA, USA). Дзета-потенциал MSS при различных условиях pH определяли с помощью дзета-потенциометра (Zetasizer Nano Z, Malvern Instruments, Малверн, Великобритания), а химические связи в шлаке анализировали с помощью инфракрасной спектроскопии с преобразованием Фурье (FTIR) (Thermo Scientific, Waltham , Массачусетс, США) с использованием сжатия KBr. Вредные металлические элементы, такие как Cu, Zn, Pb и Cd, в тесте на токсическое выщелачивание измеряли с помощью атомно-эмиссионной спектрометрии с индуктивно-связанной плазмой (ICP-AES) (OPTIMA 7000DV, Perkin Elmer, Aachen, NRW, German). Концентрацию нитрата определяли методом ультрафиолетовой спектрофотометрии, стандартным для китайской промышленности (HJ/T 346-2007) [31].
Морфологию поверхности образцов измеряли с помощью сканирующего электронного микроскопа (S-4800, HITACHI, Япония). Удельную поверхность образцов рассчитывали по изотермам сорбции N 2 при 196 °С по методу Брунауэра, Эммета и Теллера (БЭТ), а распределение пор образцов по размерам определяли по методу Беарретта-Джойнера-Халенда ( BJH) с помощью устройства ASAP 2020 (Micromeritics, Norcross, GA, USA). Дзета-потенциал MSS при различных условиях pH определяли с помощью дзета-потенциометра (Zetasizer Nano Z, Malvern Instruments, Малверн, Великобритания), а химические связи в шлаке анализировали с помощью инфракрасной спектроскопии с преобразованием Фурье (FTIR) (Thermo Scientific, Waltham , Массачусетс, США) с использованием сжатия KBr. Вредные металлические элементы, такие как Cu, Zn, Pb и Cd, в тесте на токсическое выщелачивание измеряли с помощью атомно-эмиссионной спектрометрии с индуктивно-связанной плазмой (ICP-AES) (OPTIMA 7000DV, Perkin Elmer, Aachen, NRW, German). Концентрацию нитрата определяли методом ультрафиолетовой спектрофотометрии, стандартным для китайской промышленности (HJ/T 346-2007) [31].
2.3. Испытание на выщелачивание на токсичность
Отчеты об исследованиях [32,33] показали, что стальной шлак может выделять вредные металлы, такие как Cu, Zn, Pb и Cd. Поэтому, чтобы проверить пригодность модифицированного сталеплавильного шлака в качестве адсорбента для очистки сточных вод, было проведено испытание на выщелачивание для исследования возможности выделения вредных металлических элементов в сталеплавильном шлаке до и после модификации. Токсическая концентрация выщелачивания в этом тесте была определена в соответствии с Национальным стандартом охраны окружающей среды Китайской Народной Республики — Метод горизонтального колебания для выщелачивания твердых отходов выщелачивания (HJ 557-2010) [34].
Сначала 100 г адсорбентов (OSS и MSS), высушенных при 105 °C, и 1 л деионизированной воды добавляли в экстракционную бутыль объемом 2 л, которую после закручивания крышки фиксировали в горячем вибросите вертикально. Затем частоту колебаний доводили до 110 об/мин и амплитуду 40 мм. После встряхивания при комнатной температуре в течение 8 часов экстракционную колбу брали и выдерживали 16 часов. Фильтры набивали на вакуум-фильтр, фильтрат собирали фильтрованием и измеряли концентрации меди, цинка, свинца, хрома, ванадия и мышьяка, выщелоченных из сталелитейного шлака до и после модифицирования. Каждая группа тестов делала три параллельных выборки, и регистрировалось среднее значение параллельных выборок.
После встряхивания при комнатной температуре в течение 8 часов экстракционную колбу брали и выдерживали 16 часов. Фильтры набивали на вакуум-фильтр, фильтрат собирали фильтрованием и измеряли концентрации меди, цинка, свинца, хрома, ванадия и мышьяка, выщелоченных из сталелитейного шлака до и после модифицирования. Каждая группа тестов делала три параллельных выборки, и регистрировалось среднее значение параллельных выборок.
2.4. Периодические эксперименты
В серию конических колб на 250 мл с пробкой помещали 100 мл раствора нитрата калия с начальным значением pH 4 и концентрацией нитрата 20 мг/л и 1,0 г MSS и встряхивали на шейкере с постоянной температурой (25 °С) при 180 об/мин. Супернатант собирали через 30, 60, 120, 180, 300 и 420 мин после встряхивания и центрифугировали в течение 10 мин, затем фильтровали через микропористую мембрану 0,45 мкм. Концентрацию нитрата в фильтрате измеряли УФ-спектрофотометром, а адсорбцию нитрата q t (мг/г), в разное время (t) рассчитывали по формуле Уравнение (1):
где C 0 и C t — концентрация нитрата в исходном состоянии и по истечении времени t (мг/л) соответственно, V — объем раствора (л), m — количество добавленного адсорбента (г ).
Влияние дозировки адсорбента на удаление нитратов тестировали при температуре 25 °C. Дозы адсорбента составляли 0,2, 0,4, 0,6, 0,8, 1,0 и 2,0 г/100 мл, исходная концентрация нитрата – 20 мг/л.
Исходный pH раствора (от 1,0 ± 0,1 до 10,0 ± 0,1) для удаления нитратов был испытан при температуре 25 °C, дозировке адсорбента 1 г/100 мл и начальной концентрации нитратов 20 мг/л. Влияние pH на дзета-потенциал частиц MSS исследовали путем добавления 1 г MSS к 100 мл деионизированной воды с отрегулированным значением pH.
Условия периодических равновесных экспериментов были следующими: диапазон концентраций нитратов 20–300 мг/л, дозировка адсорбента 1 г/100 мл, температура 25 °C и время колебаний 180 мин. Равновесная адсорбционная емкость, q e (мг/г), рассчитывали по следующей формуле Уравнение (2):
где C 0 и C e — исходная и равновесная концентрации нитратов (мг/л) соответственно. Каждый из вышеперечисленных экспериментов повторяли три раза, и данные выражали как среднее значение со значениями стандартного отклонения.
Каждый из вышеперечисленных экспериментов повторяли три раза, и данные выражали как среднее значение со значениями стандартного отклонения.
2.5. Регенерация
Метод регенерации МСС после адсорбции нитрата заключался в прокаливании в муфельной печи при 800 °С в течение 120 мин и охлаждении до комнатной температуры в связи с тем, что адсорбционная способность МСС по нитрату достигает насыщения через определенный период времени.
1,0 г регенерированного МСС и 100 мл раствора нитрата калия с начальным значением pH 4 и концентрацией нитрата 20 мг/л добавляли в конические колбы вместимостью 250 мл и встряхивали на шейкере с постоянной температурой (25 °C). при 180 об/мин. После фильтрации определяли концентрацию нитратов в фильтрате. Влияние регенерированного MSS на удаление нитратов и его изменение изучали путем пятикратного повторения вышеописанных стадий.
3. Результаты и обсуждение
3.1. Характеристики адсорбентов
После анализа конечного содержания нитратов в каждом фильтрате наибольшая эффективность адсорбции проявилась в МСС13, массовое соотношение сталеплавильного шлака, деионизированной воды и Al(OH) 3 составляло 3:2:0,45, а прокалка температура была 800°С. Поэтому в этом способе были использованы все следующие эксперименты для модификации сталелитейного шлака.
Поэтому в этом способе были использованы все следующие эксперименты для модификации сталелитейного шлака.
Значительные различия между OSS и MSS наблюдались с помощью сканирующей электронной микроскопии (рис. 1). Поверхность MSS оказалась округлой или неопределенной формы, что привело к большому количеству неправильных выступов и большему количеству пор. Высокотемпературный нагрев во время модификации может удалить молекулы воды и некоторые примеси из стального шлака, что приводит к открытию канала внутри и снаружи стального шлака, увеличению размера пор и образованию крупных пор. Эти морфологические изменения привели к большему увеличению удельной поверхности (в 3,34 раза выше, чем у ОСС) и объема суммарных пор, мезопор и микропор (табл. 2). Некоторые исследования пришли к выводу, что адсорбционная способность может быть повышена за счет увеличения удельной площади поверхности и центров адсорбции на поверхности частиц адсорбента [27, 28, 35].
OSS и MSS состояли в основном из CAO, FE 2 O 3 , SIO 2 , MGO, P 2 O 5 , MNO, AL 2 O 3 , TIO 2, MNO, AL 2 3 , TIO 2, MNO, AL 2 3 , TIO 2, MNO, AL 2 и т. д. (более 98 % по массе), а содержание Al 2 O 3 увеличилось с 1,66 % в OSS до 20,01 % в MSS (табл. 3). Путем сравнения данных энергодисперсионного спектрометра (ЭДС) OSS и MSS (рис. 2) было обнаружено, что содержание алюминия (вес.) на поверхности стального шлака также увеличилось после модификации. Аббас Н. и соавт. [18] показали, что активированный оксид алюминия хорошо влияет на удаление нитратов. Из-за амфотерных свойств Al 2 O 3 , его поверхность хороша для адсорбции не только нитрат-ионов, но и большинства окси-ионов. Кроме того, содержание углерода в МСС уменьшилось после модифицирования, что может быть связано с высокотемпературным разложением карбонатов с увеличением трещин и отверстий на поверхности стального шлака. Следовательно, увеличение содержания оксида алюминия и количества пор может улучшить количество активных центров адсорбентов [19, 26, 28, 30], что способствует удалению нитратов в водном растворе.
д. (более 98 % по массе), а содержание Al 2 O 3 увеличилось с 1,66 % в OSS до 20,01 % в MSS (табл. 3). Путем сравнения данных энергодисперсионного спектрометра (ЭДС) OSS и MSS (рис. 2) было обнаружено, что содержание алюминия (вес.) на поверхности стального шлака также увеличилось после модификации. Аббас Н. и соавт. [18] показали, что активированный оксид алюминия хорошо влияет на удаление нитратов. Из-за амфотерных свойств Al 2 O 3 , его поверхность хороша для адсорбции не только нитрат-ионов, но и большинства окси-ионов. Кроме того, содержание углерода в МСС уменьшилось после модифицирования, что может быть связано с высокотемпературным разложением карбонатов с увеличением трещин и отверстий на поверхности стального шлака. Следовательно, увеличение содержания оксида алюминия и количества пор может улучшить количество активных центров адсорбентов [19, 26, 28, 30], что способствует удалению нитратов в водном растворе.
При сравнении рентгенограмм OSS и MSS некоторые дифракционные пики были значительно уменьшены, а некоторые новые пики были получены (рис. 3). И OSS, и MSS содержали ферритную минеральную фазу (Ca 2 Fe 2 O 5 , JCPDS No.18-0286), оксид кальция и железа титана (Ca 4 Fe 2 Ti 2 O 11 , JCPDS № 40-0131) и титаномагнетит (Fe 2,75 Ti 0,25 O 4 , JCPDS № 75-1374). По сравнению с OSS новая минеральная фаза алюмината кальция (CaO·Al 2 O 3 , JCPDS № 34-0440) и оксид магния (MgO, JCPDS № 43-1022), а оксид железа (FeO, JCPDS № 01-1223) исчез на рентгенограмме MSS . Появление алюмината кальция может быть связано с высокотемпературной реакцией гидроксида кальция и гидроксида алюминия в процессе модификации, см. уравнение (3). Многочисленные исследователи показали, что активированный оксид алюминия (Al 2 O 3 ) имеет высокую удельную поверхность и амфотерные свойства, которые хорошо справляются с удалением нитратов из воды [18,29].,30]. Следовательно, увеличение количества активированного оксида алюминия на поверхности МСС способствует удалению нитратов.
3). И OSS, и MSS содержали ферритную минеральную фазу (Ca 2 Fe 2 O 5 , JCPDS No.18-0286), оксид кальция и железа титана (Ca 4 Fe 2 Ti 2 O 11 , JCPDS № 40-0131) и титаномагнетит (Fe 2,75 Ti 0,25 O 4 , JCPDS № 75-1374). По сравнению с OSS новая минеральная фаза алюмината кальция (CaO·Al 2 O 3 , JCPDS № 34-0440) и оксид магния (MgO, JCPDS № 43-1022), а оксид железа (FeO, JCPDS № 01-1223) исчез на рентгенограмме MSS . Появление алюмината кальция может быть связано с высокотемпературной реакцией гидроксида кальция и гидроксида алюминия в процессе модификации, см. уравнение (3). Многочисленные исследователи показали, что активированный оксид алюминия (Al 2 O 3 ) имеет высокую удельную поверхность и амфотерные свойства, которые хорошо справляются с удалением нитратов из воды [18,29].,30]. Следовательно, увеличение количества активированного оксида алюминия на поверхности МСС способствует удалению нитратов. Исчезновение оксида железа может быть связано с образованием двухкальциевого феррита или других фаз в высокотемпературных средах.
Исчезновение оксида железа может быть связано с образованием двухкальциевого феррита или других фаз в высокотемпературных средах.
3.2. Анализ токсичности
Концентрация токсичных элементов, выброшенных в раствор до и после модификации (таблица 4), была ниже предела обнаружения ИСП-АЭС и была намного ниже значений класса III нормативов качества окружающей среды для поверхностных вод ( ГБ 3838-2002) [36]. Этот результат согласуется с исследованием Chamteut Oh характеристик выщелачивания элементов стального шлака в рамках Корейского стандартного эксперимента по выщелачиванию (KSLT) [37]. Видно, что эти элементы стального шлака имеют очень малую вероятность выщелачивания, а кратковременное использование в качестве адсорбента сточных вод не приводит к токсичному загрязнению.
3.3. Адсорбционные характеристики MSS
3.3.1. Влияние дозировки адсорбента
При увеличении дозировки адсорбента с 0,2 г/100 мл до 1 г/100 мл эффективность удаления нитратов увеличилась с 12,78% до 35,27% (рис. 4). Увеличение дозировки адсорбента может обеспечить большую удельную поверхность и больше мест адсорбции для удаления нитратов. Однако при увеличении дозы адсорбента с 1 г/100 мл до 2 г/100 мл эффективность удаления нитратов несколько снижалась и становилась стабильной. Это может быть связано с агрегацией частиц адсорбента при увеличении дозы адсорбента, что приводит к неполному использованию участков поверхностной адсорбции [38].
4). Увеличение дозировки адсорбента может обеспечить большую удельную поверхность и больше мест адсорбции для удаления нитратов. Однако при увеличении дозы адсорбента с 1 г/100 мл до 2 г/100 мл эффективность удаления нитратов несколько снижалась и становилась стабильной. Это может быть связано с агрегацией частиц адсорбента при увеличении дозы адсорбента, что приводит к неполному использованию участков поверхностной адсорбции [38].
3.3.2. Влияние pH
pH раствора является одним из важных параметров, влияющих на адсорбционные характеристики адсорбента. При увеличении рН от одного до четырех эффективность адсорбции МСС увеличивалась, тогда как она снижалась с четырех до 10 (рис. 5), а самая высокая эффективность удаления нитратов (35,45%) наблюдалась при рН четыре. После измерения дзета-потенциала частиц МСС было обнаружено, что поверхностный заряд модифицированного сталеплавильного шлака уменьшился с +18,19до -5,45, когда pH раствора был от нуля до 10, где pHpc (изоэлектрическая точка) составляла 7,8.
рН раствора определял протонированный переменный заряд поверхности МСС [20,27], что сказывалось на электрических свойствах адсорбента и, таким образом, оказывало большое влияние на адсорбцию нитратов. В кислой среде поверхность гидратации МСС подвергалась реакции протонирования, см. уравнение (4), и растворенный катион металла внедрялся в поверхность МСС для получения положительного заряда [26,39].]. С увеличением начального рН концентрация ОН — в растворе увеличивалась, и на гидратированной поверхности МСС происходила реакция депротонирования с получением отрицательного заряда, см. уравнение (5). При рН менее 7,8 нитрат в присутствии анионов может адсорбироваться за счет электростатического притяжения благодаря положительно заряженной поверхности. Следовательно, снижение рН благоприятно для адсорбции нитратов. Однако при рН менее четырех активные центры на поверхности МСС диссоциировали в сильнокислой среде [27], а соляная кислота, добавляемая для начальной корректировки рН, содержала мешающие ионы хлор-ионов, которые ингибировали адсорбция нитратов [29,40]. Адсорбционная способность не может достигать максимума при очень низком рН. Концентрация гидроксильных ионов в растворе увеличивалась, когда рН составлял от четырех до 7,8, что приводило к реакции депротонирования (5) и уменьшению числа участков с положительным зарядом на поверхности и эффективности удаления нитратов. Поэтому было обнаружено, что наилучшая эффективность удаления нитратов наблюдается при рН 4. При рН 7,8 поверхностный потенциал МСС был нейтральным, а поверхностные гидроксильные группы высокой плотности образовывали прочные водородные связи между гидроксильными группами на поверхности. поверхности [41], препятствовавшей адсорбции нитрата. Когда рН был выше 7,8, адсорбционная способность нитратов снижалась из-за отрицательно заряженной поверхности МСС, что могло вызывать электростатическое отталкивание.
Адсорбционная способность не может достигать максимума при очень низком рН. Концентрация гидроксильных ионов в растворе увеличивалась, когда рН составлял от четырех до 7,8, что приводило к реакции депротонирования (5) и уменьшению числа участков с положительным зарядом на поверхности и эффективности удаления нитратов. Поэтому было обнаружено, что наилучшая эффективность удаления нитратов наблюдается при рН 4. При рН 7,8 поверхностный потенциал МСС был нейтральным, а поверхностные гидроксильные группы высокой плотности образовывали прочные водородные связи между гидроксильными группами на поверхности. поверхности [41], препятствовавшей адсорбции нитрата. Когда рН был выше 7,8, адсорбционная способность нитратов снижалась из-за отрицательно заряженной поверхности МСС, что могло вызывать электростатическое отталкивание.
где Sur и Sur-OH представляют собой поверхность шлака и поверхность гидроксильной группы соответственно.
3.
 4. Механизмы удаления нитратов
4. Механизмы удаления нитратов3.4.1. Адсорбционная кинетическая модель
Было очевидно, что эффективность удаления нитратов двумя адсорбентами увеличивалась со временем и достигала максимума через 180 мин. Эффективность удаления нитратов у МСС была в 1,9 раза выше, чем у ОСС (рис. 6).
Кинетическая модель может использоваться для оценки эффективности адсорбции и получения соответствующего выражения скорости для возможного механизма реакции. В соответствии с временным градиентом данные кинетики адсорбции для OSS и MSS через 180 минут (рис. 6) были проанализированы с помощью двух типичных кинетических моделей, включая модель кинетики псевдопервого порядка Лагергрена, см. уравнение (6) [42], и кинетическая модель псевдовторого порядка, см. уравнение (7) [43]. Модель кинетики псевдопервого порядка, основанная на количестве твердой адсорбции, была применена к адсорбции в жидкой фазе, а кинетическая модель псевдовторого порядка была основана на предположении, что скорость адсорбции контролируется механизмом химической адсорбции. . Уравнения двух кинетических моделей были следующими:
. Уравнения двух кинетических моделей были следующими:
где q e (мг/г) – равновесная адсорбционная емкость, q t – адсорбционная емкость в момент времени t, K 1 (h −1 ) и K 2 (г·мг −1 ·h −1 ) — константы скорости псевдопервого и псевдовторого порядка соответственно.
Для получения параметров скорости к псевдопервому и псевдовторостепенному модели кинетики порядка (рис. 7). Кинетические параметры адсорбции нитрата (таблица 5) были рассчитаны с использованием этих аппроксимирующих графиков. Видно, что кинетическая модель псевдовторого порядка больше подходила для моделирования реального процесса адсорбции нитрата, так как модель имела высокий коэффициент корреляции (R 2 ), а теоретическое q e,cal МСС было ближе к экспериментальному q e,exp . Это открытие указывает на то, что процесс химической адсорбции является ограничивающим фактором для адсорбции нитратов. Химическая адсорбция связана с обменом электронами или переносом электронов между адсорбентом и адсорбатом [44], а адсорбционная способность пропорциональна количеству активных центров на поверхности частиц адсорбента [38]. Поэтому, исходя из высокого коэффициента корреляции и теоретического q e,cal процесс адсорбции МСС больше соответствовал вторичной модели.
Химическая адсорбция связана с обменом электронами или переносом электронов между адсорбентом и адсорбатом [44], а адсорбционная способность пропорциональна количеству активных центров на поверхности частиц адсорбента [38]. Поэтому, исходя из высокого коэффициента корреляции и теоретического q e,cal процесс адсорбции МСС больше соответствовал вторичной модели.
3.4.2. Модель изотермической адсорбции
При начальной концентрации от 20 до 300 мг/л количество адсорбированного нитрата не достигало максимума, а эффективность адсорбции была ниже в диапазоне высоких концентраций (рис. 8). Это указывало на то, что MSS может адсорбировать нитраты в более широком диапазоне концентраций, что было похоже на результаты Yang et al. [7]. Экспериментальные данные анализировались с помощью изотермных моделей уравнения Ленгмюра (8) [45] и уравнения Фрейндлиха (9) [46], которые выражались следующим образом:
где q e и q m – равновесная и максимальная адсорбционная емкость соответственно; c e – равновесная концентрация раствора; K L – константа равновесия, связанная с теплотой адсорбции; K F и n – константы равновесия, связанные с адсорбционной емкостью и интенсивностью соответственно.
Сравнивая коэффициенты корреляции двух моделей, модель Фрейндлиха (R 2 > 0,98) больше подходит для экспериментальных данных настоящей работы (табл. 6, рис. 9). Обычно считается, что адсорбция более вероятна, когда 1/n находится между 0,1 и 1,0, тогда как адсорбция затруднена, когда 1/n больше двух [47, 48]. В этом эксперименте МСС был благоприятен для адсорбции нитрата (1/n = 0,7894). Модель Фрейндлиха предполагает, что адсорбция происходит на неровных поверхностях адсорбента путем монослойной адсорбции с взаимодействием между адсорбированными ионами. Таким образом, можно видеть, что адсорбция нитрата МСС представляет собой химическую адсорбцию мономолекулярного слоя с помощью кинетической модели адсорбции и модели Фрейндлиха.
3.4.3. Механизм удаления
По сравнению с OSS, адсорбционная способность MSS увеличилась и была в 1,9 раза выше, чем у OSS. Когда начальная концентрация нитрата составляла 300 мг/л, адсорбционная способность MSS составляла 6,165 мг/г, что достигало более высокого уровня по сравнению с другими адсорбирующими материалами, такими как галлуазит, нанооксид алюминия, активированный уголь и т. д. (таблица 7). [22,23,24,49,50]. Таким образом, дешевый стальной шлак после модифицирования может быть использован в качестве адсорбента воды, загрязненной нитратами.
д. (таблица 7). [22,23,24,49,50]. Таким образом, дешевый стальной шлак после модифицирования может быть использован в качестве адсорбента воды, загрязненной нитратами.
Морфология поверхности МСС после адсорбции проявлялась серией складок различной ширины и глубины, хлопьевидных структур и уменьшением поверхностных пустот (рис. 1). Инфракрасные спектры МСС до и после адсорбции нитрата (рис. 10) показывают, что широкий пик поглощения вблизи 3459,7 см -1 принадлежит валентному колебанию водородных связей на гидроксильных группах, а интенсивность его поглощения определяет форму пика поглощения. Межмолекулярная ассоциация гидроксильных групп приводит к более широкому пику перед адсорбцией. После адсорбции интенсивность пика увеличивается, а форма становится более резкой на пике 3459..7 см -1 , что может быть связано с образованием свободных гидроксильных групп без ассоциации. Деформационное колебание H-O-H происходило при 1648,8 см -1 , а интенсивность пика увеличивалась после адсорбции, что указывает на увеличение содержания воды в порах МСС. Сильный пик поглощения при 1383,2 см -1 принадлежал валентным колебаниям N-O, что указывает на присутствие нитрата на МСС после экспериментов по адсорбции.
Сильный пик поглощения при 1383,2 см -1 принадлежал валентным колебаниям N-O, что указывает на присутствие нитрата на МСС после экспериментов по адсорбции.
Согласно приведенной выше модели и соответствующему анализу характеристик, химическая адсорбция играет важную роль в удалении нитратов из модифицированного сталелитейного шлака. Согласно теории поверхностного комплексообразования, ионы алюминия на поверхности активированного оксида алюминия образуют комплексы с молекулами воды с образованием групп Al-OH [19].,29]. Кроме того, ионы металлов, таких как кальций, железо и их оксиды металлов, гидратируются на поверхности MSS с образованием гидроксидов и гидратированных оксидов металлов, так что на границе раздела MSS присутствует большое количество гидроксильных групп во взаимно ассоциативной или раздельной форме. адсорбента, что было подтверждено в инфракрасном спектре (рис. 10). Таким образом, нитрат может быть адсорбирован путем ионного обмена (уравнение (10), рис. 11I) [22, 29, 51, 52] или за счет водородной связи (уравнение (11), рис. 11II) [38] с гидроксильной группой.
11I) [22, 29, 51, 52] или за счет водородной связи (уравнение (11), рис. 11II) [38] с гидроксильной группой.
где М представляет собой Al, Fe и Ca.
Когда pH раствора был меньше 7,8, поверхность MSS была заряжена положительно (рис. 5), что в основном было результатом протонирования [20, 27] или растворенных катионов металлов, внедренных на ее поверхность, см. уравнение ( 4) [26,39]. Этот процесс способствует адсорбции электростатического притяжения между адсорбентом и нитратом, см. (уравнение (12), рис. 11III). Крупномасштабная вода, загрязненная нитратами, обычно имеет нейтральную или кислую реакцию [53], поэтому MSS может повысить эффективность удаления нитратов за счет электростатической адсорбции.
Кроме того, связи Si-O-Si и связи Al-O-Al на поверхности MSS могут генерировать адсорбцию диполярно-дипольной связи (силы Ван-дер-Ваальса) с нитратами (рис. 11IV), и на эту адсорбцию влияет пористость и площадь поверхности стального шлака. Процесс модификации может улучшить физическую и химическую структуру стального шлака, что способствует усилению удаления нитратов (таблица 2, рисунок 1), что приводит к увеличению адсорбции, эффективному использованию внутреннего химического состава и улучшению поверхностной энергии.
Процесс модификации может улучшить физическую и химическую структуру стального шлака, что способствует усилению удаления нитратов (таблица 2, рисунок 1), что приводит к увеличению адсорбции, эффективному использованию внутреннего химического состава и улучшению поверхностной энергии.
3.5. Регенерация
Адсорбированный МСС обжигали в муфельной печи при 800 °С в течение 120 мин и охлаждали для продолжения эксперимента по адсорбции нитратов. Результаты (рисунок 12) показали, что адсорбционная эффективность МСС снизилась с 35,87% до 18,62% после повторного использования и пятикратной регенерации. При повторном использовании эффективность адсорбции снижалась меньше и стабилизировалась примерно на уровне 20% в более поздний период. Эффективность адсорбции снизилась в меньшей степени, а затем стабилизировалась примерно на уровне 20%, что указывает на то, что после повторной регенерации МСС все еще обладает способностью удалять нитраты.
4.
 Выводы
Выводы- (1)
Эксперименты по безопасности и высвобождению ионов показали, что MSS как адсорбент сточных вод не производит токсического загрязнения, обеспечивая определенную степень безопасности.
- (2)
Площадь поверхности MSS и его способность адсорбировать нитраты были значительно увеличены до 3,34 раза и 1,9 раза выше, чем у OSS, соответственно. При начальной концентрации нитрата 300 мг/л адсорбционная емкость МСС составила 6,165 мг/г, достигнув относительно более высокого уровня.
- (3)
Адсорбция нитратов соответствовала кинетической модели псевдовторого порядка и изотермической модели Фрейндлиха, которая в основном объяснялась монослойной химической адсорбцией. Кроме того, увеличение удельной поверхности, образование активных веществ и изменение поверхностных электрических свойств позволяют эффективно улучшить способность МСС удалять нитраты.
- (4)
MSS все еще имел некоторую способность удалять нитраты после нескольких повторных использований, и эффективность удаления была стабильной на уровне 20% после вторых экспериментов по регенерации.
 Некоторые другие методы, такие как объединение сталелитейного шлака с сельскохозяйственными отходами или катионными поверхностно-активными веществами для модификации, могут быть использованы в модифицированных экспериментах для улучшения адсорбционной способности сталелитейного шлака. Кроме того, MSS для очистки реальных сточных вод необходимо дополнительно изучить в последующих экспериментах.
Некоторые другие методы, такие как объединение сталелитейного шлака с сельскохозяйственными отходами или катионными поверхностно-активными веществами для модификации, могут быть использованы в модифицированных экспериментах для улучшения адсорбционной способности сталелитейного шлака. Кроме того, MSS для очистки реальных сточных вод необходимо дополнительно изучить в последующих экспериментах.
Благодарности
Финансовая поддержка этого исследования была предоставлена Десятилетним оценочным проектом Министерства охраны окружающей среды Китайской Народной Республики (STSN-06).
Вклад авторов
Л.Ю. и мой. задумал и спроектировал эксперименты; МОЙ. и П.Х. провел эксперименты; Х.З. проанализировали данные; Х.Б. и HL предоставили реагенты/материалы/инструменты для анализа; Л.Ю. и мой. написал бумагу.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Ссылки
- Джин З.
 ; Пан, З .; Джин, М .; Ли, Ф .; Ван, Ю.; Гу Б. Определение источников загрязнения нитратами с использованием изотопных и химических индикаторов в сельскохозяйственном регионе Китая. Агр. Экосистем. Окружающая среда. 2012 , 155, 78–86. [Google Scholar] [CrossRef]
; Пан, З .; Джин, М .; Ли, Ф .; Ван, Ю.; Гу Б. Определение источников загрязнения нитратами с использованием изотопных и химических индикаторов в сельскохозяйственном регионе Китая. Агр. Экосистем. Окружающая среда. 2012 , 155, 78–86. [Google Scholar] [CrossRef] - Feleke, S. Биоэлектрохимический реактор в сочетании с адсорбером для удаления нитратов и ингибирующих пестицидов. Вода Res. 2002 , 36, 3092–3102. [Google Scholar] [CrossRef]
- Хайхамад, Л.; Алмасри, М.Н. Оценка нитратного загрязнения подземных вод с использованием моделей с сосредоточенными параметрами. Окружающая среда. Модель. ПО 2009 , 24, 1073–1087. [Google Scholar] [CrossRef]
- Керянен, А.; Лейвиска, Т .; Хорми, О .; Тансканен, Дж. Удаление нитратов модифицированными сосновыми опилками: влияние температуры и сосуществующих анионов. Дж. Окружающая среда. Управление 2015 , 147, 46–54. [Академия Google] [CrossRef] [PubMed] «> Сандор, Дж.; Поцелуй, И.; Фаркас, О .; Эмбер, И. Связь между смертностью от рака желудка и содержанием нитратов в питьевой воде: Экологическое исследование неравенства на малых территориях. Евро. Дж. Эпидемиол. 2001 , 17, 443–447. [Google Scholar] [CrossRef] [PubMed]
- Wiesmann, U.; Чой, И.С.; Домбровский Е.М. Основы биологической очистки сточных вод. Дж. Египет. Мед. доц. 2007 , 46, 1031–1040. [Google Scholar]
- Ян Л.; Сюй, П.; Ян, М .; Бай, Х. Характеристики стального шлака и влияние его применения в качестве добавки к почве на удаление нитратов из водного раствора. Окружающая среда. науч. Загрязн. Р. 2017 , 24, 4882–4893. [Google Scholar]
- Озтюрк, Н.; Бекташ, Т.Э. Удаление нитратов из водного раствора путем адсорбции на различных материалах. Дж. Азар. Матер. 2004 , 112, 155. [Google Scholar] [CrossRef] [PubMed]
- Samatya, S.; Кабай, Н .; Юксель, Ю .
 ; Арда, М.; Юксель, М. Удаление нитратов из водного раствора нитратселективными ионообменными смолами. Реагировать. Функц. Полим. 2006 , 66, 1206–1214. [Google Scholar] [CrossRef]
; Арда, М.; Юксель, М. Удаление нитратов из водного раствора нитратселективными ионообменными смолами. Реагировать. Функц. Полим. 2006 , 66, 1206–1214. [Google Scholar] [CrossRef] - Hu, Q.; Чен, Н .; Фэн, К.; Ху, В .; Лю, Х. Кинетические и изотермические исследования адсорбции нитратов на гранулированном комплексе Fe-Zr-хитозан и электрохимическое восстановление нитратов из отработанного регенерирующего раствора. RSC Adv. 2016 , 6, 61944–61954. [Google Scholar] [CrossRef]
- Нур Т.; Шим, WG; Логанатан, П.; Виньесваран, С .; Кандасами, Дж. Удаление нитратов с помощью ионообменной смолы Purolite A520E: моделирование адсорбции в периодическом режиме и на колонке с неподвижным слоем. Междунар. Дж. Окружающая среда. науч. Технол. 2015 , 12, 1311–1320. [Google Scholar] [CrossRef]
- Чжан Ю.; Песня, XL; Хуанг, С.Т.; Гэн, BY; Чанг, CH; Сунг И. Адсорбция нитрат-ионов на активированном угле, полученном из рисовой шелухи путем активации NaOH.
 Десалин. Водное лечение. 2014 , 52, 4935–4941. [Google Scholar] [CrossRef]
Десалин. Водное лечение. 2014 , 52, 4935–4941. [Google Scholar] [CrossRef] - Pollard, SJT; Фаулер, Г.Д.; Соларс, CJ; Перри, Р. Недорогие адсорбенты для очистки отходов и сточных вод: обзор. науч. Общая окружающая среда. 1992 , 116, 31–52. [Google Scholar] [CrossRef]
- Fan, S.S. Комплексное применение шлака при очистке сточных вод. Дж. Аньхой Агрик. науч. 2010 , 38, 18282–18283. [Google Scholar]
- Барка, К.; Жеренте, К.; Мейер, Д.; Чазаренц, Ф.; Андрес, Ю. Удаление фосфатов из синтетических и реальных сточных вод с использованием стальных шлаков, произведенных в Европе. Вода Res. 2012 , 46, 2376–2384. [Google Scholar] [CrossRef] [PubMed]
- Claveau-Mallet, D.; Уоллес, С.; Комо, Ю. Удаление фосфора, фторидов и металлов из фильтрата гипсовой добычи с использованием стальных шлаковых фильтров. Вода Res. 2013 , 47, 1512–1520. [Google Scholar] [CrossRef] [PubMed] «> Джа, В.К.; Камешима, Ю.; Накадзима, А .; Окада, К. Поведение опасных ионов в термически активированном сталеплавильном шлаке. Дж. Азар. Матер. 2004 , 114, 139–144. [Академия Google] [CrossRef] [PubMed]
- Аббас, Н.; Диба, Ф .; Ирфан, М .; Хан, Р.А. Исследование пригодности мышьяка, фторидов и нитратов из питьевой воды методом адсорбции. Дж. Хим. соц. пак. 2014 , 37. [Google Scholar]
- Duan, J.; Фанг, Х .; Лин, Дж.; Лин, Дж.; Хуанг, З. Одновременное удаление NH 4 + и PO 4 3− при низких концентрациях из водного раствора модифицированным конвертерным шлаком. Водная среда. Рез. 2013 , 85, 530–538. [Академия Google] [CrossRef] [PubMed]
- Дуань, Дж.; Su, B. Характеристики удаления Cd(II) из кислого водного раствора модифицированным сталеплавильным шлаком. хим. англ. J. 2014 , 246, 160–167. [Google Scholar] [CrossRef] «> Хао, В. Дж. Исследования эффективности удаления азота и фосфора из эвтрофной морской воды с помощью системы «затвердевший шлак-бетон-макроводоросли». Магистерская диссертация, Океанический университет Китая, Циндао, Китай, май 2014 г. [Google Scholar]
- Бхатнагар, А.; Кумар, Э .; Силланпаа, М. Удаление нитратов из воды с помощью нанооксида алюминия: исследование характеристик и сорбции. хим. англ. Дж. 2010 , 163, 317–323. [Google Scholar] [CrossRef]
- Hu, Q.; Чен, Н .; Фэн, К.; Ху, В.В. Адсорбция нитратов из водного раствора гранулированным комплексом хитозан-Fe 3+ . заявл. Серф. науч. 2015 , 347, 1–9. [Google Scholar] [CrossRef]
- Mishra, PC; Патель, Р.К. Использование сельскохозяйственных отходов для удаления нитратного азота из водной среды. Дж. Окружающая среда. Управление 2009 , 90, 519–522. [Google Scholar] [CrossRef] [PubMed]
- Teutli-Sequeira, A.
 ; Солаче-Риос, М.; Бальдерас-Эрнандес, П. Влияние модификации гематита гидроксидом алюминия на удаление ионов фтора из воды. Вода Воздух Почва Загрязнение. 2012 , 223, 319–327. [Google Scholar] [CrossRef]
; Солаче-Риос, М.; Бальдерас-Эрнандес, П. Влияние модификации гематита гидроксидом алюминия на удаление ионов фтора из воды. Вода Воздух Почва Загрязнение. 2012 , 223, 319–327. [Google Scholar] [CrossRef] - Ву, К.Д.; Чжан, JY; Ван, Л.; Он, М.Х. Удаление анилина и фенола из воды с использованием необработанного и модифицированного гидроксидом алюминия диатомита. Науки о воде. Технол. Дж. Междунар. доц. Загрязнение воды. Рез. 2013 , 67, 1620–1626. [Google Scholar] [CrossRef] [PubMed]
- Xue, Y.; Ву, С .; Чжоу, М. Характеристика адсорбции Cu(II) из водного раствора на шлаке основной кислородной печи. хим. англ. J. 2013 , 231, 355–364. [Академия Google] [CrossRef]
- Джа, В.К.; Камешима, Ю.; Накадзима, А .; Окада, К. Использование сталеплавильного шлака для поглощения ионов аммония и фосфата из водного раствора. Дж. Азар. Матер. 2008 , 156, 156–162. [Google Scholar] [CrossRef] [PubMed] «> Каспшик-Хордерн, Б. Химия оксида алюминия, реакции в водном растворе и его применение при очистке воды. Доп. Коллоидный интерфейс Sci. 2004 , 110, 19–48. [Google Scholar] [CrossRef] [PubMed]
- Марзук И.; Ханначи, К.; Даммак, Л.; Хамруни, Б. Удаление хрома путем адсорбции на активированном оксиде алюминия. Десалин. Водное лечение. 2011 , 26, 279–286. [Google Scholar] [CrossRef]
- Национальное агентство по охране окружающей среды. Качество воды – определение нитратного азота – ультрафиолетовая спектрофотометрия; ХДЖ/Т 346-2007; Национальное агентство по охране окружающей среды: Пекин, Китай, 2007 г. (на китайском языке)
- Манн, Р.А.; Бавор, Х. Дж. Удаление фосфора из искусственных водно-болотных угодий с использованием субстрата из гравия и промышленных отходов. Науки о воде. Технол. Дж. Междунар. доц. Загрязнение воды. Рез. Контроль. 1993 , 27, 107–113. [Академия Google] «> Ян, Дж.; Морено, Л.; Неретниекс И. Долговременная кислотонейтрализующая способность сталеплавильного шлака. Управление отходами. 2000 , 20, 217–223. [Google Scholar] [CrossRef]
- Национальное агентство по охране окружающей среды. Процедура экстракции твердых отходов для выщелачивания методом буферного раствора токсичности и уксусной кислоты; ХДЖ/Т 300-2007; Национальное агентство по охране окружающей среды: Пекин, Китай, 2007 г. (на китайском языке)
- Маларвижи, Т.С.; Санти, Т. Адсорбция ионов Zn(II) из водного раствора на золе-уноса при сжигании лигнита. Десалин. Водное лечение. 2013 , 51, 6777–6788. (На китайском языке) [Google Scholar] [CrossRef]
- Национальное агентство по охране окружающей среды. Стандарты качества окружающей среды для поверхностных вод; ГБ 3838-2002; Национальное агентство по охране окружающей среды: Пекин, Китай, 2002 г. (на китайском языке) «> О, К.; Ри, С .; О, М.; Парк, Дж. Характеристики удаления As(III) и As(V) из кислого водного раствора сталеплавильным шлаком. Дж. Азар. Матер. 2012 , 213–214, 147–155. [Академия Google] [CrossRef] [PubMed]
- Теймури А.; Насаб, С.Г.; Вахдатпур, Н.; Хабиболлахи, С.; Салавати, Х .; Чермахини, А.Н. Нанокомпозит хитозан/цеолит Y/нано ZrO 2 в качестве адсорбента для удаления нитратов из водного раствора. Междунар. Дж. Биол. макромол. 2016 , 93, 254. [Google Scholar] [CrossRef] [PubMed]
- Икеда, Т.; Хирата, М.; Кимура, Т. Гидролиз Al 3+ методом ограниченной молекулярной динамики. Дж. Хим. физ. 2006 , 124, 74503. [Google Scholar] [CrossRef] [PubMed]
- Чжэн, В.Дж.; Лин, Дж. В.; Жан, Ю.Х.; Ван, Х. Адсорбционные характеристики нитратов и фосфатов из водного раствора на активированном угле, модифицированном хлоридом циркония-гексадецилтриметиламмония. Хуань Цзин Кэ Сюэ 2015 , 36, 2185–2194.
 (На китайском языке) [Google Scholar] [PubMed]
(На китайском языке) [Google Scholar] [PubMed] - Huo, L. Адсорбция нитратов на гранулированном гидроксиде железа из смоделированных сточных вод. Подбородок. Дж. Окружающая среда. англ. 2012 , 6, 3058–3062. [Google Scholar]
- Lagergren, S. Zur Theorie der Sogenannten Adсорбция Gelöster Stoffe; Kungliga Svenska Vetenskapsakademiens. Обработка 1898 , 24, 1–39. (В Германии) [Google Scholar]
- Ho, Y.S.; Маккей Г. Сорбция красителя из водного раствора торфом. хим. англ. J. 1998 , 70, 115–124. [Google Scholar] [CrossRef]
- Хо, Ю.С.; Чиу, WT; Хсу, CS; Хуанг, К.Т. Сорбция ионов свинца из водного раствора с использованием древовидного папоротника в качестве сорбента. Гидрометаллургия 2004 , 73, 55–61. [Google Scholar] [CrossRef]
- Ленгмюр И. Адсорбция газов на плоских поверхностях стекла, слюды и платины. Варенье. хим. соц.
 1918 , 40, 1361–1403. [Google Scholar] [CrossRef]
1918 , 40, 1361–1403. [Google Scholar] [CrossRef] - Фрейндлих, Х.; Хеллер, В. Адсорбция цис- и транс-азобензола. Варенье. хим. соц. 1939 , 61, 2228–2230. [Google Scholar] [CrossRef]
- Картер, М.К.; Килдафф, Дж. Э.; Вебер, В. Дж. Анализ распределения энергии предварительно загруженных адсорбентов. Окружающая среда. науч. Технол. 1995 , 29, 1773–1780. [Google Scholar] [CrossRef] [PubMed]
- Дерило-Марчевска А.; Яронец, М.; Гелбин, Д.; Зайдель, А. Эффекты неоднородности при адсорбции одного растворенного вещества из разбавленных растворов на твердых телах. хим. Скр. 1984 , 24, 239–246. [Google Scholar]
- Ислам, М.; Мишра, ПК; Патель, Р. Физико-химическая характеристика гидроксиапатита и его применение для удаления нитратов из воды. Дж. Окружающая среда. Управление 2010 , 91, 1883. [Google Scholar] [CrossRef] [PubMed] «> Xi, Y.; Маллаварапу, М .; Найду, Р. Адсорбция гербицида 2,4-Д на органо-палигорските. заявл. Глина наук. 2010 , 49, 255–261. [Google Scholar] [CrossRef][Зеленая версия]
- Халайния, А .; Оустан, С.; Наджафи, Н .; Хатаи, А.Р.; Лакциан, А. Адсорбционно-десорбционные характеристики нитратов, фосфатов и сульфатов на слоистом двойном гидроксиде Mg-Al. заявл. Глина наук. 2013 , 80, 305–312. [Google Scholar] [CrossRef]
- Milmile, S.N.; Панде, СП; Кармакар, С.; Чакрабарти, Т .; Бансивал, А .; Бинивале, Р.Б. Равновесная изотерма и кинетическое моделирование адсорбции нитратов анионообменной смолой Indion NSSR. Опреснение 2011 , 276, 38–44. [Академия Google] [CrossRef]
- Лу, С.; Чен, Дж.; Ли, Ф. Исследование ключевых факторов и решение проблемы снижения значения pH в угольном фильтре в процессе O 3 -BAC. Подбородок. Дж. Хим. англ. 2013 , 21, 914–919. [Google Scholar] [CrossRef]
Рисунок 1. Сканирующий электронный микроскоп (СЭМ) OSS, MSS и MSS после адсорбции нитрата ( a ): OSS; ( b ): ПСС; ( c ): МСС после адсорбции.
Сканирующий электронный микроскоп (СЭМ) OSS, MSS и MSS после адсорбции нитрата ( a ): OSS; ( b ): ПСС; ( c ): МСС после адсорбции.
Рисунок 1. Сканирующий электронный микроскоп (СЭМ) OSS, MSS и MSS после адсорбции нитрата ( и ): УСС; ( b ): ПСС; ( c ): МСС после адсорбции.
Рисунок 2. Спектр ЭДС OSS и MSS (( a ): OSS; ( b ): MSS).
Рисунок 2. Спектр ЭДС OSS и MSS (( a ): OSS; ( b ): MSS).
Рисунок 3. Рентгенограмма (XRD) OSS и MSS (a: Ca 2 Fe 2 O 5 , b: FeO; c: CaO·Al 2 O 3 ; d: MgO; e : Ca 4 Fe 2 Ti 2 O 11 ; f: Fe 2,75 Ti 0,25 O 4 ).
Рисунок 3. Рентгенограмма (XRD) OSS и MSS (a: Ca 2 Fe 2 O 5 , b: FeO; c: CaO·Al 2 O 3 ; d: MgO; e : Ca 4 Fe 2 Ti 2 O 11 f: Fe 2,75 Ti 0,25 O 4 ).
Рисунок 4. Влияние дозировки на эффективность удаления нитратов. Исходная концентрация нитратов: 20 мг/л; начальный рН: 4; время реакции: 180 мин; температура: 25 °С.
Рисунок 4. Влияние дозировки на эффективность удаления нитратов. Исходная концентрация нитратов: 20 мг/л; начальный рН: 4; время реакции: 180 мин; температура: 25 °С.
Рисунок 5. Влияние начального pH на эффективность удаления нитратов и дзета-потенциал. Исходная концентрация нитратов: 20 мг/л; дозировка адсорбента: 1 г/100 мл; время реакции: 180 мин; температура: 25 °С.
Рисунок 5. Влияние начального pH на эффективность удаления нитратов и дзета-потенциал. Исходная концентрация нитратов: 20 мг/л; дозировка адсорбента: 1 г/100 мл; время реакции: 180 мин; температура: 25 °С.
Рисунок 6. Влияние времени реакции на адсорбцию нитратов. Исходная концентрация нитратов: 20 мг/л; дозировка стального шлака: 1 г/100 мл; начальный рН: 4; температура: 25 °С.
Рисунок 6. Влияние времени реакции на адсорбцию нитратов. Исходная концентрация нитратов: 20 мг/л; дозировка стального шлака: 1 г/100 мл; начальный рН: 4; температура: 25 °С.
Рисунок 7. Подгонка кривых двух кинетических моделей адсорбции нитрата с помощью OSS и MSS ( a ): псевдопервый порядок; ( b ): псевдовторой порядок.
Рис. 7. Подходящие кривые двух кинетических моделей адсорбции нитрата OSS и MSS ( a ): псевдопервого порядка; ( b ): псевдовторой порядок.
Рисунок 8. Влияние начальной концентрации нитрата на адсорбционную способность МСС. Исходная концентрация нитратов: 20–300 мг/л; дозировка шлака: 1 г/100 мл, исходный рН: 4; время контакта: 180 мин; температура: 25 °С.
Рис. 8. Влияние начальной концентрации нитрата на адсорбционную способность МСС. Исходная концентрация нитратов: 20–300 мг/л; дозировка шлака: 1 г/100 мл, исходный рН: 4; время контакта: 180 мин; температура: 25 °С.
Рисунок 9. Изотермы адсорбции нитратов: ( a ) модель Ленгмюра; ( b ) Модель Фрейндлиха.
Рис. 9. Изотермы адсорбции нитратов: ( a ) модель Ленгмюра; ( б ) Модель Фрейндлиха.
Рисунок 10. ИК-спектры МСС до и после адсорбции нитрата.
Рисунок 10. ИК-спектры МСС до и после адсорбции нитрата.
Рисунок 11. Предлагаемый механизм адсорбции между адсорбентом и нитратом.
Рисунок 11. Предлагаемый механизм адсорбции между адсорбентом и нитратом.
Рисунок 12. Адсорбционная эффективность МСС после повторной регенерации.
Рисунок 12. Адсорбционная эффективность МСС после повторной регенерации.
Таблица 1. Все виды модификаций условий и ПСС.
Таблица 1. Все виды модификаций условий и ПСС.
| Modification Conditions | 3:2:0. 15 15 | 3:2:0.30 | 3:2:0.45 | 3:2:0.60 | 3:2:0.75 |
|---|---|---|---|---|---|
| 600 ° C | MSS1 | MSS2 | MSS3 | MSS4 | MSS5 |
| 700 °C | MSS6 | MSS7 | MSS8 | MSS9 | MSS10 |
| 800 °C | MSS11 | MSS12 | MSS13 | MSS14 | MSS15 |
| 900 °C | MSS16 | MSS17 | MSS18 | MSS19 | MSS20 |
Table 2. Физические свойства OSS и MSS.
Физические свойства OSS и MSS.
Таблица 2. Физические свойства OSS и MSS.
| Образцы | S BET A M 2 /G | V T B CM³/G6 V 7. 9008 V 9008 V 9008 V 9008 V 9008 V 9008 V 9008 V 9008 V 9008 V 9008 V 9008 V 9008 V 7 V 7 V 7 V 7 V 7 V V 9008 V 9008 V V V 7 V 7 V V V V V . d cm³/g | ||
|---|---|---|---|---|
| OSS | 2.854 | 0.01253 | 0.01122 | 0.00125 |
| MSS | 9,531 | 0,02494 | 0,02184 | 0,00283 |
a Удельная поверхность, определенная методом адсорбции N2 (метод БЭТ). b Общий объем открытых пор при P/Po = 0,97. c Объем мезопор. d Объем микропор.
b Общий объем открытых пор при P/Po = 0,97. c Объем мезопор. d Объем микропор.
Таблица 3. Основной химический состав исходного и модифицированного металлургического шлака (мас. %).
Таблица 3. Основной химический состав исходного и модифицированного металлургического шлака (мас. %).
| Samples | CaO | Fe 2 O 3 | SiO 2 | MgO | P 2 O 5 | MnO | Al 2 O 3 | TiO 2 | Total |
|---|---|---|---|---|---|---|---|---|---|
| OSS | 40. 86 86 | 28.79 | 14.05 | 6.70 | 3.13 | 2.98 | 1.66 | 0.73 | 98.90 |
| MSS | 33.73 | 24.66 | 10.47 | 4.82 | 2.48 | 2.20 | 20.01 | 0.51 | 98.88 |
Table 4. Концентрация токсичных элементов в выщелачивающем растворе OSS и MSS (мг/л).
Таблица 4. Концентрация токсичных элементов в выщелачивающем растворе OSS и MSS (мг/л).
| Образцы | Cu | Zn | Pb | Cd | Cr | V | As |
|---|---|---|---|---|---|---|---|
| OSS | ≤0.002 | ≤0.002 | ≤0.03 | ≤0.002 | ≤0.003 | ≤0.003 | ≤0.03 |
| MSS | ≤0. 002 002 | ≤0.002 | ≤0.03 | ≤0.002 | ≤0.003 | ≤0.003 | ≤0.03 |
| Class III value | 1.0 | 1.0 | 0.05 | 0.005 | 0.05 | 0.05 | 0.05 |
Table 5. Кинетические параметры адсорбции нитратов на OSS и MSS.
Таблица 5. Кинетические параметры адсорбции нитратов на OSS и MSS.
| Адсорбент | Псевдо-первого порядка | Псевдо-второго порядка | q e,exp | ||||
|---|---|---|---|---|---|---|---|
| q e,cal | K 1 | R 2 | q e,cal | K 2 | R 2 | ||
| OSS | 0. 3094 3094 | 0.0251 | 0.7030 | 0.2468 | 0.1963 | 0.9955 | 0.3665 |
| MSS | 1.675 | 0.0299 | 0.9301 | 0.7041 | 0.0194 | 0,9652 | 0,6988 |
Таблица 6. Параметры изотерм Ленгмюра и Фрейндлиха для адсорбции нитратов на МСС.
Таблица 6. Параметры изотерм Ленгмюра и Фрейндлиха для адсорбции нитратов на МСС.
| Адсорбат | Постоянная Langmuir | Постоянная Фрейндлих | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Q M (MG/G) | K 7 L (MG/G) | K7 L (MG/G) | K7 L (MG/G) | K7 (MG/G) | K (MG/G) 0716 0716 K F ((mg/g) (L/mg) 1/n ) | 1/n | R 2 | | ||||||||||||||||||||||||||||||||||
| NO 3 − | 16.393 Таблица
Сравнительная оценка адсорбционной способности и других условий эксперимента различных сорбентов по удалению нитратов. Таблица 7. Сравнительная оценка адсорбционной способности и других условий эксперимента различных сорбентов по удалению нитратов.
© 2017 авторами. Лицензиат MDPI, Базель, Швейцария. Эта статья находится в открытом доступе и распространяется на условиях лицензии Creative Commons Attribution (CC BY) (http://creativecommons.org/licenses/by/4.0/). Опосредованное растворимостью замедленное высвобождение, обеспечивающее добавку нитратов в карбонатные электролиты для стабильного металлического литиевого анодаAbstract Физио-химические свойства межфазной фазы твердого электролита, в первую очередь определяемые составом электролита, оказывают глубокое влияние на электрохимическое циклирование металлического лития. Введение Морфология электроосажденных металлов в значительной степени определяется физико-химическими характеристиками на границе металл/электролит, включая ионный транспорт, межфазную энергию, механику и т.д. 1 . Это особенно касается электрохимического покрытия металлическим литием (Li), идеальным анодом для аккумуляторов следующего поколения с самой высокой удельной емкостью (3860 мАч g –1 ) и самым низким электродным потенциалом из всех возможных альтернатив 2,3 . В частности, электроосаждение Li осложняется мгновенным образованием резистивной межфазной пассивации (т. е. границы твердого электролита, SEI), возникающей в результате паразитного восстановления компонентов электролита высокореакционноспособным Li 4 . Обычно считается, что химическая неоднородность и механическая нестабильность слоя SEI вызывают неравномерный поток ионов, что приводит к образованию литиевых дендритов, которые могут привести к внутреннему короткому замыканию и поставить под угрозу безопасность батареи, в то время как повторяющиеся поломки и ремонт SEI приводят к постоянным потерям. Обширные исследования были посвящены регулированию поверхностной реактивности металлического лития. Среди всех тактик, исследованных на сегодняшний день (защитные покрытия 6,7 , наноструктурированные электроды 8,9 , высокомодульные сепараторы 10,11 и т. д.), адаптация состава электролита является одной из наиболее важных и важных парадигм. , так как он может напрямую воздействовать на физико-химию слоя SEI, модифицируя межфазную среду, чтобы изменить характер отложения лития 12,13,14,15,16 . Известно, что выбор электролитов-растворителей уже может заметно влиять на равномерность осаждения лития. В общем, электролиты на основе эфира демонстрируют относительно контролируемое осаждение и, следовательно, высокую кулоновскую эффективность (КЭ), приписываемую образованию олигомерных SEI с превосходной гибкостью 17 . Однако применение эфирных электролитов сильно затруднено из-за их высокой воспламеняемости и низкого потенциала окисления (анодное разложение при <4 В по сравнению с Li + /Li) 18 , не соответствующие эталону безопасности и появляющиеся высоковольтные катоды 19 . Теоретически, если добавка гораздо более склонна к восстановлению, чем другие компоненты электролита, для формирования межфазной среды, благоприятной для осаждения лития, хорошие электрохимические характеристики могут быть достигнуты независимо от электролитных систем («электролит-агностическая» добавка). Здесь мы сообщаем об обнаружении выраженного влияния нитрат-анионов (NO 3 – ) на морфологию и обратимость осаждения Li в карбонатных электролитах. Хотя нитратная добавка знакома сообществу, так как LiNO 3 регулярно используется в эфирах для литий-серных аккумуляторов 27,28 , в карбонатах он остается неизученным частично из-за его чрезвычайно низкой растворимости. РезультатыВлияние нитратов на морфологию Li в карбонатном электролите Как часто упоминается в литературе, катодное разложение NO 3 – может начаться уже при ~1,7 В относительно Li + /Li 32 , что намного выше, чем у других компонентов электролита на карбонатной основе. , что делает его многообещающим кандидатом в качестве «независимой от электролита» добавки (рис. 1a) 33 . Следовательно, если предпочтительное восстановление NO 3 – может привести к SEI, способствующему контролируемому отложению Li, присутствие NO 3 – в карбонатных электролитах, скорее всего, улучшит характеристики металлического лития. Преимущественное восстановление нитратов в карбонатных электролитах изменяет морфологию нуклеации Li. a Экспериментальный восстановительный потенциал различных компонентов электролита (обычные растворители, такие как ЭК и ДЭК; типичная добавка VC) на инертном электроде, описанный в литературе 31 . b CV электролитов на основе ДМЭ с 1,0 M LiNO 3 или 1,0 M LiTFSI при скорости сканирования 0,1 мВ с –1 . Нержавеющая сталь использовалась в качестве рабочего электрода, а литиевая фольга использовалась в качестве противоэлектрода/электрода сравнения. СЭМ-изображения морфологии нуклеации Li в 1.0 M LiPF 6 Электролит EC/DEC c без и d с насыщенным LiNO 3 . Изучить влияние NO 3 – в карбонате на основе электролитов, осаждение Li на медную (Cu) фольгу проводили с использованием обычного 1,0 M гексафторфосфата лития (LiPF 6 ) в электролите этиленкарбонат (ЭК)/диэтилкарбонат (ДЭК) 1:1 об./об., насыщенном LiNO 3 . К нашему большому удивлению, несмотря на то, что дендритный Li наблюдался в чистом карбонатном электролите уже на стадии зародышеобразования (0,1 мАч см –2 ; рис. 1в), однородные частицы Li можно получить в присутствии LiNO 3 ( Рис. 1г). Такое влияние на морфологию гораздо более заметно, чем у обычных пленкообразующих добавок, таких как FEC и виниленкарбонат (VC), с которыми отложение Li оставалось проволочным (дополнительный рисунок 2). Примечательно, что эффект безразличен к выбору катионов и может быть распространен на другие молекулярные виды со связью N – O (например, нитрат тетрадодециламмония и нитрит натрия; дополнительный рисунок 3). Несмотря на выраженное влияние NO 3 – на морфологию зародышеобразования Li, практичность добавки сильно ограничена ее крайне низкой растворимостью в карбонатах. Поскольку NO 3 — необходимо постоянно потреблять во время формирования SEI, его контроль над литием быстро ослабевает с увеличением емкости осаждения (дополнительный рисунок 4). Преодоление барьера растворимости за счет замедленного высвобождения Максимальная концентрация NO 3 – в различных электролитах на карбонатной основе определяли колориметрическим методом восстановлением кадмия на дискретном анализаторе (рис. 2а). Растворимость LiNO 3 в электролитах на основе ЭЦ/ДЭК составляет ~800 ppm (эквивалентно ~0,012 M), что как минимум на порядок меньше, чем концентрация добавки в эфирном электролите 27 . Изготовление пленки замедленного высвобождения, опосредованной растворимостью. Изображение в полный размер Чтобы преодолеть ограничение растворимости и сделать добавку нитрата применимой в карбонатах, мы предлагаем стратегию замедленного высвобождения, опосредованного растворимостью (рис. 2b). В частности, отдельно стоящая мембрана состоит из LiNO 3 , растворенного в полимерной матрице (называемой пленкой замедленного высвобождения LiNO 3 , LNO-SRF), которая была введена поверх анода, так что NO 3 – может непрерывно пополняться из полимерного геля, набухшего в электролите, во время осаждения Li для поддержания заметной локальной концентрации NO 3 – на аноде. На рисунке 2c показано типичное изображение LNO-SRF, полученное с помощью сканирующей электронной микроскопии (СЭМ), на котором видна высокопористая структура, вероятно, вызванная фазовой инверсией PVDF-HFP во время изготовления в присутствии гигроскопичного LiNO 3 38 . На изображении СЭМ с большим увеличением не наблюдалось заметных кристаллов соли / агломератов (рис. 2d, дополнительный рис. 6 показывает типичную морфологию кристаллов LiNO 3 ), и однородное распределение азота может быть подтверждено энергодисперсионным рентгеновским излучением ( EDX) элементное картирование (рис. Высокоэффективное циклирование в конфигурациях с половинной и полной ячейками На рис. 3a–c показано морфологическое развитие Li с увеличением емкости осаждения в присутствии LNO-SRF. Вместо того, чтобы расти в дендриты, как в случае карбонатов, насыщенных NO 3 – , плотно упакованные сферические ядра лития превратились в узелковые формы с увеличением емкости (дополнительная рис.9). Более того, эффект модуляции может сохраняться в течение повторяющихся циклов покрытия/зачистки как на литиевой фольге (рис. 3d), так и на медной подложке (дополнительная рис. 10). Поскольку наблюдение невозможно провести с использованием только чистой мембраны PVDF-HFP (дополнительная рис. 11), такой устойчивый контроль над морфологией отложений Li следует отнести к быстрому и устойчивому высвобождению NO 9.0007 3 – из микропористого LNO-SRF, что обеспечивает разумную локальную концентрацию добавки на фронте гальванического покрытия, несмотря на ее низкую растворимость (рис. Морфология осаждения и циклический КЭ с LNO-SRF. СЭМ-изображения морфологии осаждения Li на подложке Cu, покрытой LNO-SRF, при плотности тока 1 мА см –2 и емкости a 0,1 мАч см –2 , b 0,5 мАч см 2 и с 1 мАч см –2 соответственно. d СЭМ-изображение поверхности литиевой фольги после 50 циклов зачистки/покрытия в симметричной ячейке Li||Li с LNO-SRF. Циклирование проводилось при плотности тока 1 мА см –2 и емкости 1 мАч см –2 . Масштабные линейки, 2 мкм в a и 5 мкм в b – d . e Опосредованное растворимостью растворение LiNO 3 из микропористого LNO-SRF может поддерживать высокий локальный уровень NO 3 – концентрации на поверхности анода во время циклирования батареи, что, следовательно, приводит к устойчивой модуляции морфологии осаждения лития. Изображение с полным размером Эффективность циклирования литиевого анода определялась гальваностатическим нанесением/удалением лития на медный электрод при различных плотностях тока и мощностях. Важно отметить, что нитратная добавка, включенная в LNO-SRF, значительно превосходит обычные добавки при длительном циклировании, повышая эффективность циклирования лития и стабильность в карбонатных электролитах до уровня, сравнимого, если не лучше, чем с эфирными электролитами (рис. Чтобы продемонстрировать, что LNO-SRF в карбонатных электролитах может привести к созданию более конкурентоспособных литий-металлических аккумуляторов, мы сконструировали полные элементы с NMC в качестве катода. Примечательно, что в этом исследовании использовалось только ограниченное количество литиевого резервуара (либо литиевая фольга 42 мкм, либо трехмерный композитный анод из оксида графена с восстановленным металлом лития 150 мкм, Li-rGO; дополнительная рис. 18) 8 . Если предположить, что катод имеет приличную обратимость, снижение емкости полного элемента должно быть связано в основном с потерей лития на стороне анода (дополнительный рисунок 19). Обсуждение Чтобы выяснить механизм улучшенной морфологии и электрохимических характеристик металлического литиевого анода с добавкой нитрата, который, вероятно, связан с измененными свойствами SEI, мы сначала определили структуру SEI с помощью просвечивающей электронной микроскопии (ПЭМ) при криогенная температура 30 . Крио-ЭМ исследование структуры SEI в присутствии нитратов. a ПЭМ-изображения с малым увеличением и b с высоким разрешением отложений Li в 0,5 M LiPF 6 Электролит EC/DEC, насыщенный NO 3 – при плотности тока 0,5 мА 1см 43 на 150 с. Белая линия в b очерчивает границу между металлическим Li и SEI. Шкала баров, 200 нм в a и 10 нм в b . c Увеличенное изображение ПЭМ и d соответствующая схема оранжевой области, выделенной в b , показывающая двухслойную структуру SEI. Снаружи представляет собой плотный слой Li 2 O с четкими полосами решетки, а внутри представляет собой аморфную матрицу с кристаллическими доменами (Li 2 O и Li 2 CO 3 ), беспорядочно распределенными повсюду. Изображение в натуральную величину Одна из гипотез, объясняющая образование отчетливой двухслойной структуры, заключается в том, что во время формирования SEI NO 3 – сначала восстанавливается до различных нерастворимых N x O y – видов и Li 2 O 42,43 . Кристаллизация Li 2 O кинетически выгодна с образованием плотного кристаллического слоя 44 , тогда как N x O y – виды остаются в основном аморфными. Плотный, однородный неорганический наружный слой SEI может значительно улучшить однородность SEI, что не только способствует равномерному потоку ионов лития во время осаждения для подавления дендритов, но также эффективно защищает поверхность лития от электролитной коррозии, повышая эффективность циклирования. Обратите внимание, что хотя добавка FEC также приводит к двухслойной структуре SEI, как сообщалось ранее 30 , она не образует сферических ядер Li. Таким образом, точная морфология осаждения лития также в значительной степени зависит от физико-химических свойств (кинетика переноса ионов, межфазная энергия и т. Для корреляции образования сферического Li с химическим составом SEI был проведен РФЭС-анализ с пошаговым напылением электроосажденных ядер Li в электролите EC/DEC с добавкой нитрата. В соответствии с данными EELS, XPS показал четкий сигнал N 1s в SEI (рис. 5a). Поверхностные формы азота обладают более высокими степенями окисления (LiN x O y ), в то время как больше Li 3 N можно обнаружить ближе к стороне Li. По сравнению с SEI, сформированным в чистом электролите EC / DEC, в XPS не может быть обнаружено никаких других существенных различий в составе, за исключением небольших изменений концентрации различных компонентов SEI и более высокого содержания LiF (дополнительные рисунки 24–27). Таким образом, соединения азота в результате преимущественного восстановления NO 3 − можно естественным образом интерпретировать как оказывающее сильное влияние на химию поверхности Li, вероятно, за счет изменения ионно-транспортных свойств SEI, поскольку давно известно, что Li 3 N демонстрирует превосходную литий-ионную проводимость.  5 5 XPS и измерения тока обмена. a XPS N 1s глубинные профили SEI, сформированные в 0,5 M LiPF 6 электролит EC/DEC, насыщенный NO 3 – . Осаждение Li проводили при плотности тока 1 мА см –2 и емкости 0,1 мАч см –2 на медной фольге. b Типичные CV-сканы (скорость сканирования 200 мВ с –1 ), полученные с использованием ультрамикроэлектрода в 1,0 M LiPF 6 электролите EC/DEC с добавкой нитрата и без нее. c Увеличенное CV-сканирование вокруг области потенциала зародышеобразования, обозначенной в b . Присутствие NO 3 – в электролите снижает потенциал начала осаждения Li более чем на 100 мВ Наконец, ток обмена Li 9Пара 0013 + /Li в карбонатном электролите с добавкой нитрата была измерена с использованием ультрамикроэлектрода, чтобы пролить свет на улучшенные электрохимические характеристики с точки зрения кинетики переноса заряда (дополнительный метод 2). Увеличенный обменный ток подтверждает наши выводы из результатов EIS и согласуется с наблюдениями за более контролируемой морфологией отложения лития с добавкой нитрата, поскольку более высокий обменный ток имеет тенденцию приводить к более крупным отложениям лития. В заключение следует отметить, что физико-химические свойства слоя SEI, которые в значительной степени зависят от состава электролита, оказывают глубокое влияние на электрохимическое циклирование металлического лития. В этом исследовании мы обсуждаем возможность использования нитрат-анионов в качестве «независимой от электролита» добавки, которая может быть предпочтительно восстановлена во время образования SEI, чтобы создать межфазную среду, способствующую контролируемому осаждению Li, независимо от электролитных систем. С удивлением обнаруживается, что NO 3 – на миллимолярном уровне в карбонатных электролитах может резко преобразовать морфологию ядер лития из дендритной в сферическую из-за значительно измененных свойств SEI. Конструктивно можно наблюдать двухслойный SEI с плотной неорганической оболочкой, которая эффективно защищает поверхность металлического лития и гомогенизирует ионный поток. С электрохимической точки зрения, азотсодержащие частицы в SEI приводят к улучшенным свойствам переноса ионов, а присутствие NO 3 – в сольватной оболочке литий-иона приводит к более быстрой кинетике переноса заряда, оба из которых благоприятны для сдерживания роста дендритов. МетодыИзготовление LNO-SRF Всего 10 % масс. PVDF-HFP (Kynar Flex 2801–00) и 5 % масс. LiNO 3 (Alfa Aesar, приблизительно максимальная растворимость LiNO 3 в ацетоне) полностью растворяли в ацетоне при интенсивном магнитном перемешивании на плитке с температурой 60 °C. Затем раствор наносили лезвием на шероховатую сторону электроосажденной медной фольги (CF-T8G-UN; Pred. Электрохимические измерения 1,0 M LiPF 6 в электролите EC/DEC был приобретен у BASF (Selectylite LP40). 0,1 и 0,5 M LiPF 6 в электролите EC/DEC изготавливали путем разбавления Selectilyte LP40 растворителями EC (Acros Organics) и DEC (Acros Organics). LiTFSI (Solvay), LiFSI (Nippon Shokubai), DME (Sigma-Aldrich), FEC (Acros Organics) и VC (Acros Organics) использовали в готовом виде. Все растворители были высушены над молекулярными ситами 4А (Sigma-Aldrich) перед приготовлением электролитов. Все электрохимические испытания проводились в конфигурации типа «таблетка» 2032. Для изучения морфологии осаждения лития и циклического КЭ LNO-SRF накрывали поверх токосъемника анода Cu (25 мкм, 99,8% мет.прим.; Альфа Аезар). Литиевая фольга (750 мкм; Alfa Aesar) использовалась в качестве противоэлектрода/электрода сравнения, два слоя Celgard 2325 (25 мкм ПП/ПЭ/ПП) использовались в качестве сепараторов, и в каждую монетную ячейку добавлялось 80 мкл электролита. Перед испытанием ячейки выдерживали в течение 3 часов, чтобы позволить LNO-SRF полностью набухнуть в электролите. Для измерения CE батареи сначала подвергали 10 циклам активации от 0 до 1,5 В для формирования стабильного SEI и устранения побочных реакций перед гальваностатическим литием/зачисткой при различных плотностях тока и емкостях на 8-канальном тестере батарей LAND. Клетки LNO-SRF выдерживали 1 час между каждым циклом посева/зачистки. Для исследований Li||NMC с полной ячейкой в качестве анода использовалась либо тонкая литиевая фольга (~ 50 мкм, Hydro-Québec), либо Li-rGO. Характеристика Изображения SEM и картирование элементов EDX были получены с помощью сканирующего электронного микроскопа FEI XL30 Sirion при ускоряющем напряжении 5 и 20 кВ соответственно. Растворимость нитратов в различных карбонатных электролитах определяли с помощью дискретного анализатора WestCo SmartChem 200. В типичном эксперименте 200 мкл электролита, насыщенного LiNO 3 , разбавляли водой до 5 мкл. Крио-ЭМ характеристики были выполнены на сканирующем электронном микроскопе FEI Titan 80–300 (сканирующем) трансмиссионном электронном микроскопе (E(S)TEM), работающем при 300 кВ, в соответствии с протоколом криопереноса, описанным в нашей предыдущей публикации 29 . Доступность данныхНаборы данных, созданные в ходе и/или проанализированные в ходе текущего исследования, можно получить у соответствующего автора по обоснованному запросу. Ссылки
Дин, Ф. и др. Осаждение лития без дендритов с помощью механизма самовосстановления электростатического экрана. Дж. Ам. хим. соц. 135 , 4450–4456 (2013). Артикул пабмед КАС Google ученый Сюй, К. Неводные жидкие электролиты для литиевых аккумуляторов. Хим. Ред. 104 , 4303–4418 (2004 г.). Артикул пабмед КАС Google ученый Fan, X. et al. Высокофторированные промежуточные фазы позволяют использовать высоковольтные литий-металлические батареи. Chem 4 , 174–185 (2018). Артикул КАС Google ученый Яуманн, Т. и др. Роль добавки 1,3-диоксолана и LiNO 3 в долгосрочной стабильности наноструктурированных кремниево-углеродных анодов для перезаряжаемых литиевых батарей. Дж. Электрохим. соц. 163 , А557–А564 (2016 г.). Артикул КАС Google ученый Канамура, К., Тамура, Х., Сираиси, С. и Такехара, Зи XPS-анализ литиевых поверхностей после погружения в различные растворители, содержащие LiBF 4 . Дж. Электрохим. соц. 142 , 340–347 (1995). Артикул КАС Google ученый Загрузить ссылки Благодарности Мы признательны за поддержку помощнику государственного секретаря по вопросам энергоэффективности и возобновляемых источников энергии, Управление автомобильных технологий, исследования аккумуляторных материалов (BMR) и программы Battery 500 Министерства энергетики США. Информация об автореАвторы и организации
| , СШАТемпература . | Модель первого порядка . | Псевдовторой приказ . | Модель внутричастичной диффузии . | |||||||||||||||||||||||||||||||||||||
| К . | q e,cal (мг/г) . | k 1 × 10 −2 (мин. −1 )
. | Р 2 . | Р . | В 0 × 10 −4 (мг/(г·мин)) . | q e,cal (мг/г) . | k 2 × 10 −4 (г/мг мин) . | Р 2 . | Р . | к 0,5 (мг/г мин −1 ) . | Р 2 . | Р . | ||||||||||||||||||||||||||||||
| NO 3 − -N | 298 | 8.37 | 0.20 | 0.9896 | 5.05477×10 −8 | 209.33 | 11.00 | 1.73 | 0.9825 | 2,43133 × 10 −7 | 0,2140 | 0,9477 | 9.12237 × 10 −6 | |||||||||||||||||||||||||||||
| 30393222222222222н | 0.9917 | 2.27789×10 −8 | 298.12 | 11.46 | 2.27 | 0.9775 | 4.46344×10 −7 | 0.2391 | 0.8986 | 3.×10 −5 | ||||||||||||||||||||||||||||||||
| 308 | 8.78 | 0.32 | 0.9916 | 1.84834×10 −8 | 404.99 | 12.27 | 2.69 | 0.9850 | 1.04629×10 −7 | 0.2656 | 0.8966 | 3.29627×10 −5 | ||||||||||||||||||||||||||||||
| NO 2 − -N | 298 | 7.92 | 0.17 | 0.9843 | 1.× 10 −7 | 164.56 | 11.00 | 1.36 | 0.9847 | 1.78946×10 −7 | 0.1967 | 0.9659 | 1.×10 −6 | |||||||||||||||||||||||||||||
| 303 | 8. 21 21 | 0.23 | 0.9972 | 9.28335×10 −10 | 231.99 | 10.77 | 2.04 | 0.9893 | 5.28961×10 −8 | 0.2153 | 0.9312 | 1,34692 × 10 −5 | ||||||||||||||||||||||||||||||
| 308 | 8,59 | 0,41 | 0,9983 | 1.14430 × –1013 2 | 1.14430 × –1013 –1013 ° 9983 | 1,14430 × –1013 ± 10.1013.10983 | 1.14430 × | 0,9983 | .3262 4.650.9906 | 1.81887×10 −8 | 0.2209 | 0.8604 | 5.54217×10 −5 | |||||||||||||||||||||||||||||
| Anion . | Температура . | Модель первого порядка . | Псевдовторой порядок . | Модель внутричастичной диффузии .  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| К . | q e,cal (мг/г) . | k 1 × 10 −2 (мин. −1 ) . | Р 2 . | Р . | В 0 × 10 −4 (мг/(г·мин)) . | q e,cal (мг/г) . | k 2 × 10 −4 (г/мг мин) . | Р 2 . | Р . | к 0,5 (мг/г мин −1 ) . | Р 2 . | Р . | |
| НЕТ 3 − -N | 298 | 8.37 | 0.20 | 0.9896 | 5.05477×10 −8 | 209. 33 33 | 11.00 | 1.73 | 0.9825 | 2.43133×10 −7 | 0.2140 | 0.9477 | 9.12237×10 −6 |
| 303 | 8.11 | 0.26 | 0.9917 | 2.27789×10 −8 | 298.12 | 11.46 | 2.27 | 0.9775 | 4.46344×10 −7 | 0.2391 | 0.8986 | 3.×10 −5 | |
| 308 | 8.78 | 0.32 | 0.9916 | 1.84834×10 −8 | 404.99 | 12.27 | 2.69 | 0.9850 | 1.04629×10 −7 | 0.2656 | 0.8966 | 3.29627×10 −5 | |
| NO 2 − -N | 298 | 7.92 | 0.17 | 0.9843 | 1.×10 −7 | 164. 56 56 | 11.00 | 1.36 | 0.9847 | 1.78946×10 −7 | 0.1967 | 0.9659 | 1.×10 −6 |
| 303 | 8.21 | 0.23 | 0.9972 | 9.28335×10 −10 | 231.99 | 10.77 | 2.04 | 0.9893 | 5.28961×10 −8 | 0.2153 | 0.9312 | 1.34692×10 −5 | |
| 308 | 8.59 | 0.41 | 0.9983 | 1.14430×10 −10 | 476.23 | 10.12 | 4.65 | 0.9906 | 1.81887×10 −8 | 0.2209 | 0.8604 | 5.54217×10 −5 | |
Большой вид
Исследование равновесия
Слушать
Изотерма адсорбции является важным способом описания максимальной адсорбционной способности M-CHT в отношении нитратов или нитритов. Чтобы обсудить влияние различных температур, адсорбционное равновесие нитрата и нитрита на М-ЦГТ было исследовано при 298, 303 и 308 К. Как показано на рисунке 2, равновесная концентрация нитрата или нитрита увеличилась, а равновесная адсорбционная емкость была также увеличилось. При повышении температуры от 29от 8 до 308 К адсорбционное равновесие достигается быстрее. Адсорбционная способность нитратов и нитритов была высокой при высоких температурах.
Чтобы обсудить влияние различных температур, адсорбционное равновесие нитрата и нитрита на М-ЦГТ было исследовано при 298, 303 и 308 К. Как показано на рисунке 2, равновесная концентрация нитрата или нитрита увеличилась, а равновесная адсорбционная емкость была также увеличилось. При повышении температуры от 29от 8 до 308 К адсорбционное равновесие достигается быстрее. Адсорбционная способность нитратов и нитритов была высокой при высоких температурах.
Рисунок 2
УвеличитьСкачать слайд
Изотерма адсорбции (а) нитрата и (б) нитрита на М-ЦГТ при 298, 303 и 308К. (Объем раствора и дозировка адсорбента составляли 100 мл и 1 г/л соответственно.)
Рис.8, 303 и 308К. (Объем раствора и дозировка адсорбента составляли 100 мл и 1 г/л соответственно). Эти модели изотерм выражаются следующими уравнениями (5) и (6) соответственно:
(5)
(6)
где C e – концентрация нитратов или нитритов в растворе при равновесии ( мг/л), Q 0 – емкость монослоя адсорбента (мг/г), K L – постоянная Ленгмюра (л/мг), K F (мг/г) (л/мг) и n — константы Фрейндлиха, зависящие от температуры.
В таблице 2 приведены параметры изотермы адсорбции нитратов и нитритов. Модель изотермы Ленгмюра дала лучшие результаты аппроксимации со значениями R 2 (≥0,97), которые были выше, чем полученные по модели Фрейндлиха, что указывает на то, что нитраты и нитриты однородны на поверхности адсорбента, и адсорбция может быть монослойной (Ван и др. 2012; Родригес и др. 2019). При этом при 298, 303 и 308 К максимальные адсорбционные емкости М-ХТ по нитратам составили 7,89, 13,00 и 14,28 мг N/г соответственно. Соответствующие значения для нитрита составили 10,60, 12,40 и 16,90 мг N/г. Адсорбционная способность нитратов и нитритов при различных температурах увеличивалась в порядке 298 К < 303 К < 308 К. Высокая температура благоприятствовала адсорбции; эта тенденция согласовывалась с той, о которой сообщил Родригес 9.2820 и др. (2019). При 308 К наибольшей адсорбционной емкостью обладал М-ХГТ, параметры Ленгмюра для адсорбции нитратов: Q 0 = 14,28 мг N/г, K L = 1,39 л/мг; соответствующие значения для нитрита были Q 0 = 16,90 мг N/г и K L = 0,59 л/мг.
Таблица 2
Параметры изотермы адсорбции при различных температурах
| Температура (K) . | Ленгмюр: . | Фрейндлих: . | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Q 0 (мг/г) . | К л (л/мг) . | Р 2 . | Р . | K F (мг/г)(л/мг) n . | нет . | Р 2 . | Р . | |||||||
| NO 3 − -N | ||||||||||||||
| 298 | 7. 89 89 | 0.71 | 0.9445 | 8.58917×10 −7 | 5,66 | 5,25 | 0,9389 | 1,08977×10 −6 | ||||||
| 303 | 13.00 | 1.07 | 0.9785 | 1.06430×10 −7 | 7.25 | 5.84 | 0.8620 | 1.09662×10 −5 | ||||||
| 308 | 14.28 | 1.39 | 0.9892 | 2.32829×10 −8 | 8.27 | 6.09 | 0.8451 | 1.79982×10 −5 | ||||||
| NO 2 − -N | ||||||||||||||
| 298 | 10.60 | 0.52 | 0.9887 | 1.55678×10 −8 | 5.21 | 5.26 | 0.8205 | 1.53498×10 −5 | ||||||
| 303 | 12. 40 40 | 0.75 | 0.9621 | 4.28136×10 −7 | 6.45 | 5.39 | 0.8869 | 6.51297×10 −6 | ||||||
| 308 | 16.90 | 0.59 | 0.9542 | 1.85506×10 −6 | 7.72 | Температура (К) . | Ленгмюр: . | Фрейндлих: . | ||||||
| Q 0 (мг/г) . | К л (л/мг) . | Р 2 . | Р . | K F (мг/г)(л/мг) n . | нет . | Р 2 . | Р . | |||||||
| NO 3 − -N | ||||||||||||||
| 298 | 7. 89 89 | 0.71 | 0.9445 | 8.58917×10 −7 | 5.66 | 5.25 | 0.9389 | 1.08977×10 −6 | ||||||
| 303 | 13.00 | 1.07 | 0.9785 | 1.06430×10 −7 | 7.25 | 5.84 | 0.8620 | 1.09662×10 −5 | ||||||
| 308 | 14.28 | 1.39 | 0.9892 | 2.32829×10 − 8 | 8.27 | 6.09 | 0.8451 | 1.79982×10 −5 | ||||||
| NO 2 − -N | ||||||||||||||
| 298 | 10.60 | 0.52 | 0.9887 | 1.55678×10 −8 | 5.21 | 5.26 | 0.8205 | 1. 53498×10 −5 53498×10 −5 | ||||||
| 303 | 12.40 | 0.75 | 0.9621 | 4.28136×10 −7 | 6.45 | 5.39 | 0.8869 | 6.51297×10 −6 | ||||||
| 308 | 16.90 | 0.59 | 0.9542 | 1.85506×10 −6 | 7.72 | 7.75 | 0.9152 | 8.61090×10 −6 | ||||||
Посмотреть большой
Термодинамические параметры процесса адсорбции включают стандартное изменение свободной энергии (Δ G °, кДж/моль), стандартное изменение энтальпии (Δ H °, кДж/моль) и стандартное изменение энтропии (Δ S °, Дж/моль K -1 ), соответственно, которые можно рассчитать по следующим уравнениям (Aksu 2002; Debnath & Ghosh 2008):
(7)
(8)
(9)
где R (8,314 Дж/моль K) – постоянная идеального газа, T (K) – температура, C ad,e – концентрация нитрата или нитрита на М-ХГТ в состоянии равновесия (мг-N/л) и K c ′ – кажущаяся константа равновесия. Значение К c ′ в самой низкой экспериментальной концентрации нитратов или нитритов, которую можно получить (Чудоба и др. . 2020). Известно, что реакция адсорбции является самопроизвольным процессом, когда Δ G ° имеют отрицательные значения (Shahwan 2021). Здесь термодинамические параметры адсорбции нитратов и нитритов М-ХГТ приведены в таблице 3. В частности, Δ G ° являются отрицательными значениями и уменьшаются с повышением температуры, указывая на то, что процесс адсорбции нитратов и нитритов М-ХГТ ХТ спонтанная (Голбан и др. . 2019), а положительные значения Δ H ° свидетельствуют об эндотермическом характере адсорбции нитрата или нитрита М-ХГТ. Положительные значения Δ S ° иллюстрируют увеличение хаотичности процесса адсорбции.
Значение К c ′ в самой низкой экспериментальной концентрации нитратов или нитритов, которую можно получить (Чудоба и др. . 2020). Известно, что реакция адсорбции является самопроизвольным процессом, когда Δ G ° имеют отрицательные значения (Shahwan 2021). Здесь термодинамические параметры адсорбции нитратов и нитритов М-ХГТ приведены в таблице 3. В частности, Δ G ° являются отрицательными значениями и уменьшаются с повышением температуры, указывая на то, что процесс адсорбции нитратов и нитритов М-ХГТ ХТ спонтанная (Голбан и др. . 2019), а положительные значения Δ H ° свидетельствуют об эндотермическом характере адсорбции нитрата или нитрита М-ХГТ. Положительные значения Δ S ° иллюстрируют увеличение хаотичности процесса адсорбции.
Таблица 3
Термодинамические параметры адсорбции нитратов и нитритов методом М-ХТ
Материалы
. | Температура (К) . | ряд К с ’ . | Δ G 0 (кДж/моль) . | Δ H 0 (кДж/моль) . | Δ S 0 (Дж/моль·К −1 ) . | ||
|---|---|---|---|---|---|---|---|
| Nitrate | 298 | 1.85 | −4.58 | 58.74 | 212.68 | ||
| 303 | 2.31 | −5.83 | |||||
| 308 | 2.62 | −6.70 | |||||
| Nitrite | 298 | 1.27 | −3.14 | 96.43 | 334.71 | ||
| 303 | 2.13 | −5.37 | Материалы .Температура (К) . | лн К с ’ . | Δ G 0 (кДж/моль) . | Δ H 0 (кДж/моль) . | Δ S 0 (Дж/моль·К −1 ) . |
| Nitrate | 298 | 1.85 | −4.58 | 58.74 | 212.68 | ||
| 303 | 2.31 | −5.83 | |||||
| 308 | 2.62 | −6.70 | |||||
| Nitrite | 298 | 1.27 | −3.14 | 96.43 | 334.71 | ||
| 303 | 2.13 | −5,37 | |||||
| 308 | 2,53 | −6,47 |
Просмотреть большие значения коэффициента
уравнения Аррениуса, представленные на рис. 3 и в табл.934 и 0,9298. Адсорбционные процессы имеют значение энергии активации адсорбции 35,92 кДж/моль для нитрата и 67,12 кДж/моль для нитрита на М-ХГТ. Когда значение E a ниже 40 кДж/моль, тип адсорбции можно рассматривать как процесс физической адсорбции. Когда значение E a превышает 40 кДж/моль, это предполагает химическую адсорбцию (Bagheri et al. 2015). Здесь значение адсорбции нитрита E a превышало 40 кДж/моль, что указывает на возможность осуществления процесса адсорбции, имеющего преимущественно химическую природу. E a Величина адсорбции нитратов была ниже 40 кДж/моль, что может быть связано с физической адсорбцией. Таблица 4
.
Когда значение E a ниже 40 кДж/моль, тип адсорбции можно рассматривать как процесс физической адсорбции. Когда значение E a превышает 40 кДж/моль, это предполагает химическую адсорбцию (Bagheri et al. 2015). Здесь значение адсорбции нитрита E a превышало 40 кДж/моль, что указывает на возможность осуществления процесса адсорбции, имеющего преимущественно химическую природу. E a Величина адсорбции нитратов была ниже 40 кДж/моль, что может быть связано с физической адсорбцией. Таблица 4
.
.
Temperature (K)
. | Уравнение Аррениуса . | |
|---|---|---|
| E a (кДж·моль −1 ) . | Р 2 . | |
| Nitrate | 35.92 | 0.9934 |
| Nitrite | 67.12 | 0.9298 |
View Large
Figure 3
View largeDownload slide
Arrhenius plots of adsorption of (a) nitrate and (б) нитрит на M-CHT. (Объем раствора и дозировка адсорбента составляли 500 мл и 2 г/л соответственно). (Объем раствора и дозировка адсорбента составляли 500 мл и 2 г/л соответственно.)
Близкий модальный
Влияние начального pH
Слушать
Гидроталькитоподобный материал представляет собой щелочное соединение, и рН раствора сильно влияет на его адсорбционные характеристики. На рисунке 4 показаны результаты адсорбционных способностей при равновесии ( q e ) при различных начальных значениях pH. М-ЦГТ показал высокую адсорбционную способность нитратов в начальном диапазоне рН 3,36–8,45, а также высокую адсорбционную способность нитритов в начальном диапазоне рН 3,57–9..4, что указывает на то, что M-CHT обладает высокой адсорбционной способностью по отношению к нитратам и нитритам в широком диапазоне pH раствора. Максимальная адсорбционная способность нитратов и нитритов составила 9,91 мг N/г при рН 6,33 и 14,24 мг N/г при рН 6,38 соответственно.
На рисунке 4 показаны результаты адсорбционных способностей при равновесии ( q e ) при различных начальных значениях pH. М-ЦГТ показал высокую адсорбционную способность нитратов в начальном диапазоне рН 3,36–8,45, а также высокую адсорбционную способность нитритов в начальном диапазоне рН 3,57–9..4, что указывает на то, что M-CHT обладает высокой адсорбционной способностью по отношению к нитратам и нитритам в широком диапазоне pH раствора. Максимальная адсорбционная способность нитратов и нитритов составила 9,91 мг N/г при рН 6,33 и 14,24 мг N/г при рН 6,38 соответственно.
Рисунок 4
Посмотреть большойСкачать слайд
Влияние начального рН раствора М-ЦГТ на адсорбционную способность (а) нитратов и (б) нитритов, а также конечное значение рН раствора после адсорбции. (Объем раствора и дозировка адсорбента составляли 100 мл и 1 г/л соответственно.)
Рисунок 4
Посмотреть большойСкачать слайд
Влияние начального рН раствора М-ЦГТ на адсорбционную способность (а) нитратов и (б) нитритов, а также конечное значение рН раствора после адсорбции. (Объем раствора и дозировка адсорбента составляли 100 мл и 1 г/л соответственно.)
(Объем раствора и дозировка адсорбента составляли 100 мл и 1 г/л соответственно.)
Близкий режим
Когда начальный рН был >4,0, конечный рН после адсорбции превышал 10,5, что свидетельствует о том, что М-ЦГТ является сильнощелочной материал. После адсорбции pH увеличился, возможно, за счет выделения OH − из гидроталькита. В то же время при исходных значениях рН 4–10 эти тренды не были значимыми, что свидетельствовало об определенном буферном действии гидроталькита на изменение рН раствора; следовательно, в определенном диапазоне рН влияние рН на адсорбционную способность нитратов и нитритов при ХГТ не является чрезвычайно значительным, и диапазон применения широк (Ahmed et al. 2020). При снижении рН раствора до 2,50 адсорбционная емкость по нитратам и нитритам снижается до 6,41 мг N/г и 10,12 мг N/г соответственно при соответствующем снижении рН конечного раствора до 10,09.и 10.04. Так, сильнокислая среда снижает стабильность ламинированной структуры материалов (Ferreira et al. 2006), тем самым снижая адсорбционную способность по отношению к анионам. С увеличением рН конкурентная адсорбция нитрата или нитрита за счет высокого количества ОН — в растворе увеличивается, что приводит к снижению адсорбции нитрата или нитрита.
2006), тем самым снижая адсорбционную способность по отношению к анионам. С увеличением рН конкурентная адсорбция нитрата или нитрита за счет высокого количества ОН — в растворе увеличивается, что приводит к снижению адсорбции нитрата или нитрита.
Влияние сосуществующих анионов
Слушать
Typically, anions such as F − , Cl − , ClO 4 − , SO 4 2− , CO 3 2− , and PO 4 3 − присутствуют в воде, загрязненной нитратами и нитритами, которые могут конкурировать с нитратами или нитритами за места адсорбции на материалах (Gierak & łazarska 2017). Как показано на рисунке 5, в контрольной группе (без сосуществующих ионов) эффективность удаления нитратов и нитритов с помощью M-CHT составила 46,34% и 68,56% соответственно. Из общей тенденции, наблюдаемой на рисунке, адсорбционная способность нитратов и нитритов значительно снижается в присутствии сосуществующих анионов. Порядок воздействия — ПО 4 3–> CO 3 2– > F — > SO 4 2– > CL — > CLO 4 — . Адсорбционная способность М-ХТ по отношению к нитриту или нитрату из раствора в основном зависела от электрического сродства его положительной поверхности. В присутствии ПО 4 3– в растворе адсорбционная способность значительно снижалась. После прокаливания М-ЦГТ межслоевая вода или межслоевые анионы терялись, а поверхность материала приобретала положительный заряд. Чем выше валентность сосуществующего аниона, тем хуже адсорбция нитрита или нитрата M-CHT (Li и др. 2016). Таким образом, наиболее конкурентоспособным анионом является ПО 4 3– . Кроме того, на адсорбционную емкость влиял радиус аниона.
Из общей тенденции, наблюдаемой на рисунке, адсорбционная способность нитратов и нитритов значительно снижается в присутствии сосуществующих анионов. Порядок воздействия — ПО 4 3–> CO 3 2– > F — > SO 4 2– > CL — > CLO 4 — . Адсорбционная способность М-ХТ по отношению к нитриту или нитрату из раствора в основном зависела от электрического сродства его положительной поверхности. В присутствии ПО 4 3– в растворе адсорбционная способность значительно снижалась. После прокаливания М-ЦГТ межслоевая вода или межслоевые анионы терялись, а поверхность материала приобретала положительный заряд. Чем выше валентность сосуществующего аниона, тем хуже адсорбция нитрита или нитрата M-CHT (Li и др. 2016). Таким образом, наиболее конкурентоспособным анионом является ПО 4 3– . Кроме того, на адсорбционную емкость влиял радиус аниона. По сравнению с Cl — анион F — с меньшим радиусом оказывает более неблагоприятное влияние на адсорбцию нитрата или нитрата.
По сравнению с Cl — анион F — с меньшим радиусом оказывает более неблагоприятное влияние на адсорбцию нитрата или нитрата.
Рисунок 5
Просмотреть в большом размереЗагрузить слайд
Влияние сосуществующих анионов на удаление нитратов и нитритов с помощью M-CHT. ( T = 25 °C, pH = 9,08, исходный NO 3 − -N, NO 2 − -N, концентрация сосуществующих анионов 20 мг/л, дозировка М-ХТ 1 г/л, объем раствора 100 мл.)
Рисунок 5
Посмотреть большойСкачать слайд
Влияние сосуществующих анионов на удаление нитратов и нитритов с помощью M-CHT. ( T = 25 °C, pH = 9,08, исходный NO 3 − -N, NO 2 − -N, концентрация сосуществующих анионов 20 мг/л, доза M-CHT 1 г/л, объем раствора 100 мл.)
Закрытый модальный режим
Характеристика
Слушать
Рентгенофазовый анализ
Слушать
XRD использовали для исследования структуры образца. На рисунке 6 показаны рентгенограммы M-HT, M-CHT и M-CHT-A. М-ЧТ-А-НО 3 − и М-ЧТ-А-НО 2 − представляют собой прокаленный гидроталькит с адсорбированными нитратами и нитритами соответственно. Как показано на рисунке 6, до прокаливания М-ГТ демонстрировал типичную структуру HT-CO 3 2− с резкими симметричными рефлексами (003), (006), (110) и (113), а также широкие, симметричные (012), (015) и (018) рефлексы, раскрывающие характеристики гидроталькитоподобных соединений (Wang et al. 2018; Kang и др. 2020). Пик, наблюдаемый при 2 θ 30,34°, был проиндексирован как Fe 3 O 4 (JCPDS 26-1136), что указывает на то, что магнитная подложка была успешно загружена на гидротальцит (Zhang et al. 2013). ). После прокаливания при 500 °С в течение 4 ч все характерные рефлексы (003, 006, 110, 113, 012, 015 и 018) М-ГТ исчезли, что свидетельствует о разрушении слоистой структуры М-ХГТ.
На рисунке 6 показаны рентгенограммы M-HT, M-CHT и M-CHT-A. М-ЧТ-А-НО 3 − и М-ЧТ-А-НО 2 − представляют собой прокаленный гидроталькит с адсорбированными нитратами и нитритами соответственно. Как показано на рисунке 6, до прокаливания М-ГТ демонстрировал типичную структуру HT-CO 3 2− с резкими симметричными рефлексами (003), (006), (110) и (113), а также широкие, симметричные (012), (015) и (018) рефлексы, раскрывающие характеристики гидроталькитоподобных соединений (Wang et al. 2018; Kang и др. 2020). Пик, наблюдаемый при 2 θ 30,34°, был проиндексирован как Fe 3 O 4 (JCPDS 26-1136), что указывает на то, что магнитная подложка была успешно загружена на гидротальцит (Zhang et al. 2013). ). После прокаливания при 500 °С в течение 4 ч все характерные рефлексы (003, 006, 110, 113, 012, 015 и 018) М-ГТ исчезли, что свидетельствует о разрушении слоистой структуры М-ХГТ. При этом образовался смешанный оксид Mg(Fe)O с пиками при 43° и 62° (M-CHT) (Ян и др. 2012). Пик, обозначенный как Fe 3 O 4 , все еще можно четко наблюдать при 30,34°. Следовательно, M-CHT должен быть смешанным оксидом металла, и обработка прокаливанием не разрушила структуру Fe 3 O 4 . После адсорбции нитрата или нитрита на М-ХТ (М-ХТ-А-НО 3 — , М-ХТ-А-НО 2 — ) происходит перестройка слоистой структуры, что свидетельствует о адсорбция нитрата или нитрита на положительном слое и образование отрицательного слоя.
При этом образовался смешанный оксид Mg(Fe)O с пиками при 43° и 62° (M-CHT) (Ян и др. 2012). Пик, обозначенный как Fe 3 O 4 , все еще можно четко наблюдать при 30,34°. Следовательно, M-CHT должен быть смешанным оксидом металла, и обработка прокаливанием не разрушила структуру Fe 3 O 4 . После адсорбции нитрата или нитрита на М-ХТ (М-ХТ-А-НО 3 — , М-ХТ-А-НО 2 — ) происходит перестройка слоистой структуры, что свидетельствует о адсорбция нитрата или нитрита на положительном слое и образование отрицательного слоя.
Рисунок 6
Увеличить Загрузить слайд
Рентгеновские дифракционные спектры M-HT, M-CHT и M-CHT-A.
Рисунок 6
Увеличить Загрузить слайд
Спектры рентгеновской дифракции M-HT, M-CHT и M-CHT-A.
Близкий модальный
Расстояние между слоями было рассчитано путем использования базового расстояния (d003) минус ширина бруситоподобного слоя (Wan et al. 2012). При этом внутренние пространства CHT и M-CHT составляли 0,293 нм и 0,299 нм соответственно, что указывает на то, что добавление магнитной матрицы не влияет на внутреннее пространство М-НТ.
2012). При этом внутренние пространства CHT и M-CHT составляли 0,293 нм и 0,299 нм соответственно, что указывает на то, что добавление магнитной матрицы не влияет на внутреннее пространство М-НТ.
XPS-анализ
Слушать
Для анализа состава поверхности и элементного состояния M-CHT была принята XPS. Все элементы были отмечены на карте полного спектра (рис. 7(а)). Типичные энергии связи наблюдались при 56,92 эВ, 301,38 эВ, 532,80 эВ и 727,12 эВ, соответствующие Mg2p, C1s, O1s и Fe2p соответственно, которые согласуются с основными составляющими элементами M-CHT.
Рисунок 7
Увеличить Загрузить слайд
Рентгеновские фотоэлектронные спектры М-ХТГ: (а) полный спектр и (б) пики Fe2p с подгонкой спектра.
Рисунок 7
Увеличить Загрузить слайд
Рентгеновские фотоэлектронные спектры М-ХТГ: (а) полный спектр и (б) пики Fe2p с подгонкой спектра.
Близкий модальный
Как показано на рисунке 7(b), энергии связи при 712,3 эВ и 725,6 эВ были отнесены к характеристикам Fe 3+ , а энергии связи при 710,6 эВ и 723,9 эВ были отнесены к характеристика Fe 2+ (Liu и др. 2020a). Кроме того, энергия связи при 719,06 эВ является общим сателлитным пиком как для Fe 3+ , так и для Fe 2+ . Как рассчитано по площадям пиков из XPS, отношения площадей пиков Fe 2+ и Fe 3+ составляли 35,96% и 64,04% соответственно. Фактическое значение Fe 2+ /Fe 3+ , равное 0,56, в основном согласуется с теоретическим значением 0,5, указывая на то, что Fe 3 O 4 легировано гидроталькитом (Yan et al. 2015; Liu и др. 2020a).
FTIR-анализ
Слушать
На рисунке 8 показаны спектры FTIR M-HT, M-CHT и M-CHT-A. Широкая полоса на 3460 см -1 соответствует деформационному колебанию -ОН от гидроксильных групп и межслоевой воды (Ян и др. 2015; Ши и др. 2020). Слабая полоса на 1649 см -1 была отнесена к изгибным колебаниям межслоевой воды (Абделькадер и др. 2011; Лю и др. 2020a). Пик на 1364 см −1 является колебательным пиком CO 3 2− (Сайя и др. 2009). Полоса между 400 см -1 и 800 см -1 приписывается полосам растяжения скелета магниевого железа (Liu et al. 2020a). Приведенные выше результаты свидетельствуют о том, что М-ГТ проявляет характеристики гидроталькита, включающего межслоевую воду и карбонат, а введение магнитной подложки не меняет его свойств. Рисунок 8 9Рисунок 8
Широкая полоса на 3460 см -1 соответствует деформационному колебанию -ОН от гидроксильных групп и межслоевой воды (Ян и др. 2015; Ши и др. 2020). Слабая полоса на 1649 см -1 была отнесена к изгибным колебаниям межслоевой воды (Абделькадер и др. 2011; Лю и др. 2020a). Пик на 1364 см −1 является колебательным пиком CO 3 2− (Сайя и др. 2009). Полоса между 400 см -1 и 800 см -1 приписывается полосам растяжения скелета магниевого железа (Liu et al. 2020a). Приведенные выше результаты свидетельствуют о том, что М-ГТ проявляет характеристики гидроталькита, включающего межслоевую воду и карбонат, а введение магнитной подложки не меняет его свойств. Рисунок 8 9Рисунок 8
Близкий модальный
После прокаливания характерные пики гидротальцита при 3460 см -1 и 1649 см -1 ослабли или исчезли, в основном за счет разрушения пластинчатой структуры, исчезновения функциональных групп, таких как как OH — , CO 3 2 — и H 2 O при высокой температуре и превращении образца в смешанный оксид (Wan и др. 2012). После адсорбции нитрата или нитрита наблюдались новые пики при 1384 см -1 и 1271 см -1 , соответствующие нитрату и нитриту (Ogata et al. 2018), что указывает на успешную адсорбцию нитрата и нитрита. на М-ЧТ. Более того, для всех образцов пик на 582 см -1 соответствует валентной вибрации Fe-O (Liu et al. 2020b, 2021b), которая является особенностью Fe 3 O 4 (Pandi и Вишванатан, 2016 г.). Это указывало на то, что Fe 3 O 4 был успешно загружен на гидротальцит, и процесс прокаливания и адсорбции не влияет на структуру Fe 3 O 4 .
2012). После адсорбции нитрата или нитрита наблюдались новые пики при 1384 см -1 и 1271 см -1 , соответствующие нитрату и нитриту (Ogata et al. 2018), что указывает на успешную адсорбцию нитрата и нитрита. на М-ЧТ. Более того, для всех образцов пик на 582 см -1 соответствует валентной вибрации Fe-O (Liu et al. 2020b, 2021b), которая является особенностью Fe 3 O 4 (Pandi и Вишванатан, 2016 г.). Это указывало на то, что Fe 3 O 4 был успешно загружен на гидротальцит, и процесс прокаливания и адсорбции не влияет на структуру Fe 3 O 4 .
Анализ VSM
Слушать
Результаты XRD, XPS и FTIR показали, что Fe 3 O 4 было успешно нанесено на матрицу гидроталькита. На рисунке 9 показана кривая магнитного гистерезиса M-CHT при комнатной температуре. M-CHT показал намагниченность 90,15 Эме/г. Коэрцитивная сила и остаточная намагниченность были близки к нулю, что указывает на то, что M-CHT является суперпарамагнитным материалом (Xu & Wang 2012; Shen et al. 2019). На вставке к рисунку 9 показан результат магнитного разделения М-ХТ через 5 минут, что указывает на то, что М-ХТ можно легко отделить и восстановить.
На рисунке 9 показана кривая магнитного гистерезиса M-CHT при комнатной температуре. M-CHT показал намагниченность 90,15 Эме/г. Коэрцитивная сила и остаточная намагниченность были близки к нулю, что указывает на то, что M-CHT является суперпарамагнитным материалом (Xu & Wang 2012; Shen et al. 2019). На вставке к рисунку 9 показан результат магнитного разделения М-ХТ через 5 минут, что указывает на то, что М-ХТ можно легко отделить и восстановить.
Рисунок 9
Посмотреть в большом размереСкачать слайд
Кривые намагничивания М-КТГ.
Рисунок 9
Посмотреть в большом размереСкачать слайд
Кривые намагничивания М-КТГ.
Закрыть модальный режим
Слушать
В данном исследовании М-ЦГТ, синтезированный методом соосаждения и прокаливания, показал высокую адсорбционную способность по нитратам и нитритам из загрязненной воды в широком диапазоне рН (начальный рН колебался от 3 до 9). Кинетика адсорбции и изотерма нитрата и нитрита могут быть описаны с помощью модели первого порядка, псевдовторого порядка и модели Ленгмюра соответственно. В присутствии сосуществующих анионов эффективность удаления нитратов и нитритов по сравнению с М-ЦГТ снижалась в порядке PO 4 3–> CO 3 2– > F — > SO 4 2– > CL — > CLO 4 — . Анализ XRD и FTIR показал, что M-CHT может восстанавливать свою первоначальную слоистую структуру после адсорбции нитрата или нитрита. Между тем, XRD и XPS анализ подтвердили, что Fe 3 O 4 успешно наносился на гидроталькит и не влиял на структуру гидроталькита. M-CHT — это магнитный материал, который легко перерабатывается с помощью магнита. Таким образом, М-ХТ имеет большие перспективы для применения в очистке сточных вод.
Кинетика адсорбции и изотерма нитрата и нитрита могут быть описаны с помощью модели первого порядка, псевдовторого порядка и модели Ленгмюра соответственно. В присутствии сосуществующих анионов эффективность удаления нитратов и нитритов по сравнению с М-ЦГТ снижалась в порядке PO 4 3–> CO 3 2– > F — > SO 4 2– > CL — > CLO 4 — . Анализ XRD и FTIR показал, что M-CHT может восстанавливать свою первоначальную слоистую структуру после адсорбции нитрата или нитрита. Между тем, XRD и XPS анализ подтвердили, что Fe 3 O 4 успешно наносился на гидроталькит и не влиял на структуру гидроталькита. M-CHT — это магнитный материал, который легко перерабатывается с помощью магнита. Таким образом, М-ХТ имеет большие перспективы для применения в очистке сточных вод.
Слушать
Эта работа выполнена при финансовой поддержке Национального фонда естественных наук Китая (51878251), Ключевого научно-технического исследовательского проекта в провинции Хэнань (1
210170, 14B430005, 182102210398, 172102310137), Государственной ключевой лаборатории обработки материалов и технологии штамповки и пресс-форм, Хуажонг Университет науки и технологий (P2019-004).
Слушать
Авторы заявляют, что у них нет известных конкурирующих финансовых интересов или личных отношений, которые могли бы повлиять на работу, представленную в этой статье.
Слушать
Все соответствующие данные включены в документ или его дополнительную информацию.
Абделькадер
Н. Б.-Х.
,
Bentouami
A.
,
Derriche
Z.
,
Bettahar
N.
и
De Ménorval
L. L.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.-C.D-
2011
Синтез и характеристика двойных гидроксидов слоя Mg-Fe и их применение для адсорбции Orange G из водного раствора
.
Химический инженерный журнал
169
,
231
–
238
.
Ahmed
A.
,
Wang
J.
,
Wang
W.
,
Okonkwo
C. J.
&
Liu
N.
2020
Практичный метод удаления перфтороктановой кислоты из водных сред с использованием двухслойной гидридной системы: перспективы восстановления окружающей среды
.
Экологические технологии
, doi: 10.1080/095
Аксу
З.
2002
Определение равновесных, кинетических и термодинамических параметров периодической биосорбции ионов никеля(II) на Chlorella vulgaris
.
Биохимия процессов
38
,
89
–
99
.
Алиаскари
М.
и
Schäfer
A. I.
2020
Удаление нитратов, мышьяка и фторидов электродиализом из солоноватых грунтовых вод
.
Исследование воды
190
,
116683
.
Allen
S. J.
,
MCKAY
G.
и
Khader
K. Y. H.
1989
Интрапатиц.0005
.
Загрязнение окружающей среды
56
,
39
–
50
.
Bagheri
M.
,
Younesi
H.
,
Hajati
S.
и
Borghei
S. M.
2015 . хрома (VI) . Международный журнал биологических макромолекул 80 , 431 – 444 . Berkani I. , Belkacem M. , Trari M. , Lapicque F. & Bensadok K. 2019 Оценка электрокоагуляции, основанной на удалении нитратов, для обработки и повторного использования концентрата обратного осмоса для опреснения подземных вод Сахары для устойчивого управления ресурсами Альбиена . Журнал экологической химической инженерии 7 , 102951 . Boehm A. B. 2019 Пороговые значения качества воды для колифагов в поверхностных водах, основанные на оценке риска: влияние температуры и загрязнения на старение . . Chen L. , LI J. и GE M. 2009 Проматочный эффект Ce-Doped V2O5-WO3/TIO2 с низким уровнем погрузки Vanadiu NOx на Nh4 . Журнал физической химии C 113 , 21177 – 21184 . Ченг Дж. , Чжан X. , Tang Y. , Song Z. и Джин X. 2021 . Двойные гидроксиды со слоями магния (СДГ) в искусственных водно-болотных угодьях . Науки об окружающей среде и исследования загрязнения , doi: 10.1007/s11356-021-13422-7. Чудоба Д. , łudzik K. , Jażdżewska M. и Wołoszzuk S. 2020 KINETIC и Equilibrium Equilibrial Expilibriem. Международный журнал молекулярных наук 21 , 8230 . Debnath S. и Ghosh U. C. 2008 Кинетика, изотерма и термодинамика адсорбции Cr(III) и Cr(VI) из водных растворов кристаллическим водным оксидом титана . Журнал химической термодинамики 40 , 67 – 77 . Deng L. , SHI Z. , Peng X. и 0005 2016 Магнитно-кальцинированный композит феррит кобальта/магний-алюминий-гидротальцит для улучшенной адсорбции метилоранжа . Журнал сплавов и соединений 688 , 101 – 112 . Elias W. C. , Heck K. N. , GUO S. , Yazdi S. , S. , S. , S. , 0058 , Ayala-Orozco C. , Grossweiler S. , Domingos J. B. , Ringe E. & Wong M. 2020 Нанокубы Pd, декорированные индием, быстро разлагают нитрат-анионы . Прикладной катализ B: Защита окружающей среды 276 , 119048 . Ferreira O. P. , de Moraes S. G. , Durán N. , Cornejo L. & Alves O. L. 2006 Evaluation удаления бора из воды гидроталькитоподобными соединениями . Хемосфера 62 , 80 – 88 . Галлоуэй J. N. , Townsend A. , Erisman J. W. , Bekunda M. , Cai Z. , Freney J. R. , Martinelli L. A. , Seitzinger S. P. и Sutton M. A. 2008 .0005 . Наука 320 , 889 – 892 . Gierak A. & Łazarska I. 2017 Адсорбция ионов нитратов, нитритов и аммония на углеродных адсорбентах 9.0080 9.0080 9.0080 9.0080 . Голбан L. , Lupa L. , Cocheci L. & Pode R. 2019 Synthesis of MgFe layered double hydroxide from iron-containing acidic остаточный раствор и его адсорбционная способность . Кристаллы 9 , 514 . Хань Л. , Кай С. , Гао М. , Хасэгава Ж.-Й. , Wang P. , Zhang J. , SHI L. и ZHANG 2019 SELALICAT с Nh4 с использованием новых катализаторов: состояние дел и перспективы на будущее . Химические обзоры 119 , 10916 – 10976 . Ho Y.S. & McKay G. 1998 Сорбция красителя из водного раствора торфом Химический инженерный журнал 70 , 115 – 124 . Ху К. Л. , Чен Н. , FENG C. P. и HU W. W. 2016 Кинетические исследования для адсорбции нитратов на гранулярном хитозане -FE (III) комплекс . Опреснение и очистка воды 57 , 27783 – 27793 . Юнг И.-К. , Джо Ю. , Хан С.-К. и Юн Ж.-И. 2020 Эффективное удаление аниона йода из водного раствора с помощью пригодного для повторного использования магнитного двухслойного гидроксида Fe3O4@Mg/Al (LDH) ядро-оболочка . Наука об окружающей среде в целом 705 , 135814 . Канг Ж. , Левицкая Т. Г. , Парк С. , Kim J. , Varga T. & Um W. 2020 Nanostructured MgFe and CoCr layered double hydroxides for removal and sequestration of iodine anions . Химический инженерный журнал 380 , 122408 . Ким-Шапиро Д. Б. , Гладвин М. Т. , Patel R. P. и Hogg N. 2005 Между нитритом и гемоглобином: роль нитрита в гипоксическом вазодиляции гемоглобина



 S.
S. R.
R.



Журнал неорганической биохимии
99
,
237
–
246
.
Ли
Р. Х.
,
Ван
Дж. Дж.
,
Zhou
B. Y.
,
Awasthi
M. K.
,
Ali
A.
,
Zhang
Z. Q.
,
Gaston
L. A.
,
Lahori
A. H.
&
Mahar
A.
2016
Усиление адсорбции фосфатов с помощью биоугля, функционализированного двойными гидроксидами Mg/Al, с различным соотношением Mg/Al
. .
Li
J.
,
Dong
S.
,
Wang
Y.
,
Dou
X.
&
Hao
H.
2020
Удаление нитратов из водных растворов магнитным катионным гидрогелем: эффект электростатической адсорбции и механизм
.
Журнал наук об окружающей среде
91
,
177
–
188
.
Liu
Y.
,
Chen
Z.
,
Guo
P.
,
Shi
Y.
,
Chen
J.
,
He
Q.
и
Wan
D.
2020a
Адсорбция перхлората высокой концентрации из водного раствора на кальцинированном продукте магнитного гидроталькита Mg/Fe (MAG@CHT): кинетика и изотермическое исследование
.
Опреснение и очистка воды
204
,
328
–
339
.
Liu
Y.
,
LI
J.
,
WU
L.
,
SHI
Y.
,
HE
Q.
,
Chen
J.
и
WAN
D.
2020B
Магнитный оттраченное промекало Земное углу тетрациклина гидрохлорида: методология поверхности отклика для оптимизации и механизм действия
.
Наука об окружающей среде в целом
722
,
137817
.
Лю
T.
,
Liu
S.
,
He
S.
,
Tian
Z.
&
Zheng
M.
2021a
Minimization выбросов N2O при прерывистой аэрации в реакторе периодического действия (SBR): основное поведение и механизм
.
Вода
13
,
210
.
Лю
Ю.
,
LI
J.
,
WU
L.
,
WAN
D.
,
SHI
Y.
,
HE
4 400044
4
4
4
4
4
4
4
4
4
4
4
4
4
4
4
4.
4
9
.
и
Chen
J.
2021b
Синергетическая адсорбция и фентон-подобная деградация гидрохлорида тетрациклина с помощью магнитного отработанного угля для отбеливания: понимание эффективности и механизма реакции
.
Наука об окружающей среде в целом
761
,
143956
. .
Индийский журнал гигиены окружающей среды
42
,
28
–
39
.
Малхолланд
P. J.
,
Helton
A. M.
,
Poole
G. C.
,
Hall
R. O.
Jr. ,
,
Hamilton
S. K.
,
Peterson
B. J.
,
Tank
J. L.
,
Ashkenas
L. R.
,
Cooper
L. W.
,
DAHM
L. W.
,
DAHM
0004 C. N.
,
Dodds
W. K.
,
Findlay
S. E. G.
,
Gregory
S. V.
,
Grimm
N. B.
,
Johnson
S. L.
,
McDowell
W. H.
,
Meyer
J. L.
L.
,
Valett
H. M.
,
Webster
J. R.
,
Arango
C. P.
,
Beaulieu
J. J.
,
Bernot
M. J.
,
Burgin
A. J.
,
Crenshaw
C. L.
,
Johnson
L. T.
,
Niederlehner
B. R.
,
O’Brien
J. M.
,
Поттер
9000J. D.
,
Sheibley
R. W.
,
Sobota
D. J.
и
Thomas
S. M.
M.
2008
Денитрификация потока.
Природа
452
,
202
–
205
.
Нассар
Х.
,
Зиуд
A.
,
El-Hamouz
A.
,
Tanbour
R.
,
Halayqa
N.
и
9504050505050505050505050505cн. Адсорбция/десорбция нитрат-ионов в водной среде углем на основе твердых отходов оливкового масла, активированным с использованием ZnCl2
.
Устойчивая химия и фармация
18
,
100335
.
Ogata
F.
,
Nagai
N.
,
Kariya
Y.
,
Nagahashi
E.
,
Kobayashi
Y.
,
Nakamura
T.
&
Kawasaki
N.
2018
Адсорбция нитрит- и нитрат-ионов из водного раствора гидроталькитами типа Fe-Mg 9 при различных мольных соотношениях0005
.
Химический и фармацевтический бюллетень
66
,
458
–
465
.
Pandi
K.
и
Viswanathan
N.
2016
Изготовление магнитного оксида железа по сравнению с наногидроксиапатитом гелатиновым экологическим композитом для исследований дефуоридации
8.
Химический и инженерный журнал
61
,
571
–
578
.
Rodrigues
E.
,
Almeida
O.
,
Brasil
H.
,
Moraes
D.
&
dos Reis
M. A. L.
2019
Адсорбция хрома (VI) на гидроталькит-гидроксиапатитном материале, легированном углеродными нанотрубками: равновесное, кинетическое и термодинамическое исследование
. .
Saiah
F.B.D.
,
Su
B.-L.
и
Bettahar
N.
2009
Слоистый двойной гидроксид никель-железо (СДГ): текстурные свойства при гидротермальной обработке и применении при сорбции красителя
.
Журнал опасных материалов
165
,
206
–
217
.
Saifullah
B.
и
Hussein
M. Z. B.
2015
Неорганические нанослои: структура, подготовка и биомедицинские применения
85
85 . Международный журнал наномедицины
10
,
5609
–
5633
.
Саматья
С.
,
Кабай
N.
,
Юксель
Ü.
,
Arda
M.
&
Yüksel
M.
2006
Селективное удаление нитратов 908 из водного раствора нитратов 908
Реактивные и функциональные полимеры
66
,
1206
–
1214
Шахван
T.
2021
Критические взгляды на ограничения и интерпретации определения ΔGo, ΔHo и ΔSo сорбции водных загрязнителей на различных сорбентах
. .
Шен
Дж.
,
Чжоу
Й.
,
Ли
С.
,
5
P.
и
Xue
G.
2019
Наночастицы Fe3O4, покрытые гидрогелем, как эффективный гетерогенный катализатор Фентона для разложения фенола
.
Журнал материаловедения
54
,
10684
–
10694
.
Ши
Ю.
,
Ли
Дж.
,
Ван
Д.
,
Huang
J.
и
Liu
Y.
2020
Пероксимоносульфат-усиленный фотокатализ с помощью карбонил-модифицированного G-C3N4 для эффективного деградации TetracyCline Hydrochlified
88. Наука об окружающей среде в целом
749
,
142313
.
Песня
В.
,
Гао
Б.
,
Сюй
X.
,
Wang
F.
,
XUE
N.
,
Sun
S.
,
Song
W.
,
.
R.
2016
Адсорбция нитратов из водного раствора сшитым магнитным амином биополимером на основе стеблей кукурузы и его способность к химической регенерации
.
Журнал опасных материалов
304
,
280
–
290
.
Sun
X. F.
,
Imai
T.
,
Sekine
M.
,
Higuchi
T.
,
Yamamoto
K.
&
Akagi
K.
2013
Адсорбция фосфата прокаленным Mg-Fe слоистым двойным гидроксидом
.
Журнал водных и экологических технологий
11
,
111
–
120
.
Toledo
T. V.
,
Bellato
C. R.
R.
,
Rosário
R. H.
&
Marques Neto
J. O.
2010
Adsorption of arsenic(V) by the magnetic hydrotalcite– композит оксида железа
.
Química Nova
34
,
561
–
567
.
WAN
D.
,
Liu
H.
,
Liu
R.
,
Q
,
LI
.
9,
LI
С.
9958
,
9.
,
.
Zhang
J.
2012
Адсорбция нитратов и нитритов из водного раствора на прокаленный (Mg-Al) гидроталькит с различным соотношением Mg/Al
.
Химический инженерный журнал
195–196
,
241
–
247
.
Wang
M.
,
Guo
P. Y.
,
Zhang
Y.
,
Lv
C. M.
,
Liu
T. Y.
,
Chai
Т. Ю.
,
Се
Ю. Х.
,
Wang
Y. Z.
и
ZHU
T.
2018
Синтез сфотографической фонарино-подобной EU (III)-Doped58 8. 5.0008. .
5.0008. .
Журнал опасных материалов
349
,
224
–
233
.
Верчик
П.
,
Доманьска
M.
и
Konieczny
T.
2020
Извлечение азота из сбросной воды путем производства нитритного концентрата с помощью нитритации, мембранных процессов и ионного обмена
.
Опреснение и очистка воды
197
,
90
–
100
.
Ся
Н. Н.
,
Чжан
Х. Ю.
,
HU
Z. H.
,
KONG
F.
и
HE
F.
2020
Функциональный материал. .
Хемосфера
263
,
128202
.
Сюй
Л.
и
Ван
Дж.
2012
Фентон-подобное разложение 2,4-дихлорфенола с использованием магнитных наночастиц Fe3O4
.
Прикладной катализ B: Окружающая среда
123–124
,
117
–
126
.
Ян
Л.-г.
,
Ян
К.
,
Шань
Р.-р.
,
Ю
Х.-кв.
и
Ду
Б.
2015
Прокаленные двойные гидроксиды со слоями ZnAl и Fe3O4/ZnAl для эффективного удаления Cr(VI) из водного раствора
.
РСК Авансы
5
,
–
.
Yang
Y.
,
Gao
N.
,
Chu
W.
,
Zhang
Y.
&
Ma
Y.
2012
Адсорбция перхлората из водного раствора продуктом прокаливания гидроталькитоподобных соединений Mg/(Al–Fe)
.
Журнал опасных материалов
209–210
,
318
–
325
.
Zeng
D.
,
Liang
K.
,
GUO
F.
,
WU
Y.
,
WU
Y.
9.0058 и Wu
G.
2020
Эффективность денитрификации и микробное сообщество в условиях солености и стрессов MIT для обработки концентрата обратным осмосом
.
Технология разделения и очистки
242
,
116799
.
Чжан
Х. Ф.
,
Ван
Дж.
,
Ли
Р. М.
80004 Dai
Q. H.
,
Gao
R.
,
Liu
Q.
&
Zhang
M. L.
2013
Preparation of Fe3O4@C@layered double hydroxide composite for магнитная сепарация урана
.
Промышленная и инженерная химия Исследования
52
,
10152
–
10159
.
Что такое водный раствор? Определение и примеры
Эта запись была опубликована автором Anne Helmenstine (обновлено )
Водный раствор содержит воду в качестве растворителя. Примеры включают дождь, морскую воду и уксус. Водный раствор представляет собой химический раствор, в котором растворителем является вода. Растворенные вещества представляют собой растворенные молекулы и ионы, окруженные молекулами воды. Водный раствор обозначается записью ( aq ) после химической формулы. Например, водный раствор соли (NaCl) в воде представляет собой NaCl ( водный раствор ) или Na+ ( водный раствор ) + Cl- ( водный раствор ). Напротив, раствор, в котором растворителем не является вода, называется неводным раствором .
Водный раствор обозначается записью ( aq ) после химической формулы. Например, водный раствор соли (NaCl) в воде представляет собой NaCl ( водный раствор ) или Na+ ( водный раствор ) + Cl- ( водный раствор ). Напротив, раствор, в котором растворителем не является вода, называется неводным раствором .
Примеры водных растворов
Ионные и ковалентные растворы растворяются в воде и образуют водные растворы. Примеры водных растворов:
- Солевой раствор
- Морская вода
- Wine
- Vodka
- Cola
- Дождь
- Arrenius кислота и базовые растворы
- Sweet Tea
- Vinesere
. или другие растворители, не являющиеся водой. Когда вещество соединяется с водой и образует смесь, но не растворяется, водный раствор не образуется. Например, при смешивании песка и воды не образуется водный раствор. Пример задач по химии водных растворов
Учащиеся сталкиваются с несколькими типами задач по химии, связанными с водными растворами. В основном это вопросы растворимости и коллигативных свойств.
В основном это вопросы растворимости и коллигативных свойств.
Пример: Какое растворенное вещество образует водный раствор?
- нитрат натрия (NaNO 3 )
- карбонат кальция (CaCO 3 )
- гидроксид серебра (AgOH)
- сульфид меди(I) 93 0 8 02652
Технически это не большой вопрос, потому что все ионные соединения образуют водные растворы, даже если они очень плохо растворимы. Это связано с тем, что ионные соединения, такие как вода, являются полярными молекулами. Но смысл такого вопроса в том, чтобы учащийся понял правила разрешимости. Исходя из этих правил, хорошо растворим в воде только нитрат натрия. Большинство карбонатов, гидроксидов и сульфидов нерастворимы, и эти соединения не являются исключением из правил.
Другие распространенные вопросы касаются коллигативных свойств. Коллигативные свойства, такие как снижение температуры замерзания и повышение точки кипения, зависят от количества растворенных в воде частиц. Чем больше соединение диссоциирует на ионы или чем выше его концентрация, тем выше температура кипения или понижения точки замерзания.
Чем больше соединение диссоциирует на ионы или чем выше его концентрация, тем выше температура кипения или понижения точки замерзания.
Пример: Какой водный раствор имеет самую низкую температуру замерзания?
- 0,1 молярная мочевина (CH 4 N 2 O) раствор
- 0,1 молельная сахароза (C 12 H 22 O 11 ) Раствор
- 0,1 Молольный хлорид натрия (NaCl)
- 0,1 Молольный хлорид. соединений не имеет значения. Поскольку все растворы имеют одинаковую концентрацию, все, что вам нужно посмотреть, это то, на сколько частиц распадается каждая молекула в водном растворе. Мочевина и сахароза являются ковалентными соединениями, поэтому они растворяются в воде, но не диссоциируют на ионы. Вы знаете это, потому что соединения являются органическими. Это оставляет хлорид натрия и хлорид кальция. Оба этих соединения являются ионными и растворимы в воде. Они диссоциируют на свои ионы в водном растворе. Но хлорид натрия распадается только на два иона или частицы (Na + , Кл – ).
 При этом хлорид кальция распадается на три иона (Ca 2+ , Cl – , Cl – ). Так, 0,1-молярный раствор хлорида кальция имеет самую низкую температуру замерзания.
При этом хлорид кальция распадается на три иона (Ca 2+ , Cl – , Cl – ). Так, 0,1-молярный раствор хлорида кальция имеет самую низкую температуру замерзания. Пример: Какой водный раствор имеет самую высокую температуру кипения?
- 0,1 M NaCl
- 0,1 м сахароза (C 12 H 22 O 11 )
- 0,1 M CACL 2
- 0,1 M ALCL 3
- 0,1 M ALCL 3 9000
9
- 0,1 м.0004 Решите эту задачу точно так же, как вопрос о понижении точки замерзания. Во-первых, убедитесь, что соединения растворимы в воде. Затем проверьте концентрацию растворов. При этом все четыре соединения растворимы и имеют одинаковые значения концентрации. Наконец, сравните количество частиц, выделяющихся при растворении каждого из соединений в воде. Сахароза растворяется, но не диссоциирует, поэтому она образует только одну частицу и оказывает наименьшее влияние на температуру кипения.
 NaCl образует две частицы, CaCl 2 образует три частицы, а AlCl 3 образует четыре частицы (Al 3+ , Cl – , Cl – , Cl – ). Раствор хлорида алюминия имеет самую высокую температуру кипения.
NaCl образует две частицы, CaCl 2 образует три частицы, а AlCl 3 образует четыре частицы (Al 3+ , Cl – , Cl – , Cl – ). Раствор хлорида алюминия имеет самую высокую температуру кипения. Ссылки
- Кастеллан, Гилберт В. (1983). Физическая химия (3-е изд.). Эддисон-Уэсли. ISBN 978-0201103861.
- ИЮПАК (1997). «Решение». Сборник химической терминологии («Золотая книга») (2-е изд.). Научные публикации Блэквелла. doi:10.1351/goldbook.S05746
- Маккуорри, Дональд; и другие. (2011). «Коллигативные свойства растворов». Общая химия . Милл-Вэлли: Библиотека Конгресса. ISBN 978-1-89138-960-3.
- Зумдал, Стивен С. (1997). Химия (4-е изд.). Бостон, Массачусетс: Компания Houghton Mifflin. стр. 133–145. ISBN
644.
страница не найдена — Williams College
’62 Центр театра и танца, ’62 Center Касса 597-2425 Магазин костюмов 597-3373 Менеджер мероприятий/помощник менеджера 597-4808 597-4815 факс Производство 597-4474 факс Магазин сцен 597-2439 ’68 Центр изучения карьеры, Мирс 597-2311 597-4078 факс Академические ресурсы, Парески 597-4672 597-4959 факс Служба поддержки инвалидов, Парески 597-4672 Приемная, Уэстон Холл 597-2211 597-4052 факс Позитивные действия, Хопкинс-холл 597-4376 Африканские исследования, Голландия 597-2242 597-4222 факс Американские исследования, Шапиро 597-2074 597-4620 факс Антропология и социология, Холландер 597-2076 597-4305 факс Архивы и специальные коллекции, Sawyer 597-4200 597-2929 факс Читальный зал 597-4200 Искусство (История, Студия), Spencer Studio Art/Lawrence 597-3578 597-3693 факс Архитектурная студия, Spencer Studio Art 597-3134 Студия фотографии, Spencer Studio Art 597-2030 Студия гравюры, Spencer Studio Art 597-2496 Скульптурная студия, Spencer Studio Art 597-3101 Senior Studio, Spencer Studio Art 597-3224 Студия видео/фото, Spencer Studio Art 597-3193 Азиатские исследования, Голландия 597-2391 597-3028 факс Астрономия/астрофизика, Физика Томпсона 597-2482 597-3200 факс Отделение легкой атлетики, физического воспитания, отдыха, Ласелл 597-2366 597-4272 факс Спортивный директор 597-3511 Лодочная пристань, озеро Онота 443-9851 Вагоны 597-2366 Фитнес-центр 597-3182 Хоккейный каток Ice Line, Lansing Chapman 597-2433 Очные занятия, Спортивный центр Чендлера 597-3321 Физкультура 597-2141 Wet Line, Спортивный центр Чандлера 597-2419 Информация о спорте, Хопкинс-холл 597-4982 597-4158 факс Спортивная медицина 597-2493 597-3052 факс Корты для сквоша 597-2485 Поле для гольфа Taconic 458-3997 Биохимия и молекулярная биология, Биология Томпсона 597-2126 Биоинформатика, геномика и протеомика, Бронфман 597-2124 Биология, Томпсон Биология 597-2126 597-3495 факс Безопасность и безопасность кампуса, Хопкинс-холл 597-4444 597-3512 факс Карты доступа/Системы сигнализации 597-4970/4033 Служба сопровождения, Хопкинс-холл 597-4400 Офицеры и диспетчеры 597-4444 Секретарь, удостоверения личности 597-4343 Распределительный щит 597-3131 Центр развития творческого сообщества, 66 Stetson Court 884-0093 Центр экономики развития, 1065 Main St 597-2148 597-4076 факс Компьютерный зал 597-2522 Вестибюль 597-4383 Центр экологических исследований, выпуск 1966 г. Экологический центр
Экологический центр 597-2346 597-3489 факс Лаборатория наук об окружающей среде, Морли 597-2380 Экологические исследования 597-2346 Лаборатория ГИС 597-3183 Центр иностранных языков, литературы и культуры, Голландия 597-2391 597-3028 факс Арабистика, Голландия 597-2391 597-3028 факс Сравнительная литература, Hollander 597-2391 Critical Languages, Hollander 597-2391 597-3028 факс Лингвистическая лаборатория 597-3260 русский, голландец 597-2391 Центр обучения в действии, Brooks House 597-4588 597-3090 факс Библиотека редких книг Чапина, Сойер 597-2462 597-2929 факс Читальный зал 597-4200 Офис капелланов, Парески 597-2483 597-3955 факс Еврейский религиозный центр, Stetson Court 24 597-2483 Мусульманская молитвенная комната, часовня Томпсона (нижний уровень) 597-2483 Католическая часовня Ньюмана, часовня Томпсона (нижний уровень) 597-2483 Химия, Химия Томпсона 597-2323 597-4150 факс Классика (греческая и латинская), голландская 597-2242 597-4222 факс Когнитивные науки, Бронфман 597-4594 College Marshal, Thompson Physics 597-2008 Связи с колледжами 597-4057 25-я программа воссоединения, Фогт 597-4208 597-4039 факс 50-я программа воссоединения, Фогт 597-4284 597-4039 факс Отдел продвижения, Мирс-Уэст 597-4154 597-4333 факс Мероприятия для выпускников, Vogt 597-4146 597-4548 факс Фонд выпускников 597-4153 597-4036 факс Отношения с выпускниками, Мирс-Уэст 597-4151 597-4178 факс Почтовые службы для выпускников и разработчиков, Mears West 597-4369 Девелопмент, Фогт 597-4256 Связи с донорами, Фогт 597-3234 597-4039 факс Отдел планирования подарков, Фогт 597-3538 597-4039 факс Отдел грантов, Мирс-Уэст 597-4025 597-4333 факс Программа крупных подарков, Vogt 597-4256 597-4548 факс Родительский фонд, Фогт 597-4357 597-4036 факс Prospect Management & Research, Mears 597-4119 597-4178 факс Начало и академические мероприятия, Jesup 597-2347 597-4435 факс Коммуникации, Хопкинс Холл 597-4277 597-4158 факс Спортивная информация, Хопкинс Холл 597-4982 597-4158 факс Веб-группа, Southworth Schoolhouse Williams Magazines (ранее Alumni Review), Hopkins Hall 597-4278 Информатика, Химия Томпсона 597-3218 597-4250 факс Конференции и мероприятия, Парески 597-2591 597-4748 факс Справки о домике на дереве вяза, ферма Маунт-Хоуп 597-2591 Офис контролера, Хопкинс-холл 597-4412 597-4404 факс Кредиторская задолженность и ввод данных, Hopkins Hall 597-4453 Касса и кассовые чеки, Hopkins Hall 597-4396 Финансовые информационные системы, Хопкинс-холл 597-4023 Карты покупок, Hopkins Hall 597-4413 Студенческие ссуды, Hopkins Hall 597-4683 Танец, ’62 Центр 597-2410 Центр Дэвиса (ранее Мультикультурный центр), Дженнесс 597-3340 597-3456 факс Харди Хаус 597-2129 Дом Дженнесс 597-3344 Райс Хаус 597-2453 Декан колледжа, Хопкинс-холл 597-4171 597-3507 факс Декан факультета, Хопкинс Холл 597-4351 597-3553 факс Обеденные услуги, капельницы 597-2121 597-4618 факс ’82 Гриль, Парески 597-4585 Пекарня, Парески 597-4511 Питание, Факультет 597-2452 Обеденный зал Дрисколла, Дрисколл 597-2238 Эко-кафе, Научный центр 597-2383 Grab ‘n Go, Парески 597-4398 Закусочная Lee, Парески 597-3487 Обеденный зал Mission Park, Mission Park 597-2281 Уитменс, Парески 597-2889 Экономика, Шапиро 597-2476 597-4045 факс английский, голландский 597-2114 597-4032 факс Объекты, Сервисное здание объектов 597-2301 Запрос автомобиля для колледжа 597-2302 Вечерние/выходные чрезвычайные ситуации 597-4444 Запросы на работу объектов 597-4141 факс Особые события 597-4020 Склад 597-2143 597-4013 факс Преподавательский клуб, Факультетский дом/Центр выпускников 597-2451 597-4722 факс Бронирование 597-3089 Офис стипендий, Хопкинс Холл 597-3044 597-3507 факс Финансовая помощь, Weston Hall 597-4181 597-2999 факс Геофизические науки, Кларк Холл 597-2221 597-4116 факс немецкий-русский, голландский 597-2391 597-3028 факс Глобальные исследования, Холландер 597-2247 Программа магистратуры по истории искусств, The Clark 458-2317 факс Health and Wellness Services, Thompson Ctr Health 597-2206 597-2982 факс Санитарное просвещение 597-3013 Услуги комплексного благополучия (консультации) 597-2353 Экстренные ситуации, угрожающие жизни Звоните 911 Медицинские услуги 597-2206 История, Холландер 597-2394 597-3673 факс История науки, Бронфман 597-4116 факс Хопкинс Форест 597-4353 Центр Розенбурга 458-3080 Отдел кадров, здание B&L 597-2681 597-3516 факс Услуги няни, B&L Building 597-4587 Преимущества 597-4355 Программа помощи сотрудникам 800-828-6025 Занятость 597-2681 Расчет заработной платы 597-4162 Ресурсы для супругов/партнеров 597-4587 Трудоустройство студентов 597-4568 Погодная линия (ICEY) 597-4239 Гуманитарные науки, Шапиро 597-2076 Информационные технологии, Джесуп 597-2094 597-4103 факс Пакеты для чтения курсов, почтовый ящик Office Services 597-4090 Центр кредитования оборудования, Додд, приложение 597-4091 Служба поддержки преподавателей/персонала, [email protected] 597-4090 Мультимедийные услуги и справка для занятий 597-2112 Служба поддержки студентов, [email protected] 597-3088 Телекоммуникации/телефоны 597-4090 Междисциплинарные исследования, Hollander 597-2552 Международное образование и обучение вне дома, Хопкинс-холл 597-4262 597-3507 факс Инвестиционный офис, Хопкинс-холл 597-4447 Офис в Бостоне 617-502-2400 617-426-5784 факс Еврейские исследования, Мазер 597-3539 Справедливость и право, Холландер 597-2102 Латиноамериканские исследования, Hollander 597-2242 597-4222 факс Исследования лидерства, Шапиро 597-2074 597-4620 факс Морские исследования, Бронфман 597-2297 Математика и статистика, Bascom 597-2438 597-4061 факс Музыка, Бернхард 597-2127 597-3100 факс Concertline (записанная информация) 597-3146 Неврология, Биология Томпсона 597-4107 597-2085 факс Центр Окли, Окли 597-2177 597-4126 факс Управление институционального разнообразия и справедливости, Хопкинс-холл 597-4376 597-4015 факс Студенческая бухгалтерия, Хопкинс Холл 597-4396 597-4404 факс Исследования производительности, ’62 Центр 597-4366 Философия, Шапиро 597-2074 597-4620 факс Физика, Физика Томпсона 597-2482 597-4116 факс Планетарий/Обсерватория Хопкинса 597-3030 Старый театр обсерватории Хопкинса 597-4828 Бронирование 597-2188 Политическая экономия, Шапиро 597-2327 Политология, Шапиро 597-2168 597-4194 факс Офис президента, Хопкинс-холл 597-4233 597-4015 факс Дом Президента 597-2388 597-4848 факс Услуги печати/почты для преподавателей/сотрудников, ’37 House 597-2022 Преподавательская программа, Бронфман 597-4522 597-2085 факс Офис проректора, Хопкинс-холл 597-4352 597-3553 факс Психология, психологические кабинеты и лаборатории 597-2441 597-2085 факс Недвижимость, здание B&L 597-2195/4238 597-5031 факс Ипотека преподавателей/сотрудников 597-4238 Преподаватели/сотрудники Арендное жилье 597-2195 ЗАГС, Хопкинс Холл 597-4286 597-4010 факс Религия, голландец 597-2076 597-4222 факс Романские языки, голландский 597-2391 597-3028 факс Планировщик помещений 597-2555 Соответствие требованиям безопасности и охраны окружающей среды, класс ’37 Дом 597-3003 Библиотека Сойера, Сойер 597-2501 597-4106 факс Услуги доступа 597-2501 Приобретение/Серийный номер 597-2506 Услуги каталогизации/метаданных 597-2507 Межбиблиотечный абонемент 597-2005 597-2478 факс Исследовательские и справочные услуги 597-2515 Стеллаж 597-4955 597-4948 факс Системы 597-2084 Научная библиотека Шоу, Научный центр 597-4500 597-4600 факс Научные и технологические исследования, Бронфман 597-2239 Научный центр, Бронфман 597-4116 факс Магазин электроники 597-2205 Машиностроительный/модельный цех 597-2230 Безопасность 597-4444 Специальные академические программы, Hardy 597-3747 597-4530 факс Информация о спорте, Хопкинс-холл 597-4982 597-4158 факс Студенческая жизнь, Парески 597-4747 Планировщик помещений 597-2555 Управление студенческими центрами 597-4191 Планирование студенческих мероприятий 597-2546 Студенческое общежитие, Парески 597-2555 Участие студентов 597-4749 Жилищные программы высшего класса 597-4625 Студенческая почтовая служба, Почта Парески 597-2150 Устойчивое развитие/Zilkha Center, Harper 597-4462 Коммутатор, Хопкинс Холл 597-3131 Книжный магазин Williams 458-8071 458-0249 факс Театр, 62 Центр 597-2342 597-4170 факс Управление траста и недвижимости, Sears House 597-4259 Учебники 597-2580 Вице-президент Campus Life, Хопкинс-холл 597-2044 597-3996 факс Вице-президент по связям с колледжами, Мирс 597-4057 597-4178 факс Вице-президент по финансам и администрации, Hopkins Hall 597-4421 597-4192 факс Центр визуальных ресурсов, Лоуренс 597-2015 597-3498 факс Детский центр колледжа Уильямс, Детский центр Уильямс 597-4008 597-4889 факс Художественный музей колледжа Уильямс (WCMA), Лоуренс 597-2429 597-5000 факс Подготовка музея 597-2426 Служба безопасности музея 597-2376 Музейный магазин 597-3233 Уильямс Интернэшнл 597-2161 Выездной клуб Williams, Парески 597-2317 Аппаратная/стол для учащихся 597-4784 Проект Уильямса по экономике высшего образования, Мирс-Уэст 597-2192 Уильямс Рекорд, Парески 597-2400 597-2450 факс Программа Williams-Exeter в Оксфорде, Оксфордский университет 011-44-1865-512345 Программа Williams-Mystic, Музей морского порта Mystic 860-572-5359 860-572-5329 факс Женские, гендерные и сексуальные исследования, Шапиро 597-3143 597-4620 факс Написание программ, Hopkins Hall 597-4615 Центр экологических инициатив Зилха, Харпер 597-4462
Измерение нитратов в почве для определения доступного для растений азота
Концентрация нитратов в почве является хорошим индикатором доступного для растений азота.
 Требуемый уровень нитратного азота в почве (NO 3 -N) для конкретных культур варьируется от культуры к культуре, но в целом желателен диапазон концентраций 10-50 мг/кг.
Требуемый уровень нитратного азота в почве (NO 3 -N) для конкретных культур варьируется от культуры к культуре, но в целом желателен диапазон концентраций 10-50 мг/кг.



 R.
R.
 5.0008. .
5.0008. .



 Водный раствор обозначается записью ( aq ) после химической формулы. Например, водный раствор соли (NaCl) в воде представляет собой NaCl ( водный раствор ) или Na+ ( водный раствор ) + Cl- ( водный раствор ). Напротив, раствор, в котором растворителем не является вода, называется неводным раствором .
Водный раствор обозначается записью ( aq ) после химической формулы. Например, водный раствор соли (NaCl) в воде представляет собой NaCl ( водный раствор ) или Na+ ( водный раствор ) + Cl- ( водный раствор ). Напротив, раствор, в котором растворителем не является вода, называется неводным раствором .Пример задач по химии водных растворов
Учащиеся сталкиваются с несколькими типами задач по химии, связанными с водными растворами. В основном это вопросы растворимости и коллигативных свойств.
В основном это вопросы растворимости и коллигативных свойств.
Пример: Какое растворенное вещество образует водный раствор?
- нитрат натрия (NaNO 3 )
- карбонат кальция (CaCO 3 )
- гидроксид серебра (AgOH)
- сульфид меди(I) 93 0 8 02652
Технически это не большой вопрос, потому что все ионные соединения образуют водные растворы, даже если они очень плохо растворимы. Это связано с тем, что ионные соединения, такие как вода, являются полярными молекулами. Но смысл такого вопроса в том, чтобы учащийся понял правила разрешимости. Исходя из этих правил, хорошо растворим в воде только нитрат натрия. Большинство карбонатов, гидроксидов и сульфидов нерастворимы, и эти соединения не являются исключением из правил.
Другие распространенные вопросы касаются коллигативных свойств. Коллигативные свойства, такие как снижение температуры замерзания и повышение точки кипения, зависят от количества растворенных в воде частиц.
 Чем больше соединение диссоциирует на ионы или чем выше его концентрация, тем выше температура кипения или понижения точки замерзания.
Чем больше соединение диссоциирует на ионы или чем выше его концентрация, тем выше температура кипения или понижения точки замерзания.Пример: Какой водный раствор имеет самую низкую температуру замерзания?
- 0,1 молярная мочевина (CH 4 N 2 O) раствор
- 0,1 молельная сахароза (C 12 H 22 O 11 ) Раствор
- 0,1 Молольный хлорид натрия (NaCl)
- 0,1 Молольный хлорид. соединений не имеет значения. Поскольку все растворы имеют одинаковую концентрацию, все, что вам нужно посмотреть, это то, на сколько частиц распадается каждая молекула в водном растворе. Мочевина и сахароза являются ковалентными соединениями, поэтому они растворяются в воде, но не диссоциируют на ионы. Вы знаете это, потому что соединения являются органическими. Это оставляет хлорид натрия и хлорид кальция. Оба этих соединения являются ионными и растворимы в воде. Они диссоциируют на свои ионы в водном растворе. Но хлорид натрия распадается только на два иона или частицы (Na + , Кл – ).
 При этом хлорид кальция распадается на три иона (Ca 2+ , Cl – , Cl – ). Так, 0,1-молярный раствор хлорида кальция имеет самую низкую температуру замерзания.
При этом хлорид кальция распадается на три иона (Ca 2+ , Cl – , Cl – ). Так, 0,1-молярный раствор хлорида кальция имеет самую низкую температуру замерзания.Пример: Какой водный раствор имеет самую высокую температуру кипения?
- 0,1 M NaCl
- 0,1 м сахароза (C 12 H 22 O 11 )
- 0,1 M CACL 2
- 0,1 M ALCL 3
- 0,1 M ALCL 3 9000 9
- 0,1 м.0004 Решите эту задачу точно так же, как вопрос о понижении точки замерзания. Во-первых, убедитесь, что соединения растворимы в воде. Затем проверьте концентрацию растворов. При этом все четыре соединения растворимы и имеют одинаковые значения концентрации. Наконец, сравните количество частиц, выделяющихся при растворении каждого из соединений в воде. Сахароза растворяется, но не диссоциирует, поэтому она образует только одну частицу и оказывает наименьшее влияние на температуру кипения.
 NaCl образует две частицы, CaCl 2 образует три частицы, а AlCl 3 образует четыре частицы (Al 3+ , Cl – , Cl – , Cl – ). Раствор хлорида алюминия имеет самую высокую температуру кипения.
NaCl образует две частицы, CaCl 2 образует три частицы, а AlCl 3 образует четыре частицы (Al 3+ , Cl – , Cl – , Cl – ). Раствор хлорида алюминия имеет самую высокую температуру кипения.Ссылки
- Кастеллан, Гилберт В. (1983). Физическая химия (3-е изд.). Эддисон-Уэсли. ISBN 978-0201103861.
- ИЮПАК (1997). «Решение». Сборник химической терминологии («Золотая книга») (2-е изд.). Научные публикации Блэквелла. doi:10.1351/goldbook.S05746
- Маккуорри, Дональд; и другие. (2011). «Коллигативные свойства растворов». Общая химия . Милл-Вэлли: Библиотека Конгресса. ISBN 978-1-89138-960-3.
- Зумдал, Стивен С. (1997). Химия (4-е изд.). Бостон, Массачусетс: Компания Houghton Mifflin. стр. 133–145. ISBN 644.
страница не найдена — Williams College
’62 Центр театра и танца, ’62 Center Касса 597-2425 Магазин костюмов 597-3373 Менеджер мероприятий/помощник менеджера 597-4808 597-4815 факс Производство 597-4474 факс Магазин сцен 597-2439 ’68 Центр изучения карьеры, Мирс 597-2311 597-4078 факс Академические ресурсы, Парески 597-4672 597-4959 факс Служба поддержки инвалидов, Парески 597-4672 Приемная, Уэстон Холл 597-2211 597-4052 факс Позитивные действия, Хопкинс-холл 597-4376 Африканские исследования, Голландия 597-2242 597-4222 факс Американские исследования, Шапиро 597-2074 597-4620 факс Антропология и социология, Холландер 597-2076 597-4305 факс Архивы и специальные коллекции, Sawyer 597-4200 597-2929 факс Читальный зал 597-4200 Искусство (История, Студия), Spencer Studio Art/Lawrence 597-3578 597-3693 факс Архитектурная студия, Spencer Studio Art 597-3134 Студия фотографии, Spencer Studio Art 597-2030 Студия гравюры, Spencer Studio Art 597-2496 Скульптурная студия, Spencer Studio Art 597-3101 Senior Studio, Spencer Studio Art 597-3224 Студия видео/фото, Spencer Studio Art 597-3193 Азиатские исследования, Голландия 597-2391 597-3028 факс Астрономия/астрофизика, Физика Томпсона 597-2482 597-3200 факс Отделение легкой атлетики, физического воспитания, отдыха, Ласелл 597-2366 597-4272 факс Спортивный директор 597-3511 Лодочная пристань, озеро Онота 443-9851 Вагоны 597-2366 Фитнес-центр 597-3182 Хоккейный каток Ice Line, Lansing Chapman 597-2433 Очные занятия, Спортивный центр Чендлера 597-3321 Физкультура 597-2141 Wet Line, Спортивный центр Чандлера 597-2419 Информация о спорте, Хопкинс-холл 597-4982 597-4158 факс Спортивная медицина 597-2493 597-3052 факс Корты для сквоша 597-2485 Поле для гольфа Taconic 458-3997 Биохимия и молекулярная биология, Биология Томпсона 597-2126 Биоинформатика, геномика и протеомика, Бронфман 597-2124 Биология, Томпсон Биология 597-2126 597-3495 факс Безопасность и безопасность кампуса, Хопкинс-холл 597-4444 597-3512 факс Карты доступа/Системы сигнализации 597-4970/4033 Служба сопровождения, Хопкинс-холл 597-4400 Офицеры и диспетчеры 597-4444 Секретарь, удостоверения личности 597-4343 Распределительный щит 597-3131 Центр развития творческого сообщества, 66 Stetson Court 884-0093 Центр экономики развития, 1065 Main St 597-2148 597-4076 факс Компьютерный зал 597-2522 Вестибюль 597-4383 Центр экологических исследований, выпуск 1966 г.  Экологический центр
Экологический центр597-2346 597-3489 факс Лаборатория наук об окружающей среде, Морли 597-2380 Экологические исследования 597-2346 Лаборатория ГИС 597-3183 Центр иностранных языков, литературы и культуры, Голландия 597-2391 597-3028 факс Арабистика, Голландия 597-2391 597-3028 факс Сравнительная литература, Hollander 597-2391 Critical Languages, Hollander 597-2391 597-3028 факс Лингвистическая лаборатория 597-3260 русский, голландец 597-2391 Центр обучения в действии, Brooks House 597-4588 597-3090 факс Библиотека редких книг Чапина, Сойер 597-2462 597-2929 факс Читальный зал 597-4200 Офис капелланов, Парески 597-2483 597-3955 факс Еврейский религиозный центр, Stetson Court 24 597-2483 Мусульманская молитвенная комната, часовня Томпсона (нижний уровень) 597-2483 Католическая часовня Ньюмана, часовня Томпсона (нижний уровень) 597-2483 Химия, Химия Томпсона 597-2323 597-4150 факс Классика (греческая и латинская), голландская 597-2242 597-4222 факс Когнитивные науки, Бронфман 597-4594 College Marshal, Thompson Physics 597-2008 Связи с колледжами 597-4057 25-я программа воссоединения, Фогт 597-4208 597-4039 факс 50-я программа воссоединения, Фогт 597-4284 597-4039 факс Отдел продвижения, Мирс-Уэст 597-4154 597-4333 факс Мероприятия для выпускников, Vogt 597-4146 597-4548 факс Фонд выпускников 597-4153 597-4036 факс Отношения с выпускниками, Мирс-Уэст 597-4151 597-4178 факс Почтовые службы для выпускников и разработчиков, Mears West 597-4369 Девелопмент, Фогт 597-4256 Связи с донорами, Фогт 597-3234 597-4039 факс Отдел планирования подарков, Фогт 597-3538 597-4039 факс Отдел грантов, Мирс-Уэст 597-4025 597-4333 факс Программа крупных подарков, Vogt 597-4256 597-4548 факс Родительский фонд, Фогт 597-4357 597-4036 факс Prospect Management & Research, Mears 597-4119 597-4178 факс Начало и академические мероприятия, Jesup 597-2347 597-4435 факс Коммуникации, Хопкинс Холл 597-4277 597-4158 факс Спортивная информация, Хопкинс Холл 597-4982 597-4158 факс Веб-группа, Southworth Schoolhouse Williams Magazines (ранее Alumni Review), Hopkins Hall 597-4278 Информатика, Химия Томпсона 597-3218 597-4250 факс Конференции и мероприятия, Парески 597-2591 597-4748 факс Справки о домике на дереве вяза, ферма Маунт-Хоуп 597-2591 Офис контролера, Хопкинс-холл 597-4412 597-4404 факс Кредиторская задолженность и ввод данных, Hopkins Hall 597-4453 Касса и кассовые чеки, Hopkins Hall 597-4396 Финансовые информационные системы, Хопкинс-холл 597-4023 Карты покупок, Hopkins Hall 597-4413 Студенческие ссуды, Hopkins Hall 597-4683 Танец, ’62 Центр 597-2410 Центр Дэвиса (ранее Мультикультурный центр), Дженнесс 597-3340 597-3456 факс Харди Хаус 597-2129 Дом Дженнесс 597-3344 Райс Хаус 597-2453 Декан колледжа, Хопкинс-холл 597-4171 597-3507 факс Декан факультета, Хопкинс Холл 597-4351 597-3553 факс Обеденные услуги, капельницы 597-2121 597-4618 факс ’82 Гриль, Парески 597-4585 Пекарня, Парески 597-4511 Питание, Факультет 597-2452 Обеденный зал Дрисколла, Дрисколл 597-2238 Эко-кафе, Научный центр 597-2383 Grab ‘n Go, Парески 597-4398 Закусочная Lee, Парески 597-3487 Обеденный зал Mission Park, Mission Park 597-2281 Уитменс, Парески 597-2889 Экономика, Шапиро 597-2476 597-4045 факс английский, голландский 597-2114 597-4032 факс Объекты, Сервисное здание объектов 597-2301 Запрос автомобиля для колледжа 597-2302 Вечерние/выходные чрезвычайные ситуации 597-4444 Запросы на работу объектов 597-4141 факс Особые события 597-4020 Склад 597-2143 597-4013 факс Преподавательский клуб, Факультетский дом/Центр выпускников 597-2451 597-4722 факс Бронирование 597-3089 Офис стипендий, Хопкинс Холл 597-3044 597-3507 факс Финансовая помощь, Weston Hall 597-4181 597-2999 факс Геофизические науки, Кларк Холл 597-2221 597-4116 факс немецкий-русский, голландский 597-2391 597-3028 факс Глобальные исследования, Холландер 597-2247 Программа магистратуры по истории искусств, The Clark 458-2317 факс Health and Wellness Services, Thompson Ctr Health 597-2206 597-2982 факс Санитарное просвещение 597-3013 Услуги комплексного благополучия (консультации) 597-2353 Экстренные ситуации, угрожающие жизни Звоните 911 Медицинские услуги 597-2206 История, Холландер 597-2394 597-3673 факс История науки, Бронфман 597-4116 факс Хопкинс Форест 597-4353 Центр Розенбурга 458-3080 Отдел кадров, здание B&L 597-2681 597-3516 факс Услуги няни, B&L Building 597-4587 Преимущества 597-4355 Программа помощи сотрудникам 800-828-6025 Занятость 597-2681 Расчет заработной платы 597-4162 Ресурсы для супругов/партнеров 597-4587 Трудоустройство студентов 597-4568 Погодная линия (ICEY) 597-4239 Гуманитарные науки, Шапиро 597-2076 Информационные технологии, Джесуп 597-2094 597-4103 факс Пакеты для чтения курсов, почтовый ящик Office Services 597-4090 Центр кредитования оборудования, Додд, приложение 597-4091 Служба поддержки преподавателей/персонала, [email protected] 597-4090 Мультимедийные услуги и справка для занятий 597-2112 Служба поддержки студентов, [email protected] 597-3088 Телекоммуникации/телефоны 597-4090 Междисциплинарные исследования, Hollander 597-2552 Международное образование и обучение вне дома, Хопкинс-холл 597-4262 597-3507 факс Инвестиционный офис, Хопкинс-холл 597-4447 Офис в Бостоне 617-502-2400 617-426-5784 факс Еврейские исследования, Мазер 597-3539 Справедливость и право, Холландер 597-2102 Латиноамериканские исследования, Hollander 597-2242 597-4222 факс Исследования лидерства, Шапиро 597-2074 597-4620 факс Морские исследования, Бронфман 597-2297 Математика и статистика, Bascom 597-2438 597-4061 факс Музыка, Бернхард 597-2127 597-3100 факс Concertline (записанная информация) 597-3146 Неврология, Биология Томпсона 597-4107 597-2085 факс Центр Окли, Окли 597-2177 597-4126 факс Управление институционального разнообразия и справедливости, Хопкинс-холл 597-4376 597-4015 факс Студенческая бухгалтерия, Хопкинс Холл 597-4396 597-4404 факс Исследования производительности, ’62 Центр 597-4366 Философия, Шапиро 597-2074 597-4620 факс Физика, Физика Томпсона 597-2482 597-4116 факс Планетарий/Обсерватория Хопкинса 597-3030 Старый театр обсерватории Хопкинса 597-4828 Бронирование 597-2188 Политическая экономия, Шапиро 597-2327 Политология, Шапиро 597-2168 597-4194 факс Офис президента, Хопкинс-холл 597-4233 597-4015 факс Дом Президента 597-2388 597-4848 факс Услуги печати/почты для преподавателей/сотрудников, ’37 House 597-2022 Преподавательская программа, Бронфман 597-4522 597-2085 факс Офис проректора, Хопкинс-холл 597-4352 597-3553 факс Психология, психологические кабинеты и лаборатории 597-2441 597-2085 факс Недвижимость, здание B&L 597-2195/4238 597-5031 факс Ипотека преподавателей/сотрудников 597-4238 Преподаватели/сотрудники Арендное жилье 597-2195 ЗАГС, Хопкинс Холл 597-4286 597-4010 факс Религия, голландец 597-2076 597-4222 факс Романские языки, голландский 597-2391 597-3028 факс Планировщик помещений 597-2555 Соответствие требованиям безопасности и охраны окружающей среды, класс ’37 Дом 597-3003 Библиотека Сойера, Сойер 597-2501 597-4106 факс Услуги доступа 597-2501 Приобретение/Серийный номер 597-2506 Услуги каталогизации/метаданных 597-2507 Межбиблиотечный абонемент 597-2005 597-2478 факс Исследовательские и справочные услуги 597-2515 Стеллаж 597-4955 597-4948 факс Системы 597-2084 Научная библиотека Шоу, Научный центр 597-4500 597-4600 факс Научные и технологические исследования, Бронфман 597-2239 Научный центр, Бронфман 597-4116 факс Магазин электроники 597-2205 Машиностроительный/модельный цех 597-2230 Безопасность 597-4444 Специальные академические программы, Hardy 597-3747 597-4530 факс Информация о спорте, Хопкинс-холл 597-4982 597-4158 факс Студенческая жизнь, Парески 597-4747 Планировщик помещений 597-2555 Управление студенческими центрами 597-4191 Планирование студенческих мероприятий 597-2546 Студенческое общежитие, Парески 597-2555 Участие студентов 597-4749 Жилищные программы высшего класса 597-4625 Студенческая почтовая служба, Почта Парески 597-2150 Устойчивое развитие/Zilkha Center, Harper 597-4462 Коммутатор, Хопкинс Холл 597-3131 Книжный магазин Williams 458-8071 458-0249 факс Театр, 62 Центр 597-2342 597-4170 факс Управление траста и недвижимости, Sears House 597-4259 Учебники 597-2580 Вице-президент Campus Life, Хопкинс-холл 597-2044 597-3996 факс Вице-президент по связям с колледжами, Мирс 597-4057 597-4178 факс Вице-президент по финансам и администрации, Hopkins Hall 597-4421 597-4192 факс Центр визуальных ресурсов, Лоуренс 597-2015 597-3498 факс Детский центр колледжа Уильямс, Детский центр Уильямс 597-4008 597-4889 факс Художественный музей колледжа Уильямс (WCMA), Лоуренс 597-2429 597-5000 факс Подготовка музея 597-2426 Служба безопасности музея 597-2376 Музейный магазин 597-3233 Уильямс Интернэшнл 597-2161 Выездной клуб Williams, Парески 597-2317 Аппаратная/стол для учащихся 597-4784 Проект Уильямса по экономике высшего образования, Мирс-Уэст 597-2192 Уильямс Рекорд, Парески 597-2400 597-2450 факс Программа Williams-Exeter в Оксфорде, Оксфордский университет 011-44-1865-512345 Программа Williams-Mystic, Музей морского порта Mystic 860-572-5359 860-572-5329 факс Женские, гендерные и сексуальные исследования, Шапиро 597-3143 597-4620 факс Написание программ, Hopkins Hall 597-4615 Центр экологических инициатив Зилха, Харпер 597-4462 Измерение нитратов в почве для определения доступного для растений азота
Концентрация нитратов в почве является хорошим индикатором доступного для растений азота.
 Требуемый уровень нитратного азота в почве (NO 3 -N) для конкретных культур варьируется от культуры к культуре, но в целом желателен диапазон концентраций 10-50 мг/кг.
Требуемый уровень нитратного азота в почве (NO 3 -N) для конкретных культур варьируется от культуры к культуре, но в целом желателен диапазон концентраций 10-50 мг/кг.
Введение
Анализ почвы на протяжении многих лет эффективно использовался для определения доступности питательных веществ для растений. Азот является одним из этих основных питательных веществ, который преобразуется в аминокислоты, а затем используется для производства необходимых ферментов и структурных частей растения.
Нитрат-ионометр LAQUAtwin можно использовать для измерения концентрации NO 3 -N в образцах почвы. Это простой в использовании карманный измеритель, который быстро дает результаты для тестирования на месте, что устраняет необходимость транспортировки образцов в лабораторию для колориметрического или хроматографического анализа, проводимого обученным аналитиком.
Метод
Сбор и подготовка проб
- Соберите сухие пробы почвы и просейте их через сито с размером ячеек 2 мм.

- Приготовьте почвенный экстракт, смешав почву и воду или экстрагент в соотношении 1:5 (например, 5 г почвы и 25 мл воды или экстрагента). Встряхните в течение 1 минуты. Дайте образцу отстояться в течение 5 минут или отфильтруйте его с помощью фильтровальной бумаги и воронки.
Калибровка
Калибровка нитрат-иономера LAQUAtwin с использованием двух NO 3 -N стандарты калибровки в соответствии с инструкциями производителя. Убедитесь, что единица измерения счетчика установлена на ppm NO 3 -N.
Измерение образца
- Капните несколько капель неиспользованной воды или экстрагента в датчик.
- Запишите показания как пустые. Бланк требуется только один раз для каждой партии образцов.
- Промойте датчик водой и промокните его насухо салфеткой.
- Поместите несколько капель прозрачной жидкости, взятой из верхнего слоя экстракта почвы (или фильтрата, если образец фильтруется).
- Запишите показания после стабилизации.

- После каждого образца промойте датчик водой и промокните его насухо салфеткой.
Результаты и выгоды
Чтобы выразить результаты в NO 3 -N мг/кг в почве, используйте формулу: NO 3 -N мг/кг в почве = (чтение экстракта почвы — пустой метод ) ppm NO 3 -N × 5. Если в экстракте почвы используется другое соотношение, замените «5» соответствующим соотношением.
Нитрат-азот (NO 3 -N) измеряет количество доступного азота в почве, которое может быть немедленно поглощено растениями. Количество, необходимое в почве для конкретных культур, варьируется от культуры к культуре, но в целом уровни не должны опускаться ниже 10 мг/кг и не должны превышать 50 мг/кг. Тем не менее, нитраты варьируются в зависимости от почвенной воды, поэтому уровни могут сильно колебаться в зависимости от движения почвенной воды.
Рисунок 1: Руководство по интерпретации значений содержания нитратов и азота в почвах (Источник: Здоровье почвы для выращивания овощей в Австралии — Часть 4)
Чтобы определить количество азотных удобрений, необходимых для удовлетворения потребностей сельскохозяйственных культур, концентрация NO 3 -N вычитается из потребности сельскохозяйственных культур в азоте.
Дополнительная информация
- Почва. Влажные образцы необходимо высушить на воздухе, разложив тонкий слой почвы на пластиковом листе под солнцем. Это делается для того, чтобы исключить влияние влажности почвы. Образцы, содержащие слишком много глины, необходимо будет измельчить.
- Экстрагент. Для извлечения нитратов из большинства почв можно использовать воду или разбавленные растворы солей, поскольку почти все нитраты в почвах с низкой способностью к анионному обмену растворимы в воде. Основным недостатком воды является ее низкая ионная сила, которая может вызвать диспергирование и привести к мутным фильтратам. Экстрагенты, содержащие хлорид, вызывают проблемы при измерении NO 3 -N с помощью ионной хроматографии или ионоселективного электрода, поскольку хлорид может мешать анализу NO 3 -N этими методами. 0,04 М сульфат аммония (NH 4 ) 2 SO 4 является предпочтительным экстрагентом для электрода, селективного к нитратам (Griffin et al.
 , 1995). Другие экстрагенты включают 0,025 мл. AL 2 (так 4 ) 3 , 1% KAL (SO 4 ) 2 , 0,025M AL 2 (SO 4 ) 3 — 0,025M. Ag 2 SO 4 – 0,005M H 3 BO 3 (pH 3), 0,01M CuSO 4 , 0,2% или насыщенный CaSO 4 , 0,01 М цитрата натрия и 0,05 М K 2 SO 4 (Thomas, 1986).
, 1995). Другие экстрагенты включают 0,025 мл. AL 2 (так 4 ) 3 , 1% KAL (SO 4 ) 2 , 0,025M AL 2 (SO 4 ) 3 — 0,025M. Ag 2 SO 4 – 0,005M H 3 BO 3 (pH 3), 0,01M CuSO 4 , 0,2% или насыщенный CaSO 4 , 0,01 М цитрата натрия и 0,05 М K 2 SO 4 (Thomas, 1986). - Стандарт нитратов – проверьте концентрацию NO 3 -N, указанную на этикетке стандарта нитратов при калибровке NO 3 -N (например, 150 частей на миллион NO 3 — стандарт составляет 34 части на миллион NO
7 8 -N ).
- Единица измерения – Нитратометр может быть настроен на ppm (эквивалентно мг/л) NO 3 — или NO 3 -N. Обратитесь к руководству по измерительному прибору для настройки единицы измерения. Если единица измерения счетчика установлена на ppm NO 3 -N и 150 ppm NO 3 — Стандарт помещается на сенсор, 34 ppm NO 3 -N показание будет отображаться во время калибровки.


