Общая характеристика металлов | Подготовка к ЦТ и ЕГЭ по химии
20 Янв
Posted on Author admin 0
Чтобы поделиться, нажимайте
В природе металлы существуют как в свободном, так и в связанном виде. В свободном виде существуют малоактивные металлы: платина, золото, серебро. Но в основном металлы встречаются в виде различных соединений. Многие металлы способны реагировать друг с другом. Продукты взаимодействия металлов между собой называются сплавами.
Атомы металлов имеют небольшое число валентных электронов. Они слабо связаны с ядром и могут легко отрываться от него. В результате в узлах кристаллической решетки появляются положительно заряженные ионы, а между ними свободно перемещаются электроны – образуется так называемый «электронный газ». Вид связи между положительными ионами, осуществляемой за счет притяжения электронов, свободно перемещающихся по кристаллу, называется металлической.
Металлы имеют многие специфические свойства. Все они, за исключением ртути, при обычных условиях твердые вещества с характерным блеском, хорошо проводят электрический ток и тепло. Большинство металлов может коваться, тянуться и прокатываться. Электро- и теплопроводность металла объясняются наличием в нем свободных электронов.
Металлы делятся на легкие и тяжелые, отличаются друг от друга по твердости: самые мягкие – щелочные, их можно резать ножом; самый твердый – хром. Металлы делятся на легкоплавкие и тугоплавкие. В металлургии металлы делят на черные (железо, марганец, хром) и цветные (все остальные металлы).
Металлы всегда выступают в роли восстановителей. Способность отдавать электроны проявляется у металлов в разной степени. Чем легче металл отдает электроны, тем он активнее и тем более энергично взаимодействует с неметаллами и ионами других металлов. По активности все металлы располагаются в определенной последовательности, образуя электрохимический ряд напряжений.
Практически все металлы имеют сравнительно большие радиусы и малое число электронов (от 1 до 3) на внешнем энергетическом уровне. Для металлов характерны низкие значения электроотрицательности и восстановительные свойства.
Наиболее типичные металлы расположены в начале периодов (начиная со второго), далее слева направо металлические свойства ослабевают. В группе сверху вниз металлические свойства усиливаются, т.к увеличивается радиус атомов (за счет увеличения числа энергетических уровней). Это приводит к уменьшению электроотрицательности (способности притягивать электроны) элементов и усилению восстановительных свойств (способность отдавать электроны другим атомам в химических реакциях).
Типичными металлами являются s-элементы (элементы IА-группы от Li до Fr. элементы ПА-группы от Мg до Rа). Общая электронная формула их атомов ns
Небольшое число электронов (1-2) на внешнем энергетическом уровне атомов типичных металлов предполагает легкую потерю этих электронов и проявление сильных восстановительных свойств, что отражают низкие значения электроотрицательности. Отсюда вытекает ограниченность химических свойств и способов получения типичных металлов.
Отсюда вытекает ограниченность химических свойств и способов получения типичных металлов.
Характерной особенностью типичных металлов является стремление их атомов образовывать катионы и ионные химические связи с атомами неметаллов. Соединения типичных металлов с неметаллами – это ионные кристаллы «катион металлаанион неметалла», например К+ Вг–, Сa2+ О2-. Катионы типичных металлов входят также в состав соединений со сложными анионами – гидроксидов и солей, например Мg 2+(OН–)2, (Li+)2СO32-.
Металлы А-групп, образующие диагональ амфотерности в Периодической системе Ве-Аl-Gе-Sb-Ро, а также примыкающие к ним металлы (Gа, In, Тl, Sn, Рb, Вi) не проявляют типично металлических свойств. Общая электронная формула их атомов ns2np0-4 предполагает большее разнообразие степеней окисления, большую способность удерживать собственные электроны, постепенное понижение их восстановительной способности и появление окислительной способности, особенно в высоких степенях окисления (характерные примеры – соединения Тl III, РbIV, Вiv). Подобное химическое поведение характерно и для большинства (d-элементов, т. е. элементов Б-групп Периодической системы (типичные примеры – амфотерные элементы Сr и Zn).
Подобное химическое поведение характерно и для большинства (d-элементов, т. е. элементов Б-групп Периодической системы (типичные примеры – амфотерные элементы Сr и Zn).
Это проявление двойственности (амфотерности) свойств, одновременно металлических (основных) и неметаллических, обусловлено характером химической связи. В твердом состоянии соединения нетипичных металлов с неметаллами содержат преимущественно ковалентные связи (но менее прочные, чем связи между неметаллами). В растворе эти связи легко разрываются, а соединения диссоциируют на ионы (полностью или частично). Например, металл галлий состоит из молекул Ga2, в твердом состоянии хлориды алюминия и ртути (II) АlСl3 и НgСl2 содержат сильно ковалентные связи, но в растворе АlСl3 диссоциирует почти полностью, а НgСl2 – в очень малой степени (да и то на ионы НgСl+ и Сl–).
ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ И НЕМЕТАЛЛОВ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ОБРАЗОВАНИЯ
Государственный Педагогический Университет
РЕФЕРАТ
ОБЩАЯ ХАРАКТЕРИСТИКА
МЕТАЛЛОВ И НЕМЕТАЛЛОВ
Выполнил студент группы
Педагогическое образование (с двумя профильными подготовками)
География.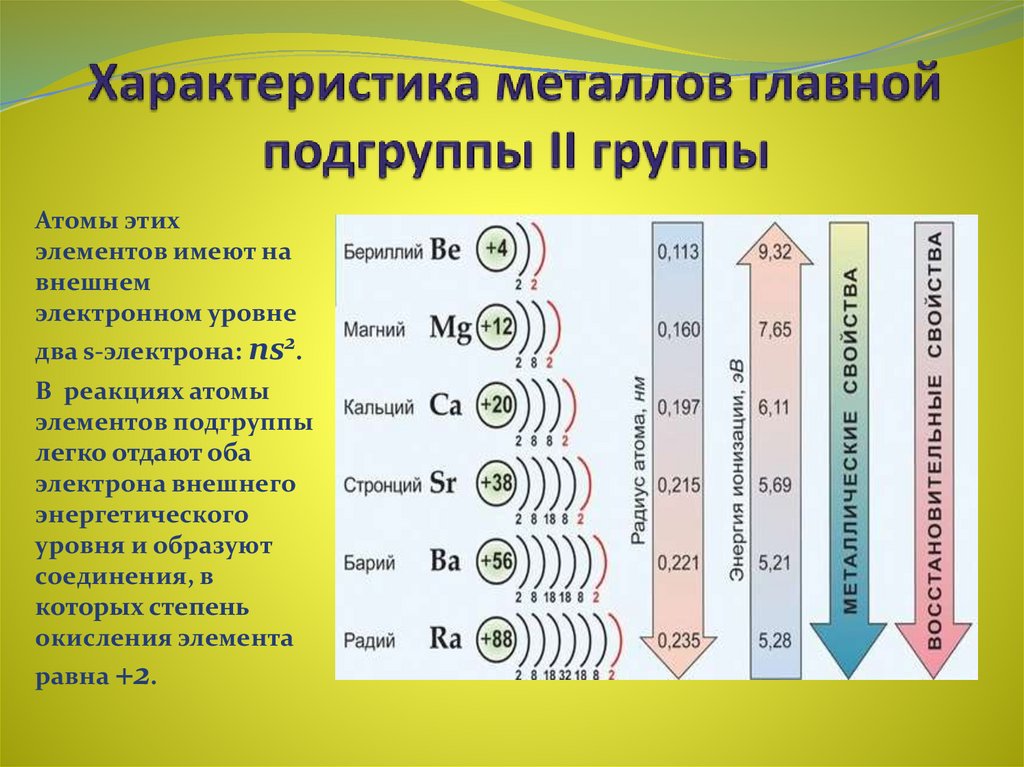 Биология
Биология
2021
СОДЕРЖАНИЕ
ВВЕДЕНИЕ 2
ГЛАВА I. МЕТАЛЛЫ 3
1.1. Металлы в периодической системе. Группы металлов 3
1.2. Физические свойства металлов 3
1.3. Химические свойства металлов 4
1.4. Коррозия металлов 5
2. ГЛАВА II. НЕМЕТАЛЛЫ 6
2.1. Физические свойства 6
2.2. Общие химические свойства неметаллов 7
2.3. Строение и свойства простых веществ – неметаллов 7
2.4. Кислородные и водородные соединения неметаллов.
Краткая характеристика их свойств 8
ВЫВОДЫ 10
СПИСОК ЛИТЕРАТУРЫ 11
ВВЕДЕНИЕ
Все многообразие окружающей нас природы состоит из сочетаний сравнительно небольшого числа химических элементов.
В различные исторические эпохи в понятие «элемент» вкладывался различный смысл. Древнегреческие философы в качестве «элементов» рассматривали четыре «стихии» – тепло, холод, сухость и влажность. Сочетаясь попарно, они образовывали четыре «начала» всех вещей – огонь, воздух, воду и землю. В средние века к этим началам добавились соль, сера и ртуть. В XVII веке Р. Бойль указал на то, что все элементы носят материальный характер и их число может быть достаточно велико.
Сочетаясь попарно, они образовывали четыре «начала» всех вещей – огонь, воздух, воду и землю. В средние века к этим началам добавились соль, сера и ртуть. В XVII веке Р. Бойль указал на то, что все элементы носят материальный характер и их число может быть достаточно велико.
В 1787 году французский химик А. Лавуазье создал «Таблицу простых тел». В нее вошли все известные к тому времени элементы. Под последними понимались простые тела, которые не удавалось разложить химическими методами на еще более простые. Впоследствии выяснилось, что в таблицу вошли и некоторые сложные вещества.
В настоящее время понятие «химический элемент» установлено точно.
Химический элемент – вид атомов с одинаковым положительным зарядом ядра. (Последний равен порядковому номеру элемента в таблице Менделеева.)
В настоящее время известно 107 элементов. Около 90 из них существуют в природе. Остальные получены искусственно с помощью ядерных реакций. 104-107 элементы были синтезированы учеными — физиками в Объединенном институте ядерных исследований в городе Дубне. В настоящее время продолжаются работы по искусственному получению химических элементов с более высокими порядковыми элементами.
В настоящее время продолжаются работы по искусственному получению химических элементов с более высокими порядковыми элементами.
Все элементы делятся на металлы и неметаллы. Из 107 элементов 85 относятся к металлам. Однако это деление условное. При определенных условиях некоторые металлы могут проявлять неметаллические свойства, а некоторые неметаллы – металлические свойства.
ГЛАВА I. МЕТАЛЛЫ
1.1. Строение атомов металлов. Положение металлов в периодическойсистеме. Группы металлов.
Причисляя тот или иной элемент к разряду металлов, мы имеем в виду наличие у него определенного комплекса свойств: Плотная кристаллическая структура, характерный металлический блеск, высокая теплопроводность и электрическая проводимость, уменьшение электрической проводимости с ростом температуры, низкие значения потенциала ионизации, т.е. способность легко отдавать электроны, ковкость и тягучесть, способность к образованию сплавов.
Все металлы и сплавы, применяемые в настоящее время в технике, можно разделить на две основные группы. К первой из них относят черные металлы — железо и все его сплавы, в которых оно составляет основную часть. Этими сплавами являются чугуны и стали.
К первой из них относят черные металлы — железо и все его сплавы, в которых оно составляет основную часть. Этими сплавами являются чугуны и стали.
Ко второй группе относят цветные металлы и их сплавы. Они получили такое название потому, что имеют различную окраску.
Это деление на черные и цветные металлы условно.
Наряду с черными и цветными металлами выделяют еще группу благородных металлов: серебро, золото, платину, рутений и некоторые другие. Они названы так потому, что практически не окисляются на воздухе.
1. 2. Физические свойства металлов.
Очень важным свойством металлов является их сравнительно легкая механическая деформируемость. Металлы пластичны, они хорошо куются, вытягиваются в проволоку, прокатываются в листы и т.п.
По плотности металлы условно подразделяются на две большие группы: легкие металлы, плотность которых не больше 5 г/см3, и тяжелые металлы — все остальные.
Частицы металлов, находящихся в твердом и жидком состоянии, связаны особым типом химической связи — так называемой металлической связью.
1.3.Химические свойства металлов.
Основным химическим свойством металлов является способность их атомов легко отдавать свои валентные электроны и переходить в положительно заряженные ионы. Типичные металлы никогда не присоединяют электронов; их ионы всегда заряжены положительно.
Легко отдавая при химических реакциях свои валентные электроны, типичные металлы являются энергичными восстановителями.
Проведем опыт — опустим кусочек цинка в раствор какой — нибудь свинцовой соли. Цинк начинает растворяться, а из раствора выделяется свинец.
Реакция выражается уравнением: Zn + Pb(NO3)2 = Pb + Zn(NO3)2
Из уравнения следует, что эта реакция является типичной реакцией окисления — восстановления. Сущность ее сводится к тому, что атомы цинка отдают свои валентные электроны ионам двухвалентного свинца, тем самым превращаясь в ионы цинка, а ионы свинца восстанавливаются и выделяются в виде металлического свинца.
Вытеснение одних металлов из их соединений другими металлами впервые было подробно изучено русским ученым Бекетовым, расположившим металлы по их убывающей химической активности в так называемый «вытеснительный ряд». В настоящее время вытеснительный ряд Бекетова носит название ряда напряжений.
Ряд напряжений характеризует химические свойства металлов:
1. Чем меньше электродный потенциал металла, тем больше его восстановительная способность.
2. Каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые стоят в ряду напряжений после него.
3. Все металлы, имеющие отрицательный стандартный электродный потенциал, то есть находящиеся в ряду напряжений левее водорода, способны вытеснять его из растворов кислот.
Необходимо отметить, что представленный ряд характеризует поведение металлов и их солей только в водных растворах и при комнатной температуре.
1.4. Коррозия металлов.
Почти все металлы, приходя в соприкосновение с окружающей их газообразной или жидкой средой, более или менее быстро подвергаются с поверхности разрушению. Всякий процесс химического разрушения металлов под действием окружающей среды называют коррозией.
Всякий процесс химического разрушения металлов под действием окружающей среды называют коррозией.
Проще всего протекает коррозия при соприкосновении металлов с газами. Иначе обстоит дело при соприкосновении металла с жидкой средой — водой и растворенными в ней веществами. Образующиеся при этом соединения могут растворяться, благодаря чему коррозия распространяется дальше вглубь металла.
Чистые металлы в большинстве случаев почти не подвергаются коррозии. Даже такой металл, как железо, в совершенно чистом виде почти не ржавеет.
Убытки, причиняемые коррозией металлов, огромны. Вычислено, например, что вследствие коррозии ежегодно гибнет такое количество стали, которое равно приблизительно четверти всей мировой добычи его за год. Поэтому изучению процессов коррозии и отысканию наилучших средств ее предотвращения уделяется очень много внимания.
ГЛАВА II. НЕМЕТАЛЛЫ
2.1. Положение неметаллических элементов в периодической системе химических элементов.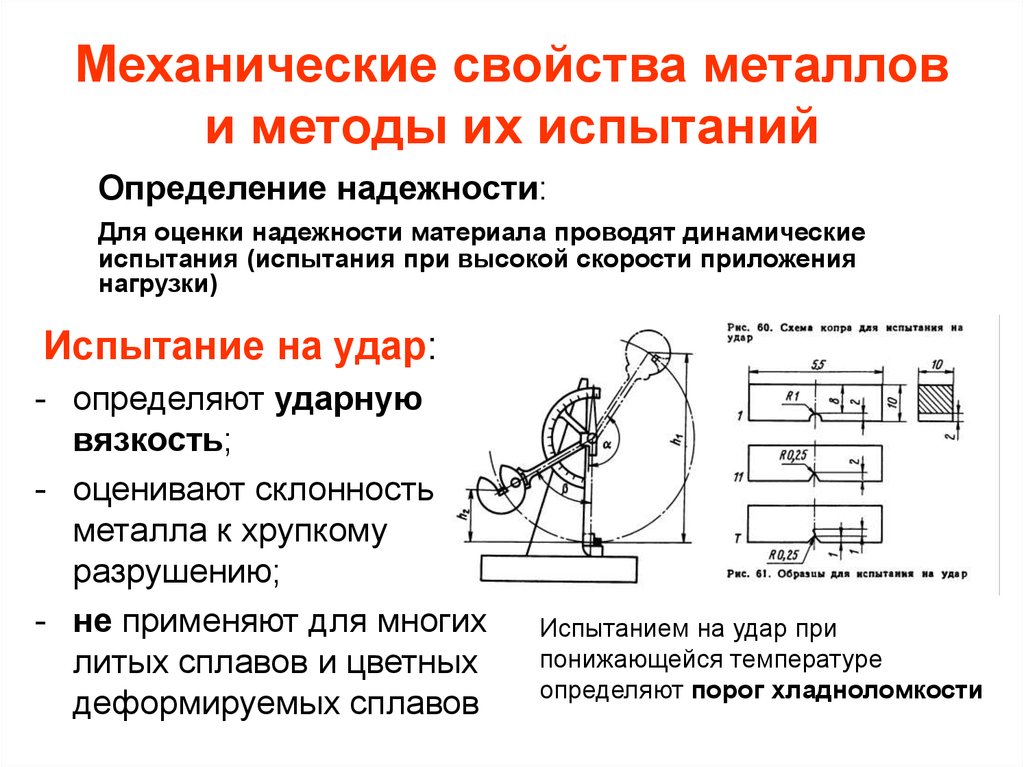 Нахождение в природе. Общие химический и
Нахождение в природе. Общие химический и
физические свойства.
Неметаллических элементов по сравнению к металлическими элементами относительно немного. Их размещение в периодической системе химических элементов Д.И. Менделеева отражено в таблице №1.
расположены в правой верхней части периодической системы. В связи с этим у неметаллов преобладают окислительные свойства. Особенно сильные окислительные свойства, т.е. способность присоединять электроны, проявляют неметаллы, находящиеся во 2-ом и 3-м периодах VI-VII групп. Самым сильным окислителем является фтор. В соответствии с численными значениями относительных электроотрицательностей окислительные способности неметаллов увеличивается в следующем порядке:
Si, B, H, P, C, S, I, N, Cl, O, F.
Фтор — самый типичный неметалл, которому нехарактерны восстановительные свойства, т.е. способность отдавать электроны в химических реакциях.
Кислород же, судя по его соединениям с фтором, может проявлять и положительную степень окисления, т. е. являться восстановителем.
е. являться восстановителем.
Все остальные неметаллы проявляют восстановительные свойства.
Перейдем к рассмотрению строения молекул неметаллов. Неметаллы образуют как одноатомные, так и двухатомные молекулы.
К одноатомным неметаллам относятся инертные газы, практически не реагирующие даже с самыми активными веществами.
Некоторые неметаллы образуют двухатомные молекулы. Это h4, F2, Cl2, Br2, I2 (элементы VII группы Периодической системы), а также кислород O2 и азот N2. Из трехатомных молекул состоит газ озон (O3).
Неметаллы в виде простых тел находятся в твердом или газообразном состоянии (исключая бром — жидкость). Они не имеют физических свойств, присущих металлам. Твердые неметаллы не обладают характерным для металлов блеском, они обычно хрупки, плохо проводят электрический ток и тепло (за исключением графита).
2.2. Общие химические свойства неметаллов.
С водородом неметаллы образуют летучие соединения, как, например, фтороводород HF, сероводород h4S, аммиак Nh5, метан CH5. При растворении в воде водородные соединения галогенов, серы, селена и теллура образуют кислоты той же формулы, что и сами водородные соединения: HF, HCl, HCl, HBr, HI, h4S, h4Se, h4Te.
При растворении в воде водородные соединения галогенов, серы, селена и теллура образуют кислоты той же формулы, что и сами водородные соединения: HF, HCl, HCl, HBr, HI, h4S, h4Se, h4Te.
С кислородом неметаллы образуют кислотные оксиды. В одних оксидах они проявляют максимальную степень окисления, равную номеру группы (например, SO2, N2O5), а других — более низкую (например, SO2, N2O3).
2.3. Строение и свойства простых веществ — неметаллов.
Самые типичные неметаллы имеют молекулярное строение, а менее типичные — немолекулярное. Этим и объясняется отличие их свойств.
Наглядно это отражено в схеме №2.
Простые вещества |
| |
С немолекулярным строением | С молекулярным строением | |
C, B, Si | F2, O2, Cl2, Br2, N2, I2, S8 | |
У этих неметаллов атомные кристаллические решетки, поэтому они обладают большой твердостью и очень высокими температурами плавления. | У этих неметаллов в твердом состоянии молекулярные кристаллические решетки. При обычных условиях это газы, жидкости или твердые вещества с низкими температурами плавления. | |
Кристаллический бор В (как и кристаллический кремний) обладает | ||
очень высокой температурой плавления (2075°С) и большой твердостью. Электрическая проводимость бора с повышением температуры сильно увеличивается, что дает возможность широко применять его в полупроводниковой технике. Добавка бора к стали и к сплавам алюминия, меди, никеля и др. улучшает их механические свойства.
Как видно из схемы №2, углерод С, кремний Si, бор В имеют сходное строение и обладают некоторыми общими свойствами.
2.4. Кислородные и водородные соединения неметаллов. Краткая характеристика их свойств.
С кислородом неметаллы образуют кислотные оксиды. В одних оксидах они проявляют максимальную степень окисления, равную номеру группы (например, SO2, N2O5), а других — более низкую (например, SO2, N2O3).
Характеристики кислородных соединений неметаллов:
1. Свойства высших оксидов (т.е. оксидов, в состав которых входит элемент данной группы с высшей степенью окисления) в периодах слева направо постепенно изменяются от основных к кислотным.
2. В группах сверху вниз кислотные свойства высших оксидов постепенно ослабевают. Об этом можно судить по свойствам кислот, соответствующих этим оксидам.
3. Возрастание кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов.
4. В главных подгруппах периодической системы химических элементов в направлении сверху вниз кислотные свойства высших оксидов неметаллов уменьшаются.
С металлами водород образует (за некоторым исключением) нелетучие соединения, которые являются твердыми веществами немолекулярного строения. Поэтому их температуры плавления сравнительно высоки.
С неметаллами водород образует летучие соединения молекулярного строения. В обычных условиях это газы или летучие жидкости.
В обычных условиях это газы или летучие жидкости.
ВЫВОДЫ
1. В периодах слева направо у ионов элементов положительный заряд увеличивается. В связи с этим кислотные свойства летучих водородных соединений элементов в водных растворах усиливаются.
2. В группах сверху вниз отрицательно заряженные анионы все слабее притягивают положительно заряженные ионы водорода Н+. В связи с этим облегчается процесс отщепления ионов водорода Н+ и кислотные свойства водородных соединений увеличиваются.
3. Водородные соединения неметаллов, обладающие в водных растворах кислотными свойствами, реагируют со щелочами. Водородные же соединения неметаллов, обладающие в водных растворах основными свойствами, реагируют с кислотами.
4. Окислительная активность водородных соединений неметаллов в группах сверху вниз сильно увеличивается. Например, окислить фтор из водородного соединения HF химическим путем нельзя, окислить же хлор из водородного соединения HCl можно различными окислителями. Это объясняется тем, что в группах сверху вниз резко возрастают атомные радиусы, в связи с чем отдача электронов облегчается.
Это объясняется тем, что в группах сверху вниз резко возрастают атомные радиусы, в связи с чем отдача электронов облегчается.
СПИСОК ЛИТЕРАТУРЫ:
1. Рудзитис Г.Е., Фельдман Ф.Г. Химия-11 – М.: Просвещение, 1992.
2. Кременчугская М., Васильев С. Справочник школьника – М.: АСТ, 1999.
3. Хомченко Г.П. Химия для поступающих в ВУЗы – М.: Высшая школа, 1993.
4. «Основы общей химии». Ю.Д.Третьяков, Ю.Г. Метлин. Москва «Просвещение» 1980.
5. «Общая химия». Н.Л.Глинка. Издательство «Химия», Ленинградское отделение 1972.
Характеристики металлов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53333
Развитие навыков
- Перечислите и объясните свойства металлов
Помните, что металлы находятся слева и внизу периодической таблицы. Основываясь на периодических тенденциях в последних трех разделах, это означает, что они обычно больше, с большей вероятностью теряют электроны и с меньшей вероятностью приобретают электроны, чем неметаллы.
Основываясь на периодических тенденциях в последних трех разделах, это означает, что они обычно больше, с большей вероятностью теряют электроны и с меньшей вероятностью приобретают электроны, чем неметаллы.
Элементарные свойства
В элементарной форме металлы обычно блестят, их можно сгибать или растягивать, они проводят тепло и электричество. Это связано с тем, что металлы слабо удерживают свои валентные электроны из-за низкого IE. Общая закономерность заключается в том, что чем ближе атом к электронной конфигурации благородного газа, тем меньше связей он образует. Металлы далеки от конфигурации благородных газов, поэтому они обычно образуют связи со многими соседями. Таким образом, они имеют структуры, в которых каждый атом касается многих соседей (иногда 6, обычно 8 или 12). Поскольку у них не очень много электронов, валентные электроны являются общими для многих атомов в «делокализованном океане» электронов, которые на самом деле не связаны с конкретными атомами. Эти «свободно плавающие» электроны позволяют металлу проводить тепло и электричество. Кроме того, поскольку связи в металле не направлены прямо от атома к атому, их нелегко разорвать. Это означает, что металлы можно сгибать и растягивать. Технические слова податливы (можно растолочь в фольгу) и пластичны (можно растянуть в проволоку). Море валентных электронов позволяет ядрам толкаться, не разделяясь. Однако я не думаю, что есть простое объяснение тому, почему металлы блестят.
Эти «свободно плавающие» электроны позволяют металлу проводить тепло и электричество. Кроме того, поскольку связи в металле не направлены прямо от атома к атому, их нелегко разорвать. Это означает, что металлы можно сгибать и растягивать. Технические слова податливы (можно растолочь в фольгу) и пластичны (можно растянуть в проволоку). Море валентных электронов позволяет ядрам толкаться, не разделяясь. Однако я не думаю, что есть простое объяснение тому, почему металлы блестят.
Модели реакций
Металлы могут смешиваться друг с другом, образуя сплавы, подобные элементарным металлам. Когда они реагируют с неметаллами, они обычно теряют электроны с образованием катионов. Затем катионы притягиваются к анионам, поэтому в результате образуются ионные или своего рода ионные соединения. Чем легче металлу терять электроны, тем более он реакционноспособен. Если вы еще этого не сделали, посмотрите это видео о реакционной способности щелочных металлов. Металлы справа, которые имеют большую энергию ионизации, образуют больше ковалентных соединений с неметаллами, с большим количеством электронов и меньшим электростатическим притяжением. Эти металлы также более гибки в отношении того, какой у них ионный заряд. Узнайте, почему, зайдя в Ptable и наблюдая, как фиолетовый цвет перемещается прямо по мере того, как вы переходите из IE 9.от 0038 1 до IE 4 или выше. Переходные металлы остаются зелеными: они не совершают резкого скачка до гораздо более высокого IE.
Эти металлы также более гибки в отношении того, какой у них ионный заряд. Узнайте, почему, зайдя в Ptable и наблюдая, как фиолетовый цвет перемещается прямо по мере того, как вы переходите из IE 9.от 0038 1 до IE 4 или выше. Переходные металлы остаются зелеными: они не совершают резкого скачка до гораздо более высокого IE.
Авторы и авторство
Characteristics of Metals распространяется по лицензии CC BY, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- СС BY
- Показать страницу TOC
- № на стр.

- Теги
- Элементарные свойства
- Эмили В Имс
- Модели реакции
ПОНИМАНИЕ СВОЙСТВ МЕТАЛЛОВ
Металлы окружают нас повсюду, в вещах, которые мы используем для приготовления пищи, вождения, работы и жизни. При выборе металла для литого изделия или другого конкретного применения важно убедиться, что его свойства будут соответствовать ожидаемым условиям эксплуатации.
Существует большая разница между металлом, используемым в небоскребе, и металлом, используемым в задвижке. Некоторые металлы представляют собой чистые элементы, такие как железо (Fe) и алюминий (Al), но большинство изделий изготавливаются из сплавов или смесей металлов. Производители должны учитывать множество переменных, прежде чем решить, какой сплав использовать для конкретного продукта.
Факторы, влияющие на выбор подходящего металлического сплава, включают:
- Структура,
- Недвижимость,
- Обработка,
- Производительность, а также взаимосвязь между этими четырьмя факторами.
Механические свойства, физические свойства и химические свойства
В основном способы различения металлов можно разделить на три категории: механические свойства , физические свойства и химические свойства.
Физические свойства относятся к наблюдаемым характеристикам материала. Примеры физических свойств включают цвет, температуру плавления и плотность. Механические свойства описывают, как материал реагирует на внешние силы, такие как толкание, растяжение или скручивание. Прочность, твердость и эластичность являются примерами механических свойств.
Химические свойства объясняют, как материал взаимодействует с другими материалами в данной среде. Эти свойства определяют поведение материала на молекулярном уровне. Химические свойства лежат в основе физических и механических свойств.
Эти свойства определяют поведение материала на молекулярном уровне. Химические свойства лежат в основе физических и механических свойств.
Ни физические, ни механические свойства не являются постоянными; они меняются в зависимости от окружающей среды. Например, эластичность (механическое свойство) и плотность (физическое свойство) зависят от температуры материала.
Общие свойства металлов
- Блеск: при отсутствии поверхностных загрязнений металлы блестят.
- Высокая теплопроводность: по сравнению с неметаллами металлы являются хорошими проводниками тепла.
- Высокая электропроводность: металлы также являются хорошими проводниками электричества.




