Страница не найдена — Трактор-РЕВЮ
Похоже, что здесь ничего нет…Может, попробуете воспользоваться поиском?
Искать:Свежие записи
- Экскаватор-погрузчик New Holland B80B
- ЛК «Европлан» предлагает субсидию 10% по госпрограмме на грузовой и легковой транспорт
- Категории грунтов по трудности разработки
- ТЛС-5 «Барнаулец»: технические характеристики
- ЛК «Европлан» улучшает пакет услуг «Привилегии»
Архивы
Архивы Выберите месяц Март 2023 Февраль 2023 Январь 2023 Декабрь 2022 Ноябрь 2022 Октябрь 2022 Сентябрь 2022 Август 2022 Июль 2022 Июнь 2022 Май 2022 Апрель 2022 Март 2022 Февраль 2022 Январь 2022 Декабрь 2021 Ноябрь 2021 Октябрь 2021 Сентябрь 2021 Август 2021 Июль 2021 Июнь 2021 Май 2021 Апрель 2021 Март 2021 Февраль 2021 Январь 2021 Декабрь 2020 Ноябрь 2020 Октябрь 2020 Сентябрь 2020 Август 2020 Июль 2020 Июнь 2020 Май 2020 Апрель 2020 Март 2020 Февраль 2020 Январь 2020 Декабрь 2019 Ноябрь 2019 Октябрь 2019 Сентябрь 2019 Август 2019 Июль 2019 Июнь 2019 Май 2019 Апрель 2019 Март 2019 Февраль 2019 Январь 2019 Декабрь 2018 Ноябрь 2018 Октябрь 2018 Сентябрь 2018 Август 2018 Июль 2018 Июнь 2018 Май 2018 Апрель 2018 Март 2018 Февраль 2018 Январь 2018 Декабрь 2017 Ноябрь 2017 Октябрь 2017 Сентябрь 2017 Август 2017 Июль 2017 Июнь 2017 Май 2017 Апрель 2017 Март 2017 Февраль 2017 Январь 2017 Декабрь 2016 Ноябрь 2016 Октябрь 2016 Сентябрь 2016 Август 2016 Июль 2016 Июнь 2016 Май 2016 Апрель 2016 Март 2016 Февраль 2016 Январь 2016 Декабрь 2015Рубрики
РубрикиВыберите рубрикуCase IHCATJohn DeereKomatsuMassey FergusonShantuiValtraАВТОГРЕЙДЕРЫАгромашАлтайлесмашАМЗАТЗАФИША СОБЫТИЙБУЛЬДОЗЕРЫВгТЗВМТЗВТЗГОСТЕХНАДЗОРГРАБЛИ-ВОРОШИЛКИГУСЕНИЧНЫЕ ЭКСКАВАТОРЫДВИГАТЕЛИЗЕРНОУБОРОЧНЫЕ КОМБАЙНЫЗМЗКамАЗКОМБАЙНЫКОРМОРАЗДАТЧИКИКОРМОУБОРОЧНЫЕ КОМБАЙНЫКОСИЛКИ И ИЗМЕЛЬЧИТЕЛИКТЗЛТЗМИНИ-ПОГРУЗЧИКИМИНИТРАКТОРЫММЗМОТОБЛОКИМТЗНАВЕСНОЕ И ПРИЦЕПНОЕ ОБОРУДОВАНИЕОТЗПМЗПНЕВМОКОЛЕСНЫЕ ЭКСКАВАТОРЫПРЕСС-ПОДБОРЩИКИПРИЦЕПНЫЕ КОМБАЙНЫПТЗРостсельмашСЕЯЛКИ И САЖАЛКИСПКТЕЛЕСКОПИЧЕСКИЕ ПОГРУЗЧИКИТЕХНИКА ДЛЯ ДОМАТОПЛИВОТРАКТОРЫУВЗУСТРОЙСТВОФРОНТАЛЬНЫЕ ПОГРУЗЧИКИХЗТМХМЗ «СЕРП И МОЛОТ»ХТЗЧЕТРАЧТЗ-УРАЛТРАКЭКСКАВАТОРЫЭКСКАВАТОРЫ-ПОГРУЗЧИКИЮМЗЯМЗМетки
 1 ТС (менее 1.8 кН)
0.2 ТС (1.8-5.4 кН)
0.6 ТС (5.4-8.1 кН)
0.9 ТС (8.1-12.6 кН)
1.4 ТС (12.6-18.0 кН)
2 ТС (18.0-27.0 кН)
3 ТС (27.0-36.0 кН)
3 класс
4 ТС (36.0-45.0 кН)
4 класс
5 ТС (45.0-54.0 кН)
5 класс
6 ТС (54.0-72.0)
6 класс
8 ТС (72.0-108.0 кН)
10 ТС (100 кН)
15 ТС (150 кН)
20 (200 кН)
25 ТС (250 кН)
35 ТС (350 кН)
50 ТС (500 кН)
Группа 1 (до 6.3 т)
Группа 2 (6.3-10 т)
Группа 3 (10-18 т)
Группа 4 (18-32 т)
Группа 5 (32-50 т)
Гусеничные
Класс 14-40 «Легкие»
Класс 60-150 «Средние»
Класс 250-350 «Тяжелые»
Класс 500-1000 «Сверхтяжелые»
Колесные 4К2
Колесные 4К4
Легкие (0.5-2 т)
Лесопромышленные
Малогабаритные
Общего назначения
Промышленные
Сельскохозяйственные
Специального назначения
Средние (2-4 т)
Тяжелые (4-10 т)
Универсально-пропашные
Энергонасыщенные
слайдер
1 ТС (менее 1.8 кН)
0.2 ТС (1.8-5.4 кН)
0.6 ТС (5.4-8.1 кН)
0.9 ТС (8.1-12.6 кН)
1.4 ТС (12.6-18.0 кН)
2 ТС (18.0-27.0 кН)
3 ТС (27.0-36.0 кН)
3 класс
4 ТС (36.0-45.0 кН)
4 класс
5 ТС (45.0-54.0 кН)
5 класс
6 ТС (54.0-72.0)
6 класс
8 ТС (72.0-108.0 кН)
10 ТС (100 кН)
15 ТС (150 кН)
20 (200 кН)
25 ТС (250 кН)
35 ТС (350 кН)
50 ТС (500 кН)
Группа 1 (до 6.3 т)
Группа 2 (6.3-10 т)
Группа 3 (10-18 т)
Группа 4 (18-32 т)
Группа 5 (32-50 т)
Гусеничные
Класс 14-40 «Легкие»
Класс 60-150 «Средние»
Класс 250-350 «Тяжелые»
Класс 500-1000 «Сверхтяжелые»
Колесные 4К2
Колесные 4К4
Легкие (0.5-2 т)
Лесопромышленные
Малогабаритные
Общего назначения
Промышленные
Сельскохозяйственные
Специального назначения
Средние (2-4 т)
Тяжелые (4-10 т)
Универсально-пропашные
Энергонасыщенные
слайдерСтраницы
- Автогрейдеры
- Афиша событий
- Бульдозеры
- CAT
- KOMATSU
- ЧЕТРА
- ЧТЗ-УРАЛТРАК
- Гостехнадзор
- Двигатели
- АМЗ
- ВМТЗ
- ЗМЗ
- ММЗ
- Топливо
- Устройство
- ХМЗ «Серп и молот»
- ЯМЗ
- Комбайны
- Зерноуборочные комбайны
- Кормоуборочные комбайны
- Навесное и прицепное оборудование
- Грабли-ворошилки
- Кормораздатчики
- Косилки и измельчители
- Пресс-подборщики
- Прицепные комбайны
- Сеялки и сажалки
- О персональных данных пользователей
- Обратная связь
- От редакции
- Погрузчики
- Мини-погрузчики
- Телескопические погрузчики
- Фронтальные погрузчики
- Пользовательское соглашение
- Техника для дома
- Минитракторы
- Мотоблоки
- Тракторы
- Case IH
- John Deere
- Valtra
- Агромаш
- АТЗ
- ВгТЗ
- ВТЗ
- КамАЗ
- КТЗ
- ЛТЗ
- МТЗ
- ОТЗ
- ПМЗ
- ПТЗ
- Ростсельмаш
- СПК
- УВЗ
- ХТЗ
- ЮМЗ
- Экскаваторы
- JCB
- Terex
- Гусеничные экскаваторы
- Пневмоколесные экскаваторы
- Экскаваторы-погрузчики
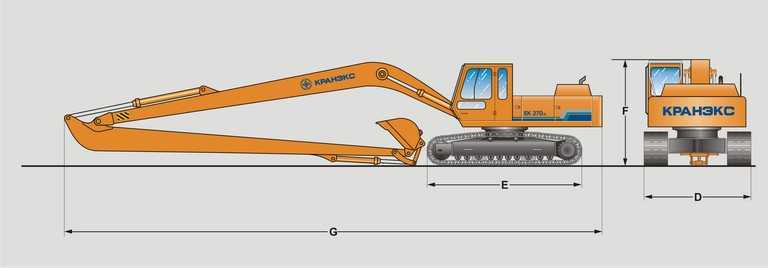
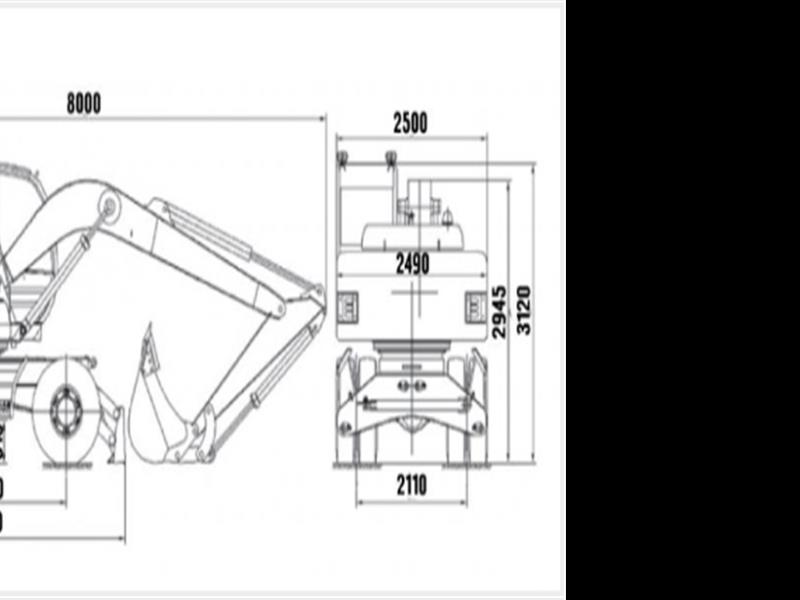
ТВЭКС ЕК-14 — Экскаваторы колесные (EK-14 — TVEHKS EK-14 — TVEKS ЕК-14 — TVEX ЕК-14 — ЕК-14 — ТВЕКС ЕК-14 — ТВЕРСКОИ ЭЗ ЕК-14 — ТВЕРСКОИ ЭКСКАВАТОР ЕК-14 — ТВЕРСКОЙ ЭЗ ЕК-14 — ТВЕРСКОЙ ЭКСКАВАТОР ЕК-14 — ТВЭКС ЕК-14 — ТЭЗ ЕК-14 — Экскаватор колесный ЕК-14 — Экскаватор колесный ТВЭКС ЕК-14) — Технические характеристики ТВЭКС ЕК-14 — Габаритные размеры ТВЭКС ЕК-14 — Двигатель ТВЭКС ЕК-14
|
Документ энциклопедии Стройтех, Категория: Экскаваторы колесные редактировать |версии документа |история документа | сравнить
Технические характеристики ТВЭКС ЕК-14
Габаритные размеры ТВЭКС ЕК-14
Двигатель ТВЭКС ЕК-14
Эксплуатационные характеристики ТВЭКС ЕК-14
EK-14|TVEHKS EK-14|TVEKS ЕК-14|TVEX ЕК-14|ЕК-14|ТВЕКС ЕК-14|ТВЕРСКОИ ЭЗ ЕК-14|ТВЕРСКОИ ЭКСКАВАТОР ЕК-14|ТВЕРСКОЙ ЭЗ ЕК-14|ТВЕРСКОЙ ЭКСКАВАТОР ЕК-14|ТВЭКС ЕК-14|ТЭЗ ЕК-14|Экскаватор колесный ЕК-14|Экскаватор колесный ТВЭКС ЕК-14instructor 21 окт 2009, 04:52Экскаваторы колесные Экскаватор колесный, Экскаватор, Землеройная техника, ТВЭКС, ЕК-14 Экскаватор колесный WikPedia (en), Google, Yandex
+ добавить объявление ТВЭКС ЕК-14 — продажа:
+ добавить объявление ТВЭКС ЕК-14 — аренда:
Энциклопедия СтройТех является открытой справочно-информационной системой. |
На правах рекламы: |
Olympus Zuiko Digital 1.4x Teleconverter EC-14 Технические характеристики: Обзор цифровой фотографии
Объявлено 24 июня 2003 г. •
Телеконвертер | Четыре трети | 261005
- Главная
- Характеристики
- Отзывы пользователей (1)
- Вопросы и ответы (3)
- Купить
| Основные характеристики2 | ||
| Тип объектива | Телеконвертер | |
|---|---|---|
| Максимальный размер формата | Четыре Третьего | |
| Стабилизация изображения | Нет | |
| Крепление объектива | Четыре трети | |
| Диафрагма | ||
| Кольцо диафрагмы | Нет | |
| Оптика | ||
| Элементы | 6 | |
| Группы | 5 | |
| Фокус | ||
| Полное руководство | Неизвестный | |
| Шкала расстояний | Нет | |
| Шкала глубины резкости | Нет | |
| Физический | ||
| Масса | 170 г (0,37 фунта) | |
| Диаметр | 68 мм (2,68 дюйма) | |
| Длина | 22 мм (0,88 дюйма) | |
| Герметизация | Да | |
| Цвет | Черный | |
| Вытяжка в комплекте | Нет | |
| Воротник штатива | Нет | |
| Прочее | ||
Вы заметили ошибку? Сообщите об этом.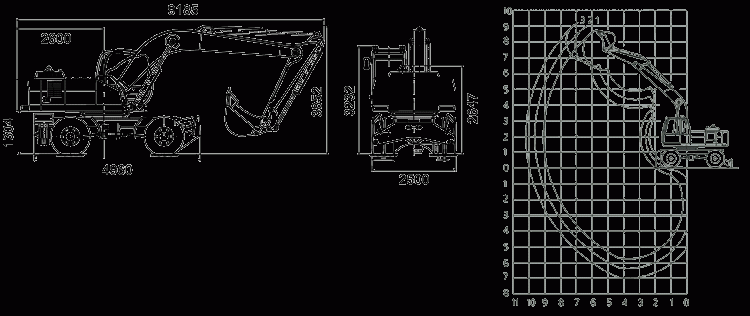 ..
..
Пожалуйста, используйте форму ниже, чтобы сообщить об ошибке.
Клинические испытания – Регламент ЕС № 536/2014
Регламент о клинических испытаниях призван заменить Директиву о клинических испытаниях после ее вступления в силу.
Хотя Регламент вступил в силу 16 июня 2014 г., сроки его применения зависят от разработки полнофункционального портала и базы данных клинических исследований ЕС. В Регламенте указано, что эта полная функциональность должна быть проверена Правлением Европейского агентства по лекарственным средствам (EMA) (на основе независимого аудита) и подтверждена Европейской комиссией в Официальном журнале. Правление EMA утвердило сроки поставки в декабре 2015 г. Однако из-за технических сложностей с разработкой ИТ-систем дату запуска портала пришлось отложить. В декабре 2019 г., Правление EMA одобрило начало независимого аудита системы в декабре 2020 года после оценки готовности к аудиту, проведенной назначенными владельцами продукта, EMA и поставщиком ИТ./1.gif) На основании результатов этого независимого аудита Правление EMA подтвердило Европейской комиссии 21 апреля 2021 года, что портал и база данных ЕС полностью функциональны. Публикация последующего уведомления Комиссии произошла 31 июля 2021 г., в нем была установлена дата начала применения Положения о клинических испытаниях 31 января 2022 г. С уведомлением можно ознакомиться здесь. Для получения дополнительной информации посетите веб-сайт EMA.
На основании результатов этого независимого аудита Правление EMA подтвердило Европейской комиссии 21 апреля 2021 года, что портал и база данных ЕС полностью функциональны. Публикация последующего уведомления Комиссии произошла 31 июля 2021 г., в нем была установлена дата начала применения Положения о клинических испытаниях 31 января 2022 г. С уведомлением можно ознакомиться здесь. Для получения дополнительной информации посетите веб-сайт EMA.
Регламент обеспечит более высокий уровень гармонизации правил проведения клинических испытаний на всей территории ЕС. Он вводит процедуру авторизации, основанную на одной подаче через единый портал ЕС, процедуру оценки, ведущую к единому решению, правила защиты субъектов и информированного согласия, а также требования прозрачности.
Это также облегчит фармацевтическим компаниям проведение многонациональных клинических испытаний, что должно увеличить количество исследований, проводимых в ЕС. Более подробная информация о регулировании доступна на веб-сайте Европейского агентства по лекарственным средствам (EMA).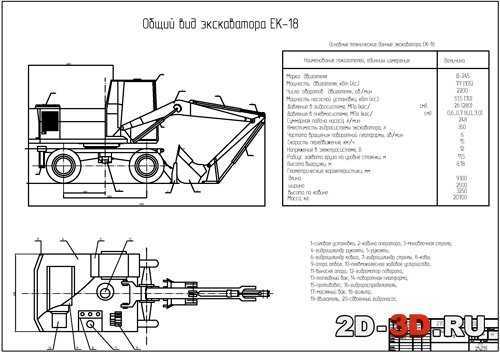
Портал клинических испытаний и база данных ЕС
Статьи 80 и 81 Регламента возложили на EMA задачу создания портала и базы данных ЕС. Портал ЕС будет единой точкой входа для подачи данных и информации, касающихся клинических испытаний, требуемых Регламентом. База данных ЕС будет содержать все данные и информацию, представленные через портал ЕС.
Портал и база данных ЕС станут основой нового режима клинических испытаний в Европе. Это значительно облегчит подачу заявки на получение разрешения на клинические исследования, в частности, в случае многонациональных клинических исследований, спонсору; оценка, проведенная национальными органами; и доступ широкой публики к информации о клинических испытаниях.
14 декабря 2014 года Правление EMA утвердило функциональные спецификации портала ЕС и базы данных ЕС для проведения аудита.
Из-за технических трудностей, связанных с разработкой ИТ-систем, дата запуска портала должна была быть отложена , и поэтому ЕС Клинические испытания Регламент вступит в силу 31 января 2022 года.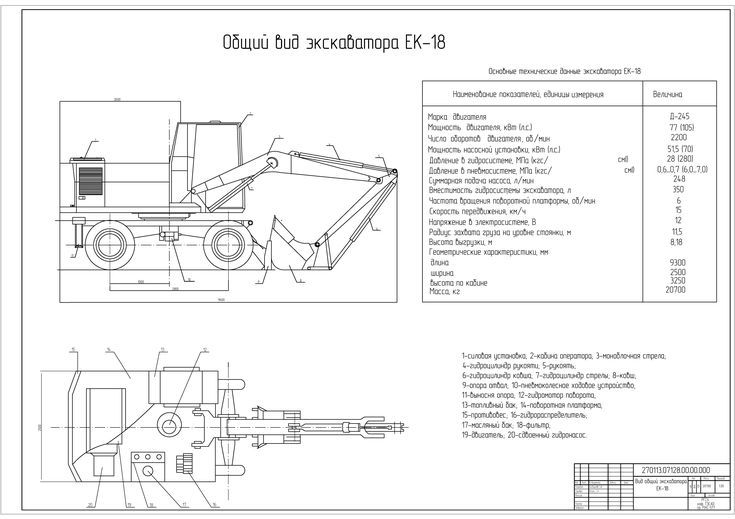 Для получения дополнительной информации, пожалуйста, обратитесь на веб-сайт EMA.
Для получения дополнительной информации, пожалуйста, обратитесь на веб-сайт EMA.
Прозрачность
Положение о клинических испытаниях обеспечивает большую прозрачность данных клинических испытаний. Вся информация в базе данных ЕС будет общедоступной, за исключением случаев, когда ее конфиденциальность может быть оправдана на основании:
- Защита коммерческой конфиденциальной информации
- Защита персональных данных
- Защита конфиденциальной связи между странами ЕС
- Обеспечение эффективного надзора за проведением клинических исследований странами ЕС
Для поддержки требований прозрачности Регламента, EMA добавила два набора требований к функциональным спецификациям для с применением исключений :
- Функции для поддержки обнародования информации
- Правила раскрытия информации, описывающие практическое применение правил прозрачности.
Правление EMA утвердило оба документа в 2015 году:
- Пересмотр раздела 6 «Функциональных спецификаций для портала ЕС и базы данных ЕС, подлежащих аудиту», в котором изложены функции для поддержки обнародования информации
- Приложение о раскрытии информации правил, к «Функциональным спецификациям для портала ЕС и базы данных ЕС, подлежащих аудиту»
Отчетность по безопасности
Регламент упрощает правила отчетности по безопасности:
- В протоколе может быть предусмотрено, что не все нежелательные явления (НЯ) и серьезные нежелательные явления регистрируются и сообщаются.

- Для клинического исследования, включающего более одного исследуемого лекарственного средства (ИЛП), в Информационную систему клинических исследований (CTIS) может быть представлен один ежегодный отчет о безопасности всех ИЛП, использованных в этом исследовании.
- О предполагаемых неожиданных серьезных побочных реакциях (SUSAR) необходимо сообщать через базу данных EudraVigilance.
Юридические обязательства Комиссии в контексте Регламента (ЕС) № 536/2014
Проверка клинических испытаний может касаться надлежащей клинической практики в отношении проведения клинических испытаний, а также надлежащей производственной практики в отношении производства исследуемого лекарственные препараты.
Для клинических испытаний, представляемых на основании Регламента, Исполнительного Регламента (ЕС) 2017/556 от 24 марта 2017 г. о подробных процедурах проверки надлежащей клинической практики в соответствии с Регламентом (ЕС) № 536/2014 Европейского парламента и Совета будут применяться.
Делегированный Регламент Комиссии (ЕС) 2017/1569 от 23 мая 2017 г., дополняющий Регламент (ЕС) № 536/2014 Европейского парламента и Совета, будет применяться ко всем клиническим испытаниям, разрешенным на основании Регламента клинических испытаний. . Он устанавливает принципы и рекомендации по надлежащей производственной практике для исследуемых лекарственных препаратов для человека, а также порядок проведения инспекций. В дополнение к этому подробное руководство Комиссии, принятое 8 декабря 2017 г., по надлежащей практике производства исследуемых лекарственных средств в соответствии со вторым абзацем статьи 63(1) Регламента (ЕС) № 536/2014 было принято 8 декабря 2014 г. Декабрь 2017.
Оба Регламента и руководство вступят в силу одновременно с Регламентом (ЕС) № 536/2014.
Клинические испытания, проведенные за пределами ЕС
Если клинические испытания проводятся за пределами ЕС, но подаются на регистрационное удостоверение в ЕС, они должны следовать принципам, аналогичным положениям Директивы о клинических испытаниях (Приложение I, пункт 8 Директива 2001/83/ЕС
Клинические испытания, проводимые за пределами ЕС, также должны проводиться в соответствии с принципами, эквивалентными принципам регламента в отношении прав и безопасности субъекта, а также надежности и надежности данных, полученных в клинические испытания
Эти данные должны быть представлены в заявке только в том случае, если клиническое испытание было зарегистрировано заблаговременно в публичном реестре, который является основным или партнерским реестром или поставщиком данных для ICTRP ВОЗ.


 Екатеринбург
Екатеринбург

 , 3000 км, 3000 ч.
, 3000 км, 3000 ч. , 5000 ч.
, 5000 ч. , 2100 ч.
, 2100 ч. Люберцы
Люберцы
 07.2016
07.2016
 02.2021
02.2021
 02.2021
02.2021
 02.2021
02.2021

