📌 Хлорметан — это… 🎓 Что такое Хлорметан?
Хлорметан (метилхлорид) — органическое вещество, принадлежащее к группе галогеналканов. Впервые был получен французскими химиками Жаном Батистом Дюма и Эженом Пелиго в 1835 году кипячением смеси метанола, серной кислоты и хлорида натрия. Аналогичный способ используется и в наши дни. Хлорметан — бесцветный легколетучий газ со сладковатым запахом. Благодаря слабому запаху, можно легко не заметить токсичной или взрывоопасной концентрации.
Производство
Большая часть хлорметана получается реакцией метанола с хлороводородом, согласно следующей химической реакции
CH3OH + HCl → CH3Cl + H2O
Это может быть осуществлено пропусканием хлороводорода через кипящий метанол вместе с хлоридом цинка в качестве катализатора или пропусканием смеси метанола и хлороводорода через окись алюминия при 350 °C.
Меньшие количества хлорметана производят нагреванием смеси метана и хлора до 400 °C. Однако, этот метод дает смесь с более хлорированными производными метана (дихлорметан, хлороформ, тетрахлорметан) и используется тогда, когда необходимы эти вещества.
Применение
Хлорметан был широкоприменяемым хладагентом. Но такое его применение прекратили из-за токсичности и пожароопасности. Хлорметан был использован для производства добавок к бензину на основе свинца (тетраметилсвинец). Наиболее важное использование хлорметана сейчас в качестве химического полупродукта в производстве силиконовых полимеров. Меньшие количество используется в качестве растворителя при производстве бутилкаучука и очистке бензина. Хлорметан используется как метилирующий или хлорирующий агент в органической химии. Он находит также множество различных применений: удаления жирных загрязнений, следов смол, как ракетное топливо, для получения пенополистирола. Как локальное обезболивающее, как промежуточный продукт при синтезе лекарств, как носитель в низкотемпературной полимеризации, как жидкость для термометрического и термостатического оборудования, в качестве гербицида.
Безопасность
Вдыхание газообразного хлорметана приводит действию на центральную нервную систему, схожую на интоксикацию. Пострадавший может почувствовать сонливость, головокружение, рассеянность и тяжесть дыхания, удушье, неуверенную походку и спутанность речи. При больших концентрациях наступают судороги, паралич и кома. В случае проглатывания может возникнуть тошнота и рвота. Контакт сжиженного метилхлорида с кожей приводит к обморожению. Контакт с глазами может привести к ухудшению зрения. Хроническое воздействие хлорметана связывают с врождёнными дефектами на мышах. Для людей контакт с хлорметаном во время беременности может вызвать неправильное развития позвоночника, таза, ног, но это не доказано окончательно.
dic.academic.ru
Химические свойства метана, формула, плотность, горение газа, молярная масса, применение в промышленности, термическое разложение, бромирование метана, строение молекулы
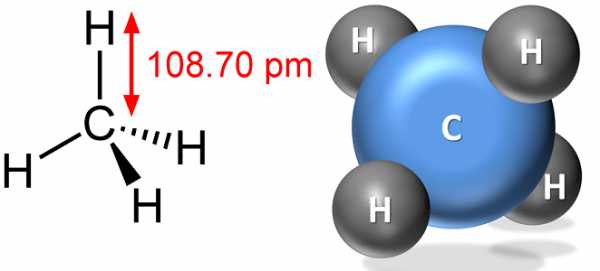
Химические свойства метана ничем не отличаются от свойств, присущих всем веществам класса алканов. В школьном курсе химии метан изучают одним из первых веществ органики, так как он является одним из простейших представителей алканов.
В его составе один атом углерода и четыре атома водорода.
Формула метана и способы его получения
| Молекулярная формула метана | Структурная формула метана |
| СH4
| Н | Н — С — Н | Н |
Метан в больших количествах содержится в атмосфере. Мы не обращаем внимания на нахождение этого газа в воздухе, ведь на нашем организме это никак не отражается, а вот канарейки очень чувствительны к метану.
Когда-то они даже помогали шахтерам спускаться под землю. Когда процентное содержание метана изменялась, птицы переставали петь. Это служило сигналом для человека, что он спустился слишком глубоко и нужно подниматься наверх.

Образуется метан в результате распада остатков живых организмов. Не случайно с английского methane переводится, как болотный газ, ведь он может быть обнаружен в заболоченных водоемах и каменноугольных шахтах.
Основным источником газа в агропромышленном комплексе является рогатый скот. Да, метан они выводят из организма вместе с остальными продуктами жизнедеятельности. Кстати, увеличение числа рогатого скота на планете может привести к разрушению озонового слоя, ведь метан с кислородом образуют взрывоопасную смесь.
Метан в промышленности можно получить с помощью нагревания углерода и водорода или синтеза водяного газа, все реакции протекают в присутствии катализатора, чаще всего никеля.

В США разработана целая система по добыче метана, она способна извлечь до 80% газа из природного угля. На сегодняшний день мировые запасы метана оцениваются экспертами в 260 триллионов метров кубических! Даже запасы природного газа значительно меньше.
В лаборатории метан получают путем взаимодействия карбида алюминия (неорганическое соединение алюминия с углеродом) и воды. Также с помощью гидроксида натрия, вступающего в реакцию с ацетатом натрия, более известного как пищевая добавка Е262.
Физические свойства метана
Характеристика:
- Бесцветный газ, без запаха.
- Взрывоопасен.
- Нерастворим в воде.
- Температура кипения: -162oC, замерзания: -183°C.
- Молярная масса: 16,044 г/моль.
- Плотность: 0,656 кг/м³.
Химические свойства метана
Говоря о химических свойствах, выделяют те реакции, в которые вступает метан. Ниже они приведены вместе с формулами.
Горение метана
Как все органические вещества, метан горит. Можно заметить, что при горении образуется голубоватое пламя.
СН4 + 2O2 → СO2↑ + 2Н2O
Называется такая реакция – реакцией горения или полного окисления.
Замещение
Метан также реагирует с галогенами. Это химические элементы 17 группы в периодической таблице Менделеева. К ним относятся: фтор, хлор, бром, йод и астат. Реакция с галогенами называется – реакцией замещения или галогенирования. Такая реакция проходит только в присутствии света.
Хлорирование и бромирование
Если в качестве галогена используется хлор, то реакция будет называться – реакцией хлорирования. Если в качестве галогена выступает бром, то – бромирование, и так далее.
CH4 + Cl2 → CH3Cl + НСl
CH4 + Br2 → CH3Br + НBr
Хлорирование. Низшие алканы могут прохлорировать полностью.
CH4 + Cl2 → CH3Cl + НСl
CH3
CH2Сl2+ Cl2 → CHCl3 + НСl
CHCl3 + Cl2 → CСl4 + НСl
Точно так же метан может полностью вступать в реакцию бромирования.
CH4 + Br2 → CH3Br + Н Br
CH3Br + Br2 → CH2Br2 + НBr
CH2Br2 + Br2 → CHBr3 + НBr
CHBr3 + Br2 → CBr4 + НBr
С йодом такой реакции уже нет, а с фтором наоборот сопровождается быстрым взрывом.
Разложение
Так же этому углеводороду свойственна реакция разложения. Полное разложение:
СН4 → С + 2H₂
И неполное разложение:
2СН4 → С2Н2 + 3Н2
Реакция с кислотами
Метан реагирует с концентрированной серной кислотой. Реакция носит название сульфирования и происходит при небольшом нагревании.
2СН4 + Н2SО4 → СН3SО3Н + Н2О
Окисление
Как уже было сказано, СH4 может полностью окисляться, но при недостатке кислорода возможно неполное окисление.
2СН4 + 3O2 → 2CO + 4Н2O
СН4 + О2 → С + 2Н2O
Помимо прочего для этого газа характерно каталитическое окисление. Оно происходит в присутствии катализатора. При разном соотношении моль вещества получаются разные конечные продукты реакции. В основном это:
Реакция протекает при температуре 1500°C. Данная реакция также носит название – крекинг – термическое разложение.
Нитрование метана
Существует также реакция нитрования или реакция Коновалова, названная в честь ученого, который доказал, что с предельными углеводородами действует разбавленная азотная кислота. Продукты реакции получили название – нитросоединения.
CH4 + НNО3 → СН3NO2 + H2O
Реакция проводится при температуре 140-150°C.
Дегидрирование метана
Кроме того, для метана характерна реакция дегидрирования (разложения) – отцепление атомов водорода и получения ацетилена, в данном случае.
2CН4 → C2H2 + 3Н2
Применение метана
Метан, как и остальные предельные углеводороды, широко используется в повседневной жизни. Его применяют в производстве бензина, авиационного и дизельного топлива.
Используют в качестве базы для получения различного органического сырья на предприятиях. Также метан широко используется в медицине и косметологии.

Метан применяют для получения синтетического каучука, красок и шин.
Атлеты используют так называемый жидкий метан для быстрого набора массы за короткий промежуток времени.
А при хлорировании метана образуется вещество, которое в дальнейшем используется для обезжиривания поверхностей или как компонент в средствах для снятия лака. Некоторое время продукт взаимодействия метана и хлора использовали в качестве наркоза.
1001student.ru
Формула метана в химии
Определение и формула метана
Формула –
Молярная масса равна г/моль.
Физические свойства – в обычных условиях бесцветный газ, не имеющий запаха.
Плохо растворяется в воде.
Известный физик А. Вольта обнаружил метан в болоте в 1776 году.
Метан является главным компонентом природного газа, он содержится в больших количествах в атмосфере газовых гигантов.
Химические свойства метана
Получение
В лабораторных условиях метан получают нагреванием безводного гидроксида натрия с ледяной уксусной кислотой:
Другой способ получения основывается на сплавлении ацетата натрия с :
Применение
Метан широко используется в качестве промышленного и бытового газа. химически перерабатывается главным образом в ацетилен, газовую сажу, фторо- и хлоропроизводные.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Хлорметан — WiKi
Хлормета́н (метилхлори́д) — органическое вещество, принадлежащее к группе галогеналканов. Впервые был получен французскими химиками Жаном Батистом Дюма и Эженом Пелиго в 1835 году кипячением смеси метанола, серной кислоты и хлорида натрия. Аналогичный способ используется и в наши дни. Хлорметан — бесцветный легколетучий ядовитый газ со сладковатым запахом. Из-за слабого запаха можно легко не заметить токсичной или взрывоопасной концентрации.
| Хлорметан | |
|---|---|
 | |
| Систематическое наименование | Хлорметан |
| Традиционные названия | монохлорметан, метилхлорид, фреон 40, R 40, UN 1063 |
| Хим. формула | CH3Cl |
| Рац. формула | CH3Cl |
| Состояние | газ |
| Молярная масса | 50.49 г/моль |
| Плотность | 0.915 г/см³ |
| Энергия ионизации | 11,28 ± 0,01 эВ[1] |
| Т. плав. | −97.7 °C |
| Т. кип. | -24.2 °C |
| Т. всп. | -46 °C |
| Т. свспл. | 625 °C |
| Пр. взрв. | 8,1 ± 0,1 об.%[1] |
| Удельная теплота испарения | 423850 Дж/кг |
| Давление пара | 490 kPa |
| Растворимость в воде | 5.325 г/100 мл |
| Гибридизация | тетраэдр |
| Рег. номер CAS | 74-87-3 |
| PubChem | 6327 |
| Рег. номер EINECS | 200-817-4 |
| SMILES | |
| InChI | |
| RTECS | PA6300000 |
| ChEBI | 36014 |
| Номер ООН | 1063 |
| ChemSpider | 6087 |
| Токсичность | ядовит, огнеопасен, канцероген |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Производство
Большая часть хлорметана получается реакцией метанола с хлороводородом, согласно следующей химической реакции:
- Ch4OH+HCl→Ch4Cl+h3O{\displaystyle {\mathsf {CH_{3}OH+HCl\rightarrow CH_{3}Cl+H_{2}O}}}
Это может быть осуществлено пропусканием хлороводорода через кипящий метанол вместе с хлоридом цинка в качестве катализатора или пропусканием смеси метанола и хлороводорода через окись алюминия при 350 °C.
Меньшие количества хлорметана производят нагреванием смеси метана и хлора до 400 °C. Однако этот метод дает смесь с более хлорированными производными метана (дихлорметан, хлороформ, тетрахлорметан) и используется тогда, когда необходимы эти вещества.
Применение
Хлорметан был широкоприменяемым хладагентом. Но такое его применение прекратили из-за токсичности и пожароопасности. Хлорметан был использован для производства добавок к бензину на основе свинца (тетраметилсвинец).
Наиболее важное использование хлорметана сейчас в качестве химического полупродукта в производстве силиконовых полимеров. Меньшие количества используют в качестве растворителя при производстве бутилкаучука и очистке бензина.
Хлорметан используют как метилирующий или хлорирующий агент в органической химии. Он находит также множество различных применений: удаления жирных загрязнений, следов смол, как ракетное топливо, для получения пенополистирола. Как локальное обезболивающее, как промежуточный продукт при синтезе лекарств, как носитель в низкотемпературной полимеризации, как жидкость для термометрического и термостатического оборудования, в качестве гербицида.
Безопасность
Вдыхание газообразного хлорметана оказывает токсическое действие на центральную нервную систему. У пострадавшего возникает сонливость, головокружение, рассеянность, нарушение координации движений, спутанность речи, нарушение дыхания, удушье. При больших концентрациях наступают судороги, параличи и кома.
В случае проглатывания может возникнуть тошнота и рвота. Контакт сжиженного метилхлорида с кожей приводит к обморожению. Контакт с глазами может привести к ухудшению зрения.
Хроническое воздействие хлорметана вызывает тератогенный эффект.
Примечания
ru-wiki.org
Хлорметан — Википедия (с комментариями)
Ты — не раб!
Закрытый образовательный курс для детей элиты: «Истинное обустройство мира».
http://noslave.org
Материал из Википедии — свободной энциклопедии
Хлормета́н (метилхлори́д) — органическое вещество, принадлежащее к группе галогеналканов. Впервые был получен французскими химиками Жаном Батистом Дюма и Эженом Пелиго в 1835 году кипячением смеси метанола, серной кислоты и хлорида натрия. Аналогичный способ используется и в наши дни. Хлорметан — бесцветный легколетучий газ со сладковатым запахом. Из-за слабого запаха можно легко не заметить токсичной или взрывоопасной концентрации.
Производство
Большая часть хлорметана получается реакцией метанола с хлороводородом, согласно следующей химической реакции:
- Невозможно разобрать выражение (Выполняемый файл <code>texvc</code> не найден; См. math/README — справку по настройке.): \mathsf{CH_3OH + HCl \rightarrow CH_3Cl + H_2O}
Это может быть осуществлено пропусканием хлороводорода через кипящий метанол вместе с хлоридом цинка в качестве катализатора или пропусканием смеси метанола и хлороводорода через окись алюминия при 350 °C.
Меньшие количества хлорметана производят нагреванием смеси метана и хлора до 400 °C. Однако этот метод дает смесь с более хлорированными производными метана (дихлорметан, хлороформ, тетрахлорметан) и используется тогда, когда необходимы эти вещества.
Применение
Хлорметан был широкоприменяемым хладагентом. Но такое его применение прекратили из-за токсичности и пожароопасности. Хлорметан был использован для производства добавок к бензину на основе свинца (тетраметилсвинец).
Наиболее важное использование хлорметана сейчас в качестве химического полупродукта в производстве силиконовых полимеров. Меньшие количества используют в качестве растворителя при производстве бутилкаучука и очистке бензина.
Хлорметан используют как метилирующий или хлорирующий агент в органической химии. Он находит также множество различных применений: удаления жирных загрязнений, следов смол, как ракетное топливо, для получения пенополистирола. Как локальное обезболивающее, как промежуточный продукт при синтезе лекарств, как носитель в низкотемпературной полимеризации, как жидкость для термометрического и термостатического оборудования, в качестве гербицида.
Безопасность
Вдыхание газообразного хлорметана оказывает токсическое действие на центральную нервную систему. У пострадавшего возникает сонливость, головокружение, рассеянность, нарушение координации движений, спутанность речи, нарушение дыхания, удушье. При больших концентрациях наступают судороги, параличи и кома.
В случае проглатывания может возникнуть тошнота и рвота. Контакт сжиженного метилхлорида с кожей приводит к обморожению. Контакт с глазами может привести к ухудшению зрения.
Хроническое воздействие хлорметана вызывает тератогенный эффект.
См. также
Напишите отзыв о статье «Хлорметан»
Отрывок, характеризующий Хлорметан
– Боролись – с чем, Изидора? Их бой был полностью проигран. Они просто выбрали, КАК они хотели уйти.– Но ведь они ушли самоубийством!.. А разве это не карается кармой? Разве это не заставило их и там, в том другом мире, так же страдать?
– Нет, Изидора… Они ведь просто «ушли», выводя из физического тела свои души. А это ведь самый натуральный процесс. Они не применяли насилия. Они просто «ушли».
С глубокой грустью я смотрела на эту страшную усыпальницу, в холодной, совершенной тишине которой время от времени звенели падающие капли. Это природа начинала потихоньку создавать свой вечный саван – дань умершим… Так, через годы, капля за каплей, каждое тело постепенно превратится в каменную гробницу, не позволяя никому глумиться над усопшими…
– Нашла ли когда-либо эту усыпальницу церковь? – тихо спросила я.
– Да, Изидора. Слуги Дьявола, с помощью собак, нашли эту пещеру. Но даже они не посмели трогать то, что так гостеприимно приняла в свои объятия природа. Они не посмели зажигать там свой «очистительный», «священный» огонь, так как, видимо, чувствовали, что эту работу уже давно сделал за них кто-то другой… С той поры зовётся это место – Пещера Мёртвых. Туда и намного позже, в разные годы приходили умирать Катары и Рыцари Храма, там прятались гонимые церковью их последователи. Даже сейчас ты ещё можешь увидеть старые надписи, оставленные там руками приютившихся когда-то людей… Самые разные имена дружно переплетаются там с загадочными знаками Совершенных… Там славный Домом Фуа, гонимые гордые Тренкавели… Там грусть и безнадёжность, соприкасаются с отчаянной надеждой…
И ещё… Природа веками создаёт там свою каменную «память» печальным событиям и людям, глубоко затронувшим её большое любящее сердце… У самого входа в Пещеру Мёртвых стоит статуя мудрого филина, столетиями охраняющего покой усопших…
– Скажи, Север, Катары ведь верили в Христа, не так ли? – грустно спросила я.
Север искренне удивился.
– Нет, Изидора, это неправда. Катары не «верили» в Христа, они обращались к нему, говорили с ним. Он был их Учителем. Но не Богом. Слепо верить можно только лишь в Бога. Хотя я так до сих пор и не понял, как может быть нужна человеку слепая вера? Это церковь в очередной раз переврала смысл чужого учения… Катары верили в ЗНАНИЕ. В честность и помощь другим, менее удачливым людям. Они верили в Добро и Любовь. Но никогда не верили в одного человека. Они любили и уважали Радомира. И обожали учившую их Золотую Марию. Но никогда не делали из них Бога или Богиню. Они были для них символами Ума и Чести, Знания и Любви. Но они всё же были ЛЮДЬМИ, правда, полностью дарившими себя другим.
Смотри, Изидора, как глупо церковники перевирали даже собственные свои теории… Они утверждали, что Катары не верили в Христа-человека. Что Катары, якобы, верили в его космическую Божественную сущность, которая не была материальной. И в то же время, говорит церковь, Катары признавали Марию Магдалину супругою Христа, и принимали её детей. Тогда, каким же образом у нематериального существа могли рождаться дети?.. Не принимая во внимание, конечно же, чушь про «непорочное» зачатие Марии?.. Нет, Изидора, ничего правдивого не осталось об учении Катар, к сожалению… Всё, что люди знают, полностью извращено «святейшей» церковью, чтобы показать это учение глупым и ничего не стоящим. А ведь Катары учили тому, чему учили наши предки. Чему учим мы. Но для церковников именно это и являлось самым опасным. Они не могли допустить, чтобы люди узнали правду. Церковь обязана была уничтожить даже малейшие воспоминания о Катарах, иначе, как могла бы она объяснить то, что с ними творила?.. После зверского и поголовного уничтожения целого народа, КАК бы она объяснила своим верующим, зачем и кому нужно было такое страшное преступление? Вот поэтому и не осталось ничего от учения Катар… А спустя столетия, думаю, будет и того хуже.
o-ili-v.ru
Метил хлорид — Справочник химика 21
Если сложить соответствующие величины А// для всех четырех стадий, суммарное значение ДЯ для образования метил хлорида (либо для исчезновения метана или хлора) будет равно —24 ккал/моль. [c.104]Исходным сырьем для приготовления раствора катализатора служат безводный хлорид алюминия и очищенный метилхлорид, которые загружаются в аппарат 2 в аппарате поддерживается температура от —20 до —30 С, перед загрузкой его продувают азотом. Порядок загрузки следующий из бункера 1 трихлорид алюминия подается в аппарат 2, после этого туда же поступает метилхлорид. Полученная первая порция катализаторного раствора направляется в емкость 9, откуда некондиционный раствор направляется в отдельную емкость. Аппарат 2 вторично заполняется метил хлоридом, и начинается приготов- [c.196]
ИОДИД + бромид + метил- + хлорид сульфат [c.112]
Натрий (метал), хлорид кальция [c.243]
Метил-хлорид этил-хло-рид -j- этанол-толуол + минеральный спирт + водная НС1……. [c.138]
Пример. Рассчитать энтальпию хлорирования метана в метил-хлорид при стандартных условиях [c.96]
При рекуперации хлорсодержащих мономеров /хлористый амин, хлоропрен/ на стадии регенерации угля водяным паром наблюдается частичный гидролиз продуктов. Это вызывает коррозию аппаратуры и снижает качество получаемого рекуперата. Например, метилхлорид извлекают из паровоздушных смесей производства бутилкаучука на угле марки АР-3, который регенерируют горячими парами метил- хлорида после турбокомпрессора [6], Яод извлекают из отходящих газов активированным углем [Зб]. Уголь используют также для очистки отходящих газов АБС-пластика [37], регенерацию здесь проводят острым водяным паром. [c.43]
Кремний, метил-хлорид Ацетон [c.91]
Несмотря на столь небольшой участок спектра, для поглощения лучше всего использовать моноизотопную резонансную лампу. Квантовый выход изотопической реакции (1.50) с метил-хлоридом равен 0,28 конечно, реакция (1.49) также имеет место при облучении светом от моноизотопной резонансной лампы. [c.25]
В реактор газофазного хлорирования поступает в час 1000 м3 метана. В результате хлорирования образуется следующее количество хлорпроизводных метил-хлорид 530 кг/ч, метиленхлорид 580 кг/ч, трихлорметан 420 кг/ч. Определить объемный расход хлора, степень конверсии метана и мольное соотношение хлор метан. [c.82]
Получение метилцеллюлозы. Метилцеллюлоза (МЦ) представляет собой простой эфир целлюлозы и метилового спирта, который получают действием на щелочную целлюлозу метил-хлорида или диметилсульфата при 125—140 °С и давлении 1,0— 1,2 МПа [c.11]
Вопрос. Объясните, почему продукт теломериэации стирола в тетрахлориде углерода содержит значительно больше хлора, чем при полимеризации в метил-хлориде. [c.231]
Основным методом получения кремнийорганических ПАВ является реакция метил-хлорида с элементарным кремнием, известная как реакция Рошоу [51] и впервые открытая в 1946 г. Она катализируется солями меди в комбинации с со-катализатором — сплавом магний/алюминий. Как правило, в результате реакции образуется смесь ме-тилтрихлорсилана, диметилдихлорсилана и триметилхлорсилана (уравн. 1.16). Ди-метилдихлорсилан наиболее желанный продукт, и условия протекания его реакции оптимизируют таким образом, чтобы выход этого продукта составлял порядка 85-90%. Moho- и трихлорсиланы также являются полезными соединениями, но рыночный спрос на них гораздо меньше. [c.27]
Алкилированием псевдокумола пропиленом можно получать триметилизопро-пилбензол, а при алкилировании метил-хлоридом в присутствии хлорида алюминия — тетраметилбензолы, содержащие 48 % (по массе) дурола. [c.161]
Разработаны электропроводные полимерные материалы на основе эфиров целлюлозы [253]. В качестве проводящих добавок использовали графит, а полимерной основой служили ацетат, ацетопропинат и ацетобутират целлюлозы. Эфиры целлюлозы растворяли в метил-хлориде или ацетоне. Полученный 10% раствор смешивали с необходимым количеством графита и отливали образцы в виде пленок. Исследования показали, что лучше всего совмещается с графитом ацетопропинат целлюлозы. В зависимости от содержания графита электропроводность композиций изменялась в широких пределах. Для всех эфиров целлюлозы удельное объемное сопротивление уменьшается от 10 Ом-см до 102 Ом-см при содержании графита 20, 30 и 60% для ацетопропината, ацетобутирата и триацетата целлюлозы соответственно. [c.178]
Знание дипольных моментов связей позволяет судить об изменении полярности молекулы при введении в нее различных заместителей. Например, введение в неполярную молекулу метана СН ( л ,=0) вместо атома водорода одного атома хлора (для связи С—С1 1р=2,05 О) должно резко повысить полярность молекулы метил-хлорида СНдС1 (в действительности у последней х ,= 1,86 Ь). [c.122]
Раствор катализатора готовят пропусканием очищенного метилхлорида через аппарат, заполненный гранулированным безводным AI I3 при 243 К. ]3след-ствие ограниченной растворимости получается раствор катализатора в метил-хлориде постоянной концентрации [1% (масс.)]. Раствор AI I3 непосредственно в трубопроводе разбавляется до заданной рабочей концентрации около 0,1% (масс.), охлаждается в этиленовом холодильнике до 180 К и подается на полимеризацию. Все операции проводятся в атмосфере сухого инертного газа. [c.151]
Рубашка и карманы охлаждаются жидким этиленом, поступающим по трубопроводу 2. Изобутилен, смешанный с метил-хлоридом, и раствор треххлористого алюминия в метилхлориде или этилхлориде поступают в реактор 1 через дюзы 3 я 4, расположенные в корпусе реактора вблизи винта. Благодаря интенсивному перемешиванию и циркуляции реакционной смеси коэффициент теилопередачи достаточно высок, так что обеспечивается отвод [c.159]
Пренебрегая некоторым различием в значениях дипольных моментов векторные дипольные мо.меиты в направлении отдельных связей. Для связи С—С1 в метиленхлориде дипольный момент получается равным 1,35 О. а для тон же связи в хлороформе 1,28 О, Уменьшение дипольного момента связи С—С з хлорофор.ме по сравнению с метил.хлоридом (ц= 1,86 0). тостигает примерно 30%. [c.36]
Точно так же метпльный радикал СНз, превращаясь в метил-хлорид СН3С1, способствует образованию полимерного радикала и сщиванию фторкаучука. [c.336]
Хорошо растворимы в хлоре тетрахлорид углерода, тетрахлорид кремния, тетрахлорид титана, трихлорид мышьяка, тетрахлорид свинца, оксихлорид фосфора и
www.chem21.info
Газы | Формула | Плотность при нормальных условиях ρ, кг/м3 |
Азот | N2 | 1,2505 |
Аммиак | NH3 | 0,7714 |
Аргон | Ar | 1,7839 |
Ацетилен | C2H2 | 1,1709 |
Ацетон | C3H6O | 2,595 |
Бор фтористый | BF3 | 2,99 |
Бромистый водород | HBr | 3,664 |
Н-бутан | C4H10 | 2,703 |
Изо-бутан | C4H10 | 2,668 |
Н-бутиловый спирт | C4H10O | 3,244 |
Вода | H2O | 0,768 |
Водород | H2 | 0,08987 |
Воздух (сухой) | — | 1,2928 |
Н-гексан | C6H14 | 3,845 |
Гелий | He | 0,1785 |
Н-гептан | C7H16 | 4,459 |
Германия тетрагидрид | GeH4 | 3,42 |
Двуокись углерода | CO2 | 1,9768 |
Н-декан | C10H22 | 6,35 |
Диметиламин | (CH3)2NH | 1,966* |
Дифтордихлорметан | CF2Cl2 | 5,51 |
Дифенил | C12H10 | 6,89 |
Дифениловый эфир | C12H10O | 7,54 |
Дихлорметан | CH2Cl2 | 3,79 |
Диэтиловый эфир | C4H10O | 3,30 |
Закись азота | N2O | 1,978 |
Йодистый водород | HI | 5,789 |
Кислород | O2 | 1,42895 |
Кремний фтористый | SiF4 | 4,9605 |
Кремний гексагидрид | Si2H5 | 2,85 |
Кремний тетрагидрид | SiH4 | 1,44 |
Криптон | Kr | 3,74 |
Ксенон | Xe | 5,89 |
Метан | CH4 | 0,7168 |
Метиламин | CH5N | 1,388 |
Метиловый спирт | CH4O | 1,426 |
Мышьяк фтористый | AsF5 | 7,71 |
Неон | Ne | 0,8999 |
Нитрозилфторид | NOF | 2,176* |
Нитрозилхлорид | NOCl | 2,9919 |
Озон | O3 | 2,22 |
Окись азота | NO | 1,3402 |
Окись углерода | CO | 1,25 |
Н-октан | C8H18 | 5,03 |
Н-пентан | C5H12 (CH3(CH2)3СН3) | 3,457 |
Изо-пентан | C5H12 (СН3)2СНСН2СН3 | 3,22 |
Пропан | C3H8 | 2,0037 |
Пропилен | C3H6 | 1,915 |
Радон | Rn | 9,73 |
Силан диметил | SiH2(CH3)2 | 2,73 |
Силан метил | SiH3CH3 | 2,08 |
Силан хлористый | SiH3Cl | 3,03 |
Cилан трифтористый | SiHF3 | 3,89 |
Стибин (15°С, 754 мм.рт.ст.) | SbH3 | 5,30 |
Селеновая кислота | H2Se | 3,6643 |
Сернистый газ | SO2 | 2,9263 |
Сернистый ангидрид | SO3 | 3,575 |
Сероводород | H2S | 1,5392 |
Сероокись углерода | COS | 2,72 |
Сульфурил фтористый | SO2F2 | 3,72* |
Триметиламин | (CH3)3N | 2,58* |
Триметилбор | (CH3)3B | 2,52 |
Фосфористый водород | PH3 | 1,53 |
Фосфор фтористый | PF3 | 3,907* |
Фосфор оксифторид | POF3 | 4,8 |
Фосфор пентафторид | PF5 | 5,81 |
Фреон-11 | CF3CI | 6,13 |
Фреон-12 (дифтордихлорметан) | CF2CI2 | 5,51 |
Фреон-13 | CFCI3 | 5,11 |
Фтор | F2 | 1,695 |
Фтористый кремний | SiF4 | 4,6905 |
Фтористый метил | CH3F | 1,545 |
Фторокись азота | NO2F | 2,9 |
Хлор | Cl2 | 3,22 |
Хлор двуокись | ClO2 | 3,09* |
Хлор окись | Cl2O | 3,89* |
Хлористый водород | HCl | 1,6391 |
Хлористый метил (метилхлорид) | CH3Cl | 2,307 |
Хлористый этил | C2H5Cl | 2,88 |
Хлороформ | CHCl3 | 5,283 |
Хлорокись азота | NO2Cl | 2,57 |
Циан, дициан | C2N2 | 2,765 (2,335*) |
Цианистая кислота | HCN | 1,205 |
Этан | C2H6 | 1,356 |
Этиламин | C2H7N | 2,0141 |
Этилен | C2H4 | 1,2605 |
Этиловый спирт | C2H6O | 2,043 |
infotables.ru
