Общие способы получения металлов | Подготовка к ЦТ и ЕГЭ по химии
Общие способы получения металлов.
Природные соединения металлов:
| хлориды | сильвинит КСl ∙ NaCl, каменная соль NaCl; |
| сульфиды | серный колчедан FeS2, киноварь HgS, цинковая обманка ZnS; |
| карбонаты | мел, мрамор, известняк СаСО3, магнезит MgCO3, доломит CaCO3 ∙ MgCO3; |
| сульфаты | глауберова соль Na2SO4 ∙ 10 H2O, гипс CaSO4 ∙ 2Н2О; |
| оксиды | магнитный железняк Fe3O4, красный железняк Fe2O3, бурый железняк Fe2O3 ∙ Н2О. |
| нитраты | чилийская селитра NaNO3; |
Минералы и горные породы, содержащие металлы и их соединения и пригодные для промышленного получения металлов, называются
Отрасль промышленности, которая занимается получением металлов из руд, называется металлургией.
Способы получения металлов из руд.
- 1. Электрометаллургический способ — это способы получения металлов с помощью электрического тока (электролиза). Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы.
При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов:
NaCl (расплав) ↔ Na+ + Cl—
катод Na+ + e → Na0 ¦ 2
анод 2Cl— — 2e → Cl20 ¦ 1
суммарное уравнение: 2NaCl (распл.) – (э.ток)
→ 2Na + Cl2Современный способ получения алюминия был изобретен в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит растворяет Al2O3, как вода растворяет сахар.
Al2O3 (расплав) → Al3+ + AlO33–
катод Al3+ +3e → Al 0 ¦ 4
анод 4AlO33– –12 e → 2Al2O3 +3O2 ¦ 1
суммарное уравнение: 2Al2O3(распл.) – (э.ток)→ 4Al + 3O2 .
- Пирометаллургический способ — это восстановление металлов из их руд при высоких температурах с помощью восстановителей:
| Алюмотермия: Fe+32O3 +2Al = 2Fe0 + Al2O3 | Получают железо, хром. |
| Восстановление оксидов металлов водородом (водородотермия): Cu +2O + H2–(t)→ Cu0 + H2O | Получают малоактивные металлы – медь, вольфрам. |
| Получение чугуна: В вертикальной печи кокс окисляется до СО, затем происходит постепенное восстановление железа из руды: | 3Fe2O3 + CO –(t)→ 2Fe3O4 + CO2 , Fe3O4 + 4CO –(t)→ 3FeО + 4CO2 FeO + CO –(t)→ Fe+ CO2
|
| Восстановление углём (коксом): ZnO + C –(t)→ Zn + CO | Получают цинк, никель. |
- Гидрометаллургический способ основан на растворении природного соединения с целью получения раствора соли этого металла и вытеснением данного металла более активным. Например, руда содержит оксид меди и ее растворяют в серной кислоте: CuO + H2SO4 = CuSO4 + H2O, затем проводят реакцию замещения:
CuSO4 + Fe = FeSO4 + Cu.
Таким способом получают серебро, цинк, молибден, золото, ванадий.
Если для восстановления требуется оксид металла, то в процессе переработки сначала получают оксид:
а) из сульфида – обжигом в кислороде: 2ZnS + 3O
б) из карбоната – разложением: СаСО3–(t)→ СаО + СО2
www.yoursystemeducation.com
Способы получения металлов

Способы получения металлов.
Автор презентации: учитель химии МБОУ СОШ № 131 Цирина Татьяна Анатольевна

Металлургия.
- Металлургия – наука о промышленных способах получения металлов из природного сырья.
- Металлургия делится на три отрасли: пирометаллургию, гидрометаллургию и электрометаллургию.

Пирометаллургия.
Пирометаллургия – это получение металлов из природных руд реакциями восстановления при высокой температуре.

Получение из оксидов.
1) Восстановление углеродом.
ZnO + C Zn + CO
2) Восстановление угарным газом.
Fe 2 O 3 + 3CO 2Fe + 3CO 2
Такими способами получают металлы средней активности и неактивные.

Получение из оксидов.
3) Восстановление водородом.
WO 3 + 3H 2 W + 3H 2 O
Таким способом получают редкоземельные металлы.

Алюмотермия
4) 3MnO 2 + 4Al 3Mn + 2Al 2 O 3
Таким способом получают Mn, Cr, Ti, Mo, W

Получение из сульфидов.
Получение происходит по схеме:
сульфиды оксиды металлы
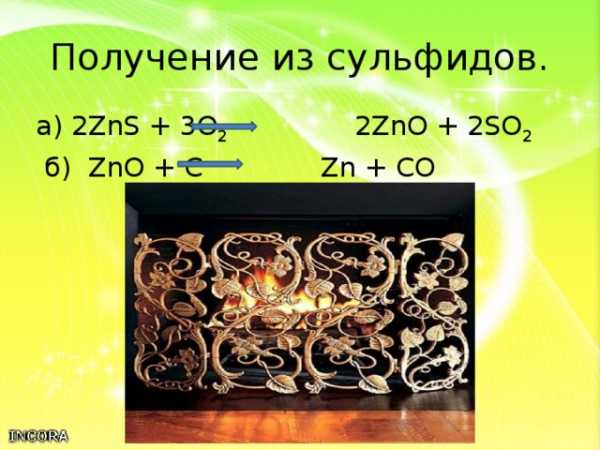
Получение из сульфидов.
а) 2ZnS + 3O 2 2ZnO + 2SO 2
б) ZnO + C Zn + CO

Гидрометаллургия.
Гидрометаллургия – получение металлов из растворов их солей.
Получение происходит по схеме:
Руда раствор соли металл

Гидрометаллургия.
а) CuO + H 2 SO 4 (р-р) CuSO 4 + H 2 O
б)CuSO 4 + Fe FeSO 4 + Cu
Таким способом получают Cu, Ag, Au, Zn, Mo, U и другие металлы.

Электрометаллургия.
Электрометаллургия
– получение металлов с помощью электрического тока (электролиз).2Na + Cl — Na 0 + Cl2 0
Таким способом получают только самые активные металлы.

Спасибо за внимание.
videouroki.net
«Способы получения металлов» — химия, уроки
Разработка урока для учащихся 10 класса.
Тема урока «Способы получения металлов»
Цель урока: Рассмотреть запасы природных соединений металлов в Казахстане и на основании природных соединений металлов определить массовую долю металла в руде, изучить способы получения металлов в промышленности.
1. Привести в систему знания о способах получения металлов на основании знаний о химических реакциях.
2. Продолжить развитие умений и навыков работы с картой полезных ископаемых Казахстана, закрепить умения и навыки в написании окислительно-восстановительных реакций, лежащих в основе производства металлов.
3. Продолжить развитие навыков творчества, исследовательской деятельности, самостоятельного изучения материала по заданному алгоритму, работая в группах, функциональной грамотности учащихся.
Тип урока: Урок получения новых знаний (интегрированный урок-исследование химия-география, нестандартный, пройдет через самостоятельную исследовательскую работу в группах. В каждой команде определен спикер, задача которого умело организовать работу с минимальной затратой времени на выполнение каждого задания).
Методы и формы обучения:
Презентация
Тестирование
Проблемный метод
Исследование
Работа в парах и группах
«Мозговой штурм» в группе
Рефлексия
Оборудование: интерактивная доска, электронные диски «Химия – базовый курс, Химия-10.11 класс», карта «Полезные ископаемые Казахстана», тестовые задания.
Программное обеспечение: Асtive Studio, Роwer Point.
Ход урока.
Эпиграф первого этапа урока «Человек не может обойтись без металлов. Если бы не металлы, человек влачил бы самую жалкую жизнь среди диких зверей» Исследователь XVI века Г. Агрикола
Проверка домашнего задания:
Творческое домашнее задание
Пролистаем альманах. Представитель команды выходит и начинает со слов «А знаете ли вы?».
Роль металлов в современном обществе огромна. Несмотря на то, что сегодня созданы разнообразные синтетические материалы с удивительными свойствами, металлы остаются важнейшими конструкционными материалами для изготовления сверхточных приборов электронной техники, основой автомобиле -, самолето-, ракето-, станкостроения.
Эпиграф второго этапа урока «Если путь твой к познанию мира ведет,-
Как бы ни был он долог и труден — вперед!»
Древнегреческоий философ Фирдоуси
II. Актуализация знаний по теме «Общие свойства металлов».
1. Вопросы для повторения. Каждая команда должна ответить на один вопрос. Если она не справляется, то ей помогают остальные команды.
Как по электронной формуле быстро определить местоположение металла в периодической таблице?
1S22S22p63S23p1 …3S23p63d34S2
Как по электронной формуле определить принадлежность металла к определенному семейству?
1S22S22p63S23p1 …3S23p63d34S2
Почему из 109 химических элементов периодической таблицы 87 приходится на долю металлов?
Почему металлы легко окисляются? Как называется величина, необходимая для отрыва внешнего электрона от атома?
2. Тестирование — четыре варианта тестовых заданий (5 минут)
(Приложение 1)
3. Самопроверка. Передали листы ответов соседу, проверяем по доске.
III. Изучение нового материала
1. Самостоятельная работа учащихся со справочной литературой, картой полезных ископаемых Казахстана по теме «Металлы в природе» по заданному алгоритму (3 минуты). Каждая команда должна заполнить таблицу. Спикер распределят задания между участниками команды.
Алгоритм работы
Содержание металлов в земной коре.
Природные соединения металлов.
Запасы руд металлов на территории Казахстана.
Задание | 1 группа Fe | 2 группа Cu | 3 группа K, Ca | 4 группа Al |
Содержание металла в земной коре. | 5,1% | 4,7∙10-3% | 3,6% Са 2,6% К | 8,1% |
Природные соединения металла | Fe2O3 Красный железняк Fe3O4 Магнитный железняк | СuS Ковеллин Сu2S Халькозин (медный блеск) | СаСО3 Мел, мрамор, известняк Са 3(РО4)2 КСl | Аl2О3 Корунд Аl2О3∙ nН2О Боксит |
Запасы руд металла на территории Казахстана | Лисаковское, Соколово-Сарбайское | Жезказган, Карсапкай | Шилишайское месторождение, г. Тараз | Костанайская, Актюбинская области |
2. На основании таблицы, используя метод «Мозгового штурма» команды должны сделать вывод (ответить на вопрос «в виде каких соединений металлы встречаются в природе?»
Li К Са Na Mg Al Zn Cr Fe Ni Sn Pb (Н2) Сu Hg Ag Pt Au
Хлориды, сульфаты, Оксиды, сульфиды Природные кристаллы
карбонаты, силикаты Самородки
Т.К. основная масса металлов встречается в виде оксидов (основные оксиды), то их получают восстановлением углём и оксидом углерода (II), водородом, алюминием.
3. Самостоятельная работа учащихся (3 мин)
Напишите ОВР получения металлов из их оксидов, показать переход электронов.
1 группа Fe | 2 группа Cu | 3 группа Zn | 4 группа Мn |
Fe2O3+ СО→ Fe + СО2 | CuO +Н2 → Cu + Н2О | ZnO+C→ Zn + CО | МnО2 + Аl →Мn + Аl2O3 |
4. Просмотр опытов (с использованием диска «Химические опыты со взрывами и без»)
IV. Рефлексия
1. В виде каких соединений металлы встречаются в природе?
2. Какие вещества используют в качестве восстановителей металлов из их оксидов?
3. Почему данный способ получения металлов считают экологически чистым процессом?
V. Домашнее задание: Рассчитать массовую долю металлов в рассмотренных оксидах: Fe2O3, CuO, ZnO, МnО2
Вариант 1 Приложение 1
Вопросы | Выбери правильные варианты ответов |
1. Металлы побочных подгрупп относятся к семейству… 2. Число электронов на внешнем уровне для металлов главных подгрупп равно… 3. Энергия ионизации в группах сверху вниз… 4. Металлические свойства в периодах справа налево… 5. Электронная формула 1S22S22p63S23p64S1 соответствует элементу… 6. Кристаллические решетки металлов бывают… | Алюминий Тетраэдрические S-элементы 2 Убывает (ют) Плоскостные Номеру периода Калий p-элементы Возрастает (ют) Магний Номеру группы d- элементы Кубические |
Вариант 2
Вопросы | Выбери правильные варианты ответов |
1. Металлы главных подгрупп относятся к семейству… 2. Число электронов на внешнем уровне для металлов побочных подгрупп равно… 3. Энергия ионизации в периодах слева направо … 4. Металлические свойства в группах снизу вверх.. 5. Электронная формула 1S22S22p63S2 соответствует элементу… 6. Кристаллические решетки металлов бывают… | Магний Гексагональные p-элементы Номеру периода Тетраэдрические Возрастает (ют) d- элементы Калий Плоскостные S-элементы Номеру группы Убывает (ют) 2 Алюминий |
kopilkaurokov.ru
Конспект урока по Химии «Общие способы получения металлов» 9 класс
Тема: «Общие способы получения металлов» 9-класс.
Цель урока: познакомить с природными соединениями металлов и с самородными металлами; дать понятие о рудах и металлургии, рассмотреть такие ее разновидности, как пиро–, гидро–, электрометаллургия, термическое разложение соединений металлов, продемонстрировать лабораторные способы получения металлов и с помощью фрагментов медиалекции ознакомить с промышленным производством металлов.
Оборудование: компьютер, видеопроектор,
I. Организационный момент.Приветствие
II. Проверка домашнего задания.
1. Написать уравнения реакций взаимодействия между веществами:
а) Li, Na, Ca, Fe c O2, Cl2, S, N2, C:
б) Na, Ca, Al c H2O;
в) Zn c H2SO4; Al c HCl;
г) Zn c CuSO4; Al c NaOH; Be c KOH.
2. Осуществите след. реакций: Al Al(OH)3 _ Al2 O3 AlCl3 Al(OH)3
Mg MgO MgSO4 Mg(OH)2
ІІІ. Природные соединения металлов.
Металлы в природе встречаются в трёх формах:
1) в свободном виде встречаются золото и платина; золото бывает в распыленном состоянии, а иногда собирается в большие массы ? самородки. Так в Австралии в 1869 году нашли глыбу золота в сто килограммов весом. Через три года обнаружили там же еще большую глыбу весом около двухсот пятидесяти килограммов. Наши русские самородки много меньше, и самый знаменитый, найденный в 1837 году на Южном Урале, весил всего около тридцати шести килограммов. В середине XVII века в Колумбии испанцы, промывая золото, находили вместе с ним тяжелый серебристый металл. Этот металл казался таким же тяжелым, как и золото, и его нельзя было отделить от золота промывкою. Хотя он и напоминал серебро (по-испански plata), но был почти нерастворим и упорно не поддавался выплавке; его считали случайной вредной примесью или преднамеренной подделкой драгоценного золота. Поэтому испанское правительство приказывало в начале XVIII столетия выбрасывать этот вредный металл при свидетелях обратно в реку. Месторождения платины находятся и на Урале. Оно представляет собой массив дунита (изверженная горная порода, состоящая из силикатов железа и магния с примесью железняка). В нем содержатся включения самородной платины в виде зерен.
2) в самородном виде и в форме соединений могут находиться в природе серебро, медь, ртуть и олово;
3) все металлы, которые в ряду напряжений находятся до олова, встречаются только в виде соединений.
Чаще всего металлы в природе встречаются в виде солей неорганических кислот: хлоридов ? сильвинит КСl • NaCl, каменная соль NaCl;
нитратов – чилийская селитра NaNO3;
сульфатов – глауберова соль Na2SO4 ? 10 H2O, гипс CaSO4 • 2Н2О;
карбонатов – мел, мрамор, известняк СаСО3, магнезит MgCO3, доломит CaCO3 • MgCO3;
сульфидов ? серный колчедан FeS2, киноварь HgS, цинковая обманка ZnS;
фосфатов – фосфориты, апатиты Ca 3(PO4)2 ;
оксидов – магнитный железняк Fe3O4, красный железняк Fe2O3, бурый железняк, содержащий различные гидроксиды железа (III)
Fe2O3 • Н2О.
Ещё в середине II тысячелетия до н. э. в Египте было освоено получение железа из железных руд. Это положило начало железному веку в истории человечества, который пришёл на смену каменному и бронзовому векам. На территории нашей страны начало железного века относят к рубежу II и I тысячелетий до н. э.
Минералы и горные породы, содержащие металлы и их соединения и пригодные для промышленного получения металлов, называются рудами.
Отрасль промышленности, которая занимается получением металлов из руд, называется металлургией. Так же называется и наука о промышленных способах получения металлов из руд.
III. Получение металлов.
— Какой основной химический процесс лежит в основе получения металлов?
Большинство металлов встречаются в природе в составе соединений, в которых металлы находятся в положительной степени окисления, значит для того, чтобы их получить, в виде простого вещества, необходимо провести процесс восстановления.
Но прежде чем восстановить природное соединение металла, необходимо перевести его в форму, доступную для переработки, например, оксидную форму с последующим восстановлением металла. На этом основан пирометаллургический способ. Это восстановление металлов из их руд при высоких температурах с помощью восстановителей неметаллических ? кокс, оксид углерода (II), водород; металлических ? алюминий, магний, кальций и другие металлы. .
Пирометаллургический способ:
1. Получение меди из оксида с помощью водорода.
Cu +2O + H2 = Cu0 + H2O (водородотермия)
2. Получение железа из оксида с помощью алюминия.
Fe+32O3 +2Al = 2Fe0 + Al2O3 (алюмотермия)
Для получения железа в промышленности железную руду подвергают магнитному обогащению:3Fe2 O3 + H2 = 2Fe3 O4 + H2O или 3Fe2O3 + CO = 2Fe3O4 + CO2 , а затем в вертикальной печи проходит процесс восстановления:
Fe3O4 + 4H2 = 3Fe + 4H2O
Fe3O4 + 4CO = 3Fe + 4CO2
Просмотр медиалекции . (CD)
Гидрометаллургический способ основан на растворении природного соединения с целью получения раствора соли этого металла и вытеснением данного металла более активным. Например, руда содержит оксид меди и ее растворяют в серной кислоте:
CuO + H2SO4 = CuSO4 + H2O, затем проводят реакцию замещения
CuSO4 + Fe = FeSO4 + Cu.
Электрометаллургический способ.
Это способы получения металлов с помощью электрического тока (электролиза). Просмотр фрагмента медиалекции. (CD)
Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы. При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов:
NaCl —> Na+ + Cl?
катод Na+ + e > Na0 ¦ 2
анод 2Cl? ?2e > Cl20 ¦ 1
суммарное уравнение: 2NaCl = 2Na + Cl2
Современный рентабельный способ получения алюминия был изобретен американцем Холлом и французом Эру в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит растворяет Al2O3, как вода растворяет сахар. Электролиз “раствора” оксида алюминия в расплавленном криолите происходит так, как если бы криолит был только растворителем, а оксид алюминия ? электролитом.
Al2O3 —> AlAlO3 —> Al3+ + AlO33–
катод Al3+ +3e —> Al 0 ¦ 4
анод 4AlO33– – 12 e —> 2Al2O3 +3O2 ¦ 1
суммарное уравнение: 2Al2O3= 4Al + 3O2 .
В английской “Энциклопедии для мальчиков и девочек” статья об алюминии начинается следующими словами: “23 февраля 1886 года в истории цивилизации начался новый металлический век — век алюминия. В этот день Чарльз Холл, 22-летний химик, явился в лабораторию своего первого учителя с дюжиной маленьких шариков серебристо-белого алюминия в руке и с новостью, что он нашел способ изготовлять этот металл дешево и в больших количествах”. Так Холл сделался основоположником американской алюминиевой промышленности и англосаксонским национальным героем, как человек, сделавшим из науки великолепный бизнес.
Термическое разложение соединений.
Железо взаимодействует с оксидом углерода (II) при повышенном давлении и температуре 100-2000, образуя пентакарбонил: Fe + 5CO = Fe (CO)5
Пентакарбонил железа-жидкость, которую можно легко отделить от примесей перегонкой. При температуре около 2500 карбонил разлагается, образуя порошок железа: Fe (CO)5 = Fe + 5CO.
Если полученный порошок подвергнуть спеканию в вакууме или в атмосфере водорода, то получится металл, содержащий 99,98– 99,999% железа. Еще более глубокой степени очистки железа (до 99,9999%) можно достичь методом зонной плавки.
Таким образом, мы познакомились с природными соединениями металлов и способами выделения из них металла, как простого вещества.
IV. Закрепление темы.
Выполнить тестовые задания:
1. Укажите справедливые утверждения: а) все элементы d- и f-семейств являются металлами; б) среди элементов р-семейства нет металлов; в) гидроксиды металлов могут обладать как основными, так амфотерными и кислотными свойствами; г) металлы не могут образовывать гидроксиды с кислотными свойствами.
2. В каком ряду приведены символы соответственно самого твердого и самого тугоплавкого металлов?
а) W, Ti; б) Cr, Hg; в) Cr, W; г) W, Cr,
3. Укажите символы металлов, которые можно окислить ионами Н+ в водном растворе кислоты: а) Cu; б) Zn; в) Fe; г) Ag.
4. Какие металлы нельзя получить в достаточно чистом виде, восстанавливая их оксиды коксом? а) W; б) Cr; в) Na; г) Al.
5. С водой только при нагревании реагируют: а) натрий; б) цинк; в) медь; г) железо.
6. Какие утверждения для металлов неверны: а) металлы составляют большинство элементов Периодической системы; б) в атомах всех металлов на внешнем энергетическом уровне содержится не более двух электронов; в) в химических реакциях для металлов характерны восстановительные свойства; г) в каждом периоде атом щелочного металла имеет наименьший радиус.
7. Отметьте формулу оксида металла с наиболее выраженными кислотными свойствами:
а) K2O; б) MnO; в) Cr2O3; г) Mn2O7.
8. В каких парах обе из реакций, схемы которых приведены ниже, позволяют получить металл?
а) CuO + CO—> и CuSO4 + Zn —> б) AgNO3 —> и Cr2O3 + Al в) ZnS + O2 и Fe2O3 + H2 —> г) KNO3 —> и ZnO + C.
9. В атомах каких металлов в основном состоянии на энергетическом d- подуровне содержится пять электронов?
а) титана; б) хрома; в) сурьмы; г) марганца.
10. Какой минимальный объем (н. у.) оксида углерода (II) нужен для восстановления 320 г оксида железа (III) до магнетита? а) 14,93 л; б) 15,48 л; в) 20,12 л; г) 11,78 л.
V. Д/З повторить
1. Укажите справедливые утверждения: а) все элементы d- и f-семейств являются металлами; б) среди элементов р-семейства нет металлов; в) гидроксиды металлов могут обладать как основными, так амфотерными и кислотными свойствами; г) металлы не могут образовывать гидроксиды с кислотными свойствами.
2. В каком ряду приведены символы соответственно самого твердого и самого тугоплавкого металлов?
а) W, Ti; б) Cr, Hg; в) Cr, W; г) W, Cr,
3. Укажите символы металлов, которые можно окислить ионами Н+ в водном растворе кислоты: а) Cu; б) Zn; в) Fe; г) Ag.
4. Какие металлы нельзя получить в достаточно чистом виде, восстанавливая их оксиды коксом? а) W; б) Cr; в) Na; г) Al.
5. С водой только при нагревании реагируют: а) натрий; б) цинк; в) медь; г) железо.
6. Какие утверждения для металлов неверны: а) металлы составляют большинство элементов Периодической системы; б) в атомах всех металлов на внешнем энергетическом уровне содержится не более двух электронов; в) в химических реакциях для металлов характерны восстановительные свойства; г) в каждом периоде атом щелочного металла имеет наименьший радиус.
7. Отметьте формулу оксида металла с наиболее выраженными кислотными свойствами:
а) K2O; б) MnO; в) Cr2O3; г) Mn2O7.
8. В каких парах обе из реакций, схемы которых приведены ниже, позволяют получить металл?
а) CuO + CO—> и CuSO4 + Zn —> б) AgNO3 —> и Cr2O3 + Al в) ZnS + O2 и Fe2O3 + H2 —> г) KNO3 —> и ZnO + C.
9. В атомах каких металлов в основном состоянии на энергетическом d- подуровне содержится пять электронов?
а) титана; б) хрома; в) сурьмы; г) марганца.
10. Какой минимальный объем (н. у.) оксида углерода (II) нужен для восстановления 320 г оксида железа (III) до магнетита? а) 14,93 л; б) 15,48 л; в) 20,12 л; г) 11,78 л.
1. Укажите справедливые утверждения: а) все элементы d- и f-семейств являются металлами; б) среди элементов р-семейства нет металлов; в) гидроксиды металлов могут обладать как основными, так амфотерными и кислотными свойствами; г) металлы не могут образовывать гидроксиды с кислотными свойствами.
2. В каком ряду приведены символы соответственно самого твердого и самого тугоплавкого металлов?
а) W, Ti; б) Cr, Hg; в) Cr, W; г) W, Cr,
3. Укажите символы металлов, которые можно окислить ионами Н+ в водном растворе кислоты: а) Cu; б) Zn; в) Fe; г) Ag.
4. Какие металлы нельзя получить в достаточно чистом виде, восстанавливая их оксиды коксом? а) W; б) Cr; в) Na; г) Al.
5. С водой только при нагревании реагируют: а) натрий; б) цинк; в) медь; г) железо.
6. Какие утверждения для металлов неверны: а) металлы составляют большинство элементов Периодической системы; б) в атомах всех металлов на внешнем энергетическом уровне содержится не более двух электронов; в) в химических реакциях для металлов характерны восстановительные свойства; г) в каждом периоде атом щелочного металла имеет наименьший радиус.
7. Отметьте формулу оксида металла с наиболее выраженными кислотными свойствами:
а) K2O; б) MnO; в) Cr2O3; г) Mn2O7.
8. В каких парах обе из реакций, схемы которых приведены ниже, позволяют получить металл?
а) CuO + CO—> и CuSO4 + Zn —> б) AgNO3 —> и Cr2O3 + Al в) ZnS + O2 и Fe2O3 + H2 —> г) KNO3 —> и ZnO + C.
9. В атомах каких металлов в основном состоянии на энергетическом d- подуровне содержится пять электронов?
а) титана; б) хрома; в) сурьмы; г) марганца.
10. Какой минимальный объем (н. у.) оксида углерода (II) нужен для восстановления 320 г оксида железа (III) до магнетита? а) 14,93 л; б) 15,48 л; в) 20,12 л; г) 11,78 л.
1. Укажите справедливые утверждения: а) все элементы d- и f-семейств являются металлами; б) среди элементов р-семейства нет металлов; в) гидроксиды металлов могут обладать как основными, так амфотерными и кислотными свойствами; г) металлы не могут образовывать гидроксиды с кислотными свойствами.
2. В каком ряду приведены символы соответственно самого твердого и самого тугоплавкого металлов?
а) W, Ti; б) Cr, Hg; в) Cr, W; г) W, Cr,
3. Укажите символы металлов, которые можно окислить ионами Н+ в водном растворе кислоты: а) Cu; б) Zn; в) Fe; г) Ag.
4. Какие металлы нельзя получить в достаточно чистом виде, восстанавливая их оксиды коксом? а) W; б) Cr; в) Na; г) Al.
5. С водой только при нагревании реагируют: а) натрий; б) цинк; в) медь; г) железо.
6. Какие утверждения для металлов неверны: а) металлы составляют большинство элементов Периодической системы; б) в атомах всех металлов на внешнем энергетическом уровне содержится не более двух электронов; в) в химических реакциях для металлов характерны восстановительные свойства; г) в каждом периоде атом щелочного металла имеет наименьший радиус.
7. Отметьте формулу оксида металла с наиболее выраженными кислотными свойствами:
а) K2O; б) MnO; в) Cr2O3; г) Mn2O7.
8. В каких парах обе из реакций, схемы которых приведены ниже, позволяют получить металл?
а) CuO + CO—> и CuSO4 + Zn —> б) AgNO3 —> и Cr2O3 + Al в) ZnS + O2 и Fe2O3 + H2 —> г) KNO3 —> и ZnO + C.
9. В атомах каких металлов в основном состоянии на энергетическом d- подуровне содержится пять электронов?
а) титана; б) хрома; в) сурьмы; г) марганца.
10. Какой минимальный объем (н. у.) оксида углерода (II) нужен для восстановления 320 г оксида железа (III) до магнетита? а) 14,93 л; б) 15,48 л; в) 20,12 л; г) 11,78 л.
1. Укажите справедливые утверждения: а) все элементы d- и f-семейств являются металлами; б) среди элементов р-семейства нет металлов; в) гидроксиды металлов могут обладать как основными, так амфотерными и кислотными свойствами; г) металлы не могут образовывать гидроксиды с кислотными свойствами.
2. В каком ряду приведены символы соответственно самого твердого и самого тугоплавкого металлов?
а) W, Ti; б) Cr, Hg; в) Cr, W; г) W, Cr,
3. Укажите символы металлов, которые можно окислить ионами Н+ в водном растворе кислоты: а) Cu; б) Zn; в) Fe; г) Ag.
4. Какие металлы нельзя получить в достаточно чистом виде, восстанавливая их оксиды коксом? а) W; б) Cr; в) Na; г) Al.
5. С водой только при нагревании реагируют: а) натрий; б) цинк; в) медь; г) железо.
6. Какие утверждения для металлов неверны: а) металлы составляют большинство элементов Периодической системы; б) в атомах всех металлов на внешнем энергетическом уровне содержится не более двух электронов; в) в химических реакциях для металлов характерны восстановительные свойства; г) в каждом периоде атом щелочного металла имеет наименьший радиус.
7. Отметьте формулу оксида металла с наиболее выраженными кислотными свойствами:
а) K2O; б) MnO; в) Cr2O3; г) Mn2O7.
8. В каких парах обе из реакций, схемы которых приведены ниже, позволяют получить металл?
а) CuO + CO—> и CuSO4 + Zn —> б) AgNO3 —> и Cr2O3 + Al в) ZnS + O2 и Fe2O3 + H2 —> г) KNO3 —> и ZnO + C.
9. В атомах каких металлов в основном состоянии на энергетическом d- подуровне содержится пять электронов?
а) титана; б) хрома; в) сурьмы; г) марганца.
10. Какой минимальный объем (н. у.) оксида углерода (II) нужен для восстановления 320 г оксида железа (III) до магнетита? а) 14,93 л; б) 15,48 л; в) 20,12 л; г) 11,78 л.
1. Укажите справедливые утверждения: а) все элементы d- и f-семейств являются металлами; б) среди элементов р-семейства нет металлов; в) гидроксиды металлов могут обладать как основными, так амфотерными и кислотными свойствами; г) металлы не могут образовывать гидроксиды с кислотными свойствами.
2. В каком ряду приведены символы соответственно самого твердого и самого тугоплавкого металлов?
а) W, Ti; б) Cr, Hg; в) Cr, W; г) W, Cr,
3. Укажите символы металлов, которые можно окислить ионами Н+ в водном растворе кислоты: а) Cu; б) Zn; в) Fe; г) Ag.
4. Какие металлы нельзя получить в достаточно чистом виде, восстанавливая их оксиды коксом? а) W; б) Cr; в) Na; г) Al.
5. С водой только при нагревании реагируют: а) натрий; б) цинк; в) медь; г) железо.
6. Какие утверждения для металлов неверны: а) металлы составляют большинство элементов Периодической системы; б) в атомах всех металлов на внешнем энергетическом уровне содержится не более двух электронов; в) в химических реакциях для металлов характерны восстановительные свойства; г) в каждом периоде атом щелочного металла имеет наименьший радиус.
7. Отметьте формулу оксида металла с наиболее выраженными кислотными свойствами:
а) K2O; б) MnO; в) Cr2O3; г) Mn2O7.
8. В каких парах обе из реакций, схемы которых приведены ниже, позволяют получить металл?
а) CuO + CO—> и CuSO4 + Zn —> б) AgNO3 —> и Cr2O3 + Al в) ZnS + O2 и Fe2O3 + H2 —> г) KNO3 —> и ZnO + C.
9. В атомах каких металлов в основном состоянии на энергетическом d- подуровне содержится пять электронов?
а) титана; б) хрома; в) сурьмы; г) марганца.
10. Какой минимальный объем (н. у.) оксида углерода (II) нужен для восстановления 320 г оксида железа (III) до магнетита? а) 14,93 л; б) 15,48 л; в) 20,12 л; г) 11,78 л.
1. Укажите справедливые утверждения: а) все элементы d- и f-семейств являются металлами; б) среди элементов р-семейства нет металлов; в) гидроксиды металлов могут обладать как основными, так амфотерными и кислотными свойствами; г) металлы не могут образовывать гидроксиды с кислотными свойствами.
2. В каком ряду приведены символы соответственно самого твердого и самого тугоплавкого металлов?
а) W, Ti; б) Cr, Hg; в) Cr, W; г) W, Cr,
3. Укажите символы металлов, которые можно окислить ионами Н+ в водном растворе кислоты: а) Cu; б) Zn; в) Fe; г) Ag.
4. Какие металлы нельзя получить в достаточно чистом виде, восстанавливая их оксиды коксом? а) W; б) Cr; в) Na; г) Al.
5. С водой только при нагревании реагируют: а) натрий; б) цинк; в) медь; г) железо.
6. Какие утверждения для металлов неверны: а) металлы составляют большинство элементов Периодической системы; б) в атомах всех металлов на внешнем энергетическом уровне содержится не более двух электронов; в) в химических реакциях для металлов характерны восстановительные свойства; г) в каждом периоде атом щелочного металла имеет наименьший радиус.
7. Отметьте формулу оксида металла с наиболее выраженными кислотными свойствами:
а) K2O; б) MnO; в) Cr2O3; г) Mn2O7.
8. В каких парах обе из реакций, схемы которых приведены ниже, позволяют получить металл?
а) CuO + CO—> и CuSO4 + Zn —> б) AgNO3 —> и Cr2O3 + Al в) ZnS + O2 и Fe2O3 + H2 —> г) KNO3 —> и ZnO + C.
9. В атомах каких металлов в основном состоянии на энергетическом d- подуровне содержится пять электронов?
а) титана; б) хрома; в) сурьмы; г) марганца.
10. Какой минимальный объем (н. у.) оксида углерода (II) нужен для восстановления 320 г оксида железа (III) до магнетита? а) 14,93 л; б) 15,48 л; в) 20,12 л; г) 11,78 л.
doc4web.ru
Способы получения металлов — Справочник химика 21
АЛЮМИНОТЕРМИЯ (алюмотермия)— способ получения металлов и их сплавов, а также неметаллов восстановлением их оксидов металлическим алюминием. А, основана на том, что соединение кислорода с алюминием сопро- [c.18]Электролиз водных растворов — важная отрасль металлургии тяжелых цветных металлов меди,висмута, сурьмы,олова, свинца, никеля, кобальта, кадмия, цинка. Он применяется также для получения благородных и рассеянных металлов, марганца и хрома. Электролиз используют непосредственно для катодного выделения металла после того, как он был переведен из руды в раствор, а раствор подвергнут очистке. Такой процесс называют электроэкстракцией. Электролиз применяется также для очистки металла — электролитического рафинирования. Этот процесс состоит в анодном растворении загрязненного металла и в последующем его катодном осаждении. Рафинирование и электроэкстракцию проводят с жидкими электродами из ртути и амальгам (амальгамная металлургия) и с электродами из твердых металлов. К электролитическим способам получения металлов относят также цементацию — восстановление ионов металла другим более электроотрицательным металлом. Цементация основана на тех же принципах, что и электрохимическая коррозия при наличии локальных элементов. Выделение металлов осуществляют иногда восстановлением их водородом, которое также может включать электрохимические стадии ионизации водорода и осаждение ионов металла за счет освобождающихся при этом электронов. [c.227]
Способы получения металлов. Сплавы [c.127]
Общие способы получения металлов. Распространение и формы нахождения металлов в природе. [c.157]
Чем отличается электролитический способ получения металлов I группы от электролитического способа получения едких щелочей [c.155]
Производство алюминия Промышленные способы получения металлов Производство стали [c.171]
Сопоставьте основные способы получения Металлов с их положением в периодической системе. Классифицируйте металлы по их положению в периодической системе и способу получения. [c.154]
Пирометаллургия охватывает способы получения металлов из руд с помощью реакций восстановления, проводимых при высоких температурах. В основе пирометаллургии лежат реакции восстановления металлов из их окислов. В тех случаях, когда руда представляет собой соль, например сульфид цинка, ее предварительно переводят в окисел [c.319]
Наиболее распространенным способом получения металла высокой чистоты из чернового никеля является электрохимическое рафинирование. В процессе рафинирования чернового никеля происходит также выделение в продукты, удобные для дальнейшей переработки, и других ценных компонентов, содержащихся в нем. [c.126]
Рассмотрим некоторые общие способы получения металлов. [c.117]
Впрочем, большинство специалистов продолжало считать, что игра не стоит свеч. К чему разрабатывать и осуществлять сложные технологические процессы извлечения металлов из нефти, когда есть достаточно богатые рудные месторождения и веками отработанные способы получения металлов из них [c.131]
Цикл включает передачи Производство серной кислоты , Катализ , РастворЬ , Горение и взрывы , Общие свойства металлов , Ряд напряжений металлов , Коррозия металлов , Электролиз , Производство алюминия , Промышленные способы получения металлов , Производство стали , Окислитель-но-восстановительные реакции , Классификация химических реакций , Закономерности протекания химических реакций . Построение и содержание телепередач цикла направлено не только на правильное усвоение учащимися основных понятий, но также на совершенствование методической работы учителя. Принимая передачи, учитель привыкает при демонстрации опытов и объяснении учебного материала обязательно указывать учащимся конкретные свойства вещества, раскрывать взаимосвязь свойств со строением, фиксировать условия протекания химических реакций, определять возможное направление процесса в других условиях. [c.92]
Общие способы получения металлов [c.117]
Сопротивление коррозии для данного металла усиливается при его покрытии более активным металлом или при их сплавлении так, покрытие железа хромом или изготовление сплавов железа с хромом устраняет коррозию железа. Хромированное железо и стали, содержащие хром нержавеющие стали) имеют высокую коррозионную стойкость. Общими способами получения металлов являются электрометаллургия, т. е. получение металлов электролизом расплавов (для наиболее активных металлов) или растворов их солей [c.160]
На этапе закрепления и систематизации знаний возможно использование учебных диафильмов Производство и применение чугуна , Производство и применение стали , телевизионных передач Промышленные способы получения металлов , Производство стали . Все эти средства применяют в комплексе с таблицами, моделями заводских аппаратов, коллекциями образцов веществ и материалов (железо и его руды, кокс, шихта, чугун, сталь и др.) и другими средствами. [c.60]
Окислительно-восстановительные реакции широко распространены. На них основаны промышленные способы получения металлов из руд, процессы горения, дыхания, фотосинтеза, электрохимические и многие другие важные процессы. [c.143]
В зависимости от способов получения металлов различают пирометаллургию, гидрометаллургию и электрометаллургию. [c.319]
I 2. Способы получения металлов. [c.472]
Назовите наиболее важные способы получения металлов из руд. Напишите уравнения реакций, протекающих при получении натрия, меди, алюминия, железа и хрома. [c.85]
Простые вещества, их свойства. Взаимодействие металлов Б-групп с галогенами, серой, кислотами. Благородные металлы. Общие способы получения металлов Б-групп. [c.182]
Основные способы получения металлов 108, 104, 55, Электролиз растворов и расплавов 88—90. [c.188]
Металлургия — наука о промышленных способах получения металлов. Она может быть черная (железо и его сплавы) и цветная (цветные металлы Сг, А1, РЬ, Mg и т. д.). 95% производимой в мире металлопродукции приходится на железо. [c.154]
По химическим признакам среди металлов выделяют активные (ЩМ, ЩЗМ, РЗЭ) и инертные, или благородные (ПМ, титан и др.). Важной является классификация по способу получения металлы бывают самородными или входят в состав руд, где они находятся в окисленном состоянии. Восстановление из руд ведут металлотермическим способом, используя активные металлы (натрий, кальций, магний и др.), углерод, водород, приемы порошковой металлургии, электролиз растворов или расплавов и т. д. [c.255]
Алюминотермия (алюмотермия) — способ получения металлов восстановлением их кислородных соединений металлическим алюминием. Явление алюминотермии было открыто и впервые использовано в 1859 г. Н. Н. Бекетовым. Алюминий для алюминотермии применяется в виде порошка или мелкой стружки. Процесс алюминотермии основан на том, что соединение алюминия с кислородом сопровождается значительно большим выделением тепла, чем окисление многих других металлов. [c.94]
Так как разнообразные способы производства различных металлов из руд базируются на ограниченном числе однотипных процессов, целесообразно рассмотреть их в комплексе как общие способы получения металлов, ознакомившись предварительно с типами и принципами переработки руд. Многие металлы применяют в виде их соединений, чаще всего — солей, поэтому полезно знать и основы производства минеральных солей. [c.390]
Итак, в основе всех способов получения металлов из их соединений лежат окислительно-восстановительные процессы. [c.168]
Каковы технические способы получения металлов из руд [c.168]
Пирометаллургаей называется способ получения металла из руд, основанный на их нагревании, например, в печах, продуваемых воздухом. Этот способ используется в двух из трех восстановительных процессов, приведенных в таблице. Нагрев при этом происходит либо на воздухе (обжиг), либо в присутствии восстановителя. Обычно используются уголь (кокс) или моноксид углерода, поскольку они недороги и доступны. Если оба этих вещества не годятся, в качестве восстановителя можно использовать более активный металл. Пирометаллургия — наиболее важный и старейший способ получения металлов из руд. [c.153]
Важнейший способ получения металлов пз руд основан на восстановлении их оксидов углем или СО. Если, например, смешать красную медную руду СпгО с углем и накалить, то уголь, восстанавливая медь, преврап1ается в оксид углерода (П), а медь выделяется в расплавленном сост(Зянии [c.334]
Метод извлечения золота из руд с помощью растворов цианидов калия или натрия был разработан в 1843 г. П. Р. Багратионом. Этот метод, прина,длежащий к гидрометаллургическим способам получения металлов, в настоящее время наиболее распространен в металлургии золота. [c.540]
Здесь рассматриваются некоторые общие свойства металлов и химические свойства оксидов и пероксидов. (на примере ряда металлов главных подгрупп периодической системы элементов Д. И. Менделеейа). Соединения металлов с серой, галогенами и другими неметаллами, а также некоторые способы получения металлов были представлены в других разделах книги. [c.165]
Тидрометаллургия охватывает способы получения металлов из растворов их солей. В этом случае элемент металла, входящего в состав руды, сначала переводят а растворимую соль с помощью соответствующих реагентов и только после этого из раствора непосредственно извлекают металл. [c.320]
Промышленные способы получения металлов из руд Электролиз расплавленных соединений ВосстаноЕление металлов углеродом, алюминотермия или электролиз водных растворов Простое нагревание соединений ШИ металлы) [c.303]
Крупнозерненый алюминий используется для термитных смесей при получении безуглеродистых металлов (Сг, Мп, Т1 и др.) по алюминотерми-ческому способу. Термитный способ получения металлов основан на реакции [c.441]
Получение металлов. Получение металлов из руд — задача металлургии. Металлургия — это наука о промышленных способах получения металлов из природного сырья. Металлургией также называют металлургическую промышленность. Современная металлургия получает более 73 металлов и многочисленные сплавы на их основе. В зависимости от способов получения металлов различают пиро-, гидро- и электрометаллургшо. [c.166]
Пирометаллургия занимает ведущее место в металлургии. Она охватывает способы получения металлов из руд с помощью реакций восстановления, проводимых при высоких температурах. В качестве восстановителей применяют уголь, активные металлы, оксид углерода (И), водород, метан. Так, например, уголь и оксид углерода (П) восстанавливают медь из красной медной руды (куприта) uaO [c.166]
Г идрометаллургия охватывает способы получения металлов из растворов их солей. При этом металл, входяш,ий в состав руды, сначала переводят в раствор с помош,ью подходящих реагентов, а затем извлекают его из этого раствора. Так, например, при обработке разбавленной серной кислотой медной руды, содержащей оксид меди (П) СиО, медь переходит в раствор в виде сульфата СиО + НаЗО = Си50,1 + Н2О [c.167]
Электрометаллургия охватывает способы получения металлов с помощью электролиза. Этим способом получак т главным образом легкие металлы — алюминий (см. 6.И), натрий (см. 6.2) и др. — из их расплавленных оксидов или хлоридов. [c.167]
chem21.info
Получение металлов из оксидов с помощью восстановителей
Для получения металлов из оксидов используются различные восстановители. Использование водорода позволяет получать активные металлы, не восстанавливаемые оксидом углерода (II). Также этот способ применяется для получения металлов с низким содержанием примесей, например, для химической лаборатории. Стоимость этого способа довольно высока. В качестве примера можно привести реакцию восстановления меди из оксида меди (II) при нагревании в струе водорода:
CuO + H2 = Cu + H2O
С указанием степени окисления элементов:
Cu+2O + H20 = Cu0 + H2+1O
Хотя реакция обратимая, но проведение ее в токе водорода, и, как следствие, удаление паров воды из зоны реакции позволяет сместить равновесие вправо и добиться полного восстановления меди.
Железо, поступающее в школьную лабораторию, часто на этикетке имеет надпись: «Восстановлено водородом»:
Fe2O3 + 3H2 = 2Fe + 3H2O
Способ восстановления металлов алюминием получил название «алюминотермия» или «алюмотермия». Алюминий является еще более активным восстановителем. Этим способом получают хром, марганец:
2Al + Cr2O3 = Al2O3 + 2Cr
При реакции оксида железа (III) с порошком алюминия (смесь необходимо поджечь магниевой лентой) выделяется много тепла:
2Al + Fe2O3 = Al2O3 + 2Fe
Алюминотермией получают некоторое количество кальция. Обратите внимание, что в электрохимическом ряду напряжений кальций находится левее алюминия, но это не делает невозможным данный способ — не следует забывать, что ряд напряжений говорит о возможности или невозможности протекания реакций только в растворах.
Оксид углерода (II) применяется наиболее широко. Например, при выплавке чугуна в доменной печи восстановителями являются кокс и образующийся оксид углерода(II). Суммарное уравнение получения железа из красного железняка:
Fe2O3 + 3CO = 2Fe + 3CO2
Чистые металлы в современной технике используются сравнительно редко. Чистые медь и алюминий применяются для изготовления электрических проводов. Цинк, никель, хром, золото наносятся на поверхность стальных изделий для защиты от коррозии и придания красивого внешнего вида.
Сплавы обладают более высокой прочностью. Легкие сплавы на основе алюминия, например, дуралюмины (содержат медь и магний) — особенно широко применяются в изготовлении летательных аппаратов, автомобилей, скоростных судов.
Сплавы на основе железа — чугун и сталь — основные конструкционные материалы современной техники. Чугун, благодаря более низкой стоимости, устойчивости к коррозии, хорошим литейным качествам широко применяется для изготовления станков, печных плит, декоративных садовых решеток и пр.
Сталь хорошо обрабатывается и обладает высокой прочностью. Добавление в сталь легирующих добавок позволяет придавать ей особые свойства: высокую твердость, устойчивость к коррозии (нержавеющие стали), кислотам (кислотоупорные), высоким температурам (жаропрочные) и т. д.
Сплавы на основе меди — латуни и бронзы — обладают хорошей теплопроводностью, устойчивостью к коррозии (в том числе в морской воде), красивым внешним видом. Применяются для изготовления радиаторов, в судостроении, для декоративных целей.
Сплавы олова и свинца — припо́и — обладают более низкой температурой плавления, чем олово и свинец в отдельности. Используются при пайке.
автор: Владимир Соколов
staminaon.com
Основные способы получения металлов — Справочник химика 21
Сопоставьте основные способы получения Металлов с их положением в периодической системе. Классифицируйте металлы по их положению в периодической системе и способу получения. [c.154]Основными способами получения редкоземельных металлов являются 1) металлотермическое восстановление хлоридов или фторидов кальцием 2) электролиз расплава безводных фторидов. Первый способ опробован в лабораторных масштабах, второй широко применяется в промышленности. [c.340]
Цикл включает передачи Производство серной кислоты , Катализ , РастворЬ , Горение и взрывы , Общие свойства металлов , Ряд напряжений металлов , Коррозия металлов , Электролиз , Производство алюминия , Промышленные способы получения металлов , Производство стали , Окислитель-но-восстановительные реакции , Классификация химических реакций , Закономерности протекания химических реакций . Построение и содержание телепередач цикла направлено не только на правильное усвоение учащимися основных понятий, но также на совершенствование методической работы учителя. Принимая передачи, учитель привыкает при демонстрации опытов и объяснении учебного материала обязательно указывать учащимся конкретные свойства вещества, раскрывать взаимосвязь свойств со строением, фиксировать условия протекания химических реакций, определять возможное направление процесса в других условиях. [c.92]
Основные способы получения металлов 108, 104, 55, Электролиз растворов и расплавов 88—90. [c.188]
Для промышленного получения ацетальдегида применяются два способа. По одному из них исходным веществом является этиловый спирт, который окисляют в ацетальдегид бихроматом, и серной кислотой или, еще лучше, воздухом в присутствии нагретых металлов (меднохромовый катализатор). Однако основным способом получения ацетальдегида является присоединение воды к ацетилену (стр. 80) в присутствии солей ртути. [c.213]
Основные способы получения металлов [c.142]
Общая характеристика металлов. Положение металлов в периодической системе. Физические свойства металлов. Химические свойства металлов. Металлы и сплавы в технике. Основные способы получения металлов. Электрохимический ряд напряжений металлов. Коррозия металлов. Методы защиты от коррозии. Электролиз расплавов и водных растворов солей. Процессы, протекающие у катода и анода. [c.8]
Металлы, их положение в периодической системе. Физические и химические свойства. Основные способы получения. Металлы и сплавы в технике. [c.502]
Основные способы получения металлов. Металлы получают из руд, т.е. исходного сырья, в котором содержится экономически приемлемое количество металла. По мере истощения руд уменьшается экономически приемлемое содержание в них металла и повышается его стоимость. [c.350]
Основными источниками получения металлов являются руды. В основе всех способов выделения металлов лежат окислительно-восстановительные реакции, суть которых сводится к восстановлению металла из оксидов. [c.240]
Назвать основные способы получения щелочных металлов. [c.9]
Рассмотрим, согласно Бредли [79], основы методики получения реплик. Имеется два основных способа получения как углеродных, так и большинства других реплик (рие. 31). Если тонкую углеродную пленку удается отделить от объекта, что обычно достигается путем растворения последнего, то применяют более простой и точный одноступенчатый метод. Объект в виде отдельного куска или частиц, нанесенных на стеклянную пластинку (рис. 31, I, а) покрывают слоем углерода (рис. 31,7,6), затем растворяют объект и промывают отделившуюся углеродную реплику (рис. 31,/, б). Если объект нельзя растворить или желательно его сохранить, то применяют двухступенчатый метод. Образец, например металл, покрывают толстым слоем пластического вещества (рис. 31, Л, б), который затем механически отделяют от образца. На промежуточный отпечаток наносят слой углерода (рис. 31, II, в), растворяют отпечаток и получают реплику. [c.97]
Основным способом получения сплавов является смешивание различных металлов в определенных пропорциях, расплавление и отливка их в специальные формы. Применение литья под давлением, в кокиль, по выплавляемым моделям, в оболочковые и песчаные формы, центробежного литья и др. позволяет получать отливки различной конфигурации, требующие лишь незначительной механической и термической обработки для превращения их в готовые изделия. [c.7]
Основным способом получения уксусной кислоты является окисле н и е уксусного альдегида кислородом воздуха. В качестве катализаторов употребляются окиси ряда металлов (кобальта, никеля, марганца, ванадия, железа, хрома и др.) или сама ледяная уксусная кислота. [c.295]
Соль можно рассматривать как продукт замещения водорода кислоты металлом или гидроксила основания — кислотным остатком. В водных растворах молекулы солей диссоциируют на положительно заряженные ионы металлов и отрицательно заряженные ионы кислотных остатков. Основным способом получения солей является взаимодействие с кислота.ми оснований, основных окислов, металлов. [c.90]
Водород и металлический уран при 1000° С восстанавливают UF4 до UP3. Щелочные и щелочноземельные металлы, как было указано выше, восстанавливают UF4 до металлического урана (основной способ получения металлического урана). [c.278]
ОСНОВНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ ЩЕЛОЧНЫХ И ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ [c.5]
Основные способы получения порошков цветных металлов [c.145]
Основными способами получения металлсодержащих полимеров являются гомополимеризация, сополимеризация и прививка соответствующих мономеров. Введение металла в полимерный продукт возможно также и за счет функциональных групп, присутствующих в уже имеющемся полимере, как в результате взаимодействия этих групп с металлсодержащими соединениями (реакция замещения), так и за счет обмена катионов в ионсодержащих функциональных группах на металл либо координационного связывания ионов металлов из гомогенной фазы. [c.161]
Основным промышленным способом получения металлического алюминия является электролиз расплавленных солей, содержащих ионы АР «. Определите величину электрического заряда, в фарадеях и кулонах, который должен быть пропущен через расплав для получения 1 кг. металла. [c.44]
Основным способом получения металлов II А подгруппы является электролиз расшхавов солей или гидроксидов. Реже используют для получения этих металлов процессы восстановления кремнием, углем, алюминием. [c.10]
Таким путем получают бор (разложение ВВгз, В ), всремний, металлы подгруппы титана и т.п. Особенностью этих методов является то, что в результате реакций пиролиза, а также диспропорционирования получаются вещества очень высокой степени чистоты. Поэтому данная группа методов находит все большее применение в современной технологии, В табл. 21 представлены основные способы получения простых веществ. [c.254]
Во многих случаях, составляющих даже большинство в области комплексных соединений, не удается найти растворитель, подходящий для изучения инфракрасных спектров, и поэтому приходится получать спектр вещества в твердом состоянии. Если не касаться исследований сравнительно больших монокристаллов, которые требуют методов, не подходящих для обычной работы, имеются три основных способа получения спектров твердых веществ. Все они включают помещение слоя беспорядочно распределенных маленьких частиц в пучок спектрометра. Это можно сделать, во-первых, без использования другого вещества в качестве матрицы. Тонкий порошок распределяется по возможности равномерно на поверхности окошка из галогенида щелочного металла либо вручную, либо путем медленного осаждения суспензии [89, 116, 117]. Когда образцы приготовляются таким образом, а также и с помощью других, описанных ниже методов, существенно, чтобы размеры частиц были не больше длины волны излучения (чтобы уменьшить рассеяние, см. ниже). Эта безматричная техника используется сейчас сравнительно редко, так как метод имеет ряд недостатков, которые устраняются в описанных ниже методах. Основные трудности заключаются в следующем [c.300]
Алюминий — металл, которого на Земле больше, чем любого другого. К сожалению, он входит главным образом в состав глин. В настоящее время отсутствует экономически оправданный крупномасштабный способ получения алюминия из такого сырья. Наиболее важным алюминиевым сырьем сейчас является боксит, состоящий в основном из оксида алюминия А12О3 2Н,0. [c.160]
Химические методы выделения металлов вызывают особый интерес. Весовое содержание кислорода в земной коре составляет 50%, и поэтому неудивительно, что многие металлы находятся в природе в виде соединений с этим высокоэлектроотрицательным элементом. Если металлы встречаются в природе в виде сульфидов, последние легко можно превратить в соответствующие окислы путем прокаливания на воздухе. Поэтому основной проблемой получения металлов является восстановление их окислов. В разд. 8.1. было отмечено, что движущей силой химической реакции является уменьщение ее свободной энергии. Эта величина, определяемая уравнением (8.6), зависит от температуры, если энтропия изменяется существенно. Наиболее удобным способом представления таких данных о свободной энергии является графический метод (Эллингем, 1944), в котором изменение в зависимости от температуры для ряда реакций (на 1 моль общего реагента) изображают на одной диаграмме. Все реакции в данном случае представляют собой восстановление окислов металлов, и поэтому общим реагентом является кислород. На рис. 9.1 приведена такая зависимость для некоторых наиболее важных металлов. [c.335]
Основные способы получения К. 1. Составление смеси порошкообразных компонентов К. конечного состава с последующей ее обработкой а) прессованием заготовок требуемой формы и последующего спекания, большей частью с образованием жидкой фазы. Этот способ применим для К. с небольшим количеством металлич. компонента б) горячим прессованием тех же заготовок с последующей термич. гомогенизацией полученного К. (или без нее) в) выдавливанием прессованием или прокаткой смеси порошков конечного состава с последующим спеканием. Во всех этих случаях для К. с относительно большим количеством металлич. фазы на завершающей стадии возможно применение горячей или холодной обработки давлением с соответствующим улучшением структуры и свойств К. 2. Формование пористого каркаса — заготовки из порошка тугоплавкого неметаллич. компонента путем холодного прессования, умеренного спекания до заданной плотности с последующей пропиткой этого каркаса расплавленным металлом без изменения формы заготовки. В нек-рых случаях после пропитки ироводят гомогенизирующий отжиг. Этим методом можно также получать К. с переменным составом в направлении от поверхности к центру изделия, в частности, с обогащением металлом поверхностных слоев. 3. Составление водной или неводной суспензии (шликера) из порош1 ообразных компонентов К. конечного состава и заливка этой суспензии в пористые, обычно гипсовые, формы. После поглощения влаги стенками формы в ней остается сформованная заготовка, к-рую затем сушат, спекают или обжигают для упрочнения. [c.273]
Основным способом получения смешанных жирноароматических эфиров тиофосфорной кислоты, как известно, является ре акция диалкилхлортиофосфатов с фенолятами щелочных металлов или фенолами в присутствии оснований . Реакция диалкилхлортиофосфатов с фенолами в отсутствие оснований или карбонатов щелочных металлов практически не идет, и соответствующие смешанные эфиры получить не удается. В связи с изучением термического разложения 0,0-диэтил-0-(4-нитрофенил)тиофосфата и эфиров хлор- и дихлортиофосфорных кислот нами было предпринято исследование реакции диалкилхлортиофосфатов с п-нитрофенолом в присутствии каталитических количеств различных ней-тра.тьных и кислых соединений при повышенной температуре. Наиболее интересные результаты получены при проведении ука-занной реакции в присутствии хлористоводородного пиридина. Реакция диалкилхлортиофосфатов с п-нитрофенолом проводилась при 130—145° на 0,1 моля эфира бралось 0,6—0,7 г соли пиридина. Основным продуктом реакции в данном случае являются 5-ал-кил-0,0-(4,4 -динитродифенил)тиофосфаты, которые образуются с выходом около 25% кроме того, получаются хлористый водород, этилен и кислые эфиры фосфорной и тиофосфорной кислот. [c.120]
Полимеризация в растворе. Как уже отмечалось (стр. 181), промышленные способы получения полнбутадиена в растворе базируются на использовании литийорганических соединений или ионно-координационных систем, содержащих металлы переменной валентности (титан, кобальт и никель). Технологическое оформление этих процессов включает следующие основные стадии 1) очистка мономера и растворителя 2) приготовление шихты (смесь бутадиена с растворителем) 3) полимеризация 4) дезактивация катализатора и введение антиоксиданта 5) отмывка раствора полимера от остатков катализатора 6) выделение полимера из раствора 7) сушка и упаковка каучука. [c.184]
Механотермический способ является одним из наиболее распространенных способов получения биметаллического материала, производство которого в последние годы постоянно возрастает. Обычно при толщине покрытия, которая составляет 4—10% от толщины листа, сцепление защитного слоя с основным металлом происходит за счет диффузии при одновременном действии температуры и давления. Плакирование защищаемого металла проводят как с одной, так и с обеих сторон защищаемого материала. Механотермический способ применяют обычно для получения листового биметалла, однако возможно получить биметаллический материал также за счет пластического деформирования отлитых заготовок, для чего плакирующий металл заливают в форму с установленной в ней стальной заготовкой. Бн-метал аический прокат нашел большое применение в нефтеперерабатывающей промышленности для корпусов аппаратов, в криогенной технике для снижения массы и повышения сопротивления материала к действию низких температур для вакуумплотного оборудования при транспортировании и хранении сжижженных газов. Представляет интерес биметаллический прокат из сплавов АМг-6+сталь XI8H9T, выпускаемый промышленным способом при толщинах до 10 мм. Полученные биметаллические листы имеют следующие механические свойства Ов = 550—640 МН/м, От = 400—500 МН/м, 0=15— 20%, прочность сцепления слоев 100 МН/м, Стср = =50 МН/м. . Высокое относительное удлинение обеспе- [c.80]
chem21.info
