Бериллий, магний, щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы.
Сегодня мы познакомимся с элементами II A группы. К ним относятся бериллий, магний, и щелочноземельные элементы: кальций, стронций, барий, радий.
Радий является радиоактивным элементом, в природе его содержание незначительно. Все изотопы радия радиоактивны, а cамый долгоживущий из них – радий 226, имеет период полураспада, равный 1620 лет.
Так как это элементы II A группы, то на внешнем энергетическом уровне у них два электрона. Эти электроны сильно отдалены от ядра, поэтому их легко оторвать, они являются сильными восстановителями. Во всех соединениях они проявляют степень окисления, равную +2.
Во II A группе сверху вниз увеличивается радиус атомов, а, следовательно, металлические и восстановительные свойства.
.
Распространённость магния и кальция в земной коре составляет около 1,5%. Содержание бериллия, стронция и бария не превышает 0,01%, а радиоактивный радий является продуктом распада урана и содержится в земной коре в очень малых количествах.
Вследствие высокой химической активности все элементы этой группы в природных условиях встречаются только в виде соединений.
Разберём физические свойства элементов (II) A группы. Простые вещества, образованные элементами этой группы, представляют собой типичные металлы с характерным металлическим блеском. Они представляют собой серебристо-белые металлы, а стронций имеет золотистый оттенок, хорошо проводят теплоту и электрический ток, имеют довольно высокие температуры плавления.
Стронций значительно твёрже бария, а барий по мягкости напоминает свинец. Из приведённой таблицы видно, что плотность металлов увеличивается сверху вниз, температуры кипения и плавления, как правило, понижаются.
Температуры плавления этих металлов гораздо выше, чем у щелочных металлов, у бериллия она превышает 1000 градусов по Цельсию, и он относится к тугоплавким металлам.
Плотность всех металлов этой группы не превышает 5 г/см3, и поэтому они относятся к лёгким.
Получают магний и кальций электролизом расплавленных хлоридов.
Что касается металлов II A группы, то они также как и щелочные металлы обладают высокой химической активностью.
При комнатной температуре к кислороду устойчивы только бериллий и магний, благодаря оксидной плёнке на поверхности. При высокой температуре окисление бериллия и магния кислородом протекает очень интенсивно.
При нагревании на воздухе эти металлы энергично сгорают с образованием оксидов. В реакции кальция с кислородом образуется оксид кальция, кальций повышает свою степень окисления до +2, а кислород понижает степень окисления до -2.
В результате сжигания магния выделяется большое количество света и теплоты, раньше эту реакцию применяли при фотографировании объектов в тёмных помещениях.
В рекцию с азотом при комнатной температуре втупает только радий, остальные металлы реагируют с азотом при нагревании с образованием нитридов. Так, в реакции бария с азотом образуется нитрид бария, барий повышает свою степень окисления до +2, а азот понижает до -3.
В реакцию взаимодействия с галогенами элементы II A группы вступают только при нагревании, при этом образуются соответствующие галогениды. В реакции кальция с хлором образуется хлорид кальция, в реакции бария с бромом образуется бромид бария. Металлы повышают свою степень окисления до +2, а галогены понижают свою степень окисления до -1.
В реакцию с серой металлы вступают тоже только при нагревании с образованием сульфидов. В реакции магния с серой образуется сульфид магния, магний повышает свою степень окисления до +2, а сера понижает степень окисления до -2.
Элементы II A группы реагируют с водородом только при высокой температуре, при этом образуются гидриды. В реакции кальция с водородом образуется гидрид кальция, где степень окисления водорода -1, а у кальция – +2.
С водой же практически не взаимодействует только бериллий
Все металлы II A группы легко растворяются в растворах кислот (серной, хлороводородной, фосфорной и т.д.) с образованием соответствующих солей и водорода. Магний практически нерастворим в плавиковой кислоте из-за малой растворимости его фторида, а бериллий реагирует с азотной кислотой только при нагревании. Остальные металлы активно взаимодействуют с кислотами. В результате взаимодействия кальция с серной кислотой образуется сульфат кальция и водород, в результате взаимодействия магния с соляной кислотой образуется хлорид магния и водород.
Бериллий, как вы помните, является амфотэрным элементом, поэтому он легко растворяется в водных растворах щелочей. В реакции бериллия с раствором гидроксида натрия образуется комплексная соль –тэтрагидроксобериллат натрия.
Подобно алюминию, магний и кальций способны восстанавливать редкие металлы – ниобий, тантал, молибдэн, вольфрам, титан – из их оксидов. Такие способы получения металлов называют магниетермией и кальциетермией. Магний чаще используют для получения титана, а кальций – для получения ванадия.
Кроме этого, магний можно использовать для вытеснения менее активного металла из раствора соли. Например, в реакции магния с раствором сульфата железа два магний вытесняет железо, как менее активный металл.
В природе щелочноземельные металлы находятся только в виде соединений из-за своей химической активности
Рассмотрим их оксиды. Их оксиды имеют состав МеО и гидроксиды состава Ме(ОН)2. Основный характер оксидов и гидроксидов увеличивается в этой группе сверху вниз. Т. е. изменяется от амфотэрных, как у оксида бериллия и гидроксида бериллия до основных, как у оксида радия и гидроксида радия.
Амфотерные BeO и Be(OH)2 → основные RaO и Ra(OH)2.
Гидроксиды бериллия и магния нерастворимы в воде, а гидроксиды щелочноземельных металлов и радия являются щелочами.
Оксиды элементов II A представляю собой твёрдые белые тугоплавкие вещества, устойчивые к воздействию высоких температур. Оксид магния почти не вступает в реакцию с водой, а оксиды щелочноземельных металлов и радия реагируют с водой, образуя гидроксиды. Например, в результате взаимодействия оксида бария с водой образуется гидроксид бария, а в реакции оксида кальция с водой – гидроксид кальция.
Оксиды щелочноземельных металлов и магния получают обжигом карбонатов: в результате разложения карбоната кальция образуется оксид кальция и оксид углерода четыре, при разложении карбоната магния образуется оксид магния и также оксид углерода (IV).
В технике оксид кальция называют негашёной известью, а оксид магния – жжёной магнэзией (её применяют для изготовления огнеупорных тиглей, труб, кирпичей, он входит в состав зубных порошков). Оба этих оксида используют в производстве строительных материалов. Они представляют собой твёрдые тугоплавкие вещества белого цвета.
Оксиды элементов II A группы легко растворяются в кислотах, а оксид и бериллия,
Гидроксиды щелочноземельных металлов являются щелочами. Их растворимость воде увеличивается в ряду от гидроксида кальция до гидроксида бария. Эти гидроксиды получают взаимодействием соответствующего оксида с водой. Гидроксид кальция получают по реакции оксида кальция с водой, гидроксид стронция по реакции оксида стронция с водой, а гидроксид бария по реакции оксида бария с водой.
Реакция взаимодействия оксида кальция с водой сопровождается выделением большого количества теплоты и называется гашением извести, а образующийся при этом гидроксид кальция – гашёной известью
. Тестообразную смесь гашёной извести с песком и водой называют известковым раствором и используют для скрепления кирпичей при кладке стен.Поглощая из воздуха углекислый газ, гидроксид кальция превращается в карбонат. Происходит постепенное затвердевание (схватывание) смеси.
Прозрачный раствор гидроксида кальция называют известковой водой, а белую взвесь его в воде – известковым молоком.
Гашёную известь используют в строительстве, а известковое молоко применяют в сахарной промышленности для очистки свекловичного сока.
Проведём небольшой эксперимент. Получим гидроксид кальция и исследуем его свойства. Для этого поместим в стаканчик немного оксида кальция, а затем добавим воду и размешаем содержимое стаканчика. У нас получился раствор гидроксида кальция.
Дадим отстояться немного этому мутному раствору
Разделим его на две пробирки. В первую пробирку будим продувать выдыхаемый воздух, который содержит углекислый газ. В результате у нас раствор мутнеет. Раствор стал мутный, вследствие образования нерастворимой соли – карбоната кальция.
А к раствору во второй пробирке добавим несколько капель фенолфталеина. Раствор окрашивается слегка в малиновый цвет, однако, окраска не такая насыщенная, как в растворах щелочей. Следовательно, раствор гидроксида кальция является малорастворимым основанием.
Гидроксиды элементов II A группы реагируют с кислотами, а гидроксид бериллия – ещё и с основаниями. Гидроксид бария в реакции с соляной кислотой образует соль – хлорид бария и воду. А гидроксид бериллия реагирует с кислотами и с основаниями. В реакции с серной кислотой образуется соль – сульфат бериллия и вода, а в результате реакции гидроксида бериллия с раствором гидроксида натрия образуется комплексная соль – тэтрагидроксобериллат натрия.
Таким образом, соли бериллия, магния и щелочноземельных металлов получают взаимодействием их с кислотами.
Соли их представляют собой белые кристаллические вещества, большинство из них растворимы в воде. Из сульфатов хорошо растворимы в воде только сульфаты бериллия и магния. Растворимость сульфатов элементов главной подгруппы II группы уменьшается от сульфата бериллия к сульфату бария. Карбонаты этих металлов малорастворимы или нерастворимы в воде. Сульфиды щелочноземельных металлов, после предварительного освещения начинают светиться различными цветами. Они входят в состав специальных светящихся красок, которые называют фосфорами. Их используют для изготовления светящихся дорожных знаков, циферблатов часов и других изделий.
Рассмотрим наиболее значимые соли.
CaCO3 – карбонат кальция – одно из самых распространённых соединений. Это соединение содержат такие минералы, как мел, мрамор, известняк.
Мрамор – основной материал для скульпторов, архитекторов. Из этого материала изготовлены стены индийского мавзолея Тадж-Махала, облицованы многие станции московского метро, созданы многие скульптуры, такие как скульптура царя Иоанна Грозного.
Без известняка не обходится ни одно строительство. Он и сам является прекрасным строительным материалом, кроме этого он используется как сырьё для получения других материалов: цемента, гашёной и негашёной извести, стекла и т.д.
Природный мел представляет собой остатки раковин древних животных. Мел используют при производстве школьных мелков, зубной пасты, бумаги, резины и побелки.
Карбонат магния – MgCO3 – необходим в производстве стекла, цемента, кирпича, в металлургии.
Сульфат кальция – CaSO4 – встречается в природе в виде минерала гипса. Его используют в строительстве, в медицине для наложения фиксирующих гипсовых поязок, получения слепков, но здесь используют полуводный гипс – алебастр, он при взаимодействии с водой образует двуводный гипс.
Кристаллогидрат сульфата магния, горькая, или английская соль используется в медицине в качестве слабительного средства. Содержится в морской воде и придаёт ей горький вкус.
Сульфат бария – BaSO4– нерастворимая в воде соль и способная задерживать рентгеновкие лучи, поэтому её используют в рентгенодиагностике («баритовая каша») для диагностики заболеваний желудочно-кишечного тракта.
Фосфат кальция – Ca3(PO4)2– входит в сотав фофоритов и апатитов, в состав костей и зубов. В организме человека содержится около одного килограмма кальция в виде фосфата кальция.
Вообще, кальций играет большую роль для всех живых организмов, потому что из него построен костный скелет. А также играеь существенную роль в процессах жизнедеятельности: ионы кальция необходимы для работы сердца, участвуют в процессах свёртывания крови.
На долю кальция приходится более 1,5% массы тела человека, 98% кальция содержится в костях, который необходим и для работы нервной системы.
Человек должен получать в день 1,5 г кальция. Наибольшее количество кальция содержится в сыре, твороге, петрушке, салате.
Ещё одним важным биоэлементом является магний, который участвует в обмене веществ. Он содержится в печени, костях, крови, нерной ткани и мозге. В организме человека содержится около 40 г магния. Магний входит в сотав хлорофилла, поэтому участвует в процессе фотосинтэза.
Соли щелочноземельных металлов окрашивают пламя в яркие цвета, поэтому их используют как добавки в фейерверки. Кальций окрашивает пламя в кирпично-красный цвет, стронций – в малиновый, барий – в светло-жёлтый.
Магний был получен в 1808 г. Дэви из белой магнэзии – минерала, который нашли вблизи греческого города Магнэзия.
Но полученный таким образом металл был загрязнён примесями, а чистый магний был получен в 1829 г. Бюсси.
Кальций впервые был получен в 1808 г. Дэви. Название было дано от латинского слова кальс, что означает «известь, мягкий камень».
Таким образом, элементы II A группы имеют на внешнем энергетическом уровне два электрона, они являются восстановителями, в соединениях они проявляют степень окисления, равную +2, в группе сверху вниз увеличиваются радиусы атомов, а следовательно восстановительные и металлические свойства. Они обладают высокой химической активностью, поэтому встречаются в природе в виде соединений. Для них характерны такие физические свойства, как металличексий блеск, тепло -и электропроводность, они лёгкие, температуры плавления у них выше, чем у щелочых металлов. Щелочноземельные металлы реагируют с неметаллами, водой, кислотами. Наиболее распространённые их соединения – оксиды, гидроксиды и соли. Оксид бериллия и его гидроксид обладает амфотэрными свойствами, оксид и гидроксид магния – слабыми основными свойствами, у остальных оксидов и гидроксидов ярко выражены основные свойства. Соли этих элементов играют большое значение, такие как карбонат кальция, сульфат магния, фосфат кальция, сульфат бария и другие.
videouroki.net
Тема 14. Бериллий, магний и щёлочноземельные металлы.
Часть I
1. Заполните таблицу «Изменение свойств щёлочноземельных металлов».
2. Схема химической связи для металлов IIA группы (М):
3. Общие химические свойства (для щёлочноземельных металлов — М).
Рассмотрим ОВР.

4. BeO и Be(OH)2 относят к амфотерным соединениям. Запишите уравнения реакций, подтверждающих это, в молекулярной, полной и сокращённой ионной формах.
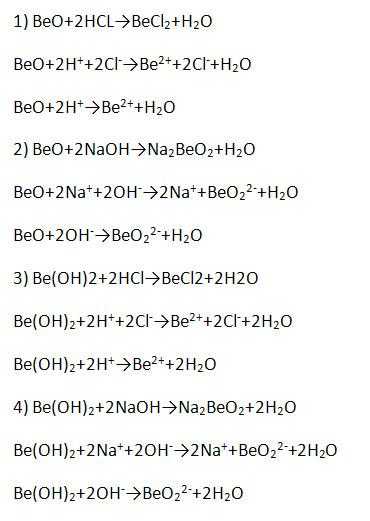
5. Подобно щелочным, щёлочноземельные металлы образуют гидриды с общей формулой МН2:
— это соединение с ионной кристаллической решёткой;
— образованы за счёт ионной химической связи, схема которой:
— по физическим свойствам эти вещества твёрдые, белые, растворимые в воде.
— взаимодействуют с водой (рассмотрите ОВР).
Часть II
1. Заполните таблицу «Применение кальция и магния».
2. Дополните цепочку переходов. Составьте уравнения реакций, с помощью которых можно осуществить превращения по схеме:
Первую и пятую реакции рассмотрите с позиций окисления-восстановления, остальные – в свете ТЭД. Для перехода Ca→Ca(NO3)2 предложите два варианта.
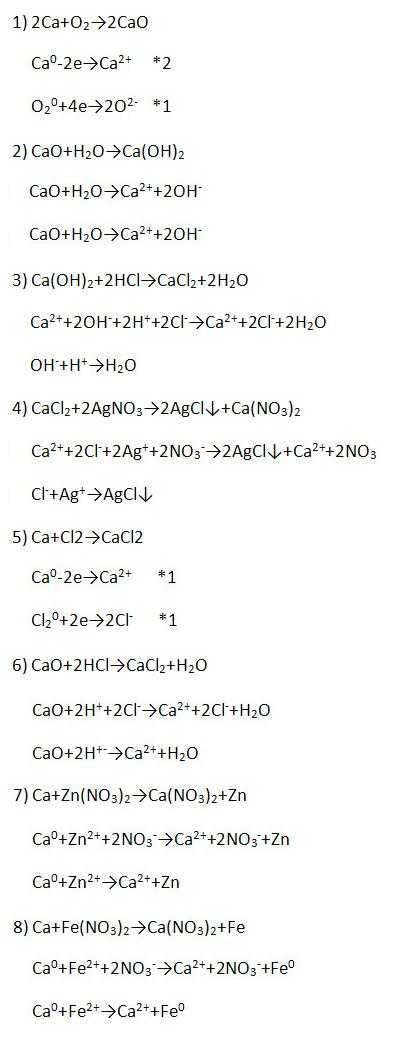
3. Проанализируйте рисунок «Взаимодействие щёлочноземельных металлов с водой». Подпишите химические формулы металлов. Объясните причину различной скорости реакций.
Скорость реакции увеличивается с активностью металла.
4. Укажите, в какой из пробирок отображено взаимодействие лития с водой, а в какой – кальция с водой.
Ответ поясните: Литий легче воды, всплывает и окисляется на поверхности.
5. Какой объём водорода образуется при взаимодействии с 0,5 л воды 20 г кальция, содержащего 5% примесей? Рассчитайте массовую долю щёлочи в полученном растворе.

6. Придумайте и решите задачу, аналогичную предыдущей, чтобы в условии фигурировал гидрид кальция.
Гидрид кальция массой 42 г вступил в реакцию с водой, массой 200 г. Найти w%(Ca(OH)2) и V(h3), если w%(прим. в Ca h3)=10%.

7. Подготовьте небольшое сообщение об одном из щёлочноземельных металлов, используя Интернет и другие источники информации.
Составьте план или запишите тезисы сообщения в особой тетради.Бериллий.
Открыт в 1798 г. французским химиком Луи Никола Вокленом, который назвал его глицинием. Современное название элемент получил по предложению химиков немца Клапрота и шведа Экеберга. В свободном виде бериллий был выделен в 1828 году французским химиком Бюсси и независимо от него немецким химиком Велером.
Известно более 30 собственно бериллиевых минералов, но промышленное значение имеет в основном берилл.
Разновидности берилла считаются драгоценными камнями: аквамарин, изумруд, гелиодор. Известны другие разновидности берилла, различающиеся окраской (темно-синие, розовые, красные, бледно-голубые, зеленые, бесцветные и др.). Цвет бериллу придают примеси.
Бериллий — относительно твердый, но хрупкий металл серебристо-белого цвета. Один из самых твердых металлов в чистом виде (уступает только осмию, вольфраму и урану). На воздухе покрывается стойкой оксидной пленкой. В бериллии очень хорошо распространяются звуковые волны — 12600 м/с.
Применяется в различных отраслях промышленности и народного хозяйства:
• Рентгенотехника
• Ядерная энергетика
• Лазерные материалы
• Аэрокосмическая техника
• Ракетное топливо
• Огнеупорные материалы
Бериллий ядовит: летучие (и растворимые) соединения бериллия, в том числе и пыль, содержащая соединения бериллия, высокотоксичные. Бериллий обладает ярко выраженным аллергическим и канцерогенным действием. Вдыхание атмосферного воздуха, содержащего бериллий, приводит к тяжелому заболеванию органов дыхания — бериллиозу.
superhimik.ru
Химические свойства металлов IIA группы (Be, Mg, Ca, Sr, Ba, Ra).
IIA группа содержит только металлы – Be (бериллий), Mg (магний), Ca (кальций), Sr (стронций), Ba (барий) и Ra (радий). Химические свойства первого представителя этой группы — бериллия — наиболее сильно отличаются от химических свойств остальных элементов данной группы. Его химические свойства во многом даже более схожи с алюминием, чем с остальными металлами IIA группы (так называемое «диагональное сходство»). Магний же по химическим свойствами тоже заметно отличается от Ca, Sr, Ba и Ra, но все же имеет с ними намного больше сходных химических свойств, чем с бериллием. В связи со значительным сходством химических свойств кальция, стронция, бария и радия их объединяют в одно семейство, называемое щелочноземельными металлами.
Все элементы IIA группы относятся к s-элементам, т.е. содержат все свои валентные электроны на s-подуровне. Таким образом, электронная конфигурация внешнего электронного слоя всех химических элементов данной группы имеет вид ns2 , где n – номер периода, в котором находится элемент.
Вследствие особенностей электронного строения металлов IIA группы, данные элементы, помимо нуля, способны иметь только одну единственную степень окисления, равную +2. Простые вещества, образованные элементами IIA группы, при участии в любых химических реакциях способны только окисляться, т.е. отдавать электроны:
Ме0 – 2e— → Ме+2
Кальций, стронций, барий и радий обладают крайне высокой химической активностью. Простые вещества, образованные ими, являются очень сильными восстановителями. Также сильным восстановителем является магний. Восстановительная активность металлов подчиняется общим закономерностям периодического закона Д.И. Менделеева и увеличивается вниз по подгруппе.
Взаимодействие с простыми веществами
с кислородом
Без нагревания бериллий и магний не реагируют ни с кислородом воздуха, ни с чистым кислородом ввиду того, что покрыты тонкими защитными пленками, состоящими соответственно из оксидов BeO и MgO. Их хранение не требует каких-либо особых способов защиты от воздуха и влаги, в отличие от щелочноземельных металлов, которые хранят под слоем инертной по отношению к ним жидкости, чаще всего керосина.
Be, Mg, Ca, Sr при горении в кислороде образуют оксиды состава MeO, а Ba – смесь оксида бария (BaO) и пероксида бария (BaO2):
2Mg + O2 = 2MgO
2Ca + O2 = 2CaO
2Ba + O2 = 2BaO
Ba + O2 = BaO2
Следует отметить, что при горении щелочноземельных металлов и магния на воздухе побочно протекает также реакция этих металлов с азотом воздуха, в результате которой, помимо соединений металлов с кислородом, образуются также нитриды c общей формулой Me3N2.
с галогенами
Бериллий реагирует с галогенами только при высоких температурах, а остальные металлы IIA группы — уже при комнатной температуре:
Мg + I2 = MgI2 – иодид магния
Са + Br2 = СаBr2 – бромид кальция
Ва + Cl2 = ВаCl2 – хлорид бария
с неметаллами IV–VI групп
Все металлы IIA группы реагируют при нагревании со всеми неметаллами IV–VI групп, но в зависимости от положения металла в группе, а также активности неметаллов требуется различная степень нагрева. Поскольку бериллий является среди всех металлов IIA группы наиболее химически инертным, при проведении его реакций с неметаллами требуется существенно большая температура.
Следует отметить, что при реакции металлов с углеродом могут образовываться карбиды разной природы. Различают карбиды, относящиеся к метанидам и условно считающимися производными метана, в котором все атомы водорода замещены на металл. Они так же, как и метан, содержат углерод в степени окисления -4, и при их гидролизе или взаимодействии с кислотами-неокислителями одним из продуктов является метан. Также существует другой тип карбидов – ацетилениды, которые содержат ион C22-, фактически являющийся фрагментом молекулы ацетилена. Карбиды типа ацетиленидов при гидролизе или взаимодействии с кислотами-неокислителями образуют ацетилен как один из продуктов реакции. То, какой тип карбида – метанид или ацетиленид — получится при взаимодействии того или иного металла с углеродом, зависит от размера катиона металла. С ионами металлов, обладающих малым значением радиуса, образуются, как правило, метаниды, с ионами более крупного размера – ацетилениды. В случае металлов второй группы метанид получается при взаимодействии бериллия с углеродом:
Остальные металлы II А группы образуют с углеродом ацетилениды:
С кремнием металлы IIA группы образуют силициды — соединения вида Me2Si, с азотом – нитриды (Me3N2), фосфором – фосфиды (Me3P2):
с водородом
Все щелочноземельные металлы реагируют при нагревании с водородом. Для того чтобы магний прореагировал с водородом, одного нагрева, как в случае со щелочноземельными металлами, недостаточно, требуется, помимо высокой температуры, также и повышенное давление водорода. Бериллий не реагирует с водородом ни при каких условиях.
Взаимодействие со сложными веществами
с водой
Все щелочноземельные металлы активно реагируют с водой с образованием щелочей (растворимых гидроксидов металлов) и водорода. Магний реагирует с водой лишь при кипячении вследствие того, что при нагревании в воде растворяется защитная оксидная пленка MgO. В случае бериллия защитная оксидная пленка очень стойкая: с ним вода не реагирует ни при кипячении, ни даже при температуре красного каления:
c кислотами-неокислителями
Все металлы главной подгруппы II группы реагируют с кислотами-неокислителями, поскольку находятся в ряду активности левее водорода. При этом образуются соль соответствующей кислоты и водород. Примеры реакций:
Ве + Н2SO4(разб.) = BeSO4 + H2↑
Mg + 2HBr = MgBr2 + H2↑
Ca + 2CH3COOH = (CH3COO)2Ca + H2↑
c кислотами-окислителями
− разбавленной азотной кислотой
С разбавленной азотной кислотой реагируют все металлы IIA группы. При этом продуктами восстановления вместо водорода (как в случае кислот-неокислителей) являются оксиды азота, преимущественно оксид азота (I) (N2O), а в случае сильно разбавленной азотной кислоты – нитрат аммония (NH4NO3):
4Ca + 10HNO3(разб.) = 4Ca(NO3)2 + N2O↑ + 5H2O
4Mg + 10HNO3(сильно разб.) = 4Mg(NO3)2 + NН4NO3 + 3H2O
− концентрированной азотной кислотой
Концентрированная азотная кислота при обычной (или низкой) температуре пассивирует бериллий, т.е. в реакцию с ним не вступает. При кипячении реакция возможна и протекает преимущественно в соответствии с уравнением:
Магний и щелочноземельные металлы реагируют с концентрированной азотной кислотой с образованием большого спектра различных продуктов восстановления азота.
− концентрированной серной кислотой
Бериллий пассивируется концентрированной серной кислотой, т.е. не реагирует с ней в обычных условиях, однако реакция протекает при кипячении и приводит к образованию сульфата бериллия, диоксида серы и воды:
Be + 2H2SO4 → BeSO4 + SO2↑+ 2H2O
Барий также пассивируется концентрированной серной кислотой вследствие образования нерастворимого сульфата бария, но реагирует с ней при нагревании, сульфат бария растворяется при нагревании в концентрированной серной кислоте благодаря его превращению в гидросульфат бария.
Остальные металлы главной IIA группы реагируют с концентрированной серной кислотой при любых условиях, в том числе на холоду. Восстановление серы может происходить до SO2, H2S и S в зависимости от активности металла, температуры проведения реакции и концентрации кислоты:
Mg + H2SO4(конц.) = MgSO4 + SO2↑ + H2O
3Mg + 4H2SO4(конц.) = 3MgSO4 + S↓ + 4H2O
4Ca + 5H2SO4(конц.) = 4CaSO4 +H2S↑ + 4H2O
с щелочами
Магний и щелочноземельные металлы со щелочами не взаимодействуют, а бериллий легко реагирует как растворами щелочей, так и с безводными щелочами при сплавлении. При этом при осуществлении реакции в водном растворе в реакции участвует также и вода, а продуктами являются тетрагидроксобериллаты щелочных или щелочноземельных металлов и газообразный водород:
Be + 2KOH + 2H2O = H2↑ + K2[Be(OH)4] — тетрагидроксобериллат калия
При осуществлении реакции с твердой щелочью при сплавлении образуются бериллаты щелочных или щелочноземельных металлов и водород
Be + 2KOH = H2↑+ K2BeO2 — бериллат калия
с оксидами
Щелочноземельные металлы, а также магний могут восстанавливать менее активные металлы и некоторые неметаллы из их оксидов при нагревании, например:
Метод восстановления металлов из их оксидов магнием называют магниетермией.
scienceforyou.ru
ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ
ПОДГРУППА IIA
БЕРИЛЛИЙ, МАГНИЙ И ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ КАЛЬЦИЙ, СТРОНЦИЙ, БАРИЙ, РАДИЙ
Строго говоря, эта подгруппа состоит из двух типов элементов. Бериллий и магний элементы коротких периодов более сходны между собой, чем с другими четырьмя элементами, которые собственно и образуют семейство щелочноземельных металлов. Фактически, бериллий и в меньшей степени магний более сходны с первыми элементами подгруппы IIIA. Особенностью электронного строения любого элемента подгруппы IIA является наличие двух электронов на внешнем слое и внутренняя электронная структура по типу предыдущего благородного газа. Способность отдавать два внешних валентных электрона возрастает в подгруппе с увеличением атомного радиуса и атомного номера элемента. Максимальная степень окисления составляет II, но имеются сведения о существовании соединений со степенью окисления I. Такие соединения неустойчивы и диспропорционируют с образованием свободного металла и иона М(II).
Физические и химические свойства. Все элементы подгруппы IIA химически активны и поэтому в свободном состоянии в природе не существуют. Щелочноземельные металлы энергично реагируют с водой, вытесняя водород и образуя гидроксиды, как и щелочные металлы. Магний взаимодействует только с кипящей водой, а бериллий не реагирует даже с парами при высокой температуре. Бериллий отличается от остальных элементов подгруппы и даже от магния по химическим и многим физическим свойствам. Такое отличие характерно для всех элементов, начинающих подгруппы А, что объясняется малым радиусом иона и соответственно высокой зарядовой плотностью. Особенности и отличия свойств бериллия приведены ниже.
Физические свойства. Бериллий очень твердый материал и способен оставлять царапины на стекле; твердость других элементов подгруппы уменьшается, и барий по твердости близок к свинцу (табл. 3).
Кристаллическая структура. Различие в физических свойствах всех металлов этой подгруппы объясняется различием их кристаллической структуры, а кальций имеет две модификации.
Взаимодействие с кислотами. Все эти элементы реагируют с разбавленными растворами минеральных кислот (типа HCl), а бериллий растворяется менее энергично. Соли бериллия (продукты реакций бериллия с кислотами, например, BeCl2) имеют более ковалентную связь, чем соли других металлов этой подгруппы, и поэтому обладают в растворе меньшей электропроводностью. В водных растворах соли бериллия гидратированы благодаря малому радиусу иона Be2+ и сильному взаимодействию с дипольными молекулами воды. Бериллий в отличие от других металлов плохо реагирует с азотной кислотой, так как на поверхности образуется защитная пассивирующая пленка BeO.
Карбонаты. Невозможно образование BeCO3 в растворе из-за сильного взаимодействия иона Be2+ c кислородом воды или OH. По той же причине и карбонат магния MgCO3, образующийся в растворе, содержит некоторую долю ассоциированного с ним основания Mg(OH)2. Другие металлы образуют в этих условиях средние карбонаты. Связь BeO в карбонате бериллия BeОCO2 настолько прочна, что эта соль способна разлагаться на BeO и CO2.
Оксиды и гидроксиды. При взаимодействии с кислородом Be и Mg образуют оксиды МО, а другие, более активные металлы, могут образовывать и пероксиды, например BaO2. Пероксиды могут образовываться и по реакции гидроксидов Ca, Sr и Ba с h3O2. Растворимость гидроксидов возрастает по мере увеличения радиуса иона и ослабления притяжения между ионом металла и гидроксид-ионом.
Комплексообразование. Ион Be2+ обладает высоким химическим сродством к ионам или молекулам, имеющим электронную пару. Например, 2 иона :Cl:предоставляют две электронные пары для образования химической связи в :Cl:Be:Cl:, 4 электрона распределяются на 2s- и 2p-гибридизованных орбиталях, формируя линейное строение молекулы BeCl2 с ковалентными свойствами. Be2+ способен удерживать большее число электронных пар, образуя различные комплексные ионы с координационным числом 4 (наиболее стабильные лиганды гидроксид-ион, альдегид, эфир, дикарбоновые кислоты, дикетоны). Be2+, как и другие члены подгруппы IIA, образует устойчивые комплексы с этилендиаминтетрауксусной кислотой (ЭДТА). Благодаря прочности комплексов с ЭДТА эта кислота часто используется для анализа содержания кальция и магния
см. также ХИМИЯ АНАЛИТИЧЕСКАЯ.
Источники сырья и применение. Все металлы подгруппы и их соединения находят различное промышленное применение. Бериллий получают из минерала берилла, отделяя гидроксид от сопутствующего алюминия. Гидроксид переводят в хлорид или фторид, и металл получают электролизом расплава галогенида. Добавки бериллия к меди приводят к получению твердого, не искрящего, прочного сплава, который широко используется в специальных пружинах и инструментах для работы во взрывоопасной атмосфере. Металл прозрачен для рентгеновского излучения и поэтому из него изготовляют окна в рентгеновских трубках. Ядро бериллия имеет низкое поперечное сечение захвата нейтронов, поэтому бериллий используется как оболочка урановых стержней в ядерных реакторах. Получение металлического магния важный технологический процесс. Металл трудно обрабатывать и сваривать из-за его воспламеняемости. Многие сплавы магния находят применение в промышленности. Чистый металл получают из морской воды или богатых рассолов осаждением в виде Mg(OH)2. Гидроксид прокаливают, образующийся оксид переводят в хлорид MgCl2, который подвергают электролизу, выделяя чистый магний. Для этих же целей можно получать оксид магния прокаливанием доломита, содержащего MgCO3. Во время Второй мировой войны был разработан процесс получения Mg восстановлением MgO угольной пылью и парами нефти.
См. также МАГНИЕВАЯ ПРОМЫШЛЕННОСТЬ.
Остальные металлы этой подгруппы получают электролизом расплавов их солей, они также имеют несколько крупных областей применения. Так, прокаливание известняка (минерал, содержащий CaCO3, MgCO3 и силикаты) с целью получения оксида кальция негашеной извести является многотоннажным производством. При частичной гидратации получается гашеная известь. Оба продукта применяются в производстве цемента, штукатурки и строительного раствора. Сульфат кальция соcтава CaSO4Ч0,5h3O известен как гипс, который при смешении с водой затвердевает с небольшим расширением в результате образования CaSO4*2h3O. См. также КАЛЬЦИЙ.
Радий. Радий существенно отличается от остальных элементов подгруппы IIA: он радиоактивен, при его распаде испускаются a- и g-частицы. По свойствам он близок к барию, особенно по растворимости (кроме растворимости хлоридов), химической активности и физическим свойствам. Радий и его соединения применяются в промышленности светящихся красок. Урановая смолка (урановая руда) содержит следы радия и служит основным источником мировой добычи радия, всего несколько сот граммов. Поделитесь на страничке
slovar.wikireading.ru
Конспект урока «Бериллий, магний и щелочноземельные металлы»
Здесь Вы можете скачать Конспект урока «Бериллий, магний и щелочноземельные металлы» для предмета : Химия. Данный документ поможет вам подготовить хороший и качественный материал для урока.
«Бериллий, магний и щелочноземельные металлы»
Цель: дать общую характеристику металлов главной подгруппы II группы. Рассмотреть основные физические и химические свойства этих элементов
Ход урока
Орг момент
Проверка умений и навыков
Генетические ряды:
LiOH ←Li →Li2O →LiOH→LiCl
↓
LiCl
Na→Na2O2→Na2O→NaOH→Na2SO4
↓
Na3PO4
Беседа по вопросам:
— Что общего в строении атомов ЩМ?
— Как меняются восстановительные свойства ЩМ в группе?
— Почему ЩМ хранят под слоем керосина?
— Перечислить физические свойства ЩМ.
— Как получают ЩМ?
— Перечислить основные химические свойства ЩМ.
— Какой характер имеют оксиды ЩМ?
— В какой цвет окрашиваю пламя соли лития, натрия, калия?
3. Изучение нового материала
Общая характеристика элементов главной подгруппы II группы
Ar | Количество электронов на последнем уровне | СО | Атомный радиус | Металлические свойства | Восстановительные свойства | |
Бериллий | 9 | 2s2 | +2 | )) | ||
Магний | 24 | 3s2 | +2 | ))) | ||
Кальций | 40 | 4s2 | +2 | )))) | ||
Стронций | 88 | 5s2 | +2 | ))))) | ||
Барий | 137 | 6s2 | +2 | )))))) | ||
Радий | [226] | 7s2 | +2 | ))))))) |
К щелочноземельным металлам относят : Ca, Sr, Ba, Ra
Ве — амфотерный металл, Mg – металл, Сa, Sr,Ba — щёлочноземельные металлы Ra –радиоактивный элемент
— Общим является одинаковое строение внешнего электронного слоя
— Элементы проявляют СО +2
— Атомы элементов являются сильными восстановителями, т.к содержат 2 электрона на внешнем энергетическом уровне, которые отдают при взаимодействиями с другими элементами.
— С увеличением № элементов увеличивается атомный радиус, увеличивается число электронных слоев, следовательно возрастает легкость отдачи электронов. Восстановительные свойства увеличиваются в группе сверху вниз.
— Mg хранится на воздухе, ЩЗМ под слоем керосина.
Физические свойства.
Be – светло-серый, твердый, хрупкий металл
Mg – относительно мягкий, пластичный, ковкий
Ca – твердый, пластичный
Sr – ковкий
Ba — пластичный, ковкий
Химические свойства элементов II группы главной подгруппы
2M+O2=2MO (оксид) | |
2.С галогенами | M+Cl2=MCl2 (хлорид) |
3.С серой | M+S=MS (сульфид) |
4.С азотом | 3M+N2=M3N2 (нитрид) |
5.С водородом | M+H2=MH2 (гидрид) |
6.С водой | M+2H2O=M(OH)2+H2 |
Химические свойства оксидов и гидроксидов
BeO – амфотерный оксид
MgO
CaO
SrO Основные оксиды
BaO
CaO +H2O → Ca(OH)2
По таблице растворимости определить растворимость гидроксидов:
Ве(ОН)2 – амфотерный гидроксид
Mg(OH)2 – нерастворимое основание
Ca(OH)2
Sr(OH)2 — растворимые основания (щелочи)
Ba(OH)2
Генетические ряды
Са(ОН)2 ←Са→СаО→Са(ОН)2→Са(NO3)2→CaSO4
Be→BeO→BeCl2→Be(OH)2→Na2BeO2
↓
BeSO4
Домашнее задание
§12, упр 5
docbase.org
Щелочноземельные металлы
Часть первая. Общая характеристика II А группы Периодической Системы элементов.
В этой группе располагаются следующие элементы: Be, Mg, Ca, Sr, Ba, Ra. Они имеют общую электронную конфигурацию: (n-1)p6 ns2 , кроме Ве 1s2 2s2 . В силу последнего, свойства Ве немного отличаются от свойств подгруппы в целом. Свойства магния тоже отличаются от свойств подгруппы, но в меньшей степени. В ряду Са – Sr – Ba – Ra свойства меняются последовательно. Относительная электроотрицательность в ряду Ве – Ra падает т.к. с увеличением размера атома валентные электроны отдаются охотнее. Свойства элементов IIА подгруппы определяются легкостью отдачи двух ns-электронов. При этом образуются ионы Э2+ . При изучении дифракции рентгеновских лучей выяснилось, что в некоторых соединениях элементы IIА подгруппы проявляют одновалентность. Примером таких соединения являются ЭГ, которые получаются при добавлении Э к расплаву ЭГ2 . Все элементы этого ряда не встречаются в природе в свободном состоянии ввиду высокой активности.
Часть вторая. Бериллий и магний.
История бериллия
Соединения бериллия в виде драгоценных камней были известны еще в древности. С давних пор люди искали и разрабатывали месторождения голубых аквамаринов, зеленых изумрудов, зеленовато-желтых бериллов и золотистых хризобериллов. Но только в конце 18 века химики заподозрили, что в бериллах есть какой-то новый неизвестный элемент. В 1798 году французский химик Льюис Николас Воклен выделил из берилла окись «La terree du beril», отличавшуюся от окиси алюминия. Эта окись придавала солям сладкий вкус, не образовывала квасцов, растворялась в растворе карбоната аммония и не осаждалась оксалатом калия. Металлический бериллий был впервые получен в 1829 году известным немецким ученым Веллером и одновременно французским ученым Бюсси, который получил порошок металлического бериллия восстановлением хлористого бериллия металлическим калием. Начало промышленного производства относится к 30-40 гг. прошлого столетия.
История магния
Свое название элемент получил по местности Магнезия в Древней Греции.Природные магнийсодержащие материалы магнезит и доломит издавна использовались в строительстве.
Первые попытки выделить металлическую основу магнезии в чистом виде были предприняты в начале XIX в. знаменитым английским физиком и химиком Гемфри Дэви (1778–1829) после того, как он подверг электролизу расплавы едкого кали и едкого натра и получил металлический Na и K. Он решил попытаться аналогичным образом осуществить разложение оксидов щелочноземельных металлов и магнезии. В своих первоначальных опытах Дэви пропускал ток через влажные оксиды, предохраняя их от соприкосновения с воздухом слоем нефти; однако при этом металлы сплавлялись с катодом и их не удавалось отделить.
Дэви пробовал применять множество различных методов, но все они по разным причинам оказывались малоуспешными. Наконец, в 1808 г. его постигла удача – он смешал влажную магнезию с оксидом ртути, поместил массу на пластинку из платины и пропустил через нее ток; амальгаму перенес в стеклянную трубку, нагрел, чтобы удалить ртуть, и получил новый металл. Тем же способом Дэви удалось получить барий, кальций и стронций. Промышленное производство магния электролитическим способом было начато в Германии в конце 19 века. Теоретические и экспериментальные работы по получению магния электролитическим способом в нашей стране были выполнены П.П. Федотьевым; процесс восстановления оксида магния кремнием в вакууме исследовал П.Ф. Антипин.
Распространение
Бериллий относится к числу не очень распространенных элементов: его содержание в земной коре составляет 0,0004 вес. %. Бериллий в природе находится в связанном состоянии. Важнейшие минералы бериллия: берилл- Be3 Al2 (SiO3 )6 , хризоберилл- Be(AlO2 )2 и фенакит- Be2 SiO4 . Основная часть бериллия распылена в качестве примесей к минералам ряда других элементов, особенно алюминия. Бериллий содержится также в глубинных осадках морей и золе некоторых каменных углей. Некоторые разновидности берилла, окрашенные примесями в различные цвета, относятся к драгоценным камням. Таковы, например, зеленые изумруды, голубовато-зеленые аквамарины.
Магний – один из самых распространенных в земной коре элементов. Содержание магния составляет 1,4 %. К числу важнейших минералов относятся, в частности, углекислые карбонатные породы, образующие огромные массивы на суше и даже целые горные хребты – магнезит MgCO3 и доломит MgCO3 -CaCO3 . Под слоями различных наносных пород совместно с залежами каменной соли известны колоссальные залежи и другого легкорастворимого магнийсодержащего минерала – карналлита MgCl2 -KCl-6H2 O. Кроме того, во многих минералах магний тесно связан с кремнеземом, образуя, например, оливин [(Mg, Fe)2 SiO4 ] и реже встречающийся форстерит (Mg2 SiO4 ). Другие магнийсодержащие минералы – это бруцит Mg(OH)2, кизерит MgSO4, эпсонит MgSO4 -7H2 O, каинит MgSO4 -KCl-3H2 O. На поверхности Земли магний легко образует водные силикаты (тальк, асбест и др.), примером которых может служить серпентин 3MgO-2SiO2 -2H2 O. Из известных минералов около 13 % содержат магний. Однако природные соединения магния широко встречаются и в растворенном виде. Кроме различных минералов и горных пород, 0,13 % магния в виде MgCl2 постоянно содержатся в водах океана (его запасы здесь неисчерпаемы – около 6-1016 т) и в соленых озерах и источниках. Магний также входит в состав хлорофилла в количестве до 2 % и выступает здесь как комплексообразователь. Общее содержание этого элемента в живом веществе Земли оценивается величиной порядка 1011 тонн.
Получение
Основной (около 70%) способ получения магния – электролиз расплавленного карналлита или MgCl2 под слоем флюса для защиты от окисления. Термический способ получения магния (около 30%) заключается в восстановлении обожженного магнезита или доломита. Бериллиевые концентраты перерабатывают в оксид или гидроксид бериллия, из которых получают фторид или хлорид. При получении металлического бериллия осуществляют электролиз расплава BeCl2 (50 вес.%) и NaCl.Такая смесь имеет температуру плавления 300 о С против 400 о С для чистого ВеCl2 . Также бериллий получают магний- или алюмотермически при 1000-12000 C из Na2 [BeF4 ]: Na2 [BeF4 ] + 2Mg = Be + 2Na + МgF2 . Особо чистый бериллий (в основном для атомной промышленности) получают зонной плавкой, дистилляцией в вакууме и электролитическим рафинированием.
Особенности
Бериллий является “чистым” элементом. В природе магний встречается в виде трех стабильных изотопов: 24 Mg (78,60%), 25 Mg (10,11%) и 26 Mg (11,29%). Искусственно были получены изотопы с массами 23, 27 и 28.
Бериллий имеет атомный номер 4 и атомный вес 9,0122. Он находится во втором периоде периодической системы и возглавляет главную подгруппу 2 группы. Электронная структура атома бериллия — 1s2 2s2 . При химическом взаимодействии атом бериллия возбуждается (что требует затраты 63 ккал/г×атом) и один из 2s-электронов переходит на 2р-орбиталь что определяет специфику химии бериллия: он может проявлять максимальную ковалентность, равную 4, образуя 2 связи по обменному механизму, и 2 по донорно-акцепторному. На кривой потенциалов ионизации бериллий занимает одно из верхних мест. Последнее соответствует его малому радиусу и характеризует бериллий как элемент не особенно охотно отдающий свои электроны, что в первую очередь определяет малую степень химической активности элемента. С точки зрения электроотрицательности бериллий может рассматриваться как типичный переходный элемент между электроположительными атомами металлов, легко отдающих свои электроны, и типичными комплексо-образователями, имеющими тенденцию к образованию ковалентной связи. Бериллий проявляет диагональную аналогию с алюминием в большей мере, чем LicMg и является кайносимметричным элементом. Бериллий и его соединения весьма токсичны. ПДК в воздухе — 2 мкг/м3 .
В периодической системе элементов магний располагается в главной подгруппе II группы; порядковый номер магния – 12, атомный вес 24,312. Электронная конфигурация невозбужденного атома – 1s2 2s2 2p6 3s2 ; строение внешних электронных оболочек атома Mg (3s2 ) соответствует его нульвалентному состоянию. Возбуждение до двухвалентного 3s1 3p1 требует затраты 62 ккал/г-атом. Ионизационные потенциалы магния меньше, чем бериллия, поэтому соединения магния характеризуются большей долей ионности связи. По комплексообразовательной способности магний тоже уступает бериллию. Взаимодействие с элементами IIIВ группы с недостроенными d-оболочками имеет некоторые особенности. В эту группу входят Sc, Y, Ln, и Th. Эти элементы образуют с магнием ряд промежуточных фаз и хорошо растворяются в нем в жидком состоянии. Диаграммы состояния смесей этих элементов с магнием – эвтектического характера. Растворимость этих элементов в магнии в твердом состоянии не велика (2 – 5 % по массе). Со щелочноземельными и особенно со щелочными металлами магний не образует значительной области растворимости в твердом состоянии, что связано с большим различием атомных радиусов. Исключением является литий, атомный радиус которого отличается от атомного радиуса магния на 2 %. Системы магния с медью, серебром и золотом – эвтектического типа. Растворимость серебра при температуре эвтектики –16 % по массе.
Физические свойства
Бериллий – металл серебристо-белого цвета. Довольно тверд и хрупок. Обладает диамагнитными свойствами. На воздухе он покрывается тонкой окисной пленкой предающей металлу серый, матовый цвет и предохраняющей от дальнейшей коррозии. Сжимаемость бериллия очень мала. Меньше всех металлов (в 17 раз меньше Аl) задерживает рентгеновское излучение. Он кристаллизуется в ГПУ-структуре с периодами а=0,228 нм, и с=0,358 нм, КЧ=6. При 1254 о С гексагональная a-модификация переходит в кубическую b. Бериллий образует эвтектические сплавы с Al и Si.
mirznanii.com
Бериллий, магний и щёлочноземельные металлы
15. Бериллий, магний и щёлочноземельные металлы
В главную подгруппу II группы входят бериллий (Be), магний (Mg), кальций (Са), стронций (Sr), барий (Ва) и радий (Ra). Кальций, стронций, барий и радий относятся к щёлочноземельным металлам. Первый элемент этой подгруппы, бериллий, по большинству свойств гораздо ближе к алюминию, чем к высшим аналогами группы, в которую он входит. Второй элемент этой группы, магний, в некоторых отношениях значительно отличается от щелочноземельных металлов по ряду химических свойствАтомы элементов II группы имеют на внешнем энергетическом уровне два электрона, которые они отдают при химических взаимодействиях, и поэтому являются сильнейшими восстановителями. Во всех соединениях они имеют степень окисления +2.
В окислительно-восстановительных реакциях все металлы подгруппы ведут себя как сильные восстановители, однако несколько более слабые, чем щелочные металлы. Это объясняется тем, что атомы металлов II группы имеют меньшие атомные радиусы. С ростом порядкового номера элемента отдача электронов облегчается, и поэтому металлические свойства возрастают.
Бериллий, магний и щелочноземельные металлы — это простые вещества. Лёгкие серебристо-белые металлы, исключение составляет только стронций, который имеет золотистый оттенок.
Например, кальций – серебристо белый и довольно твердый металл, легкий. Температура плавления и кипения выше, чем у щелочных металлов. Поскольку у кальция на энергетическом уровне находится 2 электрона, то его степень окисления во всех соединениях всегда равна +2. На воздухе кальций окисляется, поэтому его хранят в закрытых сосудах, обычно в керосине.
Химические свойства данной группы металлов рассмотрим на примере кальция.
С биологической точки зрения, кальций играет немаловажную роль для растений, животных и человека. В нашем организме он входит в состав костей. Кальций придает костям твердость. Например, при обычных условиях кальций реагирует с
галогенами, а с серой, азотом и углеродом – при нагревании. При взаимодействии кальция с хлором образуется хлорид кальция.
Ca + CI2 =CaCI2 (кальций плюс хлор два равно кальций хлор два)
При взаимодействии кальция с серой образуется сульфид кальция.
Сa + S = CaS
(кальций плюс сера равно кальций эс)
При взаимодействии кальция с азотом образуется нитрид кальция.
(три кальций плюс эн два стрелочка кальций три эн два)
Данные реакции происходят при нагревании.
Кальций (Ca) являясь активным металлом вытесняет водород из воды:
Сa + 2Н2О = Ca(ОН)2+Н2
(кальций плюс два аш два о стрелочка кальций о аш дважды плюс аш два стрелочка вверх)
При этом не все металлы главной подгруппы II группы Периодической системы одинаково реагируют с водой: бериллий практически не взаимодействует с водой, т.к. взаимодействию препятствует защитная пленка на его поверхности, реакция магния с водой протекает довольно медленно, остальные же металлы взаимодействуют с водой аналогично кальцию.
При нагревании на воздухе кальций сгорает, образуя оксид кальция:
2Сa + О2 = 2CaО
(два кальций плюс о два равно два кальций о)
При взаимодействии кальций с углеродом образует карбид кальция СaC2
Сa + 2С = CaС2
(кальций плюс два це стрелочка кальций це два)
Вследствие своей высокой химической активности в природе щёлочноземельные металлы находятся только в форме соединений.
Оксиды данных металлов твердые белые тугоплавкие вещества, устойчивые к воздействию высоких температур. Проявляют основные свойства. Исключение составляет оксид бериллия, который имеет амфотерный характер.
Рассмотрим оксиды на примере кальция.
Оксид кальция (техническое название: негашеная известь, жженая известь) – это порошок белого цвета.
Оксид кальция энергично взаимодействует с водой с образованием гидроксида кальция:
CaO + H2O = Ca(OH)2 +Q
(кальций о плюс аш два о равно кальций о аш дважды плюс ку)
Реакция оксида кальция с водой сопровождается выделением большого количества теплоты и называется гашение извести, а образующийся Ca(OH)2 — гашёной известью.
Гашеная известь – твердое вещество белого цвета, растворимое в воде. Раствор гашеной извести в воде называется известковой водой. Раствор обладает щелочными свойствами.
Рассмотрим щелочные свойства на примере:
Ca(OH)2 + CO2 → CaCO3↓ + h3O
(кальций о аш дважды плюс це о два стрелочка кальций це о три стрелочка вниз плюс аш два о)
При пропускании через известковую воду оксида углерода (IV) раствор мутнеет
(кальций це о три плюс це о два плюс аш два о две стрелочки направленны противоположно друг другу кальций аш це о три дважды)
При дальнейшем пропускании замечаем, что муть исчезает.
Соли бериллия, магния и щёлочноземельных металлов получают при взаимодействии их с кислотами.
К солям кальция относится карбонат кальция. Карбонат кальция имеет следующую формулу — CaCO3(кальций це о три)
Он содержится в известняке, меле и мраморе. Мрамор широко применяется в скульптуре и архитектуре, без известняка не обходится ни одно строительство, т.к. он сам является прекрасным строительным камнем и используется для получения таких материалов как стекло, цемент, гашеная и негашеная известь. В природе мел представляет собой остатки раковин древних животных, его можно увидеть в школе (школьные мелки), его используют в зубной пасте, при производстве бумаги, при побелке.
Сульфат кальция встречается в природе в виде минерала гипса — CaSO4*2H2О (кальций эс о четыре умножить два аш два о).
Обжигом гипса при 150-180С0 получают белый порошок – жженый гипс или алебастр
CaSO4*0,5h3О(кальций эс о четыре умножить ноль целых пять десятых аш два о).
Если алебастр смешать с водой, то он быстро затвердевает, снова превращается в гипс.
Например,
CaSO4*0,5h3О +1,5 h3О = CaSO4* 2h3О
(кальций эс о четыре умножить ноль целых пять десятых аш два о плюс одна целая пять десятых аш два о равно кальций эс о четыре умножить два аш два о)
Сульфат кальция широко используют в строительстве для изготовления скульптур и скульптурных элементов, для облицовочных и отделочных работ, в медицине для изготовления гипсовых повязок.
infourok.ru
