Химические соединения — это… Характеристика, примеры и свойства
Большинство людей не задумывается о составе окружающих их предметов, веществ, материи. Атомы, молекулы, электроны, протоны — эти понятия кажутся не только непонятными, но и далекими от действительности. Однако такое мнение ошибочно. Практически все, что нас окружает, состоит из химических связей. Химические соединения — это достаточно сложные формы веществ. В окружающем нас мире великое множество таких связей. Однако и соединения, состоящие только из одного элемента химического, могут относиться к ним, например, кислород или хлор. Поэтому стоит подробнее разобрать вопрос: «Химические соединения — это что?»

Сложный «химический» мир
Мало кто задумывается о том, что окружающий нас мир состоит из сложных структур, макромолекул и крошечных частиц. Удивительно, насколько разнородны даже размеры атомов у разных элементов. Различия в величинах атомных масс тоже впечатляют — бериллий со своими 9 а. е. м. — «легковес» по сравнению с «тяжеловесом» астатом: его атомный вес составляет 210 а. е. м. (а. е. м. — атомные единицы массы — единица измерения массы атомов, молекул, ядер, которая равна 1/12 массы атома углерода, находящегося в основном состоянии).
Многообразие элементов обуславливает и наличие множества химических соединений (это, простыми словами, комбинация соединенных между собой атомов различных и, в некоторых случаях, одинаковых частей). Большинство предметов, веществ представляют собой именно такого рода соединения. Необходимый для жизни кислород, поваренная соль, ацетон… Можно еще очень долго перечислять примеры и всем известные, и понятные только узким специалистам. Что же такое эти химические соединения?

Определение, отличие от смесей
Химические соединения — это сложные вещества, которые состоят из соединенных между собой атомов разных химических элементов, однако существуют исключения: к химическим соединениям относятся и простые вещества (то есть состоят из атомов одного элемента), если атомы этих веществ соединены ковалентной связью (она образована общими для обоих атомов электронами). К таким веществам относятся азот, кислород, большинство галогенов (в таблице Менделеева элементы седьмой группы главной подгруппы; фтор, хлор, бром, йод, предположительно и астат).
Зачастую путают между собой понятия «химическое соединение» и «смесь простых веществ». Смесь веществ — это, как можно сделать вывод из названия, не самостоятельное вещество, а система двух и более компонентов. Сам состав этих двух единиц химических веществ является основным различием между ними. Как уже говорилось, соединение химических элементов и смесь простых (или сложных) веществ — это не одно и то же. Свойства, способы получения, методы разделения на компоненты также являются отличительными критериями смесей и соединений. Важно отметить, что ни получить, ни разделить химические соединения нельзя без проведения химических реакций, а смеси — можно.

Очень многие люди также путают между собой словосочетания «соединение химических веществ» и «соединение элементов». По непонятным причинам, но, скорее всего, в силу своей некомпетентности, большинство из них не видит разницы между первым и вторым научными понятиями. Стоит узнать и понимать, что не существует такой терминологии, как «соединение химических веществ». Не стоит повторять за другими ошибки этимологии тех или иных не только выражений, но и слов.
Как определить свойства соединений
Зачастую свойства химических соединений разительно отличаются от свойств элементов, из которых они состоят. Например, молекула этилового спирта состоит из двух атомов углерода, шести атомов водорода и одного атома кислорода, однако его свойства разительно отличаются от свойств всех элементов своего состава. В связи с тем, что существуют разные классы соединений, то и свойства у каждого из них свои. Большинство реакций, безусловно, являются характерными для многих соединений, однако механизмы их проявления разные.

На какие классы делятся химические соединения
В зависимости от своей природы, существуют такие классы химических соединений, как органические и неорганические. Стоит сказать, что органическими называют вещества (соединения), в составе которых присутствует углерод (исключения составляют некоторые соединения, содержащие углерод, но относящиеся к неорганическим, ниже они приводятся). Основными группами органических соединений являются углеводороды, спирты, альдегиды, кетоны, эфиры, карбоновые кислоты, амиды и амины. Неорганические вещества (соединения) в своем составе не содержат атомов углерода, однако среди них можно выделить карбиды, цианиды, карбонаты и оксиды углерода, так как они, наравне с органическими соединениями, в своем составе содержат его атомы. И те, и другие соединения имеют свои особенности, свои свойства, причем разные группы соединений одного класса могут иметь разные характеристики.
Неорганические соединения: основные свойства
Все неорганические соединения можно разбить на несколько групп. У каждого из данных видов соединений есть общие свойства, зачастую не совпадающие с другими группами этого же класса. Итак, ответ на вопросы, какие химические соединения относятся к неорганическими, какие группы образуют и какими свойствами обладают, можно представить следующим образом:
- Первая группа — простые неорганические соединения неметаллической природы. Данную категорию соединений объединяют такие свойства, как возможность находиться в газообразном состоянии. Твердые соединения неметаллического характера обладают немолекулярным строением, в связи с чем способны к образованию кристаллов.
- Вторая группа — сложные неорганические соединения. Их можно разделить на четыре подгруппы.

Сложные неорганические соединения, их свойства
Как было сказано ранее, вторую группу неорганических соединений можно разделить на четыре подгруппы:
- Оксиды. Для этой подгруппы неорганических соединений характерны реакции взаимодействия с водой, кислотами и кислотными оксидами (у них есть соответствующая кислородсодержащая кислота).
- Кислоты. Эти соединения взаимодействуют с водой, щелочами и основными оксидами (у них есть соответствующее основание).
- Амфотерные соединения — соединения, которые могут вести себя и как кислоты, и как основания (обладают и теми, и теми свойствами). Такие соединения реагируют и с кислотными оксидами, и с основаниями.
- Гидроксиды. Эти вещества неограниченно растворяются в воде, изменяют окраску при воздействии на них щелочами.
Соединения органической природы
Большинство предметов, с которыми человек ежедневно сталкивается, изготовлены из органических соединений. Органические химические соединения представляют собой обширный класс связей, составы и свойства групп, при взаимодействии которых они отличаются завидной разнообразностью. Стоит подробнее рассмотреть группы этих соединений.

Группы органических соединений и их некоторые свойства
- Углеводороды. Они представляют собой соединения только атомов водорода и углерода. Можно выделить предельные и непредельные, линейные (ациклические) и карбоциклические, ароматические и не ароматические; алканы, алкены, алкины, диены, нафтены. Для всех перечисленных углеводородов является общим свойством их не смешиваемость с водой. Для предельных типичны реакции замещения, а для непредельных — присоединения.
- Спирты — соединения, содержащие в своем составе гидроксильную (-ОН) группу (конечно, органические соединения). Они обладают свойствами слабых кислот, для них характерны реакции нуклеофильного замещения и реакции окисления, а также спирты сами могут выступать в качестве нуклеофила.
- Простые и сложные эфиры. Простые эфиры малорастворимы в воде, обладают слабоосновными свойствами. Сложные эфиры выступают в качестве носителей электрофильных реагентов, вступают в реакции замещения.
- Альдегиды (содержат альдегидную -СНО группу). Они вступают в такие реакции, как присоединение, окисление, восстановление, сопряженного присоединения.
- Кетоны. Для них характерны гидрирование, конденсация, нуклеофильное замещение.
- Карбоновые кислоты. Они проявляют, конечно же, кислотные свойства. Восстановление, галогенирование, реакции нуклеофильного замещения у ацильного атома углерода, получение амидов и нитрилов, декарбоксилирование — основные характерные реакции.
- Амиды. Гидролизация, разложение, кислотность и основность — основные свойственные реакции для амидов.
- Амины. Являются основаниями; взаимодействуют с водой, с кислотами, с ангидридами, галогенами и галогеналканами.
fb.ru
Химическое соединение — это… Что такое Химическое соединение?
Стереоскопическое изображение химического соединенияХими́ческое соедине́ние — сложное вещество, состоящее из химически связанных атомов двух или нескольких элементов (гетероядерные молекулы). Некоторые простые вещества также могут рассматриваться как химические соединения, если их молекулы состоят из атомов, соединённых ковалентной связью (азот, кислород, иод, бром, хлор, фтор, предположительно астат).[1] Инертные (благородные) газы и атомарный водород нельзя считать химическими соединениями.
История
Для формулирования понятия про химическое соединение важное значение имел закон постоянства состава, открытый Жозефом Прустом в 1799 году[2]. Этот закон утверждает, что независимо от того, каким образом было получено определенное соединение, оно всегда состоит из одних и тех же химических элементов, причем отношение масс этих элементов выражается малыми целыми числами. Через несколько лет, в 1803 году Джон Дальтон сформулировал закон кратных отношений, согласно которому в случае, когда из определенных элементов могут образовываться два соединения, с определённой массой первого из них сочетаются такие массы другого, что отношение их тоже даёт целое число
Понятие структурной формулы ввёл в 1850-тые годы немецкий химик Фридрих Август Кекуле фон Штрадониц[6][7].
Качественный и количественный состав
Состав химического соединения записывается в виде химических формул, а строение часто изображается структурными формулами. Систематическое название (номенклатура ИЮПАК) также указывает состав соединения.
В подавляющем большинстве случаев химические соединения подчиняются закону постоянства состава и закону кратных отношений. Однако известны довольно многочисленные соединения переменного состава (бертоллиды), например:
- PaO2,18—PaO2,21.
Для установления качественного и количественного состава химического соединения, используются различные методы химического анализа (например, колориметрия, хроматография). Эти методы являются предметом изучения аналитической химии.
Отличия соединений и смесей
Физические и химические свойства соединений отличаются от свойств смеси простых веществ — это один из главных критериев отличия соединения от смесей простых или сложных веществ, так как свойства смеси обычно тесным образом связаны со свойствами компонентов. Другим критерием отличия является то, что смесь обычно может быть разделена на составляющие нехимическими процессами, такими, как просеивание, фильтрация, выпаривание, использование магнитов, тогда как компоненты химического соединения могут быть разделены только при помощи химической реакции. И наоборот, смеси могут быть созданы без использования химической реакции, а соединения — нет.
Некоторые смеси так тесно связаны, что некоторые их свойства сходны со свойствами химических соединений, и их легко спутать. Наиболее частым примером таких смесей являются сплавы. Сплавы изготавливаются при помощи физических процессов, обычно — путём расплавления и смешивания компонентов с последующим остыванием. Другим примером смесей, не являющихся сплавами, являются интерметаллиды.
Химические реакции
Химические соединения получают в результате химических реакций. Сложные вещества могут разлагаться с образованием нескольких других веществ. Образование химических соединений сопровождается выделением (экзотермическая реакция) или поглощением (эндотермическая реакция) энергии. Физические и химические свойства химических соединений отличаются от свойств веществ, из которых они получены. Химические соединения разделяются на неорганические и органические. Известно более 100 тыс. неорганических и более 3 млн органических соединений. Каждое химическое соединение, которое описано в литературе, имеет уникальный идентификатор — CAS-номер.
Классы химических соединений
Химические соединения делят на классы: неорганические и органические. Последние в широком смысле включают в себя элементоорганические соединения: борорганические, кремнийорганические, фосфорорганические и др.
Некоторые виды cложных неорганических соединений:
Органические вещества

Органические соединения, органические вещества — класс химических соединений, в состав которых входит углерод (за исключением карбидов, угольной кислоты, карбонатов, оксидов углерода и цианидов).[8]
Неорганические вещества
Неорганическое вещество или неорганическое соединение — это химическое соединение, которое не является органическим, то есть оно не содержит углерода (кроме карбидов, цианидов, карбонатов, оксидов углерода и некоторых других соединений, которые традиционно относят к неорганическим). Неорганические соединения не имеют характерного для органических углеродного скелета.
Регистрационный номер CAS
Всем химическим веществам, а значит, всем химическим соединениям, описанным в научной литературе, присваивается номер CAS, химической реферативной службы, по которому вещество можно идентифицировать в базах данных, например в PubChem.
Литература
- Robert Siegfried From elements to atoms: a history of chemical composition. — American Philosophical Society, 2002. — ISBN 978-0-87169-924-4
См. также
Примечания
- ↑ Соединение химическое — БСЭ — Яндекс. Словари
- ↑ Proust, J.-L. (1799). Researches on copper, Ann. chim., 32:26-54. Excerpt, in Henry M. Leicester and Herbert S. Klickstein, A Source Book in Chemistry, 1400—1900, Cambridge, MA: Harvard, 1952. Accessed 2008-05-08.
- ↑ Helmenstine, Anne Law of Multiple Proportions Problem. 1. Архивировано из первоисточника 8 декабря 2012. Проверено 31 января 2012.
- ↑ law of multiple proportions definition
- ↑ law of multiple proportions (chemistry) (англ.). — статья из Encyclopædia Britannica Online.
- ↑ Aug. Kekulé (1857). «Über die s. g. gepaarten Verbindungen und die Theorie der mehratomigen Radicale». Annalen der Chemie und Pharmacie 104 (2): 129–150. DOI:10.1002/jlac.18571040202.
- ↑ Aug. Kekulé (1858). «Ueber die Constitution und die Metamorphosen der chemischen Verbindungen und über die chemische Natur des Kohlenstoffs». Annalen der Chemie und Pharmacie 106 (2): 129–159. DOI:10.1002/jlac.18581060202.
- ↑ Хомченко Г. П. Пособие по химии для поступающих в вузы. — 3-е изд. испр. и доп. — М.: ООО «Издательство Новая Волна», ЗАО «Издательский Дом ОНИКС», 2000. с. 334. ISBN 5-7864-0103-0, ISBN 5-249-00264-1
Ссылки
dic.academic.ru
Химические соединения — Электронный учебник K-tree
После прочтения статьи Вы узнаете, как образуются молекулы, какие процессы происходят при связи атомов и какие виды связей бывают
Химическое соединение — это вещество, состоящее из двух и более атомов, связанных между собой химической связью. Органические химические соединения описаны в разделе органическая химия.
Молекула
Различные атомы могут соединяться между собой и образовывать сложные соединения — молекулы. Примером молекулы может быть H2O — вода, HCl — соляная кислота или H2SO4 — серная кислота. Когда два атома находятся на близком расстоянии, их электронные облака могут перекрыться и образовать соединение — молекулу, при этом ядра атомов будут находиться внутри одного электронного облака.
На большом расстоянии атомы не взаимодействуют друг с другом, на некотором расстоянии атомы притягиваются друг к другу и на очень близких расстояниях атомы отталкиваются. В какой-то момент силы отталкивания и притяжения уравновешиваются и атомы могут соединиться в молекулу. На возникновение связи главным образом влияет электронная конфигурация каждого из атомов. Дело в том, что каждый электрон двигается по некоторой орбитали, т.е. обладает некоторым уровнем энергии. Образование связи между атомами обозначает создание общих электронных орбиталей, т.е. создаются другие, новые энергетические уровни, по которым двигаются электроны.
Молекулярные орбитали
Молекулярные орбитали — это метод, позволяющий определить конфигурацию электронной оболочки молекулы, а также
её свойства. На каждом энергетическом уровне молекулярной орбитали, как и на атомной орбитали, располагаются два электрона.
При этом уровни образуются так, что первый укрепляет связь между атомами, а следующий за ним ослабляет (разрыхляет) связь.
На рисунке 2 показано, как выглядят σ- и π-связи в пространстве. На рисунке 1 показано перераспределение
электронов с атомных орбиталей на молекулярные орбитали.
Последовательность заполнений молекулярных орбиталей следующая:
σ
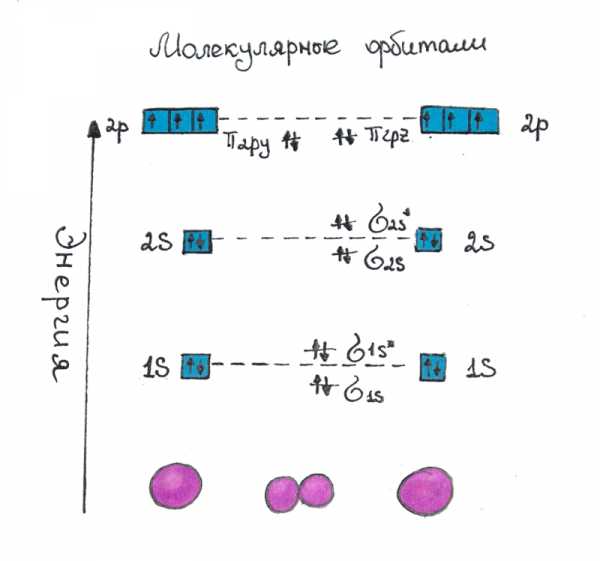 Рис.1 Молекулярные орбитали. Энергетический уровень молекулярных орбиталей относительно атомных. Расположение электронов в молекуле N2.
Рис.1 Молекулярные орбитали. Энергетический уровень молекулярных орбиталей относительно атомных. Расположение электронов в молекуле N2. 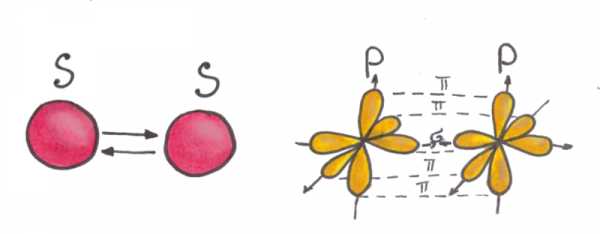 Рис.2 Сигма- и пи-связи в молекуле между двумя атомами. При взаимодействии p-орбиталей образуются две π-связи и одна σ-связь
Рис.2 Сигма- и пи-связи в молекуле между двумя атомами. При взаимодействии p-орбиталей образуются две π-связи и одна σ-связьМагнитные свойства вещества
Магнитные свойства вещества определяются его электронной конфигурацией, вне зависимости от того, атом это или молекула. Если один или более электронов в оболочке находятся без пары, то вещество, образованное такими молекулами будет обладать парамагнитными свойствами — будет намагничиваться во внешнем магнитном поле. В противном случае вещество называется
Ионная связь
Самые распространённые типы связей в молекуле это: ковалентная, металлическая и ионная связи. Ионная связь основана на притяжении разноимённых зарядов — катионов и анионов. Например, катиону натрия Na+ для возврата в основное состояние необходим один электрон, аниону хлора Cl— необходимо отдать один электрон для возврата в основное состояние. Таким образом при взаимодействии Na+ и Cl—, в образованной молекуле они делят между собой один электрон, что позволяет им находиться в стабильном состоянии.
k-tree.ru
Химическое соединение
Для химического соединения характерны следующие отличительные особенности:
1) Кристаллическая решетка отличается от решеток компонентов, образующих соединение.
2) В соединении всегда сохраняется простое кратное соотношение его компонентов. Это позволяет выразить их состав простой формулой AmBn, где А и В – соответствующие элементы, n и m – простые числа.
3) Свойства соединения резко отличаются от свойств образующих его компонентов.
4) Температура плавления (диссоциации) постоянная.
5) Образование химического соединения сопровождается значительным тепловым эффектом.
Химические соединения образуются между компонентами, имеющими большое различие в электронном строении атомов и кристаллических решеток.
В качестве примера типичных химических соединений можно назвать такие, как соединения магния с элементами IV-VI групп периодической системы: Mg2Sn, Mg2Pb, Mg2P, Mg3Sb, MgS и другие.
Соединения одних металлов с другими носят общее название интерметаллических соединений, или интерметаллидов.
Соединения металла с неметаллом (нитриды, оксиды, карбиды и др.) могут иметь как металлическую, так и ионную связь. Соединения, имеющие металлическую связь, называют металлическими соединениями.
Большое число химических соединений, образующихся в металлических сплавах, отличается от типичных химических соединений, так как не подчиняется законам валентности и не имеет постоянного состава. Рассмотрим наиболее важные химические соединения, образующиеся в сплавах.
7.2.1.Фазы внедрения. Переходные металлы (Fe, Mn, Cr, Mo и др.) образуют с углеродом, азотом, бором и водородом, т.е. с элементами, имеющими малый атомный радиус, соединения: карбиды, нитриды, бориды и гидриды. Они имеют общность строения и свойств и часто называются фазами внедрения.
Фазы внедрения имеют формулу М4Х (Fe4N, Mn4N и др.), M2X (W2C, Fe2N и др.), MX (WC, TiC,TiN и др.).
Кристаллическая структура фаз внедрения определяется соотношением атомных радиусов неметалла (Rx) и металла (RM). Если Rx/ RM <59, то атомы в этих фазах расположены по типу одной из кристаллических решеток: кубической или гексагональной, в которую внедряются атомы неметалла, занимая в ней определенные поры.
Фазы внедрения являются фазами переменного состава. Карбиды и Нитриды обладают высокой твердостью. Кристаллическая решетка фаз внедрения отличается от решетки металла.
7.2.2. Электронные соединения (фазы Юм-Розери). Эти соединения чаще образуются между одновалентными (Cu, Ag, Au, Li, Na) металлами или металлами переходных групп (Fe, Mn, Co и др.), с одной стороны, и с простыми металлами с валентностью от 2 до 5 (Be,
Mg, Zn, Cd, Al и др.), с другой стороны. Соединения этого типа имеют определенное соотношение числа валентных электронов к числу атомов, т.е. определенную электронную концентрацию. Эти соотношения, как показал английский металлофизик Юм-Розери, могут быть 3/2, 21/13 и 7/4, причем каждому соотношению соответствует определенная кристаллическая решетка: объемно центрированная кубическая или гексагональная решетка, сложная кубическая решетка и гранецентрированная кубическая решетка, соответственно.
7.2.3.Фазы Лавеса. Эти фазы имеют формулу АВ2 и образуются между элементами, атомные диаметры которых находятся примерно в соотношении 1 : 1,2. Например, MgZn2, TiCr2 и др. Фазы Лавеса встречаются как упрочняющие интерметаллиды в жаропрочных сплавах.
Твердые растворы
Твердыми растворами называют фазы, в которых один из компонентов сплава сохраняет свою кристаллическую решетку, а атомы других (или другого) компонентов располагаются в решетке первого компонента (растворителя), изменяя ее размеры. Таким образом, твердый раствор, состоящий из нескольких компонентов, имеет один тип решетки и представляет собой одну фазу. Кроме того, твердый раствор существует не при определенном соотношении компонентов (как в химическом соединении), а в интервале концентраций.
Различают твердые растворы замещения, внедрения и вычитания.
При образовании твердых растворов замещения атомы растворенного компонента замещают часть атомов растворителя в его кристаллической решетке (рис.26, б).
При образовании твердого раствора внедрения (рис.26, в) атомы растворенного компонента располагаются в межузлиях (пустотах) кристаллической решетки растворителя.
Рис.26. Кристаллическая решетка ОЦК: а — чистый металл, б — твердый раствор замещения, в — твердый раствор внедрения; А — атомы основного металла, В – атомы замещения, С – атомы внедрения.
Металлы могут в той или иной степени взаимно растворяться друг в друге в твердом состоянии, образуя твердые растворы замещения с ограниченной или неограниченной растворимостью. Твердые растворы с неограниченной растворимостью образуются при следующих условиях:
1) Компоненты должны обладать одинаковыми по типу (изоморфными) кристаллическими решетками.
2) Различие в атомных размерах компонентов должно быть незначительным и не превышать 10-15%.
3) Компоненты должны принадлежать к одной и той же (или родственной) группе периодической системы элементов.
В некоторых сплавах (например, Cu-Au, Fe-Al), образующих при высоких температурах растворы замещения (с неупорядоченным чередованием атомов компонентов), при медленном охлаждении или длительном нагреве при определенных температурах протекает процесс перераспределения атомов. Твердые растворы, устойчивые при сравнительно низких температурах, получили название упорядоченных твердых растворов, или сверхструктур. Упорядоченные твердые растворы можно рассматривать как промежуточные фазы между твердыми растворами и химическими соединениями. В отличие от химических соединений кристаллическая решетка упорядоченных твердых растворов представляет собой решетку растворителя. Образование упорядоченных твердых растворов сопровождается изменением физических и механических свойств. Прочность обычно возрастает, а пластичность падает.
Способность к образованию твердых растворов присуща не только чистым элементам, но и химическим соединениям. В этих случаях сохраняется кристаллическая решетка химического соединения, но избыточное количество атомов одного из компонентов может заменять какое-то количество атомов другого компонента. Кроме того, при этом в отдельных узлах могут появляться незанятые места – пустоты. Твердые растворы на базе химических соединений, образование которых сопровождается появлением пустых мест в узлах решетки, называются растворами вычитания.
РЕЗЮМЕ
Под сплавом подразумевают вещество, полученное сплавлением двух или более элементов.
Совокупность фаз, находящихся в состоянии равновесия, называют системой. Фазой называют однородные составные части системы, имеющие одинаковый состав, кристаллическое строение и свойства, одно и то же агрегатное состояние и отделенные от составных частей поверхности раздела. Под структурой понимают форму, размеры и характер взаимного расположения фаз в металлах и сплавах. Компоненты в сплаве могут образовывать механические смеси, химические соединения или твердые растворы.
Механическая смесь двух компонентов образуется тогда, когда они не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения.
Химические соединения образуются между компонентами, имеющими большое различие в электронном строении атомов и кристаллических решеток. Строение и свойства химического соединения отличаются от строения и свойств создавших его компонентов.
Наиболее важные химические соединения, образующиеся в сплавах:
— Фазы внедрения
— Электронные соединения (фазы Юм-Розери)
— Фазы Лавеса
Твердыми растворами называют фазы, в которых один из компонентов сплава сохраняет свою кристаллическую решетку, а атомы других (или другого) компонентов располагаются в решетке первого компонента (растворителя), изменяя ее размеры.
Различают твердые растворы замещения, внедрения и вычитания.
Вопросы для повторения
1. Что такое сплав?
2. Дать определение терминам «фаза», «система», «структура».
3. Когда в сплаве образуется механическая смесь компонентов, а когда — химическое соединение?
4. Что такое твердые растворы? Какие виды твердых растворов Вы знаете?
8. ДИАГРАММЫ СОСТОЯНИЯ
Диаграмма состояния представляет собой графическое изображение состояния сплава. Диаграммы состояния строят для условий равновесия или условий, достаточно близких к ним. Поэтому диаграмма состояния может также называться диаграммой равновесия.
Равновесное состояние соответствует минимальному значению свободной энергии. Этого состояния можно достичь при отсутствии перегрева или переохлаждения сплава. Диаграмма состояния представляет собой теоретический случай, т.к. равновесные превращения (без переохлаждения или перегрева) на практике не могут совершать-
ся. Обычно на практике используются превращения, происходящие при малых скоростях нагрева или охлаждения.
Общие закономерности сосуществования устойчивых фаз могут быть выражены в математической форме в виде правила фаз или закона Гиббса.
Правило фаз дает количественную зависимость между степенью свободы системы и количеством фаз компонентов.
Под числом степеней свободы (вариантностью) системы понимают число внешних и внутренних факторов (температура, давление, концентрация), которое можно изменять без изменения числа фаз в системе.
Правило фаз.
С= k — f + 2
С — число степеней свободы, k— число компонентов, f – число фаз, 2 – число внешних факторов.
Правило фаз справедливо только для равновесного состояния.
Независимыми переменными в уравнении правила фаз являются концентрация, температура и давление. Если принять, что все превращения в металле происходят при постоянном давлении, то число переменных уменьшится на единицу.
С= k — f + 1
Пример. Посмотрим, как изменяется степень свободы однокомпонентной системы (k=1) для случая кристаллизации чистого металла. Когда металл находится в жидком состоянии, т.е. f =1 (одна фаза — жидкость), число степеней свободы равно 1. Температура в данном случае может изменяться, не изменяя агрегатного состояния. В момент кристаллизации f =2 (две фазы – твердая и жидкая), С=0. Это значит, что две фазы находятся в равновесии при строго определенной температуре (температура плавления), и она не может быть изменена до тех пор, пока одна фаза не исчезнет, т.е. система не станет моновариантной (C=1).
Похожие статьи:
poznayka.org
Химическое соединение
Химическое соединение — вещество, молекулы которого состоят из атомов двух или более различных химических элементов, соединенных между собой тем или иным типом химической связи. Химические соединения отличаются от простых веществ тем, что в их состав входят атомы различных химических элементов. В отличие от смесей химических элементов, химическое соединение имеет качественно новые свойства, которые не сводятся к свойствам химических элементов, входящих в ее состав.
Понятие химическое соединение — идеализированное, в отличие от реальных химических веществ, большинство из которых являются смесями различных химических соединений. Химические вещества, имеющие в своем составе практически только одну химическое соединение называют чистыми.
Обычно, структурной единицей химического соединения является молекула, химический состав и строение которой может определяться определенной химической формулой. Однако, существуют также соединения немолекулярного строения. Более того, существуют соединения переменного состава.
Поскольку в состав соединения входят различные химические элементы, соответствующие вещества называют сложными. Сложных веществ несравненно больше, чем простых. Если простых веществ сейчас известно более 400, то сложных веществ в неорганической химии — более 50 тысяч, а в органической химии — около 3 млн.
К сложным веществам относятся, например, вода — H 2 O, молекулы которого состоят из двух атомов Водорода и одного атома Кислорода, серная кислота — H 2 SO 4, молекулы которого состоят из двух атомов водорода, одного атома Серы и четырех атомов кислорода, т..
Состав может быть такой, как вода, когда связь удерживается благодаря общей паре электронов ( ковалентная связь), или ионной, когда связь образуется благодаря притяжению противоположных зарядов ( ионная связь), например хлорид натрия.
Соединения могут иметь различные фазы существования. Все соединения могут существовать в твердом состоянии. Вещества могут быть жидкостью, газом или плазмой. Они могут распадаться до меньших соединений или до атомов при определенных температурах (температура разложения).
1. Характеристики
С определенного набора химических элементов могут образовываться различные химические соединения, в зависимости от того, каким образом соединены между собой атомы. Например, Карбон и кислород могут образовать угарный газ CO или углекислый газ CO 2.
Часто химическое соединение можно однозначно идентифицировать по ее химической формулой, которая указывает сколько атомов любого сорта входят в состав соединения, например: аммиак : NH 3. Больше информации дает структурная формула, в которой указаны не только типы атомов, но и то, как они соединены между собой. Соединения с одинаковым атомным составом, но с разной структурной формуле, а, следовательно, химическими свойствами, называются изомерами.
Важной общей характеристикой химических соединений является их молекулярная масса — сумма атомных масс всех атомов, входящих в состав структурной единицы химического соединения.
2. История
Для формулировки понятия о химическом соединении важное значение имел закон постоянства состава, открытый Жозефом Прустом в 1799 [1]. Этот закон утверждает, что независимо от того, каким образом образовалась определенная вещество, она всегда содержит одни и те же химические элементы, причем отношение масс этих элементов выражаются малыми целыми числами. Через несколько лет, в 1803 Джон Дальтон сформулировал закон кратных соотношений, который утверждал, что в случае, когда из определенных элементов могут образовываться два соединения, с определенной массой первого из них сочетаются такие массы другого, отношение которых тоже дает малое целое число [2] [3] [4]. Эти два открытия проложили путь к пониманию атомного строения веществ.
Понятие структурной формулы ввел в 1850-тех немецкий химик Фридрих Август Кекуле фон Страдониц [5] [6].
3. Классификация
Все химические соединения, которых насчитывается около 17 миллионов, делятся на два больших класса: органические соединения (более 16 миллионов) и неорганические соединения. Согласно этому разделению в химии существуют два раздела: органическая химия и неорганическая химия. В органических соединений входят почти все соединения, содержащие Карбон, кроме простейших. Название органические связана с ранними представлениями, что такие соединения образуются и существуют только в живых организмах.
Другой тип разделения химических соединений связано с их химическими свойствами, обусловленными определенными химическими элементами и функциональными группами, входящими в их состав. В зависимости от типов электролитов, какие химические соединения образуют, растворяясь в воде, химические соединения подразделяются на кислоты, основы и соли. Для кислот, как органических, так и неорганических, характерно отщепление протона H +, тогда как от основ при диссоциации отделяется функциональная группа, гидроксид, OH -.
В зависимости от присутствия в составе химического соединения определенных химических элементов выделяются отдельные группы: гидриды, оксиды, сульфиды, и другие.
Органические соединения имеют собственную классификацию. В крупнейших групп органических веществ относятся углеводороды, углеводы, спирты, альдегиды, липиды, сахара и тому подобное. Отдельный класс составляют ароматические соединения — соединения с циклическими группами. Благодаря свойствам Углерода образовывать химические связи различной конфигурации, органические вещества могут иметь вид длинных цепочек, которые называют полимерами. Такие полимеры как белки, ДНК и РНК является биохимической основой жизни.
3.1. Классификация по типу химической связи
Исходя из типа связи между элементами в составе можно выделить четыре типа химических соединений:
Конечно, существуют и переходные формы между этими четырьмя типами.
3.2. Бинарные, тернарни и квартернарни соединения
Химические соединения можно классифицировать и в зависимости от присутствия в их составе определенного количества химических элементов. Так бинарные соединения состоят из двух элементов и имеют общую формулу A x B y. Так, например, хлороводород (HCl), фторид натрия (NaF) или вода (H 2 O) состоят из двух элементов и являются бинарными химическими соединениями. Аналогично бинарных, классифицируются и тернарни соединения, состоящие из трех элементов. Например, карбонат натрия (Na 2 CO 3), в состав которого входят элементы Натрий, Карбон и Кислород. Квартернарни (четверной) соединения состоят соответственно из четырех элементов. Как пример — гидрокарбонат натрия NaHCO 3, в состав которого входят элементы Натрий, Карбон, кислород и четвертый элемент Водород.
4. Наименование
Многие химические соединения имеют традиционные названия, сложившиеся исторически, например: вода, углекислый газ, серная кислота и т.д.. Однако, большинство химических соединений не имеют таких названий. Как следствие, возникла необходимость разработки химической номенклатуры — правил наименования химических соединений, которые были бы международными и можно лучше отражали бы структуру вещества. Созданием и поддержкой такой номенклатуры занимается Международный союз чистой и прикладной химии (IUPAC).
В Украине номенклатура химических соединений утверждается государственными стандартами [7].
5. Номер CAS
Всем химическим веществам, а значит, всем химическим соединениям, описанным в научной литературе, присваивается номер CAS, химической реферативной службы, по которому вещество можно идентифицировать в базах данных, например в PubChem.
См.. также
Источники
- Глоссарий терминов по химии / / И. Опейда, А. Шило. Инстит-т физико-органической химии и углехимии им. Л. М. Литвиненко НАН Украины, Донецкий национальный университет — М.: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0
- М. Л. Глiнка Общая химия (Учебник) 2-е изд., Перераб. и доп .. — С. 608. — Киев: «Высшая школа», 1982.
- Ф. А. Деркач, Химия — Л., 1968 г.
7. Сноски
- Proust, J.-L. (1799). Researches on copper, Ann. chim., 32 :26-54. Excerpt, in Henry M. Leicester and Herbert S. Klickstein, A Source Book in Chemistry, 1400 — 1900, Cambridge, MA: Harvard, 1952. Accessed 2008-05-08.
- Helmenstine, Anne. «Law of Multiple Proportions Problem». 1 . http://chemistry.about.com/od/workedchemistryproblems/a/law-of-multiple-proportions-problem.htm . Проверено 31 January 2012 .
- http://www.britannica.com/EBchecked/topic/397165/law-of-multiple-proportions
- Aug. Kekul? ?ber die sg gepaarten Verbindungen und die Theorie der mehratomigen Radicale / / Annalen der Chemie und Pharmacie. — 104. — (1857) (2): 129-150. DOI : 10.1002/jlac.18571040202.
- Aug. Kekul? Ueber die Constitution und die Metamorphosen der chemischen Verbindungen und ?ber die chemische Natur des Kohlenstoffs / / Annalen der Chemie und Pharmacie. — 106. — (1858) (2): 129-159. DOI : 10.1002/jlac.18581060202.
- Фармацевтическая энциклопедия о номенклатуре некоторых химических соединений
nado.znate.ru
Химические соединения Википедия
Хими́ческое соедине́ние — сложное вещество, состоящее из химически связанных атомов двух или более элементов (гетероядерные молекулы). Некоторые простые вещества также могут рассматриваться как химические соединения, если их молекулы состоят из атомов, соединённых ковалентной связью (азот, кислород, иод, бром, хлор, фтор, предположительно астат).[2] Инертные (благородные) газы и атомарный водород нельзя считать химическими соединениями.
История[ | код]
Для формулирования понятия про химическое соединение важное значение имел закон постоянства состава, открытый Жозефом Прустом в 1799 году[3]. Этот закон утверждает, что независимо от того, каким образом было получено определённое соединение, оно всегда состоит из одних и тех же химических элементов, причём отношение масс этих элементов выражается малыми целыми числами. Через несколько лет, в 1803 году Джон Дальтон сформулировал закон кратных отношений, согласно которому в случае, когда из определённых элементов могут образовываться два соединения, с определённой массой первого из них сочетаются такие массы другого, что отношение их тоже даёт целое число[4][5][6]. Эти два утверждения подготовили путь к пониманию атомного строения вещества.
Понятие структурной формулы ввёл в 1850-тые годы немецкий химик Фридрих Август Кекуле фон Штрадониц[7][8].
Качественный и количественный состав[ | код]
Состав химического соединения записывается в виде химических формул, а строение часто изображается структурными формулами. Систематическое название (номенклатура ИЮПАК) также указывает состав соединения.
В подавляющем большинстве случаев химические соединения подчиняются закону постоянства состава и закону кратных отношений. Однако известны довольно многочисле
ru-wiki.ru
Классификация химических соединений
Все вещества можно разделить на простые(состоящие из атомов одного химического элемента) и сложные(состоящие из атомов разных химических элементов). Простые вещества делятся на металлы и неметаллы.
Металлы обладают характерным “металлическим” блеском, ковкостью, тягучестью, могут прокатываться в листы или вытягиваться в проволоку, обладают хорошей теплопроводностью и электрической проводимостью. При комнатной температуре все металлы, кроме ртути, находятся в твердом состоянии.
Неметаллы не обладают блеском, хрупки, плохо проводят теплоту и электричество. При комнатной температуре некоторые неметаллы находятся в газообразном состоянии.
Сложные вещества делят на органические и неорганические.
Органическими соединениями принято называть соединения углерода. Органические соединения входят в состав биологических тканей и являются основой жизни на Земле.
Все остальные соединения называются неорганическими (реже минеральными). Простые соединения углерода (СО, СО2 и ряд других) принято относить к неорганическим соединениям, их обычно рассматривают в курсе неорганической химии.
Классификация неорганических соединений
Неорганические вещества делят на классы либо по составу (бинарные и многоэлементные; кислородосодержащие, азотсодержащие и т.п.), либо по функциональным признакам.
К важнейшим классам неорганических соединений, выделяемых по функциональным признакам, относятся соли, кислоты, основания и оксиды.
Соли – это соединения, которые в растворе диссоциируют на катионы металла и кислотные остатки. Примерами солей могут служить, например, сульфат бария BaSO4 и хлорид цинка ZnCl2.
Кислоты – вещества, диссоциирующие в растворах с образованием ионов водорода. Примерами неорганических кислот могут служить соляная (НCl), серная (H2SO4), азотная (HNO3), фосфорная (H3PO4) кислоты. Наиболее характерное химическое свойство кислот – их способность реагировать с основаниями с образованием солей. По степени диссоциации в разбавленных растворах кислоты подразделяются на сильные кислоты, кислоты средней силы и слабые кислоты. По окислительно–восстановительной способности различают кислоты–окислители (HNO3) и кислоты–восстановители (HI, H2S). Кислоты реагируют с основаниями, амфотерными оксидами и гидроксидами с образованием солей.
Основания – вещества, диссоциирующие в растворах с образованием только гидроксид-анионов (OH1-). Растворимые в воде основания называют щелочами (КОН, NaOH). Характерное свойство оснований – взаимодействие с кислотами с образованием соли и воды.
Оксиды – это соединения двух элементов, один из которых кислород. Различают оксиды основные, кислотные и амфотерные. Основные оксиды образованы только металлами (CaO, K2O), им соответствуют основания (Ca(OH)2, KOH). Кислотные оксиды образуются неметаллами (SO3, P2O5) и металлами, проявляющими высокую степень окисления (Mn2O7), им соответствуют кислоты (H2SO4, H3PO4, HMnO4). Амфотерные оксиды в зависимости от условий проявляют кислотные и основные свойства, взаимодействуют с кислотами и основаниями. К ним относятся Al2O3, ZnO, Cr2O3 и ряд других. Существуют оксиды, не проявляющие ни основных, ни кислотных свойств. Такие оксиды называются безразличными (N2O, CO и др.)
Классификация органических соединений
Углерод в органических соединениях, как правило, образует устойчивые структуры, в основе которых лежат углерод-углеродные связи. В способности образовывать такие структуры углерод не имеет себе равных среди других элементов. Большинство органических молекул состоит из двух частей: фрагмента, который в ходе реакции остаётся без изменения, и группы, подвергающейся при этом превращениям. В связи с этим определяется принадлежность органических веществ к тому или иному классу и ряду соединений.
Неизменный фрагмент молекулы органического соединения принято рассматривать в качестве остова молекулы. Он может иметь углеводородную или гетероциклическую природу. В связи с этим можно условно выделить четыре больших ряда соединений: ароматический, гетероциклический, алициклический и ациклический.
В органической химии также выделяют дополнительные ряды: углеводороды, азотсодержащие соединения, кислородосодержащие соединения, серосодержащие соединения, галогеносодержащие соединения, металлоорганические соединения, кремнийорганические соединения.
В результате комбинации этих основополагающих рядов образуются составные ряды, например: «Ациклические углеводороды», «Ароматические азотсодержащие соединения».
Наличие тех или иных функциональных групп либо атомов элементов определяет принадлежность соединения к соответствующему классу. Среди основных классов органических соединений выделяют алканы, бензолы, нитро- и нитрозосоединения, спирты, фенолы, фураны, эфиры и большое количество других.
Типы химических связей
Химическая связь – это взаимодействие, удерживающее два или несколько атомов, молекул или любую комбинацию из них. По своей природе химическая связь представляет собой электрическую силу притяжения между отрицательно заряженными электронами и положительно заряженными атомными ядрами. Величина этой силы притяжения зависит главным образом от электронной конфигурации внешней оболочки атомов.
Способность атома образовывать химические связи характеризуется его валентностью. Электроны, участвующие в образовании химической связи, называются валентными.
Различают несколько типов химических связей: ковалентную, ионную, водородную, металлическую.
При образовании ковалентной связи происходит частичное перекрывание электронных облаков взаимодействующих атомов, образуются электронные пары. Ковалентная связь оказывается тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
Различают полярную и неполярную ковалентные связи.
Если двухатомная молекула состоит из одинаковых атомов (H2, N2), то электронное облако распределяется в пространстве симметрично относительно обоих атомов. Такая ковалентная связь называется неполярной (гомеополярной). Если же двухатомная молекула состоит из разных атомов, то электронное облако смещено к атому с большей относительной электроотрицательностью. Такая ковалентная связь называется полярной (гетерополярной). Примерами соединений с такой связью могут служить HCl, HBr, HJ.
В рассмотренных примерах каждый из атомов обладает одним неспаренным электроном; при взаимодействии двух таких атомов создается общая электронная пара – возникает ковалентная связь. В невозбужденном атоме азота имеется три неспаренных электрона, за счет этих электронов азот может участвовать в образовании трех ковалентных связей (NH3). Атом углерода может образовать 4 ковалентных связи.
Перекрывание электронных облаков возможно только при их определенной взаимной ориентации, при этом область перекрывания располагается в определенном направлении по отношению к взаимодействующим атомам. Другими словами, ковалентная связь обладает направленностью.
Энергия ковалентных связей находится в пределах 150–400 кДж/моль.
Химическая связь между ионами, осуществляемая электростатическим притяжением, называется ионной связью. Ионную связь можно рассматривать как предел полярной ковалентной связи. В отличие от ковалентной связи ионная связь не обладает направленностью и насыщаемостью.
Важным типом химической связи является связь электронов в металле. Металлы состоят из положительных ионов, которые удерживаются в узлах кристаллической решетки, и свободных электронов. При образовании кристаллической решетки валентные орбитали соседних атомов перекрываются и электроны свободно перемещаются из одной орбитали в другую. Эти электроны уже не принадлежат определенному атому металла, они находятся на гигантских орбиталях, которые простираются по всей кристаллической решетке. Химическая связь, осуществляемая в результате связывания положительных ионов решетки металла свободными электронами, называется металлической.
Между молекулами (атомами) веществ могут осуществляться слабые связи. Одна из самых важных – водородная связь, которая может быть межмолекулярной и внутримолекулярной. Водородная связь возникает между атомом водорода молекулы (он заряжен частично положительно) и сильно электроотрицательным элементом молекулы (фтор, кислород и т.п.).
Энергия водородной связи значительно меньше энергии ковалентной связи и не превышает 10 кДж/моль. Однако этой энергии оказывается достаточно для создания ассоциаций молекул, затрудняющих отрыв молекул друг от друга. Водородные связи играют важную роль в биологических молекулах (белках и нуклеиновых кислотах), во многом определяют свойства воды.
Силы Ван-дер-Ваальсатакже относятся к слабым связям. Они обусловлены тем, что любые две нейтральных молекулы (атома) на очень близких расстояниях слабо притягиваются из-за электромагнитных взаимодействий электронов и ядер одной молекулы с электронами и ядрами другой.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
zdamsam.ru

