Задания для подготовки к ЕГЭ | Материал по химии (11 класс) по теме:
Подготовка к ЕГЭ по химии
Тесты по разделу «Неорганическая химия»
1.Из предложенных веществ выберите соли.
А) NН4CI Б) NаН В) N2Н2 Г) К[АI(ОН)4]
Д) СS2 Е) С6Н5 NН3CI Ж) АI4С3 З) СН3СОН
1) Б, Д, Е 2) А,В,Ж 3) А,Г,Е 4) Г,Е,З
2.Высший гидроксид хрома
1) проявляет кислотные свойства 2) проявляет основные свойства
3) проявляет амфотерные свойства 4) не проявляет кислотно-основных свойств
3.Какому из указанных оксидов не соответствует гидроксид?
1) оксиду серы (IV) 2) оксиду углерода (IV) 3) оксиду углерода (II) 4) оксиду азота (III)
4.Химическая реакция возможна между
1) Cu и h3O 2) Nа и CI2 3) Au и h3 4) Fe и NаCI
5. Оксид алюминия реагирует с обоими веществами пары
Оксид алюминия реагирует с обоими веществами пары
1) железо и серная кислота 2) гидроксид натрия и кислород
3) оксид кремния и оксид натрия 4) вода и хлорид натрия
6.Как гидроксид натрия, так и гидроксид меди (II)
1) разлагаются при нагревании 2) растворяются в серной кислоте
3) взаимодействуют с оксидом углерода (IV) 4) изменяют окраску фенолфталеина
7.Сульфат меди (II) реагирует с каждым из двух веществ
1) MgО и НCI 2) NаОН и Fe 3) НNО3 и СО2 4) Nа2S и СаО
t +Х2
8.В схеме превращений NаНСО3 → Х1 → Са(НСО3)2 веществами «Х1» и «Х2» являются соответственно
1) Nа2СО3 и СаCI2 2) СО2 и СаСО3 3) СО2 и СаCI2 4) Nа2СО3 и СаСО3
9.Средними солями являются:
А) СН3СООК Б) MgОНCI В) NаН2РО4 Г) NН4 NО3 Д) NН4НСО3 Е) С6Н5ОК
1) Б,В,Д 2) А,Б,Г 3) Г,Д,Е 4) А,Г,Е
10. Оксид железа (III)
Оксид железа (III)
1) не проявляет кислотно-основных свойств 2) проявляет кислотные свойства
3) проявляет основные свойства 4) проявляет амфотерные свойства
11.Формула высшего гидроксида хлора
1) НCI 2) НCIО4 3) НCIО3 4) НCIО
12.При взаимодействии кальция с водой образуется
1) оксид кальция и водород 2) гидроксид кальция и водород
3) гидрид кальция и кислород 4) оксид кальция и кислород
13. Химическая реакция возможна между
1) оксидом марганца (VII) и оксидом калия 2) оксидом кремния и водой
3) оксидом углерода (IV) и оксидом серы (VI) 4) оксидом фосфора (V) и оксидом серы (VI)
14.Верны ли следующие суждения о гидроксиде цинка
А. Гидроксид цинка растворяется в серной кислоте.
Б. Гидроксид цинка растворяется в щелочи натрия
Гидроксид цинка растворяется в щелочи натрия
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
15.Химическая реакция возможна между
1) CuSO4 и NaNO3 2) NaCI и Ba(NO3)2 3) CaCI2 и NаНСО3 4) KI и AgNO3
16.В схеме превращений Р4 → А → Н3РО4 веществом А является
1) вода 2) оксид фосфора (III) 3) фосфин (РН3) 4) оксид фосфора (V)
17.Кислотными оксидами являются
1) NО2, Cr2O3, AI2O3, SiO2 2) CO , Mn2O7, K2O, P2O5
3) CO2, N2О3, CrO3 , CI2O 4) ZnO, CI2O7, Fe2O3, SO2
18.При взаимодействии металла с водой выделяется газ, а раствор при добавлении фенолфталеина окрасился в малиновый цвет. Этим металлом может быть
1) кальций 2) цинк 3) бериллий 4) алюминий
19.Верны ли следующие суждения о соединениях неметаллов?
А. Оксиды, образованные атомами неметаллов, в высших степенях окисления являются кислотами.
Оксиды, образованные атомами неметаллов, в высших степенях окисления являются кислотами.
Б. Летучие водородные соединения всех неметаллов проявляют кислотные свойства.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
20.Химическая реакция возможна между
1) Cu и FeSO4 2) Cu и AgSO4 3) Нg и NaCI 4) Ag и CuSO4
21.Продуктом химической реакции NО2 + О2 + Н2О = ? является
1) азотистая кислота 2) азотная кислота 3) оксид азота (V) 4) аммиак
22.Как гидроксид бария, так и сероводородная кислота реагируют с
1) сульфатом натрия 2) гидроксидом натрия 3) серной кислотой 4) натрием
23.Карбонат натрия не реагирует с:
1) Н2SO4 2) CaCI2 3) CO2 4) Cu(ОН)2
Н2О SO3
24. В схеме превращений Ва → Х1 → Х2 веществами «Х1» и «Х2» являются соответственно
В схеме превращений Ва → Х1 → Х2 веществами «Х1» и «Х2» являются соответственно
1) Ва(ОН)2 и ВаSO4 2) ВаО и ВаSO4
3) Ва(ОН)2 и ВаSO3 4) ВаО и ВаSO3
25.Основный оксид и кислота соответственно представлены в группе
1) CuО и NаНСО3 2) Nа2О и NаН 3) MnO2 и NН3 4) MnO и НСN
26.Формула гидроксида, который соответствует оксиду хрома (VI)
1) Cr(OН)2 2) Cr(OН)3 3) Н2CrO4 4) Н3[Cr(OН)6]
27. Летучее водородное соединение селена в водном растворе
1) реагирует с кислотами
2) реагирует с основаниями
3) реагирует и с кислотами, и с основаниями
4) не реагирует ни с кислотами, ни с основаниями
28.Химическая реакция возможна между железом и
1) Н2SO4 (конц.) 2) СаSO4 (раствор) 3) AI2O3 4) Н2О (пар)
29. Химическая реакция не протекает между оксидом натрия и
Химическая реакция не протекает между оксидом натрия и
1) оксидом хрома (III) 2) оксидом азота (V) 3) оксидом железа (III) 4) оксидом цинка
30.Верны ли следующие суждения о серной кислоте
А. Серная кислота проявляет окислительные свойства
Б. Концентрированная серная кислота окисляет железо
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
31.Хлорид бария реагирует с каждым из двух веществ
1) CO2 и НNO3 2) Nа2SO4 и Nа3РО4 3) Mg и Н2SO4 4) КОН и SO3
О2 (кат.) О2 О2, Н2О
32. Вещества «Х» и «Y» в цепи превращений NН3 → Х → Y → НNO3
1) Х – оксид азота (II), Y – азотистая кислота
2) Х – азот, Y — оксид азота (II)
3) Х — оксид азота (II), Y — оксид азота (IV)
4) Х – азот, Y — оксид азота (II)
33. Основание и кислая соль представлены в группе
Основание и кислая соль представлены в группе
1) NН3 и NН4НСО3 2) NаОН и (CuОН)2СО3
3) Н2S и NаНSO4 4) АI(ОН)3 и АIОНCI2
34.Щелочные металлы получают
1) алюминотермическим способом
2) электролизом расплава их бескислородных солей
3) нагреванием гидроксида металла в токе оксида углерода (II)
4) восстановлением водородом и их оксидов
35.Верны ли следующие суждения о галогенах?
А. Окислительные свойства простых веществ галогенов с увеличением порядкового номера элемента в ПСХЭ увеличиваются.
Б. Все простые вещества галогенов являются только окислителями.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
36.Химическая реакция возможна между алюминием и
1) раствором гидроксида натрия 2) раствором хлорида натрия
3) раствором карбоната натрия 4) оксидом натрия
37.В каком из рядов расположены только солеобразующие оксиды?
1) СО2, SO2, N2О, SO3 2) СО, CI2О7, Р2О3, SO3
3) NО, As2O5, Br2O5, SO3 4) СО2, SO2, Р2О5, SеO3
38.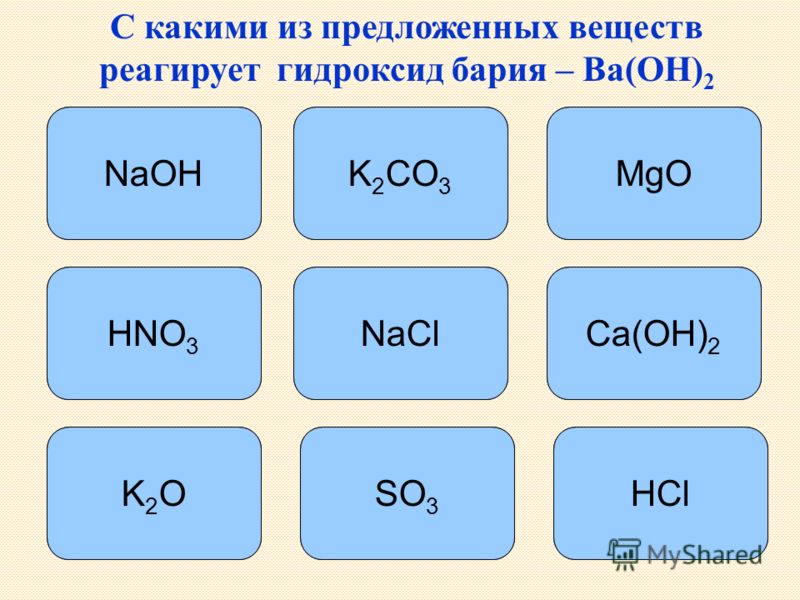 Соляная кислота способна реагировать с веществами
Соляная кислота способна реагировать с веществами
А) цинк Б) сульфит натрия В) этан Г) медь Д) этилен У) сульфат натрия
1) Б,В,Г 2) Б,Д,Е 3) В,Г,Д 4) А,Б,Д
39.Как СаCI2 , так и Ва(NО3)2 не реагируют с
1) фосфатом натрия 2) сульфатом меди (II) 3) оксидом углерода (IV) 4) гидроксидом натрия
t + NаОН
40.В схеме превращений АI(ОН)3 → Х1 → Х2 веществами «Х1» и «Х2» являются соответственно
1) AI2O3 и АI(ОН)3 2) AI2O3 и Nа[AI (ОН)4]
3) AI и Nа[AI (ОН)4] 4) AI и АI(ОН)3
41.Среди представленных соединений отсутствуют соли
1) SCI2, NО, КОН, CuS 2) СО, КSСN, РН3, СCI4
3) СО2, ТiН2, Н2О2, О3 4) НСN2, SiН4, Са3(РО4)2,СаF2
42.Для гидроксида марганца (VII) характерны
1) кислотные свойства 2) амфотерные свойства
3) основные свойства 4) свойства восстановителя
43. В ряду водородных соединений неметаллов РН3, Н2S, НCI
В ряду водородных соединений неметаллов РН3, Н2S, НCI
1) не наблюдается проявление кислотно-основных свойств
2) основные свойства усиливаются
3) кислотно-основный характер соединений не изменяется
4) основные свойства убывают, кислотные усиливаются
44.Химическая реакция не протекает между
1) AgNO3 и KI 2) CI2 и C6H6 3) Br2 и NaCI 4) CI2 и NaOH
45.Оксид азота (V) реагирует с каждым веществом пары
1) вода и серная кислота 2) оксид натрия и кислород
3) оксид алюминия и вода 4) оксид серы (VI) и гидроксид натрия
46.Раствор гидроксида натрия реагирует с
А) SiО2, Б) Fe(OH)2 В) Mg Г) Н2SO3 Д) АI(ОН)3 Е) ) FeO
1) А,Г,Д 2) А,Б,Е 3) Б,В,Д 4) А,Г,Е
47. Химическая реакция не протекает между
1) хлоридом бария и нитратом серебра 2) силикатом натрия и серной кислотой
3) гидроксидом бария и хлоридом алюминия 4) нитратом цинка и хлоридом натрия
t FeS
48. В схеме превращений КNО3 → Х1 → Х2 веществами «Х1» и «Х2» являются соответственно
В схеме превращений КNО3 → Х1 → Х2 веществами «Х1» и «Х2» являются соответственно
1) О2 и SO2 2) О2 и S 3) КNО2 и SO2 4) КNО2 и S
49.Кислотами являются
А) Н2SO3 Б) Н3N В) NаН2РО4 Г) Н2О2 Д) НСООН Е) Н2Cr2О7
1) А,Д,Е 2) А,Б,Д 3) В,Г,Е 4) Б,Г,Д
50.Соединения меди (I) в окислительно-восстановительных реакциях
1) не проявляют ни окислительные, ни восстановительные свойства
2) проявляют только окислительные свойства
3) проявляют только восстановительные свойства
4) проявляют как окислительные, так и восстановительные свойства
51.Кислород взаимодействует с обоими веществами пары
1) золото и железо 2) аргон и натрий 3) фосфор и кремний 4) хлор и углерод
52.Верны ли следующие суждения об оксиде серы (VI)
А. При растворении этого оксида в воде образуется кислота.
Б. Этот оксид реагирует как с гидроксидом натрия, так и оксидом бария.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
53.Гидроксид цинка реагирует с обоими веществами пары
1) NaOH и SO3 2) CuSО4 и НCI 3) Н2SO4 и КОН 4) AI2O3 и Nа
54.Как хлорид аммония, так и сульфат цинка реагирует с
1) NaOH 2) ВаCI2 3) Na2 S 4) Н3РО4
+Н2О + SO2 + Н2SO4
55. Веществами Х, Y и Z в цепи превращений Nа → Х → Y → Z
1) Х – оксид натрия, Y – сульфит натрия, Z — сернистый газ
2) Х – гидроксид натрия, Y — сульфит натрия, Z — сернистый газ
3) Х — гидроксид натрия, Y – сульфат натрия Z — серный ангидрид
4) Х – гидроксид натрия, Y — сера Z — водород
56. Кислотный оксид и амфотерный гидроксид соответственно представлены в группе
Кислотный оксид и амфотерный гидроксид соответственно представлены в группе
1) CI2О7 и Сr(ОН)2 2) NО и Zn(ОН)2 3) СО2 и Са(ОН)2 4) ZnО и АI(ОН)3
57.Формулы высшего оксида и высшего гидроксида элемента, имеющего электронную конфигурацию 1s22s22p63s23p64s2
1) SrO и Sr(OH)2 2) К2О и КОН 3) СаО и Са(ОН)2 4) Rb2O и RbOH
58. Верны ли следующие суждения о соединениях неметаллов?
А. Все оксиды, образуемые атомами неметаллов, являются кислотными.
Б. В высших степенях окисления атомы неметаллов проявляют окислительные свойства.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
59.Раствор фтора в воде получить нельзя, так как фтор
1) не растворяется в воде 2) частично растворяется в воде
3) восстанавливает из воды водород 4) окисляет из воды кислород
60. Как оксид хрома (III), так и оксид хрома (IV) взаимодействуют с обоими веществами группы
Как оксид хрома (III), так и оксид хрома (IV) взаимодействуют с обоими веществами группы
1) вода и серная кислота 2) гидроксид калия и кислород
3) соляная кислота и гидроксид натрия 4) оксид натрия и оксид азота (V)
61.Азотная кислота реагирует с обоими веществами пары
1) AI2O3 и SO3 2) Cu и Н2S 3) SO2 и ВаCI2 4) Zn(ОН)2 и Н2
62.Не взаимодействуют между собой
1) сульфит натрия и серная кислота 2) сульфат натрия и хлорид железа (III)
3) сульфид натрия и хлорид железа (III) 4) сульфат натрия хлорид бария
63.Вещества расположены в последовательности: кислотный оксид, основание, кислая соль
1) СаО, Са(ОН)2, СаНРО4 2) SO3, Nа2[Zn(ОН)4], Nа НСО3
3) СrО3, Сr(ОН)3, СrSО4 4) Р2О3, Мn(ОН)2, NаН4НСО3
64.В ряду AI – Ве – Mg – Li восстановительная способность металлов в водных растворах
1) сначала убывает, затем возрастает 2) не изменяется
3) убывает 4) возрастает
65. Верны ли следующие суждения о неметаллах?
Верны ли следующие суждения о неметаллах?
А. Все соединения неметаллов проявляют только окислительные свойства.
Б. Все водородные соединения неметаллов являются кислотами.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
66.В атмосфере кислорода не горит
1) пропан 2) магний 3) водород 4) хлор
67.При взаимодействии оксида натрия с раствором сероводородной кислоты образуется
1) гидроксид натрия и сероводород 2) сульфид натрия и водород
3) сульфид натрия и вода 4) сульфат натрия и вода
68.Как для гидроксида алюминия, так и для гидроксида железа (II) характерно
1) разложение при нагревании 2) взаимодействие с гидроксидом натрия
3) взаимодействие с оксидом натрия 4) окисление кислородом воздуха
69.Хлорид аммония реагирует с каждым из двух веществ
1) гидроксид бария и оксид серы (IV) 2) нитрат серебра и гидроксид натрия
3) нитрат ртути (II) и оксид магния 4) серная кислота и оксид углерода (IV)
70. Веществами Х, Y и Z в цепи превращений
Веществами Х, Y и Z в цепи превращений
+Х + NaOH + Z
Cu → CuCI2 → Y →[Cu(NН3)4](ОН)2
1) Х – хлорид цинка, Y – гидроксид меди (II), Z — вода
2) Х – соляная кислота, Y — гидроксид меди (II), Z — гидроксид натрия
3) Х — хлор, Y – гидроксид меди (II), Z — аммиачная вода
4) Х – соляная кислота, Y — гидроксид меди (II), Z — аммиачная вода
71.Вещество, представленное формулой Na3[АI(ОН)6], является
1) амфотерным гидроксидом 2) основанием
3) комплексной солью 4) основной солью
72.Металл, который почти в два раза легче воды
1) алюминий 2) литий 3) магний 4) бериллий
73.Летучее водородное соединение углерода
1) проявляет кислотные свойства 2) не проявляет кислотно-основные свойства
3) проявляет основные свойства 4) проявляет амфотерные свойства
74. Оксид образуется при взаимодействии с кислородом
Оксид образуется при взаимодействии с кислородом
1) лития 2) натрия 3) калия 4) рубидия
75. Верны ли следующие суждения об оксиде алюминия
А. Оксид алюминия взаимодействует только с растворами кислот
Б. В оксиде алюминия химическая связь ковалентная полярная
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
76.Вещество А в уравнении реакции А + 2О2 → Н3РО4
1) метафосфорная кислота 2) фосфин
3) оксид фосфора (V) 4) фосфористая кислота
77 Химическая реакция не протекает между
1) карбонатом натрия и нитратом кальция
2) фосфатом аммония и гидроксидом натрия
3) силикатом натрия и соляной кислотой
4) сульфидом натрия и нитратом калия
+Х2
78. В схеме превращений СаСО3 → Х1 → СаCI2 веществами «Х1» и «Х2» являются соответственно
В схеме превращений СаСО3 → Х1 → СаCI2 веществами «Х1» и «Х2» являются соответственно
1) СаО и CI2 2) Са и НCI 3) СаО и НCI 4) Са и CI2
79.Металлические свойства усиливаются в ряду соединений
1) натрий – магний – алюминий 2) литий – натрий – калий
3) барий – кальций – магний 4) калий – натрий – литий
80.Какой из металлов вытесняет железо из сульфата железа (II)
1) Cu 2) Zn 3) Sn 4) Нg
81.Верны ли следующие суждения о свойствах соединений элемента, электронная конфигурация атома которого 1s22s22p63s23p4
А. Этот элемент образует гидроксид с ярко выраженными кислотными свойствами
Б.Степень окисления этого элемента в ваысшем гидроксиде равна +4
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
82. Оксид серы (VI) взаимодействует с каждым из двух веществ:
Оксид серы (VI) взаимодействует с каждым из двух веществ:
1) вода и соляная кислота 2) кислород и оксид магния
3) оксид кальция и гидроксид натрия 4) вода и медь
83.Как гидроксид алюминия, так и соляная кислота могут взаимодействовать с
1) CuО 2) Н2SO4 3) СО2 4) NaOH
84.Карбонат калия в растворе не взаимодействует с
1) азотной кислотой 2) углекислым газом
3) сульфатом натрия 4) хлоридом меди (II)
t +Н2 +О2
85.В схеме превращений Cu(ОН)2 → А → В → Х веществом «Х» является
1) CuО 2) Cu 3) Cu(ОН)2 4) CuCI2
86. Верны ли следующие суждения о щелочных металлах?
А. Во всех соединениях они имеют степень окисления +1
Б. С неметаллами они образуют соединения с ионной связью
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
87. У атомов химических элементов, расположенных в ряду Р → S → CI, увеличивается
У атомов химических элементов, расположенных в ряду Р → S → CI, увеличивается
1) радиус 2) окислительная способность
3) восстановительная способность 4) число неспаренных электронов
88.При обычной температуре медь реагирует с
1) водой 2) кислородом 3) хлороводородной кислотой 4) азотной кислотой
89. Оксид серы (IV) проявляет свойства
1) только основного оксида 2) амфотерного оксида
3) кислотного оксида 4) несолеобразующего оксида
90.Разбавленная серная кислота может реагировать с каждым из двух веществ:
1) серой и магнием
2) оксидом железа (II) и оксидом кремния (IV)
3) гидроксидом калия и хлоридом калия
4) нитратом бария и гидроксидом меди (II)
91.Хлорид железа (II) реагирует с каждым из двух веществ:
1) МgО и НCI 2) Zn и АgNО3 3) Н NО3 и СО2 4) СаО и СО2
+ НCI + Nа2СО3
92. В схеме превращений: СаСО3 → Х1 → Х2 + NаCI веществом «Х2» является
В схеме превращений: СаСО3 → Х1 → Х2 + NаCI веществом «Х2» является
1) СаСО3 2) СаCI2 3) СаО 4) Са(ОН)2
93.Амфотерные свойства проявляют кислородные соединения
1) бария 2) магния 3) кальция 4) бериллия
94.Среди перечисленных элементов VА-группы типичным неметаллом является
1) фосфор 2) мышьяк 3) сурьма 4) висмут
95.Химическая реакция возможна между:
1) Cu и НCI 2) Fe и Na3РО4 3) Ag и Mg(NO3)2 4) Zn и FeCI2
96. Оксид углерода (IV) взаимодействует с каждым из двух веществ:
1) водой и оксидом кальция 2) кислородом и оксидом серы (IV)
3) сульфатом калия и гидроксида натрия 4) фосфорной кислотой и водородом
97.Гидроксид цинка может реагировать с каждым из двух веществ:
1) сульфат кальция, оксид серы (VI) 2) гидроксида натрия (р-р), соляная кислота
3) вода, хлорид натрия 4) сульфат бария, гидроксид железа (III)
98. В уравнении реакции 2AgNO3 = 2Ag + 2Х + О2 веществом «Х» является
В уравнении реакции 2AgNO3 = 2Ag + 2Х + О2 веществом «Х» является
1) оксид азота (IV) 2) оксид азота (II) 3) азот 4) оксид азота (V)
+ NaOH +О2+Н2О
99.В схеме превращений: FeCI2 → Х1 → Х2 веществом «Х2» является
1) FeО 2) Fe(ОН)3 3) FeCI2 4) FeCI3
100.Кислотным и основным оксидом являются соответственно
1) SO2 и MgО 2) СО2 и AI2O3 3) Na2О и FeО 4) ZnО и SO3
101.Какой из металлов не вытесняет водород из разбавленной серной кислоты
1) железо 2) хром 3) медь 4) цинк
102.Соединения состава КН2ЭО4 и К2НЭО4 образует элемент
1) хлор 2) сера 3) азот 4) фосфор
103.Углерод выступает в роли восстановителя в реакции с
1) водородом 2) алюминием 3) кальцием 4) оксидом меди ((II)
104. Между собой взаимодействуют
Между собой взаимодействуют
1) SiO2 и Н2О 2) СО2 и Н2SO4 3) СО2 и Са(ОН)2 4) Na2О и Са(ОН)2
105.Концентрированная азотная кислота при обычных условиях не взаимодействует с
1) магнием 2) гидроксидом натрия 3) железом 4) оксидом магния
106.С водным раствором хлорводорода, гидроксида бария и хлорида меди (II) реагирует
1) СаСО3 2) К2SO3 3) Na2SO4 4) AI2 (SO4)3
107.В цепочки превращений: FeCI3 → Х1 → Х2→ Fe(ОН)3 веществами «Х1» и «Х2» могут быть соответственно
1) Fe2(SO4)3 и Fe2О3 2) FeРО4 и Fe3О4
3) Fe(NО3)3 и Fe2О3 4) Fe(ОН)3 и Fe2(SO4)3
108. Верны ли следующие суждения о соединениях меди?
А.Формула высшего оксида меди Cu2О
Б. Высший оксид меди проявляет только окислительные свойства
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
109. Кислотные свойства проявляет соединение
Кислотные свойства проявляет соединение
1) РН3 2) СН4 3) Н2S 4) NН3
110.Как водород, так и хлор взаимодействуют с
1) водой 2) аммиаком 3) гидроксида кальция 4) металлическим кальцием
111.Вещество, которое может реагировать с водородом, серной кислотой и алюминием, имеет формулу
1) Р2О5 2) CuО 3) Ва(NО3)2 4) К2О
112.Гидроксид натрия не реагирует с
1) AI(ОН)3 2) ZnО 3) Н2SO4 4) Ва(ОН)2
113.С гидроксидом натрия, хлорводородной кислотой и хлоридом бария может реагировать
1) Сr(ОН)3 2) CuSO4 3) (NН4)2СО3 4) Zn
114. В цепочки превращений: ZnО → Х1 → Х2→ Zn(ОН)2 веществами «Х1» и «Х2» могут быть соответственно
1) Zn(ОН)2 и ZnCI2 2) Zn(ОН)2 и ZnSO4
3) ZnCI2 и ZnSO4 4) ZnCI2 и ZnО
115. Из перечисленных ниже утверждений для оснований не характерно следующее: «Основания…».
Из перечисленных ниже утверждений для оснований не характерно следующее: «Основания…».
1) сложные вещества, в которых каждый атом металла связан с одной или несколькими гидроксогруппами;
2) взаимодействуют с кислотами;
3) взаимодействуют с кислотными оксидами;
4) взаимодействуют с основными оксидами.
116.Из опытов, иллюстрирующих химические свойства хлора, можно осуществить при обычных условиях следующий:
1) горение сурьмы в хлоре; 2) горение меди в хлоре;
3) взаимодействие хлора с натрием; 4) взаимодействие хлора с железом.
117.С ростом порядкового номера элемента кислотные свойства оксидов в ряду N2О3 – Р2О3 – Аs2О3 – Sb2O3 – Bi2O3 …
1) усиливаются 2) ослабевают
3) остаются неизменными 4) усиливаются, затем ослабевают
118.В пробирку с нитратом цинка добавили немного гидроксида натрия. Образовался осадок. Его разделили на две части. В первую часть добавили раствор соляной кислоты; а во вторую – раствор гидроксида калия. При этом оказалось, что…
При этом оказалось, что…
1) в обеих частях с осадком ничего не произошло;
2) в первой части осадок растворился, а во второй не растворился;
3) в первой части осадок не растворился, а во второй растворился;
4) в обеих частях осадок растворился.
119.Нельзя использовать для перевода гидроксида железа (III) в растворимое состояние раствор вещества…
1) NaOH 2) НCI 3) Н2SO4 4) СН3СООН
120.Из следующих газов попарно не совместимы…
1) NН3 и НCI 2) СО2 и СН4 3) СО2 и НCI 4) NН3 и СН4
121.Верны ли следующие суждения об основных оксидах?
А. Основным оксидам соответствуют основания.
Б. Основные оксиды образуют только металлы.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
122.Медь взаимодействует с разбавленным водным раствором кислоты
1) серной 2) соляной 3) азотной 4) фторводородной
123. Как водород, так и хлор взаимодействует с
Как водород, так и хлор взаимодействует с
1) водой 2) аммиаком 3) гидроксидом кальция 4) металлическим кальцием
124.Карбонат калия в растворе не взаимодействует с
1) азотной кислотой 2) углекислым газом 3) сульфатом натрия 4) хлоридом меди (II)
125.Только кислотные оксиды расположены в ряду:
1) СО2, Mn2O7, SO3 2) Na2O, SiO2, Cr2O3 3) CrO, SO2, СаО 4) CuО, AI2O3, FeО
126.Какой из металлов не вытесняет водород из разбавленной серной кислоты?
1) железо 2) хром 3) медь 4) цинк
127.Оксиды с общей формулой R2O3 и R2O5 образуют элементы подгруппы
1) углерода 2) азота 3) серы 4) фтора
128.Верны ли следующие суждения о свойствах хлора?
А. Хлор реагирует как с активными, так и с неактивными металлами.
Б. Хлор не растворяется в воде.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
129. С каждым из перечисленных веществ: Н2S, КОН, Zn взаимодействует
С каждым из перечисленных веществ: Н2S, КОН, Zn взаимодействует
1) Pb(NO3)2 2) ZnSO4 3) Na2CO3 4) HCI
130.К амфотерным оксидам относится
1) CrO3 2) SO3 3) СО2 4) Cr2O3
131.В каком ряду химические элементы расположены в порядке усиления металлических свойств?
1) Na, Mg, AI 2) AI, Mg, Na 3) Са, Mg, Ве 4) Mg, Ве, Са
132.В ряду элементов: азот – кислород – фтор увеличивается
1) атомный радиус 2) число неспаренных электронов в атоме
3) число S-электронов в атоме 4) электроотрицательность
133.С водой без нагревания реагирует
1) цинк 2) медь 3) железо 4) литий
134.Гидроксид алюминия реагирует с каждым веществом
1) сульфат кальция и оксид серы (IV)
2) гидроксид натрия (р-р) и азотная кислота
3) водород и хлорид натрия
4) сульфат бария и гидроксид железа (III)
t +Н2О
135. В схеме превращений СаСО3 → Х1 → Х2 веществом «Х2» является
В схеме превращений СаСО3 → Х1 → Х2 веществом «Х2» является
1) СаО 2) Са(ОН)2 3) Са(НСО3)2 4) СаН2
136.Соединени, в состав которых входит функциональная группа –NН2, относятся к классу
1) аминов 2) нитросоединений 3) карбоновых кислот 4) альдегидов
137.Окислительные свойства фосфор проявляет при взаимодействии с
1) кислородом 2) серой 3) хлором 4) магнием
138.При обычной температуре медь реагирует с
1) водой 2) азотом 3) хлорводородной кислотой 4) азотной кислотой
139.Вещество, которое может реагировать с водородом, серной кислотой и алюминием, имеет формулу
1) Р2О5 2) CuО 3) Ва(NО3)2 4) К2О
140.Раэбавленная серная кислота может реагировать с каждым из двух веществ:
1) серой и магнием 2) оксидом железа (II) и оксидом кремния (IV)
3) гидроксидом калия и хлоридом калия 4) нитратом бария и гидроксидом меди (II)
141. Раствор сульфата меди (II) реагирует с каждым из двух веществ:
Раствор сульфата меди (II) реагирует с каждым из двух веществ:
1) HCI и h3SiO3 2) h3O и Cu(OH)2 3) O2 и HNO3 4) NaOH и BaCI2
142.Реакция нейтрализации происходит между
1) цинком и соляной кислотой
2) серной кислотой и хлоридом бария
3) гидроксидом кальция и азотной кислотой
4) гидроксидом натрия и сульфатом меди
143.Углерод выступает в качестве восстановителя в реакции с
1) водородом 2) алюминием 3) кальцием 4) оксидом меди
144.Химическая реакция возможна между
1) Cu и HCI 2) Fe и Na3РО4 3) Ag и Mg(NO3)2 4) Zn и FeCI2
145.В результате кипячения водного раствора гидрокарбоната кальция в осадок выпадает
1) оксид кальция 2) карбид кальция 3) гидроксид кальция 4) карбонат кальция
t + HCI
146. В схеме превращений Fe(ОН)3 → Х1 → Х2 веществом «Х2» является
1) Fe2О3 2) FeО 3) FeCI3 4) FeCI2
147. Верны ли следующие суждения о меди?
Верны ли следующие суждения о меди?
А. Для меди характерны степени окисления +1 и +2.
Б. Медь вытесняет цинк из раствора сульфата цинка.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
148.Соляная кислота не взаимодействует ни с одним из двух веществ:
1) цинком и гидроксидом натрия 2) медью и оксидом меди (II)
3) ртутью и оксидом углерода (IV) 4) магнием и аммиаком
Х1 Х2
149. В схеме превращений AI(ОН)3 → Y → AI(ОН)3 веществами «Х1» и «Х2» могут быть соответственно
1) K2SO4 и KOH 2) NaCI и HCI 3) Na2SO4 и h3SO4 4) HNO3 и NaOH
150.Хлорид железа (II) реагирует с каждым из двух веществ:
1) MgО и HCI 2) Zn и AgNО3 3) НNО3 и СО2 4) СаО и СО2
151.В каком ряду простые вещества расположены в порядке уменьшения металлических свойств?
1) Ва, Sr, Ca 2) Li, Na, K 3) Be, Mg, Ca 4) AI, Mg, Na
152. Верны ли следующие суждения о свойствах соединений элемента, электронная конфигурация атома которого 1s22s22p63s23p4?
Верны ли следующие суждения о свойствах соединений элемента, электронная конфигурация атома которого 1s22s22p63s23p4?
А. Этот элемент образует гидроксид с ярко выраженными кислотными свойствами.
Б. Степень окисления этого элемента в высшем гидроксиде равна +4.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
153.При обычных условиях практически осуществима реакция между железом и
1) серой (кр.) 2) серной кислотой (конц.)
3) нитратом цинка (р-р) 4) нитратом меди (II) (р-р)
154.Оксид кальция взаимодействует с каждым из трех веществ:
1) кислород, вода, серная кислота
2) соляная кислота, углекислый газ, вода
3) оксид магния, оксид серы (IV), аммиак
4) железо, азотная кислота, оксид фосфора (V)
155.Гидроксид натрия не реагирует с
1) AI(ОН)3 2) ZnО 3) h3SO4 4) Ва(ОН)2
156. Хлорид меди (II) реагирует с каждым из двух веществ:
Хлорид меди (II) реагирует с каждым из двух веществ:
1) MgО и HNO3 2) AgNО3 и Fe 3) СО2 и Н3N 4) СаО и NаОН
157.Водородное соединение с ярко выраженными основными свойствами образует
1) углерод 2) азот 3) фтор 4) кислород
158.Карбонат натрия в растворе не взаимодействует с
1) серной кислотой 2) углекислым газом
3) сульфатом натрия 4) хлоридом железа (II)
159.Формула ангидрида хлорной кислоты HCIO4
1) CI2O 2) CIO2 3) CI2O7 4) HCI
160.Оксид кремния (SiO2) реагирует с каждым из двух веществ:
1) NaOH и HF 2) AI2O3 и HCI 3) C и SO2 4) HNO3 и h3
Ответы к тестам по разделу
«Неорганическая химия»
Вопрос | Ответ | Вопрос | Ответ | Вопрос | Ответ | Вопрос | Ответ |
1 | 3 | 41 | 3 | 81 | 1 | 121 | 3 |
2 | 1 | 42 | 1 | 82 | 3 | 122 | 3 |
3 | 3 | 43 | 4 | 83 | 4 | 123 | 4 |
4 | 2 | 44 | 3 | 84 | 3 ? | 124 | 3 |
5 | 3 | 45 | 3 | 85 | 1 | 125 | 1 |
6 | 2 | 46 | 1 | 86 | 3 | 126 | 3 |
7 | 2 | 47 | 4 | 87 | 2 | 127 | 2 |
8 | 2 | 48 | 1 | 88 | 4 | 128 | 1 |
9 | 4 | 49 | 1 | 89 | 3 | 129 | 1 |
10 | 4 | 50 | 4 | 90 | 4 | 130 | 4 |
11 | 2 | 51 | 3 | 91 | 2 | 131 | 2 |
12 | 2 | 52 | 3 | 92 | 1 | 132 | 4 |
13 | 1 | 53 | 3 | 93 | 4 | 133 | 4 |
14 | 3 | 54 | 1 | 94 | 1 | 134 | 2 |
15 | 4 | 55 | 2 | 95 | 4 | 135 | 2 |
16 | 4 | 56 | 1 | 96 | 1 | 136 | 1 |
17 | 3 | 57 | 3 | 97 | 2 | 137 | 4 |
18 | 1 | 58 | 2 | 98 | 1 | 138 | 4 |
19 | 1 | 59 | 4 | 99 | 2 | 139 | 2 |
20 | 2 | 60 | 2 | 100 | 1 | 140 | 4 |
21 | 2 | 61 | 2 | 101 | 3 | 141 | 4 |
22 | 3 | 62 | 2 | 102 | 4 | 142 | 3 |
23 | 4 | 63 | 4 | 103 | 4 | 143 | 4 |
24 | 1 | 64 | 4 | 104 | 3 | 144 | 4 |
25 | 4 | 65 | 4 | 105 | 3 | 145 | 4 |
26 | 3 | 66 | 4 | 106 | 2 | 146 | 3 |
27 | 2 | 67 | 3 | 107 | 4 | 147 | 1 |
28 | 4 | 68 | 1 | 108 | 2 | 148 | 3 |
29 | 3 | 69 | 2 | 109 | 3 | 149 | 4 |
30 | 1 | 70 | 3 | 110 | 4 | 150 | 2 |
31 | 2 | 71 | 3 | 111 | 2 | 151 | 1 |
32 | 3 | 72 | 2 | 112 | 4 | 152 | 1 |
33 | 1 | 73 | 2 | 113 | 3 | 153 | 4 |
34 | 2 | 74 | 1 | 114 | 3 | 154 | 2 |
35 | 4 | 75 | 2 | 115 | 4 | 155 | 4 |
36 | 1 | 76 | 2 ? | 116 | 2 | 156 | 2 |
37 | 4 | 77 | 4 | 117 | 2 | 157 | 2 |
38 | 4 | 78 | 3 | 118 | 4 | 158 | 3 |
39 | 4 | 79 | 2 | 119 | 1 | 159 | 3 |
40 | 2 | 80 | 2 | 120 | 1 | 160 | 1 |
Ответы | § 35.
 -}.7N2e−,5e−. На внешнем (незавершенном) слое — пять электронов.
-}.7N2e−,5e−. На внешнем (незавершенном) слое — пять электронов.4) Элемент относится к группе неметаллов. Его простое вещество при обычных условиях находится в газообразном агрегатном состоянии. Формула простого вещества N2\mathrm{N_2}N2.
5) Валентность азота в высшем оксиде равна V, так как это элемент V группы. Валентность в летучем водородном соединении равна III.
6) Формула высшего оксида — N2O5\mathrm{N_2O_5}N2O5. Он принадлежит к кислотным оксидам. Гидроксид, соответствующий ему, предел являет собой кислоту HNO3\mathrm{HNO_3}HNO3.
7) Формула летучего водородного соединения — Nh4\mathrm{NH_3}Nh4.
в) Алюминий
1) Название химического элемента — алюминий, химический знак Al, относительная масса 27.
2) Атомный (порядковый) номер в периодической системе 13, элемент 3-го периода (малого), IIIA-группы (главной).
3) Заряд ядра атома 13+, оно содержит 13 протонов; в ядре нуклида 1327Al  14\mathrm{_{13}^{27}Al\,\, 14}1327Al14 нейтронов. -.}17Cl2e−,8e−,7e−. На внеш нем (незавершенном) слое семь электронов.
-.}17Cl2e−,8e−,7e−. На внеш нем (незавершенном) слое семь электронов.
4) Элемент относится к группе неметаллов. Его простое вещество при обычных условиях находится в газообразном агрегатном состоянии. Формула простого вещества — Cl2\mathrm{Cl_2}Cl2.
5) Валентность хлора в высшем оксиде равна VII, так как это элемент VII-А группы. Валентность в летучем водородном соединении равна I.
6) Формула высшего оксида — Cl2O7\mathrm{Cl_2O_7}Cl2O7. Он принадлежит к кислотным оксидам. Гидроксид, соответствующий ему, представляет собой кислоту — HClO4\mathrm{HClO_4}HClO4.
7) Формула летучего водородного соединения — HCl\mathrm{HCl}HCl.
Практическая работа «Алюминий» химия 10 клас
Вариант1
Часть А
А1. Элемент, электронная формула которого 1s22s22p63s23p1 образует высший оксид, проявляющий свойства:
1) несолеобразующего 2) кислотного 3) основного 4) амфотерного
А2. В атоме алюминия число свободных 3d-орбиталей равно:
В атоме алюминия число свободных 3d-орбиталей равно:
1) 0 2) 2 3) 5 4) 3
А3. Верны ли утверждения о гидроксиде алюминия?
А. Гидроксид алюминия проявляет только кислотные свойства.
Б. Гидроксид алюминия проявляет только основные свойства?
1) верно только А 3) верны оба утверждения
2) верно только Б 4) оба утверждения неверны
А4. Реакции концентрированной серной кислоты с алюминием при (о.у.) соответствует уравнение:
1) 2Al + 6H2SO4 = Al2(SO4)3 + 3SO2 + 6H2O 2) не взаимодействуют
3) 2Al + 5H2SO4 = Al2(SO4)3 + 2S + 5H2O 4) 2Al + 3H2SO4 = Al2(SO4)3 + 3H2
А5. При нагревании гидроксида алюминия образуются:
1) Al2O3 и H2O 3) Al и H2O 2) Al и H2 4) Al2O3 и H2
А6. Веществами Х и Y в схеме химической реакции Al 2S3 + H2O → X + Y являются:
Веществами Х и Y в схеме химической реакции Al 2S3 + H2O → X + Y являются:
1) Al(HS)3 и H2S 2) Al(OH)3 и H2S 3) Al(OH)S и H2S 4) Al2O3 и Al(HS)3
Часть В
В1. Установите соответствие между металлом и способом его электролитического получения в промышленности:
МЕТАЛЛ СПОСОБ ПОЛУЧЕНИЯ
А) натрий 1) водного раствора солей
Б) алюминий 2) водного раствора гидроксида
В) серебро 3) расплава поваренной соли
Г) медь 4) расплавленного оксида
5) раствора оксида в расплавленном криолите
В2. Установите соответствие между формулой соли и окраской индикаторов в ее водном растворе:
Установите соответствие между формулой соли и окраской индикаторов в ее водном растворе:
ФОРМУЛА СОЛИ ОКРАСКА ИНДИКАТОРОВ
А) KF 1) лакмус красный, фенолфталеин малиновый
Б) Al2(SO4)3 2) лакмус красный, фенолфталеин бесцветный
В) С6Н5ОNa 3) лакмус синий, фенолфталеин малиновый
Г) LiNO3 4) лакмус фиолетовый, фенолфталеин малиновый
5) лакмус синий, фенолфталеин бесцветный
6) лакмус фиолетовый, фенолфталеин бесцветный
Вариант2
Часть А
А1. Сумма протонов, нейтронов и электронов в атоме
Сумма протонов, нейтронов и электронов в атоме
1) 27 2) 40 3) 13 4) 14
А2. В ряду Al → Si → P → S
1) увеличивается число энергетических уровней в атомах
2) уменьшается радиус атома
3) усиливаются металлические свойства элементов
4) уменьшается высшая степень окисления элементов
А3. Алюминий реагирует с каждым из набора веществ:
1) азот и хлорид натрия 2) кислород и концентрированная азотная кислота (о.у.)
3) соляная кислота и гидроксид натрия 4) аргон и нашатырь
А4. Водород может выделиться при протекании реакции:
1) Al + NaOH + H2O = 2) Ag + HCl = 3) Fe + CuSO4 = 4) P + HNO3 =
А5. Гидроксид алюминия проявляет амфотерные свойства при взаимодействии с:
1) NaOH и Cs2SO4 2) KOH и Na2O 3) H2SO4 и KOH 4) HCl и CaCl2
А6. В схеме превращений Al → X1→ X2→ Al веществами Х1 и X2 могут быть
В схеме превращений Al → X1→ X2→ Al веществами Х1 и X2 могут быть
соответственно:
1) Al(NO3)3 и Al(OH)3 2) AlPO4 и Al(OH)3 3) Al(OH)3 и Al2(СO3)3
Часть В
В1. Установите соответствие между формулой вещества и продуктами электролиза его водного раствора с инертными электродами:
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
А) AlCl3
1) металл, галогенБ) RbOH 2) гидроксид металла, хлор, водород
В) Hg(NO3)2 3) металл, кислород
Г) AuCl3 4) металл, кислота, кислород
5) водород, кислород
6) водород, галоген
В2.
НАЗВАНИЕ СОЛИ СПОСОБНОСТЬ К ГИДРОЛИЗУ
А) ацетат аммония 1) по катиону
Б) сульфид алюминия 2) по аниону
В) ортофосфат калия 3) по катиону и аниону
Г) сульфат хрома(II) 4) гидролиз не происходит
Задания | А1 | А2 | А3 | А4 | А5 | А6 | В1 | В2 |
вариант 1 | 4 | 3 | 4 | 2 | 1 | 2 | 3511 | 3236 |
вариант 2 | 2 | 2 | 3 | 1 | 3 | 4 | 2541 | 3321 |
Aluminum Hydroxide Oxide Nanoparticles / Nanopowder
View the history of American Elements on Wikipedia
| PRODUCT | Product Code | ORDER | SAFETY DATA | TECHNICAL DATA | ||||
|---|---|---|---|---|---|---|---|---|
| (2N) 99% Aluminum Нанопорошок гидроксида оксида | AL-OOH-02-NP | Цены > | Паспорт безопасности > | Технический паспорт > | ||||
| (3n) 99,9% алюминиевого гидроксида нанопоокаватора | AL-OOH-03-NP | Цена> | SDS> | Data Pleas | AL-OOH-04-NP | ЦЕНЫ> | SDS> | ГЛАВНЫЙ ПЕРЕКЛЮЧЕНИЕ> |
| (5N) 99,999% Aluminum Hydroxide Oxide Nanopowder 999999% HydRexide Oxide Nanopowder 999999% HydRexide nanopowder 999999% | ||||||||
| ЦЕНЫ> | SDS> | Лист данных> |
Гидроксид алюминия Наночастицы/нанопорошок Информация о здоровье и безопасности
| Сигнальное слово | N/A |
|---|---|
| Hazard Statements | N/A |
| Hazard Codes | N/A |
| Risk Codes | N/A |
| Safety Statements | N/A |
| Транспортная информация | Н/Д |
Посмотреть и распечатать паспорт безопасности
РАЗДЕЛ 1.
 ИДЕНТИФИКАЦИЯ0003
ИДЕНТИФИКАЦИЯ0003Номер продукта: Все применимые коды продуктов American Elements, например. АЛ-ООХ-02-НП , АЛ-ООХ-03-НП , АЛ-ООХ-04-НП , AL-OOH-05-NP
Номер CAS: 24623-77-6
Соответствующие установленные области применения вещества: Научные исследования и разработки
Сведения о поставщике: 2 American Elements2
Los Angeles, CA
Тел.: +1 310-208-0551
Факс: +1 310-208-0351
Телефон службы экстренной помощи:
Внутренний, Северная Америка: +1 800-424-9300
РАЗДЕЛ 2. ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
Химическое название: Бемит, [ALOH]
CAS-23-776
Указание на опасность: Отсутствует
Особые комментарии об опасности для людей и окружающей среды: Отсутствуют
Дополнительную информацию о токсичности см. в Разделе 11.
РАЗДЕЛ 4. МЕРЫ ПЕРВОЙ ПОМОЩИ
Вдыхание: Выйти на свежий воздух. При необходимости проконсультируйтесь с врачом.
При необходимости проконсультируйтесь с врачом.
Контакт с кожей : Механическое (сухое) удаление. Последующее ополаскивание водой.
Попадание в глаза: Интенсивное промывание водой. При необходимости проконсультируйтесь с врачом.
Проглатывание: Прополоскать рот и дать выпить большое количество воды. Обратитесь за медицинской помощью.
РАЗДЕЛ 5. МЕРЫ ПОЖАРОТУШЕНИЯ
Подходящие средства пожаротушения: Сам продукт негорюч. Необходимо учитывать способ пожаротушения окружающих территорий.
Небезопасные средства пожаротушения: Нет.
Особые опасности воздействия : Нет.
Специальное защитное оборудование: Нет.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры личной безопасности: Избегайте образования пыли. В случае воздействия высоких концентраций переносимой по воздуху пыли
наденьте индивидуальный респиратор в соответствии с национальным законодательством.
Меры предосторожности по охране окружающей среды : Никаких особых мер предосторожности по охране окружающей среды не требуется.
Методы очистки: Собрать механически. Утилизируйте абсорбированный материал в соответствии с пунктом 9.0022 в рамках правил.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение: Избегать образования пыли. Никаких специальных рекомендаций по обращению не требуется.
Хранение: Сухое хранение.
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ/СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ
Пределы воздействия: OSHA-PEL: 15 мг/м3 (общая пыль), 5 мг/м3 (вдыхаемая пыль)
ACGIH-TWA: 10 мг/м3 (значение для твердые частицы, не содержащие асбеста и кристаллического кремнезема)
Средства индивидуальной защиты:
Средства защиты органов дыхания:
В случае недостаточной вентиляции наденьте подходящее респираторное оборудование. Когда концентрация пыли превышает пределы воздействия, рабочие должны использовать соответствующие сертифицированные респираторы.
Защита рук:
Носить подходящие перчатки.
Защита глаз: Наденьте защитные очки, чтобы избежать контакта с глазами.
Защита кожи: Не требуется специального защитного оборудования.
Гигиенические меры: Не есть, не пить и не курить при обращении. Мойте руки после обращения с
и перед едой.
Другая/общая защита: Нет.
Воздействие на окружающую среду
средства контроля: Данные отсутствуют.
РАЗДЕЛ 9. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Физическое состояние: Порошок
Цвет: Белый
Запах: Без запаха
pH: 9 -10
Растворимость в воде: Нерастворим
Плотность: 3,0 г/см ° C)
Давление пара:
Температура кипения:
Температура плавления: Разлагается перед плавлением
Температура вспышки:
Воспламеняемость:
Самовозгорание:
Октанол-вода Н/Д
РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Стабильность: Стабилен при нормальных условиях. Потеря воды и разложение начинаются при 340 °С.
Условия, которых следует избегать: Нет
Опасные реакции: Опасные реакции неизвестны.
Опасная полимеризация : Не происходит.
Опасное разложение: Нет
Дополнительная информация: Растворим в сильных кислотах и щелочных растворах.
РАЗДЕЛ 11. ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Продукт нетоксичен.
Острая оральная токсичность: Крыса, DL50 : >5000 мг/кг
Раздражение кожи: Нет эффекта.
Раздражение глаз: Нет эффекта.
Вдыхание: Может вызвать раздражение дыхательных путей.
Проглатывание: данные отсутствуют.
Сенсибилизация: Нет эффекта.
Канцерогенность: Опасные канцерогенные эффекты неизвестны.
Нет данных о мутагенном или токсическом воздействии на репродуктивную функцию.
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Бемит не представляет опасности для окружающей среды. Класса экотоксичности для 9 не существует.0022 бемит.
Токсичность водорослей: Водоросли, ErC50 > 100 мг/л
Токсичность дафний: Дафния, EC50 > 100 мг/л.
РАЗДЕЛ 13. РЕКОМЕНДАЦИИ ПО УТИЛИЗАЦИИ
Утилизация отходов : По возможности используйте повторно или перерабатывайте.
Утилизировать в соответствии с местным законодательством.
Испорченные упаковки: Пустые контейнеры следует сдавать на местную переработку, восстановление или утилизацию
отходов.
Дополнительная информация: Может быть выброшен на свалку при соблюдении местных правил.
РАЗДЕЛ 14. ИНФОРМАЦИЯ О ТРАНСПОРТИРОВКЕ
Наземный транспорт
ADR, RID, GGVS, GGVE Не классифицируется как опасный груз.
Речной транспорт
ВОПОГ, ДОПОГ Не классифицируется как опасный груз.
Морской транспорт
IMDG, GGV См. Не классифицируется как опасный груз.
Воздушный транспорт
ICAO-TI, IATA-DGR Не классифицируется как опасный груз.
DOT Не регулируется
РАЗДЕЛ 15. НОРМАТИВНАЯ ИНФОРМАЦИЯ
Маркировка в соответствии с директивами ЕС: Не определено, продукт не опасен.
Класс опасности для воды: Не опасен для воды.
R-фразы: неприменимо
S-фразы: неприменимо
Символы: нет
РАЗДЕЛ 16.
 ПРОЧАЯ ИНФОРМАЦИЯ
ПРОЧАЯ ИНФОРМАЦИЯПаспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (REACH). Приведенная выше информация считается верной, но не претендует на полноту и должна использоваться только в качестве руководства. Информация в этом документе основана на современном уровне наших знаний и применима к продукту с учетом соответствующих мер предосторожности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКОЕ ПРАВО 1997-2022 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Напечатать эту страницу
Наночастицы / нанопорошок оксида алюминия
Нанопорошок оксида алюминия, наноточки или наночастицы обычно имеют размер 10–45 нанометров (нм) с удельной площадью поверхности (SSA) в диапазоне 30–50 м2/г и также доступны со средним размером частиц 75–100 нм и удельной площадью поверхности примерно 2–10 м 2 /г. Наночастицы оксида гидроксида алюминия также доступны в пассивированных формах, формах сверхвысокой чистоты и высокой чистоты, а также покрытых и диспергированных формах. Они также доступны в виде дисперсии через производственную группу AE Nanofluid. Наножидкости обычно определяются как суспендированные наночастицы в растворе с использованием поверхностно-активных веществ или технологии поверхностного заряда. Также доступно техническое руководство по дисперсии наножидкостей и выбору покрытия. Другие наноструктуры включают наностержни, наноусы, нанорожки, нанопирамиды и другие нанокомпозиты. Наночастицы золота и углеродные наночастицы нашли новое применение в лечении рака с использованием радиоволн для нагревания и разрушения опухоли, лимфомы или метастазированного рака. Недавние открытия подтверждают осуществимость этой технологии на людях. Функционализированные поверхностью наночастицы позволяют частицам предпочтительно адсорбироваться на поверхности раздела с использованием химически связанных полимеров.
Наночастицы оксида гидроксида алюминия также доступны в пассивированных формах, формах сверхвысокой чистоты и высокой чистоты, а также покрытых и диспергированных формах. Они также доступны в виде дисперсии через производственную группу AE Nanofluid. Наножидкости обычно определяются как суспендированные наночастицы в растворе с использованием поверхностно-активных веществ или технологии поверхностного заряда. Также доступно техническое руководство по дисперсии наножидкостей и выбору покрытия. Другие наноструктуры включают наностержни, наноусы, нанорожки, нанопирамиды и другие нанокомпозиты. Наночастицы золота и углеродные наночастицы нашли новое применение в лечении рака с использованием радиоволн для нагревания и разрушения опухоли, лимфомы или метастазированного рака. Недавние открытия подтверждают осуществимость этой технологии на людях. Функционализированные поверхностью наночастицы позволяют частицам предпочтительно адсорбироваться на поверхности раздела с использованием химически связанных полимеров.
Наночастицы оксида алюминия / нанопорошки Синонимы
Оксигидроксид алюминия, гидроксидоксидоалюминий, метаалюминиевая кислота, моногидрат оксида алюминия, бемит, монооксид алюминия монооксид, гидрокси(оксо)алюминий, гидрокси(оксо)алюман, CAS 1318-23-6, CAS 8006- 30-2, CAS 11139-78-9, CAS ALOOH, псевдобемит, γ-AlO(OH)
Химические идентификаторы
| Линейная формула | AlO(OH) | 0N/A |
|---|---|
| EC No. | 246-368-8 |
| Beilstein/Reaxys No. | N/A |
| Pubchem CID | 32524 |
| IUPAC Name | hydroxy (oxo) alumane |
| SMILES | InChI=1S/Al.h3O.O/h;1h3;/q+1;;/p-1 |
| InchI Identifier | FAHBNUUHRFUEAI-UHFFFAOYSA-M |
| Дюймовый ключ | O[Al]=O |
Customers For Aluminum Hydroxide Oxide Nanoparticles / Nanopowder Have Also Viewed
Aluminum Oxide Nanofibers | Nickel Oxyhydroxide Nanopowder | Yttrium Aluminum Oxide Nanoparticle Dispersion |
Aluminum Cerium Дисперсия наночастиц оксида | Дисперсия наночастиц оксида цинка, легированная алюминием | Cobalt Aluminum Oxide Nanoparticles / Nanopowder |
Copper Aluminum Oxide Nanoparticle Dispersion | Magnesium Aluminum Oxide Nanoparticle Dispersion | Iron Oxide Hydroxide Nanoparticle Dispersion |
Related Applications, Forms & Industries for Оксид гидроксида алюминия Наночастицы/нанопорошок
Спецификации упаковки
Типичная оптовая упаковка включает пластиковый поддон на 5 галлонов/25 кг. ведра, волокнистые и стальные барабаны до 1-тонных супермешков в количестве полного контейнера (FCL) или загрузки грузовика (T/L). Исследования и образцы, а также гигроскопичные, окисляющие или другие чувствительные к воздуху материалы могут быть упакованы в аргоне или вакууме. Отгрузочная документация включает сертификат анализа и паспорт безопасности (SDS). Растворы упаковываются в полипропиленовые, пластиковые или стеклянные банки, вплоть до контейнеров для жидкостей на поддонах емкостью 440 галлонов и автоцистерн на 36 000 фунтов.
ведра, волокнистые и стальные барабаны до 1-тонных супермешков в количестве полного контейнера (FCL) или загрузки грузовика (T/L). Исследования и образцы, а также гигроскопичные, окисляющие или другие чувствительные к воздуху материалы могут быть упакованы в аргоне или вакууме. Отгрузочная документация включает сертификат анализа и паспорт безопасности (SDS). Растворы упаковываются в полипропиленовые, пластиковые или стеклянные банки, вплоть до контейнеров для жидкостей на поддонах емкостью 440 галлонов и автоцистерн на 36 000 фунтов.
Способы оплаты
American Elements принимает чеки, банковские переводы, ACH, большинство основных кредитных и дебетовых карт (Visa, MasterCard, AMEX, Discover) и Paypal.
Для удобства наших международных клиентов American Elements предлагает следующие дополнительные способы оплаты:
Банковский перевод SOFORT для Австрии, Бельгии, Германии и Швейцарии Карты JCB для Японии и всего мираBoleto Bancario для БразилииiDeal платежи для Нидерландов, Германии, Австрии, Бельгия, Италия, Польша, Испания, Швейцария и ВеликобританияКарты GiroPay для ГерманииКарты Dankort для ДанииКарты Elo для БразилииКарты eNETS для СингапураCartaSi для ИталииКарты Carte-Bleue для ФранцииКарты UnionPayHipercard для БразилииКарты TROY для ТурцииКарты BC для Южной КореиRuPay для Индии
Сопутствующие элементы
13 Al 26. 981538600 Алюминий
981538600 Алюминий
Посмотреть другие изделия из алюминия. Алюминий (или алюминий) (атомный символ: Al, атомный номер: 13) представляет собой элемент блока P, группы 13, периода 3 с атомным весом 26,9815386. Это третий по распространенности элемент в земной коре и самый распространенный металлический элемент. Название алюминия происходит от глинозема, минерала, из которого сэр Хамфри Дэви пытался его очистить в 1812 году. Алюминий был впервые предсказан Антуаном Лавуазье в 1787 году и впервые выделен Гансом Кристианом Эрстедом в 1825 году. характеристики. Он легкий, немагнитный и не искрящий. Он стоит на втором месте среди металлов по шкале ковкости и на шестом по пластичности. Он широко используется во многих отраслях промышленности, где требуется прочный, легкий и простой в изготовлении материал. Хотя он имеет только 60% электропроводности меди, он используется в линиях электропередачи из-за его легкого веса. Чистый алюминий мягок и не обладает прочностью, но в сочетании с небольшими количествами меди, магния, кремния, марганца или других элементов придает ему множество полезных свойств.
Recent Research
Слоистые двойные гидроксидные пленки на нанопористом анодном оксиде алюминия/алюминиевой проволоке: новое волокно для экспресс-анализа эфирных масел Origanum vulgare.
Получение мезопористых основных смешанных оксидов металлов путем сборки монодисперсных наночастиц двойного гидроксида со слоями Mg-Al.
Наночастицы оксида меди и объемный оксид меди в сочетании с индол-3-уксусной кислотой изменяют алюминий, бор и железо в семенах Pisum sativum.
Нанолисты из твердого раствора оксида цинка и алюминия, полученные пиролизом слоистого двойного гидроксида, в качестве фотоанодов для сенсибилизированных красителем солнечных элементов.
Синтез наночастиц алюминия, не содержащих оксидов, для нанесения на проводящую пленку.
Огнезащитный и дымоподавляющий эффект гибрида, содержащего модифицированный CuMoO4 восстановленный оксид графена/слоистый двойной гидроксид на эпоксидной смоле.
Низкокристаллический анод из наночастиц гидроксида оксида железа для высокоэффективных суперконденсаторов.
Структура атомарного масштаба пленок аморфного оксигидроксида, оксида и оксикарбида алюминия, исследованная методом ядерного магнитного резонанса (27)Al в очень сильном поле.
Синтез наностержней гидроксида празеодима (Pr(OH)3) и оксида празеодима (Pr6O11) путем старения при комнатной температуре.
Адсорбция олиго-ДНК на поверхности двухгидроксидных наночастиц со слоями магния и алюминия: механистическое значение в доставке генов. | СпрингерПлюс
- Исследования
- Открытый доступ
- Опубликовано:
- Агадже Бедемо 1 ,
- Бхагван Сингх Чандраванши 1 и
- Фелек Зевге 1 38 СпрингерПлюс том 5 , Номер статьи: 1288 (2016) Процитировать эту статью
2889 доступов
22 цитаты
Сведения о показателях
Атиех М.А., Бакатер О.Ю., Тавабини Б.С., Бухари А.А., Халед М., Альхарти М., Феттоухи М., Абуилаиви Ф.А. (2010) Удаление хрома(III) из воды с помощью модифицированных и немодифицированных углеродных нанотрубок . Дж Наноматер. дои: 10.1155/2010/232378
Google ученый
Байг М.А., Мехмуд Б., Матин А. (2003) Удаление хрома из промышленных сточных вод путем фильтрации через песок. Electron J Environ Agric Food Chem 2: 374–379
Google ученый
Chakir A, Bessiere J, Kacemi KE, Marouf B (2002) Сравнительное исследование удаления трехвалентного хрома из водных растворов бентонитом и вспученным перлитом.
 J Hazard Mater 95:29–46
J Hazard Mater 95:29–46Статья Google ученый
Csobán K, Joó P (1999) Сорбция Cr(III) на кремнеземе и оксиде алюминия: эксперименты и моделирование. Коллоиды Surf A Physicochem Eng Asp 151: 97–112
Артикул Google ученый
da Fonseca MG, de Oliveira MM, Arakaki LNH (2006) Удаление катионов кадмия, цинка, марганца и хрома из водного раствора глинистым минералом. J Hazard Mater 137:288–292
Статья Google ученый
Dubey SP, Gopal K (2007) Адсорбция хрома (VI) на недорогих адсорбентах, полученных из сельскохозяйственных отходов: сравнительное исследование. Дж. Хазард Матер 145: 465–470
Артикул Google ученый
Гарг В.К., Гупта Р., Кумар Р., Гупта Р.К. (2004) Адсорбция хрома из водного раствора на обработанных опилках. Биоресурс Технол 92:79–81
Статья Google ученый
Гупта В.
 К., Гупта М., Шарма С. (2001) Разработка процесса удаления свинца и хрома из водного раствора с использованием красного шлама — отходов алюминиевой промышленности. Водные ресурсы 35:1125–1134
К., Гупта М., Шарма С. (2001) Разработка процесса удаления свинца и хрома из водного раствора с использованием красного шлама — отходов алюминиевой промышленности. Водные ресурсы 35:1125–1134Google ученый
Igwe JC, Abia AA (2006) Процесс биоразделения для удаления тяжелых металлов из сточных вод с использованием биосорбентов. Afr J Biotechnol 5:1167–1179
Google ученый
Карале Р.С., Вадкар Д.В., Нангаре П.Б. (2007) Удаление и извлечение шестивалентного хрома из промышленных сточных вод методом осаждения с учетом оптимизации затрат. J Environ Res Dev 2: 209–216
Google ученый
Karnitz O Jr, Gurgel LV, de Melo JC, Botaro VR, Melo TM, de Freitas Gil RP, Gil LF (2007) Адсорбция иона тяжелого металла из водного раствора одного металла с помощью химически модифицированного жома сахарного тростника. Биоресурс Технол 98:1291–1297
Статья Google ученый
Li H, Li Z, Liu T, Xiao X, Peng Z, Deng L (2008) Новая технология биосорбции и извлечения шестивалентного хрома из сточных вод с помощью биофункциональных магнитных шариков.
 Биоресурс Техно 99:6271–6279
Биоресурс Техно 99:6271–6279Артикул Google ученый
Мандал С., Махапатра С.С., Патель Р.К. (2015) Нейро-нечеткий подход к удалению мышьяка (III) и хрома (VI) из воды. J Water Process Eng 5:58–75
Статья Google ученый
Мохан Д., Чарльз У., Питтман Дж. (2006) Активированные угли и недорогие адсорбенты для очистки воды от трех- и шестивалентного хрома. Дж. Хазард Матер 10: 5772–5822
Google ученый
Nomanbhay SM, Palanisamy K (2005) Удаление тяжелых металлов из промышленных сточных вод с использованием покрытого хитозаном угля из скорлупы масличной пальмы. Electron J Biotechnol 8:1–6
Статья Google ученый
Ostolska I, Wiśniewska M (2015) Исследование возможностей удаления коллоидного Cr 2 O 3 из водного раствора с использованием блок-сополимеров ионных полиаминокислот.
 Дж Хазард Матер 290:69–77
Дж Хазард Матер 290:69–77Статья Google ученый
Овлад М., Аруа М.К., Ашри В., Дауд В., Барутиан С. (2009) Удаление воды и сточных вод, загрязненных шестивалентным хромом: обзор. Вода Воздух Загрязнение почвы 200:59–77
Статья Google ученый
Ramakrishniah CR, Prathima B (2012) Удаление шестивалентного хрома из промышленных сточных вод методом химического осаждения. Int J Eng Res Appl 2:599–603
Google ученый
Салими А., Амини Н., Даньяли Х., Халладж Р. (2006) Электрокаталитическое восстановление хрома (VI) тионином: электрохимические свойства и механистическое исследование. Электроанализ 17:1664–1671
Статья Google ученый
Зарин В., Пант К.К. (2006) Удаление хрома из промышленных отходов с помощью коры эвкалипта. Биоресурс Технол 97:15–20
Артикул Google ученый
Селварадж К.
 , Манонмани С., Паттабхи С. (2003) Удаление шестивалентного хрома с использованием спиртового шлама. Биоресурс Технол 89:207–211
, Манонмани С., Паттабхи С. (2003) Удаление шестивалентного хрома с использованием спиртового шлама. Биоресурс Технол 89:207–211Статья Google ученый
Sumathi KMS, Mahimairaja S, Naidu R (2004) Использование недорогих биологических отходов и вермикулита для удаления хрома из сточных вод кожевенного завода. Биоресурс Технол 96:309–316
Артикул Google ученый
Шевчук-Карпиш К., Вишневская М. (2015) Исследование возможностей удаления оксида хрома (III) из водного раствора в присутствии альбуминов. Int J Environ Sci Technol 12:2947–2956. doi: 10.1007/s13762-014-0712-y
Артикул Google ученый
Шевчук-Карпиш К., Вишневская М., Пац М., Чома А., Команецкая И. (2014) Sinorhizobium meliloti 1021 экзополисахарид в качестве флокулянта, улучшающего удаление оксида хрома (III) из водных растворов.
 Вода Воздух Почва Загрязнение 225:2052. дои: 10.1007/s11270-014-2052-4
Вода Воздух Почва Загрязнение 225:2052. дои: 10.1007/s11270-014-2052-4Артикул Google ученый
Wiśniewska M, Szewczuk-Karpisz K (2013) Возможности удаления коллоидного оксида хрома (III) из воды с помощью полиакриловой кислоты. Environ Sci Pollut Res 20:3657–3669
Артикул Google ученый
Wiśniewska M, Chibowski S, Urban T (2016) Синтетический полиакриламид как потенциальный флокулянт для удаления коммерческого оксида хрома (III) из водной суспензии. Int J Environ Sci Technol 13:679–690. дои: 10.1007/s13762-015-0912-0
Артикул Google ученый
Ю Л.Дж., Шукла С.С., Доррис К.Л., Шукла А., Маргрейв Д.Л. (2003) Адсорбция хрома из водных растворов кленовыми опилками. Дж. Хазард Матер 100: 53–63
Артикул Google ученый
Химический факультет, Колледж естественных наук, Университет Аддис-Абебы, P.
 O. Box 1176, Аддис-Абеба, Эфиопия
O. Box 1176, Аддис-Абеба, ЭфиопияАгадже Бедемо, Бхагван Сингх Чандраванши и Фелек Зевге
- Агадже Бедемо
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Бхагван Сингх Чандраванши
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Feleke Zewge
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
Abstract
Вода является второй по важности для человека. Загрязнение воды делает ее непригодной для употребления человеком. Ионы хрома поступают в водоемы с различных производств, обладающих высокой токсичностью, что влияет на жизнь биоты в этих водах. В этом исследовании гидроксид оксида алюминия был проверен на его эффективность для удаления трехвалентного хрома из водных растворов в экспериментах в периодическом режиме. Концентрации хрома в водных растворах и сточных водах кожевенного завода до и после экспериментов по адсорбции определяли с помощью пламенной атомно-абсорбционной спектрометрии. Изучено влияние рН, времени контакта, начальной концентрации и дозы адсорбента на адсорбцию Cr(III). Исследование показало, что более 9Удаление Cr(III) на 9 % достигается в широком диапазоне начальных значений рН (3–10). Установлено, что оптимальными условиями для удаления Cr(III) являются рН 4–6 с дозой адсорбента 40 г/л при времени контакта 60 мин. Адсорбционную емкость оценивали по изотермам Ленгмюра и Фрейндлиха. Данные о равновесии при различной дозе адсорбента подчиняются двум изотермам.
Загрязнение воды делает ее непригодной для употребления человеком. Ионы хрома поступают в водоемы с различных производств, обладающих высокой токсичностью, что влияет на жизнь биоты в этих водах. В этом исследовании гидроксид оксида алюминия был проверен на его эффективность для удаления трехвалентного хрома из водных растворов в экспериментах в периодическом режиме. Концентрации хрома в водных растворах и сточных водах кожевенного завода до и после экспериментов по адсорбции определяли с помощью пламенной атомно-абсорбционной спектрометрии. Изучено влияние рН, времени контакта, начальной концентрации и дозы адсорбента на адсорбцию Cr(III). Исследование показало, что более 9Удаление Cr(III) на 9 % достигается в широком диапазоне начальных значений рН (3–10). Установлено, что оптимальными условиями для удаления Cr(III) являются рН 4–6 с дозой адсорбента 40 г/л при времени контакта 60 мин. Адсорбционную емкость оценивали по изотермам Ленгмюра и Фрейндлиха. Данные о равновесии при различной дозе адсорбента подчиняются двум изотермам. Установлено, что адсорбент эффективен для удаления Cr(III) из стоков кожевенного производства.
Установлено, что адсорбент эффективен для удаления Cr(III) из стоков кожевенного производства.
Справочная информация
Тяжелые металлы токсичны даже в следовых количествах, и их присутствие в окружающей среде представляет серьезную опасность для многих форм жизни на Земле (Selvaraj et al. 2003; Igwe and Abia 2006). Большинство металлических загрязнений попадает в водную среду в результате различных промышленных процессов. Токсичные металлы не поддаются биологическому разложению, поэтому их концентрации необходимо снизить до приемлемого уровня перед сбросом промышленных сточных вод в водоемы. Всемирная организация здравоохранения (ВОЗ) считает, что алюминий, хром, марганец, железо, кобальт, никель, медь, цинк, кадмий, ртуть и свинец вызывают наибольшую озабоченность (Baig et al. 2003).
Соединения хрома широко используются во многих отраслях промышленности, что приводит к выбросу большого количества ионов хрома в окружающую среду. Загрязнение почвы и воды хромом является серьезной экологической проблемой. Токсичность хрома сильно различается среди широкого спектра соединений хрома, степени его окисления и растворимости в воде (Салими и др., 2006). Хром встречается в окружающей среде в основном в двух валентных состояниях: трехвалентном хроме Cr(III) и шестивалентном хроме Cr(VI). Хром(III) считается важным элементом питания человека и млекопитающих, в то время как хром(VI) высокотоксичен и обладает мутагенной и канцерогенной активностью (Nomanbhay and Palanisamy 2005; Sarin and Pant 2006). Однако менее токсичный трехвалентный хром легко окисляется до шестивалентного хрома в присутствии окисляющих примесей.
Токсичность хрома сильно различается среди широкого спектра соединений хрома, степени его окисления и растворимости в воде (Салими и др., 2006). Хром встречается в окружающей среде в основном в двух валентных состояниях: трехвалентном хроме Cr(III) и шестивалентном хроме Cr(VI). Хром(III) считается важным элементом питания человека и млекопитающих, в то время как хром(VI) высокотоксичен и обладает мутагенной и канцерогенной активностью (Nomanbhay and Palanisamy 2005; Sarin and Pant 2006). Однако менее токсичный трехвалентный хром легко окисляется до шестивалентного хрома в присутствии окисляющих примесей.
Загрязнение хромом может происходить в естественной среде или в результате промышленных процессов. Тем не менее, загрязнение хромом, вызванное деятельностью человека, в последнее время было в центре внимания многих научных дискуссий, беспокойства регулирующих органов и юридических позиций. Загрязнение водоемов хромом – это вопросы, которые продолжают возникать в отношении безопасности питьевого водоснабжения. Хром из антропогенных источников обычно выделяется в виде хромсодержащих жидких или твердых отходов, которые могут содержать любую комбинацию Cr(III) или Cr(VI) с различной растворимостью. Концентрация хрома в сбрасываемых сточных водах зависит в основном от количества и состояния соединений хрома, используемых в промышленном процессе, от рН и наличия других органических и неорганических технологических отходов.
Хром из антропогенных источников обычно выделяется в виде хромсодержащих жидких или твердых отходов, которые могут содержать любую комбинацию Cr(III) или Cr(VI) с различной растворимостью. Концентрация хрома в сбрасываемых сточных водах зависит в основном от количества и состояния соединений хрома, используемых в промышленном процессе, от рН и наличия других органических и неорганических технологических отходов.
Cr(III) является основной формой Cr в водоемах и может удерживаться многими адсорбентами. Адсорбция Cr(III) усиливается с увеличением рН за счет депротонирования поверхности адсорбента. Адсорбция Cr(III) обычно усиливается, если адсорбент имеет высокое содержание органических веществ, поскольку присутствует больше мест для сорбции (Igwe and Abia 2006). Cr(VI) ведет себя как анион. В целом сорбция Cr(VI) уменьшается с увеличением pH, в то время как при низких значениях pH поверхности будут нейтральными или положительно заряженными, что приводит к более высокой адсорбции из-за притяжения противоположных зарядов. Кроме того, сорбция Cr(VI) уменьшается по мере увеличения концентрации конкурирующих анионов, сорбированных на твердой поверхности, и в конечном итоге сорбция Cr(VI) становится незначительной. Таким образом, процессы адсорбции используются косвенно для восстановления Cr(VI), т.е. Cr(VI) сначала восстанавливается до Cr(III) (Selvaraj et al. 2003).
Кроме того, сорбция Cr(VI) уменьшается по мере увеличения концентрации конкурирующих анионов, сорбированных на твердой поверхности, и в конечном итоге сорбция Cr(VI) становится незначительной. Таким образом, процессы адсорбции используются косвенно для восстановления Cr(VI), т.е. Cr(VI) сначала восстанавливается до Cr(III) (Selvaraj et al. 2003).
Адсорбция является эффективным и экономичным методом удаления хрома из воды и сточных вод. Недавно рассматривалось использование недорогих адсорбентов для снижения концентрации хрома в промышленных сточных водах. Несколько адсорбентов (кора эвкалипта, опилки, песок, глинистый минерал, древесный уголь и различные побочные продукты сельского хозяйства, такие как скорлупа арахиса, шелуха пшеницы, жмых сахарного тростника, биосорбция, магнитные шарики, углеродные нанотрубки, экзополисахарид Sinorhizobium meliloti 1021, полиакриловая кислота, ионные блок-сополимеры полиаминокислот, альбумины, синтетический полиакриламид и т. д.) изучались многими учеными на предмет их эффективности удаления хрома в разных частях мира (Gupta et al. 2001; Garg et al. 2004; Mohan et al. 2006; da Фонсека и др., 2006 г., Дубей и Гопал, 2007 г., Карниц и др., 2007 г., Карале и др., 2007 г., Ли и др., 2008 г., Овлад и др., 2009 г.; Атие и др. 2010 г.; Рамакришнайя и Пратима, 2012 г.; Вишневская и Шевчук-Карпиш, 2013 г.; Шевчук-Карпиш и др. 2014; Мандал и др. 2015 г.; Остольская и Вишневская, 2015 г.; Шевчук-Карпиш и Вишневская, 2015 г.; Вишневская и др. 2016). Однако в литературе нет сообщений об удалении хрома с использованием местных адсорбентов в Эфиопии. Следовательно, это исследование было сосредоточено на использовании местного адсорбента с большей эффективностью.
2001; Garg et al. 2004; Mohan et al. 2006; da Фонсека и др., 2006 г., Дубей и Гопал, 2007 г., Карниц и др., 2007 г., Карале и др., 2007 г., Ли и др., 2008 г., Овлад и др., 2009 г.; Атие и др. 2010 г.; Рамакришнайя и Пратима, 2012 г.; Вишневская и Шевчук-Карпиш, 2013 г.; Шевчук-Карпиш и др. 2014; Мандал и др. 2015 г.; Остольская и Вишневская, 2015 г.; Шевчук-Карпиш и Вишневская, 2015 г.; Вишневская и др. 2016). Однако в литературе нет сообщений об удалении хрома с использованием местных адсорбентов в Эфиопии. Следовательно, это исследование было сосредоточено на использовании местного адсорбента с большей эффективностью.
Методы
Химикаты и реагенты
Все растворы готовили на дистиллированной и деионизированной воде. Исходный стандартный раствор металлического хрома (1000 мг/л, Buck Scientific Puro-Graphic, США), приготовленный в виде нитрата в 2 % HNO 3 , использовали в качестве калибровочного стандарта для определения концентрации хрома с помощью пламенного атомно-абсорбционного спектрометра. Исходный раствор Cr(III) с концентрацией 1000 мг/л готовили путем растворения 5,1240 г аналитически чистого CrCl 3 ·6H 2 O (Riedel-deHaen, Германия) в мерной колбе вместимостью 1 л и доводили до маркируют дистиллированной деионизированной водой. Дальнейшие рабочие растворы готовили соответствующими разведениями. 0,2 М NaOH (99,0 %, BDH Chemicals Ltd, Англия) и 0,2 М HCl (36 %, Fisher Scientific UK Limited, Англия) использовали для корректировки pH.
Исходный раствор Cr(III) с концентрацией 1000 мг/л готовили путем растворения 5,1240 г аналитически чистого CrCl 3 ·6H 2 O (Riedel-deHaen, Германия) в мерной колбе вместимостью 1 л и доводили до маркируют дистиллированной деионизированной водой. Дальнейшие рабочие растворы готовили соответствующими разведениями. 0,2 М NaOH (99,0 %, BDH Chemicals Ltd, Англия) и 0,2 М HCl (36 %, Fisher Scientific UK Limited, Англия) использовали для корректировки pH.
Адсорбент
Адсорбент (гидроксид оксида алюминия) готовили путем смешивания 100 г сульфата алюминия в 500 мл дистиллированной воды при перемешивании магнитной мешалкой. Полученный более низкий pH 2,72 был доведен до pH 7,00 с использованием 2 M NaOH. Осажденный твердый материал отфильтровывали и сушили при 50°C в печи. Затем фракции высушенного материала обрабатывали при температуре 200°С в печи (Carbolite, модель ELF 11/14B, Англия). Нагретые адсорбенты охлаждали в эксикаторе до момента его использования. Сульфат алюминия (99 %), используемый для приготовления гидроксида оксида алюминия, был получен от Управления водоснабжения и канализации Аддис-Абебы, который производится на месте заводом по производству сульфата алюминия и серной кислоты в Аваш Мелкаса (Аваш Мелкаса, Эфиопия).
Сульфат алюминия (99 %), используемый для приготовления гидроксида оксида алюминия, был получен от Управления водоснабжения и канализации Аддис-Абебы, который производится на месте заводом по производству сульфата алюминия и серной кислоты в Аваш Мелкаса (Аваш Мелкаса, Эфиопия).
Аппаратура
Изучение эффективности удаления хрома адсорбентами заключается в определении количества хрома в сточных растворах до и после проведения адсорбции. Это было сделано с использованием пламенного атомно-абсорбционного спектрометра (Buck Scientific Model 210 VGP, East Norwalk, USA), оснащенного дейтериевым корректором фона, распылителем и лампой с хромовым катодом с использованием воздушно-ацетиленового пламени.
Для определения концентрации хрома в фильтратах была приготовлена серия стандартных растворов хрома в диапазоне концентраций 0,05–3 мг/л путем разбавления исходного раствора хрома деионизированной водой. Контрольный образец (дистиллированная деионизированная вода) и стандарты анализировали на пламенном атомно-абсорбционном спектрометре и строили калибровочные кривые по четырем точкам. Затем растворы образцов всасывали в прибор ААС и записывали прямые показания общей концентрации хрома. Для каждого образца проводили три повторных определения. Затем рассчитывали количество адсорбированного Cr(III) по разнице между количеством до и после адсорбции.
Затем растворы образцов всасывали в прибор ААС и записывали прямые показания общей концентрации хрома. Для каждого образца проводили три повторных определения. Затем рассчитывали количество адсорбированного Cr(III) по разнице между количеством до и после адсорбции.
Эксперимент по адсорбции
Эксперименты в периодическом режиме проводили в конической колбе на 250 мл при комнатной температуре (22 ± 2 °C). Исследовали эффективность адсорбции хрома (% удаления) в зависимости от времени установления равновесия, рН, количества адсорбента и исходной концентрации Cr(III). Для оптимизации времени контакта 2 г адсорбента перемешивали с 50 мл 40 мг/л раствора Cr(III) через разные промежутки времени (0, 2, 5, 10, 15, 20, 25, 30, 40, 50, 60, 80 и 100 мин). По окончании периода перемешивания образцы центрифугировали при 8000 об/мин в течение 10 мин и фильтровали через фильтровальную бумагу Whatman № 1. Концентрацию Cr(III) в фильтрате определяли с помощью пламенной атомно-абсорбционной спектрометрии. Чтобы изучить влияние pH, исходный pH 50 мл растворов Cr(III) с концентрацией 40 мг/л был доведен до различных значений pH (2, 3, 4, 5, 6, 7, 8, 9).и 10) с использованием 0,2 М NaOH и 0,2 М HCl. Затем 1 г адсорбента уравновешивали этими растворами в течение 60 мин и фильтраты анализировали на концентрацию Cr(III). Влияние дозировки адсорбента также изучали путем изменения количества адсорбента (0,2, 0,4, 0,6, 0,8, 1,0, 1,2, 1,4, 1,8, 2,2, 2,6, 3,0 и 3 г) при начальной концентрации 40 мг/л. Cr(III) при pH 3,8 при времени контакта 60 мин. В другой серии экспериментов 50 мл растворов Cr(III) различной концентрации (0, 10, 20, 40, 60, 80, 100 мг/л) переносили в коническую колбу, содержащую 1 г адсорбента, и перемешивали в течение 60 мин и фильтраты анализировали на концентрацию Cr(III).
Чтобы изучить влияние pH, исходный pH 50 мл растворов Cr(III) с концентрацией 40 мг/л был доведен до различных значений pH (2, 3, 4, 5, 6, 7, 8, 9).и 10) с использованием 0,2 М NaOH и 0,2 М HCl. Затем 1 г адсорбента уравновешивали этими растворами в течение 60 мин и фильтраты анализировали на концентрацию Cr(III). Влияние дозировки адсорбента также изучали путем изменения количества адсорбента (0,2, 0,4, 0,6, 0,8, 1,0, 1,2, 1,4, 1,8, 2,2, 2,6, 3,0 и 3 г) при начальной концентрации 40 мг/л. Cr(III) при pH 3,8 при времени контакта 60 мин. В другой серии экспериментов 50 мл растворов Cr(III) различной концентрации (0, 10, 20, 40, 60, 80, 100 мг/л) переносили в коническую колбу, содержащую 1 г адсорбента, и перемешивали в течение 60 мин и фильтраты анализировали на концентрацию Cr(III).
Результаты и обсуждение
Все эксперименты по адсорбции проводились в трех повторах, и данные, представленные на всех рисунках, представляют собой средние значения трехкратных измерений. Контрольные опыты (до добавления адсорбента) также проводили в трех экземплярах. Относительные стандартные отклонения, связанные с контрольными опытами, экспериментами по адсорбции и определением Cr(III), были менее 5 %.
Относительные стандартные отклонения, связанные с контрольными опытами, экспериментами по адсорбции и определением Cr(III), были менее 5 %.
Влияние времени контакта
Эксперименты по адсорбции проводили при исходной концентрации 40, 50 и 60 мг/л Cr(III) с 2 г адсорбента через разные промежутки времени (2–100 мин) для оптимизации времени установления равновесия для удаление Cr(III). График процентного удаления Cr(III) при трех начальных концентрациях в разные промежутки времени (рис. 1) показывает, что скорость процентного удаления Cr(III) выше в начале. Вероятно, это связано с большей площадью поверхности адсорбента, доступной в начале для адсорбции Cr(III) (Sumathi et al. 2004).
Рис. 1Процент удаления Cr(III) в зависимости от времени контакта (доза адсорбента 40 г/л, начальный pH 3,8) при трех различных начальных концентрациях (40, 50, 60 мг/л) Cr( III)
Изображение полного размера
Измерение процентной адсорбции Cr(III) в зависимости от времени показывает, что процентная адсорбция Cr(III) увеличивалась с увеличением времени контакта и достигала равновесия через 15 мин независимо от концентрации Cr (III). Но время, необходимое для достижения кажущегося равновесия, увеличивалось при более высоких начальных концентрациях.
Но время, необходимое для достижения кажущегося равновесия, увеличивалось при более высоких начальных концентрациях.
Следует отметить, что тенденция удаления почти одинакова независимо от начальной дозы Cr(III). Предположительно это связано с более высокой дозой адсорбента, использованного в этом эксперименте (доза адсорбента 40 г/л), а также может быть связана с меньшими различиями в исходной дозе Cr(III) (40, 50, 60 мг/л).
Влияние начального pH
Значение pH раствора является важным фактором, контролирующим поглощение Cr(III). Экспериментальные результаты показали, что процент адсорбции Cr(III) увеличивался с увеличением рН и достигал 98 % при рН 4 (рис. 2). Когда рН снижался ниже 3, процент удаления уменьшался, при этом удаление всего 0,1 % при рН 2 указывало на то, что адсорбент совершенно неэффективен при очень низком рН.
Рис. 2Процент удаления Cr(III) в зависимости от начального pH (доза адсорбента 20 г/л, исходная концентрация Cr(III) 40 мг/л, время контакта 60 мин)
Изображение в натуральную величину
Адсорбцию при различных значениях рН можно объяснить видовым распределением хрома в воде и характером поверхности адсорбента. При кислом рН преобладающими видами катионов Cr(III) являются: Cr 3+ , CrOH 2+ и CrOH 2 + и в кислых условиях поверхность адсорбента становится протонированной и, следовательно, уменьшается электростатическое притяжение между частицами Cr(III) и адсорбентом. поверхности с последующим снижением процента адсорбции. Но по мере увеличения pH поверхность адсорбента становится менее протонированной и будет иметь сильное притяжение для катионных частиц Cr(III).
При кислом рН преобладающими видами катионов Cr(III) являются: Cr 3+ , CrOH 2+ и CrOH 2 + и в кислых условиях поверхность адсорбента становится протонированной и, следовательно, уменьшается электростатическое притяжение между частицами Cr(III) и адсорбентом. поверхности с последующим снижением процента адсорбции. Но по мере увеличения pH поверхность адсорбента становится менее протонированной и будет иметь сильное притяжение для катионных частиц Cr(III).
Другой возможностью увеличения процента удаления Cr(III) при повышении pH является образование осадка нерастворимого гидроксида при более высоких значениях pH. Обычно адсорбция Cr(III) была выше при более высоких значениях pH и уменьшалась при уменьшении pH по причинам, объясненным выше. Кривая эффективности удаления (рис. 2) показывает, что гидроксид алюминия эффективен в широком диапазоне рН (3–10).
В настоящем исследовании было обнаружено, что равновесный рН выше, чем начальный рН при начальных значениях рН <6. Но равновесные значения рН снижались примерно до 6 для начальных значений рН >6. Результирующий равновесный рН в зависимости от начального рН показан в Таблице 1. Увеличение рН можно объяснить протонированием адсорбента. При начальных значениях рН <6 адсорбент действует как основание и протонируется. Этот процесс уменьшил концентрацию ионов H + и привел к увеличению pH. Но адсорбент действует как кислота и депротонируется, когда начальные значения рН > 6. В результате рН снизился. Снижение pH также может быть связано с образованием нерастворимого гидроксида Cr, который уносит OH − ион из раствора.
Но равновесные значения рН снижались примерно до 6 для начальных значений рН >6. Результирующий равновесный рН в зависимости от начального рН показан в Таблице 1. Увеличение рН можно объяснить протонированием адсорбента. При начальных значениях рН <6 адсорбент действует как основание и протонируется. Этот процесс уменьшил концентрацию ионов H + и привел к увеличению pH. Но адсорбент действует как кислота и депротонируется, когда начальные значения рН > 6. В результате рН снизился. Снижение pH также может быть связано с образованием нерастворимого гидроксида Cr, который уносит OH − ион из раствора.
Полная таблица
Влияние дозы адсорбента
Процентную адсорбцию Cr(III) изучали при увеличении дозы адсорбента от 4 до 60 г/л при 40 мг л исходной концентрации раствора Cr(III). Результаты показали удаление Cr(III) более чем на 98 % при дозе адсорбента 20 г/л через 60 минут времени контакта.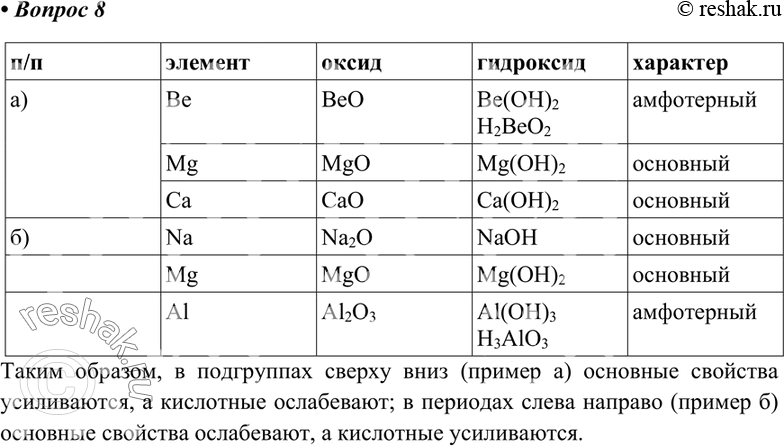 Наблюдается, что в пределах исследованного диапазона доз адсорбента процент удаления увеличивается с увеличением количества адсорбента до оптимального количества адсорбента, за пределами которого процент удаления остается практически неизменным (рис. 3). Увеличение процента адсорбции с увеличением дозы адсорбента связано с увеличением числа центров адсорбции.
Наблюдается, что в пределах исследованного диапазона доз адсорбента процент удаления увеличивается с увеличением количества адсорбента до оптимального количества адсорбента, за пределами которого процент удаления остается практически неизменным (рис. 3). Увеличение процента адсорбции с увеличением дозы адсорбента связано с увеличением числа центров адсорбции.
Процент удаления Cr(III) в зависимости от количества адсорбента [исходная концентрация Cr(III) 40 мг/л, время контакта 60 мин, начальный pH 3,8]
Полноразмерное изображение
Адсорбция isotherm
Данные о равновесии адсорбции, полученные при фиксированной начальной концентрации Cr(III) и различной дозе адсорбента, уложены в линейную форму изотерм адсорбции Ленгмюра и Фрейндлиха. Простейшая изотерма адсорбции, изотерма Ленгмюра, основана на предположении, что все центры адсорбции эквивалентны и что способность частицы связываться с ними не зависит от того, заняты ли соседние сайты. Линейная форма уравнения адсорбции Ленгмюра имеет вид:
Линейная форма уравнения адсорбции Ленгмюра имеет вид:
$${\text{x/m}} = 1 / {\text{x}}_{\text{m}} + 1 / {\text{b}}\;{\text{x}} _{\text{m}} {\text{C}}_{\text{e}} \;{\text{или}}\;{\text{C}}_{\text{e}} \ влево ( {\ text {x / m}} \ right) = {\ text {C}} _ {\ text {e}} / {\ text {x}} _ {\ text {m}} + 1 / { \text{bx}}_{\text{m}}$$
, который имеет форму y = bx + a с наклоном 1/x м и точкой пересечения с осью y 1/bx м . Где x/m — адсорбционная емкость, количество адсорбированного растворенного вещества (в мг) на количество адсорбента (в г), x m — количество адсорбированного растворенного вещества на единицу веса адсорбента, необходимое для однослойного покрытия поверхности, также называемой монослойной емкостью. b – константа, связанная с теплотой адсорбции, C e – равновесная концентрация (Sarin and Pant 2006). x м и b были определены по наклону и пересечению графика и составили 3,36 мг/г и 3,35 л/мг соответственно. Адсорбционная емкость, полученная в этом эксперименте, согласуется с результатами, опубликованными в литературе (максимальная сорбционная емкость находится в диапазоне 3,23–11,8 мг/г (Selvaraj et al., 2003). Линейный график C e /(x/ m) по сравнению с C e (рис. 4) с коэффициентом регрессии 0,9994 (R 2 ) показали, что адсорбционное равновесие подчиняется модели Ленгмюра, проявляющей монослойную адсорбцию.
Адсорбционная емкость, полученная в этом эксперименте, согласуется с результатами, опубликованными в литературе (максимальная сорбционная емкость находится в диапазоне 3,23–11,8 мг/г (Selvaraj et al., 2003). Линейный график C e /(x/ m) по сравнению с C e (рис. 4) с коэффициентом регрессии 0,9994 (R 2 ) показали, что адсорбционное равновесие подчиняется модели Ленгмюра, проявляющей монослойную адсорбцию.
Ленгмюровская изотерма адсорбции Cr(III) на гидроксиде оксида алюминия [исходная концентрация Cr(III) 40 мг/л, время контакта 60 мин, начальный pH 3,8]
Полноразмерное изображение
Изотерма адсорбции Фрейндлиха, которая предполагает неоднородные поверхностные условия, утверждает, что адсорбционная способность x/m является функцией равновесной концентрации растворенного вещества. Линейная форма уравнения Фрейндлиха выражается как:
$${ \log }\left( {\text{x/m}} \right) = {\log }\left( {\text{K}}_{\text{f}}} \right ) + 1 / {\text{n}}\;{\log }\left( {\text{C}}_{\text{e}} } \right)$$
, где K f константа, связанная с адсорбционной способностью, 1/n является константой, связанной с интенсивностью адсорбции (Салими и др. , 2006). Линейный график зависимости log(x/m) от log(C e ) (рис. 5) с коэффициентом регрессии 0,988 показал, что адсорбционное равновесие также подчиняется модели Фрейндлиха, демонстрирующей неоднородные поверхностные условия. К 9Значения 0095 f и 1/ n , полученные из графика (рис. 5), составляют 2,09 мг/г и 0,22 л/г соответственно. Низкое значение 1/ n (<1) свидетельствует о большей адсорбционной эффективности вновь разработанного адсорбента. Эти значения сопоставимы с несколькими опубликованными литературными данными для различных адсорбентов (Chakir et al. 2002; Sarin and Pant 2006).
, 2006). Линейный график зависимости log(x/m) от log(C e ) (рис. 5) с коэффициентом регрессии 0,988 показал, что адсорбционное равновесие также подчиняется модели Фрейндлиха, демонстрирующей неоднородные поверхностные условия. К 9Значения 0095 f и 1/ n , полученные из графика (рис. 5), составляют 2,09 мг/г и 0,22 л/г соответственно. Низкое значение 1/ n (<1) свидетельствует о большей адсорбционной эффективности вновь разработанного адсорбента. Эти значения сопоставимы с несколькими опубликованными литературными данными для различных адсорбентов (Chakir et al. 2002; Sarin and Pant 2006).
Изотерма адсорбции Фрейндлиха для адсорбции Cr(III) на гидроксиде алюминия [исходная концентрация Cr(III) 40 мг/л, время контакта 60 мин, начальный pH 3,8]
Изображение полного размера
Влияние исходной концентрации
Эксперименты по адсорбции при различных исходных концентрациях Cr(III) от 10 до 100 мг/л проводились с фиксированными дозами (20 г/л) адсорбента. Результаты показывают, что процент удаления Cr(III) снижается по мере увеличения исходной концентрации Cr(III). Удаление Cr(III) колебалось от 100 до 79 % при исходной концентрации Cr(III) 10–100 мг/л (рис. 6). Это можно объяснить тем, что все адсорбенты имели ограниченное количество активных центров, которые при превышении определенной концентрации становились бы насыщенными. Поскольку процентное удаление = (C o — C e )/C o , другой причиной уменьшения процентного удаления является большее увеличение значения знаменателя (C o ) по сравнению со значением (C o — C e ) ценность. Но фактическое количество удаленного хрома (мг) на грамм адсорбента тем больше, чем выше концентрация (Csobán and Joó 1999; Yu et al. 2003).
Результаты показывают, что процент удаления Cr(III) снижается по мере увеличения исходной концентрации Cr(III). Удаление Cr(III) колебалось от 100 до 79 % при исходной концентрации Cr(III) 10–100 мг/л (рис. 6). Это можно объяснить тем, что все адсорбенты имели ограниченное количество активных центров, которые при превышении определенной концентрации становились бы насыщенными. Поскольку процентное удаление = (C o — C e )/C o , другой причиной уменьшения процентного удаления является большее увеличение значения знаменателя (C o ) по сравнению со значением (C o — C e ) ценность. Но фактическое количество удаленного хрома (мг) на грамм адсорбента тем больше, чем выше концентрация (Csobán and Joó 1999; Yu et al. 2003).
Процент удаления Cr(III) в зависимости от начальной концентрации (время контакта 60 мин, доза адсорбента 20 г/л, начальный pH 3,8)
Изображение полного размера
В целом оптимальные условия для удаления Cr(III) оказались при pH 4–6 с дозой адсорбента 40 г/л при времени контакта 60 мин.
Применение метода к реальному образцу
Эффективность адсорбента, гидроксида алюминия, для удаления хрома была протестирована с использованием сточных вод кожевенного завода Hafde (Аддис-Абеба, Эфиопия). Концентрация хрома в сточных водах в месте сброса была очень высокой (5520 мг/л). Эксперименты по адсорбции на этом реальном образце были проведены при двух разных значениях pH (таблицы 2, 3): при pH 3,8, что соответствует pH сточных вод, и при pH 5. Было установлено, что адсорбент практически одинаково эффективен при двух значениях pH. . Таким образом, адсорбент можно наносить непосредственно без какой-либо регулировки pH. Так как сточные воды являются высококонцентрированными, адсорбционные эксперименты проводили после разбавления (25 раз). Даже после разбавления сточных вод они остаются очень концентрированными и содержат 221 мг/л хрома. Поэтому проценты адсорбции (табл. 2, 3) кажутся небольшими (74 и 76%). Но фактическое количество, удаляемое на грамм адсорбента, такое же, как и у стандартного водного раствора, приготовленного в лаборатории.
Полноразмерная таблица
Таблица 3 Процентное удаление хрома из реального раствор образца (разбавленный в 25 раз) (время контакта 60 мин, доза адсорбента 40 г/л, начальный рН 5)Полная таблица
Заключение
В этом исследовании был разработан эффективный метод адсорбции для удаления трехвалентного хрома из сточных вод на основе периодического режима адсорбционных экспериментов. Гидроксид оксида алюминия оказался очень эффективным адсорбентом для удаления трехвалентного хрома из сточных вод. Влияние различных параметров (таких как время контакта, начальный рН, количество адсорбентов и начальная концентрация Cr(III)) было изучено для максимальной адсорбции Cr(III) на гидроксиде оксида алюминия. В ходе исследования было выявлено более 9Удаление Cr(III) на 9 % 1 г адсорбента в 50 мл раствора Cr(III) с концентрацией 40 мг/л в широком диапазоне начальных значений рН (3–10). Данные о равновесии адсорбции, полученные при фиксированной начальной концентрации и различной дозе адсорбента, хорошо согласовывались с изотермами адсорбции Ленгмюра и Фрейндлиха. Предложенный адсорбент, гидроксид алюминия, был применен для удаления Cr(III) из сточных вод кожевенного завода (Аддис-Абеба, Эфиопия) и оказался очень эффективным. Таким образом, адсорбент можно применять для удаления хрома из сточных вод.
Данные о равновесии адсорбции, полученные при фиксированной начальной концентрации и различной дозе адсорбента, хорошо согласовывались с изотермами адсорбции Ленгмюра и Фрейндлиха. Предложенный адсорбент, гидроксид алюминия, был применен для удаления Cr(III) из сточных вод кожевенного завода (Аддис-Абеба, Эфиопия) и оказался очень эффективным. Таким образом, адсорбент можно применять для удаления хрома из сточных вод.
Ссылки
Скачать ссылки
Вклад авторов
BSC и FZ внесли свой вклад в разработку исследования. Компания AB участвовала в отборе проб и анализе. AB, BSC и FZ внесли свой вклад в интерпретацию данных и составление рукописи. BSC внес свой вклад в критический пересмотр документа. Все авторы читали и одобрили окончательный вариант рукописи.
Компания AB участвовала в отборе проб и анализе. AB, BSC и FZ внесли свой вклад в интерпретацию данных и составление рукописи. BSC внес свой вклад в критический пересмотр документа. Все авторы читали и одобрили окончательный вариант рукописи.
Благодарности
Авторы признательны Химическому факультету Университета Аддис-Абебы, Аддис-Абеба, Эфиопия, за предоставление лабораторного оборудования. Агадже Бедемо благодарен химическому факультету Университета Аддис-Абебы, Аддис-Абеба, Эфиопия, за спонсирование его исследования.
Конкурирующие интересы
Авторы заявляют, что у них нет конкурирующих интересов.
Финансирование
Эта работа финансировалась исследовательскими и аспирантскими программами Университета Аддис-Абебы, Эфиопия. Исследовательские и аспирантские программы Университета Аддис-Абебы, Эфиопия, не участвовали в разработке, сборе данных, анализе или публикации рукописи.
Информация об авторе
Авторы и организации
Авторы
Автор, ответственный за корреспонденцию
Бхагван Сингх Чандраванши.
Права и разрешения
Открытый доступ Эта статья распространяется в соответствии с условиями международной лицензии Creative Commons Attribution 4.0 (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии вы должным образом указываете автора (авторов) и источник, предоставляете ссылку на лицензию Creative Commons и указываете, были ли внесены изменения.
Перепечатки и разрешения
Об этой статье
Цены и характеристики оксида алюминия 99%
Глинозем представляет собой кислородное соединение химического элемента алюминия. В технической области глинозем называют электрокорундом (ЭЛК).
Глинозем
Добыча и представление
Из бокситов гидроксид алюминия получают вывариванием в растворе гидроксида натрия (процесс Байера). Путем удаления воды, например путем обжига, спекания или прокаливания, получают оксид алюминия.
Получение глинозема также можно осуществить путем осторожного обезвоживания гиббсита (гидраргиллита) или бемита.
Окись алюминия также образуется при сгорании алюминиевой пудры с перхлоратом аммония в твердотопливных ракетах.
Чистый металлический алюминий имеет тонкий самопроизвольный слой оксида алюминия (самопассивация) после хранения на воздухе, который защищает его от коррозии. С помощью электролитически нанесенного слоя оксида алюминия алюминиевые поверхности предметов повседневного обихода приобретают чрезвычайно твердую (например, твердость по шкале Мооса 9) и антикоррозионный защитный слой путем анодирования. Для производства электролитических конденсаторов используют анодированный алюминий этих марок.
Для производства электролитических конденсаторов используют анодированный алюминий этих марок.
Мировое производство глинозема увеличилось со 108 миллионов тонн в 2014 году до примерно 118 миллионов тонн в 2015 году. Тремя крупнейшими производителями глинозема в 2014 году были Китай (47,8 миллиона тонн), Австралия (20,5 миллиона тонн) и Бразилия. (10,6 млн тонн). Геологическая служба США указала средние цены на импорт оксида алюминия в США на уровне 410 долларов США за тонну в 2015 году, в то время как импортные цены на бокситы в том же году были на уровне 28 долларов США за тонну.
В качестве побочного продукта производства глинозема красный шлам, содержащий едкий едкий натр и токсичные тяжелые металлы, хранится во всем мире на открытых свалках или сбрасывается в реки.
Свойства
модификации
Наиболее важными модификациями оксида алюминия являются:
кубический γ-Al2O3 (глина, исходный материал для производства керамики и алюминия)
ромбоэдрический (тригональный) минерал корунд, сапфир или — для легирования хромом — рубин, как абразив и алюмокерамика)
Точно так же известен β-оксид алюминия (β-Al2O3), это историческая ошибка. Это комбинация Na2O и Al2O3 в Na2Al22O34 (Na2O · 11Al2O3), также известная под названием минерала Diaoyudaoit
Это комбинация Na2O и Al2O3 в Na2Al22O34 (Na2O · 11Al2O3), также известная под названием минерала Diaoyudaoit
Электрические свойства
Al2O3 является очень хорошим изолятором и имеет очень высокую диэлектрическую прочность 35 кВ/мм. Удельное сопротивление при 20°С составляет 1012 Ом·м, при 1000°С падает до 107 Ом·м. Относительная диэлектрическая проницаемость составляет 9-10 на частоте 100 МГц, коэффициент потерь около 10-4.
Тепловые свойства
При стандартных условиях теплопроводность за счет фононного резонанса имеет относительно высокое значение 35,6-39 для керамических материалов Вт·м-1·К-1 (монокристаллический корунд: 40 Вт·м-1·К-1, плотная керамика с 96% Al2O3 25 Вт·м-1·К-1), которая резко возрастает с понижением температуры и снижается с повышением температуры при 1000°С примерно до 5 Вт·м- 1 · К-1.
Коэффициент расширения находится в пределах 6,5-8,9·10-6 К-1.
Температура плавления составляет 2072 °С, поэтому температура нанесения высокочистой глиноземной керамики должна быть ниже 1900 °С. в сочетании с основанием) или в виде основания (в сочетании с кислотой).
в сочетании с основанием) или в виде основания (в сочетании с кислотой).
γ-Al2O3 представляет собой гигроскопичный белый сыпучий порошок, который не растворяется в воде, но растворяется в сильных кислотах и основаниях. Уже при 800 °C γ-Al2O3 превращается в α-Al2O3, который обычно нерастворим в кислотах, таких как основания.
γ-Al2O3 представляет собой пористый материал, структура поверхности которого может сильно зависеть от производственного процесса или его температуры. В хроматографии используется в качестве стационарной фазы.
Оксид алюминия образует алюминаты с различными оксидами металлов.
Механические свойства
Механические свойства глиноземной керамики зависят от чистоты и микроструктуры полученной керамики. Чем чище сорт, тем обычно достигаются лучшие свойства, но тем сложнее весь производственный процесс. В дополнение к свойствам, перечисленным в таблице ниже, глиноземная керамика также характеризуется очень хорошими трибологическими свойствами и очень хорошими характеристиками трения и износа:
| Недвижимость | 96% | 99,8% |
|---|---|---|
| плотность | 3,75 г/см³ | 3,96 г/см³ |
| прочность на изгиб | 310 МПа | 630 МПа |
| Модуль Вейбулла | 13 | 15 |
| Прочность на сжатие | 2500 МПа | 4000 МПа |
| вязкость разрушения | 4,0 МПам½ | 4,3 МПам½ |
| Модуль | 350 ГПа | 406 ГПа |
| Твердость по Виккерсу HV1 | 1620 МПа | 2000 МПа |
Использование
Около 70% мирового производства 120 миллионов тонн оксида алюминия в 2016 году было использовано в производстве металлического алюминия (процесс Холла-Эру).
Гибридная схема на алюмокерамической подложке
Натриевые разрядные трубки высокого давления с разрядными трубками (это затупленные стержни внутри), изготовленные из прозрачной глиноземной керамики
α-Al2O3 имеет твердость по шкале Мооса от 9 до 9,5 и перерабатывается, среди прочего, в опорные камни измерительных приборов и часов, а также к абразивам. Основой для этого часто является побочный продукт алюминотермии, накапливающий алунд.
Прокаленный оксид алюминия используется в керамике (например, в раковинах, посуде для гостиниц, пуленепробиваемой одежде) или в самом широком смысле в качестве полирующих средств (например, в чистящих средствах для стеклокерамики, средствах по уходу за автомобилем, тормозных колодках, зубных пастах). Кроме того, спеченный α-Al2O3 (спекшийся корунд) служит огнеупорным материалом для футеровки печей или лабораторного оборудования.
Загрязненный небольшими количествами Cr2O3 или TiO2 корунд образует драгоценные камни рубин (часовые камни, рисовальные камни, рубиновый лазер) и сапфир.
Монокристаллы Al2O3, легированные Ti2O3, образуют сердце Титана: сапфировый лазер.
γ-Al2O3 служит адсорбентом и носителем катализатора, а также самим катализатором.
В электротехнике глиноземная керамика используется в качестве диэлектрика из-за ее низкого коэффициента диэлектрических потерь. Основной областью применения является реализация полосковых линий и конденсаторов в высокочастотной технике. Керамические пластины из оксида алюминия также служат подложкой для толстопленочной технологии, тонкопленочной технологии и платиновых терморезисторов (см. PT100). Хорошая металлизуемость этой керамики также позволяет осуществлять прямую пайку электронных компонентов, таких как резисторы или светодиоды. Керамика также действует как теплоотвод одновременно. Эти керамические электронные системы столь же эффективны, как и системы с металлическими радиаторами. Оксид алюминия также используется для производства крепежных элементов.
Высокая диэлектрическая прочность и максимальная рабочая температура до 1900°C делают оксид алюминия идеальным изолятором для свечей зажигания.
Керамика из оксида алюминия используется в производстве установок и машин, в частности, для защиты от износа и коррозии. Например, транспортные каналы и желоба, барабанные мельницы и смесители облицованы высокоэффективной керамической плиткой для увеличения срока службы систем. Коррозионную стойкость стеклянных поверхностей можно значительно повысить, нанеся на них покрытие из оксида алюминия. Также при плазменной сварке зарекомендовали себя сопла из глинозема. Благодаря хорошим трибологическим свойствам отдельных компонентов, таких как уплотнительные и регулирующие колеса, опорные втулки и валы, нитенаправители в текстильной промышленности, а также шары и чаши тазобедренных суставов в эндопротезировании, зарекомендовали себя. Также инновационным является использование керамических шипов на беговых дорожках трамплинов.
Высокочистая, крупнокристаллическая и поэтому прозрачная глиноземная керамика используется для изготовления трубок горелок газоразрядных ламп высокого давления (натриевых, металлогалогенных). Раньше он использовался в качестве прозрачного для ультрафиолетового излучения оконного материала для СППЗУ.
Раньше он использовался в качестве прозрачного для ультрафиолетового излучения оконного материала для СППЗУ.
Новейшие процессы спекания позволяют использовать оксид алюминия для производства чрезвычайно прочной наноразмерной стеклокерамики, для. B. Очки для наручных часов.
Керамика Al2O3 также недавно использовалась в броне транспортных средств. Керамическая плитка приклеивается к ткани из арамида или Dyneema. Этот тип брони обеспечивает вдвое больший защитный эффект по сравнению с броневой сталью при том же базовом весе. Керамика разбивает снаряд, а арамидные волокна затем улавливают осколки.
Al2O3 продается как корунд, полудрагоценный корунд и обычный корунд, известный как корунд (ELK). В электрической печи это производится при температуре около 2000 ° C. Полученный расплавленный пирог разбивается и просеивается в соответствии с размерами зерен, указанными DIN. Благородный корунд используется в технике в качестве абразива при изготовлении абразивных кругов.

 0021
0021 J Hazard Mater 95:29–46
J Hazard Mater 95:29–46 К., Гупта М., Шарма С. (2001) Разработка процесса удаления свинца и хрома из водного раствора с использованием красного шлама — отходов алюминиевой промышленности. Водные ресурсы 35:1125–1134
К., Гупта М., Шарма С. (2001) Разработка процесса удаления свинца и хрома из водного раствора с использованием красного шлама — отходов алюминиевой промышленности. Водные ресурсы 35:1125–1134 Биоресурс Техно 99:6271–6279
Биоресурс Техно 99:6271–6279 Дж Хазард Матер 290:69–77
Дж Хазард Матер 290:69–77 , Манонмани С., Паттабхи С. (2003) Удаление шестивалентного хрома с использованием спиртового шлама. Биоресурс Технол 89:207–211
, Манонмани С., Паттабхи С. (2003) Удаление шестивалентного хрома с использованием спиртового шлама. Биоресурс Технол 89:207–211 Вода Воздух Почва Загрязнение 225:2052. дои: 10.1007/s11270-014-2052-4
Вода Воздух Почва Загрязнение 225:2052. дои: 10.1007/s11270-014-2052-4 O. Box 1176, Аддис-Абеба, Эфиопия
O. Box 1176, Аддис-Абеба, Эфиопия