Гидроксид бария: способы получения и химические свойства
Гидроксид бария Ba(OH)2 — неорганическое соединение. Белый, плавится без разложения. При дальнейшем нагревании разлагается. Хорошо растворяется в воде. Проявляет основные свойства.
Относительная молекулярная масса Mr = 171,34; относительная плотность для тв. и ж. состояния d = 4,5; tпл = 408º C.
1. Гидроксид бария получают в результате взаимодействия твердого сульфида бария и паров воды при 450º С, на выходе образуется гидроксид бария и сероводородная кислота:
BaS + 2H2O = Ba(OH)2 + H2S
2. При взаимодействии бария с водой при комнатной температуре образуется гидроксид бария и водород:
Ba + 2H2O = Ba(OH)2↓ + H2↑
3. Оксид бария при взаимодействии с водой образует гидроксид бария:
Оксид бария при взаимодействии с водой образует гидроксид бария:
BaO + H2O = Ba(OH)2
Качественная реакция на гидроксид бария — окрашивание фенолфталеина в малиновый цвет.
1. Гидроксид бария взаимодействует со сложными веществами:
1.1. Гидроксид бария реагирует с кислотами:
1.1.1. В результате реакции между гидроксидом бария и разбавленной соляной кислотой образуется хлорид бария и вода:
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
1.1.2. Гидроксид бария взаимодействует с разбавленной серной кислотой, образуя сульфат бария и воду:
Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O
1.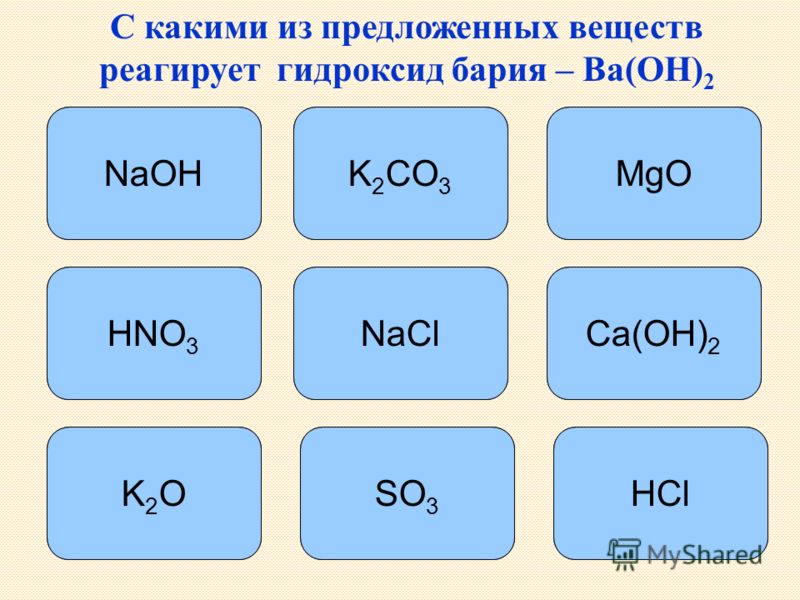 1.3. В результате взаимодействия гидроксида бария и разбавленной фосфорной кислоты образуется фосфат бария и вода:
1.3. В результате взаимодействия гидроксида бария и разбавленной фосфорной кислоты образуется фосфат бария и вода:
3Ba(OH)2 + 2H3PO4 = Ba3(PO4)2↓ + 6H2O,
если с гидроксидом бария будет взаимодействовать концентрированная фосфорная кислота, то в результате реакции возможно образование гидрофосфата бария и воды:
Ba(OH)2 + H3PO4 = BaHPO4↓ + 2H2O
1.1.4. С насыщенным и холодным гидроксидом бария реагирует разбавленная сероводородная кислота, образуя сульфид бария и воду:
Ba(OH)2 + H2S = BaS↓ + 2H2O,
если сероводородная кислота будет насыщенной на выходе образуются гидросульфид бария и вода:
Ba(OH)2 + 2H2S = Ba(HS)2 + 2H2O
1. 1.5. Гидроксид бария вступает во взаимодействие с концентрированной плавиковой кислотой с образованием фторида бария и воды:
1.5. Гидроксид бария вступает во взаимодействие с концентрированной плавиковой кислотой с образованием фторида бария и воды:
Ba(OH)2 + 2HF = BaF2↓ + 2H2O
1.2. Гидроксид бария взаимодействует с оксидами:
1.2.1. В результате взаимодействия гидроксида бария и углекислого газа образуется карбонат бария и вода:
Ba(OH)2 + СO2 = BaСO3 + H2O,
если с углекислым газом реагирует карбонат бария в виде суспензии, то образуется гидрокарбонат бария в растворе:
Ba(OH)2 + 2СO2 = Ba(HСO3)2
1.2.2. Гидроксид бария вступает в реакцию с оксидом серы (IV), образуя на выходе сульфит бария и воду:
Ba(OH)2 + SO2 = BaSO3 + H2O,
если с оксидом серы (IV) взаимодействует гидроксид бария в виде суспензии, то на выходе происходит образование гидросульфита бария в растворе:
Ba(OH)2 + 2SO2 = Ba(HSO3)2
1. 3. Гидроксид бария вступает в взаимодействие с солями:
3. Гидроксид бария вступает в взаимодействие с солями:
1.3.1. Гидроксид бария вступает в реакцию с хроматом калия и образует хромат бария и гидроксид калия:
Ba(OH)2 + K2CrO4 = BaCrO4↓ + 2KOH
1.3.2. Насыщенный гидроксид бария взаимодействует при кипении с концентрированным раствором хлората аммония. При этом образуются хлорат бария, газ аммиак и воды:
Ba(OH)2 + 2NH4ClO3 = Ba(ClO3)2 + 2NH3↑ + H2O
2. Гидроксид бария разлагается при температуре 780 — 800º С, образуя на выходе оксид бария и воду:
Ba(OH)2 = BaO + H2O
Понравилось это:
Нравится Загрузка. ..
..
Гидроксид бария — щелочь 2-го класса опасности
Гидроксид бария — относящееся к категории оснований неорганическое вещество, сильная щелочь с формулой Ba(OH)2. Часто реактив еще называют «едкий барит». Гидроокись может существовать как в безводной форме, так и в виде кристаллогидратов с 1, 2-мя, 7-ю, 8-ю молекулами воды. В обычных условиях образуется 8-водная гидроокись Ba(OH)2∙8H2O.
Свойства
Едкий барит представляет собой твердое белое порошкообразное вещество с прозрачными кристаллами, без запаха. Порошок гигроскопичный, активно поглощает влагу из воздуха. Водорастворимый, растворимость увеличивается в горячей воде; не растворяется в спирте. Не горит, не взрывается. Токсичен. Как и все щелочи, вызывает химические ожоги.
Концентрированный раствор гидроксида в воде называют баритовой водой. Раствор в химических реакциях проявляет сильные оснóвные свойства. Реагирует с кислотами и оксидами, образуя соли. Поглощает из воздуха СО2. Это свойство используют в аналитической химии при индикации диоксида углерода.
Это свойство используют в аналитической химии при индикации диоксида углерода.
Меры предосторожности
Гидроксид бария относится к веществам 2-го класса опасности. Разрушает органические ткани, поэтому опасен для кожи, глаз, слизистых оболочек и внутренних органов. Опасны также пыль, туман, испарения. Симптомы отравления: головная боль, одышка, тошнота, кашель, диарея, желудочные боли. В серьезных случаях наблюдается повышение давления, нарушения сердечного ритма, сосудистая недостаточность, вялость мышц и шоковое состояние. При нарушениях техники безопасности и превышении в воздухе ПДК гидроокиси бария у людей могут наблюдаться изменения в составе крови, иногда развиваются заболевания головного мозга, ЖКТ, сердца.
Работать с едким баритом следует в вентилируемом помещении с использованием средств защиты (толстые резиновые перчатки, спецкостюм, респиратор, защитные очки). Если реактив попал на кожу или в глаза, пораженные участки нужно сразу же хорошо промыть водой и обратиться к врачу.
Хранят гидроокись бария в герметичной таре (влагонепроницаемые мешки), отдельно от кислот и других сильных окислителей, воды. Помещение должно быть хорошо вентилируемым, крытым, сухим. Наилучший температурный диапазон: от +15 до +25 °С.
Перевозить вещество можно всеми видами транспорта с маркировкой «Опасно».
Применение
• В химпроме как сырье для производства солей бария, реагент для получения щелочей рубидия и цезия из их сульфатов и карбонатов.
• Для очистки пищевых масел и жиров от сульфатов, для выделения белого сахара из мелассы (густой сиропообразной темной жидкости при производстве тростникового сахара).
• В нефтедобыче для приготовления и очистки буровых растворов.
• В лабораторной практике для титрования органических кислот; как индикатор сульфат-ионов SO42−, карбонат-ионов CO32−, диоксида углерода.
• Для производства смазок, добавок к техническим маслам.
• Для очистки промышленных растворов от сульфат-ионов.
• В цветной металлургии.
Гидроксид бария | AMERICAN ELEMENTS®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ
Наименование продукта: Гидроксид бария
Номер продукта: Все применимые коды продуктов American Elements, например. БА-ОН-02 , БА-ОН-03 , БА-ОН-04 , BA-OH-05
Номер CAS: 17194-00-2
Соответствующие установленные области применения вещества: Научные исследования и разработки
Информация о поставщике:
American Elements
10884 Weyburn Ave.
Los Angeles, CA
Тел.: +1 310-208-0551
Факс: +1 310-208-0351
Телефон службы экстренной помощи:
Внутренний, Северная Америка: +1 800-44 -9300
Международный: +1 703-527-3887
РАЗДЕЛ 2. ИДЕНТИФИКАЦИЯ ОПАСНОСТЕЙ
Обзор чрезвычайных ситуаций
Опасности OSHA
Воздействие на орган-мишень, Токсично при проглатывании, Разъедающее
Органы-мишени, Nal Gastrointract, Hearterves.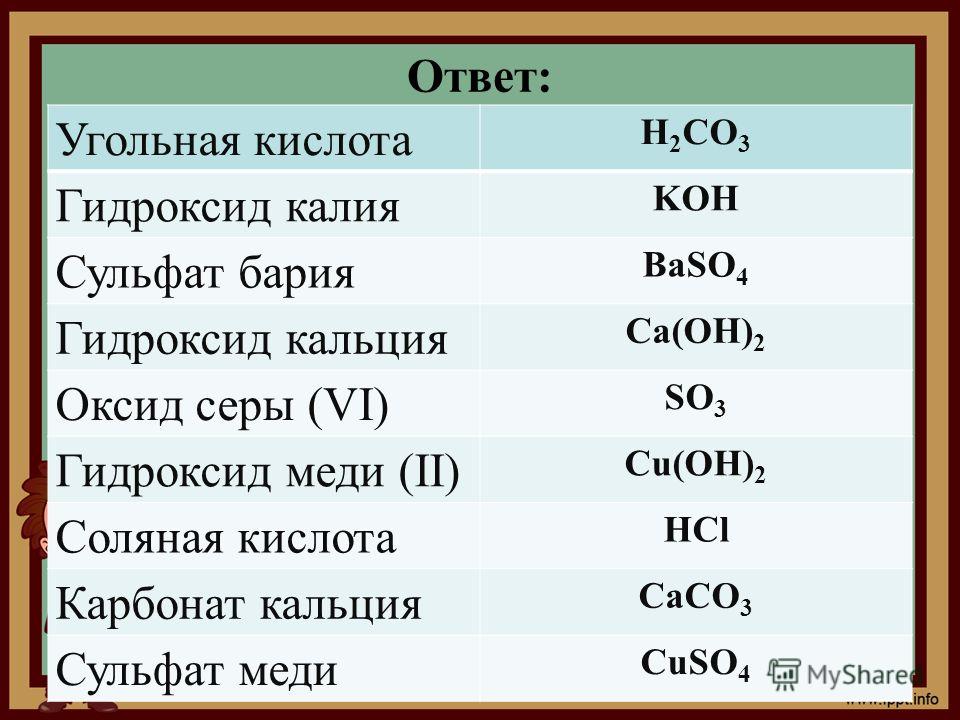 , Костный мозг, Селезенка., Печень
, Костный мозг, Селезенка., Печень
Элементы маркировки СГС, включая меры предосторожности
Пиктограмма
Сигнальное слово Опасно
Краткая характеристика опасности
h402 + h432 Вреден при проглатывании или при вдыхании.
h414 Вызывает серьезные ожоги кожи и повреждения глаз.
Меры предосторожности
P280 Пользоваться защитными перчатками/ защитной одеждой/ средствами защиты глаз/ средствами защиты лица.
P305 + P351 + ПРИ ПОПАДАНИИ В ГЛАЗА: осторожно промывать водой в течение нескольких минут. Снимите контактные линзы, если
P338 присутствует и это легко сделать. Продолжайте полоскать.
P310 Немедленно обратиться в ТОКСИКОЛОГИЧЕСКИЙ ЦЕНТР или к врачу.
Классификация HMIS
Опасность для здоровья: 3
Хроническая опасность для здоровья: *
Воспламеняемость: 0
Физические опасности: 0
Рейтинг NFPA
Опасность для здоровья: 3
Пожар: 0
Опасность реактивности: 0 вдохнул. Материал крайне деструктивен для тканей слизистых оболочек и верхних дыхательных путей.
Кожа Может причинить вред при впитывании через кожу. Вызывает ожоги кожи.
Глаза Вызывает ожоги глаз.
Проглатывание Токсично при проглатывании. Вызывает ожоги.
РАЗДЕЛ 3. СОСТАВ/ИНФОРМАЦИЯ О КОМПОНЕНТАХ
Формула: h3BaO2
Молекулярная масса: 171,34 г/моль
CAS-Номер. EC-№. Индекс-№. Концентрация
Бария гидроксид
17194–00–2 241–234–5 – –
РАЗДЕЛ 4. МЕРЫ ПЕРВОЙ ПОМОЩИ
Общие рекомендации
Обратитесь к врачу. Покажите этот паспорт безопасности лечащему врачу. Покиньте опасную зону.
При вдыхании
При вдыхании вывести пострадавшего на свежий воздух. Если нет дыхания, сделайте искусственное дыхание. Проконсультируйтесь с врачом.
При попадании на кожу
Немедленно снять загрязненную одежду и обувь. Смыть большим количеством воды с мылом. Обратитесь к врачу
.
При попадании в глаза
Продолжать промывать глаза во время транспортировки в больницу. Тщательно промывать большим количеством воды в течение не менее 15 минут
и обратиться к врачу.
При проглатывании
НЕ вызывать рвоту. Никогда не давайте ничего в рот человеку, находящемуся без сознания. Прополоскать рот водой.
Обратитесь к врачу.
РАЗДЕЛ 5. МЕРЫ ПОЖАРОТУШЕНИЯ
Подходящие средства пожаротушения
Используйте распыленную воду, спиртостойкую пену, сухой химикат или двуокись углерода.
Специальное защитное снаряжение для пожарных
При тушении пожара наденьте автономный дыхательный аппарат.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры личной безопасности
Использовать средства индивидуальной защиты. Избегайте образования пыли. Избегайте вдыхания пыли. Обеспечьте достаточную вентиляцию.
Эвакуируйте персонал в безопасные зоны.
Меры предосторожности по охране окружающей среды
Не допускать попадания продукта в канализацию.
Методы и материалы для локализации и очистки
Собрать и организовать утилизацию без образования пыли. Хранить в подходящих закрытых контейнерах для утилизации.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
Меры предосторожности для безопасного обращения
Избегать образования пыли и аэрозолей.
Обеспечьте соответствующую вытяжную вентиляцию в местах образования пыли. Стандартные меры противопожарной защиты
защита.
Условия для безопасного хранения
Хранить контейнер плотно закрытым в сухом и хорошо проветриваемом месте.
Чувствителен к воздуху. Хранить в сухом месте.
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ/ИНДИВИДУАЛЬНАЯ ЗАЩИТА
Компоненты с параметрами контроля на рабочем месте
Средства индивидуальной защиты
Средства защиты органов дыхания респираторные картриджи типа P3 (EN 143) в качестве резервного средства технического контроля. Если респиратор
единственное средство защиты, используйте полнолицевой респиратор с подачей воздуха. Используйте респираторы и компоненты, протестированные и одобренные
в соответствии с соответствующими государственными стандартами, такими как NIOSH (США) или CEN (ЕС).
Защита рук
Ручка в перчатках.
Защита глаз
Маска для лица и защитные очки
Защита кожи и тела
Выберите средства защиты тела в соответствии с количеством и концентрацией опасного вещества на рабочем месте
.
Гигиенические меры
Обращаться в соответствии с правилами промышленной гигиены и техники безопасности. Мойте руки перед перерывами и в
конец рабочего дня.
РАЗДЕЛ 9. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Форма порошка
pH 12,5 при 50 г/л при 20 °C (68 °F)
Температура плавления > 300 °C (> 572 °F) – лит.
Температура кипения нет данных
Температура вспышки неприменимо
Температура воспламенения нет данных
Нижний предел взрываемости нет данных
Верхний предел взрываемости нет данных
Плотность 2,2 г/мл при 25 °C (77 °F) данные доступны
РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Химическая стабильность
Стабилен при соблюдении рекомендуемых условий хранения.
Условия, которых следует избегать
данные отсутствуют
Материалы, которых следует избегать
кислоты, Сильные окислители
Опасные продукты разложения
Опасные продукты разложения, образующиеся в условиях пожара. – Оксид бария
РАЗДЕЛ 11. ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Острая токсичность
LD50 Перорально – крыса – 308 мг/кг
Разъедание/раздражение кожи
Серьезное повреждение/раздражение глаз
данные отсутствуют
Респираторная или кожная сенсибилизация
данные отсутствуют
Мутагенность зародышевых клеток
данные отсутствуют
Канцерогенность
IARC: Ни один компонент этого продукта, присутствующий на уровнях, превышающих или равных 0,1%, не идентифицирован как
вероятный, возможный или подтвержденный IARC канцероген для человека.
ACGIH: Ни один из компонентов этого продукта, присутствующий в концентрациях выше или равных 0,1%, не идентифицирован ACGIH как канцероген
или потенциальный канцероген.
NTP: Ни один из компонентов этого продукта, присутствующий в концентрациях выше или равных 0,1%, не идентифицирован NTP как
известный или ожидаемый канцероген.
OSHA: Ни один из компонентов этого продукта, присутствующий на уровне выше или равном 0,1%, не идентифицирован OSHA как канцероген
или потенциальный канцероген.
Репродуктивная токсичность
данные отсутствуют
Специфическая токсичность для затронутого органа – однократное воздействие (Глобально согласованная система)
данные отсутствуют
Специфическая токсичность для затронутого органа – многократное воздействие (Глобально согласованная система)
данные отсутствуют
Опасность при вдыхании
данные отсутствуют
Потенциальное воздействие на здоровье
Вдыхание Может причинить вред при вдыхании. Материал крайне деструктивен для тканей слизистых оболочек
и верхних дыхательных путей.
Проглатывание Токсично при проглатывании. Вызывает ожоги.
Кожа Может причинить вред при впитывании через кожу. Вызывает ожоги кожи.
Вызывает ожоги кожи.
Глаза Вызывает ожоги глаз.
Признаки и симптомы воздействия
Материал чрезвычайно разрушительно действует на ткани слизистых оболочек и верхних дыхательных путей, глаз и
кожа., Кашель, Затрудненность дыхания, Головная боль, Тошнота
Дополнительная информация
RTECS: CQ9200000
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Токсичность Стойкость и разлагаемость Потенциал биоаккумуляции
нет данных нет данных нет данных данных нет Оценка PBT и vPvB Другие неблагоприятные воздействия
нет данных нет данных нет данных
Может быть вредным для водных организмов из-за изменения рН.
РАЗДЕЛ 13. УТИЛИЗАЦИЯ
Продукт
Соблюдайте все федеральные, региональные и местные экологические нормы. Обратитесь в лицензированную профессиональную службу по утилизации отходов
, чтобы утилизировать этот материал. Растворите или смешайте материал с горючим растворителем и сожгите в химической печи для сжигания отходов
, оборудованной камерой дожигания и скруббером.
Загрязненная упаковка
Утилизировать как неиспользованный продукт.
РАЗДЕЛ 14. ИНФОРМАЦИЯ О ТРАНСПОРТИРОВКЕ
DOT (US)
Номер ООН: 3262 Класс: 8 Группа упаковки: II
Надлежащее отгрузочное наименование: Коррозионное твердое, основное, неорганическое, н.у.к. (гидроксид бария)
Загрязнитель морской среды: №
Опасность отравления при вдыхании: №
IMDG
Номер ООН: 3262 Класс: 8 Группа упаковки: II Номер EMS: F-A, S-B
Надлежащее отгрузочное наименование: КОРРОЗИОННОЕ ТВЕРДОЕ ВЕЩЕСТВО, ОСНОВНОЕ, НЕОРГАНИЧЕСКОЕ, Н.У.К. (гидроксид бария)
Загрязнитель морской среды: №
IATA
Номер ООН: 3262 Класс: 8 Группа упаковки: II
Надлежащее отгрузочное наименование: Коррозионное твердое вещество, основное, неорганическое, н.у.к. (гидроксид бария)
РАЗДЕЛ 15. НОРМАТИВНАЯ ИНФОРМАЦИЯ
Опасности OSHA
Воздействие на орган-мишень, Токсично при проглатывании, Разъедающее
Статус DSL
Все компоненты этого продукта включены в список DSL Канады.
Компоненты SARA 302
SARA 302: никакие химические вещества в этом материале не подпадают под действие требований к отчетности в соответствии с разделом 302 раздела III SARA.
Компоненты SARA 313
Гидроксид бария CAS-Номер.
17194–00–2
SARA 311/312 Опасности
Острая опасность для здоровья, Хроническая опасность для здоровья
Право на информацию о компонентах штата Массачусетс
Никакие компоненты не подпадают под действие Закона штата Массачусетс о праве на информацию.
Pennsylvania Right To Know Components
Гидроксид бария CAS-Номер.
17194–00–2
Нью-Джерси Право знать компоненты
Гидроксид бария CAS-Номер.
17194–00–2
California Prop. 65 Компоненты
Этот продукт не содержит каких-либо химических веществ, известных в штате Калифорния как вызывающие рак, врожденные дефекты или любой другой
вред репродуктивной системе.
РАЗДЕЛ 16. ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (REACH). Приведенная выше информация считается верной, но не претендует на полноту и должна использоваться только в качестве руководства. Информация в этом документе основана на современном уровне наших знаний и применима к продукту с учетом соответствующих мер предосторожности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКОЕ ПРАВО 1997-2022 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Приведенная выше информация считается верной, но не претендует на полноту и должна использоваться только в качестве руководства. Информация в этом документе основана на современном уровне наших знаний и применима к продукту с учетом соответствующих мер предосторожности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКОЕ ПРАВО 1997-2022 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
БАРИЯ ГИДРОКСИД — Ataman Kimya
Номер CAS: 17194-00-2
Номер ЕС: 241-234-5
Молекулярная масса/ Молярная масса: 171,34 г/моль
Химическая формула: Bah3O2
Гидроксид бария также называют баритом с формулой Ba(OH)2.
Гидроксид бария представляет собой прозрачный белый порошок без запаха.
Гидроксид бария ядовит по своей природе.
Гидроксид бария имеет ионную природу, например, Ba(OH)2 (гидроксид бария) в водном растворе может давать два иона гидроксида на молекулу.
Ba(OH)2 в основном используется для производства других бариевых продуктов.
Как эти продукты используются, обсуждается позже.
Гидроксид бария также используется в лабораториях для измерения концентрации слабых кислот.
Этот процесс называется титрованием.
Гидроксид бария также используется для производства стекла, жира или других щелочей.
Гидроксид бария также используется для очистки сточных вод.
Гидроксид бария обычно присутствует в природе, так как гидроксид бария присутствует во многих минералах.
Гидроксид бария является единственным реагентом, описанным для металлизации карбоксамидов. Гидроксид бария был менее разлагающим по сравнению с оксидом бария.
Гидроксид бария используется для обезвоживания и удаления сульфатов из различных продуктов.
Гидроксид бария использует очень низкую растворимость сульфата бария.
Ba(OH)2 также применяется в лабораториях.
Гидроксид бария представляет собой химическое соединение с химической формулой Ba(OH)2(h3O)x.
Моногидрат (x = 1), известный как барит или баритовая вода, является одним из основных соединений бария.
Этот белый гранулированный моногидрат, гидроксид бария, является обычной коммерческой формой.
Гидроксид бария представляет собой химическое соединение с формулой Ba(OH)2.
Белый гранулированный моногидрат является обычной коммерческой формой.
Лабораторное использование гидроксида бария
Гидроксид бария используется в аналитической химии для титрования слабых кислот, особенно органических кислот.
Прозрачный водный раствор гидроксида бария гарантированно не содержит карбоната, в отличие от растворов гидроксида натрия и гидроксида калия, поскольку карбонат бария нерастворим в воде.
Это позволяет использовать такие индикаторы, как фенолфталеин или тимолфталеин (с изменением щелочной окраски) без риска ошибок титрования из-за присутствия карбонат-ионов, которые являются гораздо менее щелочными.
Гидроксид бария иногда используется в органическом синтезе как сильное основание, например, для гидролиза сложных эфиров и нитрилов, а также как основание в альдольных конденсациях.
Существует несколько применений гидроксида бария, например, для гидролиза одной из двух эквивалентных сложноэфирных групп в диметилгендекандиоате.
Гидроксид бария также использовался для декарбоксилирования аминокислот с высвобождением в процессе карбоната бария.
Гидроксид бария также используется при получении циклопентанона, диацетонового спирта и D-гулонового γ-лактона.
Использование гидроксида бария – Ba(OH)2
Гидроксид бария образует сильное едкое основание в водном растворе.
Гидроксид бария имеет множество применений, например, как тест на сульфиды; в пестицидах; в производстве щелочи и стекла.
Использование извести Ba(OH)2 вместо натронной извести, высокая концентрация севофлурана, высокая температура абсорбента и использование свежего абсорбента.
Гидроксид бария используется в производстве щелочей, стекла, присадок к маслам и жирам, бариевых мыл и других соединений бария.
Октагидрат гидрата бария широко используется в качестве закрепителя для штукатурок и настенных росписей.
Гидроксид бария реагирует с углекислым газом, образуя карбонат бария, соль, почти нерастворимую в воде, которая дает консолидирующий эффект.
Кроме того, гидроксид бария реагирует с сульфатом кальция (CaSO4), присутствующим на фресках в виде высолов, с образованием сульфата бария (BaSO4), крайне нерастворимой соли.
Получение и структура гидроксида бария:
Гидроксид бария можно получить растворением оксида бария (BaO) в воде:
BaO + h3O → Ba(OH)2
Гидроксид бария кристаллизуется в виде октагидрата, который при нагревании на воздухе превращается в моногидрат.
При 100 ° C в вакууме моногидрат даст BaO и воду.
Центры Ba2+ имеют квадратную антипризматическую геометрию.
Каждый центр Ва2+ связан двумя водными лигандами и шестью гидроксидными лигандами, которые, соответственно, дважды и трижды связаны с соседними центрами Ва2+.
В октагидрате отдельные центры Ba2+ снова восьмикоординатны, но не имеют общих лигандов.
Ba(OH)2 используется, например:
-добавка в производстве смазок и консистентных смазок
-добавка к термопластичным смолам, вискозе и ПВХ
-производство мыла
-химический синтез прочих солей бария и органических соединений
— сплавление силикатов
Использование гидроксида бария
Гидроксид бария используется для ряда целей, таких как
-В производстве щелочь
-В строительном стекле
-В вулканизации синтетического каучука
-В ингибиторах коррозии
— В качестве буровых растворов, пестицидов и смазочных материалов
-Для средства от накипи
-Для фресковой росписи
-В умягчении воды
-В составе гомеопатических средств
-Для очистки кислотных разливов
-Гидроокись бария также используется в сахарной промышленности для получения свекловичного сахара.

Каково применение гидроксида бария?
В промышленности гидроксид бария используется в качестве предшественника нескольких других соединений бария.
Моногидрат этого соединения широко используется для обезвоживания и извлечения сульфата из различных продуктов.
В этом приложении используется очень низкая растворимость сульфата бария.
Как получают гидроксид бария?
Гидроксид бария обычно получают растворением оксида бария (химическая формула: BaO) в воде.
Химическое уравнение этой реакции приведено ниже.
BaO + 9h3O → Ba(OH)2·8h3O
Номер CAS:
17194-00-2
22326-55-2 (моногидрат)
12230-71-6 (октагидрат)
ЧЕБИ:32592
ChemSpider: 26408
Информационная карта ECHA: 100.037.470
Номер ЕС: 241-234-5
Гмелин Ссылка: 846955
Идентификационный номер PubChem: 28387
Номер RTECS: CQ9200000
УНИИ: 1OHB71MYBK
P27GID97XM: (моногидрат)
L5Q5V03TBN: (октагидрат)
Информационная панель CompTox (EPA): DTXSID10892155
Определение гидроксида бария:
Гидроксид бария представляет собой белое гранулированное соединение.
Гидроксид бария состоит из оксида бария и воды.
Гидроксид бария в основном используется для производства других продуктов бария.
Гидроксид бария имеет химическую формулу Ba(OH)₂ₓ.
Однако в коммерческой сфере белый гранулированный моногидрат бария используется для многих целей.
Химическая структура гидроксида бария
Химическая формула оксида бария: Ba(OH)₂.
Химическая формула гидроксида бария интересна.
Как видно из названия, гидроксид бария состоит из бария и гидроксида.
Итак, логически говоря, формула должна быть Ba(OH).
Тогда почему мы пишем Ba(OH)₂ как формулу гидроксида бария?
Это связано с тем, что барий имеет два положительных иона, а гидроксид — один отрицательный.
Итак, чтобы показать барий как нейтральное соединение, мы добавляем еще один гидроксид к гидроксиду бария и делаем гидроксид бария нейтральным.
Свойства гидроксида бария
Чтобы найти молярную массу гидроксида бария, нам нужно добавить молярные массы элементов, из которых состоит это соединение.
Молярная масса или молекулярная масса бария составляет 137,33.
В соединении есть только один барий.
Молярная масса водорода 1,008.
В соединении два атома водорода.
Таким образом, общая молярная масса двух объединенных атомов водорода составляет 2,016.
Молярная масса кислорода 15,999.
Есть два кислорода, и, следовательно, общая молярная масса двух атомов кислорода вместе составляет 31,998.
Теперь, если мы сложим эти числа, мы получим 171.344.
Таким образом, молярная масса гидроксида бария составляет 171,344 г/моль.
Оксид бария: сильное основание
Основание — это химические вещества, которые реагируют с водой с выделением ионов гидроксида.
Сильное основание — это такое основание, которое может полностью диссоциировать в воде с выделением точного количества анионов и катионов, которое было у элементов в нерасщепленном основании.
Точка кипения
Гидроксид бария кипит при 780 градусах Цельсия.
Если вы продолжите кипятить и температура достигнет 800 градусов по Цельсию, гидроксид бария разложится и выделит оксид бария.
Другие свойства гидроксида бария
Гидроксид бария имеет белый цвет.
Гидроксид бария обычно выглядит как гранулированное твердое вещество.
Гидроксид бария не имеет запаха.
pH гидроксида бария составляет 11,27
.
Плотность моногидратной формы гидроксида бария составляет 3,74 г/см3.
А плотность октагидратной формы составляет 2,18 г/куб.см.
Реакции
Ba(OH)2 разлагается до оксида бария при нагревании до 800 °C.
Реакция гидроксида бария с углекислым газом дает карбонат бария.
Водный раствор гидроксида бария, будучи сильно щелочным, вступает в реакции нейтрализации кислотами, так как является сильным основанием.
Гидроксид бария особенно полезен в реакциях, требующих титрования слабых органических кислот.
Таким образом, гидроксид бария образует сульфат бария и фосфат бария с серной и фосфорной кислотами соответственно.
Реакция с сероводородом дает сульфид бария.
Осаждение многих нерастворимых или малорастворимых солей бария может происходить в результате реакции двойного замещения, когда водный раствор гидроксида бария смешивают со многими растворами других солей металлов.
Реакции гидроксида бария с солями аммония сильно эндотермичны.
Реакция октагидрата гидроксида бария с хлоридом аммония или тиоцианатом аммония часто используется в качестве демонстрации химии в классе, создавая температуры, достаточно низкие, чтобы заморозить воду, и достаточное количество воды, чтобы растворить полученную смесь.
Формула соединения: Bah3O2
Молекулярный вес: 171,36
Внешний вид: порошок от белого до почти белого цвета, кристаллы или кристаллический порошок
Температура плавления: 78°C (172,4°F)
Точка кипения: 780°C (1436°F)
Плотность: 3,74 г/см3
Масса моноизотопа: 171,910721
Ba(OH)2 представляет собой кристаллический источник бария с высокой нерастворимостью в воде для использования в средах с более высоким (базовым) pH.
Гидроксид, анион ОН-, состоящий из атома кислорода, связанного с атомом водорода, обычно присутствует в природе и является одной из наиболее широко изучаемых молекул в физической химии.
Гидроксидные соединения имеют разнообразные свойства и применение: от основного катализа до обнаружения диоксида углерода.
В 2013 году ученые из JILA (Объединенный институт лабораторной астрофизики) впервые добились испарительного охлаждения соединений с помощью молекул гидроксида. Это открытие может привести к новым методам управления химическими реакциями и может повлиять на целый ряд дисциплин. включая науку об атмосфере и технологии производства энергии.
Гидроксид бария обычно сразу же доступен в большинстве объемов.
Композиции сверхвысокой чистоты и высокой чистоты улучшают как оптическое качество, так и применимость в качестве научных стандартов.
Гидроксид бария образует щелочной раствор в воде («баритовая вода»), который можно использовать для титрования слабых кислот, поскольку чистый водный раствор гидроксида бария гарантированно не содержит карбоната (карбонат бария нерастворим в воде).
Растворим ли гидроксид бария в воде?
Растворимость гидроксида бария в воде умеренная.
Однако это соединение нерастворимо в ацетоне.
При комнатной температуре гидроксид бария может образовывать раствор.
Установлено, что раствор гидроксида бария имеет приблизительную концентрацию 0,1 моль дм-3.
Химическая формула: Ba(OH)2
Молярная масса:
171,34 г/моль (безводный)
189,355 г/моль (моногидрат)
315,46 г/моль (октагидрат)
Внешний вид: белое твердое вещество
Плотность:
3,743 г/см3 (моногидрат)
2,18 г/см3 (октагидрат, 16 °C)
Температура плавления:
78 ° C (172 ° F, 351 K) (октагидрат)
300 °C (моногидрат)
407 °C (безводный)
Температура кипения: 780 °C (1440 °F, 1050 K)
Физические свойства гидроксида бария:
Гидроксид бария представляет собой твердое вещество белого цвета без запаха.
Гидроксид бария имеет плотность 3,743 г мл-1 (в форме моногидрата) и 2,18 г мл-1 (в форме октагидрата).
Температура плавления составляет 78 ºC (в форме октагидрата), 300 ºC (в форме моногидрата) и 407 ºC (в безводной форме).
Температура кипения составляет около 780 ºC.
Все 3 формы мало растворимы в воде при низких температурах, но растворимость в воде увеличивается с повышением температуры.
Химические свойства гидроксида бария:
Гидроксид бария образует щелочные растворы, когда мы растворяем гидроксид бария в воде из-за высвобождения гидроксильных анионов.
Гидроксид бария полезен для получения солей бария, поскольку гидроксид бария может реагировать с серной, фосфорной и другими кислотами с образованием соответствующих солей, таких как фосфат бария и т. д.
Использование гидроксида бария:
Гидроксид бария способен использовать гидроксид бария в качестве источника бария для производства других солей бария, таких как фосфат бария, сульфид бария и сульфат бария, которые мы используем в химической промышленности в различных процессах.
Кроме того, мы также можем использовать гидроксид бария в качестве аналитического стандарта для титрования слабых кислот из-за щелочных свойств гидроксидов бария.
Лабораторное использование гидроксида бария:
Гидроксид бария используется в аналитической химии, особенно для органических кислот.
Однако чистый водный раствор гидроксида бария должен быть свободен от карбоната, в отличие от гидроксида натрия и гидроксида калия, поскольку карбонат бария не растворяется в воде.
Это позволяет использовать такие индикаторы, как фенолфталеин или тимолфталеин (с изменением щелочной окраски), без риска ошибок титрования из-за присутствия ионов карбоната, которые являются очень менее щелочными.
Гидроксид Бария, предлагаемый нами, используется в химической промышленности, машиностроении и металлообработке.
В химической промышленности гидроксид бария используется для производства соли бария.
Гидроксид бария используется для изготовления солей для термообработки; Гидроксид бария также используется для обработки котловой воды и электролиза сульфатных солей.
Ba(OH)2 используется для изготовления пигментов, керамических изделий для предотвращения выцветания.
Гидроксид бария также используется в текстильной и кожевенной промышленности в качестве протравы и искусственного матирования, а также в электронной промышленности.
Гидроксид бария представляет собой химическое соединение с формулой Ba(OH)2.
Гидроксид бария, также известный как барит или баритовая вода, является одним из основных соединений бария.
Растворимость в воде, масса BaO (не Ba(OH)2):
1,67 г/100 мл (0 °C)
3,89 г/100 мл (20 °C)
4,68 г/100 мл (25°С)
5,59 г/100 мл (30 °С)
8,22 г/100 мл (40 °С)
11,7 г/100 мл (50 °C)
20,94 г/100 мл (60 °С)
101,4 г/100 мл (100 °C)
Растворимость в других растворителях: низкая
Основность (pKb): 0,15 (первый OH–), 0,64 (второй OH–)
Магнитная восприимчивость (χ): −53,2·10–6 см3/моль
Показатель преломления (nD): 1,50 (октагидрат)
Гидроксид бария имеет молекулярную формулу Ba(OH)2 и молекулярную массу 121,6324 г/моль.
Гидроксид бария встречается в виде ангидрида, призматические бесцветные кристаллы которого очень расплываются.
Стандартная свободная энергия образования определяется уравнением ΔGr° = 49,400 – 16,6 Тл (кал/моль) в современном диапазоне температур.
Из термодинамического цикла было установлено, что энергия связи между барием и двумя гидроксильными группами составляет 196,8 ккал/моль.
Лучший метод приготовления включает добавление NaOH к нитрату.
Поскольку гидроксид бария достаточно растворим, гидроксид бария необходим для выпаривания раствора для кристаллизации Ba(OH)2·8h3O.
Этанол добавляют, чтобы помочь в этой кристаллизации.
Кристаллы промывают холодным этанолом для удаления ионов натрия и затем сушат.
Октагидрат гидроксида бария образует кристаллические осадки, растворимость которых не изменяется при старении и растворимость которых в воде увеличивается с повышением температуры.
При нагревании октагидрат разлагается на моногидрат при температуре около 78 °C и на ангидрид при температуре около 375 °C.
Исследована термическая дегидратация кристаллического октагидрата гидроксида бария.
Октагидрат сначала растворяется в собственных водах гидратации гидроксидов бария (78 °C), а затем теряет четыре воды с образованием тригидрата при температуре около 125 °C.
Тригидрат нестабилен, и именно моногидрат получают при 180°С.
Постепенная термическая обработка на воздухе приводит к образованию безводного гидроксида бария при 375 °С.
Оксид бария образуется при температуре около 410°С в инертной атмосфере.
Гидроксид превращается непосредственно в пероксид в диапазоне температур 400–600 °С.
Применение гидроксида бария:
Реагент, используемый при влажной химической конверсии геля в кристаллит с образованием BaTiO3 при низких температурах.
Получение гидроксида бария:
Гидроксид бария можно получить растворением оксида бария (BaO) в воде.
BaO + 9h3O → Ba(OH)2·8h3O
Гидроксид бария кристаллизуется в виде октагидрата, который при нагревании на воздухе превращается в моногидрат.
При 100 °C в вакууме моногидрат дает BaO.
Использование гидроксида бария:
Гидроксид бария используется в аналитической химии для титрования слабых кислот, особенно органических кислот.
Прозрачный водный раствор гидроксида бария гарантированно не содержит карбоната, в отличие от растворов гидроксида натрия и гидроксида калия, поскольку карбонат бария нерастворим в воде.
Это позволяет использовать такие индикаторы, как фенолфталеин или тимолфталеин (с изменением щелочной окраски) без риска ошибок титрования из-за наличия слабоосновных карбонат-ионов.
Гидроксид бария используется в органическом синтезе как сильное основание, например для гидролиза сложных эфиров и нитрилов.
Гидроксид бария использовался для гидролиза одной из двух эквивалентных сложноэфирных групп в диметилгендекандиоате.
Гидроксид бария также используется при получении циклопентанона, диацетонового спирта и D-гулонового γ-лактона.
Гидроксид бария используется для демонстрации эндотермических реакций, поскольку при смешивании с солью аммония реакция становится холодной, поскольку тепло поглощается из окружающей среды.
Различные применения гидроксида бария:
Под названием барита гидроксид бария используется в гомеопатических средствах.
Гидроксид бария также используется для очистки разливов кислоты.
Также под названием барита гидроксид бария используется в производстве фотобумаги для печати.
марка: техническая марка
Уровень качества: 100
анализ: ~95%
форма: порошок
т.пл.: >300 °C (лит.)
плотность: 2,2 г/мл при 25 °C (лит.)
Строка SMILES: O[Ba]O
ИнЧИ: 1С/Ва.2х3О/ч;2*1х3/q+2;;/р-2
Ключ ИнЧИ: RQPZNWPYLFFXCP-UHFFFAOYSA-L
Мы также знаем гидроксид бария как «барит» с формулой, т. е. Ba(OH)2.
Гидроксид бария представляет собой порошок кристально белого цвета без запаха.
Более того, гидроксид бария очень ядовит по своей природе из-за некоторых своих опасных характеристик.
Гидроксид бария имеет ионную природу, например, Ba(OH)2(гидроксид бария) в водном растворе может давать 2 иона гидроксида на молекулу.
Однако гидроксид бария является единственным описанным нами реагентом для металлизации карбоксамидов.
Кроме того, гидроксид бария менее подвержен разложению, чем оксид бария.
Давайте посмотрим на формулу гидроксида бария ниже.
Что такое гидроксид бария?
Гидроксид бария представляет собой химическое соединение с формулой Ba(OH)2.
Гидроксид бария можно получить растворением оксида бария (BaO) в воде:
BaO + 9h3O → Ba(OH)2·8h3O
Гидроксид бария кристаллизуется в виде октагидрата, который при нагревании на воздухе превращается в моногидрат.
Оба сорта часто используются в стабилизаторах / смазках ПВХ, а также в качестве превосходных термостабилизаторов.
Формула и структура гидроксида бария:
Гидроксид бария имеет химическую формулу Ba(OH)2.
Гидроксид бария может быть трех типов: безводный, моногидрат и октагидрат с молекулярной массой 171,34 г моль-1, 189,955 и 315,46 г моль-1 соответственно.
Структура соединения образована 2 гидроксильными анионами (OH–) и 1 катионом бария (Ba2+).
