ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ
Свойства щелочноземельных металлов
Физические свойства
Щелочноземельные металлы (по сравнению со щелочными металлами) обладают более высокими t╟пл. и t╟кип., потенциалами ионизации, плотностями и твердостью.
Химические свойства
1. Очень реакционноспособны.
2. Обладают положительной валентностью +2.
3. Реагируют с водой при комнатной температуре (кроме Be) с выделением водорода.
4. Обладают большим сродством к кислороду (восстановители).
5. С водородом образуют солеобразные гидриды ЭH2.
6. Оксиды имеют общую формулу ЭО. Тенденция к образованию пероксидов выражена слабее, чем для щелочных металлов.
Нахождение в природе
Be
3BeO ∙ Al2O3 ∙ 6SiO2 берилл
Mg
MgCO3 магнезит
CaCO3 ∙ MgCO3 доломит
KCl ∙ MgSO4 ∙ 3H2O каинит
KCl
∙ MgCl2 ∙ 6H
Ca
CaCO3 кальцит (известняк, мрамор и др. )
)
Ca3(PO4)2 апатит, фосфорит
CaSO4 ∙ 2H2O гипс
CaSO4 ангидрит
CaF2 плавиковый шпат (флюорит)
Sr
SrSO4 целестин
SrCO3 стронцианит
Ba
BaSO4 барит
BaCO3 витерит
Получение
Бериллий получают восстановлением фторида:
BeF2 + Mg═ t═ Be + MgF2
Барий получают восстановлением оксида:
3BaO + 2Al═ t═ 3Ba + Al2O3
Остальные металлы получают электролизом расплавов хлоридов:
CaCl2 = Ca + Cl2╜
катод: Ca2+ + 2ē = Ca0
анод: 2Cl— — 2ē = Cl02
MgO + C = Mg + CO
Металлы главной
подгруппы II
группы — сильные восстановители; в
соединениях проявляют только степень
окисления +2. Активность металлов и их
восстановительная способность
увеличивается в ряду: Be
Mg
Ca
Sr
Ba╝
Активность металлов и их
восстановительная способность
увеличивается в ряду: Be
Mg
Ca
Sr
Ba╝
1. Реакция с водой.
В обычных условиях поверхность Be и Mg покрыты инертной оксидной пленкой, поэтому они устойчивы по отношению к воде. В отличие от них Ca, Sr и Ba растворяются в воде с образованием гидроксидов, которые являются сильными основаниями:
Mg + 2H2O═ t═ Mg(OH)2 + H2
Ca + 2H2O = Ca(OH)2 + H2╜
2. Реакция с кислородом.
Все металлы образуют оксиды RO, барий-пероксид BaO2:
2Mg + O2 = 2MgO
3. С другими неметаллами образуются бинарные соединения:
Be + Cl2 = BeCl2 (галогениды)
Ba + S = BaS (сульфиды)
3Mg + N2 = Mg3N2 (нитриды)
Ca + H2 = CaH2(гидриды)
Ca + 2C = CaC2(карбиды)
3Ba + 2P = Ba3P2(фосфиды)
Бериллий и магний
сравнительно медленно реагируют с
неметаллами.
4. Все металлы растворяются в кислотах:
Ca + 2HCl = CaCl2 + H2╜
Mg + H2SO4(разб.) = MgSO4 + H2╜
Бериллий также растворяется в водных растворах щелочей:
Be + 2NaOH + 2H2O = Na2
[Be(OH)4] + H2╜5. Качественная реакция на катионы щелочноземельных металлов — окрашивание пламени в следующие цвета:
Ca2+ — темно-оранжевый
Sr2+— темно-красный
Ba2+ — светло-зеленый
Катион Ba2+ обычно открывают обменной реакцией с серной кислотой или ее солями:
Сульфат бария — белый осадок, нерастворимый в минеральных кислотах.
Оксиды щелочноземельных металлов
Получение
1) Окисление металлов (кроме Ba, который образует пероксид)
2) Термическое разложение нитратов или карбонатов
CaCO3═ t═ CaO + CO2╜
2Mg(NO3)2═ t═ 2MgO + 4NO2╜ + O2╜
Химические свойства
Типичные основные
оксиды.
MgO + H2O = Mg(OH)2
3CaO + P2O5 = Ca3(PO4)2
BeO + 2HNO3 = Be(NO3)2 + H2O
BeO — амфотерный оксид, растворяется в щелочах:
BeO + 2NaOH + H2O = Na2[Be(OH)4]
Гидроксиды щелочноземельных металлов R(OH)
2Получение
Реакции щелочноземельных металлов или их оксидов с водой: Ba + 2H2O = Ba(OH)2 + H2
CaO(негашеная известь) + H2O = Ca(OH)2(гашеная известь)
Химические свойства
Гидроксиды R(OH)2 — белые кристаллические вещества, в воде
растворимы хуже, чем гидроксиды щелочных
металлов (растворимость гидроксидов
уменьшается с уменьшением порядкового
номера; Be(OH) 2 — нерастворим в воде, растворяется в
щелочах). Основность R(OH)2 увеличивается с увеличением атомного
номера:
Основность R(OH)2 увеличивается с увеличением атомного
номера:
Be(OH)2 — амфотерный гидроксид
Mg(OH)2 — слабое основание
остальные гидроксиды — сильные основания (щелочи).
1) Реакции с кислотными оксидами:
Ca(OH)2 + SO2 = CaSO3¯ + H2O
Ba(OH)2 + CO2 = BaCO3¯ + H2O
2) Реакции с кислотами:
Mg(OH)2 + 2CH3COOH = (CH3COO)2Mg + 2H2O
Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
3) Реакции обмена с солями:
4) Реакция гидроксида бериллия со щелочами:
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
Жесткость воды
Природная вода,
содержащая ионы Ca2+ и Mg2+,
называется жесткой. Жесткая вода при
кипячении образует накипь, в ней не
развариваются пищевые продукты; моющие
средства не дают пены.
Жесткая вода при
кипячении образует накипь, в ней не
развариваются пищевые продукты; моющие
средства не дают пены.
Карбонатная (временная) жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния, некарбонатная (постоянная) жесткость — хлоридов и сульфатов.
Общая жесткость воды рассматривается как сумма карбонатной и некарбонатной.
Удаление жесткости воды осуществляется путем осаждения из раствора ионов Ca2+ и Mg2+:
1) кипячением:
Сa(HCO3)2═ t
═ CaCO3¯ + CO2 + H2OMg(HCO3)2═ t═ MgCO3¯ + CO2 + H2O
2) добавлением известкового молока:
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3¯ + 2H2O
3) добавлением соды:
Ca(HCO3)2 + Na2CO3 = CaCO3¯+ 2NaHCO3
CaSO4 + Na2CO3 = CaCO3¯ + Na2SO4
MgCl2 + Na2CO3 = MgCO3¯ + 2NaCl
Для удаления
временной жесткости используют все
четыре способа, а для постоянной — только
два последних.
Термическое разложение нитратов.
Э(NO3)2 =t= ЭO + 2NO2 + 1/2O2
Особенности химиии берилия.
Be(OH)2 + 2NaOH (изб) = Na2[Be(OH)4]
Al(OH)3 + 3NaOH (изб) = Na3[Al(OH)6]
Be + 2NaOH + 2h3O = Na2[Be(OH)4] + h3
Al + 3NaOH + 3h3O = Na3[Be(OH)4] + 3/2h3
Be, Al + HNO3 (Конц) = пассивация
химия для детей: элементы — щелочноземельные металлы
химия для детей: элементы — щелочноземельные металлыГлавная Дети Элементы — щелочноземельные металлы
Щелочноземельные металлы представляют собой группу элементов в периодическая таблица . Все они находятся во втором столбце периодической таблицы. Иногда их называют элементами группы 2.
Какие элементы являются щелочноземельными металлами?
К элементам щелочноземельных металлов относятся: бериллий , магний , кальций , стронций, барий и радий .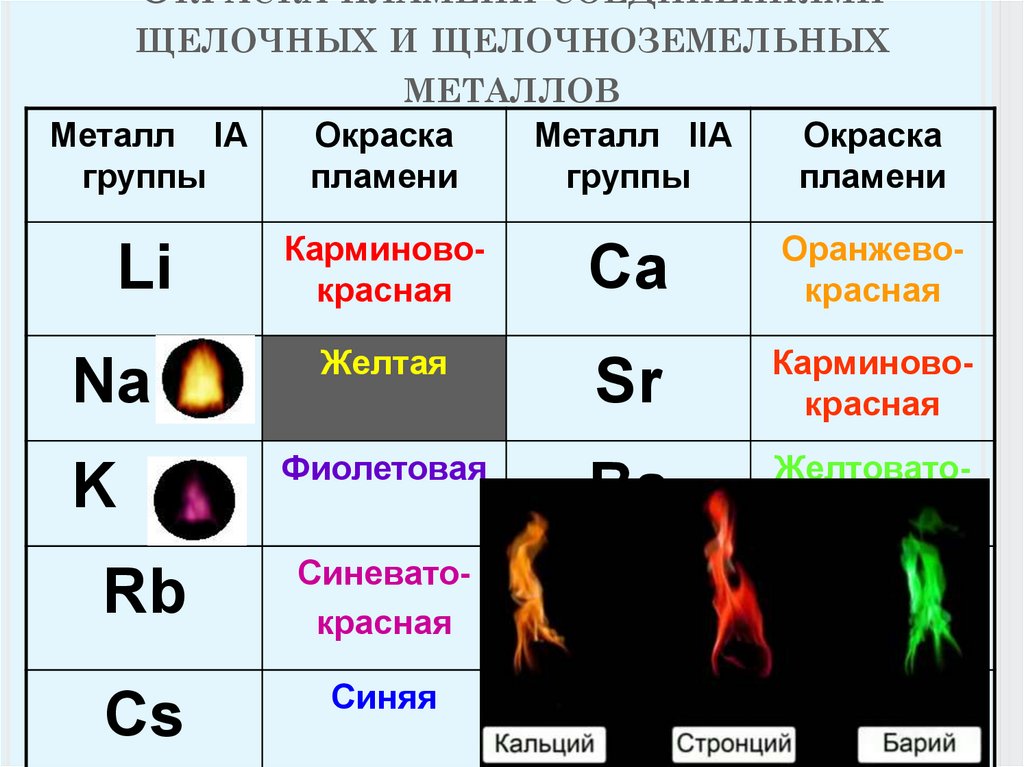
Каковы схожие свойства щелочноземельных металлов?
Щелочноземельные металлы обладают многими схожими свойствами, в том числе:
- Это серебристые, блестящие и относительно мягкие металлы.
- В стандартных условиях они довольно реактивны.
- У них есть два внешних валентных электрона, которые они легко теряют.
- Все они встречаются в природе, но встречаются только в соединениях и минералах, а не в их элементарных формах.
- Они реагируют с галогенами с образованием соединений, называемых галогенидами.
- Все они, кроме бериллия, сильно реагируют с водой.
- Они имеют тенденцию образовывать ионные связи, за исключением бериллия, который образует ковалентные связи.
Орден изобилия
Самым распространенным из щелочноземельных металлов на Земле является кальций, который является пятым по распространенности элементом в земной коре.
- Кальций
- Магний
- Барий
- Стронций
- Бериллий
- Радий
Интересные факты о щелочноземельных металлах
- Они горят пламенем разного цвета: бериллий (белый), магний (ярко-белый), кальций (красный), стронций (малиновый), барий (зеленый) и радий (красный).
- Название «щелочноземельные земли» происходит от старого названия оксидов элементов. Их называют щелочными, потому что они образуют растворы с pH более 7, что делает их щелочными или «щелочными».
- Радий образуется при распаде урана. Он очень радиоактивен и с ним опасно обращаться.
- Кальций и магний важны для жизни животных и растений. Кальций играет важную роль в укреплении костей, а магний используется для регулирования температуры тела.
- Английский химик сэр Хамфри Дэви был первым, кто выделил многие щелочноземельные металлы, включая кальций, стронций, магний и барий.
- Радий открыли ученые Мари и Пьер Кюри .

- Радий, барий и стронций имеют мало промышленных применений, в то время как магний и кальций находят множество применений в производстве и промышленности.
Подробнее об элементах и периодической таблице
Элементы
Периодическая таблица
| Щелочных металлов Литий Натрий Калий Щелочноземельные металлы Переходные металлы | Постпереходные металлы Алюминий Галлий Полагать Вести Металлоиды Неметаллы | Галогены Фтор Хлор Йод Благородные газы Лантаноиды и актиниды |
Другие предметы химии
| Иметь значение Атом Молекулы Изотопы Твердые вещества, жидкости, газы Плавление и кипячение Химическая связь Химические реакции Радиоактивность и радиация | Смеси и Компаунды Именование соединений Смеси Разделение смесей Решения Кислоты и основания Кристаллы Металлы Соли и мыло Воды | Другой Глоссарий и термины Химическое лабораторное оборудование Органическая химия Известные химики |
- сколько там команд нхл
- Тайвань расположен у побережья
- как Массачусетс стал штатом
- какая из следующих наций стала одним из первых лидеров европейских исследований?
Суринам
Искусство романтизма для детей
Аббасидский халифат
Швеция
Аль Капоне для детей
Тутанхамон
Основы игры на фортепиано
Королева Елизавета II — Основные события в период правления и интересные факты
Миртл-Бич, Южная Каролина
Исторические куклы
Щелочноземельный металл | Elements Wiki
щелочноземельных металла — это группа химических элементов в периодической таблице с очень похожими свойствами.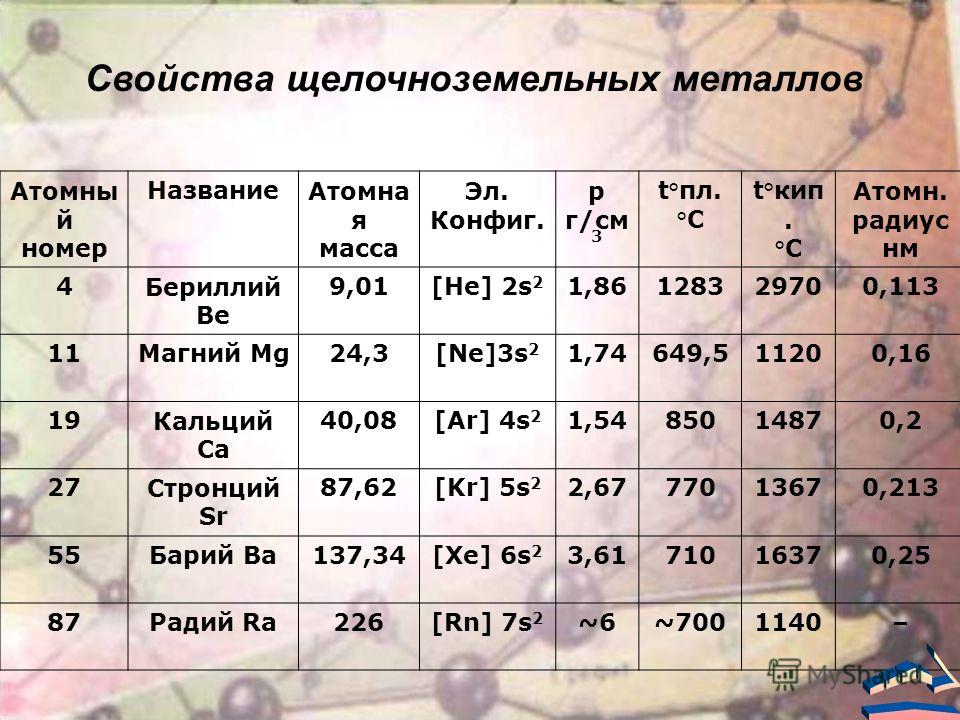 Они характеризуются наличием двух электронов вне ядра из инертного благородного газа: [NG] ns 2 . Эти два слабо связанных электрона определяют химический состав щелочных земель. Все они представляют собой блестящие, серебристо-белые химически активные металлы при стандартной температуре и давлении и легко теряют два своих крайних электрона с образованием катионов с зарядом 2+ и степенью окисления или степенью окисления +2. В современной номенклатуре IUPAC щелочноземельные металлы включают группа 2 элементы .
Они характеризуются наличием двух электронов вне ядра из инертного благородного газа: [NG] ns 2 . Эти два слабо связанных электрона определяют химический состав щелочных земель. Все они представляют собой блестящие, серебристо-белые химически активные металлы при стандартной температуре и давлении и легко теряют два своих крайних электрона с образованием катионов с зарядом 2+ и степенью окисления или степенью окисления +2. В современной номенклатуре IUPAC щелочноземельные металлы включают группа 2 элементы .
Щелочноземельные металлы – это бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эта группа находится в s-блоке периодической таблицы. Все, кроме Ра, довольно распространены как на Земле, так и в более широкой Вселенной. На самом деле мантия Земли в значительной степени образована минералами, представляющими собой комплексы MgO и SiO2. Вероятно, это относится ко всем планетам земной группы и к ядрам планет-гигантов, которые слишком малы, чтобы иметь вырожденные ядра.
Все обнаруженные щелочноземельные металлы встречаются в природе. В настоящее время проводятся эксперименты по синтезу элемента 120, который считается следующим щелочноземельным металлом. Ubn сам по себе, вероятно, имеет самый высокий Z среди всех элементов, которые можно назвать «щелочноземельными» металлами. После периода 8 различия в свойствах между группами станут небольшими. Характерный химический состав металлов 2-й группы, вероятно, исчезнет, превратившись в сплошное месиво активных металлов, свойства которых не сильно меняются от элемента к элементу.
Элементы щелочноземельные металлы 120-???: Unbinilium, Bibioctium…
| Периодическая таблица элементов с 9 периодами | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | 1 Н | 2 Он | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2 | 3 Ли | 4 Be | 5 Б | 6 С | 7 Н | 8 О | 9 Ф | 10 Не | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | 11 Нет данных | 12 мг | 13 Ал | 14 Si | 15 Р | 16 С | 17 Класс | 18 Ар | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | 19 К | 20 Ка | 21 Sc | 22 Ти | 23 В | 24 Кр | 25 Мн | 26 Fe | 27 Ко | 28 Никель | 29 Медь | 30 Цинк | 31 Га | 32 Ге | 33 Как | 34 Se | 35 Бр | 36 Кр | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 | 37 руб. 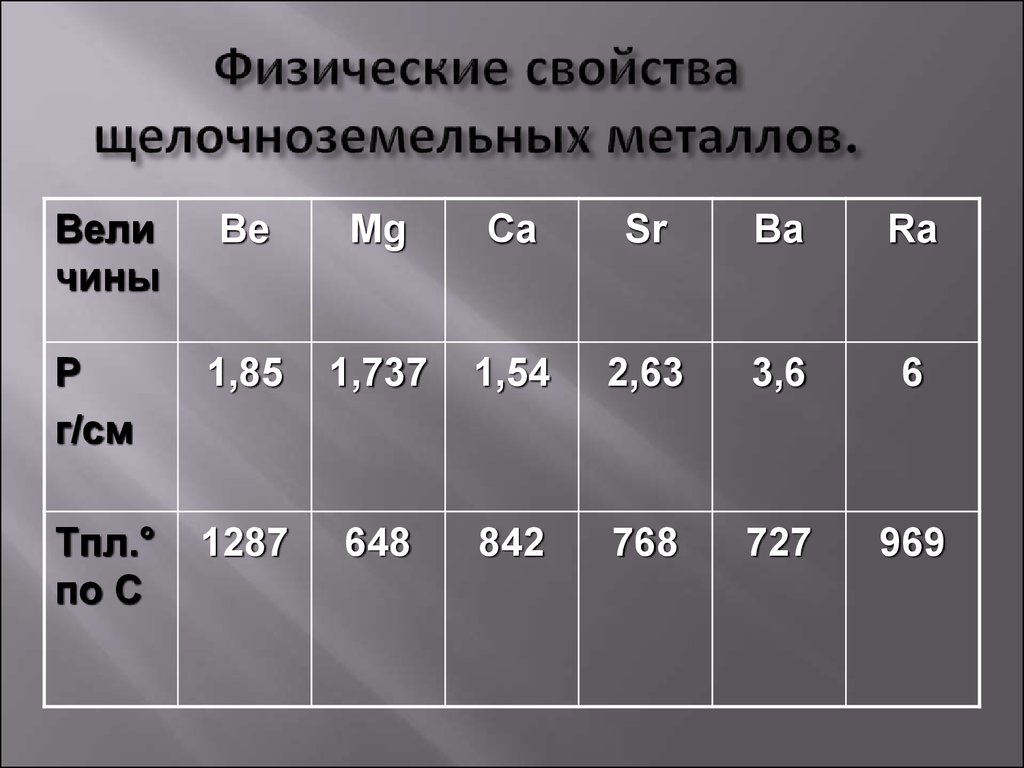 | 38 Старший | 39 Д | 40 Зр | 41 № | 42 Пн | 43 Тк | 44 Ру | 45 Правая | 46 Pd | 47 Аг | 48 CD | 49 В | 50 Сн | 51 Сб | 52 Те | 53 я | 54 Хе | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 | 55 Cs | 56 Ба | 57 Ла | 58 Се | 59 Пр | 60 Нд | 61 Вечер | 62 См | 63 ЕС | 64 гд | 65 Тб | 66 Дай | 67 Хо | 68 Er | 69 Тм | 70 Ыб | 71 Лу | 72 Хф | 73 Та | 74 Ш | 75 Re | 76 ОС | 77 Ир | 78 Пт | 79 Золото | 80 рт.  ст. ст. | 81 Тл | 82 Pb | 83 Би | 84 ПО | 85 В | 86 Рн | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7 | 87 Пт | 88 Ра | 89 Ас | 90 | 91 Па | 92 У | 93 № | 94 Полиуретан | 95 Ам | 96 См | 97 Бк | 98 См. | 99 Эс | 100 ФМ | 101 Мд | 102 № | 103 Лр | 104 РФ | 105 Дб | 106 Сг | 107 Бх | 108 Гс | 109 Мт | 110 Дс | 111 Рг | 112 Спец. 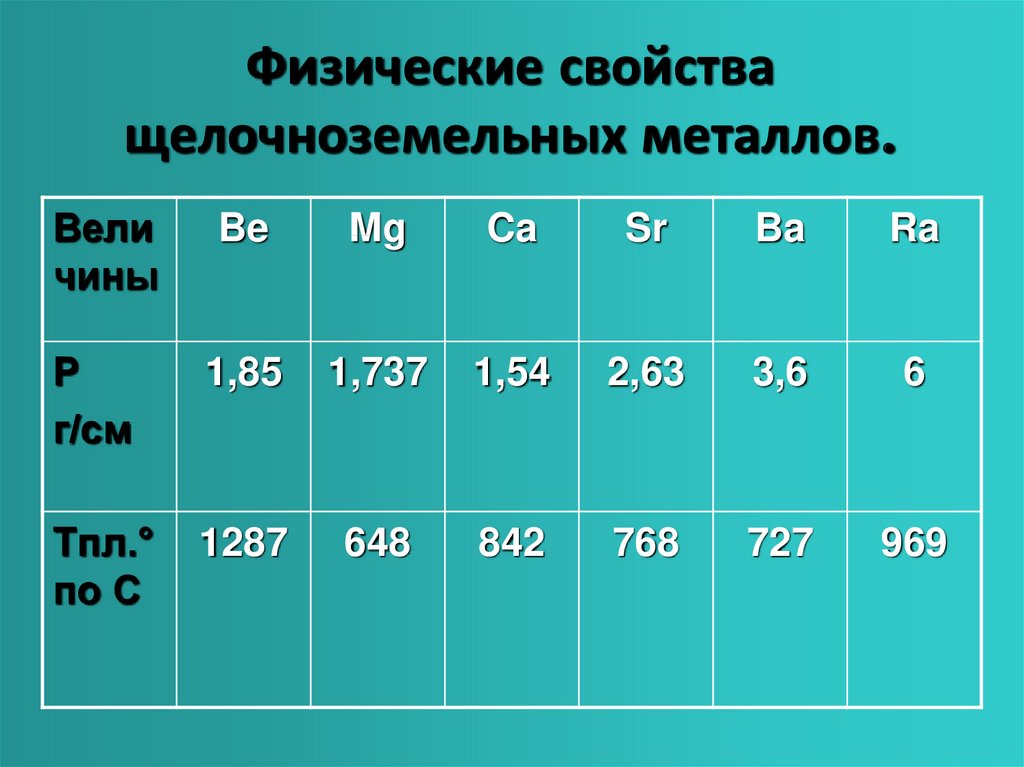 | 113 Нх | 114 Фл | 115 Мк | 116 ур. | 117 Ц | 118 Ог | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8 | 119 Ууэ | 120 Убн | 121 Убу | 122 Убб | 123 Убт | 124 Убк | 125 Убп | 126 Убх | 127 Убс | 128 Убо | 129 Убе | 130 Утн | 131 Уту | 132 Утб | 133 Ютт | 134 Утк | 135 Утп | 136 Ут | 137 Утс | 138 До | 139 Юте | 140 Uqn | 141 Uqu | 142 Укб | 143 кв. 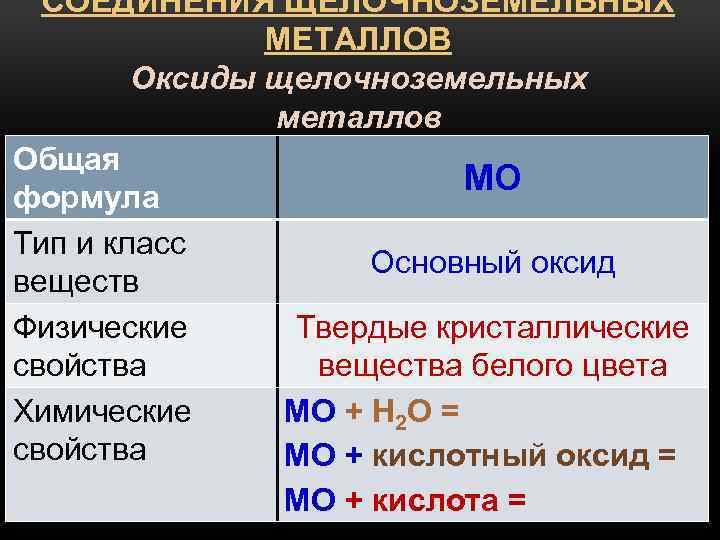 | 144 Укв | 145 УКП | 146 Uqh | 147 Укс | 148 Уко | 149 Уке | 150 До | 151 Упу | 152 Убб | 153 До | 154 Upq | 155 Упп | 156 Вверх | 157 ИБП | 158 Упо | 159 Упе | 160 Ун | 161 Уху | 162 Ухб | 163 Ут | 164 Uhq | 165 Uhp | 166 Ухх | 167 Uhs | 168 Ухо | 169 Ухе | 170 Усн | 171 Усу | 172 USB | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9 | 173 Усть | 174 Укв. 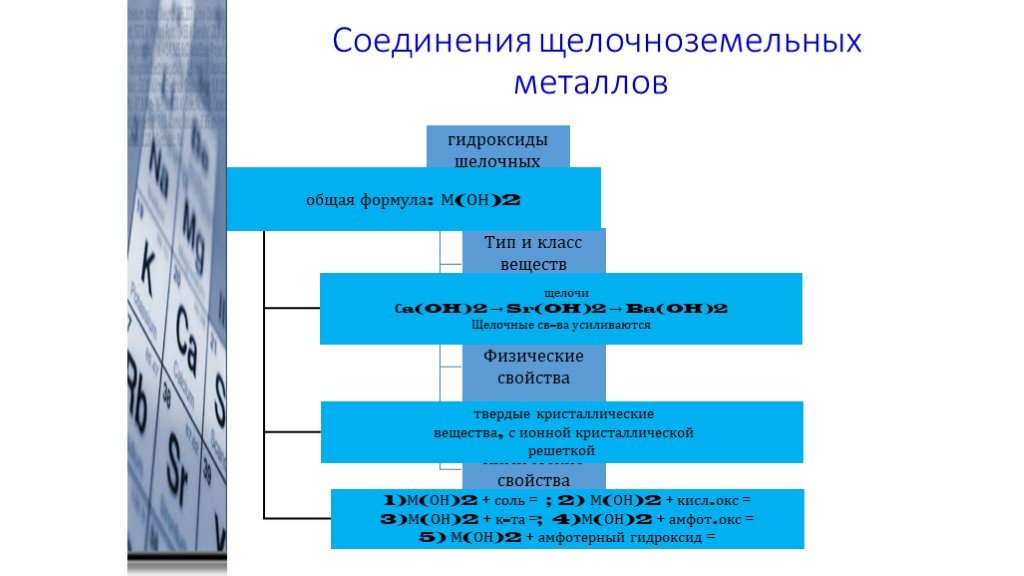 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Контент сообщества доступен по лицензии CC-BY-SA, если не указано иное.
Обзор щелочноземельных металлов
Щелочноземельные металлы состоят из шести элементов: бериллия (Be), магния (Mg), кальция (Ca), стронция (Sr), радия (Ra) и бария (Ba). Все элементы группы щелочноземельных металлов имеют валентную конфигурацию s2, что означает, что их внешняя s-орбиталь имеет два электрона, которые эти элементы отдают, чтобы сформировать катион с электрическим зарядом +2 наряду с состоянием +2 окисление.
Все элементы группы щелочноземельных металлов имеют валентную конфигурацию s2, что означает, что их внешняя s-орбиталь имеет два электрона, которые эти элементы отдают, чтобы сформировать катион с электрическим зарядом +2 наряду с состоянием +2 окисление.
Щелочноземельные металлы обладают многими другими сходными свойствами, помимо общей электронной валентной конфигурации s2. К ним относятся:
Температуры кипения и плавленияВ отличие от щелочных металлов, щелочноземельные металлы не имеют четкого распределения температур кипения и плавления в зависимости от их атомного номера. У щелочных металлов наблюдается снижение температуры кипения и плавления с увеличением атомного номера, но этого нельзя сказать о щелочноземельных металлах.
Например, бериллий (Be) имеет самый низкий атомный номер в группе и самую высокую температуру плавления при 1287°C. Между тем, литий, имеющий самый низкий атомный номер среди щелочных металлов, имеет температуру плавления 180,5°C .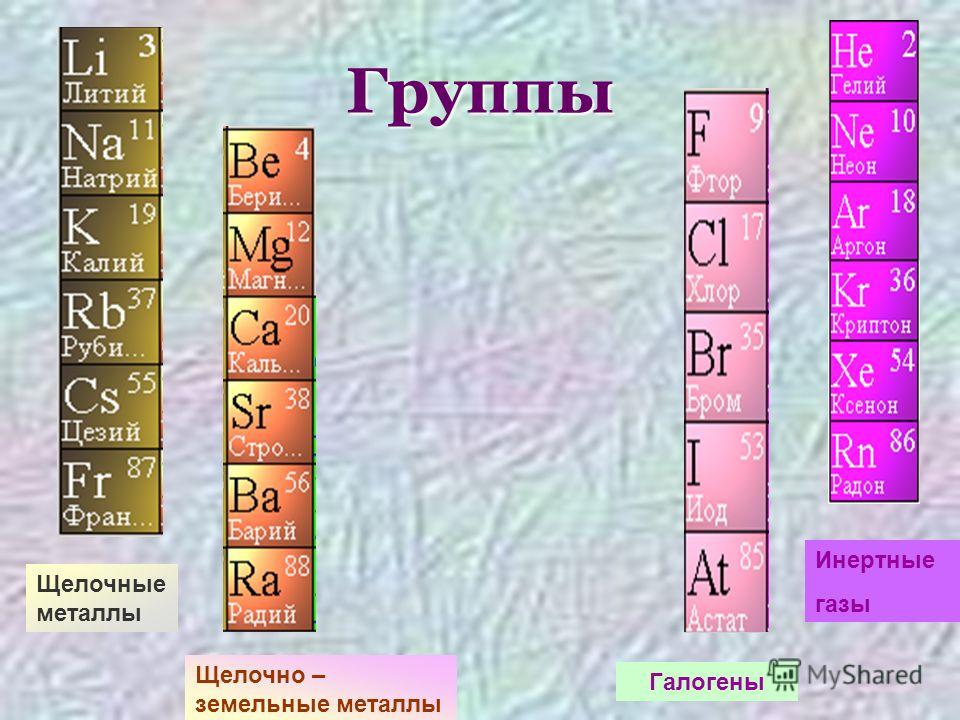
По всей группе наблюдается неравномерный характер снижения и повышения температуры кипения и плавления в зависимости от увеличения атомного номера.
Изобилие в природеЩелочноземельные металлы являются одними из наиболее распространенных в природе элементов. Хотя они не могут быть найдены в их элементарной форме, есть много веществ, которые имеют компоненты различных щелочноземельных металлов.
Магний и кальций являются одними из наиболее распространенных щелочноземельных металлов, встречающихся в природе, занимая пятое и восьмое место по распространенности среди щелочноземельных металлов соответственно.
Доломит, карналлит и магнезит являются одними из распространенных минералов, содержащих магний. Принимая во внимание, что мел, гипс, известняк и ангидрит являются одними из распространенных минералов, содержащих кальций.
Бериллий содержится в земной коре в концентрации от двух до шести частей на миллион, при этом большая часть его содержится в почве в концентрации шесть частей на миллион.
Стронций также довольно распространен, а распространенными минералами, содержащими стронций, являются стронцианит и целестин.
Реакционная способностьВсе щелочноземельные металлы реагируют с галогенами с образованием ионных галогенидов, таких как, например, хлорид кальция (CaCl2). Все щелочноземельные металлы образуют ионные галогениды, за исключением галогенидов бериллия, которые имеют ковалентную природу.
Щелочноземельные металлы, за исключением бериллия, также реагируют с водой с образованием газообразного водорода и кислорода с образованием гидроксидов. Реакционная способность этих элементов увеличивается по мере их перемещения от верха таблицы к низу.
Другие свойства щелочноземельных металловПомимо вышеупомянутых свойств, щелочноземельные металлы также обладают некоторыми другими сходными свойствами, такими как:
- Все щелочноземельные металлы имеют блестящий и серебристый вид.
- Все щелочноземельные металлы имеют характерный цвет пламени.

- Они имеют низкую плотность и являются мягкими, но не такими мягкими и легкими, как щелочные металлы.
- Они также имеют практическое применение в реальной жизни.
Существует множество практических применений щелочноземельных металлов. Различные элементы группы по-разному используются в нашей повседневной жизни, а также имеют биологический компонент.
БериллийБериллий используется в качестве рентгеновских трубок в больницах, поскольку он пропускает больше рентгеновских лучей, чем стекло. Он также встречается в изумрудах и аквамаринах. Кроме того, металлические сплавы, содержащие не менее 2 % бериллия, обладают большей устойчивостью к повседневному износу, прочнее и обладают большей стабильностью при более высоких температурах.
Кальций Кальций был важной частью строительных конструкций в форме известняка и гипса и до сих пор широко используется. Он также используется во многих металлических сплавах, таких как алюминий и медь, а также для раскисления сплавов.
Он также используется во многих металлических сплавах, таких как алюминий и медь, а также для раскисления сплавов.
В сталелитейной промышленности используется форма кальция, так как он помогает удалять загрязняющие вещества и другие примеси из стали, а карбонат кальция используется в бумажной промышленности, поскольку он придает бумаге блеск во время производства.
Кальций также используется в повседневных продуктах, таких как зубная паста, витаминные добавки и т. д.
МагнийМагний в основном используется в производстве стали и железа. Его высокая воспламеняемость не позволяет использовать его на полную мощность, но магний по-прежнему имеет множество реальных применений.
Помимо использования в производстве стали и железа, магний также обеспечивает лучшую структурную прочность по сравнению с такими материалами, как алюминий, для строительства зданий.
Магний также играет биологическую роль и способствует улучшению пищеварения.


