АМФОТЕРНЫЕ МЕТАЛЛЫ И их свойства советы и инструкции 08:38 2023
Прежде чем рассказать про амфотерные металлы и их амфотерные свойства нужно все таки прояснить, что означает в химии термин амфотерность.
Под амфотерностью в химии понимают свойство некоторых химических веществ в разных условиях иметь или кислотные или основные (щелочные) свойства. Под амфотерностью металлов понимают не саму амфотерность металов а именно амфотерность образованных с участием данных металлов химических соединений.
Среди основных критериев оценки амфотерных металлов применяют такой параметр как координационное число. Данный параметр определяет количество ближайших атомов в молекуле.
Есть 7 металлов имеющих ярко выраженные амфотерные свойства.
Самый амфотерный из металлов это алюминий.
Свойства амфотерности алюминия хорошо проявляются на примере взаимодействия гидрооксида алюминия с сильными щелочами и кислотами.
Так реакция гидрооксида алюминия с соляной кислотой будет выглядеть как типичная реакция кислоты со щелочью с образованием хлорида алюминия и воды. Это выглядит вполне естественно если учесть что гидрооксид алюминия по сути щелочь.
Это выглядит вполне естественно если учесть что гидрооксид алюминия по сути щелочь.
Но в этот же гидроксид алюминияв в реакции с более сильной щелочью, как например гидрооксид натрия проявляет себя как кислота с образованием тетрагидроксоалюмината натрия.
Координационное число—4 или 6.
Наглядней всего амфотерность цинка видна в реакции оксида цинка с соляной кислотой. В результате реакции образуется хлорид цинка и вода.
В реакции оксида цинка с гидрооксидом натрия образуется цинкат натрия и вода. И в первом и во втором случае видим типичные реакции кислоты и щелочи.
Координационное число—4.
Пример амфотерности берилия наглядно просматривается на примере реакции оксида берилия с серной кислотой и гидрооксидом натрия. В первом случае оксид берилия ведет как щелочь с образованием сульфата берилия и воды.
Во втором случае реакция приводит к образованию тетрагидроксобериллата натрия.
Координационное число—4.
Амфотерность железа хорошо видна на примере взаимодействия оксида железа (III) с соляной кислотой и гидрооксидом натрия. Продуктами реакцииоксида железа (III) и соляной кислоты будут хлорид железа и вода типичные продукты реакции кислоты и щелочи. В реакции со щелочью оксида железа (III) проявит кислотные свойства с образованием таких веществ как диоксоферрат(III) натрия и воды.
Продуктами реакцииоксида железа (III) и соляной кислоты будут хлорид железа и вода типичные продукты реакции кислоты и щелочи. В реакции со щелочью оксида железа (III) проявит кислотные свойства с образованием таких веществ как диоксоферрат(III) натрия и воды.
Координационное число— от4до 6.
Амфотерность олова наглдно видна на примере реакции оксида олова с серной кислотой. Продукты реакции будут характерны для реакции кислоты и щелочи. В данном случае будет получен сульфат олова и вода.
В реакции с гидрооксидом натрия оксид олово поведет себя как вещество с кислотными свойствами, в результате чего будет получен гидрооксид олова и вода.
Координационное число—4.
Свойства амфотерности свинца хорошо виднына примере взаимодействия оксида свинца(II)с сильными кислотамии щелочами. В реакции ссоляной кислотой образуется хлорид свинца и вода типичная реакция кислоты и щелочи.
Оксида свинца(II) в присутствии сильной щелочи гидрооксида натрия вступает в реакцию как кислотное соединениес образованиемплюмбитанатрия и воды.
Координационное число—4.
Амфотерность хроманаглядней всего демонстрирует реакция оксида хрома (III) и соляной кислоты, где будут типичные для реакции кислоты и щелочи продукты как хлорид хрома(III)и вода.
В реакциис едким кали свойстваоксида хрома (III) будут уже кислотными с образованием таких продуктов реакции как хромит калия и вода.
Координационное число—4 или 6.
Видео обзор
| Все(5) |
|---|
| Химические свойства амфотерных оксидов. Амфотерность. | Переходные металлы. Видеоурок по химии 11 класс | Амфотерные оксиды и их свойства. Самоподготовка к ЕГЭ и ЦТ по химии | 50. Химические свойства амфотерных гидроксидов | Амфотерные гидроксиды. Опыты. Видеоурок по химии 11 класс Опыты. Видеоурок по химии 11 класс |
Амфотерные металлы и их свойства
Амфотерные металлы – это простые вещества, которые по структуре, химическим и физическим свойствам сходны с металлической группой элементов. Сами по себе металлы не могут проявлять амфотерных свойств, в отличие от их соединений. Например, оксиды и гидроксиды некоторых металлов обладают двойственной химической природой – в одних условиях они ведут себя как кислоты, а в других обладают свойствами щелочей.
Основные амфотерные металлы – это алюминий, цинк, хром, железо. К этой же группе элементов можно отнести бериллий и стронций.
Что такое амфотерность?
Впервые это свойство было обнаружено достаточно давно. А термин «амфотерные элементы» был введен в науку в 1814 году известными химиками Л. Тенаром и Ж. Гей-Люссаком. В те времена химические соединения принято было разделять на группы, которые соответствовали их основным свойствами во время реакций.
Тем не менее, группа оксидов и оснований обладала двойственными способностями. В некоторых условиях такие вещества вели себя как щелочи, в других же, наоборот, действовали как кислоты. Именно так и возник термин «амфотерность». Для таких химических веществ поведение во время кислотно-основной реакции зависит от условий ее проведения, природы участвующих реагентов, а также от свойств растворителя.
В некоторых условиях такие вещества вели себя как щелочи, в других же, наоборот, действовали как кислоты. Именно так и возник термин «амфотерность». Для таких химических веществ поведение во время кислотно-основной реакции зависит от условий ее проведения, природы участвующих реагентов, а также от свойств растворителя.
Интересно, что в естественных условиях амфотерные металлы могут взаимодействовать как с щелочью, так и с кислотой. Например, во время реакции алюминия с сульфатной кислотой образуется сульфат алюминия. А при реакции этого же метала с концентрированной щелочью образуется комплексная соль.
Амфотерные основания и их основные свойства
При нормальных условиях это твердые вещества. Они практически не растворяются в воде и считаются довольно слабыми электролитами.
Основной метод получения таких оснований – это реакция соли металла с небольшим количеством щелочи. Реакцию осаждения нужно проводить медленно и осторожно. Например, при получении гидроксида цинка в пробирку с хлоридом цинка осторожно, каплями добавляют едкий натр. Каждый раз нужно несильно встряхивать емкость, чтобы увидеть белый осадок металла на дне посуды.
Каждый раз нужно несильно встряхивать емкость, чтобы увидеть белый осадок металла на дне посуды.
С кислотами и кислотными оксидами амфотерные вещества реагируют как основания. Например, при реакции гидроксида цинка с соляной кислотой образуется хлорид цинка.
А вот во время реакций с основаниями амфотерные основания ведут себя как кислоты.
Кроме того, при сильном нагревании амфотерные гидроксиды разлагаются с образованием соответствующего амфотерного оксида и воды.
Самые распространенные амфотерные металлы: краткая характеристика
Цинк относится к группе амфотерных элементов. И хотя сплавы этого вещества широко использовались еще в древних цивилизациях, в чистом виде его смогли выделить лишь в 1746 году.
Чистый металл представляет собой достаточно хрупкое вещество голубоватого цвета. На воздухе цинк быстро окисляется – его поверхность тускнеет и покрывается тонкой пленкой оксида.
В природе цинк существует преимущественно в виде минералов – цинкитов, смитсонитов, каламитов. Самое известное вещество – это цинковая обманка, которая состоит из сульфида цинка. Самые большие месторождения этого минерала находятся в Боливии и Австралии.
Самое известное вещество – это цинковая обманка, которая состоит из сульфида цинка. Самые большие месторождения этого минерала находятся в Боливии и Австралии.
Алюминий на сегодняшний день считается наиболее распространенным металлом на планете. Его сплавы использовались на протяжении многих столетий, а в 1825 году вещество было выделено в чистом виде.
Чистый алюминий представляет собой легкий металл серебристого цвета. Он легко поддается механической обработке и литью. Этот элемент обладает высокой электро- и теплопроводностью. Кроме того, данный металл стоек к коррозии. Дело в том, что поверхность его покрыта тонкой, но очень стойкой оксидной пленкой.
На сегодняшний день алюминий широко применяется в промышленности.
Фотостимулированная эмиссия экзоэлектронов из поверхностного слоя амфотерных металлов, реагирующих с концентрированным гидроксидом натрия или гидроксидом калия
Фотостимулированная эмиссия экзоэлектронов из поверхностного слоя амфотерных металлов, реагирующих с концентрированным гидроксидом натрия или гидроксидом калия
Скачать PDF
Ваша статья скачана
Карусель с тремя слайдами одновременно. Используйте кнопки «Назад» и «Далее» для перехода по трем слайдам за раз или кнопки с точками в конце для перехода по трем слайдам за раз.
Используйте кнопки «Назад» и «Далее» для перехода по трем слайдам за раз или кнопки с точками в конце для перехода по трем слайдам за раз.
Скачать PDF
- Опубликовано:
- J. WAWRZYNIAK 1
- B. SUJAK 1 na1
Природа том 186 , страница 467 (1960)Цитировать эту статью
89 доступов
Сведения о показателях
Abstract
ВО ВРЕМЯ изучения влияния жидкостей 1 на явления трибовозбужденной эмиссии экзоэлектронов (эффект Крамера 2 ) из металлов мы обнаружили, что амфотерные металлы, такие как алюминий, цинк и олово, а также латунь и некоторые припои, содержащие олово, дают сравнительно сильную эмиссию экзоэлектронов при облучении видимым светом после опрыскивания свежеотшлифованной поверхности сильно концентрированным гидроксидом натрия или гидроксидом калия.
Ссылки
Lewowski, T., and Sujak, B., Acta Phys. пол. (в печати).
«Exoelektronentagung», Acta Phys. Austriaca , 10 , 313 (1957).
Sujak, B., Physikalische Blätter , 15 , 209 (1959).
Артикул Google ученый
Скачать ссылки
Информация об авторе
Примечания автора
Б. СУДЖАК: В отпуске в Кларендонской лаборатории, Оксфорд.
Authors and Affiliations
Institute of Experimental Physics, University of Wrocław, Wrocław, Poland
J. WAWRZYNIAK & B. SUJAK
Authors
- J. WAWRZYNIAK
View author publications
You также можете искать этого автора в PubMed Google Академия
- B.
 SUJAK
SUJAKПросмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Права и разрешения
Перепечатка и разрешения
Об этой статье
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
NEET UG: амфотерные оксиды
Амфотерные оксиды — это оксиды, которые могут действовать как основные, так и кислотные соединения. Амфотерные оксиды проявляют характеристики как кислотных, так и основных оксидов и обладают способностью нейтрализовать как кислоты, так и основания. Это простое объяснение того, что такое амфотерные оксиды. В присутствии воды амфотерные оксиды растворяются и образуют щелочные растворы. Ионы гидроксида присутствуют в щелочных жидкостях. Оксид алюминия (Al 2 O 3 ) реагирует с соляной кислотой с образованием воды и хлорида алюминия в результате этой реакции. Аморфный оксид алюминия классифицируется как амфотерный оксид. Он образует воду и алюминат натрия при обработке раствором гидроксида натрия (NaAlO 2 ).
Аморфный оксид алюминия классифицируется как амфотерный оксид. Он образует воду и алюминат натрия при обработке раствором гидроксида натрия (NaAlO 2 ).
Химический состав амфотерных оксидов
Оксиды — это соединения, образующиеся при соединении металлов или неметаллов с кислородом с образованием химического вещества. Существует четыре различных вида оксидов. Амфотерные оксиды классифицируются как оксиды металлов, потому что они реагируют как с кислотами, так и с основаниями, а также с водой и солями, образуя растворы воды и солей. Оксид цинка и оксид свинца являются примерами амфотерных оксидов, которые встречаются в различных формах. Примеры включают белки и аминокислоты, принадлежащие к семействам карбоновых кислот и аминов, а также молекулы, способные к самоионизации, такие как вода и этанол. Амфотерные оксиды представляют собой соединения кислорода, обладающие как основными, так и кислотными свойствами. Они встречаются в природе.
Некоторые амфотерные оксиды и химия их образования
Химическое объяснение простое. Веществу необходимо вести себя в растворе как основание, чтобы каким-то образом разорвать связь Н-ОН и высвободить ионы ОН-, которые затем вступят в реакцию с протоном, образовавшимся в результате диссоциации. Оксид калия (K 2 O), например, создает ионы 2K + (которые не способны гидролизовать молекулы воды из-за их низкого положительного заряда) и O 2-, способный разрывать связь Н-ОН, связываясь с атомом водорода Н 2 О и выделяя ионы ОН- в раствор. В результате он классифицируется как основной оксид. Единственная реакция, которую мы наблюдаем с водой с кислородом, связана с тем, что калий имеет заряд +1 и не сильно притягивается к ОН- в воде. Из-за этого мы видим реакцию только с водой или кислородом. Однако мы можем видеть, что когда мы смотрим на амфотерный оксид, такой как оксид алюминия, алюминий имеет очень высокий положительный заряд +3, что заставляет его притягиваться к гидроксильной группе в воде. В результате, когда он вступает в контакт с водой, он может высвобождать протоны вместо гидроксильных групп.
Веществу необходимо вести себя в растворе как основание, чтобы каким-то образом разорвать связь Н-ОН и высвободить ионы ОН-, которые затем вступят в реакцию с протоном, образовавшимся в результате диссоциации. Оксид калия (K 2 O), например, создает ионы 2K + (которые не способны гидролизовать молекулы воды из-за их низкого положительного заряда) и O 2-, способный разрывать связь Н-ОН, связываясь с атомом водорода Н 2 О и выделяя ионы ОН- в раствор. В результате он классифицируется как основной оксид. Единственная реакция, которую мы наблюдаем с водой с кислородом, связана с тем, что калий имеет заряд +1 и не сильно притягивается к ОН- в воде. Из-за этого мы видим реакцию только с водой или кислородом. Однако мы можем видеть, что когда мы смотрим на амфотерный оксид, такой как оксид алюминия, алюминий имеет очень высокий положительный заряд +3, что заставляет его притягиваться к гидроксильной группе в воде. В результате, когда он вступает в контакт с водой, он может высвобождать протоны вместо гидроксильных групп.
Применение амфотерных оксидов
Соли амфотерного оксида используются в различных областях, некоторые из которых подробно описаны ниже: Различные продукты и материалы, включая пластмассы, каучуки, стекло, керамику, смазочные материалы (включая цемент), мази (включая мази и кремы), краски ( включая герметики) и клеи (включая пищевые продукты), пигменты (включая антипирены), батареи (включая батареи) и ленты для оказания первой помощи могут выиграть от добавления оксида цинка (ZnO) (соединения, содержащие Fe 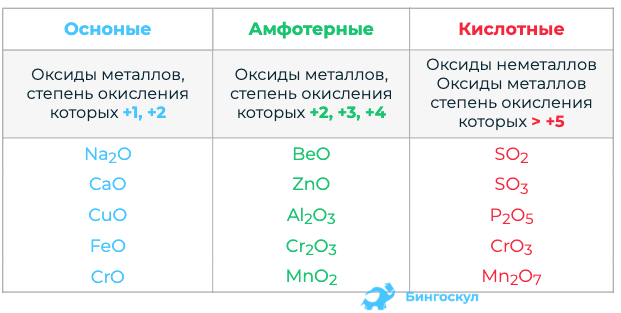 Оксид алюминия (Al 2 O 3 ) также используется в производстве алюминия, хотя и менее распространен.
Оксид алюминия (Al 2 O 3 ) также используется в производстве алюминия, хотя и менее распространен.
Заключение
Кроме того, из-за того, что он относительно химически бесцветен и инертен, этот оксид является популярным наполнителем для пластмасс. Это популярный элемент в солнцезащитных кремах, а также в небольших количествах его можно найти в таких косметических средствах, как губная помада, краска для ногтей и румяна. Оксид алюминия иногда используется в качестве компонента при производстве некоторых изделий из стекла. В сочетании со спиртом его можно использовать в качестве катализатора при дегидратации спирта до алкенов и в реакции Клауса. Амфотерный оксид — это название, данное оксиду алюминия. PbO — это химическое соединение, широко используемое в производстве стекла. В различных типах стекла использование PbO может иметь множество полезных эффектов, включая снижение вязкости стекла, увеличение показателя преломления стекла, улучшение способности стекла поглощать рентгеновские лучи и увеличение электрического сопротивления.

 SUJAK
SUJAK