Оксиды — что это такое? Химические свойства и классификация
Поможем понять и полюбить химию
Начать учиться
Знакомство с оксидами обычно начинается на уроках химии в 8 классе. Из этой статьи вы узнаете, что такое оксиды в химии, их классификацию и свойства, а также способы получения.
Определение оксидов
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Запишитесь и участвуйте в розыгрыше 8 уроков
Виды оксидов
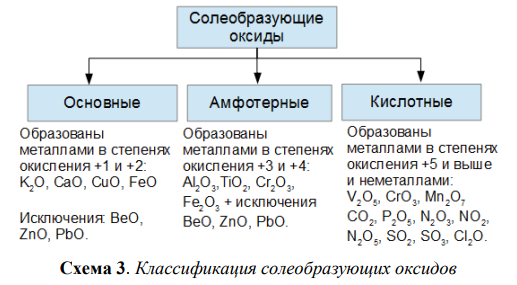
Все оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
Солеобразующие оксиды делятся на три группы:
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na+12O, Ca+2O, Ba+2O.
Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.

К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
Примеры амфотерных оксидов: Al+32O3, Fe2+3O3.
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Примеры кислотных оксидов: S+6O3, N2+5O5, Mn2+7O7.
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
Например:
CrO (оксид хрома (II)) — проявляет основные свойства;
Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.

Закрепим знания о типах оксидов, изучив схему:
Номенклатура оксидов
Названия оксидов строятся по систематической номенклатуре следующим образом:
Пишем слово «оксид».
Указываем название второго химического элемента в родительном падеже.
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три.
Na2O — оксид натрия. Читается: натрия два о.
SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
Химическая формула оксида | Бытовое (тривиальное название) | Возможное научное название |
|---|---|---|
| H2O | Вода | Оксид водорода |
| CO2 | Углекислый газ | Оксид углерода (IV), диоксид углерода |
| CO | Угарный газ | Оксид углерода (II), монооксид углерода |
| SO3 | Серный газ | Оксид серы (VI), триоксид серы |
| SO2 | Сернистый газ | Оксиды серы (IV), диоксид серы |
| SiO | Кварц, горный хрусталь, песок кварцевый, речной и морской | Оксид кремния |
| Al2O3 | Глинозем | Оксид алюминия |
| Fe2O3 | Гематит (крокус) | Оксид железа (III) |
| CaO | Негашеная известь | Оксид кальция |
Основный оксид + вода = основание Например: Na2O + H2O = 2NaOH |
|---|
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
Основный оксид + кислотный оксид = соль Например: BaO + SO3 = BaSO4 Основный оксид + кислота = соль + вода Например: Mg(OH)2 + 2HNO3 = Mg(NO3)2 + 2H2O |
|---|
3. Взаимодействие с амфотерными оксидами
В эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Основный оксид + амфотерный оксид = соль Например: Na2O + Al2O3 = NaAlO2 |
|---|
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
1. Взаимодействие с водой
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
Кислотный оксид + вода = кислота Например: SO3 + H2O = H2SO4 |
|---|
2.
 Взаимодействие с основными оксидами и щелочами
Взаимодействие с основными оксидами и щелочамиКислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотный оксид + основный оксид = соль Например: SO3 + CuO = CuSO4 Кислотный оксид + основание = соль + вода Например: N2O5 + 2NaOH = 2NaNO3 + H2O |
|---|
Кислотные оксиды, соответствующие слабым кислотам (такие как CO
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Кислотный оксид + амфотерный оксид = соль Например: SO3 + Al2O3 = Al2(SO4)3 Кислотный оксид + амфотерный оксид = соль + вода Например: SO3 + Al(OH)3 = Al2(SO4)3 + H2O |
|---|
Химические свойства амфотерных оксидов
1. Взаимодействие с водой
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерный оксид + вода ≠ |
|---|
2. Взаимодействие с кислотными оксидами и кислотой
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерный оксид + кислотный оксид = соль Например: Al2O3 + N2O5 = 2Al(NO3)3 Амфотерный оксид + кислота = соль + вода Например: Al2O3 + 6HCl = 2AlCl3 + 3H2O |
|---|
3. Взаимодействие с основными оксидами
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Амфотерный оксид + основный оксид (расплав) = соль Например: Al2O3 + Na2O = 2NaAlO2 |
|---|
4.
 Взаимодействие со щелочами
Взаимодействие со щелочамиПродукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Амфотерный оксид + щелочь (раствор) + вода = комплексная соль Например: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4] Амфотерный оксид + щелочь (расплав) = средняя соль + вода Например: ZnO + 2KOH = K2ZnO2 + H2O |
|---|
Получение оксидов
1. Окисление металлов
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Например: 4Al + 3O2 = 2Al2O3
Исключение
Не взаимодействуют с кислородом: платина, золото и палладий.
Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
4Cr + 3O2 = 2Cr2O3
При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
4P + 5O2 (избыток) = 2P2O5
При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
4P + 3O2 (недостаток) = 2P2O3
Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
S + O2 = SO2
Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
N2 + O2 = 2NO
Запомнить
Галогены (элементы VIIA группы) вовсе не взаимодействуют с кислородом, так же как и инертные газы (элементы VIIIA группы).
3. Разложение гидроксидов
Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
Гидроксид (кислота) = оксид + вода
Например:
H2SO3 = SO2↑ + H2O
H2CO3 = CO2↑ + H2O
Ag(OH) = Ag2O + H2O
NH4OH = NH3↑ + H2O
Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
Например:
4. Окисление сложных веществ
Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
Например:
2H2S + 3O2 = 2SO2 + 2H2O
4NH3 + 5O2 = 4NO + 6H2O
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т.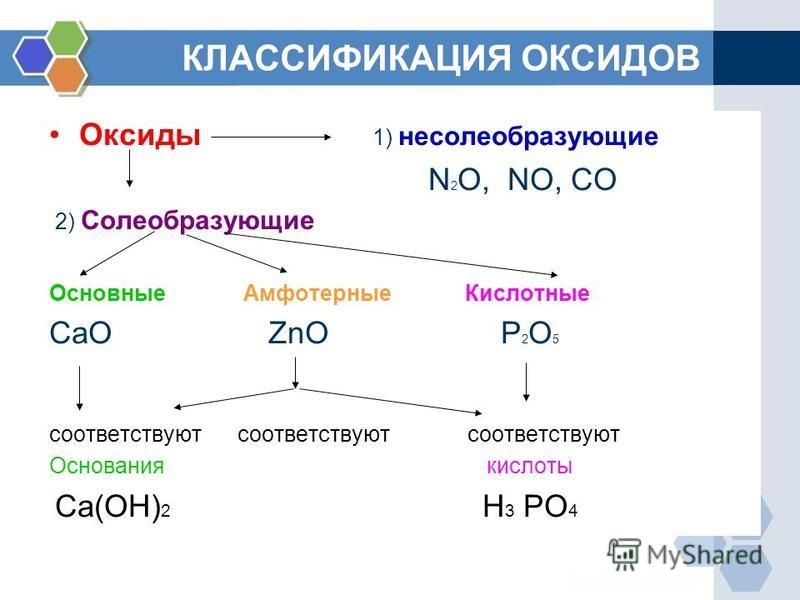 д.
д.
Например, Li2CO3 = Li2O + CO2↑
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
Татьяна Сосновцева
К предыдущей статье
Ковалентные неполярные и полярные связи
К следующей статье
Химические свойства металлов
Характер химического элемента по кислотно- основным свойствам. (Амфотерные соединения)
Похожие презентации:
Химические свойства основных классов неорганических соединений
Классификация химических элементов
Основные классы химических соединений
Химические свойства основных классов неорганических соединений
Классификация химических элементов. Амфотерность
Классификация химических элементов
Характеристика химических элементов и химических реакций
Оксиды. Классификация. Химические и физические свойства
Классификация. Химические и физические свойства
Химическая связь и ее типы. Основные классы неорганических соединений
Классы неорганических веществ
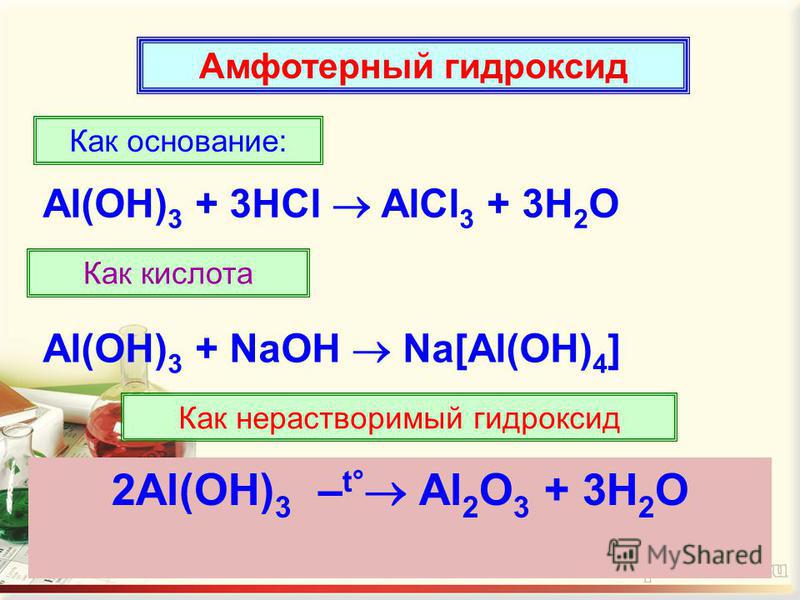
1. Характер химического элемента по кислотно- основным свойствам. (Амфотерные соединения)
Урок химии в 9 классеОлейникова Елена Владимировна.
Конспект урока(фото) с заданиями
отправить в личном сообщении до
12.11 -18:00 вечера
2. Проблема
Можно ли варить кислые щи и хранитьквашеную капусту в алюминиевой
посуде? Можно ли мыть алюминиевую
посуду щелочными средствами,
например, содой?
3. Основные классы неорганических веществ:
КислотыОснования
Вещества
Оксиды
Соли
4. Выполните задание 1 в тетради
Составьте формулы оксидов и гидроксидов,образованных следующими элементами, и
назовите
их: Формула Характер Формула
Химически
й элемент
оксида
свойств
гидроксида
Характе
р
свойств
Вa
?
?
P
?
?
Укажите характер свойств этих оксидов и гидроксидов;
как из простого вещества можно получить оксид, а из оксида гидроксид? Составьте цепочки превращений и решите их
указав степени окисления и расставив коэффициенты в
уравнении реакции.

5. О чем идет речь?
ВЫВОДнеметаллы
металлы
кислотные оксиды
оснόвные оксиды
кислоты
основания
6. О чем идет речь?
«Амфотерность»«амфо» или «амфи» (греч.) — означает: с
двух сторон; и то, и другое;
это вещества, которые проявляют
свойства и те, и другие.
способность соединений проявлять
либо кислотные либо основные
свойства, в зависимости от того с чем
они реагируют.
При добавлении к таким веществам кислоты,
они проявляют основные свойства, а при
добавлении к ним щелочи – кислотные
свойства.
7. ВЫВОД
Какие элементы периодической системы образуютамфотерные соединения?
Неметаллы,
исключая элементы
побочных подгрупп
Металлы
Амфотерный характер носят оксиды и гидроксиды
большинства переходных элементов и многих элементов
побочных подгрупп.
8. «Амфотерность»
Выполните задание 4 втетради
Найдите в периодической системе химические
элементы с амфотерными свойствами и назовите
формулы их соединений (оксидов, гидроксидов).

9. Какие элементы периодической системы образуют амфотерные соединения?
Амфотерные элементызаписать все в тетрадь
Элементы, проявляющие в соединениях
металлические и неметаллические
свойства, называют амфотерными, к ним
относятся элементы А-групп
Периодической системы — Be, Al, Ga, Ge, Sn,
Pb, Sb, Bi, Po и др., а также большинство
элементов Б-групп — Cr, Mn, Fe, Zn, Cd, Au и
др.
10. Выполните задание 4 в тетради
Амфотерные оксидызаписать в тетрадь
Из оксидов двойственными свойствами
обладают:
BeO — оксид бериллия
Cr2O3 — оксид хрома(III)
Al2O3 — оксид алюминия
Fe2O3 — оксид
железа(III)
ZnO — оксид цинка(II)
PbO – оксид свинца(II)
SnO2 — оксид олова(IV) PbO2 – оксид свинца(IV)
11. Амфотерные элементы записать все в тетрадь
Амфотерные гидроксидызаписать в тетрадь
Be(OH)2
— гидроксид бериллия
Al(OH)3
— гидроксид алюминия
Zn(OH)2
— гидроксид цинка
Fe(OH)3
— гидроксид железа(III)
12.
 Амфотерные оксиды записать в тетрадьПроблема
Амфотерные оксиды записать в тетрадьПроблемаКак доказать амфотерность оксида или гидроксида?
Параграф 2, стр 10, 11
Задание 5: Записать практическую работу
Элементы оценивания: Название, Цель, Ход работы с
уравнениями реакции, Вывод.
Провести химический
эксперимент. ИЛИ
Экспериментальная
задача
13. Амфотерные гидроксиды записать в тетрадь
Экспериментальнаязадача
Цель работы:
получить амфотерный гидроксид
(на примере гидроксида цинка) и
изучить его свойства.
14. Проблема
Ход работыЧто делали
1
Что наблюдали
В пробирки №1 и №2 налили по 1-2 мл
р-ра NaOH
и добавили несколько
капель ZnCl2 до образования осадка
Уравнение реакции: NaOH + ZnCl2 =
2
К осадку в пробирке №1 добавили р-р
соляной кислоты
Уравнение реакции: Zn(OH)2 + HCl =
3
К осадку в пробирке №2 добавили р-р
гидроксида натрия (избыток)
Уравнение реакции: Zn(OH)2 + NaOH
15.
 Экспериментальная задачаГидроксиды – вещества, в
Экспериментальная задачаГидроксиды – вещества, всоставе которых есть
гидроксогруппы (-ОН)
O
HNO3
H–O- N
O
h3SO4
H–O
O
S
H–O
NaOH
Na – O — H
O
16. Ход работы
Гидроксид цинка можно записатьи как основание, и как кислоту
Основание
Zn(OH)2 = ZnO2h3 =
= h3ZnO2
Цинковая кислота,
ее соли — цинкаты
17. Гидроксиды – вещества, в составе которых есть гидроксогруппы (-ОН)
ДополнениеНа самом деле, взаимодействие гидроксида цинка со
щелочью с образованием средней соли – цинката натрия происходит при нагревании (сплавлении) твердых веществ.
Если же взять водные растворы веществ, то реакция пойдет
несколько иначе – с образованием комплексной соли:
Zn(OН)2 + 2NaOH → Na2[Zn(OH)4] (тетрагидроксоцинкат
натрия)
Аналогично происходит взаимодействие и оксида цинка с
водным раствором гидроксида натрия:
ZnO + 2NaOH + Н2О → Na2[Zn(OH)4] (тетрагидроксоцинкат
натрия)
Таким образом, продукты реакции зависят от
условий проведения реакции: в расплаве или в
водном растворе щелочи.

18. Гидроксид цинка можно записать и как основание, и как кислоту
Вывод1.
Гидроксид цинка, взаимодействуя со
щелочью, проявляет ________свойства, а
взаимодействуя с кислотой, проявляет
_________ свойства.
2.
Гидроксид цинка проявляет ______________
характер.
19. Дополнение
Оксид алюминияAl2O3 -оксид алюминия чрезвычайно распространенное на
Земле вещество. Он составляет основу глины, бокситов,
корунда и других минералов.
Проверим свои знания
Задание :
Вариант 1: составьте уравнения реакций
взаимодействия оксида алюминия Al2O3 с
соляной кислотой и гидроксидом натрия.
Вариант 2: составьте уравнения реакций
взаимодействия гидроксида алюминия
Al(OH)3 с соляной кислотой и гидроксидом
натрия.
21. Оксид алюминия
Проверим свои знанияКак основный
Al2O3 + 6HCl = 2AlCl3 + 3h3O
Al2O3 + 3NaOH = Na3AlO3 + 3h3O
Как кислотный
Как основание
Al(OН)3 + 3HCl = AlCl3 + 3h3O
Al(OН)3 + 3NaOH = Na3AlO3 + 3h3O
Как кислота
Дополнительная
информация
Если элемент проявляет различные
степени окисления
Сr
(+2) CrO
основный
Cr(OH)2
основани
е
(+3) Cr2O3
амфотерны
й
Cr(OH)3
Амфотерны
й
гидроксид
(+6) CrO3
кислотный
h3CrO4
h3Cr2O7
кислоты
Дополнительная информация
• элементы,
которые образуют амфотерные
соединения – оксиды и гидроксиды, могут
и сами проявлять амфотерные свойства.

Zn + h3SO4(разб.)→ ZnSO4 + h3↑
Zn + 2NaOH → Na2ZnO2 + Н2↑
(цинкат натрия)
Zn + 2NaOH + 2h3O → Na2[Zn(OH)4] + Н2↑
(тетрагидроксоцинкат
натрия)
24. Дополнительная информация
Проверим свои знанияОтгадайте загадку:
Вещество – универсал:
Щелочь он парализует,
Кислоту
нейтрализует,
И в реакции такой
Получаем соль с водой.
25. Дополнительная информация
Подведем итогиОксиды
ЭхОу
Амфотерные
Основные
оксиды металлов
с.о. +1,+2
CaO, FeO, CuO
Na2O
Оксиды
металлов
(с.о. +2,+3,+4)
Fe2O3, Al2O3
ZnO, BeO
Кислотные
Оксиды неметаллов,
оксиды металлов
(с.о.+5,+6+7)
SO3, Cl2O7, WO3
26. Проверим свои знания
Подведем итогиГидроксиды
Основания
Ca(ОН)2, Fe(OН)3
Cu(ОН)2
NaОН
Амфотерные
гидроксиды
Fe(OН)3, Al(OН)3
Zn(OН)2, Be(OН)2
Кислоты
Н2SO4, НClO4,
Н2WO4, Н2СО3
Вернемся к проблеме
Можно ли варить кислые щи и хранить
квашенную капусту в алюминиевой
посуде? Можно ли мыть алюминиевую
посуду щелочными средствами,
например, содой?
Вернемся к проблеме
Ответ запиши в тетради
29.
 Вернемся к проблеме Домашнее задание!
Вернемся к проблеме Домашнее задание!Стр13, №2 Сделать превращение
под номером 4,5!
English Русский Правила
Реакции элементов периода 3 и их оксидов
Содержание
Третий период периодической таблицы представляет интересную химию в форме элементов и их оксидов, которые подвергаются множеству реакций. Давайте узнаем больше о реакциях элементов периода 3 и их оксидов!
Период 3 Периодической таблицыТаблица — 1
Группа 1 | Группа 2 | Группа 3-12 | Группа 13 | Группа 14 | Группа 15 | Группа 16 | Группа 17 | Группа 18 | |
| Период 3 | 11 На 22,99 | 12 Мг 24.31 | 13 Ал 26,98 | 14 Си 28. | 15 Р 30,97 | 16 С 32.07 | 17 Кл 35,45 | 18 Ар 39,95 | |
| Электроотрицательность: | 0,9 | 1,2 | 1,5 | 1,8 | 2.1 | 2,5 | 3,0 | / | |
| Разница в электроотрицательности | 2,6 | 2,3 | 2,0 | 1,7 | 1,4 | 1,0 | 0,5 | / |
Тенденция электроотрицательности → → → → → Тип связи в оксидах можно определить, оценив разницу в электроотрицательности между кислородом и элементом. Электроотрицательность кислорода 3,5. Электроотрицательность элементов периода 3 (с использованием шкалы электроотрицательности атомов Полинга) и различия в электроотрицательности каждого элемента и кислорода показаны в таблице 1.
В течение периода, когда мы идем слева направо, то есть от Na к Ar, электроотрицательность увеличивается из-за увеличения количества зарядов на ядре.
В оксидах кислород притягивает к себе электроны гораздо сильнее, чем металлы (Na, Mg и Al), поэтому атом кислорода оттягивает электроны от атома металла, в результате чего образуются два иона: анион кислорода, O 2- ; катион металла, Na + , Mg 2+ , Al 3+ и ионные связи. Это твердые оксиды, и силы электростатического притяжения удерживают ионы кислорода и металлов в организованных трехмерных структурах, решетках.
Оксиды металлов состоят из гигантских структур с сильным притяжением между ионами. Для разрушения этих притяжений требуется много тепловой энергии, поэтому эти оксиды твердые и имеют высокие температуры плавления.
Другие элементы 3-го периода: Si, P, S и Cl больше похожи на кислород по электроотрицательности, поэтому электроны, образующие связь между атомами, больше разделяются, чем притягиваются одним из них. Таким образом, эти элементы образуют ковалентный тип связи в своих оксидах.
Таким образом, эти элементы образуют ковалентный тип связи в своих оксидах.
SiO 2 образует твердую трехмерную сеть, называемую кремнеземом, подобную по структуре алмазу. Кремнезем очень твердый при комнатной температуре с высокой температурой плавления.
Оксиды фосфора P 4 O 10 a сера SO 2 и SO 3 и хлор представляют собой небольшие дискретные ковалентные молекулы. Некоторые из этих молекул являются индивидуальными, а некоторые являются полимерными. Между этими молекулами действуют межмолекулярные силы типа Ван-дер-Ваальсовых дисперсионных сил или диполь-дипольных взаимодействий, и они определяют низкую температуру плавления такого рода оксидов, значительно более низкую, чем у оксидов металлов.
При взаимодействии элементов с кислородом образуются продукты – оксиды.
Оксиды всех элементов периода 3, кроме Cl и Ar, могут быть получены одним и тем же методом: сжиганием элемента в воздухе в реакции горения, когда элемент будет реагировать с кислородом воздуха с образованием оксида элемента. Ar является благородным газом и не образует оксидов, а Cl образует оксиды (Cl 2 O, ClO 2 , Cl 2 O 7 ), которые нестабильны и не могут быть получены таким способом.
Ar является благородным газом и не образует оксидов, а Cl образует оксиды (Cl 2 O, ClO 2 , Cl 2 O 7 ), которые нестабильны и не могут быть получены таким способом.
Рассматривая Период 3 Периодической таблицы слева направо, мы можем прийти к некоторым выводам:
- Природа связи в оксидах элементов Периода 3 изменяется от ионной к ковалентной связи.
- Оксиды образуют ионную решетку от ковалентной сети до ковалентных молекул.
- Оксиды элементов периода 3 от основных до амфотерных и кислых.
Вода хотя и очень слабый окислитель, очень легко и быстро окисляет натрий. Полученный раствор сильно щелочной и имеет рН 14:9.0003
2Na (s) + 2H 2 O → 2Na + + 2OH — + H 2(g)
Магний медленно и экзотермически реагирует с горячей водой с холодной водой, но очень экзотермически Дает оксид:
мг (S) + H 2 O (G) → MGO (S) + H 2 (G)
Реакции Оксидации. Натрий 4Na + O 2 → 2Na 2 O
Натрий 4Na + O 2 → 2Na 2 O- NA 2 O (S) + H 2 O (L) → 2NA + 60173 (L) → 2NA + 01607070707070 (L) → 2NA +
. 2OH — (водный)
- 2MgO (т) + H 2 O (л) → 2Mg 2+ (водн.
 ) + 2OH — (водн.)64
) + 2OH — (водн.)64
Гидроксиды этого металла: NaOH и Mg(OH) 2 — обе базы.
- Al 2 O 3 не реагирует с H 2 O, прочность ионных связей, скрепляющих решетку, слишком велика.
- SiO 2 не реагирует с H 2 Ковалентные связи, удерживающие атомы кремния и кислорода вместе в трехмерной решетке, слишком прочны, чтобы их могли разрушить молекулы воды.
- Оксиды неметаллов реагируют с водой с образованием оксикислот (кислота, в которой кислород связан с неметаллом).
P 4 O 10 (S) + 6 H 2 O (L) → 4H 3 PO4 (L)
SO 2 (G) + H 2 O (L) → H 2 SO 3 (L)
SO 3 (S) + H
2 2 3 3 (S) + H 2 2 2 3 (S) + H 2 2 2 3 (S) + H 2 2 23 (S)
3 (S) . ) → H 2 SO 4(l)
) → H 2 SO 4(l) Таким образом, растворы оксидов металлов в воде проявляют свойства оснований, а водные растворы оксидов неметаллов проявляют свойства кислот.
Реакция оксидов 3-го периода с кислотами и основаниями и их основные, амфотерные и кислотные свойстваОбщая тенденция изменения кислотности в оксидах элементов 3-го периода по периоду слева (группа 1) справа (группа 17):
основные оксиды (группа 1, 2) → амфотерный оксид (Al 2 O 3 ) → кислые оксиды (оксикислоты)
Такая же тенденция наблюдается в каждом периоде Периодической таблица и имеем:
Основания реагируют с кислотами, такими как HCl:- Оксид натрия реагирует с разбавленной соляной кислотой с образованием соли и воды:
Na 2 O (s) + 2HCl (aq) → 2NaCl (aq) + H 2 O (l)
- Magnesium oxide reacts with warm dilute HCl to produce salt и вода.

MgO (т) + 2HCl (водн.) → MgCl 2 (водн.) + H 2 O (l)
- Реакция взаимодействия оксида алюминия и горячей разбавленной соляной кислоты с образованием хлорида алюминия и воды.
Al 2 O 3 + 6HCl (водн.) → 2AlCl 3 + 3H 2 O (l)
9000s также реагирует с оксидами алюминия. При добавлении концентрированного раствора гидроксида натрия к оксиду алюминия образуются комплексные ионы, такие как ион тетрагидроксоалюмината:Al 2 O 3(s) + 2NaOH(водн.) +3H 2 O (ж) →2NaAl(OH) 4(водн.)
В этой реакции Al 2 O 3 действует как кислота.
Заключение: Al 2 O 3 имеет амфотерный характер.
- Диоксид кремния, оксид металлоида химически очень инертен и слабокислотный.
 Он реагирует с горячим концентрированным гидроксидом натрия с образованием силиката натрия и воды.
Он реагирует с горячим концентрированным гидроксидом натрия с образованием силиката натрия и воды.
SiO 2(т) + 2NaOH (л) → Na 2 SiO 3(ж) + H 2 O (ж)
водный раствор гидроксида натрия в качестве основания. Оксиды фосфора реагируют с водой с образованием кислот, как мы видели, и эти кислоты могут реагировать с гидроксидом натрия в реакции нейтрализации.
- Тогда имеем:
H 3 PO 3(водн.) + 3NaOH (водн.) →Na 3 PO 3 (AQ) + 3H 2 O (L)
H 3 PO 4 (AQ) + 3NAOH (AQ) 44444444.
+ 3naOH (AQ) 444444444444. 3NAOH (AQ) 4444444444 → + 3NAOH (AQ) 44444444 itpe ) + 3H 2 O (l)- Диоксид серы реагирует с водным раствором гидроксида натрия с образованием соли (натрия
сульфит) и вода. Триоксид серы бурно реагирует с водой с образованием серной кислоты, которая вступает в реакцию с гидроксидом натрия с образованием соли.
Триоксид серы бурно реагирует с водой с образованием серной кислоты, которая вступает в реакцию с гидроксидом натрия с образованием соли.
SO 2(g) + 2NaOH (aq) →Na 2 SO 3(aq) + H 2 O (l)
H 2 SO 4(aq ) + 2NAOH (aq) → NA 2 SO4 (AQ) + H 2 O (L)
Запротив. Сколько элементов содержится в третьем периоде периодической таблицы?
В третьем периоде таблицы Менделеева восемь элементов. Его называют нормальным или коротким периодом. Эти элементы включают в себя; натрий, магний, алюминий, кремний, фосфор, хлор и аргон (благородный газ).
Что такое электроотрицательность?
Электроотрицательность — это сила элемента, с которой он может притягивать общую пару электронов в ковалентной связи. Электроотрицательность уменьшается сверху вниз в группе и увеличивается слева направо в периоде.
Какой элемент в периоде 3 демонстрирует явление цепной связи?
Кремний в третьем периоде таблицы Менделеева показывает явление цепной связи. Он образует длинные цепи своего оксида, «диоксида кремния», широко известного как кремнезем.
Как можно получить оксиды элементов периода 3?
Оксиды элементов периода 3 можно получить, просто сжигая их в присутствии кислорода, за исключением элементов аргона и хлора. Аргон является благородным газом и не реагирует с кислородом, а хлор образует неустойчивые оксиды.
Ссылка:- https://en.wikibooks.org/wiki/A-level_Chemistry/AQA/Module_5/Periodicity
- https://chem.libretexts.org/Core/Inorganic_Chemistry/Descriptive_Chemistry/
Elements_Organized_by_Period/Period_3_Elements/Reactions_of_Period_3_Elements
Оксиды периода 3: элементы и свойства
Промышленное стекло содержит около 70% диоксида кремния и 15% оксида натрия. Эти два оксида являются обычными примерами оксидов периода 3 , которые образуются в результате реакции между элементом периода 3 и кислородом.
- Эта статья о периоде 3 оксидов в неорганической химии.
- Начнем с рассмотрения склеивание в период 3 оксида.
- Затем мы увидим, как это влияет на некоторые их свойства, такие как температура плавления и электропроводность , а также степень окисления .
- После этого мы рассмотрим их реакции с водой, кислотами и основаниями . Это потребует рассмотрения их кислотно-щелочного поведения .
- Наконец, мы также исследуем некоторые другие соединения периода 3, а именно гидроксиды периода 3 и хлориды .
Связывание в оксидах периода 3
Для начала рассмотрим связывание оксидов периода 3. Это поможет нам понять, когда мы будем исследовать свойства и реакции оксидов периода 3 позже.
Существует множество различных оксидов 3-го периода, но в этой статье мы ограничим наше исследование только Na 2 O, MgO, Al 2 O 3 , SiO 2 , P 4 O 3 10 , СО 2 и SO 3 . Чтобы упростить жизнь, мы разделили их на две группы: оксиды металлов (Na 2 O, MgO и Al 2 O 3 ) и оксиды неметаллов (SiO 2 , P 4). O 10 , SO 2 и SO 3 ).
Чтобы упростить жизнь, мы разделили их на две группы: оксиды металлов (Na 2 O, MgO и Al 2 O 3 ) и оксиды неметаллов (SiO 2 , P 4). O 10 , SO 2 и SO 3 ).
Если вы хотите узнать, как образуются эти оксиды, посмотрите «Элементы периода 3», чтобы узнать о различных реакциях.
Обычно при движении слева направо по периоду количество связей в оксидах периода 3 меняется с ионная от до ковалентная . Это связано с разницей электроотрицательности между элементом периода 3 и кислородом.
Оксиды металлов
Na 2 O и MgO являются ионными соединениями . Это происходит потому, что между металлом и кислородом существует большая разница в электроотрицательности . Они состоят из гигантских решеток чередующихся положительных ионов металлов и отрицательных ионов кислорода.
Ал 2 О 3 также является ионным, но отображает ковалентный символ . Хотя разница электроотрицательностей между алюминием и кислородом достаточно велика для переноса электронов, образующих ионную связь, ион алюминия довольно мал и имеет высокую плотность заряда . Это означает, что он частично способен притягивать одну из пар электронов иона кислорода, искажая электронное облако иона кислорода. Электронная пара начинает действовать как общих пар электронов 9.0008 .
Оксиды неметаллов
SiO 2 представляет собой гигантскую ковалентную макромолекулу . Разница в электроотрицательности между кремнием и кислородом не так уж велика, поэтому SiO 2 связывает ковалентно . Он состоит из гигантских решеток из атомов кремния и кислорода, соединенных ковалентными связями.
P 4 O 10 , SO 2 и SO 3 также связаны ковалентно. Однако они образуют простых ковалентных молекул вместо гигантской ковалентной макромолекулы.
Однако они образуют простых ковалентных молекул вместо гигантской ковалентной макромолекулы.
Рис. 1 – Электроотрицательность в периодической таблице
Свойства оксидов периода 3
Далее посмотрим, как структура и связи оксидов периода 3 влияют на их свойства. В частности, мы сосредоточимся на температуре плавления и электрической проводимости
. Мы также рассмотрим степень окисления .Температура плавления оксидов периода 3
Оксиды металлов периода 3 имеют высокая температура плавления , в то время как простые ковалентные оксиды имеют низкую температуру плавления . Однако гигантская макромолекула SiO 2 имеет очень высокую температуру плавления .
Оксиды металлов
Na 2 O, MgO и Al 2 O 3 имеют высоких температур плавления . Это связано с тем, что они представляют собой ионные соединения , удерживаемые вместе в виде твердого тела сильным электростатическим притяжением между их положительными ионами металлов и отрицательными ионами кислорода.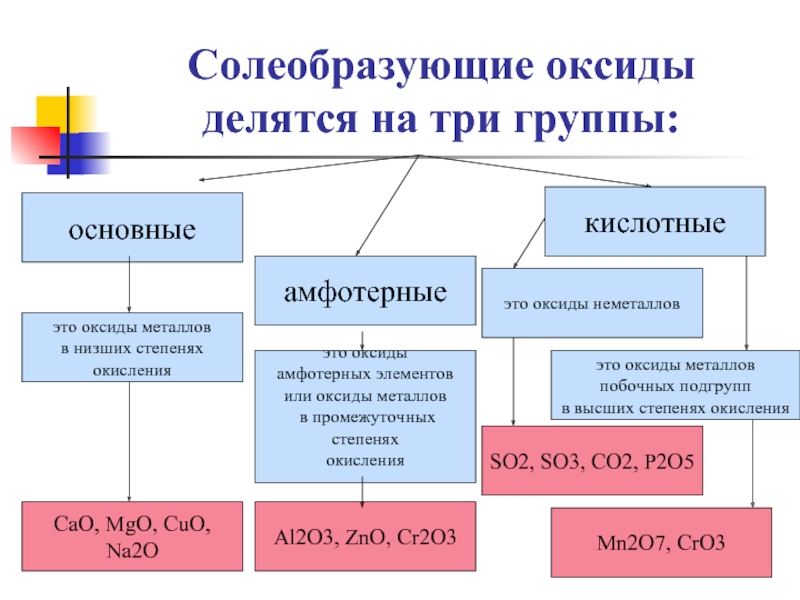 MgO и Al 2 O 3 имеют более высокую температуру плавления, чем Na 2 O, потому что они содержат ионы металлов с более высоким зарядом .
MgO и Al 2 O 3 имеют более высокую температуру плавления, чем Na 2 O, потому что они содержат ионы металлов с более высоким зарядом .
Оксиды неметаллов
SiO 2 имеет очень высокую температуру плавления , потому что это гигантская ковалентная макромолекула . Он состоит из решетки атомов кремния и кислорода, вытянутых во всех направлениях, скрепленных прочными ковалентными связями . Плавление SiO 2 связано с преодолением этих ковалентных связей, что требует много энергии.
P 4 O 10 , SO 2 и SO 3 имеют низких температур плавления . Это потому, что они представляют собой простых ковалентных молекул . Хотя внутри молекул существуют прочные ковалентные связи , единственными силами, удерживающими молекулы вместе как твердое тело, являются слабые межмолекулярные силы , для преодоления которых не требуется много энергии. P 4 O 10 имеет более высокую температуру плавления, чем SO 3 , который, в свою очередь, имеет более высокую температуру плавления, чем SO 2 из-за того, что это более крупная молекула .
P 4 O 10 имеет более высокую температуру плавления, чем SO 3 , который, в свою очередь, имеет более высокую температуру плавления, чем SO 2 из-за того, что это более крупная молекула .
Ознакомьтесь с разделом «Физические свойства склеивания», чтобы узнать больше по этой теме.
Электропроводность
В твердом состоянии ни один из оксидов периода 3 не может проводить электричество . Однако это меняется в других состояниях.
Оксиды металлов
Оксиды металлов периода 3 (Na 2 O, MgO и Al 2 O 3 ) могут проводить электричество, когда расплавленный или водный . Помните, что оксиды металлов состоят из ионной решетки положительных ионов металлов и отрицательных ионов кислорода. В твердом теле эти ионы прочно удерживаются на месте сильным электростатическим притяжением , и поэтому нет свободных заряженных частиц, которые могли бы свободно перемещаться. Однако в расплавленном или водном состоянии часть электростатического притяжения преодолевается, и ионы могут перемещаться и нести заряд .
Однако в расплавленном или водном состоянии часть электростатического притяжения преодолевается, и ионы могут перемещаться и нести заряд .
Оксиды неметаллов
Оксиды неметаллов периода 3 (SiO 2 , P 4 O 10 , SO 2 и SO 3 ) не могут проводить электричество в любом состоянии . Это потому, что они не содержат заряженных частиц, которые могут нести заряд.
Степень окисления
Теперь давайте попробуем вычислить степеней окисления оксидов периода 3.
Степени окисления , также известные как степени окисления , показывают количество электронов, которое элемент должен потерять или получить по сравнению с его несвязанным состоянием.
Ранее в этой статье мы рассмотрели относительную электроотрицательность кислорода и элементов периода 3. Кислород более электроотрицателен, чем все они. Это означает, что когда дело доходит до оксидов периода 3, кислород всегда принимает более низкую степень окисления . В частности, он всегда принимает степень окисления -2. Сумма степеней окисления в нейтральном соединении всегда равна нулю , поэтому, используя это знание, мы можем вычислить степени окисления соответствующего элемента периода 3. Эта таблица должна помочь:
В частности, он всегда принимает степень окисления -2. Сумма степеней окисления в нейтральном соединении всегда равна нулю , поэтому, используя это знание, мы можем вычислить степени окисления соответствующего элемента периода 3. Эта таблица должна помочь:
Рис. 2 – Степени окисления оксидов периода 3
Реакции оксидов периода 3
Оксиды периода 3 имеют одну общую черту: все они содержат кислород. Однако это не означает, что они реагируют одинаково. В следующем разделе мы рассмотрим, как оксиды периода 3 реагируют с кислородом , кислотами, и основаниями . Это предполагает рассмотрение их кислотно-щелочной природы .
Кислота является донором протонов, , в то время как основание является акцептор протонов .
Перейдите к разделу «Кислоты и щелочи», если вы впервые освещаете такого рода соединения.
Оксиды металлов в левой части периода 3 имеют тенденцию быть основными по своей природе, а оксиды неметаллов кислотными . Al 2 O 3 находится посередине и является амфотерным .
Al 2 O 3 находится посередине и является амфотерным .
Реакции оксидов периода 3 с водой
Обычно оксиды металлов периода 3 являются основными по своей природе. Это означает, что они реагируют с водой с образованием гидроксид , образующий основной раствор. С другой стороны, оксиды неметаллов периода 3 являются кислотными по своей природе. Они реагируют с водой с образованием кислоты .
Оксиды металлов
Na 2 O и MgO реагируют с водой с образованием гидроксидов . Они делают это из-за их ионной связи. Они содержат сильноосновных оксидных ионов (O 2 — ) благодаря большой разнице электроотрицательностей между металлом и кислородом. Ион кислорода может принять ион водорода из раствора, действуя как основание.
- Na 2 O реагирует с водой с образованием NaOH, который диссоциирует на ионы Na + и OH — .

- MgO реагирует с водой с образованием Mg(OH) 2 , который малорастворим и частично диссоциирует на ионы Mg 2+ и OH — .
Вот уравнения:
$$ Na_2O(тв)+H_2O(ж)\rightarrow 2NaOH(вод) $$
$$ MgO(тв)+H_2O(ж)\rightarrow Mg(OH)_2( aq) $$
С другой стороны, Al 2 O 3 является нерастворимым в воде и, следовательно, никак не реагирует.
Оксиды неметаллов
P 4 O 10 , SO 2 и SO 3 реагируют с водой с образованием кислот . Поскольку они связаны ковалентно, они не содержат ионов кислорода и поэтому не могут действовать как основания. Вместо этого они могут отдавать ион водорода в растворе, что означает, что они действуют как кислота.
- P 4 O 10 реагирует с водой с образованием H 3 PO 4 , который частично диссоциирует на ионы H + и H 2 PO 4 — .

- SO 2 реагирует с водой с образованием H 2 SO 3 (сера ous кислота), которая частично диссоциирует на H + и HSO 3 — ионы.
- SO 3 реагирует с водой с образованием H 2 SO 4 (сера ic кислота), которая полностью диссоциирует на H + и HSO 4 — ионы.
Вам необходимо знать уравнения:
$$ P_4O_{10}(s)+6H_2O(l)\rightarrow 4H_3PO_4(aq) $$
$$ SO_2(g)+H_2O(l)\ rightarrow H_2SO_3(водн.) $$
$$ SO_3(г) + H_2O(л)\rightarrow H_2SO_4(водн.) $$
Подобно Al 2 O 3 , SiO 2 нерастворим в воде. В воде никак не прореагирует.
Не путайте серосодержащие кислоты. Вот структуры сернистой кислоты, H 2 SO 3 и серная кислота, H 2 SO 4 . Рис. 3. Сернистая и серная кислоты Они, следовательно, реагируют с кислотами . Напротив, оксиды неметаллов периода 3 являются кислыми по своей природе и поэтому реагируют с основаниями. Al 2 O 3 находится между двумя группами и равен амфотерный в природе.
Напротив, оксиды неметаллов периода 3 являются кислыми по своей природе и поэтому реагируют с основаниями. Al 2 O 3 находится между двумя группами и равен амфотерный в природе.
Оксиды металлов
Na 2 O и MgO действуют как основания , реагируя с кислотами с образованием соли и воды. Это потому, что они связывают ионно . Например:
- Реакция Na 2 O с HCl дает NaCl и H 2 O.
- Реакция MgO с HCl дает MgCl 2 и H 2 O.
Уравнения показаны ниже:
$$ Na_2O(S+2HCl(водн.)\rightarrow 2NaCl(водн.)+H_2O(л) $$
$$ MgO(т)+2HCl(водн.)\rightarrow MgCl_2(водн.)+H_2O(ж) $ $
Al 2 O 3 немного отличается – это амфотерный . Это означает, что он может вести себя как как кислота, так и основание .
 Как и другие оксиды металлов периода 3, он действует как основание на реагирует с кислотой с образованием соли и воды благодаря своей ионной связи . Здесь ион алюминия имеет положительный заряд. Но он также может действовать как кислота на , реагируя с основаниями , благодаря своему ковалентному характеру . В этом случае мы образуем алюминат , соединение, в котором ион алюминия имеет отрицательный заряд . Например:
Как и другие оксиды металлов периода 3, он действует как основание на реагирует с кислотой с образованием соли и воды благодаря своей ионной связи . Здесь ион алюминия имеет положительный заряд. Но он также может действовать как кислота на , реагируя с основаниями , благодаря своему ковалентному характеру . В этом случае мы образуем алюминат , соединение, в котором ион алюминия имеет отрицательный заряд . Например:- Реагирование AL 2 O 3 с HCL, продуцирующим ALCL 3 и H 2 O.
- , реагируя AL 2 O 3
- с Al 2 O 3
- . условия, одним из которых может быть NaAl(OH) 4 . Уравнения: l)+2NaAl(OH)_4(aq) $$
и SO 9070 0 8 действуют как кислоты путем реакции с основаниями с образованием соли и воды.Оксиды неметаллов
SiO 2 , P 4 O 10 , SO 2 , SO 9070 0 8
 Это потому, что они связывают ковалентно . Например:
Это потому, что они связывают ковалентно . Например:- Взаимодействие SiO 2 с NaOH дает NaSiO 3 и H 2 O. Он производит смесь солей, включая Na 3 PO 4 , а также H 2 O.
- Реакция SO 2 с NaOH аналогична реакции сернистой кислоты с NaOH. В целом он производит Na 2 SO 3 и H 2 O.
- Реакция SO 3 с NaOH аналогична реакции серной кислоты с NaOH. В целом он производит Na 2 SO 4 и H 2 O.
И снова мы предоставили вам уравнения:
$$ SiO_2(s)+2NaOH(aq)\rightarrow Na_2SiO_3 (водн.)+H_2O(ж) $$
$$ P_4O_{10}(т)+12NaOH(водн.)\rightarrow 4Na_3PO_4(водн.)+6H_2O $$
$$ SO_2(г)+2NaOH(водн.)\ rightarrow Na_2SO_3(водн.)+H_2O(л) $$
$$ SO_3(г)+2NaOH(водн.)\rightarrow Na_2SO_4(водн.)+H_2O(ж) $$
Сводка реакций оксидов периода 3
В завершение этого раздела приведем полезную таблицу, резюмирующую реакции оксидов периода 3 и их кислотно-основную природу.

Рис. 4 – Реакции оксидов периода 3
Гидроксиды периода 3
Другой тип соединения периода 3, о котором вам может понадобиться знать, это гидроксиды периода 3 . В этом разделе мы рассмотрим реакции трех гидроксидов периода 3 – NaOH, Mg(OH) 2 и Al(OH) 3 – с кислотами и основаниями .
Проверьте, подпадают ли гидроксиды периода 3 под действие вашей спецификации .
Реакция с кислотами и основаниями
И NaOH, и Mg(OH) 2 действуют как типичные основания . Они реагируют с кислотами с образованием соли и воды. Например:
- Реакция NaOH с HCl дает NaCl и H 2 O.
- Реакция Mg(OH) 2 с HCl дает MgCl 2 и H 2 O.
Вот уравнения:
$$ NaOH(вод)+HCl(вод)\rightarrow NaCl(вод)+H_2O(ж) $$
$$ Mg( OH)_2(водн.
 )+2HCl(водн.)\rightarrow MgCl_2(водн.)+2H_2O(л) $$
)+2HCl(водн.)\rightarrow MgCl_2(водн.)+2H_2O(л) $$Al(OH) 3 ведет себя немного иначе – он амфотерный . Он действует как основание , реагируя с кислотой с образованием соли и воды. Но он также действует как кислота , реагируя с основаниями с образованием алюминат . Например:
- Реакция Al(OH) 3 с HCl дает AlCl 3 и H 2 O.
- Реакция Al(OH) 3 с NaOH дает NaAl(OH) 4 9017.
Уравнения для этих реакций приведены ниже:
$$ Al(OH)_3(водн.)+2HCl(водн.)\rightarrow AlCl_3(водн.)+ 3H_2O(ж) $$
$$ Al(OH)_3 (водн.)+NaOH_(водн.)\rightarrow NaAl(OH)_4(водн.) $$
Хлориды периода 3
Последнее, что у нас сегодня на повестке дня, это хлориды периода 3. Мы посмотрим на их температуры плавления , степень окисления и их реакция с водой .

Точка плавления
Обычно хлориды металлов периода 3 имеют высоких температур плавления , а хлориды неметаллов периода 3 имеют низких температур плавления . AlCl 3 является аномалией – несмотря на то, что он является хлоридом металла, он имеет низкую температуру плавления .
Хлориды металлов
Как NaCl, так и MgCl 2 имеют высокие температуры плавления . Это потому, что они представляют собой ионных соединений . Благодаря большой разнице в электроотрицательности между металлом и хлором они способны связываться ионно , а твердое тело удерживается сильным электростатическим притяжением между противоположно заряженными ионами.
AlCl 3 немного отличается. При комнатной температуре и давлении он ионно связывает с , поэтому можно ожидать, что он будет иметь высокую температуру плавления.
 Но при повышении температуры он превращается из ионной решетки в простой Al 2 Cl 6 молекулы, которые со временем распадаются на более мелкие молекулы AlCl 3 . Это оба примера простых ковалентных молекул . Они удерживаются вместе как твердое тело за счет слабых межмолекулярных сил , для преодоления которых не требуется много энергии, поэтому AlCl 3 на самом деле имеет низкую температуру плавления .
Но при повышении температуры он превращается из ионной решетки в простой Al 2 Cl 6 молекулы, которые со временем распадаются на более мелкие молекулы AlCl 3 . Это оба примера простых ковалентных молекул . Они удерживаются вместе как твердое тело за счет слабых межмолекулярных сил , для преодоления которых не требуется много энергии, поэтому AlCl 3 на самом деле имеет низкую температуру плавления .Хлориды неметаллов
SiCl 4 , PCl 5 , SCl 2 и S 2 Cl 2 все имеют низкую температуру плавления . Это потому, что они представляют собой простых ковалентных молекул . Единственными силами, удерживающими их вместе как твердое тело, являются слабые межмолекулярные силы , для преодоления которых не требуется много энергии.
Степень окисления
Во всех хлоридах периода 3 хлор принимает отрицательную степень окисления -1.
 Это потому, что он на более электроотрицательный , чем элемент периода 3, с которым он связан. Сумма степеней окисления атомов в нейтральном соединении всегда равна нулю , и из этого вы можете определить степень окисления элемента периода 3. Запомнить довольно просто – за исключением SCl 2 и S 2 Cl 2 степень окисления соответствует номеру группы элемента. В следующей таблице собрана информация для вас.
Это потому, что он на более электроотрицательный , чем элемент периода 3, с которым он связан. Сумма степеней окисления атомов в нейтральном соединении всегда равна нулю , и из этого вы можете определить степень окисления элемента периода 3. Запомнить довольно просто – за исключением SCl 2 и S 2 Cl 2 степень окисления соответствует номеру группы элемента. В следующей таблице собрана информация для вас.Рис. 5. Степени окисления хлоридов периода 3
Реакция с водой
Наконец, мы исследуем реакций хлоридов периода 3 с водой , включая анализ рН образовавшегося раствора. Обычно хлориды металлов просто растворяются в воде , тогда как хлориды неметаллов реагируют более энергично . Опять же, AlCl 3 противоречит тенденции, реагируя как хлорид неметалла.
Хлориды металлов
NaCl и MgCl 2 оба растворяются в воде .
 Они делают это благодаря своей ионной связи . NaCl образует нейтральный раствор ионов Na + и Cl — с pH 7 , а MgCl 2 образует слегка кислый раствор Mg 2+ и Cl с 07 pH около 0 ионов 6 .
Они делают это благодаря своей ионной связи . NaCl образует нейтральный раствор ионов Na + и Cl — с pH 7 , а MgCl 2 образует слегка кислый раствор Mg 2+ и Cl с 07 pH около 0 ионов 6 .AlCl 3 действует иначе благодаря своему ковалентному характеру . Он реагирует с водой с образованием кислого раствора с pH около 3 , выделяя пары HCl .
Хлориды неметаллов
Другие хлориды неметаллов реагируют так же, как AlCl 3 , благодаря их ковалентным связям . Они реагируют с водой с образованием кислых растворов , каждый из которых имеет рН около 2 . Все реакции выделяют паровые пары HCl .
Существуют четкие тенденции во всех различных свойствах и реакциях.
 Знание некоторых ключевых фактов, таких как тип связи, присутствующей в каждом соединении, должно помочь вам, когда речь идет об оксидах, гидроксидах и хлоридах периода 3.
Знание некоторых ключевых фактов, таких как тип связи, присутствующей в каждом соединении, должно помочь вам, когда речь идет об оксидах, гидроксидах и хлоридах периода 3.Оксиды периода 3 – Ключевые выводы
- Оксиды периода 3 представляют собой соединения, состоящие из элемента периода 3 и кислорода .
- Связывание в оксидах периода 3 меняется с ионных на ковалентных по мере продвижения по периоду. Оксиды металлов имеют тенденцию быть ионными , в то время как оксиды неметаллов являются ковалентными . Оксид металла Al 2 O 3 является ионным, но имеет ковалентный характер .
- Оксиды металлов периода 3 обычно имеют высоких температур плавления , в то время как оксиды неметаллов имеют низких температур плавления . Оксид неметалла SiO 2 представляет собой гигантскую ковалентную макромолекулу и имеет очень высокую температуру плавления.

- с Al 2 O 3

 09
09