Газ хлор, физические свойства хлора, химические свойства хлора.
ПродажаПроизводствоДоставка
Хлор (от греч. χλωρ?ς — «зелёный») — элемент главной подгруппы седьмой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 17. Обозначается символом Cl (лат. Chlorum). Химически активный неметалл. Входит в группу галогенов (первоначально название «галоген» использовал немецкий химик Швейгер для хлора [дословно «галоген» переводится как солерод], но оно не прижилось, и впоследствии стало общим для VII группы элементов, в которую входит и хлор[2]).
Простое вещество хлор (CAS-номер: 7782-50-5) при нормальных условиях — ядовитый газ желтовато-зелёного цвета, с резким запахом. Молекула хлора двухатомная (формула Cl2).
История открытия хлораВпервые газообразный безводный хлороводород собрал Дж. Присли в 1772г. (над жидкой ртутью). Впервые хлор был получен в 1774 г. Шееле, описавшим его выделение при взаимодействии пиролюзита с соляной кислотой в своём трактате о пиролюзите:
(над жидкой ртутью). Впервые хлор был получен в 1774 г. Шееле, описавшим его выделение при взаимодействии пиролюзита с соляной кислотой в своём трактате о пиролюзите:
- 4HCl + MnO2 = Cl2 + MnCl2 + 2H2O
Шееле отметил запах хлора, схожий с запахом царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойства.
Однако Шееле, в соответствии с господствовавшей в химии того времени теории флогистона, предположил, что хлор представляет собой дефлогистированную соляную кислоту, то есть оксид соляной кислоты. Бертолле и Лавуазье предположили, что хлор является оксидом элемента мурия, однако попытки его выделения оставались безуспешными вплоть до работ Дэви, которому электролизом удалось разложить поваренную соль на натрий и хлор.
Распространение в природеВ природе встречаются два изотопа хлора 35Cl и 37Cl. В земной коре хлор самый распространённый галоген. Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы. Поэтому в природе он встречается только в виде соединений в составе минералов: галита NaCI, сильвина KCl, сильвинита KCl · NaCl, бишофита MgCl2 · 6h3O, карналлита KCl · MgCl2 · 6Н2O, каинита KCl · MgSO4 · 3Н2О. Самые большие запасы хлора содержатся в составе солей вод морей и океанов (содержание в морской воде 19 г/л[3]). На долю хлора приходится 0,025 % от общего числа атомов земной коры, кларковое число хлора — 0,017 %, а человеческий организм содержит 0,25 % ионов хлора по массе. В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.
Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы. Поэтому в природе он встречается только в виде соединений в составе минералов: галита NaCI, сильвина KCl, сильвинита KCl · NaCl, бишофита MgCl2 · 6h3O, карналлита KCl · MgCl2 · 6Н2O, каинита KCl · MgSO4 · 3Н2О. Самые большие запасы хлора содержатся в составе солей вод морей и океанов (содержание в морской воде 19 г/л[3]). На долю хлора приходится 0,025 % от общего числа атомов земной коры, кларковое число хлора — 0,017 %, а человеческий организм содержит 0,25 % ионов хлора по массе. В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.
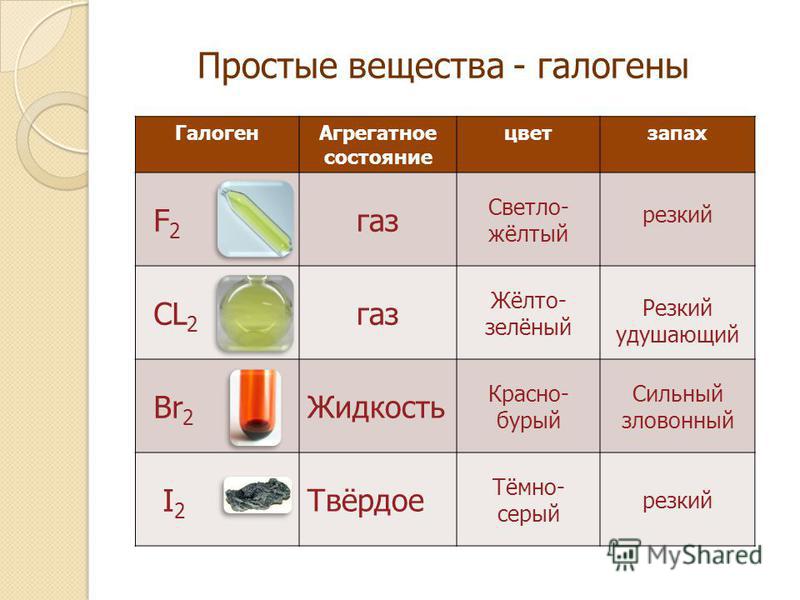
При нормальных условиях хлор — жёлто-зелёный газ с удушающим запахом.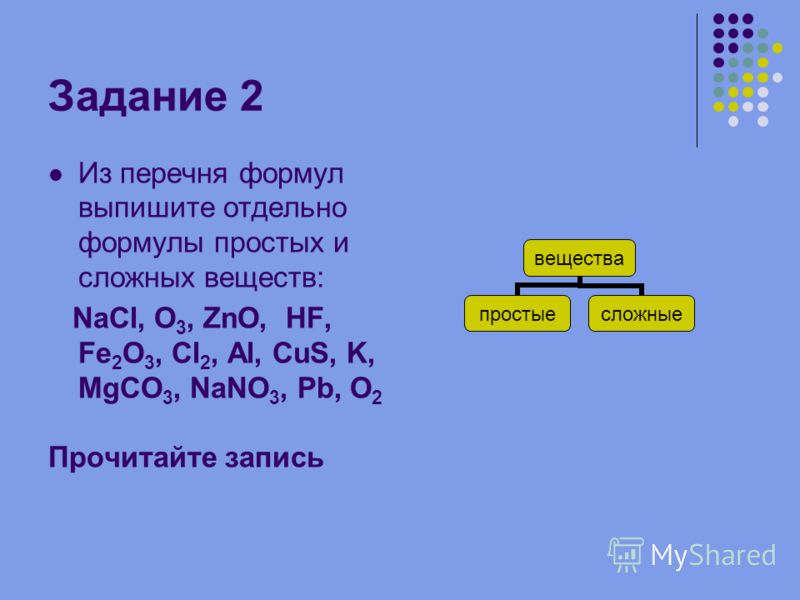 Некоторые его физические свойства представлены в таблице.
Некоторые его физические свойства представлены в таблице.
Некоторые физические свойства хлора
| Свойство |
Значение |
|---|---|
| Цвет (газ) | Жёлто-зелёный |
| Температура кипения | −34 °C |
| Температура плавления | −100 °C |
| Температура разложения (диссоциации на атомы) |
~1400 °C |
| Плотность (газ, н.у.) | 3,214 г/л |
| Сродство к электрону атома | 3,65 эВ |
| Первая энергия ионизации | 12,97 эВ |
| Теплоемкость (298 К, газ) | 34,94 (Дж/моль·K) |
| Критическая температура | 144 °C |
| Критическое давление | 76 атм |
| Стандартная энтальпия образования (298 К, газ) | 0 (кДж/моль) |
| Стандартная энтропия образования (298 К, газ) | 222,9 (Дж/моль·K) |
| Энтальпия плавления | 6,406 (кДж/моль) |
| Энтальпия кипения | 20,41 (кДж/моль) |
| Энергия гомолитического разрыва связи Х-Х | 243 (кДж/моль) |
| Энергия гетеролитического разрыва связи Х-Х | 1150 (кДж/моль) |
| Энергия ионизациии | 1255 (кДж/моль) |
| Энергия сродства к электрону | 349 (кДж/моль) |
| Атомный радиус | 0,073 (нм) |
| Электроотрицательность по Полингу | 3,20 |
| Электроотрицательность по Оллреду-Рохову | 2,83 |
| Устойчивые степени окисления | -1, 0, +1, +3, (+4), +5, (+6), +7 |
Газообразный хлор относительно легко сжижается. Начиная с давления в 0,8 МПа (8 атмосфер), хлор будет жидким уже при комнатной температуре. При охлаждении до температуры в −34 °C хлор тоже становится жидким при нормальном атмосферном давлении. Жидкий хлор — жёлто-зелёная жидкость, обладающая очень высоким коррозионным действием (за счёт высокой концентрации молекул). Повышая давление, можно добиться существования жидкого хлора вплоть до температуры в +144 °C (критической температуры) при критическом давлении в 7,6 МПа.
Начиная с давления в 0,8 МПа (8 атмосфер), хлор будет жидким уже при комнатной температуре. При охлаждении до температуры в −34 °C хлор тоже становится жидким при нормальном атмосферном давлении. Жидкий хлор — жёлто-зелёная жидкость, обладающая очень высоким коррозионным действием (за счёт высокой концентрации молекул). Повышая давление, можно добиться существования жидкого хлора вплоть до температуры в +144 °C (критической температуры) при критическом давлении в 7,6 МПа.
При температуре ниже −101 °C жидкий хлор кристаллизуется в орторомбическую решётку с пространственной группой Cmca и параметрами a=6,29 Å b=4,50 Å, c=8,21 Å. Ниже 100 К орторомбическая модификация кристаллического хлора переходит в тетрагональную, имеющую пространственную группу
| Растворитель | Растворимость г/100 г |
|---|---|
| Бензол | Растворим |
| Вода[8] (0 °C) | 1,48 |
| Вода (20 °C) | 0,96 |
| Вода (25 °C) | 0,65 |
| Вода (40 °C) | 0,46 |
| Вода (60 °C) | 0,38 |
| Вода (80 °C) | 0,22 |
| Тетрахлорметан (0 °C) | 31,4 |
| Тетрахлорметан (19 °C) | 17,61 |
| Тетрахлорметан (40 °C) | 11 |
| Хлороформ | Хорошо растворим |
| TiCl4, SiCl4, SnCl4 | Растворим |
Степень диссоциации молекулы хлора Cl 2 → 2Cl. При 1000 К равна 2,07×10−4%, а при 2500 К 0,909 %.
При 1000 К равна 2,07×10−4%, а при 2500 К 0,909 %.
Порог восприятия запаха в воздухе равен 0,003 (мг/л).
По электропроводности жидкий хлор занимает место среди самых сильных изоляторов: он проводит ток почти в миллиард раз хуже, чем дистиллированная вода, и в 1022 раз хуже серебра. Скорость звука в хлоре примерно в полтора раза меньше, чем в воздухе.
Химические свойстваСтроение электронной оболочкиНа валентном уровне атома хлора содержится 1 неспаренный электрон: 1s2 2s2 2p6 3s2 3p5, поэтому валентность равная 1 для атома хлора очень стабильна. За счёт присутствия в атоме хлора незанятой орбитали d-подуровня, атом хлора может проявлять и другие валентности. Схема образования возбуждённых состояний атома:
| Валентность | Возможные степени окисления | Электронное состояние валентного уровня | Пример соединений |
|---|---|---|---|
| I | +1, −1 | 3s2 3p5 | NaCl, NaClO |
| III | +3 | 3s2 3p4 3d1 | NaClO2 |
| V | +5 | 3s2 3p3 3d2 | KClO3 |
| VII | +7 | 3s1 3p3 3d3 | KClO4 |
Также известны соединения хлора, в которых атом хлора формально проявляет валентность 4 и 6, например ClO2 и Cl2O6. Однако, эти соединения являются радикалами, то есть у них есть один неспаренный электрон.
Однако, эти соединения являются радикалами, то есть у них есть один неспаренный электрон.
Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании):
- Cl2 + 2Na → 2NaCl
- 3Cl2 + 2Sb → 2SbCl3
- 3Cl2 + 2Fe → 2FeCl3
C неметаллами (кроме углерода, азота, кислорода и инертных газов), образует соответствующие хлориды.
На свету или при нагревании активно реагирует (иногда со взрывом) с водородом по радикальному механизму. Смеси хлора с водородом, содержащие от 5,8 до 88,3 % водорода, взрываются при облучении с образованиемхлороводорода. Смесь хлора с водородом в небольших концентрациях горит бесцветным или желто-зелёным пламенем. Максимальная температура водородно-хлорного пламени 2200 °C.:
- Cl2 + H2 → 2HCl
- 5Cl2 + 2P → 2PCl5
- 2S + Cl2 → S2Cl2
С кислородом хлор образует оксиды в которых он проявляет степень окисления от +1 до +7: Cl2O, ClO2, Cl2O6, Cl2O7. Они имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду.
Они имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду.
При реакции с фтором, образуется не хлорид, а фторид:
- Cl2 + 3F2 (изб.) → 2ClF3
Хлор вытесняет бром и иод из их соединений с водородом и металлами:
- Cl2 + 2HBr → Br2 + 2HCl
- Cl2 + 2NaI → I2 + 2NaCl
При реакции с монооксидом углерода образуется фосген:
- Cl2 + CO → COCl2
При растворении в воде или щелочах, хлор дисмутирует, образуя хлорноватистую (а при нагревании хлорную) и соляную кислоты, либо их соли:
- Cl2 + H2O → HCl + HClO
- 3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O
Хлорированием сухого гидроксида кальция получают хлорную известь:
- Cl2 + Ca(OH)2 → CaCl(OCl) + H2O
Действие хлора на аммиак можно получить трёххлористый азот:
- 4NH3 + 3Cl2 → NCl3 + 3NH4Cl
Хлор очень сильный окислитель.
- Cl2 + H2S → 2HCl + S
С насыщенными соединениями:
- CH3-CH3 + Cl2 → C2H5Cl + HCl
Присоединяется к ненасыщенным соединениям по кратным связям:
- CH2=CH2 + Cl2 → Cl-CH2-CH2-Cl
Ароматические соединения замещают атом водорода на хлор в присутствии катализаторов (например, AlCl3 или FeCl3):
- C6H6 + Cl2 → C6H5Cl + HCl
Первоначально промышленный способ получения хлора основывался на методе Шееле, то есть реакции пиролюзита с соляной кислотой:
- MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
В 1867 году Диконом был разработан метод получения хлора каталитическим окислением хлороводорода кислородом воздуха. Процесс Дикона в настоящее время используется при рекуперации хлора из хлороводорода, являющегося побочным продуктом при промышленном хлорировании органических соединений.
Процесс Дикона в настоящее время используется при рекуперации хлора из хлороводорода, являющегося побочным продуктом при промышленном хлорировании органических соединений.
- 4HCl + O2 → 2H2O + 2Cl2
Сегодня хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза раствора поваренной соли:
- 2NaCl + 2H2О → H2↑ + Cl2↑ + 2NaOH
- Анод: 2Cl− — 2е− → Cl20↑
- Катод: 2H2O + 2e− → H2↑ + 2OH−
Так как параллельно электролизу хлорида натрия проходит процесс электролиз воды, то суммарное уравнение можно выразить следующим образом:
- 1,80 NaCl + 0,50 H2O → 1,00 Cl2↑ + 1,10 NaOH + 0,03 H2↑
Применяется три варианта электрохимического метода получения хлора. Два из них электролиз с твердым катодом: диафрагменный и мембранный методы, третий — электролиз с жидким ртутным катодом (ртутный метод производства). В ряду электрохимических методов производства самым легким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути.
В ряду электрохимических методов производства самым легким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути.
Полость электролизера разделена пористой асбестовой перегородкой — диафрагмой — на катодное и анодное пространство, где соответственно размещены катод и анод электролизёра. Поэтому такой электролизёр часто называют диафрагменным, а метод получения — диафрагменным электролизом. В анодное пространство диафрагменного электролизёра непрерывно поступает поток насыщенного анолита (раствора NaCl). В результате электрохимического процесса на аноде за счёт разложения галита выделяется хлор, а на катоде за счёт разложения воды — водород. При этом прикатодная зона обогащается гидроксидом натрия.
Мембранный метод по сути, аналогичен диафрагменному, но анодное и катодное пространства разделены катионообменной полимерной мембраной. Мембранный метод производства эффективнее, чем диафрагменный, но сложнее в применении.
Мембранный метод производства эффективнее, чем диафрагменный, но сложнее в применении.
Процесс проводят в электролитической ванне, которая состоит из электролизера, разлагателя и ртутного насоса, объединённых между собой коммуникациями. В электролитической ванне под действием ртутного насоса циркулирует ртуть, проходя через электролизёр и разлагатель. Катодом электролизёра служит поток ртути. Аноды — графитовые или малоизнашивающиеся. Вместе с ртутью через электролизёр непрерывно течет поток анолита — раствора хлорида натрия. В результате электрохимического разложения хлорида на аноде образуются молекулы хлора, а на катоде выделившийся натрий растворяется в ртути образуя амальгаму.
В лабораториях для получения хлора обычно используют процессы, основанные на окислении хлороводорода сильными окислителями (например, оксидом марганца (IV), перманганатом калия, дихроматом калия):
- 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ +8H2O
- K2Cr2O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2O
Производимый хлор хранится в специальных «танках» или закачивается в стальные баллоны высокого давления. Баллоны с жидким хлором под давлением имеют специальную окраску — болотный цвет. Следует отметить что при длительной эксплуатации баллонов с хлором в них накапливается чрезвычайно взрывчатый треххлористый азот, и поэтому время от времени баллоны с хлором должны проходить плановую промывку и очистку от хлорида азота.
Баллоны с жидким хлором под давлением имеют специальную окраску — болотный цвет. Следует отметить что при длительной эксплуатации баллонов с хлором в них накапливается чрезвычайно взрывчатый треххлористый азот, и поэтому время от времени баллоны с хлором должны проходить плановую промывку и очистку от хлорида азота.
Согласно ГОСТ 6718-93 «Хлор жидкий. Технические условия» производятся следующие сорта хлора
| Наименование показателя ГОСТ 6718-93 | Высший сорт | Первый сорт |
|---|---|---|
| Объемная доля хлора, не менее, % | 99,8 | 99,6 |
| Массовая доля воды, не более, % | 0,01 | 0,04 |
| Массовая доля треххлористого азота, не более, % | 0,002 | 0,004 |
| Массовая доля нелетучего остатка, не более, % | 0,015 | 0,10 |
Применение
Хлор применяют во многих отраслях промышленности, науки и бытовых нужд:
- В производстве поливинилхлорида, пластикатов, синтетического каучука, из которых изготавливают: изоляцию для проводов, оконный профиль, упаковочные материалы, одежду и обувь, линолеум и грампластинки, лаки, аппаратуру и пенопласты, игрушки, детали приборов, строительные материалы.

- Отбеливающие свойства хлора известны с давних времен, хотя не сам хлор «отбеливает», а атомарный кислород, который образуется при распаде хлорноватистой кислоты: Cl2 + H2O → HCl + HClO → 2HCl + O•. Этот способ отбеливания тканей, бумаги, картона используется уже несколько веков.
- Производство хлорорганических инсектицидов — веществ, убивающих вредных для посевов насекомых, но безопасные для растений. На получение средств защиты растений расходуется значительная часть производимого хлора. Один из самых важных инсектицидов — гексахлорциклогексан (часто называемый гексахлораном). Это вещество впервые синтезировано ещё в 1825 г. Фарадеем, но практическое применение нашло только через 100 с лишним лет — в 30-х годах ХХ столетия.
- Использовался как боевое отравляющее вещество, а также для производства других боевых отравляющих веществ: иприт, фосген.

- Для обеззараживания воды — «хлорирования». Наиболее распространённый способ обеззараживания питьевой воды; основан на способности свободного хлора и его соединений угнетать ферментные системы микроорганизмов катализирующие окислительно-восстановительные процессы. Для обеззараживания питьевой воды применяют: хлор, двуокись хлора, хлорамин и хлорную известь. СанПиН 2.1.4.1074-01 [1] устанавливает следующие пределы (коридор)допустимого содержания свободного остаточного хлора в питьевой воде централизованного водоснабжения 0.3 — 0.5 мг/л. Ряд учёных и даже политиков в России критикуют саму концепцию хлорирования водопроводной воды, но альтернативы дезинфицирующему последействию соединений хлора предложить не могут. Материалы, из которых изготовлены водопроводные трубы, по разному взаимодействуют с хлорированной водопроводной водой. Свободный хлор в водопроводной воде существенно сокращает срок службы трубопроводов на основе полиолефинов: полиэтиленовых труб различного вида, в том числе сшитого полиэтилена, большие известного как ПЕКС (PEX, PE-X).

- В пищевой промышленности зарегистрирован в качестве пищевой добавки E925.
- В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов, ядов, лекарств, удобрений.
- В металлургии для производства чистых металлов: титана, олова, тантала, ниобия.
- Как индикатор солнечных нейтрино в хлор-аргонных детекторах.
Многие развитые страны стремятся ограничить использование хлора в быту, в том числе потому, что при сжигании хлорсодержащего мусора образуется значительное количество диоксинов.
Биологическая роль
Хлор относится к важнейшим биогенным элементам и входит в состав всех живых организмов.
У животных и человека, ионы хлора участвуют в поддержании осмотического равновесия, хлорид-ион имеет оптимальный радиус для проникновения черезмембрану клеток. Именно этим объясняется его совместное участие с ионами натрия и калия в создании постоянного осмотического давления и регуляции водно-солевого обмена. Под воздействием ГАМК (нейромедиатор) ионы хлора оказывают тормозящий эффект на нейроны путём снижения потенциала действия. Вжелудке ионы хлора создают благоприятную среду для действия протеолитических ферментов желудочного сока. Хлорные каналы представлены во многих типах клеток, митохондриальных мембранах и скелетных мышцах. Эти каналы выполняют важные функции в регуляции объёма жидкости, трансэпителиальном транспорте ионов и стабилизации мембранных потенциалов, участвуют в поддержании рН клеток. Хлор накапливается в висцеральной ткани, коже и скелетных мышцах. Всасывается хлор, в основном, в толстом кишечнике. Всасывание и экскреция хлора тесно связаны с ионами натрия и бикарбонатами, в меньшей степени с минералокортикоидами и активностью Na+/K+ — АТФ-азы. В клетках аккумулируется 10-15 % всего хлора, из этого количества от 1/3 до 1/2 — в эритроцитах. Около 85 % хлора находятся во внеклеточном пространстве. Хлор выводится из организма в основном с мочой (90-95 %), калом (4-8 %) и через кожу (до 2 %). Экскреция хлора связана с ионами натрия и калия, и реципрокно с HCO3− (кислотно-щелочной баланс).
Всасывается хлор, в основном, в толстом кишечнике. Всасывание и экскреция хлора тесно связаны с ионами натрия и бикарбонатами, в меньшей степени с минералокортикоидами и активностью Na+/K+ — АТФ-азы. В клетках аккумулируется 10-15 % всего хлора, из этого количества от 1/3 до 1/2 — в эритроцитах. Около 85 % хлора находятся во внеклеточном пространстве. Хлор выводится из организма в основном с мочой (90-95 %), калом (4-8 %) и через кожу (до 2 %). Экскреция хлора связана с ионами натрия и калия, и реципрокно с HCO3− (кислотно-щелочной баланс).
Человек потребляет 5-10 г NaCl в сутки. Минимальная потребность человека в хлоре составляет около 800 мг в сутки. Младенец получает необходимое количество хлора через молоко матери, в котором содержится 11 ммоль/л хлора. NaCl необходим для выработки в желудке соляной кислоты, которая способствует пищеварению и уничтожению болезнетворных бактерий. В настоящее время участие хлора в возникновении отдельных заболеваний у человека изучено недостаточно хорошо, главным образом из-за малого количества исследований. Достаточно сказать, что не разработаны даже рекомендации по норме суточного потребления хлора. Мышечная ткань человека содержит 0,20-0,52 % хлора, костная — 0,09 %; в крови — 2,89 г/л. В организме среднего человека (масса тела 70 кг) 95 г хлора. Ежедневно с пищей человек получает 3-6 г хлора, что с избытком покрывает потребность в этом элементе.
Достаточно сказать, что не разработаны даже рекомендации по норме суточного потребления хлора. Мышечная ткань человека содержит 0,20-0,52 % хлора, костная — 0,09 %; в крови — 2,89 г/л. В организме среднего человека (масса тела 70 кг) 95 г хлора. Ежедневно с пищей человек получает 3-6 г хлора, что с избытком покрывает потребность в этом элементе.
Ионы хлора жизненно необходимы растениям. Хлор участвует в энергетическом обмене у растений, активируя окислительное фосфорилирование. Он необходим для образования кислорода в процессе фотосинтеза изолированными хлоропластами, стимулирует вспомогательные процессы фотосинтеза, прежде всего те из них, которые связаны с аккумулированием энергии. Хлор положительно влияет на поглощение корнями кислорода, соединений калия, кальция, магния. Чрезмерная концентрация ионов хлора в растениях может иметь и отрицательную сторону, например, снижать содержание хлорофилла, уменьшать активность фотосинтеза, задерживать рост и развитие растений.
Но существуют растения, которые в процессе эволюции либо приспособились к засолению почв, либо в борьбе за пространство заняли пустующие солончаки на которых нет конкуренции. Растения произрастающие на засоленных почвах называются — галофиты, они накапливают хлориды в течение вегетационного сезона, а потом избавляются от излишков посредствомлистопада или выделяют хлориды на поверхность листьев и веток и получают двойную выгоду притеняя поверхности от солнечного света.
Растения произрастающие на засоленных почвах называются — галофиты, они накапливают хлориды в течение вегетационного сезона, а потом избавляются от излишков посредствомлистопада или выделяют хлориды на поверхность листьев и веток и получают двойную выгоду притеняя поверхности от солнечного света.
Среди микроорганизмов, так же известны галофилы — галобактерии — которые обитают в сильносоленых водах или почвах.
Особенности работы и меры предосторожности
Хлор — токсичный удушливый газ, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье. Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе около 0,006 мг/л (т.е. в два раза выше порога восприятия запаха хлора). Хлор был одним из первых химических отравляющих веществ, использованных Германией в Первую мировую войну. При работе с хлором следует пользоваться защитной спецодеждой, противогазом, перчатками. На короткое время защитить органы дыхания от попадания в них хлора можно тряпичной повязкой, смоченной растворомсульфита натрия Na2SO3 или тиосульфата натрия Na2S2O3.
ПДК хлора в атмосферном воздухе следующие: среднесуточная — 0,03 мг/м³; максимально разовая — 0,1 мг/м³; в рабочих помещениях промышленного предприятия — 1 мг/м³.
Хлор и его соединения. Свободный хлор Cl.
Основаны на процессе окисления анионов Cl—
2Cl—— 2e— = Cl20
Электролиз водных растворов хлоридов, чаще — NaCl:
2NaCl + 2Н2O = Cl2↑ + 2NaOH + H2↑
Окисление конц. HCI различными окислителями:
4HCI + MnO2 = Cl2↑ + МпCl2 + 2Н2O
16НСl + 2КМпО4 = 5Cl2↑ + 2MnCl2 + 2KCl + 8Н2O
6HCl + КСlO3 = ЗCl2↑ + KCl + 3Н2O
14HCl + К2Сr2O7 = 3Cl2↑ + 2CrCl3 + 2KCl + 7Н2O
Хлор — очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl—:
Cl20+ 2e— = 2Cl—
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Примеры:
Cl2+ 2Na = 2NaCl
3Cl2 + 2Fe = 2FeCl3
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Примеры:
Cl2 + Сu = CuCl2
3Cl2 + 2Аu = 2AuCl3
Хлор непосредственно не взаимодействует только с O2, N2, С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Примеры:
Cl2 + Н2 =2НС1
Cl2 + 2S (расплав) = S2Cl2
ЗCl2 + 2Р = 2РCl3 (или РCl5 — в избытке Cl2)
2Cl2 + Si = SiCl4
3Cl2 + I2 = 2ICl3
Примеры:
Cl2 + 2KBr = Br2 + 2KCl
Cl2 + 2KI = I2 + 2KCl
Cl2 + 2HI = I2 + 2HCl
Cl2 + H2S = S + 2HCl
ЗСl2 + 2NH3 = N2 + 6HCl
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl—, а другие в положительной степени окисления входят в состав анионов ClO— или ClO3—.
Cl2 + Н2O = HCl + НClO хлорноватистая к-та
Cl2 + 2КОН =KCl + KClO + Н2O
3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2O
3Cl2 + 2Са(ОН)2 = CaCl2 + Са(ClO)2+ 2Н2O
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO3 и Са(ClO)2 — гипохлориты; КClO3 — хлорат калия (бертолетова соль).
а) замещение атомов водорода в молекулах ОВ
б) присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
H2C=CH2 + Cl2 → ClH2C-CH2Cl 1,2-дихлорэтан
HC≡CH + 2Cl2 → Cl2HC-CHCl2 1,1,2,2-тетрахлорэтан
Хлороводород и соляная кислота
HCl — хлорид водорода. При об. Т — бесцв. газ с резким запахом, достаточно легко сжижается (т.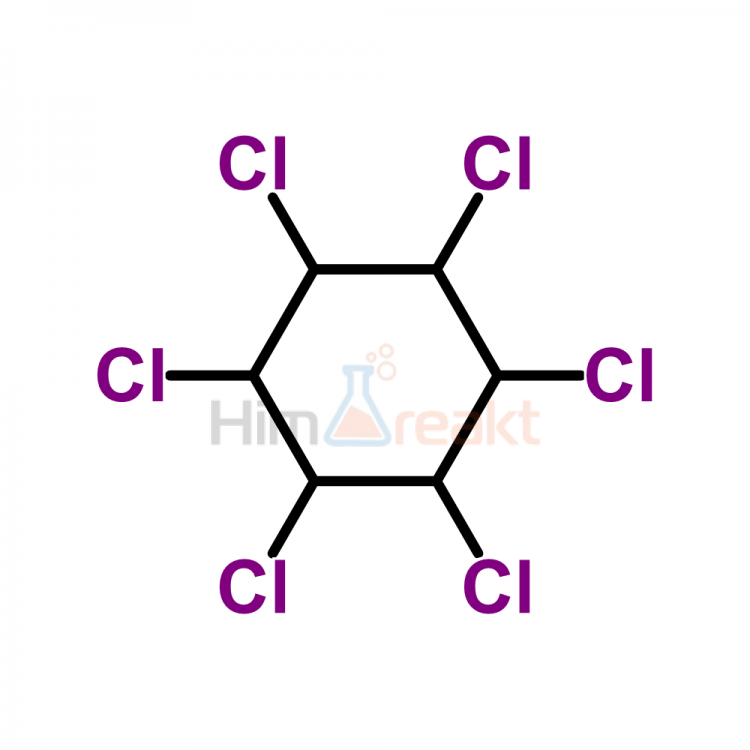 пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
2HCl + F2 = Сl2 + 2HF
4HCl + O2 = 2Сl2 + 2Н2O
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
1. Синтез из простых веществ:
Н2 + Cl2 = 2HCl
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl2 = R-Cl + HCl
3. В лаборатории получают действием конц. H2SO4 на хлориды:
В лаборатории получают действием конц. H2SO4 на хлориды:
H2SО4(конц.) + NaCl = 2HCl↑ + NaHSО4 (при слабом нагревании)
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4 (при очень сильном нагревании)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н2O растворяется ~ 450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н+
HCl → H+ + Cl—
Взаимодействие:
а) с металлами (до Н):
2HCl2 + Zn = ZnCl2 + H2
б) с основными и амфотерными оксидами:
2HCl + CuO = CuCl2 + Н2O
6HCl + Аl2O3 = 2АlCl3 + ЗН2O
в) с основаниями и амфотерными гидроксидами:
2HCl + Са(ОН)2 = CaCl2 + 2Н2О
3HCl + Аl(ОН)3 = АlСl3 + ЗН2O
г) с солями более слабых кислот:
2HCl + СаСО3 = CaCl2 + СO2 + Н3O
HCl + C6H5ONa = С6Н5ОН + NaCl
д) с аммиаком:
HCl + NH3 = NH4Cl
Реакции с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7.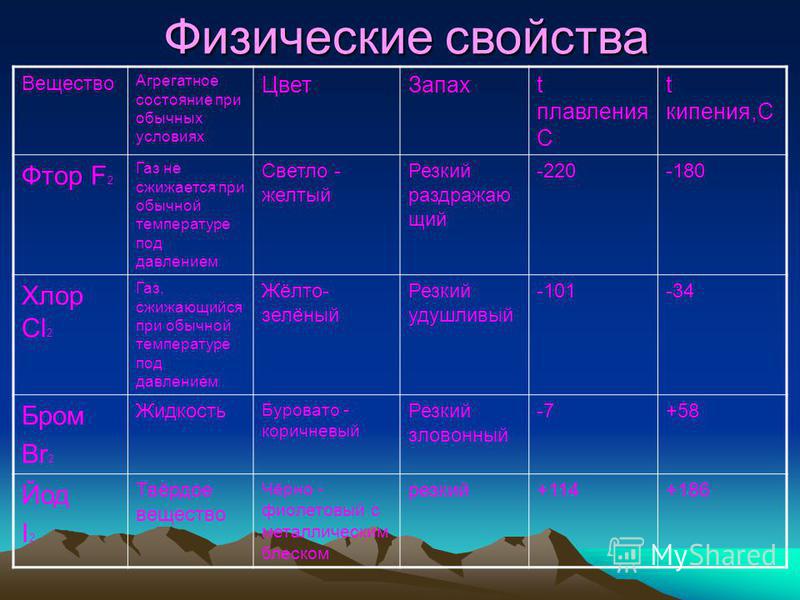 Анион Cl—окисляется до свободного галогена:
Анион Cl—окисляется до свободного галогена:
2Cl—— 2e— = Cl20
Уравнения реакция см. «Получение хлора». Особое значение имеет ОВР между соляной и азотной кислотами:
Взаимодействие:
а) с аминами (как органическими основаниями)
R-NH2 + HCl → [RNH3]+Cl—
б) с аминокислотами (как амфотерными соедимнеиями)
Оксиды и оксокислоты хлора
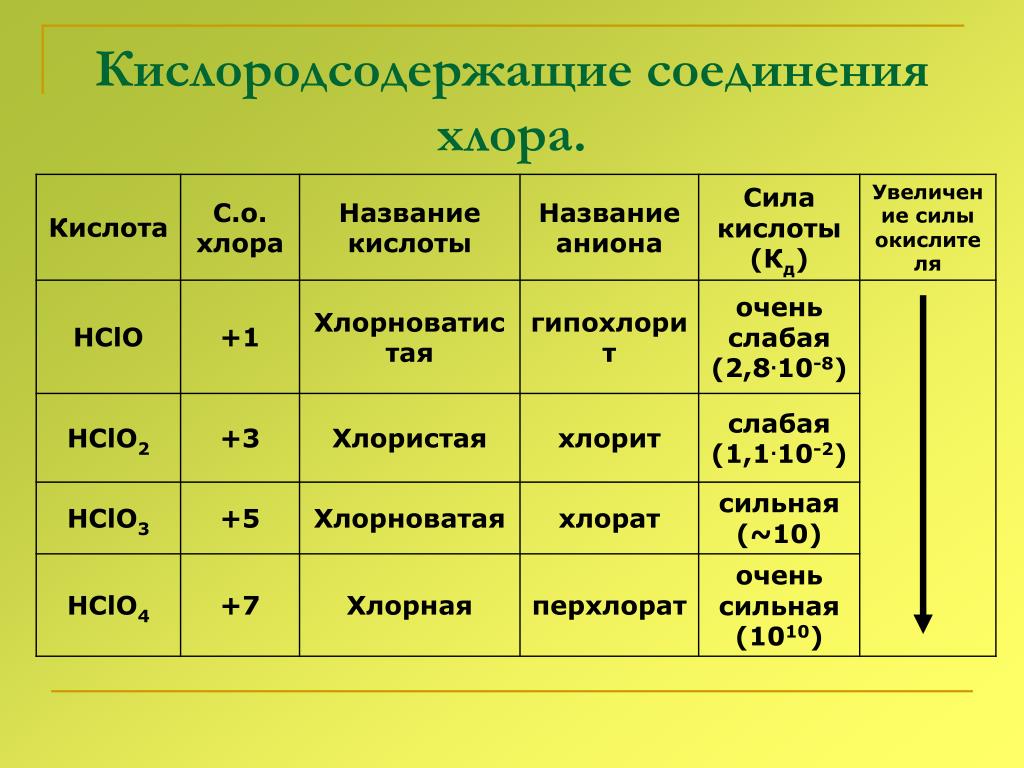
Кислородсодержащие соединения хлора — чрезвычайно неустойчивые вещества, так как включают атомы Cl в нестабильных положительных с. о. Тем не менее некоторые из них имеют важное практическое значение.
гипохлориты | хлориты | хлораты | перхлораты |
NaClOKClOCa(ClO)2 | Ca(ClO2)2 | KClO3 бертолетова сольMg(ClO3)2 | KClO4NaClO4NH4ClO4 |
1. Все оксокислоты хлора и их соли являются сильными окислителями.
Все оксокислоты хлора и их соли являются сильными окислителями.
2. Почти все соединения при нагревании разлагаются за счет внутримолекулярного окисления-восстановления или диспропорционирования.
Примеры:
Хлорная известь
Хлорная (белильная) известь — смесь гипохлорита и хлорида кальция, обладает отбеливающим и дезинфицирующим действием. Иногда рассматривается как пример смешанной соли, имеющей в своем составе одновременно анионы двух кислот:
Жавелевая вода
Водный раствор хлорида и гапохлорита калия KCl + KClO + H2O
Chlorine (Cl) — Chemical properties, Health and Environmental effects
- Home
- Periodic table
- Elements
- Chlorine
|
| Хлор Обнаружен в 1774 году Карлом Вильгельмом Шееле. Хлор получил свое название в 1810 году от Гемфри Дэви, который настаивал на том, что на самом деле это элемент. Чистый химический элемент имеет физическую форму двухатомного зеленого газа. Название хлор происходит от слова «хлорос», что означает «зеленый» и относится к цвету газа. Газообразный хлор в два с половиной раза тяжелее воздуха, имеет крайне неприятный удушливый запах и чрезвычайно ядовит. Этот элемент является частью ряда галогенов, образующих соли. Его извлекают из хлоридов путем окисления и электролиза. Газообразный хлор имеет зеленовато-желтый цвет и легко соединяется почти со всеми другими элементами. Области применения Хлор является важным химическим веществом для очистки воды, дезинфицирующих средств, отбеливателей и горчичного газа. Хлор также широко используется в производстве многих продуктов и предметов прямо или косвенно, т. е. в производстве бумажных изделий, антисептиков, красителей, продуктов питания, инсектицидов, красок, нефтепродуктов, пластмасс, лекарств, текстиля, растворителей и многих других потребительских товаров. товары. Хлор используется при обработке древесной массы для производства бумаги, отбеливатель также используется в промышленности для удаления чернил с макулатуры. Хлор часто придает органическим соединениям многие желаемые свойства, когда он заменяет водород (синтетический каучук), поэтому он широко используется в органической химии, при производстве хлоратов, хлороформа, четыреххлористого углерода и при экстракции брома. Хлор в окружающей среде В природе встречается только в сочетании с другими элементами, главным образом с натрием, в виде поваренной соли (NaCl), а также в карналлите и сильвите. Хлориды составляют большую часть солей, растворенных в земных океанах: около 1,9 % массы морской воды составляют ионы хлора. Количество хлоридов в почвах зависит от расстояния до моря. Среднее значение в верхних слоях почвы составляет около 10 частей на миллион. Растения содержат различное количество хлора; это незаменимый микроэлемент для высших растений, где он концентрируется в хлоропластах. Рост страдает, если количество хлоридов в почве падает ниже 2 частей на миллион, но это случается редко. Верхний предел допуска варьируется в зависимости от культуры.
Назад к периодической диаграмме. Рекомендуемая суточная доза хлора | |
Еще из «Элементов»
Актиний
Silver
Aluminum
Americium
Argon
Arsenic
Astatine
Gold
Boron
Barium
Beryllium
Bohrium
Bismuth
Berkelium
Bromine
Carbon
Calcium
Cadmium
Церий
Калифорний
Кюрий
Кобальт
Хром
Цезий
Медь
Dubnium
Darmstadtium
Dysprosium
Erbium
Einsteinium
Europium
Fluorine
Iron
Fermium
Francium
Gallium
Gadolinium
Germanium
Hydrogen
Helium
Hafnium
Ртуть
Гольмий
Хассий
Йод
Индий
Иридий
Калий
Krypton
Lanthanum
Lithium
Lawrencium
Lutetium
Mendelevium
Magnesium
Manganese
Molybdenum
Meitnerium
Nitrogen
Sodium
Niobium
Neodymium
Neon
Nickel
Нобелий
Нептуний
Кислород
Осмий
Фосфор
Протактиний
Lead
Palladium
Promethium
Polonium
Praseodymium
Platinum
Plutonium
Radium
Rubidium
Rhenium
Rutherfordium
Roentgenium
Rhodium
Radon
Ruthenium
Sulfur
Сурьма
Скандий
Селен
Сиборгий
Кремний
Самарий
Олово
Стронций
Тантал
Тербий
Технеций
Теллур
Торий
хлор | Использование, свойства и факты
хлор
См. все средства массовой информации
все средства массовой информации
- Ключевые люди:
- Карл Вильгельм Шееле Майкл Фарадей сэр Хамфри Дэви
- Похожие темы:
- химический элемент галоген отбеливать дефицит хлора хлор-36
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
хлор (Cl) , химический элемент, второй по легкости член галогенных элементов, или Группа 17 (Группа VIIa) периодической таблицы. Хлор — это токсичный, едкий газ зеленовато-желтого цвета, который раздражает глаза и дыхательную систему.
| атомный номер | 17 |
|---|---|
| . | |
| плотность (1 атм, 0 °C или 32 °F) | 3,214 г/литр (0,429 унции/галлон) |
| степени окисления | −1, +1, +3, +5, + 7 |
| электронная конфигурация | 1 с 2 2 S 2 2 P 6 3 S 2 3 P 5 |
 несколько тысяч лет. Это основная составляющая солей, растворенных в морской воде, из которой ее получали в Древнем Египте путем выпаривания. В римские времена солдатам частично платили солью ( салариум , корень современного слова оклад ). В 1648 году немецкий химик Иоганн Рудольф Глаубер получил сильную кислоту, которую он назвал соляным спиртом, нагревая влажную соль в угольной печи и конденсируя пары в ресивере. Позже он получил тот же продукт, который теперь известен как соляная кислота, путем нагревания соли с серной кислотой.
несколько тысяч лет. Это основная составляющая солей, растворенных в морской воде, из которой ее получали в Древнем Египте путем выпаривания. В римские времена солдатам частично платили солью ( салариум , корень современного слова оклад ). В 1648 году немецкий химик Иоганн Рудольф Глаубер получил сильную кислоту, которую он назвал соляным спиртом, нагревая влажную соль в угольной печи и конденсируя пары в ресивере. Позже он получил тот же продукт, который теперь известен как соляная кислота, путем нагревания соли с серной кислотой. В 1774 году шведский химик Карл Вильгельм Шееле обработал порошкообразный черный оксид марганца соляной кислотой и получил зеленовато-желтоватый газ, который ему не удалось распознать как элемент. Истинная природа газа как элемента была установлена в 1810 году английским химиком Гемфри Дэви, который позднее назвал его хлором (от греческого хлорос , что означает «желтовато-зеленый») и объяснил его отбеливающее действие.
Наличие и распространение
Помимо очень небольших количеств свободного хлора (Cl) в вулканических газах, хлор обычно встречается только в форме химических соединений. Он составляет 0,017 процента земной коры. Природный хлор представляет собой смесь двух стабильных изотопов: хлора-35 (75,53%) и хлора-37 (24,47%). Наиболее распространенным соединением хлора является хлорид натрия, который встречается в природе в виде кристаллической каменной соли, часто обесцвеченной примесями. Хлорид натрия также присутствует в морской воде, средняя концентрация которой составляет около 2 процентов этой соли. Некоторые моря, не имеющие выхода к морю, такие как Каспийское море, Мертвое море и Большое Соленое озеро в штате Юта, содержат до 33 процентов растворенной соли. Небольшие количества хлорида натрия присутствуют в крови и в молоке. Другими хлорсодержащими минералами являются сильвит (хлорид калия [KCl]), бишофит (MgCl 2 ∙6H 2 O), карналлит (KCl∙MgCl 2 ∙6H 2 O) и каинит (KCl∙MgSO 4 ∙3H 2 O 9).




 моль -1
моль -1  7 kJ.mol -1
7 kJ.mol -1  В жидкой и твердой форме он является сильным окислителем, отбеливающим и дезинфицирующим средством.
В жидкой и твердой форме он является сильным окислителем, отбеливающим и дезинфицирующим средством.


 Он также может выходить из воды и попадать в воздух при определенных условиях. Наиболее прямые выбросы хлора в окружающую среду происходят в воздух и в поверхностные воды.
Он также может выходить из воды и попадать в воздух при определенных условиях. Наиболее прямые выбросы хлора в окружающую среду происходят в воздух и в поверхностные воды.