Оксид бария
Оксид бария известен в качестве соединения бария и кислорода. В письменном обозначении в составе химических формул оксид бария обозначается, как ВаО. В ряде химических реакций выступает оксидом основного вида. Допустим и элементарный визуальный анализ вещества в соответствии со стандартными условиями, где ВаО представлен в виде бесцветных кристаллов с кубической по форме решеткой.
Оксид бария входит в число элементов, относящихся к подгруппе IV, то есть к неорганическим основаниям, представленным оксидами, гидроксидами и пероксидами металлов. Любое из оснований данного вида представляет собой соединение, где явно выражено наличие гидроксильного радикала (OH). Такие основания реагируют с кислотой, вследствие чего характерно образование солей.
Сырье, в основном используемое при получении бария, применяется в виде барита или, что реже, витерита. Реакция получения оксида бария – это реакция восстановления минералов при помощи каменного угля, кокса либо газа природного происхождения.
Основные уравнения реакций оксида бария
• Реакция взаимодействия металлического бария и кислорода, в результате которой происходит образование оксида бария: 2Ва + О2 → 2ВаО. В подобном типе реакции обеспечивается получение не только оксида, но и пероксида бария: Ва + О2 → ВаО2;
• Реакция разложения карбоната бария при условии обязательного нагревания, где получение оксида бария сопровождается выделением углекислого газа: ВаСО3 → ВаО + СО2↑. Существует обратная реакция оксида бария и оксида углерода (IV) при условиях комнатной температуры;
• Реакция разложения нитрата бария при условиях нагревания, где полученными веществами являются оксид бария, оксид азота и кислород: 2Ba(NO3)2 → 2BaO + 4NO2 + O2;
• Реакция гидроксида бария и оксида серы (IV): Ва(НО)2 + 2SО2 → Ва(НSО3)2, где результатом взаимодействия веществ становится образование (Ва(НSО3)2).
Получение металлического бария возможно и с проведением реакции восстановления. Главное, какой оксид использовать в реакции дополнительно. Например, наиболее яркая реакция — это химическая реакция с участием оксида алюминия:
3ВаО + 2Аl → 3Ва + Аl2О3
Кроме этого, гарантированное получение бария обеспечивается посредством электролиза смеси хлорида бария и кальция в расплавленном состоянии.
Степень растворимости Ва
Растворимость оксида бария определяется по реакции данного вещества с водой. В этом случае, исходя из данных уравнения по взаимодействию:
ВаО + Н2О = Ва(ОН)2,
где оксид бария — это оксид основного типа.
Следовательно такому оксиду будет соответствовать основание — Ва(ОН)2. Сверяя полученные данные с таблицей растворимости веществ нетрудно определить, что данный вид оснований относится к растворимым и подтверждает тот факт, что реакция вполне осуществима.
Природные источники вещества
По содержанию в природных источниках различается несколько возможных:
- • Земная кора, где масса вещества составляет 0, 05 %;
- • Морская вода, где средняя величина содержания бария составляет 0,02 мг/литр.

Области применения оксидов основного типа
Любое их химических соединений данной группы широко применяется в различных отраслях современной промышленности. В соответствии с краткой классификацией веществ, можно определить следующее разграничение использования оксидов (калия, магния, бария, алюминия):
- • Оксид калия. Широко применяется в производстве удобрений минерального типа, используемых аграрном хозяйстве;
- • Оксид натрия. Незаменим в химической промышленности для получения гидроксида натрия;
- • Оксид бария. Применим в качестве катализатора в осуществлении химических реакций;
- • Оксид магния. Область применения – пищевая промышленность (в виде добавки Е530).
Определение химических свойств вещества на практике
• Ярко протекает реакция взаимодействия оксида бария и воды, вследствие чего отмечается образование щелочи с параллельным выделением тепла: ВаО + Н2О → Ва(ОН)2.
• Взаимодействует оксид бария и с кислотными оксидами, в результате чего характерно образование солей: ВаО + СО2 → ВаСО3, ВаО + SО3 → Ва SО4↓, где оксид бария вступает в реакцию с триоксидом серы;
• Реакция взаимодействия ВаО с кислотами, где обеспечивается итоговое образование солей и воды: ВаО + Н2Сl → ВаСl2 + Н2О, ВаО + Н2SО4 → Ва SО4↓ + Н2О. В течение подобной реакции между оксидом бария и серной кислотой (в разбавленном виде) результатом становится образование сульфата бария и воды.
Также стоит обратить внимание на реакцию оксида бария с соляной кислотой: ВаО + 2НСl (при обязательном условии разбавленного состояния) → ВаСl2 + Н2О, где результатом реакции обеспечено образование хлорида бария BaCl2 и воды h3O.
Описание физических свойств ВаО
Существует в твердом состоянии. Непосредственно сам барий отличается характерным серебристо – белым оттенком, достаточно пластичен, по причине чего относится к ковким металлам.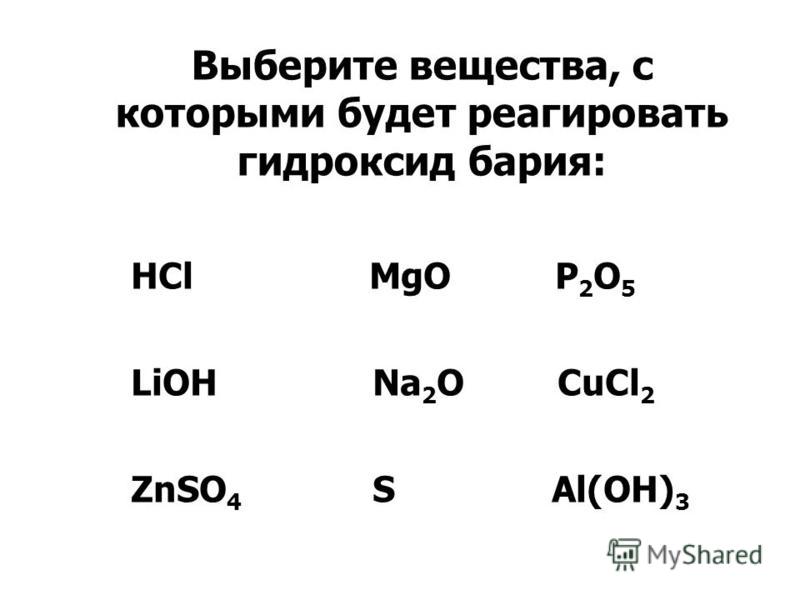
- • Величина молярной массы оксида бария, гр/моль: 153, 3394;
- • По плотности вещество характеризуется следующими показателями, при условии температурного режима в 20 °C: 5, 72;
- • Растворимость в воде, то есть показатель Кs, при условии температуры в 20° С = 1, 5 г/100 г;
Особенности гидроксида и пероксида бария
Гидроксид бария обозначается, как Ba(OH). Применяется в виде кристаллообразных пластин белого цвета, либо в состоянии раствора, более известного как баритовая вода. Популярен в стекольном производстве, например для создания и разработки непроницаемого стекла для рентгеновских установок. Также используется в производстве керамических изделий, в процессах по очистке воды и в производстве гидроксида калия.
Пероксид бария, обозначаемый, как BaO, получается путем нагревания оксида бария в воздушном пространстве с характерным отсутствием диоксида углерода.
Применение
Выход ВаО достаточно низок, соответственно, учитывая его невысокую стоимость, он пользуется повышенным спросом в работах по покрытию катодов, входящих в электронно-вакуумные приборы, на элементах телевизионных устройства и осциллографических трубок.
- • Производство антикоррозионных материалов;
- • Товары из категории сегнето- и пьезо- электрики;
- • Изготовление оптических приборов, таких, как призмы, линзы и прочие;
- • Пиротехнические изделия с целью окрашивания пламени заряда в зеленый цвет;
- • Отрасль атомно-водородной и ядерной энергетики;
- • В составе фторионных аккумуляторных батарей, как электролитный компонент;
- • При разработке и производстве медицинского оборудования.
Хранение
Условия соответствующего хранения ВаО подразумевают полное отсутствие любых легко возгораемых веществ. Также исключены в близком хранении и нахождении восстанавливающие агенты, металлы в порошкообразном состоянии. Категорически запрещается параллельное нахождение любых продуктов питания и сельскохозяйственных животных кормов.
Особые обозначения на упаковке
Полностью исключена одновременная транспортировка с пищевыми продуктами, косметической продукцией, животными кормами и любыми водными организмами. Весь транспортируемый материал должен быть помечен следующими символами:
Весь транспортируемый материал должен быть помечен следующими символами:
- • Хn, обозначающий раздражающее действие отмеченных веществ;
- • R, с числовым значением 20/22, что говорит об опасности при вдохе и в случае проглатывания;
- • S, с числовым значением 17, что предписывает ранение вещества в максимальной отдаленности от горюче – смазочных материалов;
- • S, с числовым значением 28, указывающем на незамедлительное промывание, в случае попадания ВаО на поверхность кожных покровов.
Варианты фасовки подразумевают распределение вещества по упаковкам в 1, 20 – 25, 100, 500 и 1000 килограммовые упаковки, которыми служат банки из стекла, мешки из полипропилена, пакеты из полиэтилена. На фасовке любого веса обязателен к указанию класс степени опасности: 5.1. Существует понятие вторичной опасности, означаемой 6.1.
Влияние ВаО на организм человека
Симптоматика отравлений барием как правило выражена в следующем: повышенное слюнотечение, жжение во рту, дискомфорт в пищеводе. Период отравления сопровождается явно выраженными болями в области желудка, тошнотой, рвотой, острыми коликами. При тяжелом отравлении вероятен смертельный исход, наступающий в течение 24 часов. Смертельная доза составляет порядка 0,8 граммов.
Период отравления сопровождается явно выраженными болями в области желудка, тошнотой, рвотой, острыми коликами. При тяжелом отравлении вероятен смертельный исход, наступающий в течение 24 часов. Смертельная доза составляет порядка 0,8 граммов.
При использовании любых соединений бария стоит помнить о том, что изучение его недостаточно, а к жизненно важным микроэлементам он не относится. Вещество характеризуется как высокотоксичное, так что при любом виде контакта рекомендовано соблюдать все меры предосторожности и СИЗ.
Урок «Упражнения для огэ»
Задание 8
1. Какие два из перечисленных веществ вступают в реакцию с оксидом серы (VI)? 1) нитратом натрия 2) хлором 3) оксидом алюминия
4) оксидом кремния 5) гидроксидом натрия
2. Какие два из перечисленных веществ вступают в реакцию с оксидом серы (IV)? 1) гидроксидом натрия 2) углеродом 3) кислородом
4) хлоридом железа (II) 5) сульфидом меди (II)
3. Какие два из
перечисленных веществ вступают в реакцию с оксидом железа (III)?
Какие два из
перечисленных веществ вступают в реакцию с оксидом железа (III)?
1) гидроксидом меди (II) 2) хлоридом магния 3) серной кислотой
4) гидроксидом натрия 5) оксидом алюминия
4. Какие два из перечисленных веществ вступают в реакцию с оксидом меди (II)? 1) HCl 2) H2O 3) HNO3 4) NaOH 5) FeO
5. Какие два из перечисленных веществ вступают в реакцию с оксидом фосфора (V)? 1) оксид углерода (II) 2) оксид натрия 3) сера 4) вода
5) оксид углерода (IV)
6. Из предложенного списка выберите две пары оксидов, между которыми возможна реакция
1) CuO и H2O 2) MgO и K2O 3) CO2 и SO2 4) Na2O и Al2O3 5) P2O5 и Li2O
7. Из предложенного списка выберите две пары веществ, с каждым из которых оксид цинка реагирует при нормальных условиях:
1) Na2O и H2O 2) HNO3 и O2 3) SiO2 и Ag 4) NaOH и HCl 5) KOH и SO3
8. Из
предложенного списка выберите две пары веществ, между которыми возможна
реакция:
Из
предложенного списка выберите две пары веществ, между которыми возможна
реакция:
1) оксидом кремния (IV) и оксидом натрия
2) оксидом алюминия и гидроксидом натрия
3) оксидом бериллия и кислородом
4) оксидом железа (II) и оксидом калия
5) оксидом серы (IV) и соляной кислотой
9. Какие два из перечисленных веществ не вступают в реакцию с оксидом меди (II)?
1) водородом 2) соляной кислотой 3) азотом 4) оксидом углерода (II)
5) оксидом железа (II)
10. Какие два из перечисленных веществ вступают в реакцию с оксидом кальция? 1) K2O 2) SO2 3) N2O 4) MgO 5) SO3
11. Из предложенного списка выберите две пары веществ, с каждым из которых реагирует оксид серы (VI):
1) вода и хлорид натрия 2) оксид кальция и раствор гидроксида натрия
3) кислород и оксид магния 4) вода и серебро 5) вода и оксид натрия
12. Какие два из перечисленных веществ не вступают в реакцию с оксидом железа (III)? 1) соляная кислота 2) вода 3) серебро 4) серная кислота
5) гидроксид натрия
13. Из
предложенного списка выберите два вещества, с растворами которых реагирует
оксид железа (II):
Из
предложенного списка выберите два вещества, с растворами которых реагирует
оксид железа (II):
1) соляная кислота 2) бромоводород 3) карбонат калия 4) хлорид натрия 5) аммиак
14. Из предложенного списка выберите две пары веществ, с каждым из которых реагирует оксид цинка:
1) 2) 3) 4) 5)
15. Из предложенного списка выберите два вещества, которые будут взаимодействовать с каждым из веществ, формулы которых
1) оксид углерода (IV) 2) оксид калия 3) оксид кремния (IV)
4) оксид меди (II) 5) аммиак
16. Из предложенного списка выберите два вещества, с водными растворами которых реагирует оксид меди (II):
1) хлорида калия 2) хлороводорода 3) карбоната натрия
4) азотной кислоты 5) сульфата магния
17. С какими двумя парами перечисленных веществ реагирует оксид углерода (IV)? 1) H2O и CaO 2) O2 и Na2O 3) KOH и Na2SO4 4) Fe2O3 и H2SO4 5) MgO и Li2O
18. Какие два из перечисленных
веществ вступают в реакцию и с оксидом алюминия, и с оксидом натрия?
Какие два из перечисленных
веществ вступают в реакцию и с оксидом алюминия, и с оксидом натрия?
1) вода 2) соляная кислота 3) водород 4) оксид азота (V)
5) гидроксид калия
19. Из предложенного перечня выберите две пары веществ, с каждым из которых реагирует оксид алюминия:
1) медью и азотной кислотой 2) азотом и хлороводородом
3) оксидом калия и оксидом серы (VI)
4) гидроксидом кальция и сульфатом цинка
5) оксидом натрия и соляной кислотой
20. Из предложенного перечня выберите две пары веществ, с каждым из которых реагирует оксид меди (II):
1) 2) 3) 4) 5)
21. Из предложенного перечня выберите две пары веществ, с каждым из которых реагирует оксид серы (IV):
1) 2) 3) 4)
5)
22. Из предложенного перечня выберите две пары веществ, с каждым из которых реагирует оксид кальция:
1) HCl и P2O5 2) H2O и CO2 3) NaOH и SO2 4) HNO3 и BaO 5) SO2 и O2
23. Из
предложенного перечня выберите две пары веществ, с каждым из которых реагирует
оксид углерода (IV):
Из
предложенного перечня выберите две пары веществ, с каждым из которых реагирует
оксид углерода (IV):
1) 2) 3) 4)
5)
24. Из предложенного перечня выберите две пары веществ, с каждым из которых реагирует оксид меди (II):
1) 2) 3) 4) 5)
25. Из предложенного перечня выберите две пары веществ, с каждым из которых реагирует оксид алюминия:
1) 2) 3) 4) 5)
26. Из предложенного перечня выберите две пары веществ, с каждым из которых реагирует оксид цинка:
1) 2) 3) 4) 5)
27. Из предложенного перечня выберите две пары веществ, которые могут реагировать между собой:
1) NO и CO2 2) CaO и FeO 3) P2O5 и SO3 4) Na2O и Al2O3 5) CO2 и K2O
28. Из предложенного перечня выберите две пары веществ, которые могут реагировать между собой:
1) 2) 3) 4)
5) и
29. Из
предложенного перечня выберите две пары веществ, с каждым из которых реагирует
оксид меди (II):
Из
предложенного перечня выберите две пары веществ, с каждым из которых реагирует
оксид меди (II):
1) H2O и CO2 2) O2 и C 3) H2 и HNO3 4) HCl и NaOH 5) CO и HCl
30. Из предложенного перечня выберите две пары веществ, с каждым из которых реагирует оксид углерода (IV):
1) S и SO2 2) CaO и KOH 3) H2O и HCl 4) Ca(OH)2 и Na2O 5) Mg и MgCl2
31. Из предложенного перечня выберите два вещества, которые не реагируют с водой, но реагируют с азотной кислотой:
1) Na2O 2) CO2 3) Ag2O 4) Fe2O3 5) NO2
32. Из предложенного перечня выберите два вещества, которые реагируют с водой, но не реагируют с углекислым газом:
1) SO3 2) CuO 3) CaO 4) P2O5 5) N2O
33. Из предложенного перечня выберите два вещества, которые не реагируют с оксидом алюминия: 1) H2O 2) O2 3) HNO3 4) KOH 5) Na2O
34. Из
предложенного перечня выберите два вещества, которые не реагируют с оксидом
серы (IV): 1) CO2 2) O2 3) Li2O 4) N2O 5) Ca(OH)2
Из
предложенного перечня выберите два вещества, которые не реагируют с оксидом
серы (IV): 1) CO2 2) O2 3) Li2O 4) N2O 5) Ca(OH)2
35. Из предложенного перечня выберите две пары веществ, между которыми возможна химическая реакция:
1) оксид железа (III) и кислород 2) оксид серы (VI) и оксид кремния
3) оксид бария и вода 4) оксид алюминия и гидроксид натрия
5) оксид углерода (IV) и оксид фосфора (V)
36. Из предложенного перечня выберите два вещества, которые реагируют с оксидом магния:
1) хлороводородом 2) оксидом натрия 3) серной кислотой
4) хлоридом кальция 5) гидроксидом бария
37. Из предложенного перечня выберите два вещества, которые реагируют с оксидом фосфора (V):
1) кислород 2) вода 3) оксид углерода (IV) 4) оксид кремния
5) гидроксид натрия
38. Из предложенного перечня выберите два вещества, которые реагируют с оксидом кремния (IV): 1) оксид серы (IV) 2) гидроксид натрия
3) серная кислота 4) сульфат калия 5) оксид кальция
39. Из
предложенного перечня выберите две пары веществ, с которыми реагирует оксид
цинка:
Из
предложенного перечня выберите две пары веществ, с которыми реагирует оксид
цинка:
1) вода и гидроксид натрия 2) соляная кислота и гидроксид калия
3) оксид натрия и серная кислота 4) оксид углерода (IV) и сульфат меди (II)
5) хлорид натрия и серная кислота
40. Из предложенного перечня выберите две пары веществ, с которыми реагирует оксид натрия:
1) CaO и NO 2) ZnO и Fe 3) CO2 и Al2O3 4) P2O5 и HCl 5) BaO и CO2
41. Из предложенного перечня выберите два вещества, которые реагируют с оксидом фосфора (V):
1) вода 2) оксид серы (IV) 3) сероводород 4) оксид натрия 5) аммиак
42. Из предложенного перечня выберите две пары веществ, которые реагируют с раствором гидроксида натрия:
1) MgO и NO 2) NO2 и CuO 3) FeO и ZnO 4) CO2 и Al2O3 5) ZnO и P2O5
43. Из
предложенного перечня выберите два вещества, реакция которых с водой приводит к
образованию кислоты:
Из
предложенного перечня выберите два вещества, реакция которых с водой приводит к
образованию кислоты:
1) оксид углерода (IV) 2) оксид фосфора (V) 3) оксид натрия
4) оксид азота (II) 5) оксид углерода (II)
44. Из предложенного перечня выберите два вещества, которые реагируют с оксидом магния: 1) HCl 2) NaOH 3) SO3 4) BaSO4 5) KCl
45. Из предложенного перечня выберите две пары веществ, каждое из которых реагирует с разбавленной серной кислотой:
1) SiO2 и MnO2 2) CO и CO2 3) BaO и NO 4) Na2O и Al2O3 5) CuO и ZnO
46. Из предложенного перечня выберите два вещества, которые реагируют с оксидом углерода (IV):
1) раствор гидроксида кальция 2) оксид серы (IV) 3) кислород
4) серная кислота 5) оксид натрия
47. Из предложенного перечня выберите две пары веществ, между которыми возможна реакция:
1) оксид алюминия и оксид натрия 2) оксид калия и оксид бария
3) оксид углерода (IV) и оксид серы (VI) 4) оксид лития и оксид серы (IV)
5) оксид железа (III) и оксид цинка
48. Из
предложенного перечня выберите две пары веществ, с каждым из которых реагирует
оксид цинка:
Из
предложенного перечня выберите две пары веществ, с каждым из которых реагирует
оксид цинка:
1) гидроксид меди (II) и соляная кислота 2) оксид калия и хлорид калия
3) оксид натрия и гидроксид натрия 4) вода и серная кислота
5) оксид серы (VI) и серная кислота
49. Из предложенного перечня выберите две пары веществ, между которыми возможна химическая реакция:
1) оксид натрия и оксид серы (IV) 2) оксид кремния и вода
3) оксид кальция и гидроксид натрия 4) оксид азота (V) и кислород
5) оксид цинка и оксид натрия
50. Из предложенного перечня выберите две пары веществ, между которыми возможна химическая реакция:
1) оксидом меди (II) и кислородом
2) оксидом алюминия и азотной кислотой
3) оксидом кремния (IV) и водой
4) оксидом хлора (VII) и оксидом углерода (IV)
5) оксидом серы (IV) и водой
Ответы
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
35 | 13 | 34 | 13 | 24 | 45 | 45 | 12 | 35 | 25 |
11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
25 | 23 | 12 | 12 | 13 | 24 | 15 | 24 | 35 | 35 |
21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
15 | 12 | 13 | 23 | 23 | 13 | 45 | 15 | 35 | 24 |
31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 |
34 | 14 | 12 | 14 | 34 | 13 | 25 | 25 | 23 | 34 |
41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 |
14 | 45 | 12 | 13 | 45 | 15 | 14 | 35 | 15 | 25 |
БАРИЯ ОКСИД | CAMEO Chemicals
Добавить в MyChemicals Страница для печати
Химический паспорт
Химические идентификаторы | Опасности | Рекомендации по ответу | Физические свойства | Нормативная информация | Альтернативные химические названия
Химические идентификаторы
Что это за информация?
Поля химического идентификатора
включают общие идентификационные номера,
алмаз NFPA
Знаки опасности Министерства транспорта США и общий
описание хим. Информация в CAMEO Chemicals поступает
из множества
источники данных.
Информация в CAMEO Chemicals поступает
из множества
источники данных.
| Номер CAS | Номер ООН/НА | Знак опасности DOT | Береговая охрана США КРИС Код |
|---|---|---|---|
|
|
| никто |
| Карманный справочник NIOSH | Международная карта химической безопасности | ||
| никто |
| ||
NFPA 704
нет данных
Общее описание
Порошок от белого до желтого цвета. Может быть токсичным при приеме внутрь. Раздражает кожу, глаза и слизистые оболочки. Используется в качестве осушителя бензина и растворителей.
Может быть токсичным при приеме внутрь. Раздражает кожу, глаза и слизистые оболочки. Используется в качестве осушителя бензина и растворителей.
Опасности
Что это за информация?
Опасные поля включать специальные предупреждения об опасности воздух и вода реакции, пожароопасность, опасность для здоровья, профиль реактивности и подробности о задания реактивных групп и потенциально несовместимые абсорбенты. Информация в CAMEO Chemicals поступает из различных источников. источники данных.
Предупреждения о реактивности
- Реакция на воду
Реакции с воздухом и водой
Гигроскопичен. Легко и экзотермически реагирует с водой с образованием раствора коррозионно-активного гидроксида бария [Merck, 11-е изд. 1989].
Пожароопасность
Выдержка из Руководства ERG 157 [Вещества – токсичные и/или коррозионные (негорючие/чувствительные к воде)]:
Негорючее, само по себе вещество не горит, но может разлагаться при нагревании с образованием коррозионных и/или токсичных паров. UN1796, UN1802, UN1826, UN2032, UN3084, UN3085 и при концентрациях выше 65% UN2031 могут действовать как окислители. Также см. Руководство ERG 140. Пары могут скапливаться в замкнутых пространствах (подвал, резервуары, вагоны-цистерны и т. д.). Вещество может вступать в реакцию с водой (иногда бурно) с выделением коррозионно-активных и/или токсичных газов и стоков. При контакте с металлами может выделяться легковоспламеняющийся газообразный водород. Контейнеры могут взорваться при нагревании или загрязнении водой. (ЭРГ, 2020)
UN1796, UN1802, UN1826, UN2032, UN3084, UN3085 и при концентрациях выше 65% UN2031 могут действовать как окислители. Также см. Руководство ERG 140. Пары могут скапливаться в замкнутых пространствах (подвал, резервуары, вагоны-цистерны и т. д.). Вещество может вступать в реакцию с водой (иногда бурно) с выделением коррозионно-активных и/или токсичных газов и стоков. При контакте с металлами может выделяться легковоспламеняющийся газообразный водород. Контейнеры могут взорваться при нагревании или загрязнении водой. (ЭРГ, 2020)
Опасность для здоровья
Выдержка из Руководства ERG 157 [Вещества – токсичные и/или коррозионно-активные (негорючие/чувствительные к воде)]:
ТОКСИЧНЫЕ; вдыхание, проглатывание или контакт (кожа, глаза) с парами, пылью или веществом может привести к серьезным травмам, ожогам или смерти. Реакция с водой или влажным воздухом может привести к выделению токсичных, едких или горючих газов. Реакция с водой может привести к выделению большого количества тепла, что повысит концентрацию паров в воздухе. При пожаре выделяются раздражающие, коррозионные и/или токсичные газы. Сток от пожаротушения или вода для разбавления могут быть коррозионно-активными и/или токсичными и вызывать загрязнение окружающей среды. (ЭРГ, 2020)
При пожаре выделяются раздражающие, коррозионные и/или токсичные газы. Сток от пожаротушения или вода для разбавления могут быть коррозионно-активными и/или токсичными и вызывать загрязнение окружающей среды. (ЭРГ, 2020)
Профиль реакционной способности
ОКСИД БАРИЯ реагирует как сильное основание. Экзотермически соединяется со всеми категориями кислот. Реагирует с диоксидом углерода с образованием карбоната бария [Merck, 11-е изд. 1989]. Воспламеняет гидроксиламин при контакте [Mellor 8:291 1946-47]. Смеси с окисью ртути или никеля энергично реагируют с сероводородом на воздухе. Это может привести к взрывам [Mellor 10:140 1946-47]. Может реагировать, особенно в присутствии влаги, с алюминием и цинком с образованием оксидов или гидроксидов металла и выделением газообразного водорода. Может инициировать реакции полимеризации в полимеризуемых органических соединениях, особенно эпоксидах. Может образовывать легковоспламеняющиеся и/или токсичные газы с солями аммония, нитридами, галогенированными органическими соединениями, пероксидами и гидропероксидами.
Принадлежит к следующей реакционной группе(ам)
- Основания, сильные
Потенциально несовместимые абсорбенты
Соблюдайте осторожность. Известно, что он реагирует с абсорбенты перечислено ниже. Больше информации о абсорбентах, в том числе о ситуациях, на которые следует обратить внимание…
- Абсорбенты на основе целлюлозы
- Абсорбенты на минеральной и глиняной основе
Ответные рекомендации
Что это за информация?
Поля рекомендации ответа включают в себя расстояния изоляции и эвакуации, а также рекомендации по пожаротушение, пожарное реагирование, защитная одежда и первая помощь. информация в CAMEO Chemicals поступает из различных источники данных.
Изоляция и эвакуация
Выдержка из Руководства ERG 157 [Вещества — токсичные и/или коррозионные (негорючие / чувствительные к воде)]:
НЕМЕДЛЕННЫЕ МЕРЫ ПРЕДОСТОРОЖНОСТИ: Изолируйте место разлива или утечки во всех направлениях на расстоянии не менее 50 метров (150 футов) для жидкостей и не менее 25 метров (75 футов) для твердых тел.
РАЗЛИВ: При необходимости увеличьте дистанцию немедленных мер предосторожности в подветренном направлении.
ПОЖАР: Если цистерна, железнодорожная цистерна или автоцистерна вовлечены в пожар, ИЗОЛИРОВАТЬ на расстоянии 800 метров (1/2 мили) во всех направлениях; также рассмотрите первоначальную эвакуацию на 800 метров (1/2 мили) во всех направлениях. (ЭРГ, 2020)
Пожаротушение
Выдержка из Руководства ERG 157 [Вещества — токсичные и/или коррозионные (негорючие / чувствительные к воде)]:
Примечание. Некоторые пеноматериалы вступают в реакцию с материалом и выделяют коррозионно-токсичные газы.
НЕБОЛЬШОЙ ПОЖАР: CO2 (кроме цианидов), сухой химикат, сухой песок, спиртоустойчивая пена.
БОЛЬШОЙ ПОЖАР: Распыление воды, туман или спиртоустойчивая пена. Если это можно сделать безопасно, уберите неповрежденные контейнеры из зоны вокруг огня. Избегайте направления прямых или сплошных струй непосредственно на продукт. Сток дамбы от пожарной охраны для последующей утилизации.
Сток дамбы от пожарной охраны для последующей утилизации.
ПОЖАР, ВКЛЮЧАЮЩИЙ РЕЗЕРВУАРЫ ИЛИ АВТОМОБИЛЬНЫЕ/ТРЕЙЛЕРНЫЕ НАГРУЗКИ: Тушить огонь с максимального расстояния или использовать беспилотные устройства основного потока или контрольные насадки. Не допускайте попадания воды внутрь контейнеров. Охладите контейнеры заливающим количеством воды до тех пор, пока огонь не погаснет. Немедленно отозвать в случае усиления звука от вентиляционных предохранительных устройств или обесцвечивания бака. ВСЕГДА держитесь подальше от танков, охваченных огнем. (ЭРГ, 2020)
Непожарное реагирование
Выдержка из Руководства ERG 157 [Вещества – токсичные и/или коррозионно-активные (негорючие/чувствительные к воде)]:
УСТРАНИТЕ все источники возгорания (не курить, факелы, искры или пламя) в непосредственной близости. Все оборудование, используемое при работе с продуктом, должно быть заземлено. Не прикасайтесь к поврежденным контейнерам или пролитому материалу, если вы не надели соответствующую защитную одежду. Остановите утечку, если вы можете сделать это без риска. Для уменьшения паров можно использовать пароподавляющую пену. НЕ ПОЛУЧАЙТЕ ВОДУ ВНУТРИ КОНТЕЙНЕРОВ. Используйте распыление воды, чтобы уменьшить количество паров или отклонить дрейф облаков паров. Избегайте попадания стекающей воды на разлитый материал. Не допускать попадания в водные пути, канализацию, подвалы или замкнутые пространства.
Остановите утечку, если вы можете сделать это без риска. Для уменьшения паров можно использовать пароподавляющую пену. НЕ ПОЛУЧАЙТЕ ВОДУ ВНУТРИ КОНТЕЙНЕРОВ. Используйте распыление воды, чтобы уменьшить количество паров или отклонить дрейф облаков паров. Избегайте попадания стекающей воды на разлитый материал. Не допускать попадания в водные пути, канализацию, подвалы или замкнутые пространства.
НЕБОЛЬШОЙ РАЗЛИВ: Накрыть СУХОЙ землей, СУХИМ песком или другим негорючим материалом, а затем накрыть полиэтиленовой пленкой, чтобы свести к минимуму распространение или контакт с дождем. Используйте чистые, искробезопасные инструменты для сбора материала и поместите его в неплотно закрытые пластиковые контейнеры для последующей утилизации. (ЭРГ, 2020)
Защитная одежда
Выдержка из Руководства ERG 157 [Вещества — токсичные и/или коррозионные (негорючие / чувствительные к воде)]:
Наденьте автономный дыхательный аппарат с положительным давлением (SCBA). Носите одежду химической защиты, специально рекомендованную производителем, когда НЕТ РИСКА ПОЖАРА. Структурная защитная одежда пожарных обеспечивает тепловую защиту, но лишь ограниченную химическую защиту. (ЭРГ, 2020)
Носите одежду химической защиты, специально рекомендованную производителем, когда НЕТ РИСКА ПОЖАРА. Структурная защитная одежда пожарных обеспечивает тепловую защиту, но лишь ограниченную химическую защиту. (ЭРГ, 2020)
Ткани для костюмов DuPont Tychem®
Информация отсутствует.
Первая помощь
Выдержка из Руководства ERG 157 [Вещества — токсичные и/или коррозионные (негорючие / чувствительные к воде)]:
Позвоните в службу 911 или в службу неотложной медицинской помощи. Убедитесь, что медицинский персонал знает о материале(ах) и принимает меры предосторожности для своей защиты. Переместите пострадавшего на свежий воздух, если это можно сделать безопасно. Сделайте искусственное дыхание, если пострадавший не дышит. Не проводите реанимацию рот в рот, если пострадавший проглотил или вдохнул вещество; вымойте лицо и рот перед проведением искусственного дыхания. Используйте карманную маску с односторонним клапаном или другое надлежащее респираторное медицинское устройство. Дайте кислород, если дыхание затруднено. Снять и изолировать загрязненную одежду и обувь. В случае контакта с веществом немедленно промойте кожу или глаза проточной водой в течение не менее 20 минут. При попадании на кожу плавиковой кислоты (UN1790), если имеется гель глюконата кальция, промойте 5 минут, затем нанесите гель. В противном случае продолжайте полоскание до тех пор, пока не будет доступна медицинская помощь. При незначительном контакте с кожей избегайте нанесения материала на здоровую кожу. Держите пострадавшего в покое и тепле. Последствия воздействия (вдыхание, проглатывание или контакт с кожей) вещества могут проявляться с задержкой. (ЭРГ, 2020)
Дайте кислород, если дыхание затруднено. Снять и изолировать загрязненную одежду и обувь. В случае контакта с веществом немедленно промойте кожу или глаза проточной водой в течение не менее 20 минут. При попадании на кожу плавиковой кислоты (UN1790), если имеется гель глюконата кальция, промойте 5 минут, затем нанесите гель. В противном случае продолжайте полоскание до тех пор, пока не будет доступна медицинская помощь. При незначительном контакте с кожей избегайте нанесения материала на здоровую кожу. Держите пострадавшего в покое и тепле. Последствия воздействия (вдыхание, проглатывание или контакт с кожей) вещества могут проявляться с задержкой. (ЭРГ, 2020)
Физические свойства
Что это за информация?
Поля физических свойств
включают в себя такие свойства, как давление пара и
температура кипения, а также пределы взрываемости и
пороги токсического воздействия
Информация в CAMEO Chemicals поступает из различных источников. источники данных.
источники данных.
| Химическая формула: |
|
Температура вспышки: данные отсутствуют
Нижний предел взрываемости (НПВ): данные отсутствуют
Верхний предел взрываемости (ВПВ): данные отсутствуют
Температура самовоспламенения: данные отсутствуют
Температура плавления: данные отсутствуют
Давление паров недоступно
Плотность паров (относительно воздуха): данные недоступны
Удельный вес: данные недоступны
Температура кипения: данные отсутствуют
Молекулярный вес: данные отсутствуют
Растворимость в воде: данные отсутствуют
Энергия/потенциал ионизации: данные отсутствуют
IDLH: данные отсутствуют Информация об AEGL отсутствует.
ERPG (Руководство по планированию реагирования на чрезвычайные ситуации)
Информация о ERPG отсутствует.PAC (критерии защитных действий)
| Химикат | ПАК-1 | ПАК-2 | ПАК-3 |
|---|---|---|---|
| Оксид бария (1304-28-5) | 1,7 мг/м3 | 200 мг/м3 | 1200 мг/м3 |
(DOE, 2018)
Нормативная информация
Что это за информация?
Поля нормативной информации
включить информацию из
Сводный список III Агентства по охране окружающей среды США
списки,
Химический завод Агентства кибербезопасности и безопасности инфраструктуры США
антитеррористические стандарты,
и Управление по охране труда и здоровья США
Перечень стандартов по управлению безопасностью технологического процесса при работе с особо опасными химическими веществами
(подробнее об этих
источники данных).
Сводный перечень списков EPA
| Нормативное наименование | Номер CAS/ 313 Код категории | EPCRA 302 EHS TPQ | EPCRA 304 EHS RQ | CERCLA RQ | ЭПКРА 313 ТРИ | RCRA Код | CAA 112(r) RMP TQ |
|---|---|---|---|---|---|---|---|
| Соединения бария | Н040 | 313 |
(Перечень списков Агентства по охране окружающей среды, 2022 г. )
)
Антитеррористические стандарты химических предприятий CISA (CFATS)
Отсутствует нормативная информация.
Список стандартов OSHA по управлению безопасностью процессов (PSM)
Отсутствует нормативная информация.
Альтернативные химические названия
Что это за информация?
В этом разделе приводится список альтернативных названий этого химического вещества, включая торговые названия и синонимы.
- БАРИЯ
- БАРИЯ МОНОКСИД
- БАРИЯ ОКСИД
- БАРИЯ ОКСИД (BA2O2)
- БАРИТА
Оксид бария – формула, структура, свойства, производство и применение
Перейти к содержимому
Что такое оксид бария?
Оксид бария представляет собой неорганическое соединение с формулой BaO. Это белое твердое вещество, нерастворимое в воде. Это продукт реакции сульфата бария с кислородом.
Зарегистрируйтесь, чтобы получить бесплатный пробный тест и учебные материалы
+91
Подтвердите OTP-код (обязательно)
Я согласен с условиями и политикой конфиденциальности.
Какова формула оксида бария?
Формула оксида бария: BaO. Оксид бария представляет собой белое, малорастворимое твердое вещество без запаха. Его получают термическим разложением карбоната бария. Оксид бария используется в производстве других соединений бария, в качестве флюса в производстве металлов и в качестве белого пигмента.
Структура оксида бария
Оксид бария представляет собой белый порошок без запаха, нерастворимый в воде. Это основной оксид, который реагирует с кислотами с образованием солей бария. Он используется в производстве керамики, стекла и других соединений бария.
Свойства оксида бария (BaO)
Оксид бария представляет собой белый порошок без запаха и вкуса, нерастворимый в воде. Это основной оксид, который реагирует с кислотами с образованием солей бария. Он используется в производстве стекла, эмалей и фарфора.
Он используется в производстве стекла, эмалей и фарфора.
Производство оксида бария
Производство оксида бария представляет собой двухстадийный процесс:
- Первым этапом производства оксида бария является реакция бария с кислородом. Эту реакцию можно осуществить двумя способами. Первый способ заключается в реакции бария с газообразным кислородом. Второй способ заключается в реакции бария с кислородом в воде. Реакция бария с газообразным кислородом является наиболее распространенным способом получения оксида бария. В этой реакции барий помещают в печь и пропускают через него кислород. Барий реагирует с кислородом с образованием оксида бария.
- Вторым этапом производства оксида бария является нагревание оксида бария. На этом этапе оксид бария помещают в печь и нагревают до высокой температуры. Оксид бария реагирует с печью с образованием металлического бария.
Использование оксида бария
- Оксид бария представляет собой универсальное химическое соединение, которое имеет множество применений.



