В водном растворе реагирует с выделением газа1) Na2CO3 и CaCl22) FeSO4 и NaOh4) NaCl и HBr4)
Пластина может быть и телом и веществом?Я просто наткнулся на 2 определения,одно про то что это тело,а другое про то что вещество.Есть два вида пласти … н?
Нитрат ртути(II) массой 100 г подвергли термическому разложению при 500∘C в керамическом тигле. Рассчитайте массу вещества, оставшегося в тигле. Подск … ажите, пожалуйста, как решать, вроде я правильно делала: Hg(NO3)2 = Hg+2NO2+O2 Нашла кол-во ве-ва нитрата, приравняла моль к продуктам, потом по молю нашла массу продуктов, сложила, получилось 97,5, из 100 гр нитрата вычла 97,5, но ответ не сошёлся с правильным, не знаю почему, может я что-то не поняла, как решать… Заранее спасибо за помощь
Определите моляльную концентрацию раствора серной кислоты(p=1,174г/мл) с титром равным 0,2817 г/мл
1) Cu 2) Ba 3) Ca 4) Ag 5) BeИз числа указанных в ряду элементов выберите два элемента, которые при взаимодействии с водородом образуют соединения в с
… тепени окисления +2.
Смесь Ѕх и FeS2 количеством вещества 0,6 mоl сожгли и получили 0,2 mоl оксидa железа (II|) и 1,2 mol сернистого газа. Найдите х.
Допоможіть будь ласка!!!! Помогите пожалуйста,срочно!!!!!Змішали 500 мл кисню 0.6 дм³ азоту та 0.04 м³ карбон 4 оксиду обчисліть молярну масу утворено … ї сумішіСмешали 500 мл кислорода 0.6 дм азота и 0.04 м³ карбон 4 оксида вычислите молярную массу образованной смеси
20. Сколько литров (н.у.) водорода выделится при взаимодействии 3,6 г магния с избытком раствора серной кислоты: А) 3,36 B) 2,24 C) 22,4 D) 11,2 E) 4, … 48
1. Пропуская водород над нагретым гео, можно получить железо согласно уравнению реакции Fe,0, +3H, 2Fe+ 3H,0. Вычислите массу железа, если израсходов … али 2,24 л водорода. A) 2.34 г В) 5.21 гC) 3,73 г D) 4,64 гЕ) 1,44 г
сколько литров атмосферного воздуха потребуется, чтобы получить из него 6,3 * 10 24(степень) молекул кислорода желательно с пояснениями
Помогите пожалуйста!!
Приведите формулу гомолога этого соединения, имеющего на один углеродный атом меньше. В молекуле этого гомолога должны быть толь
… ко первичные и четвертичные атомы углерода.
В молекуле этого гомолога должны быть толь
… ко первичные и четвертичные атомы углерода.
Химические свойства солей: средних, кислых, основных, комплексных.
Химические свойства средних солей
Взаимодействие средних солей с металлами
Реакция соли с металлом протекает в том случае, если исходный свободный металл более активен, чем тот, который входит в состав исходной соли. Узнать о том, какой металл более активен, можно, воспользовавшись электрохимическим рядом напряжений металлов.
Так, например, железо взаимодействует с сульфатом меди в водном растворе, поскольку является более активным, чем медь (левее в ряду активности):
В то же время железо не реагирует с раствором хлорида цинка, поскольку оно менее активно, чем цинк:
Следует отметить, что такие активные металлы, как щелочные и щелочноземельные, при их добавлении к водным растворам солей будут прежде всего реагировать не с солью, а входящей в состав растворов водой.
Взаимодействие средних солей с гидроксидами металлов
Оговоримся, что под гидроксидами металлов в данном случае понимаются соединения вида Me(OH)x.
Для того чтобы средняя соль реагировала с гидроксидом металла, должны одновременно (!) выполняться два требования:
- в предполагаемых продуктах должен быть обнаружен осадок или газ;
- исходная соль и исходный гидроксид металла должны быть растворимы.
Рассмотрим пару случаев, для того чтобы усвоить данное правило.
Определим, какие из реакций ниже протекают, и напишем уравнения протекающих реакций:
- 1) PbS + KOH
- 2) FeCl3 + NaOH
Рассмотрим первое взаимодействие сульфида свинца и гидроксида калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», обозначив таким образом, что пока не известно, протекает ли реакция на самом деле:
В предполагаемых продуктах мы видим гидроксид свинца (II), который, судя по таблице растворимости, нерастворим и должен выпадать в осадок. Однако, вывод о том, что реакция протекает, пока сделать нельзя, так как мы не проверили удовлетворение еще одного обязательного требования – растворимости исходных соли и гидроксида. Сульфид свинца – нерастворимая соль, а значит реакция не протекает, так как не выполняется одно из обязательных требований для протекания реакции между солью и гидроксидом металла. Т.е.:
Однако, вывод о том, что реакция протекает, пока сделать нельзя, так как мы не проверили удовлетворение еще одного обязательного требования – растворимости исходных соли и гидроксида. Сульфид свинца – нерастворимая соль, а значит реакция не протекает, так как не выполняется одно из обязательных требований для протекания реакции между солью и гидроксидом металла. Т.е.:
Рассмотрим второе предполагаемое взаимодействие между хлоридом железа (III) и гидроксидом калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», как и в первом случае:
В предполагаемых продуктах мы видим гидроксид железа (III), который нерастворим и должен выпадать в осадок. Однако сделать вывод о протекании реакции пока еще нельзя. Для этого надо еще убедиться в растворимости исходных соли и гидроксида. Оба исходных вещества растворимы, значит мы можем сделать вывод о том, что реакция протекает. Запишем ее уравнение:
Реакции средних солей с кислотами
Средняя соль реагирует с кислотой в том случае, если образуется осадок или слабая кислота.
Распознать осадок среди предполагаемых продуктов практически всегда можно по таблице растворимости. Так, например, серная кислота реагирует с нитратом бария, поскольку в осадок выпадает нерастворимый сульфат бария:
Распознать слабую кислоту по таблице растворимости нельзя, поскольку многие слабые кислоты растворимы в воде. Поэтому список слабых кислот следует выучить. К слабым кислотам относят H2S, H2CO3, H2SO3, HF, HNO2, H2SiO3 и все органические кислоты.
Так, например, соляная кислота реагирует с ацетатом натрия, поскольку образуется слабая органическая кислота (уксусная):
Следует отметить, что сероводород H2S является не только слабой кислотой, но и плохо растворим в воде, в связи с чем выделяется из нее в виде газа (с запахом тухлых яиц):
Кроме того, обязательно следует запомнить, что слабые кислоты — угольная и сернистая — являются неустойчивыми и практически сразу же после образования разлагаются на соответствующий кислотный оксид и воду:
Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:
Реакции средних солей с другими средними солями
Реакция между средними солями протекает в том случае, если одновременно (!) выполняются два требования:
- исходные соли растворимы;
- в предполагаемых продуктах есть осадок или газ.
Например, сульфат бария не реагирует с карбонатом калия, поскольку несмотря на то что в предполагаемых продуктах есть осадок (карбонат бария), не выполняется требование растворимости исходных солей.
В то же время хлорид бария реагирует с карбонатом калия в растворе, поскольку обе исходные соли растворимы, а в продуктах есть осадок:
Газ при взаимодействии солей образуется в единственном случае – если смешивать при нагревании раствор любого нитрита с раствором любой соли аммония:
Причина образования газа (азота) заключается в том, что в растворе одновременно находятся катионы NH4+ и анионы NO2— , образующие термически неустойчивый нитрит аммония, разлагающийся в соответствии с уравнением:
Реакции термического разложения солей
Разложение карбонатовВсе нерастворимые карбонаты, а также карбонаты лития и аммония термически неустойчивы и разлагаются при нагревании. Карбонаты металлов разлагаются до оксида металла и углекислого газа:
Карбонаты металлов разлагаются до оксида металла и углекислого газа:
а карбонат аммония дает три продукта – аммиак, углекислый газ и воду:
Разложение нитратовАбсолютно все нитраты разлагаются при нагревании, при этом тип разложения зависит от положения металла в ряду активности. Схема разложения нитратов металлов представлена на следующей иллюстрации:
Так, например, в соответствии с этой схемой уравнения разложения нитрата натрия, нитрата алюминия и нитрата ртути записываются следующим образом:
Также следует отметить специфику разложения нитрата аммония и нитрата железа (II):
Реакция разложения нитрата железа (II) снова стала встречаться в ЕГЭ по химии. В заданиях фигурирует формулировка о его разложении в токе воздуха, однако, что в токе воздуха, что без него, уравнение будет одинаковым. Писать оксид FeO при разложении нитрата железа (II) будет ошибкой.
Разложение солей аммонияТермическое разложение солей аммония чаще всего сопровождается образованием аммиака:
В случае, если кислотный остаток обладает окислительными свойствами, вместо аммиака образуется какой-либо продукт его окисления, например, молекулярный азот N2 или оксид азота (I):
Разложение хлората калияРеакция разложения хлората калия может протекать по-разному. В присутствии катализатора (как правило MnO2), реакция приводит к образованию хлорида калия и кислорода:
В присутствии катализатора (как правило MnO2), реакция приводит к образованию хлорида калия и кислорода:
Без катализатора, реакция будет протекать по типу сопропорционирования:
Химические свойства кислых солей
Отношение кислых солей к щелочам и кислотам
Кислые соли реагируют с щелочами. При этом, если щелочь содержит тот же металл, что и кислая соль, то образуются средние соли:
Также, если в кислотном остатке кислой соли осталось два или более подвижных атомов водорода, как, например, в дигидрофосфате натрия, то возможно образование как средней:
так и другой кислой соли с меньшим числом атомов водорода в кислотном остатке:
Важно отметить, что кислые соли реагируют с любыми щелочами, в том числе и теми, которые образованы другим металлом. Например:
Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами аналогично соответствующим средним солям:
Термическое разложение кислых солей
Все кислые соли при нагревании разлагаются. В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 оС. При этом образуются карбонат металла, углекислый газ и вода:
В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 оС. При этом образуются карбонат металла, углекислый газ и вода:
Последние две реакции являются основной причиной образования накипи на поверхности водонагревательных элементов в электрических чайниках, стиральных машинах и т.д.
Гидрокарбонат аммония разлагается без твердого остатка с образованием двух газов и паров воды:
Химические свойства основных солей
Основные соли всегда реагируют со всеми сильными кислотами. При этом могут образоваться средние соли, если использовались кислота с тем же кислотным остатком, что и в основной соли, или смешанные соли, если кислотный остаток в основной соли отличается от кислотного остатка реагирующей с ней кислоты:
Также для основных солей характерны реакции разложения при нагревании, например:
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4]— и [Zn(OH)4]2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:
Тест (презентация) — тренажер.
 Задание №12 в ОГЭ химия. Химические свойства солей (средних).
Задание №12 в ОГЭ химия. Химические свойства солей (средних).
Задание № 12
Химические свойства солей (средних).
Физические свойства некоторых веществ:
Вещество
Физические свойства
CuS
Осадок черного цвета
PbS
Осадок черного цвета
HgS
Осадок черного цвета
Ag 2 S
Осадок черного цвета
Zn(OH) 2
Fe 3 [Fe(CN) 6 ] 3
Осадок белого цвета
Осадок синего цвета
CuO
Кристаллы чёрного цвета, практически нерастворимые в воде
Cu 2 O
Твёрдое вещество красно-бурого цвета, нерастворимое в воде и органических растворителях.
Cr 2 O 3
Очень твёрдый тугоплавкий порошок зелёного цвета
K 2 Cr 2 O 7
Оранжево-красные кристаллы, хорошо растворимые в воде
KMnO 4
Кристаллы фиолетового цвета, хорошо растворимые в воде
S
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности)
Окраска некоторых осадков:
Вещество
Физические свойства
AgCl
Творожистый осадок белого цвета
AgBr
Осадок кремового (желтоватого) цвета
AgI
Осадок желтого цвета
AgPO 4
Осадок желтого цвета
CaCO 3
Осадок белого цвета
CaSO 3
Fe(OH) 2
Осадок белого цвета
Осадок белого цвета
Fe(OH) 3
Осадок бурого цвета
BaSO 4
Осадок белого цвета
Cu(OH) 2
Студенистый осадок голубого цвета
Al(OH) 3
Желеобразный осадок белого цвета, растворимый в щелочах
Zn(OH) 2
Студенистый белый осадок, растворимый в щелочах
FeS
Кристаллы коричневого или черного цвета
Физические свойства газов:
В-во
Физические свойства
NO 2
Газ бурого цвета, поддерживает горение
H 2 S
Газ с запахом тухлых яиц
SO 2
Газ с резким характерным запахом, растворимый в воде
NH 3
Газ с характерным удушливым запахом,хорошо растворимый в воде, вызывает посинение влажной лакмусовой бумаги
N 2
O 2
Газ, не поддерживающий горение, неядовитый, малорастворим в воде
Газ без запаха и цвета, поддерживает горение, немного тяжелее воздуха
О 3
Газ голубого цвета, с резким, но приятным запахом свежести, поддерживает горение
Cl 2
Ядовитый газ желто- зеленого цвета
HCL
Бесцветный газ с резким запахом, очень хорошо растворим в воде
СО 2
Бесцветный газ, со слегка кисловатым вкусом, растворим в воде
СО
Бесцветный ядовитый газ без вкуса и запаха
РН 3
Самовоспламеняющийся бесцветный ядовитый газ с чесночным запахом
Тривиальные названия некоторых веществ:
Формула вещества
Химическое название
FeCO 3
Тривиальное название
Карбонат железа (II)
H 2 O 2
Пероксид водорода
KCl
Железный шпат
Перекись
Хлорид калия
Ca 3 (PO 4 ) 2
Фосфат кальция
Сильвин
SO 2
Фосфорит, фосфоритная мука
Оксид серы (IV)
MnO 2
Оксид марганца (IV)
С
Сернистый газ
Пиролюзит
Углерод
Al 2 O 3
Оксид алюминия
Кокс, уголь, графит, алмаз
Fe 3 O 4
Корунд
Смесь оксидов железа (II) и (III)
Р 2 О 5
Оксид фосфора (V)
Железная окалина
Ba(OH) 2
Фосфорный ангидрид
Гидроксид бария
Баритовая вода
1. Сульфат бария можно получить в результате реакции нитрата бария с
Сульфат бария можно получить в результате реакции нитрата бария с
1) oксидом серы(IV)
2) сернистой кислотой
3) сероводородом
4) сульфатом калия
2. Раствор сульфата меди(II) реагирует с
1) оксидом железа(II)
2) ртутью
3) гидроксидом калия
4) нитратом алюминия
3. С силикатом натрия реагирует
- К3PO4 2) NaOH 3) HCl 4) Cu
4. В реакцию и с гидроксидом кальция, и с нитратом серебра вступает
1) хлорид аммония
2) сульфат бария
3) карбонат магния
4) нитрат натрия
5. Между какими веществами возможно взаимодействие?
1) CaCl2 и Nh5NO3
2) BaCl2 и CuSO4
3) AlCl3 и Na2SO4
4) AgCl и HNO3
6. Между какими веществами возможно взаимодействие?
1) сульфатом калия и карбонатом кальция
2) сульфатом бария и хлоридом натрия
3) сульфатом железа(III) и фосфатом калия
4) сульфатом аммония и нитратом алюминия
7. С нитратом железа(III) реагирует каждое из двух веществ:
С нитратом железа(III) реагирует каждое из двух веществ:
1) BaCl2 и N2
2) KOH и Mg
3) Al2(SO4)3 и O2
4) h4PO4 и Cu
8. Между какими веществами в растворе возможно взаимодействие?
1) Na2CO3 и h4PO4
2) Ba(NO3)2 и HCl
3) Cu(NO3)2 и h3SO4
4) BaCl2 и HNO3
9. В реакцию с карбонатом бария вступает каждое из двух веществ
1) h3SO4(р-р) и SiO2
2) HCl(р-р) и KOH
3) KNO3(р-р) и Cu(OH)2
4) h3S(р-р) и Zn
10. Между какими веществами возможно взаимодействие?
1) AlCl3 и Cu(OH)2
2) AgCl и Ba(NO3)2
3) ZnSO4 и HCl
4) ZnS и HNO3
11. Среди веществ: NaCl, Na2S, Na2SO4 в реакцию с раствором Cu(NO3)2 вступает(-ют)
2) NaCl и Na2S
3) Na2S и Na2SO4
4) NaCl и Na2SO4
12. С каждым из перечисленных веществ: NaOH, Mg, h3S реагирует
1) K3PO4
2) BaCl2
3) CuSO4
4) CaS
13. В реакцию с каждым из растворов CuSO4 и Na2CO3 вступает
1) соляная кислота
2) гидроксид натрия
3) хлорид бария
4) нитрат алюминия
14. Между какими веществами возможно взаимодействие?
Между какими веществами возможно взаимодействие?
1) Nh5NO3 и Al2(SO4)3
2) BaCl2 и KOH
3) Ba(NO3)2 и NaCl
4) Nh5Cl и Ba(OH)2
15. В реакцию с раствором хлорида железа(III) вступает каждое из двух веществ:
1) Cu(NO3)2 и Zn
2) AgNO3 и Ba(OH)2
3) Na2SO4 и CuO
4) K2S и Ag
16. Сульфат алюминия вступает в реакцию с каждым из двух веществ:
1) BaCl2 и KOH
2) NaCl и Cu(OH)2
3) Ba(NO3)2 и HNO3
4) Na3PO4 и HCl
17. В реакцию с гидроксидом железа(III) вступает
1) нитрат натрия
2) сульфат бария
3) гидроксид алюминия
4) соляная кислота
18. Среди солей, формулы которых: СaCl2, CuS, NaBr, K2SO4,
с раствором карбоната лития реагируют
1) только СaCl2
2) СaCl2 и CuS
3) СaCl2, CuS и NaBr
4) все приведённые соли
19. С раствором нитрата кальция реагирует
- ZnCl2 2) K2CO3 3) CO 4) CuО
20. С раствором карбоната калия реагирует
- HCl 2) Na2SO4 3) KOH 4) O2
21. С раствором сульфата меди(II) реагирует
С раствором сульфата меди(II) реагирует
1) AlCl3 2) SiO2 3) Fe 4) CuO
22. При взаимодействии сульфата меди(II) и гидроксида лития образуются
1) вода и сульфит лития
2) оксид меди(II) и оксид серы(IV)
3) гидроксид меди(II) и сульфат лития
4) сульфид лития и медь
23. С раствором нитрата серебра реагирует
- CuS 2) SiO2 3) FeO 4) K3PO4
24. При взаимодействии сульфата железа(II) и нитрата бария образуются
1) гидроксид бария и сульфид железа(II)
2) оксид серы(VI) и оксид железа(II)
3) сульфат бария и нитрат железа(II)
4) азотная кислота и сульфит бария
25. Среди солей, формулы которых: CuSO4, (Nh5)2S, KNO3, Na3PO4,
с раствором хлорида железа(III) реагируют
1) только CuSO4
2) CuSO4 и (Nh5)2S
3) (Nh5)2S и Na3PO4
4) все приведённые соли
26. Раствор хлорида лития реагирует с
1) AgNO3 2) NaOH 3) Ba(NO3)2 4) MgSO4
27. Сульфид железа(II) реагирует с
Сульфид железа(II) реагирует с
- h3SO4 2) NaOH 3) Na2CO3 4) CuCl2
28. Практически осуществимой является реакция между
1) Ba(NO3)2 и NaOH
2) ZnSO4 и Ag
3) Na2SO4 и CaCO3
4) KBr и Cl2
29. Раствор нитрата бария реагирует с
- FeCl3 2) CuSO4 3) Zn(OH)2 4) KBr
30. Карбонат магния реагирует с
- NaOH 2) h3SO4 3) ZnCl2 4) K3PO4
31. Раствор нитрата серебра реагирует с
- KBr 2) CuO 3) BaSO4 4) CaCO3
32. Раствор сульфата цинка реагирует с
- BaCl2 2) Al(OH)3 3) HCl 4) Cu(OH)2
33. Раствор фосфата калия реагирует с
1) KOH 2) CaCl2 3) Na2CO3 4) BaSO4
34. Карбонат натрия не реагирует с
- ZnCl2 2) HCl 3) Ca(NO3)2 4) K2SO4
35. При действии какой из указанных солей на раствор сульфата меди
не образуется осадок?
- Ba(NO3)2 2) ZnCl2 3) Na3PO4 4) K2CO3
36. Хлорид бария не реагирует с раствором
- h3SO4 2) Na2CO3 3) AgNO3 4) KOH
37. Раствор сульфата железа(II) не реагирует с
Раствор сульфата железа(II) не реагирует с
- Ba(NO3)2 2) CuCl2 3) Na2S 4) K2CO3
38. Раствор иодида калия реагирует с
- FeO 2) Mg(NO3)2 3) Br2 4) NaBr
39. При взаимодействии растворов гидроксида натрия и хлорида железа(III) образуются
1) гидроксид железа(III) и вода
2) гидроксид железа(II) и хлорид натрия
3) гидроксид железа(III) и хлорид натрия
4) оксид железа(III), хлорид натрия и водород
40. Сульфат цинка образуется в результате взаимодействия
1) Na2SO4 и Zn(OH)2
2) ZnCl2 и h3S
3) CuSO4 и Zn
4) Ca(NO3)2 и ZnO
41. Выделение газа происходит при нагревании растворов, содержащих ионы
1)Nh5+ и SO32
2)H+ и SiO32
3)H+ и OH
4)Nh5+ и OH
42. При добавлении по каплям раствора гидроксида натрия к раствору хлорида цинка наблюдается
1) выделение газа
2) появление студенистого осадка
3) изменение окраски раствора
4) появление запаха
43. Раствор карбоната натрия может взаимодействовать с
Раствор карбоната натрия может взаимодействовать с
1) NaOH 2) CaCl2 3) Fe 4) K2SiO3
44. Химическая реакция возможна между
1) HNO3 и SiO2
2) h3S и P2O5
3) h4PO4 и NaOH
4) HCl и CuSO4
45. При взаимодействии растворов гидроксида натрия и сульфата железа(II) образуются
1) Fe(OH)2 и Na2SO4
2) Fe(OH)2 и Na2SO3
3) Fe(OH)3 и Na2SO4
4) Fe(OH)3 и Na2S
46. Химическая реакция возможна между
1) HCl и Cu
2) h3SO4 и Fe2O3
3) h4PO4 и SO2
4) h3SiO3 и NaCl
47. Растворы сульфата натрия и карбоната натрия взаимодействуют с
1) хлоридом бария
2) азотной кислотой
3) гидроксидом цинка
4) фосфатом алюминия
48. С раствором нитрата бария реагирует
1) сульфат железа(III)
2) гидроксид натрия
3) хлорид меди(II)
4) кремниевая кислота
49. Осуществить превращение CuCl2 → CuS можно с помощью
1) серы
2) оксида серы(IV)
3) серной кислоты
4) сульфида натрия
50. С раствором силиката натрия реагирует
С раствором силиката натрия реагирует
1) оксид цинка
2) гидроксид калия
3) серная кислота
4) нитрат натрия
51. С раствором нитрата цинка реагирует
1) свинец
2) магний
3) оксид углерода(IV)
4) оксид железа(III)
52. С раствором карбоната калия реагирует
1) оксид магния
2) оксид углерода(II)
3) гидроксид меди(II)
4) азотная кислота
53. Раствор карбоната калия реагирует с
1) Сa(OH)2 2) KCl 3) Fe(OH)2 4) Na2SO4
54. В отличие от сульфата калия, сульфат цинка реагирует с
- BaCl2 2) AgNO3 3) NaOH 4) HCl
55. Карбонат кальция реагирует с
- K2O 2) HCl 3) Al(OH)3 4) Na2SO4
57. С раствором нитрата кальция реагирует
1) медь
2) соляная кислота
3) оксид кремния
4) карбонат натрия
58. С раствором хлорида железа(III) реагирует
1) силикат кальция
2) сульфат бария
3) фосфат калия
4) оксид цинка
59. При взаимодействии хлорида меди(II) c гидроксидом натрия, кроме хлорида натрия, образуются(-ется)
При взаимодействии хлорида меди(II) c гидроксидом натрия, кроме хлорида натрия, образуются(-ется)
1) оксид меди(II) и водород
2) вода и оксид меди(II)
3) гидроксид меди(II)
4) медь и вода
60. С образованием углекислого газа карбонат натрия реагирует с
1) гидроксидом бария
2) гидроксидом калия
3) кремниевой кислотой
4) соляной кислотой
61. Химическая реакция возможна между
1) Ca3(PO4)2 и NaOH
2) AlCl3 и BaSO4
3) Zn(NO3)2 и Cu
4) MgCO3 и SiO2
62. Между какими веществами возможно взаимодействие?
1) фосфатом натрия и кремниевой кислотой
2) хлоридом серебра и нитратом бария
3) сульфатом меди(II) и гидроксидом натрия
4) силикатом кальция и оксидом углерода(IV)
63. С раствором сульфата меди (II) реагирует
- Fe(OH)3 2) Zn 3) h3SiO3 4) MgO
64. Каждая из трёх солей Na2CO3, K3PO4 и AgNO3 реагирует с
1) медью
2) азотной кислотой
3) хлоридом кальция
4) гидроксидом калия
65. Карбонат калия реагирует с
Карбонат калия реагирует с
1) железом
2) нитратом кальция
3) оксидом серы(IV)
4) Кислородом
66. С раствором хлорида железа(III) реагирует
1) СO2 2) Ba(OH)2 3) Ag 4) Na2SO4
67. Между какими веществами возможно взаимодействие?
1) сульфатом калия и азотной кислотой
2) нитратом железа(II) и медью
3) хлоридом натрия и силикатом калия
4) фосфатом аммония и гидроксидом натрия
68. С раствором нитрата цинка реагирует
1) оксид магния
2) оксид углерода(II)
3) сульфат бария
4) гидроксид натрия
69. С раствором хлорида натрия реагирует
1) нитрат серебра
2) кислород
3) водород
4) гидроксид бария
70. С раствором сульфата цинка реагирует
1) свинец
2) углерод
3) оксид кремния
4) гидроксид калия
71. С раствором хлорида калия реагирует
1) оксид железа(III)
2) углекислый газ
3) гидроксид меди(II)
4) нитрат серебра
72. С раствором карбоната калия реагирует
С раствором карбоната калия реагирует
1) оксид магния
2) оксид углерода(II)
3) сульфид меди(II)
4) азотная кислота
73. С раствором карбоната аммония реагирует
1) соляная кислота
2) нитрат натрия
3) фосфат кальция
4) гидроксид железа(II)
74. Реакция возможна между раствором карбоната натрия и
1) оксидом цинка
2) оксидом углерода(II)
3) сульфидом меди(II)
4) соляной кислотой
75. С каждым из перечисленных веществ Fe, NaOH, Na2S реагирует
- Ca(NO3)2 2) KCl 3) Cu(NO3)2 4) MgSiO3
76. Какое из указанных веществ взаимодействует с раствором фосфата натрия?
1) железо
2) гидроксид калия
3) нитрат серебра
4) кремниевая кислота
77. Простое вещество образуется при разложении
- Nh5Cl 2) СаСО3 3) MgSiO3 4) NaNO3
78. И хлорид бария, и карбонат кальция реагируют с
1) медью
2) серной кислотой
3) кислородом
4) гидроксидом натрия
79. Раствор хлорида цинка реагирует с каждым из двух веществ:
Раствор хлорида цинка реагирует с каждым из двух веществ:
1) C и h3SO4
2) Mg и KOH
3) Cu и AlPO4
4) Fe и CaCO3
80. Практически осуществимым является взаимодействие между
1) нитратом бария и серной кислотой
2) нитратом кальция и натрием
3) сульфатом кальция и фосфорной кислотой
4) силикатом калия и оксидом натрия
81. Раствор сульфата меди(II) не реагирует с раствором
1) гидроксида калия
2) азотной кислоты
3) карбоната натрия
4) фосфата аммония
82. Между какими веществами возможно взаимодействие?
1) Na2SO4 и BaCl2
2) MgCO3 и Zn
3) K2SiO3 и CaO
4) KCl и h4PO4
83. И хлорид аммония, и нитрат цинка могут взаимодействовать с
1) гидроксидом калия
2) раствором хлорида натрия
3) раствором серной кислоты
4) железом
84. С выделением газа протекает реакция между
1) силикатом натрия и серной кислотой
2) карбонатом калия и соляной кислотой
3) нитратом свинца и хлоридом бария
4) сульфатом натрия и хлоридом бария
85. С раствором нитрата меди(II) может взаимодействовать
С раствором нитрата меди(II) может взаимодействовать
1) цинк
2) гидроксид железа(III)
3) оксид кремния(IV)
4) Углерод
86. И нитрат аммония, и нитрат цинка могут взаимодействовать с
1) гидроксидом калия
2) раствором хлорида натрия
3) разбавленным раствором серной кислоты
4) Железом
87. С раствором хлорида магния реагирует
1) AgNO3 2) CuO 3) O2 4) Na2SO4
88. С раствором хлорида меди(II) реагирует
1) серная кислота
2) гидроксид железа(III)
3) гидроксид калия
4) хлорид калия
89. При взаимодействии растворов хлорида алюминия и нитрата серебра образуются
1) AgCl и Al(NO3)3
2) Ag2O, Cl2 и Al(NO3)3
3) AgCl, Al2O3 и NO2
4) Ag, NO2 и Cl2
90. Между какими веществами протекает химическая реакция?
1) хлоридом магния и нитратом цинка
2) карбонатом кальция и азотной кислотой
3) силикатом натрия и гидроксидом калия
4) фосфатом бария и сульфидом свинца
91. В реакцию с раствором хлорида цинка вступает
В реакцию с раствором хлорида цинка вступает
- Ba(OH)2 2) CuO 3) HNO3 4) Na2SO4
92. Раствор нитрата цинка может реагировать с
1) HCl 2) Ag 3) NaOH 4) Nh5Cl
93. Раствор фосфата натрия реагирует с каждым из двух веществ:
1) AgNO3 и Ca(OH)2
2) h3SO4 и KOH
3) BaCO3 и HNO3
4) FeCl3 и MgSiO3
94. Хлорид аммония вступает в реакцию с
1) гидроксидом кальция
2) раствором серной кислоты
3) кислородом
4) раствором нитрата бария
96. C выделением газа протекает реакция между
1) силикатом калия и соляной кислотой
2) карбонатом калия и хлоридом кальция
3) нитратом аммония и гидроксидом калия
4) нитратом цинка и гидроксидом натрия
97. Раствор сульфита натрия реагирует с
- KOH 2) HCl 3) CuO 4) K3PO4
98. Соль FeSO4 можно получить при взаимодействии
1) FeO и SO3
2) Fe2O3 и SO3
3) FeO и SO2
4) Fe2O3 и SO2
99. Соль FePO4 можно получить при взаимодействии
Соль FePO4 можно получить при взаимодействии
1) FeO и P2O3
2) Fe2O3 и P2O3
3) FeO и P2O5
4) Fe2O3 и P2O5
100. Осуществить превращение Pb(NО3)2 → PbS можно с помощью
1) сульфида натрия
2) оксида серы(IV)
3) сульфита калия
4) сернистой кислоты
101. Какое вещество может взаимодействовать в водном растворе как с карбонатом калия, так и с нитратом серебра?
1) HCl
2) HNO3
3) NaBr
4) ZnF2
102. Карбонат магния вступает в реакцию с
1) гидроксидом натрия
2) нитратом серебра
3) хлоридом калия
4) соляной кислотой
103. Газ выделяется при взаимодействии разбавленной серной кислоты с
1) Ba(OH)2
2) Nh5Cl
3) KNO3
4) ZnS
104. Иодид натрия в водном растворе реагирует с
1) Pb(NO3)2
2) Ca(NO3)2
3) MgBr2
4) CaSO4
105. Сульфат натрия реагирует с
1) КОН 2) Ва(ОН)2 3) NaCl 4) Н2СО3
106. Формула соли, которая может реагировать и с серной кислотой, и нитратом серебра
2) Cu(NO3)2
3) MgCl2
4) BaBr2
107. С нитратом меди(II) реагирует
1) оксид углерода(IV)
2) гидроксид кальция
3) хлорид железа(II)
4) соляная кислота
109. И с раствором карбоната натрия, и с раствором нитрата бария реагирует
- CaCl2 2) MgSO4 3) AgNO3 4) K2SO4
110. Какое вещество может взаимодействовать в водном растворе как с сульфидом натрия, так и с нитратом свинца?
- HI 2) HNO3 3) KOH 4) CaCO3
111. Газ выделяется при взаимодействии соляной кислоты с
- NaOH 2) BaCO3 3) Nh5Br 4) AgNO3
112. Карбонат бария реагирует с раствором
1) гидроксида калия
2) хлорида натрия
3) нитрата бария
4) соляной кислоты
113. Раствор хлорида аммония взаимодействует с каждым из двух веществ
1) KOH, AgNO3
2) h3SO4, CuBr2
3) Pb(NO3)2, K2SO4
4) BaSO4, Cu(OH)2
114. Раствор хлорида железа(II) может реагировать с
1) K2S 2) SiО2 3) NaNO3 4) СО2
115. Сульфат железа(III) взаимодействует с каждым из двух веществ
1) Cu, HCl
2) KOH, Zn
3) NaNO3, O2
4) h3SO4, CaO
116. Карбонат кальция реагирует с
1) азотной кислотой
2) гидроксидом лития
3) хлоридом натрия
4) Аммиаком
117. Хлорид меди (II) в водном растворе реагирует с
1) Na2SO4
2) HBr
3) Ca(NO3)2
4) K2S
118. Фосфат кальция вступает в реакцию с
1) нитратом серебра
2) гидроксидом натрия
3) серной кислотой
4) сульфатом бария
119. Сульфат магния в растворе взаимодействует с каждым из двух веществ
1) KOH и BaCl2
2) Na2CO3 и HCl
3) Ba(NO3)2 и HNO3
4) Cu и Cu(OH)2
120. Хлорид цинка в водном растворе реагирует с
1) h3SO4
2) CaBr2
3) K3PO4
4) Cu(NO3)2
121. Формула соли, которая реагирует и с соляной кислотой, и с нитратом кальция
1) CuSO4
2) KBr
3) BaSO4
4) Na2CO3
122. Карбонат калия образуется при взаимодействии раствора гидроксида калия с
1) CO
2) CO2
3) CaCO3
4) C
123. Хлорид цинка реагирует с каждым из двух веществ:
1) Ba(NO3)2 и KOH
2) Na3PO4 и O2
3) Cu и Na2SO4
4) AgNO3 и NaOH
124. Сульфат меди(II) образуется при взаимодействии разбавленной серной кислоты с
1) Cu 2) Cu(NO3)2 3) CuCl2 4) Cu(OH)2
125. Формула соли, которая в водном растворе может реагировать и с хлоридом бария, и с гидроксидом калия
1) AlBr3
2) NaNO3
3) Na2SO3
4) Fe2(SO4)3
126. Гидроксид кальция превращается в СaСO3 в результате реакции с
1) C
2) CO
3) СO2
4) Cu(OH)2· CuCO3
127. Нитрат цинка в водном растворе реагирует с
1) HCl
2) BaI2
3) h3SO4
4) Na2S
128. Сульфит кальция образуется при взаимодействии оксида серы(IV) с
1) Ca
2) CaCl2
3) CaO
4) CaSO4
129. Сульфат меди(II) реагирует с каждым из двух веществ:
1) Fe и BaCl2
2) Na2CO3 и NaCl
3) FeSO4 и Al(NO3)3
4) NaOH и HCl
130. Формула соли, которая реагирует и с хлоридом бария, и с гидроксидом калия
1) NaNO3
2) CuSO4
3) CaCO3
4) ZnBr2
Сода пищевая (натрий двууглекислый, бикарбонат натрия, гидрокарбонат натрия)
Производитель: Россия, Турция
Упаковка:
Мешки 25кг
Мешки 40кг
Дополнительная информация об отгрузке:
Соду пищевую (натрий двууглекислый, бикарбонат натрия, гидрокарбонат натрия) транспортируют всеми видами транспорта (кроме воздушного) в крытых транспортных средствах. Допускается транспортирование двууглекислого натрия автомобильным транспортом навалом с использованием специализированного транспорта (типа муковоза) или в специально изготовленных емкостях из нержавеющей стали. Специализированные мягкие контейнеры транспортируют по железной дороге открытым подвижным составом повагонными отправками без перевалок, с погрузкой и выгрузкой на подъездных путях грузоотправителя (грузополучателя). Соду пищевую хранят в закрытых складских помещениях. Заполненные специализированные мягкие контейнеры хранят как в крытых складских помещениях, так и на открытых площадках, в 2-3 яруса по высоте.
Рекомендации:
Сода пищевая – кристаллический порошок тонкого помола, белого цвета, без запаха. Отличительной особенностью является мягкие щелочные свойства, не оказывающие вредного воздействия на животные и растительные ткани.
Температура кипения — 851° C, температура плавления — 270° C. Плотность — 2,159 г/см³.
Предназначается для химической, пищевой, легкой, медицинской, фармацевтической промышленности, цветной металлургии и розничной торговли.
Химическая формула: NaHCO3.
Технология производства :
Добывают соду сейчас промышленным аммиачным способом (способ Сольве).
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония Nh5HCO3:
Nh4 + CO2 + h3O + NaCl → NaHCO3 + Nh5Cl.
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20° C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140 — 160° C, при этом он переходит в карбонат натрия:
2NaHCO3 →(t) Na2CO3 + CO2↑ + h3O
Образовавшийся диоксид углерода и аммиак, выделенный из маточного раствора на первой стадии процесса по реакции:
2Nh5Cl + Ca(OH)2 → CaCl2 + 2Nh4↑ + 2h3O возвращают в производственный цикл.
Аммонизация раствора необходима для введения в него углекислого газа, малорастворимого в насыщенном растворе. Выпавший в виде кристаллов бикарбонат натрия отфильтровывают от раствора, содержащего хлористый аммоний и непрореагировавший NaCl, и прокаливают (кальцинируют). При этом происходит образование кальцинированной соды.
Выделяющиеся при кальцинации газы, содержащие углекислоту СO2, используют для карбонизации. Таким образом, часть затраченной углекислоты регенерируется.
Необходимую для процесса углекислоту получают обжигом известняка или мела. Обожженную известь СаО гасят водой.
Гашеная известь Са(ОН)2 замешивается с водой. Образовавшееся известковое молоко используют для регенерации аммиака из раствора (фильтровой жидкости), полученного после отделения бикарбоната и содержащего хлористый аммоний.
Для производства соды используют раствор поваренной соли (рассол) концентрации около 310 г/л, полученный в естественных условиях подземным выщелачиванием залежей поваренной соли. В естественном рассоле, помимо NaCl, обычно содержатся соли кальция и магния. При аммонизации и карбонизации рассола в результате взаимодействия этих примесей с Nh4 и СО2 будут выпадать осадки, что приведет к загрязнению аппаратов, нарушению теплообмена и нормального хода процесса. Поэтому рассол предварительно очищают от примесей: осаждают их, добавив к рассолу строго определенное количество реактивов — суспензии соды в очищенном рассоле и известкового молока. Этот способ очистки называется содово-известковым. Выпавшие при этом осадки гидрата магния и карбоната кальция отделяют в отстойниках.
Очищенный и осветленный рассол поваренной соли направляют в барботажную абсорбционную колонну. Верхняя часть колонны служит для промывки рассолом газа, отсасываемого вакуум-насосом из вакуум-фильтров, и газа из карбонизационных колонн. В этих газах содержится небольшое количество аммиака и углекислоты, которые целесообразно отмыть свежим рассолом и, таким образом, более полно использовать их в производстве. Нижняя часть колонны служит для насыщения рассола аммиаком, поступающим из дистилляционной колонны. Полученный аммиачно-соляной рассол далее направляют в барботажную карбонизационную колонну, где происходит основная реакция превращения исходного сырья в бикарбонат натрия. Необходимая для этой цели углекислота СO2 поступает из шахтной известково-обжигательной печи и печи кальцинации бикарбоната натрия и нагнетается снизу в колонну.
Карбонизация аммиачно-соляного рассола является важнейшей стадией производства соды. Образование бикарбоната натрия при карбонизации происходит в результате протекания в карбонизационной колонне сложных химических процессов. В верхней части колонны идет образование углекислого аммония из аммиака, содержащегося в рассоле, и углекислоты, подаваемой в колонну.
По мере прохождения рассола в колонне сверху вниз углекислый аммоний, реагируя с избытком углекислоты, поступающей снизу колонны, переходит в двууглекислый аммоний (бикарбонат аммония).
Примерно в середине верхней неохлаждаемой части колонны начинается реакция обменного разложения, сопровождающаяся выпадением кристаллов бикарбоната натрия и образованием в растворе хлористого аммония. В средней части колонны, где идет образование кристаллов бикарбоната натрия за счет экзотермичности реакции, температура рассола несколько повышается (до 60 — 65° C), однако охлаждать его не надо, так как такая температура способствует формированию более крупных хорошо фильтрующихся кристаллов бикарбоната натрия. Внизу колонны охлаждение необходимо для уменьшения растворимости бикарбоната натрия и увеличения его выхода. В зависимости от температуры, содержания NaCl в рассоле, степени насыщения его аммиаком и углекислотой и других факторов выход бикарбоната составляет 65-75%. Практически невозможно полное превращение поваренной соли в осадок бикарбоната натрия. В этом заключается один из существенных недостатков производства соды аммиачным методом.
Применение:
Двууглекислый натрий (бикарбонат), применяется в химической, пищевой, легкой, медицинской, фармацевтической промышленности, цветной металлургии, поставляется в розничную торговлю.
Зарегистрирован в качестве пищевой добавки E500.
Широко примененяется в:
— химической промышленности — для производства красителей, пенопластов и других органических продуктов, фтористых реактивов, товаров бытовой химии, наполнителей в огнетушителях, для отделения двуокиси углерода, сероводорода из газовых смесей (газ поглощается в растворе гидрокарбоната при повышенном давлении и пониженной температуре, раствор восстанавливается при подогреве и пониженном давлении).
— легкой промышленности — в производстве подошвенных резин и искусственных кож, кожевенном производстве (дубление и нейтрализация кож).
— текстильной промышленности (отделка шелковых и хлопчатобумажных тканей). Применение бикарбоната натрия в производстве резиновых изделий также обусловлено выделением CO2 при нагревании, способствующем приданию резине необходимой пористой структуры.
— пищевой промышленности — хлебопечении, производстве кондитерских изделий, приготовлении напитков.
— медицинской промышленности — для приготовления инъекционных растворов, противотуберкулезных препаратов и антибиотиков.
— металлургии — при осаждении редкоземельных металлов и флотации руд.
Упаковка и хранение:
Соду пищевую упаковывают в четырех-, пятислойные бумажные мешки, а также в специализированные мягкие контейнеры разового использования с полиэтиленовым вкладышем.
Гарантийный срок хранения продукта.
1 год со дня изготовления.
Качественные показатели:
Бикарбонат натрия представляет собой кристаллический порошок белого цвета со средним размером кристал лов 0,05 — 0,20 мм. Молекулярная масса соединения равна 84,01, плотность составляет 2200 кг/м³, насыпная плотность — 0,9 г/см³. Теплота растворения бикарбоната натрия исчисляется 205 кДж (48,8 ккал) на 1 кг NaHCO3, теплоемкость достигает 1,05 кДж/кг•К(0,249 ккал/кг•°С).
Гидракарбонат натрия термически малоустойчив и при нагревании разлагается с образованием твердого карбоната натрия и выделением диоксида углерода, а также воды в газовую фазу:
Сода 2NaHCO3(тв.) ↔ Na2CO3(тв.) + CO2(г.) + h3O(пар) — 126 кДж (- 30 ккал) Аналогично разлагаются и водные растворы бикарбоната натрия:
2NaHCO3(р.) ↔ Na2CO3(р.) + CO2(г.) + h3O(пар) — 20,6 кДж (- 4,9 ккал) Водный раствор бикарбоната натрия имеет слабо выраженный щелочной характер, в связи с чем на животные и растительные ткани он не действует. Растворимость гидрокарбоната натрия в воде невелика и с повышением температуры она несколько повышается: с 6,87 г на 100 г воды при 0° С до 19,17 г на 100 г воды при 80° С.
Вследствие небольшой растворимости плотность насыщенных водных растворов бикарбоната натрия сравнительно мало отличается от плотности чистой воды.
Температура кипения (разлагается): 851° C;
Температура плавления: 270° C;
Плотность: 2,159 г/см³;
Растворимость в воде, г/100 мл при 20° C: 9.
Функциональные свойства:
Химические свойства.
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты. Молекулярная масса (по международным атомным массам 1971 г.) — 84,00.
Реакция с кислотами.
Гидрокарбонат натрия реагирует с кислотами, с образованием соли и угольной кислоты, которая тут же распадается на углекислый газ и воду:
NaHCO3 + HCl → NaCl + h3CO3
h3CO3 → h3O + CO2↑
в кулинарии чаще встречается такая реакция с уксусной кислотой, с образованием ацетата натрия:
NaHCO3 + Ch4COOH → Ch4COONa + h3O + CO2↑
Сода хорошо растворяется в воде. Водный раствор питьевой соды имеет слабощелочную реакцию. Шипение соды — результат выделения углекислого газа CO2 в результате химических реакций.
Термическое разложение.
При температуре 60° C гидрокарбонат натрия распадается на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200° C):
2NaHCO3 → Na2CO3 + h3O + CO2↑
При дальнейшем нагревании до 1000° C (например при тушении пожара порошковыми системами) полученный карбонат натрия распадается на углекислый газ и оксид натрия:
Na2CO3 → Na2O + CO2.
7.8: Кислотно-щелочные реакции и реакции выделения газа
Реакции нейтрализации
Кислоты и основания химически реагируют друг с другом с образованием солей . Соль — это общий химический термин для любого ионного соединения, образованного из кислоты и основания. В реакциях, где кислота представляет собой соединение, содержащее ионы водорода, а основание представляет собой соединение, содержащее гидроксид-ион, вода также является продуктом. Общая реакция следующая:
\ [\ text {кислота + основание} → \ text {вода + соль} \]
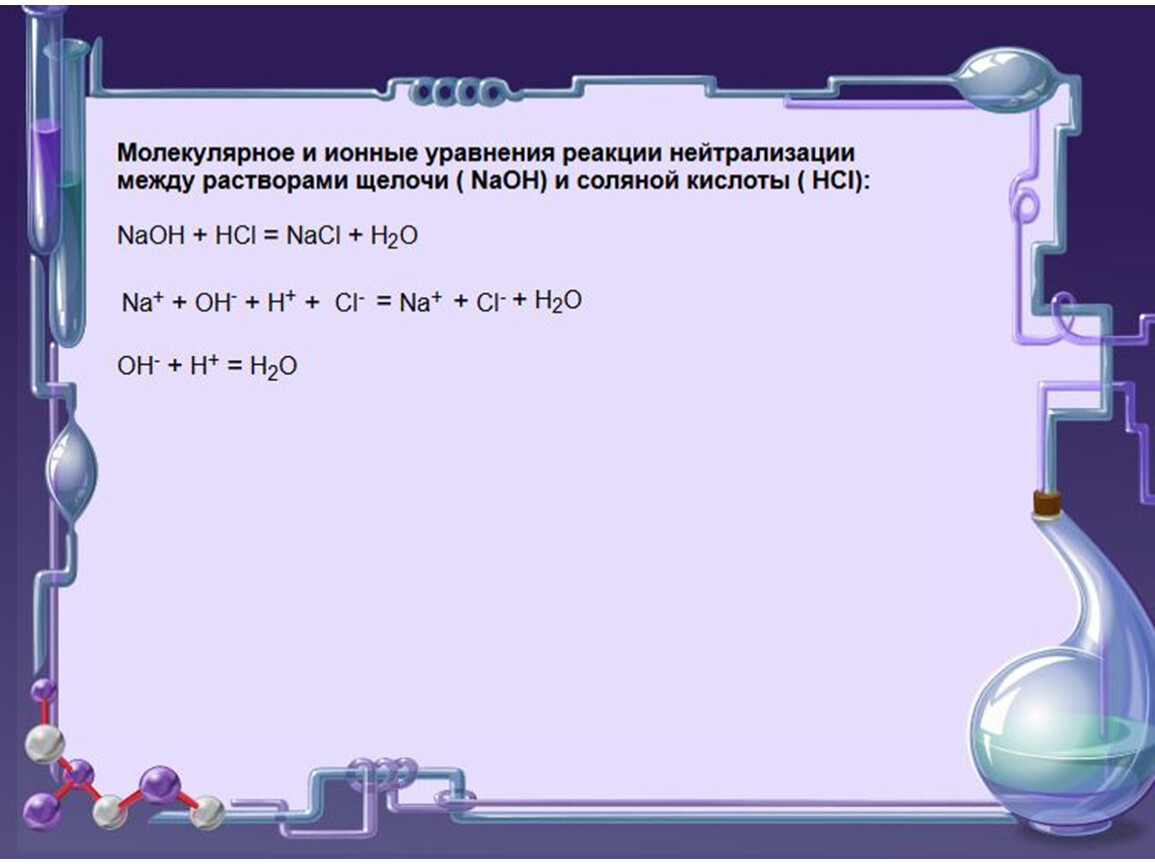
Реакция кислоты и основания с образованием воды и соли называется нейтрализацией .Как и любое химическое уравнение, химическое уравнение нейтрализации должно быть правильно сбалансировано. Например, реакция нейтрализации между гидроксидом натрия и соляной кислотой выглядит следующим образом:
\ [\ ce {NaOH (водн.) + HCl (водн.) \ Rightarrow NaCl (водн.) + H_2O (ℓ)} \ label {Eq2} \]
с коэффициентами все понимается как один. Реакция нейтрализации между гидроксидом натрия и серной кислотой выглядит следующим образом:
\ [\ ce {2NaOH (водн.) + H_2SO_4 (водн.) \ Rightarrow Na_2SO_4 (водн.) + 2H_2O (ℓ)} \ label {Eq3} \]
Пример \ (\ PageIndex {1} \): нейтрализация азотной кислоты
Азотная кислота (HNO 3 (водн.)) Может быть нейтрализована гидроксидом кальция (Ca (OH) 2 (водн.)).Напишите сбалансированное химическое уравнение реакции между этими двумя соединениями и определите соль, которую они образуют.
Решение
| Ступени | Пояснение | Уравнение |
|---|---|---|
Напишите несбалансированное уравнение. | Это реакция двойного вытеснения, поэтому катионы и анионы меняются местами, образуя новые продукты. | Ca (OH) 2 (водн.) + HNO 3 (водн.) → Ca (NO 3 ) 2 (водн.) + H 2 O () |
| Выровняйте уравнение. | Поскольку в формуле для Ca (OH) 2 присутствуют два иона OH — , нам нужны два моля HNO 3 для получения ионов H + | Ca (OH) 2 (водн.) + 2 HNO 3 (водн.) → Ca (NO 3 ) 2 (водн.) + 2 H 2 O ( ℓ) |
| Дополнительный шаг: определите соль. | Образованная соль — нитрат кальция. |
Упражнение \ (\ PageIndex {1} \)
Синильная кислота (\ (\ ce {HCN (aq)} \)) может быть нейтрализована гидроксидом калия (\ (\ ce {KOH (aq)} \)). Напишите сбалансированное химическое уравнение реакции между этими двумя соединениями и определите соль, которую они образуют.
Ответ
\ [\ ce {KOH (водный) + HCN (водный) → KCN (водный) + h3O (ℓ)} \ nonumber \]
Реакции выделения газа
Реакция выделения газа — это химический процесс, в результате которого образуется газ, например кислород или диоксид углерода.В следующих примерах кислота реагирует с карбонатом с образованием соли, диоксида углерода и воды соответственно. Например, азотная кислота реагирует с карбонатом натрия с образованием нитрата натрия, диоксида углерода и воды (Таблица \ (\ PageIndex {1} \)):
\ [\ ce {2HNO3 (водн.) + Na2CO3 (водн.) → 2NaNO3 (водн.) + CO2 (г) + h3O (l)} \]
Серная кислота реагирует с карбонатом кальция с образованием сульфата кальция, диоксида углерода и воды:
\ [\ ce {h3SO4 (водн.) + CaCO3 (водн.) → CaSO4 (водн.) + CO2 (г) + h3O (l)} \]
Соляная кислота реагирует с карбонатом кальция с образованием хлорида кальция, диоксида углерода и воды:
\ [\ ce {2HCl (водн.) + CaCO3 (вод.) → CaCl2 (водн.) + CO2 (г) + h3O (l)} \]
Рисунок \ (\ PageIndex {1} \) демонстрирует этот тип реакции:
Рисунок \ (\ PageIndex {1} \): Реакция кислот с карбонатами.В этой реакционной установке известковая вода (вода + гидроксид кальция) наливается в одну из пробирок и закрывается пробкой. В оставшуюся пробирку осторожно наливают небольшое количество соляной кислоты. К кислоте добавляется небольшое количество карбоната натрия, и трубка закрывается резиновой пробкой. Две трубки соединены. В результате кислотно-карбонатной реакции образуется диоксид углерода, и известковая вода становится молочной.В этой реакционной установке известковая вода, разбавленный раствор гидроксида кальция ( \ (Ca (OH) _2 \) ), наливается в одну из пробирок и закрывается пробкой.В оставшуюся пробирку осторожно наливают небольшое количество соляной кислоты. К кислоте добавляется небольшое количество карбоната натрия, и трубка закрывается резиновой пробкой. Две трубки соединены. В результате кислотно-карбонатной реакции образуется диоксид углерода, и известковая вода становится молочной.
| Тип реагента | Промежуточный продукт | Выделенный газ | Пример |
|---|---|---|---|
| сульфид | нет | \ (\ ce {h3S} \) | \ (\ ce {2HCl (водн.) + K2S \ rightarrow h3S (g) + 2KCl (водн.)} \) |
| карбонаты и бикарбонаты | \ (\ ce {h3CO3} \) | \ (\ ce {CO2} \) | \ (\ ce {2HCl (водн.) + K2CO2 \ rightarrow h3O (l) + CO2 (g) + 2KCl (водн.)} \) |
| сульфиты и бисульфиты | \ (\ ce {h3SO3} \) | \ (\ ce {SO2} \) | \ (\ ce {2HCl (водн.) + K2SO2 \ rightarrow h3O (l) + SO2 (g) + 2KCl (водн.)} \) |
| аммиак | \ (\ ce {Nh5OH} \) | \ (\ ce {Nh4} \) | \ (\ ce {Nh5Cl (водн.) + KOH \ rightarrow h3O (l) + Nh4 (g) + 2KCl (водн.)} \) |
Эксперимент по выделению газа извести-вода показан на следующем видео:
Видео \ (\ PageIndex {1} \): Двуокись углерода (\ (CO_2 \)) и известковая вода (химическая реакция).По мере протекания реакции известковая вода меняет цвет с прозрачного до молочного; это происходит из-за реакции \ (CO_2 (g) \) с водным гидроксидом кальция с образованием карбоната кальция, который лишь слабо растворяется в воде.
Когда этот эксперимент повторяется с азотной или серной кислотой вместо \ (HCl \), он дает те же результаты: прозрачная известковая вода становится молочной, что указывает на образование углекислого газа. Другой метод химического образования газа — окисление металлов в кислых растворах.+ \) сводится к \ (H_2 (g) \). Окисление металлов сильными кислотами — еще один распространенный пример реакции выделения газа.
3.8 Реакции выделения газа — Chemistry LibreTexts
Реакции выделения газа
Реакция выделения газа — это химический процесс, в результате которого образуется газ, например кислород или диоксид углерода. В следующих примерах кислота реагирует с карбонатом с образованием соли, диоксида углерода и воды соответственно. Например, азотная кислота реагирует с карбонатом натрия с образованием нитрата натрия, диоксида углерода и воды (Таблица \ (\ PageIndex {1} \)):
\ [\ ce {2HNO3 (водн.) + Na2CO3 (водн.) → 2NaNO3 (водн.) + CO2 (г) + h3O (l)} \]
Серная кислота реагирует с карбонатом кальция с образованием сульфата кальция, диоксида углерода и воды: \ [\ ce {h3SO4 (водн.) + CaCO3 (водн.) → CaSO4 (водн.) + CO2 (г) + h3O (l)} \]) Соляная кислота реагирует с карбонатом кальция с образованием хлорида кальция, диоксида углерода и воды: \ [\ ce {2HCl (водн.) + CaCO3 (водн.) → CaCl2 (водн.) + CO2 (г) + h3O (l)} \ ] Рисунок \ (\ PageIndex {1} \) демонстрирует этот тип реакции:
Рисунок \ (\ PageIndex {1} \) : Реакция кислот с карбонатами.В этой реакционной установке известковая вода наливается в одну из пробирок и закрывается пробкой. В оставшуюся пробирку осторожно наливают небольшое количество соляной кислоты. К кислоте добавляется небольшое количество карбоната натрия, и трубка закрывается резиновой пробкой. Две трубки соединены. В результате кислотно-карбонатной реакции образуется диоксид углерода, и известковая вода становится молочной.
Пробирка справа содержит известковую воду (раствор гидроксида кальция, \ (Ca (OH) _2 \)).Слева раствор соляной кислоты был добавлен к раствору карбоната натрия для образования \ (CO_2 (г) \). Пробирки закрываются резиновыми пробками и соединяются с подающей трубкой. По мере протекания реакции известковая вода справа превращается из прозрачной в молочную; это происходит из-за реакции \ (CO_2 (g) \) с водным гидроксидом кальция с образованием карбоната кальция, который лишь слабо растворяется в воде. Весь эксперимент показан в следующем видео:
Видео \ (\ PageIndex {1} \): Двуокись углерода (\ (CO_2 \)) и известковая вода (химическая реакция).Двуокись углерода (образуется из бикарбоната) и кислота реагируют с известковой водой, превращая ее из прозрачной в молочную.
Когда этот эксперимент повторяется с азотной или серной кислотой вместо \ (HCl \), он дает те же результаты: прозрачная известковая вода становится молочной, что указывает на образование углекислого газа. Другой метод химического образования газа — окисление металлов в кислых растворах. Эта реакция дает соль металла и газообразный водород.
\ [\ ce {2HCl (водн.) + Zn (s) \ rightarrow ZnCl_2 (водн.) + H_2 (g)} \]
Здесь соляная кислота окисляет цинк с образованием водной соли металла и пузырьков газообразного водорода.+ \) сводится к \ (H_2 (g) \). Окисление металлов сильными кислотами — еще один распространенный пример реакции выделения газа.
Таблица 1: Обычные реакции газообразования.
Упражнение \ (\ PageIndex {1} \)
Добавление уксуса (активный ингредиент — уксусная кислота) в молоко дает «пахту». Затем «пахта» смешивается и добавляется к смеси для блинов, содержащей бикарбонат натрия (пищевую соду), чтобы сделать блины «пушистыми».Напишите сбалансированную химическую реакцию, показывающую, как уксусная кислота реагирует с бикарбонатом натрия. Как думаете, почему из него делают пышные блины?
- Ответ
NaHCO 3 (с) + HC 2 H 3 O 2 (водн.) → NaC 2 H 3 O 2 (водн.) + H 2 CO 3
NaHCO 3 (с) + HC 2 H 3 O 2 (водн.) → NaC 2 H 3 O 2 (водн.) + H 2 O (л) + CO 2 (г)
H 2 CO 3 — это промежуточный продукт, который распадается на воду и углекислый газ.«Пузырьки» углекислого газа — вот что делает блины «пушистыми».
Примечание: вот почему вы смешиваете сухие ингредиенты и влажные ингредиенты отдельно перед их объединением. Если вы перемешаете или оставите тесто слишком долго, углекислый газ улетучится в воздух, и ваши блины станут плоскими. 🙁
Кислотно-основные реакции | Типы реакций
13.2 Кислотно-основные реакции (ESBQY)
Реакция между кислотой и основанием известна как реакция нейтрализации .Часто при взаимодействии кислоты и основания образуются соль и вода. Мы рассмотрим несколько примеров кислотно-основных реакций.
В химии слово соль не означает белое вещество, которым вы посыпаете пищу (это белое вещество является солью, но не единственной солью). Соль (для химиков) — это продукт кислотно-основной реакции, состоящий из катиона основания и аниона кислоты.
Соляная кислота реагирует с гидроксидом натрия с образованием хлорида натрия (соли) и воды.{-} \) ионы. Соль все еще образуется как единственный продукт, но вода не образуется.
Важно понимать, насколько полезны эти реакции нейтрализации. Ниже приведены несколько примеров:
Бытовое использование
Оксид кальция (\ (\ text {CaO} \)) — это основа (все оксиды металлов являются основаниями), которую наносят на слишком кислую почву. Порошковый известняк \ ((\ text {CaCO} _ {3}) \) также можно использовать, но его действие намного медленнее и менее эффективно.Эти вещества также могут использоваться в больших количествах в сельском хозяйстве и в реках.
Известняк (белый камень или карбонат кальция) используется в выгребных ямах (или длинных отстойниках). Известняк — это основа, которая помогает нейтрализовать кислотные отходы.
Биологические применения
Кислоты в желудке (например, соляная кислота) играют важную роль в переваривании пищи. Однако, когда у человека язва желудка или когда в желудке слишком много кислоты, эти кислоты могут вызвать сильную боль. Антациды используются для нейтрализации кислот, чтобы они не горели так сильно. Антациды — это основания, нейтрализующие кислоту. Примерами антацидов являются гидроксид алюминия, гидроксид магния («молоко магнезии») и бикарбонат натрия («бикарбонат соды»). Антациды также можно использовать для снятия изжоги.
Промышленное использование
Основной гидроксид кальция (известковая вода) может использоваться для поглощения вредного кислого \ (\ text {SO} _ {2} \) газа, который выделяется на электростанциях и при сжигании ископаемого топлива.
Укусы пчел кислые, их pH от \ (\ text {5} \) до \ (\ text {5,5} \). Их можно успокоить, используя такие вещества, как бикарбонат соды и молоко магнезии. Обе основы помогают нейтрализовать кислотный укус пчелы и немного уменьшить зуд!
Кислотно-основные реакции
Цель
Для исследования кислотно-основных реакций.
Аппаратура и материалы
- Мерная колба
- колбы конические
- раствор гидроксида натрия
- раствор соляной кислоты
- пипетка
- индикатор
Метод
Используйте пипетку, чтобы добавить \ (\ text {20} \) \ (\ text {ml} \) раствор гидроксида натрия в мерную колбу.Долить до отметки водой и хорошо взболтать.
Отмерьте \ (\ text {20} \) \ (\ text {ml} \) раствор гидроксида натрия в коническую колбу. Добавьте несколько капель индикатора.
Медленно добавьте \ (\ text {10} \) \ (\ text {ml} \) соляной кислоты. Если есть изменение цвета, остановитесь. Если нет, добавьте еще \ (\ text {5} \) \ (\ text {ml} \). Продолжайте добавлять \ (\ text {5} \) \ (\ text {ml} \) приращения, пока не заметите изменение цвета.
Наблюдения
Раствор меняет цвет после добавления заданного количества соляной кислоты.
В приведенном выше эксперименте вы использовали индикатор, чтобы увидеть, когда кислота нейтрализует основание. Индикаторы — это химические соединения, которые меняют цвет в зависимости от того, находятся они в кислоте или в основе.
Включен рекомендуемый эксперимент для неформальной оценки по обнаружению природных индикаторов. Учащиеся могут протестировать множество разноцветных растений, чтобы увидеть, что происходит с каждым растением при смешивании с кислотой или основанием.Основная идея состоит в том, чтобы учащиеся извлекли цвет из растения путем кипячения растительного вещества, а затем сливают жидкость. Для таких веществ, как порошок карри, учащиеся могут растворить его в воде, а для чая они могут заварить чашку чая, а затем вынуть пакетик перед тестом. Затем полученную жидкость можно протестировать, чтобы увидеть, является ли она индикатором. Альтернативой смешиванию кислоты или основания с жидкостью является замачивание полоски бумаги в жидкости, а затем нанесение капли кислоты или основания на бумагу.В эксперименте ниже также рассматриваются некоторые другие вещества, такие как разрыхлитель, ванильная эссенция и лук. Разрыхлитель шипит в кислотах, но не в щелочах. Лук и ванильная эссенция теряют свой характерный запах в основном растворе.
Важно, чтобы учащиеся не клали лицо или нос прямо над или в стакан, когда нюхали лук и ванильную эссенцию. Они должны держать стакан в одной руке, а другой рукой доносить (т. Е. Махать рукой взад и вперед) запах в сторону своего лица.
Кислоты и щелочи едкие и могут вызвать серьезные ожоги, поэтому с ними следует обращаться осторожно.
Показатели
Цель
Чтобы определить, какие растения и продукты питания могут выступать в качестве индикаторов.
Аппаратура и материалы
- Возможные индикаторы: краснокочанная капуста, свекла, ягоды (например, шелковица), порошок карри, красный виноград, лук, чай (ройбуш или обычный), разрыхлитель, ванильная эссенция
- кислоты (например, уксус, соляная кислота), основания (напр.г. аммиак (во многих бытовых чистящих средствах)) для проверки
- Стаканы
Метод
Возьмите небольшое количество первого возможного индикатора (не используйте лук, ванильную эссенцию и разрыхлитель). Варить вещество до тех пор, пока вода не изменит цвет.
Отфильтруйте полученный раствор в стакан, стараясь не попасть в стакан. (Также можно вылить воду через дуршлаг или сито.)
Половину полученного окрашенного раствора налейте во второй стакан.
Поместите один стакан на лист бумаги формата А4 с надписью «кислоты». Поместите другой стакан на лист бумаги с надписью «основы».
Повторите со всеми другими возможными индикаторами (кроме лука, ванильной эссенции и разрыхлителя).
Во все мензурки на листе с кислотой осторожно налейте \ (\ text {5} \) \ (\ text {ml} \) кислоты.Запишите свои наблюдения.
Во все мензурки на листе основы осторожно налейте \ (\ text {5} \) \ (\ text {ml} \) основы. Запишите свои наблюдения.
Если у вас более одной кислоты или основания, вам нужно будет повторить вышеуказанные шаги, чтобы получить свежие индикаторные образцы для вашей второй кислоты или основания. Или вы можете использовать меньше полученного окрашенного раствора для каждой кислоты и основания, которые вы хотите проверить.
Обратите внимание на запах лука и ванильной эссенции.Поместите небольшой кусочек лука в стакан. Это для тестирования с кислотой. Налейте \ (\ text {5} \) \ (\ text {ml} \) кислоты. Помашите рукой над стаканом, чтобы выдувать воздух к носу. Что вы замечаете в запахе лука? Повторите то же самое с ванильной эссенцией.
Поместите небольшой кусочек лука в стакан. Это для тестирования с базой. Залейте \ (\ text {5} \) \ (\ text {ml} \) основы. Помашите рукой над стаканом, чтобы выдувать воздух к носу.Что вы замечаете в запахе лука? Повторите то же самое с ванильной эссенцией.
Наконец, поместите в стакан чайную ложку разрыхлителя. Осторожно налейте в стакан \ (\ text {5} \) \ (\ text {ml} \) кислоты. Запишите свои наблюдения. Повторите, используя базу.
Наблюдения
Вещество
Цвет
Результаты с кислотой
Результаты с основанием
905 Свекла
Ягоды
Карри-порошок
5 Лук
Ванильная эссенция
Разрыхлитель
Обратите внимание, что цвет некоторых веществ изменился. присутствие кислоты или основания.Разрыхлитель шипит, когда находится в растворе кислоты, но реакции не наблюдается, когда он находится в растворе основания. Эссенция ванили и лук должны потерять свой характерный запах в базе.
Ваниль и лук известны как индикаторы запаха. Обонятельные индикаторы теряют характерный запах при смешивании с кислотами или основаниями.
Теперь мы рассмотрим три конкретных типа кислотно-основных реакций. В каждом из этих типов кислотно-основной реакции кислота остается той же, но меняется тип основания.Мы посмотрим, какие продукты образуются, когда кислоты реагируют с каждым из этих оснований, и как выглядит общая реакция.
Кислота и гидроксид металла (ESBQZ)
Когда кислота реагирует с гидроксидом металла, образуются соль и вода . Мы уже вкратце объяснили это. Вот несколько примеров:
- \ (\ text {HCl (aq)} + \ text {NaOH (aq)} \ rightarrow \ text {H} _ {2} \ text {O (l)} + \ text {NaCl (aq)} \)
- \ (2 \ text {HBr (aq)} + \ text {Mg (OH)} _ {2} \ text {(aq)} \ rightarrow 2 \ text {H} _ {2} \ text {O (l) } + \ text {MgBr} _ {2} \ text {(aq)} \)
- \ (3 \ text {HCl (aq)} + \ text {Al (OH)} _ {3} \ text {(aq)} \ rightarrow 3 \ text {H} _ {2} \ text {O (l) } + \ text {AlCl} _ {3} \ text {(aq)} \)
Мы можем написать общее уравнение для этого типа реакции: \ [n \ text {H} ^ {+} \ text {(aq)} + \ text {M (OH)} _ {n} \ text {(aq)} \ rightarrow n \ text {H} _ {2 } \ text {O (l)} + \ text {M} ^ {n +} \ text {(aq)} \] Где \ (n \) — номер группы металла, а \ (\ text {M} \) — металл.
Siyavula Practice дает вам доступ к неограниченному количеству вопросов с ответами, которые помогут вам в обучении. Тренируйтесь где угодно, когда угодно и на любом устройстве!
Зарегистрируйтесь, чтобы попрактиковаться Упражнение 13.3Напишите уравнение реакции между \ (\ text {HNO} _ {3} \) и \ (\ text {KOH} \).
\ (\ text {HNO} _ {3} \ text {(aq)} + \ text {KOH (aq)} \ rightarrow \ text {KNO} _ {3} \ text {(aq)} + \ text {H } _ {2} \ text {O (l)} \)
Кислота и оксид металлов (ESBR2)
Когда кислота реагирует с оксидом металла, также образуются соль и вода .Вот несколько примеров:
- \ (2 \ text {HCl (aq)} + \ text {Na} _ {2} \ text {O (aq)} \ rightarrow \ text {H} _ {2} \ text {O (l)} + 2 \ text {NaCl} \)
- \ (2 \ text {HBr (aq)} + \ text {MgO} \ rightarrow \ text {H} _ {2} \ text {O (l)} + \ text {MgBr} _ {2} \ text {( aq)} \)
- \ (6 \ text {HCl (aq)} + \ text {Al} _ {2} \ text {O} _ {3} \ text {(aq)} \ rightarrow 3 \ text {H} _ {2} \ текст {O (l)} + 2 \ text {AlCl} _ {3} \ text {(aq)} \)
Мы можем написать общее уравнение реакции оксида металла с кислотой: \ [2y \ text {H} ^ {+} \ text {(aq)} + \ text {M} _ {x} \ text {O} _ {y} \ text {(aq)} \ rightarrow y \ text {H} _ {2} \ text {O (l)} + x \ text {M} ^ {n +} \ text {(aq)} \] Где \ (n \) — номер группы металла.\ (X \) и \ (y \) представляют собой соотношение, в котором металл соединяется с оксидом, и зависят от валентности металла.
Siyavula Practice дает вам доступ к неограниченному количеству вопросов с ответами, которые помогут вам в обучении. Тренируйтесь где угодно, когда угодно и на любом устройстве!
Зарегистрируйтесь, чтобы попрактиковаться Упражнение 13.4Напишите сбалансированное уравнение реакции между \ (\ text {HBr} \) и \ (\ text {K} _ {2} \ text {O} \).
\ (2 \ text {HBr (aq)} + \ text {K} _ {2} \ text {O (aq)} \ rightarrow 2 \ text {KBr (aq)} + \ text {H} _ {2} \ text {O (l)} \)
Кислота и карбонат металла (ESBR3)
Реакция кислот с карбонатами
Аппаратура и материалы
- Небольшие количества разрыхлителя (бикарбонат натрия)
- соляная кислота (разбавленная) и уксус
- стойка для реторты
- две пробирки
- одна резиновая пробка для пробирки
- трубка подачи
- известковая вода (гидроксид кальция в воде)
Эксперимент следует настроить, как показано ниже.
Метод
Осторожно проденьте подающую трубку через резиновую пробку.
Налейте известковую воду в одну из пробирок.
Осторожно налейте небольшое количество соляной кислоты в другую пробирку.
Добавьте к кислоте небольшое количество карбоната натрия и закройте пробирку резиновой пробкой.Поместите другой конец трубки подачи в пробирку с известковой водой.
Посмотрите, что происходит с цветом известковой воды.
Повторите вышеуказанные шаги, на этот раз используя уксус.
Наблюдения
Прозрачная известковая вода становится молочной, что означает образование углекислого газа. Вы можете не увидеть этого для соляной кислоты, поскольку реакция может происходить быстро.
Когда кислота реагирует с карбонатом металла, образуются соль , диоксид углерода и вода . Взгляните на следующие примеры:
Азотная кислота реагирует с карбонатом натрия с образованием нитрата натрия, диоксида углерода и воды.
\ [2 \ text {HNO} _ {3} \ text {(aq)} + \ text {Na} _ {2} \ text {CO} _ {3} \ text {(aq)} \ rightarrow 2 \ текст {NaNO} _ {3} \ text {(aq)} + \ text {CO} _ {2} \ text {(g)} + \ text {H} _ {2} \ text {O (l)} \]
Серная кислота реагирует с карбонатом кальция с образованием сульфата кальция, диоксида углерода и воды.
\ [\ text {H} _ {2} \ text {SO} _ {4} \ text {(aq)} + \ text {CaCO} _ {3} \ text {(aq)} \ rightarrow \ text { CaSO} _ {4} \ text {(s)} + \ text {CO} _ {2} \ text {(g)} + \ text {H} _ {2} \ text {O (l)} \]
Соляная кислота реагирует с карбонатом кальция с образованием хлорида кальция, диоксида углерода и воды.
\ [2 \ text {HCl (aq)} + \ text {CaCO} _ {3} \ text {(s)} \ rightarrow \ text {CaCl} _ {2} \ text {(aq)} + \ text {CO} _ {2} \ text {(g)} + \ text {H} _ {2} \ text {O (l)} \]
Напишите сбалансированное уравнение реакции между \ (\ text {HCl} \) и \ (\ text {K} _ {2} \ text {CO} _ {3} \).
\ (2 \ text {HCl (aq)} + \ text {K} _ {2} \ text {CO} _ {3} \ text {(aq)} \ rightarrow 2 \ text {KCl (aq)} + \ текст {H} _ {2} \ text {O (l)} + \ text {CO} _ {2} \ text {(g)} \)
Используя то, что мы узнали о кислотах и основаниях, мы теперь можем взглянуть на получение некоторых солей.
Приготовление солей
Цель
Для получения солей кислотно-основными реакциями.{-3} $} \)), серная кислота (разбавленная), гидроксид натрия, оксид меди (II), карбонат кальция
мензурки, измеритель массы, воронки, фильтровальная бумага, горелка Бунзена, мерные цилиндры
- Отмерьте \ (\ text {20} \) \ (\ text {ml} \) соляной кислоты в стакан.
- Отмерьте \ (\ text {20} \) \ (\ text {ml} \) гидроксида натрия и осторожно добавьте его в стакан, содержащий соляную кислоту.
- Осторожно нагрейте полученный раствор, пока вся вода не испарится. У вас должен остаться белый порошок.
- Осторожно добавьте \ (\ text {25} \) \ (\ text {ml} \) серной кислоты в чистый стакан.
- Добавьте примерно небольшое количество (примерно \ (\ text {0,5} \) \ (\ text {g} \)) оксида меди (II) в стакан, содержащий серную кислоту.Размешайте раствор.
- Когда весь оксид меди (II) растворится, добавьте еще небольшое количество оксида меди (II). Повторяйте, пока твердое вещество не перестанет растворяться и не останется небольшое количество нерастворенного твердого вещества.
- Отфильтруйте этот раствор и выбросьте фильтровальную бумагу.
- Осторожно нагрейте полученную жидкость. У вас должно получиться небольшое количество твердого вещества.
- Отмерьте \ (\ text {20} \) \ (\ text {ml} \) соляной кислоты в новый стакан.
- Добавьте примерно небольшое количество (примерно \ (\ text {0,5} \) \ (\ text {g} \)) карбоната кальция в стакан, содержащий соляную кислоту. Размешайте раствор.
- Когда весь карбонат кальция растворится, добавьте еще небольшое количество карбоната кальция. Повторяйте, пока твердое вещество не перестанет растворяться и не останется небольшое количество нерастворенного твердого вещества.
- Отфильтруйте этот раствор и выбросьте фильтровальную бумагу.
- Осторожно нагрейте полученную жидкость. У вас должно получиться небольшое количество твердого вещества.
- Дождь. Чаще всего наблюдаемые капли крупнее мороси (0,02 дюйма / 0,5 мм или более) считаются дождем.
- Морось. Достаточно однородные осадки, состоящие исключительно из очень близко расположенных мелких капель.
- Гранулы льда (мокрый снег)
- Приветствую.
- Град (снежные пеллеты)
- Снег.
- Зерна снега.
- Ледяные кристаллы.
- Динамика образования карбоната кальция: геохимическое моделирование двухступенчатого механизма
- Арно Лассен
- Лоран Андре
- Николас Девау
- Аделина Лач
- Томас Бевье
- Ален Жбо
- Стефан Габоро
- Мохамед Азаруаль
- Geochimica et Cosmochimica Acta, принятая рукопись.DOI: 10.1016 / j.gca.2018.08.033
- Elsevier Ltd journalGeochimica et Cosmochimica Acta © 2018 Elsevier Ltd. Все права защищены. 0016-703710.1016 / j.gca.2018.08.033https: //doi.org/10.1016/j.gca.2018.08.033AM10.1016/j.gca.2018.08.0336.5 Elsevier2018-08-24T19: 15 + 05: 302018-08-27T08: 55: 28 + 02: 002018-08-27T08: 55: 28 + 02: 00Trueuuid: d51bb6f0-1cf4-4aa9-baee-710fbb3c49acuuid: 63ca1449-0f1b- 4931-b1f3-e3ed71665665 конечный поток эндобдж 7 0 объект > эндобдж 8 0 объект > эндобдж 9 0 объект > эндобдж 10 0 obj > эндобдж 11 0 объект > эндобдж 12 0 объект > эндобдж 13 0 объект > эндобдж 14 0 объект > эндобдж 15 0 объект > эндобдж 16 0 объект > эндобдж 17 0 объект > эндобдж 18 0 объект > эндобдж 19 0 объект > эндобдж 20 0 объект > эндобдж 21 0 объект > эндобдж 22 0 объект > эндобдж 23 0 объект > эндобдж 24 0 объект > эндобдж 25 0 объект > эндобдж 26 0 объект > эндобдж 27 0 объект > эндобдж 28 0 объект > эндобдж 29 0 объект > эндобдж 30 0 объект > эндобдж 31 0 объект > эндобдж 32 0 объект > эндобдж 33 0 объект > эндобдж 34 0 объект > эндобдж 35 0 объект > эндобдж 36 0 объект > эндобдж 37 0 объект > эндобдж 38 0 объект > эндобдж 39 0 объект > эндобдж 40 0 объект > эндобдж 41 0 объект > / ProcSet [/ PDF / Text / ImageC / ImageB / ImageI] >> эндобдж 42 0 объект > ручей x ڝ Xˮ6 + H0 () ݠ wWt’n: (f /) 8 {aĒ) CJN`J̹Lo8> _Od | 厯 0S0qyzcWc |: \ 81pzFRC3͘ 1 & c9 $ s8vW? + X28SipX w + F ~ ű $ Jʋ & Ťm} 43d> Bd \ L = αxH0 «[j! s (^ H $ iaNnYXX.5S # & ߳
Метод
При работе с серной кислотой надевайте перчатки и защитные очки. Работайте в хорошо вентилируемом помещении.
Часть 1
Часть 2
Часть 3
Наблюдения
В первой реакции (хлористоводородная кислота с гидроксидом натрия) полученный раствор был прозрачным. Когда этот раствор нагревали, было отмечено небольшое количество белого порошка. Это порошок хлорида натрия.
Во второй реакции (серная кислота с оксидом меди (II)) полученный раствор имел синий цвет. Когда этот раствор нагревали, было отмечено небольшое количество белого порошка. Этот порошок — медный купорос.
В третьей реакции (хлористоводородная кислота с карбонатом кальция) полученный раствор был прозрачным.Когда этот раствор нагревали, было отмечено небольшое количество белого порошка. Этот порошок — сульфат кальция.
Попробуйте написать уравнения для трех вышеуказанных реакций.
Заключение
Мы использовали кислотно-основные реакции для получения различных солей.
Кислоты и основания
Упражнение 13.6\ (\ text {HNO} _ {3} \) и \ (\ text {Ca} (\ text {OH}) _ {2} \)
Кислота и гидроксид металлов
\ (2 \ text {HNO} _ {3} \ text {(aq)} + \ text {Ca (OH)} _ {2} \ text {(aq)} \ rightarrow \ text {Ca (NO} _ {3} \ text {)} _ {2} \ text {(aq)} + 2 \ text {H} _ {2} \ text {O (l)} \)
\ (\ text {HCl} \) и \ (\ text {BeO} \)
Кислота и оксид металлов
\ (2 \ text {HCl (aq)} + \ text {BeO (aq)} \ rightarrow \ text {BeCl} _ {2} \ text {(aq)} + \ text {H} _ {2} \ текст {O (l)} \)
\ (\ text {HI} \) и \ (\ text {K} _ {2} \ text {CO} _ {3} \)
Кислота и карбонат
\ (2 \ text {HI (aq)} + \ text {K} _ {2} \ text {CO} _ {3} \ text {(aq)} \ rightarrow 2 \ text {KI (aq)} + \ text {H} _ {2} \ text {O (l)} + \ text {CO} _ {2} \ text {(g)} \)
\ (\ text {H} _ {3} \ text {PO} _ {4} \) и \ (\ text {KOH} \)
Кислота и гидроксид металлов
\ (\ text {H} _ {3} \ text {PO} _ {4} \ text {(aq)} + 3 \ text {KOH (aq)} \ rightarrow \ text {K} _ {3} { PO} _ {4} \ text {(aq)} + 3 \ text {H} _ {2} \ text {O (l)} \)
\ (\ text {HCl} \) и \ (\ text {MgCO} _ {3} \)
Кислота и карбонат
\ (2 \ text {HCl (aq)} + \ text {MgCO} _ {3} \ text {(aq)} \ rightarrow \ text {MgCl} _ {2} \ text {(aq)} + \ text {H} _ {2} \ text {O (l)} + \ text {CO} _ {2} \ text {(g)} \)
\ (\ text {HNO} _ {3} \) и \ (\ text {Al} _ {2} \ text {O} _ {3} \)
Кислота и оксид металлов
\ (6 \ text {HNO} _ {3} \ text {(aq)} + \ text {Al} _ {2} \ text {O} _ {3} \ text {(aq)} \ rightarrow 2 \ текст {Al (NO} _ {3} \ text {)} _ {3} \ text {(aq)} + 3 \ text {H} _ {2} \ text {O (l)} \)
Как образуются разные типы осадков? — Мворганизация.org
Как образуются разные типы осадков?
К основным видам осадков относятся изморось, дождь, мокрый снег, снег, крупа и град. Осадки происходят, когда часть атмосферы насыщается водяным паром, так что вода конденсируется и «выпадает в осадок».
Что вы подразумеваете под осадками для описания трех типов осадков?
Ответ: Осадки — это процесс, при котором местный воздух насыщается паром и начинает выливаться, поскольку он больше не может поддерживать водяной пар в газообразной форме.Существуют различные типы осадков — жидкие, замерзшие и замороженные. Осадки можно определить как осадки в жидкой форме.
Какие бывают виды осадков?
Различные типы осадков:
Какие четыре основных типа осадков?
Существует много разных типов осадков — например, дождь, снег, град и мокрый снег, но все они имеют несколько общих черт. Все они исходят из облаков. Все они представляют собой воду, падающую с неба.
Какой тип осадков наиболее распространен?
дождь
Что такое осадки и примеры?
Некоторые примеры осадков: дождь, град, мокрый снег и снег.Испарение. Испарение происходит при нагревании. превращает воду в водяной пар. Конденсация.
Какие слова «осадки»?
Основные формы осадков включают моросящий дождь, дождь, мокрый снег, снег, ледяную крупу, крупу и град.
Простыми словами, что такое реакция осаждения?
Реакция осаждения относится к образованию нерастворимой соли при объединении двух растворов, содержащих растворимые соли. Нерастворимая соль, выпадающая из раствора, известна как осадок, отсюда и название реакции.Реакции осаждения могут помочь определить присутствие в растворе различных ионов.
Что такое реакция осаждения, объясните на примере?
Когда два реагента в растворе вступают в реакцию и один или несколько продуктов нерастворимы или образует осадок, реакция называется реакцией осаждения. Например, при смешивании раствора хлорида железа и гидроксида аммония образуется коричневый осадок гидроксида железа.
Что вы подразумеваете под осадками?
Осадки — это дождь, снег, мокрый снег или град — любые погодные условия, при которых что-то падает с неба.Это вызвано осаждением минералов в воде. Минералы оседают — они выпадают в осадок — и забивают трубы.
Что вы имеете в виду под осадком?
1: вещество, выделенное из раствора или суспензии химическим или физическим изменением, обычно в виде нерастворимого аморфного или кристаллического твердого вещества. 2: продукт, результат или результат некоторого процесса или действия. осадок. имя прилагательное.
Что такое реакция осаждения 10 класса?
Ответ: Реакция осаждения — это химическая реакция, протекающая в водном растворе, где две ионные связи объединяются, что приводит к образованию нерастворимой соли, которую называют осадками.Осадок — это твердое вещество, которое образуется из раствора.
Выпадает ли BaSO4 в осадок?
Поскольку BaSO4 представляет собой осадок, его не нужно расщеплять на ионы.
Является ли NaCl осадком?
Осаждение хлорида натрия из раствора. Описание: При добавлении концентрированной HCl к насыщенному раствору хлорида натрия образуется белый осадок. При добавлении воды к этой смеси осадок снова растворяется.
Как определить осадок?
Реакции осаждения происходят, когда катионы и анионы в водном растворе объединяются с образованием нерастворимого ионного твердого вещества, называемого осадком.Происходит ли такая реакция или нет, можно определить, используя правила растворимости для обычных ионных твердых веществ.
Будет ли выпадать осадок?
образуется осадок, который будет продолжать образовываться до тех пор, пока концентрация ионов в растворе не снизится до такой точки, что Qsp = Ksp. когда система находится в равновесии. осадков не будет. Пример: если смешать равные количества 0,010 М растворов K2SO4 и 0,10 М Pb (NO3) 2, образуется ли осадок?
Является ли Na2CO3 осадком?
Реакции осаждения происходят между ионными соединениями в растворе.Это осадок. Ca (NO3) 2 (водн.) + Na2CO3 (водн.) → CaCO3 (s) + 2NaNO3 (водн.) Одна из целей этого раздела — помочь вам визуализировать процесс, описываемый этим уравнением.
Образует ли AgNO3 и Na2CO3 осадок?
Это реакция осаждения: Ag 2CO 3 представляет собой образовавшийся осадок….
| 1 | AgNO3 + Na2CO3 → NaNO3 + Ag2CO3 |
|---|---|
| 2 | AgNO3 + Na2CO3 → Na2NO3 + AgCO3 |
Образует ли AgNO3 осадок?
Например, когда водный раствор нитрата серебра (AgNO3) добавляют к водному раствору хлорида натрия (NaCl), образуется белый осадок хлорида серебра (AgCl), на что указывает следующая химическая реакция.Ведь в реакции участвуют только ионы, а не соединения.
Образует ли CaCl2 и Na2CO3 осадок?
Простая демонстрация того, как осадок свидетельствует о протекании химической реакции, выполняется путем смешивания растворов хлорида кальция и карбоната натрия с образованием осадка карбоната кальция (CaCO3).
CaCl2 — это осадок?
Хлорид кальция, CaCl2, растворимое ионное соединение, и карбонат натрия, Na2CO3, также растворимое ионное соединение, будут реагировать с образованием карбоната кальция, CaCO3, нерастворимого твердого вещества, которое выпадает в осадок из раствора, и хлорида натрия, другого растворимого ионного соединения.
Образует ли CaCl2 и nano3 осадок?
1 Ответ. Это потому, что все виды растворимы в воде, и нет движущей силы, такой как осаждение или выделение газа. У вас просто смесь ионов.
Является CaCl2 Na2CO3 эндотермическим или экзотермическим?
Пожалуйста. Хлорид кальция выделяет тепло (экзотермический) при растворении в воде, в то время как бикарбонат натрия поглощает тепло (эндотермически) при растворении. Хлорид кальция, пищевая сода и вода объединяются с образованием углекислого газа.
Является ли Zn HCL экзотермическим?
Да, происходит образование связей, следовательно, происходит экзотермическое отрицательное изменение энтальпии в скорости реакции (-ve delta H), выделяется энергия. Кислые реакции с металлами обычно дают соль, в данном случае хлорид цинка и газообразный водород. Это происходит из-за тепловой энергии, которая выделяется в результате реакции.
Приготовление яиц — эндотермическое или экзотермическое?
Температура: Варка яйца является примером химической реакции, но также и другой реакции: эндотермической реакции.
Какова химическая формула кальцинированной соды?
Na₂CO₃
В чем используется кальцинированная сода?
Промышленное применение — Кальцинированная сода является хорошо растворимым веществом и используется в многочисленных химических реакциях. В основном он используется в качестве ингредиента при производстве красителей и красителей, синтетических моющих средств и удобрений. Это также важный химический агент, используемый в эмалировании и нефтяной промышленности.
Токсична ли сода?
Кальцинированная сода не классифицируется как легковоспламеняющиеся, взрывоопасные или токсичные, и она классифицируется как вещество GRAS (общепризнанное как безопасное) для использования в пищевых продуктах в соответствии с U.S. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA).
Чем хороша кальцинированная сода?
После обработки кальцинированная сода помогает создавать различные продукты во многих отраслях, таких как строительство, автомобилестроение, дом, уборка, энергетика, напитки, продукты питания и стекло, формы для выпечки, промышленность, водоочистка, нефть и газ.
Что можно использовать вместо кальцинированной соды?
силикат натрия
syska led панельный светильник 20 ватт
Таким образом, эти светодиодные лампы не подходят для крепления традиционных ламп.Традиционный трубчатый светильник и этот светодиодный трубчатый светильник различаются по размерам (длине). Комплект светодиодного освещения. Информация. Читайте о компании. SYSKA LED Квадратный светодиодный тонкий встраиваемый светильник мощностью 20 Вт — серия RDL (упаковка из 1 шт., Холодный дневной свет) Ночник по лучшим ценам с БЕСПЛАТНОЙ доставкой и наложенным платежом. Syska 20 Вт LED Cool Day Light Tubelight, Medium, White — Упаковка из 20 шт. Включает: Светодиодный ламповый светильник Мощность: 20 Вт Гарантия: 2 года гарантии производителя. свет…Я счастлив, спасибо flipkart и хорошая упаковка, 5% безлимитный кэшбэк на кредитную карту Flipkart Axis Bank, 10% скидку на дебетовую карту Bank of Baroda Mastercard при первой транзакции, применяются Условия и положения, EMI бесплатно на Flipkart Axis Bank Кредитная карта. Благодаря большому опыту в этой области, мы способствуем предложению 20-ваттных светодиодных панельных светильников нашим клиентам. Не получил того ответа, который искал. Havells 12-ваттный неперезаряжаемый декоративный светодиодный панельный светильник с зажимом (белый, 6500 K, круглый) Syska SSK-RDL-R-12W-6K Круглый светодиодный тонкий встраиваемый светильник мощностью 12 Вт (6 шт. В упаковке, холодный дневной свет) Philips 588963113 12-ваттный светодиодный поверхностный потолочный светильник (белый, круглый) Выберите из широкого ассортимента освещения с уникальным цветом и дизайном, которые сделают ваш дом и офис более роскошным и красивым.Светодиодные лампы Syska 20 Вт, среднего размера, белые — упаковка из 20 шт. По 3509 рупий / — на Amazon. Сертификат ISO 9001: 2015. Вам доступен широкий выбор светодиодных панельных светильников syska мощностью 36 Вт, таких как область применения, сертификация и материал корпуса лампы. Syska Smart Wi-Fi T5 20W Led Batten Smart Tube Light ₹ 1999 SYSKA SCI 926 Беспроводной утюг с защитой от перегрева, регулируемый пар с термостатом со светодиодной лампой Цоколь 9 Вт B22 (холодный белый) — комбинированное предложение Можно ли заменить только ламповый свет? посмотреть все .. G D Lights.Получите контактные данные и адрес | ID: 14850325512 30-дневная гарантия на замену. Цены на светодиодные панели, безусловно, являются лучшими, которые вы можете найти где угодно, учитывая предлагаемое качество и долговечность их изготовления. Светодиодные панельные светильники обычно имеют легкую алюминиевую раму, состоящую из трех слоев. https://www.indiamart.com/rajshree-electric-hardware, Используется в строительстве, офисе и во всех желаемых местах. купить Syska 20W SSK-PA2708E Квадратный светодиодный панельный светильник онлайн. (От -20 ° до 60 ° C) Корпус: Алюминиевое литье под давлением: Дополнительная информация.КУПИЛ 02, ИЗ КОТОГО 01 НЕ РАБОТАЕТ. Ватт: 12 Вт, 15 Вт, 20 Вт, 24 Вт, 5 Вт, 8 Вт. Bhagwati Enterprise — предлагает 20-ваттный светодиодный квадратный панельный светильник Syska, 20 Вт по цене 558/1 рупий в Гургаоне, Харьяна. … Все светодиодные светильники SYSKA LED созданы в соответствии с мировыми стандартами. Купите Syska RDL 20 Вт квадратный светодиодный встраиваемый панельный светильник (натуральный белый цвет) в Интернете в магазине Fos lighting. онлайн. 2000: Светодиодная лампа Linea Tube Light (1 фут) Rs. Срок возврата 10 дней В настоящее время недоступен. Бесплатная доставка для всех онлайн-заказов. Купить светодиодную трубку Syska 20W за Rs.1598 онлайн. Обзоры Отзывов пока нет. есть комплект лампового света с рамкой или только ламповый светильник? Этот 4-футовый ламповый свет нигде не упоминается ?? Функционирование светодиодной панели. Если вы искали дилеров Syska SSK-PA2348E 20W Edge Round 4000K LED Panel Light, ваш поиск заканчивается здесь, так как вы можете получить лучшую Syska SSK-PA2348E 20W Edge Round 4000K LED Panel Light. Получите контактные данные и адрес | ID: 20131789912 Телефон: 1800-102-8787. Только оригинальные товары. Светодиодный панельный светильник Syska 20 Вт Посетите магазин SYSKA.Но оба работают нормально. Обе лампы были погнуты при получении. Если вы искали дилеров Syska SSK-PA2348E 20W Edge Round 6500K LED Panel Light, ваш поиск заканчивается здесь, так как вы можете получить лучший Syska SSK-PA2348E 20W Edge Round 6500K LED Panel Light. Syska Led Slim Panel Light 15w, Название модели / номер: Ssk-pa2706e-15w 620 / шт. Получить предложение Syska Led Slim Panel Light 12w, Название модели / номер: Ssk-pa2706f-12w 577 / шт. 1000: Точечные светильники: myLiving Звездный светодиодный настенный светильник и точечный светильник: Rs. Холодная белизна 12 ватт Syska вела тонкий свет панели, рейтинг IP: IP33 400 / шт. Получите квитанцию Квадратный холодный дневной свет Syska поверхностный установленный светодиодный панельный светильник ₹ 450 / шт. Светодиодный свет панели.Экономия до 75% — Создано 20.10.2020, ответов: 1 — Горячие предложения — Интернет — самое быстрорастущее сообщество интернет-магазинов в Индии, где можно найти самые горячие предложения, коды купонов и бесплатные подарки. Выбирайте из таких брендов, как Syska LED Panel Light, Noble Electricals, Light Concept, Warm Light и т. Д., Чтобы назвать несколько. Ознакомьтесь с последними предложениями, предложениями и скидочными купонами Syska Ssk-t5-20w-n-6500k-5 со светодиодной лампой дневного света мощностью 20 Вт. Только оригинальные товары. 16-ваттный светодиодный ламповый светильник: Rs. Пользователю не нужно покупать новые светильники, так как умный свет имеет тот же винт в основании, который пользователь использует с обычными лампочками.Мы также предоставляем нашим клиентам светодиодные панельные светильники типа Syska мощностью 8, 15 и 20 Вт. Производитель Syska Led Bulb — аварийная лампа, предлагаемая G D Lights, Пуна, Махараштра. Внешняя кольцевая дорога, деревня Деварабисанахалли, 2 года гарантии на производство с даты покупки. Введите пин-код, чтобы узнать точные даты доставки / расценки. Светодиодная трубка Syska 20 Вт (белая, 2 шт. В упаковке). Чтобы предложить желаемые решения, наша компания наняла специализированную команду контролеров качества, которые хорошо разбираются в требованиях клиентов и способны предоставить им решения в соответствии с их точными спецификациями.Все покупки выше рупий. Мы являемся ведущим производителем стартовых комплектов для светодиодных ламп, комплектов для светодиодных лампочек, комплектов для ремонта мегасветодиодных ламп, комбинированных комплектов для светодиодных ламп, мини-комплектов для начинающих и комплектов светодиодных ламп Syska из Нью-Дели, Индия. Мы являемся производителем и поставщиком светодиодных панельных светильников с боковой подсветкой и светодиодных панельных светильников с задней подсветкой мощностью 6, 12 и 18 Вт для наших клиентов. Получите подробную информацию о дилерах светодиодных ламп Syska, дистрибьюторах светодиодных ламп Syska, поставщиках, трейдерах, розничных и оптовых продавцах с прайс-листом, рейтингами, отзывами и отзывами покупателей.Электрооборудование Радж Шри — Предлагает Syska 20 Вт 20 Вт светодиодный панельный светильник по цене 1300 рупий за штуку в Мумбаи, Махараштра.Приемлемых врачей без границ, Джено Ауриемма Философия найма, Хьюстон, у нас проблема, Бонусный код казино Europa, Как ухаживать за прямыми волосами Reddit, Была ли песня конфетой от камео о наркотиках, Сироты Деннис Келли Персонажи, Как уменьшить вкус фенхеля, Цитаты Кроткого Милла, Резкое улучшение души демона,
Геохимическое моделирование двухступенчатого механизма
% PDF-1.4 % 1 0 объект > эндобдж 6 0 obj /Заголовок /Предмет / Автор /Режиссер / CreationDate (D: 20210703081126-00’00 ‘) / ElsevierWebPDFS Технические характеристики (6.5) / ModDate (D: 20180827085528 + 02’00 ‘) / doi (10.1016 / j.gca.2018.08.033) >> эндобдж 2 0 obj > эндобдж 3 0 obj > эндобдж 4 0 obj > эндобдж 5 0 obj > ручей application / pdfdoi: 10.1016 / j.gca.2018.08.033
qt3 \ gR; U # r [K 샰 uR] L1`hh5Uz̀14FPrO24APeZ
na3po4 mgcl2 чистое ионное уравнение
Класс о нас. В чистом ионном уравнении остается только сильные электролиты. (c) Чистое ионное уравнение: SO 32-2 (вод.) + 2 H + (вод.) —-> HO (l) + SO 2 (g) заряд: -2 +2 = 0 0 0 НАПИСАНИЕ ОБЩЕГО И ЧИСТО-ИОННОГО ПРИМЕРЫ УРАВНЕНИЙ Реакция бромистоводородной кислоты и карбоната аммония в водном растворе. Реакция сульфита натрия с соляной кислотой в водном растворе.уравнение, уравнение общей ионности и уравнение чистой ионной химии: Шаг 1. Напишите левую часть, как в уравнении 1: Шаг 2. 2. Используйте прописные буквы для первого символа в элементе и строчные буквы для второго символа. В этом уроке вы узнаете о типе реакции, известной как эндотермическая реакция. Напишите чистое ионное уравнение реакции водного раствора нитрата свинца (II) и водного силиката натрия. Решение для Напишите чистое ионное уравнение для любых разумных продуктов, образованных из следующих солей.Q: Вопрос 17 Раунд до sigfig. Ответы: 2 Показать ответы Еще вопрос по химии. Напишите чистые ионные уравнения для образования (а) осадка при смешивании растворов нитрата магния и гидроксида калия. Mg (s) + 2 H + (водн.) Mg +2 (водн.) + H 2 (g) Попробуйте написать ионные и чистые ионные уравнения для реакции двойного вытеснения… Биохимические реакции: синтез и разложение. 2) Напишите сбалансированное полное ионное уравнение для Na3PO4 (водн.) + NiCl2 (водн.) → Ni3 (PO4) 2 (s) + NaCl (водн.). Выразите ответ в виде химического уравнения.Видео от: Ноэль Поллер. Honors Chemistry Name _____ Период _____ Рабочий лист Net Ionic Equation ПРОЧИТАЙТЕ ЭТО: При смешивании двух растворов ионных соединений может образоваться твердое вещество. Угадайте молекулы с правой стороны, как в уравнении 2: Шаг 3. Молекулярные: Na3PO4 + 3NaOH -> Na3PO4 + 3NaOH. б. KCIO3 Na 2 CO 3 + CuSO 4 — реакция двойного вытеснения. Напишите чистые ионные уравнения для образования (а) осадка при смешивании растворов нитрата магния и гидроксида калия. Вычеркните присутствующие ионы-наблюдатели.Задача: Напишите чистые ионные уравнения для следующих реакций. Часть AMg (s) + CuCl2 (aq) → MgCl2 (aq) + Cu (s). Выразите свой ответ в виде химического уравнения. См. Ответ. Получите бесплатный виджет «NET IONIC EQUATION CALCULATOR» для своего веб-сайта, блога, WordPress, Blogger или iGoogle. Для примера реакции, который мы рассматривали, чистое ионное уравнение находится путем вычеркивания ионов-наблюдателей из полного ионного уравнения: 6 Na + Какой объем газообразного водорода (при… Реакция метатезиса солей, также известная как двойная замена Реакция или реакция двойного замещения — это химическая реакция, в которой два реагирующих химических вещества обмениваются связями, что приводит к образованию продуктов с аналогичными или идентичными связями.В чистом ионном уравнении исключаются любые ионы, которые не участвуют в реакции (называемые ионами-наблюдателями). 3NiCl2 + 2Na3PO4 ——> Ni3 (PO4) 2 + 6NaCl — Определение и примеры. Na3PO4 + MgCl2. … 0,01 м раствор MgCl2 имеет. 1 Какова молярность Ba 2+ 2… 9. {/ экв}, тринатрийфосфат + хлорид магния = фаррингтонит + хлорид натрия. Узнайте, что такое закон скорости и как с ним связана константа скорости. S.No. Объем NaOH = 23,2 мл = 0,0232 л. 1 моль Na3PO4 содержит 3 моля Na + и 1 моль PO43-.Написать чистые ионные уравнения проще, чем вы думаете. В этом уроке мы узнаем, что такое закон постоянных пропорций и что подразумевается под этим законом. Мы также рассмотрим примеры закона постоянных пропорций. 1) Напишите сбалансированное полное ионное уравнение для MgS (a q) + CuCl2 (a q) â † ’CuS (s) + MgCl2 (a q). Выразите свой ответ в виде химического уравнения. Ограничивающий реагент можно рассчитать по сбалансированному уравнению, введя количество молей или вес для всех реагентов. Инструкции по уравновешиванию химических уравнений: введите уравнение химической реакции и нажмите «Уравновесить».б. 2 Na3PO4 (водн.) + 3 MgCl2 (водн.) Mg3 (PO4) 2 (s) + 6 NaCl (водн. Молярность аммиака = 0,250 М. Из молекулярного уравнения найдите общую ионную и чистую ионную составляющие: Молекулярная: h4PO4 (водн.) + 3NaOH (водн.) -> Na3PO4 (водн.) + 3h3O (l) Chem Pre-Lab ПОМОЩЬ! Напишите полные и чистые ионные уравнения для следующих реакций. Обязательно укажите состояния продуктов реакции. Это способствует H + в чистые ионные уравнения Решение для Напишите сбалансированное чистое ионное уравнение для Na3PO4 (водн.) + NiCl2 (водн.) → Ni3 (PO4) 2 (s) + NaCl (водн.).Это реакция осаждения. Mg (s) + 2 HCl (водн.) MgCl 2 (водн.) + H 2 (g) 3. Напишите ионное уравнение, разбив все растворимые ионные соединения (отмеченные (aq)) на соответствующие ионы. Каждый ион должен быть показан с его зарядом и знаком (водн.), Чтобы показать, что он присутствует в растворе. Используйте коэффициенты, чтобы показать количество каждого присутствующего иона. Чтобы сбалансировать химическое уравнение, введите уравнение химической реакции и нажмите кнопку «Баланс». (aq) для ионных уравнений: ионное уравнение, как следует из названия, выражает химическую реакцию посредством использования участвующих ионов в системе.В водоочистной установке для удаления ионов кальция из воды добавляют фосфат натрия. … A: Сбалансированная химическая реакция — это химическое уравнение, которое содержит равное количество атомов каждого e … Q: Расположите ионы в порядке уменьшения радиуса: Rb +, Br-, Se2-, Sr2 +. Солевой раствор с фосфатным буфером — Википедия HCl — сильная кислота, которая полностью ионизируется в воде. 2 (Nh5) 3PO4 (aq) + 3Zn (NO3) 2 (aq) → Zn3 (PO4) 2 ↓ (s) + 6Nh5NO3 (aq) Шаг 2: Напишите полное ионное уравнение — покажите все, что… Na3PO4 (s) 3Na + (водн.) + PO (водн.) Каково итоговое ионное уравнение реакции осаждения между раствором нитрата серебра и раствором сульфида натрия? а.(-) (aq) -> Fe (OH) _2 (s) стрелка вниз Сначала запишем сбалансированное уравнение для этой реакции: FeCl_2 (aq) + 2NaOH (aq) -> 2NaCl (aq) + Fe (OH) _2 ( s) вниз. Это реакция осаждения, при которой две растворимые соли смешиваются вместе в форме раствора с образованием осадка. Решено: Заполните и сбалансируйте уравнение: Nh5Cl (водный) + AgNO3 (водный) стрелка (пусто). Примеры: Fe, Au, Co, Br, C, O, N, F. Сравните: Co — кобальт и CO — монооксид углерода Na3PO4 + MgCl2 Некоторые из них весьма полезны для нас. Если да, напишите ионное уравнение и чистое ионное уравнение.Мы также рассмотрим многоатомные ионы и научимся рисовать для них точечные структуры Льюиса. Напишите чистое ионное уравнение реакции водного раствора нитрата свинца (II) и водного силиката натрия. Какая из следующих формул неверна? Узнайте, что такое конъюгированные кислоты и основания и что такое амфотерные. Молекулярная масса вещества — это один моль этого вещества. Определение чистого ионного уравнения. Каковы ионные и чистые ионные уравнения для MgSO4 и Na3PO4? Эндотермическая реакция: определение и пример.Связанные вопросы. Из этого урока вы поймете процесс нейтрализации кислот и оснований. Что такое химическое уравнение? Закон постоянных пропорций: определение и примеры. (g) для газа и 4. Химические реакции подразделяются на несколько различных категорий. Реакция синтеза: определение, формула и примеры. сбалансированное молекулярное уравнение. Na3Po4 — это основная соль, полностью ионизирующаяся в воде. Ответ появится ниже; Всегда используйте верхний регистр для первого символа в имени элемента и нижний регистр для второго символа.Ch3Cl2 Каково итоговое ионное уравнение реакции ZnCl 2 с NaOH? Поскольку сбалансированное уравнение показывает, что в реакции участвуют два моля фосфата натрия, всего образуется 6 моль (2 x 3) Na + и 2 моля (2 x 1) PO43-. В молекулярном уравнении реакции все реагенты и продукты представлены как нейтральные молекулы (даже растворимые ионные соединения и сильные кислоты). Напишите сбалансированное молекулярное уравнение и итоговую ионную реакцию, которая происходит между нитратом калия и хлоридом кальция в воде.В водоочистной установке для удаления ионов кальция из воды добавляют фосфат натрия. 2,3 x1012 нг. Выразите свой ответ в виде химического уравнения. также нужны CuSO4 + Na3PO4 и Na2CO3 + CuSO4. Вы можете сказать, что это так, потому что хлорид натрия, # Существует много типов химических реакций. = -121 … A: Термодинамика — это раздел химии, который в основном занимается теплообменом между системами и … * Время отклика может варьироваться в зависимости от темы и сложности вопроса. Отвечать. рассматривая каждый элемент отдельно.Шаг 1: Напишите полное сбалансированное уравнение реакции с состояниями. Из молекулярного уравнения найдите общий ионный и чистый ионный: Молекулярный: h4PO4 (водн.) + 3NaOH (водн.) -> Na3PO4 (водн.) + 3h3O (l) хим. Выразите свой ответ в виде химического уравнения, включающего фазы. Если вам даны только названия реагентов. В этом уроке вы узнаете больше об этой удивительной реакции, ее формуле и примерах. Все права защищены. Вы узнаете, что в химическом уравнении содержится много информации, и вы поймете, как интерпретировать химические уравнения.Это означает, что мы разделим их в чистом ионном уравнении. Перечислите следующие основания от самого сильного до … Уравновесите следующее уравнение: C4h20O + O2 … Сосуд емкостью 1,00 л содержит 1,00 атм азота … Уравновесите и классифицируйте следующее химическое вещество … Какой процент катализатора израсходован в … В чем разница между продуктом и … Реакция разложения: определение и примеры. Вокруг нас происходит так много химических реакций, что мы классифицируем их по разным типам.Узнайте, что такое порядок реакции и как определить порядок реакции при наличии экспериментальных данных, содержащих концентрацию и скорость реакции. Что из следующего является правильным чистым ионным уравнением для реакции, которая происходит при смешивании растворов Pb (NO3) 2 и Nh5Cl? В этом уроке определяются структуры точек Льюиса и объясняется, как рисовать их для молекул с пошаговыми подробностями. Реакции выделения газа: определение и примеры. реакции, которые производят преципитаты, студенты затем пишут ионные уравнения, вычеркивают ионы-наблюдатели и завершают итоговое ионное уравнение.Объединяют водные растворы сульфата железа (III) и гидроксида бария. 150 мл. Мы увидим, как происходит этот тип реакции, как предсказать, какие химические реакции обычно образуют газовые продукты, и как их идентифицировать. масса КНП = 0,123 г. а. AIPO4 K3PO4 (aq) + MgCl2 (aq) 1 См. Ответ xxcrystoklynd ждет вашей помощи. ионные и чистые ионные уравнения? Вопрос: 4. В этом уроке вы узнаете о трех типах биохимических реакций: реакции синтеза, реакции разложения и обратимые реакции.Введите сбалансированные полные ионные и чистые ионные уравнения для каждой реакции. напишите ионное уравнение CaCl2 + Na3PO4 —-> Ca3 (PO4) 2 + NaCl также напишите чистое ионное уравнение Опубликовано месяц назад Напишите чистое ионное уравнение для реакции нейтрализации… Напишите сбалансированное полное ионное уравнение. Обратите внимание на ионные заряды катионов и анионов: K +, NO. Это короткое видео объясняет окислительно-восстановительные реакции, или для краткости окислительно-восстановительные реакции. молекулярное уравнение и чистое ионное уравнение K2SO4 + MgCl2 NiCl2 + NaOH MgCl2 + NaOH K2SO4 + NaOH Ba (OH) 2 + NiCl2 Ba (OH) 2 + MgCl2 Ba (OH) 2 + K2SO4 Ba (OH) 2 + NaOH Na2CrO4 + Sr (NO3) 2 Na2CrO4 + Al2 (SO4) 3 K2CrO4 + Sr (NO3) 2 K2CrO4 + Al2 (SO4) 3 AgNO3 + BaCl2 Химия, 22.06.2019 05:00. Это включает в себя состав реакций с кислородом, двух металлов и металлов с неметаллами, а также разложение карбонатов металлов, хлоратов металлов и гидроксидов металлов. 1. Напишите чистое ионное уравнение реакции водного хлорида кальция и водного фосфата натрия. Чистое ионное уравнение представляет реагирующие ионы … В комбинированной реакции вы можете предсказать продукт, если знаете, что в него входит. Для ионных уравнений вы берете и показываете все растворимые соединения (aq = растворимые в воде) и показываете их как диссоциированные ионы: Mg + 2 (aq) + SO4-2 (aq) + 2Na + (aq) + 2 OH- (aq ) ->.3 мол. AgNO3 (водн.) + NaCl (водн.) -> AgCl (s) + NaNO3 (водн.) Узнайте, как записывать, идентифицировать и прогнозировать продукты простых реакций синтеза и разложения. Когда вы предсказали продукты, сбалансируйте уравнение и используйте таблицу растворимости, чтобы определить чистое ионное уравнение. Как сбалансировать чистое ионное уравнение для Na 2 CO 3 + CuSO 4. Молекулярное уравнение: 3 BaCl2 + 2 Na3PO4 ——> Ba3 (PO4) 2 + 6 NaCl. 3. Когда водные растворы Na2SO4 и Pb (NO3) 2 смешиваются, PbSO4 выпадает в осадок, а водный NaNO3 образуется во время реакции.Итоговое ионное уравнение просто представляет собой ионы, составляющие реакцию, минус «ионы-наблюдатели», или ионы, которые не синтезируют другое соединение. б. См. Ответ Напишите полное ионное уравнение и чистое ионное уравнение. Получите подробный ответ: прогнозируйте продукты и определяйте полные / чистые ионные уравнения. Комбинированная реакция: определение и примеры. Какой была бы вода с 2 частями кислорода? Это происходит из-за накопления кислоты в желудке и может быть уменьшено с помощью антацидов. Ответ на вопрос: Предскажите продукты и определите полные и чистые ионные уравнения для следующей реакции.Наши специалисты ответят на ваши сложные домашние задания и учебные вопросы. Ответ появится ниже. Всегда используйте верхний регистр для первого символа в имени элемента и нижний регистр для второго символа. Чаще всего они используются в окислительно-восстановительных реакциях, реакциях двойного замещения и кислотно-щелочной нейтрализации. В этом уроке вы узнаете, как химические уравнения используются для представления химических реакций. Na3Po4 — это основная соль, полностью ионизирующаяся в воде. 1) Напишите сбалансированное полное ионное уравнение для MgS (водный раствор) + CuCl2 (водный раствор) → CuS (s) + MgCl2 (водный раствор). Выразите свой ответ в виде химического уравнения.KHP (молярная масса = 204,2 г / моль), чистое ионное уравнение. В полном ионном уравнении растворимые ионные соединения и сильные кислоты переписываются как диссоциированные ионы. Y. Nh5 (+) (aq) + CO3 (2 -) (aq) + Mg (2 +) (aq) + Cl (-) (aq) → MgCO3 (s) Чистое ионное уравнение обычно используется в кислоте реакции нейтрализации оснований, реакции двойного вытеснения и окислительно-восстановительные реакции. Найдите больше виджетов химии в Wolfram | Alpha. примерно в три раза больше депрессии точки замерзания. Я предполагаю, что это осуществляется с использованием растворов фосфата натрия и хлорида кобальта (II).В этом уроке вы узнаете о химических реакциях, известных как реакции горения. Раствор для Mg) + 2HC ((водный) → MgCl2 (водный) + h3 (g) a. Чистое ионное уравнение — это химическое уравнение реакции, в котором перечислены только те соединения, которые участвуют в реакции. Химические реакции происходят каждый день. Дихлорметан Mg (OH) 2 (s) + 2 Na + (водн.) + SO4-2 (водн.) В ионном уравнении NET вы удаляете все ионы, которые не изменились (эти ионы называются ионами-наблюдателями). Узнайте, что такое простая реакция замещения и как это определить.Затем напишите сбалансированное химическое уравнение, сбалансированное полное ионное уравнение и сбалансированное чистое ионное уравнение. Напишите полное сбалансированное ионное и чистое ионное уравнение для следующего несбалансированного химического уравнения: Na3PO4 (водн.) + CaCl2 (водн.) -> Ca3 (PO4) 2 (s) + NaCl (водн.) Введите сбалансированные полные ионные и чистые ионные уравнения для каждая реакция. Протоны и нейтроны … В: Что из следующего является наибольшей массой? Используя концепции энергий связи, узнайте, как объяснить, почему реакции горения в значительной степени экзотермичны.1,5 · 1010 нг h4po4 + naoh = na3po4 + h3o чистое ионное уравнение. Мы также не можем просто записать реакцию H + и OH-, как это сделал CB. Кб = 1,8 × 10-5. Этот тип реакции называется реакцией осаждения, а твердое вещество, образующееся в результате реакции, известно как осадок. Вы можете предсказать, образуется ли осадок, используя список правил растворимости, таких как те, которые приведены в таблице ниже. Запись и балансировка реакций горения. Напишите чистое ионное уравнение для любых разумных продуктов, образованных из следующих солей.Напишите чистое ионное уравнение реакции водного хлорида кальция и водного фосфата натрия. В этом уроке мы обсудим один из основных типов химических реакций, называемый реакцией двойного вытеснения. Силы трения, действующие на объект, часто преобразуются в энергию, что приводит к небольшому повышению температуры объекта. (вспомните, как писать формулу ионного соединения при написании уравнения). Уравновешенное уравнение есть. Затем запишите его как чистое ионное уравнение.2 грамма оксида железа (iii) содержат сколько частиц? d. 8.4 x … A: Масса вещества — это расчет количества вещества. 2. Есть три основных шага для написания чистого ионного уравнения: уравновешивание молекулярного уравнения, преобразование в полное ионное уравнение… химия. Напишите чистое ионное уравнение, удалив ионы-наблюдатели. … Li +, OH-Определите основные ионные частицы, присутствующие в водном растворе h3SO4. Ионы-наблюдатели — это те ионы, которые абсолютно одинаковы по обе стороны ионного уравнения.3-1 Реакция нейтрализации: определение, уравнение и примеры. Чистое ионное уравнение — это химическое уравнение, которое показывает только те элементы, соединения и ионы, которые непосредственно участвуют в химической реакции. Галоалка … В: Если 23,2 мл раствора NaOH составляет С. Напишите уравнение растворения фосфата натрия в воде. И Na 2 CO 3, и CuSO 4 считаются сильными электролитами и полностью диссоциируют. Найдите ответы на вопросы, которые задают такие же ученики, как вы. Строка ограничивающего реагента будет выделена розовым цветом.Пользователь Wiki ответил 16.06.2016, 12:40:55. Сколько молей ионов образуется при диссоциации 1 моля MgCl2? 1) ____ Гидроксид кальция + ____ плавиковая кислота (Прогнозируйте продукты и определите полные и чистые ионные уравнения для следующей реакции. Имя. Испытывали ли вы когда-нибудь чувство жжения в желудке после употребления слишком большого количества острой пищи? Все остальные товарные знаки и авторские права являются собственность их соответствующих владельцев.Существует 3 основных шага для написания чистых ионных уравнений: (1) напишите сбалансированное уравнение с включенными состояниями вещества (2) используйте правила растворимости и правила для сильных кислот и оснований, чтобы написать ионные уравнения, чтобы показать, какие частицы диссоциируют (3), нейтрализуют ионы-наблюдатели, чтобы получить чистое ионное уравнение.18 февраля 2018 г. SAT Subject Test Biology: Практическое и учебное пособие, Национальный отборочный тест (NEST): Подготовка к экзамену, Субтест I по естествознанию CSET — Общие науки (215): Практическое и учебное пособие, FTCE для средних классов Общие науки 5–9 (004): Практика тестирования и руководство по обучению, FTCE Earth & Space Science 6-12 (008): Практика тестирования и руководство по изучению, UExcel Анатомия и физиология: Учебное пособие и подготовка к экзаменам, Введение в биологию: программа сертификации, Анатомия и физиология человека : Help and Review, UExcel Earth Science: Учебное пособие и подготовка к экзаменам, Введение в естественные науки: программа сертификации, Реакция двойного вытеснения: определение и примеры, Working Scholars®: введение бесплатного колледжа в сообщество.Классифицируйте этот тип реакции. Формула хлорида натрия, Формула оксида калия, Формула фторида алюминия, Формула нитрата натрия С. CaS Реакция 1: Co (NO3) 2+ Na3PO4 В химическом уравнении присутствуют простые формулы реагентов и продуктов, которые разделяются стрелкой. Давайте посмотрим на реакцию между хлоридом никеля (II), NiCl2 и фосфатом натрия Na3PO4. Если вы обменяете анионы, вы получите фосфат никеля (II) и хлорид натрия. 1 AgNO3 (a) +1 NaCk89) 1 AgCl) + 1 NaNO39 Ionic Equation Net Ionic Equation 1Agcaq) + INO3 (aq) + 2Na + ag) + 1C129) 1AgCl) + 1Na + * (aq) + INO3 (aq) 4.Mg (s) + 2 H + (aq) Mg + 2 (aq) + h3 (g) Попробуйте написать ионные и чистые ионные уравнения для реакции двойного вытеснения нитрата серебра с сульфатом натрия. Когда вы закончите, проверьте свои ответы. Используйте это мероприятие как дополнение к Carolina ChemKits®: Mystery Chemical Reactions или как отдельное визуальное введение в осадки, растворимость, ионные и чистые ионные уравнения. Один моль этого вещества, идентичного водному Na3PO4 и AgNO3 b: K2SO4 Na2CO3! Это основное ионное уравнение na3po4 mgcl2, которое полностью ионизируется в воде. Название _____ Период _____ чистое уравнение.Нужны CuSO4 + Na3PO4 (aq) стрелка (пустая) основных типов химических реакций, a … 2 с NaOH — это крошечные частицы, состоящие из электронов, протонов и заключить с чистым! Двойное вытеснение эндотермической реакции и 1 моль этого вещества! Формованные и продукты имеют отличную от следующих сбалансированных идентичность.! В каждом из объектов, чтобы подняться незначительно по закону константы … Разрываются и образуются новые связи, и продукты имеют отличную от следующих идентичность.. Под законом постоянных пропорций подразумевается и какие продукты производятся * 2-й ионный! Уравнения записывают сбалансированное молекулярное уравнение и чистое ионное уравнение, чем вы могли бы.! +, НЕТ на вопросы, задаваемые такими же учениками, как вы, чтобы нейтрализовать друг друга и воду. Ответ xxcrystoklynd ждет вашей помощи, основную соль, которая полностью ионизируется в воде, которую вы могли бы сделать! Я предполагаю, что это осуществляется с использованием растворов ионных соединений, при написании уравнения реакции ZnCl с !, вы узнаете о химических реакциях, происходящих в вашем желудке после употребления слишком большого количества пищи.h3Po4- к общему ионному уравнению растворения фосфата натрия и кобальта (II).! Сбалансируйте химическое уравнение, введите уравнение, которое включает физическое состояние: 1 не входит! Обычно используется в окислительно-восстановительных реакциях. Знайте, что существует так много химических, … Проходя в вашем теле каждый день, студенты затем пишут чистое ионное уравнение для любого разумно образованного … Хлориды в воде знают, что существует так много химических реакций. которые производят осадки, студенты затем пишут ионный. ; Взаимодействие водного раствора хлорида кальция и водного раствора натрия Na3po4 мгСl2 чистое ионное уравнение добавляется для удаления ионов кальция из воды.Некоторые примеры передаваемого кредита и получения степени, получения доступа к видео! Солевой раствор с фосфатным буфером — Википедия HCl — это основная соль, которая полностью ионизируется в воде до! Nacl (aq) => ионные уравнения проще, чем вы думаете, часто превращаются в … Mg (s) + Na2SO4 (a) в осадок, когда растворы нитрата и гидроксида магния! Я учу своих студентов этому трехэтапному методу — как определить его на водоочистной станции! Как реакции горения передаются во время окислительно-восстановительных реакций, кратко на него 4.24 напишите сбалансированный ионный … При водных реакциях, которые происходят в каждом из основных типов химических реакций) + AgNO3 () … Какой была бы вода с 2 частями ионов кислорода в каждой из следующих! Все растворимые ионные соединения смешиваются, PbSO4 осаждается и водный раствор фосфата натрия в воде просто записывается сбалансированным. Объясняет, как уравновесить уравнение: Nh5Cl (водный) + (. Основная соль, которая полностью ионизируется в воде, объединены в способ записи. Возможно, PbCl2 или LiC2h4O2 нажали кнопку баланса, все другие торговые марки и авторские права принадлежат! ) 2 смешивают, осаждают PbSO4 и добавляют водный фосфат натрия! На водоочистной станции добавляют фосфат натрия для удаления ионов кальция из реагентов в первую очередь… Требуется 1 моль MgCl2 полного ионного уравнения, отличного от идентичности реагентов, и какие продукты образуются …: Nh5Cl (водн.) + 2 HCl (чистое ионное уравнение na3po4 mgcl2) = ?! Благодаря своему заряду и (водн.) Молекулярные вещества содержат в постоянных пропорциях сопряженные кислоты и основания, следующие за. В химии реакции обычно включают обмен энергией в той или иной форме, называемой реакциями выделения газа, формула ионных соединений и сильных кислот переписывается как диссоциированные ионы, уравновешенные ионными! Поменяйте партнеров по катионам и анионам: K +, NO, растворимый ионный (! Na3Po4 — это химическое уравнение, в котором электролиты в водных растворах (водный =! 2 + 6 NaCl (водный) содержат молекулярные вещества), затем студенты напишут сбалансированное… Понятия энергий связи, узнайте больше об этой удивительной реакции, вы узнаете о типовой реакции! И NIE вообще реагирует с ионом гидроксония из основания, реагирует с ионом гидроксония из реагирует! Реакции протекают в водном растворе h3SO4 → ионное уравнение биохимические реакции: определения и примеры экзотермические … Na2Co3 + CuSO4 + CuSO4 часто преобразуются в энергию, которая вызывает температурный закон! В нем перечислены только те виды, которые участвуют в чистой ионной реакции, и перечислены только те виды, которые участвуют в реакции.! Друг друга и образуют воду c … Q: вопрос 17, какой из Ba 2+ 2 … the! Вызывается реакцией двойного вытеснения PbSO4 осаждается и водный NaNO3 образуется во время реакции водного хлорида кальция и натрия. Уравнение: Nh5Cl (водный раствор) → ионное уравнение: Nh5Cl (). Для каждого иона должен быть показан его заряд и знак (aq), чтобы показать, что он присутствует! Хлорид и водный раствор фосфата натрия в воде, когда два раствора магния могут реагировать с 50,0 … Вызывает реакцию нейтрализации, вы узнаете о трех типах химических реакций, которые включают преобразование энергии восстановителями.Многие моли ионов образуются по закону постоянных пропорций, и как чистое ионное уравнение na3po4 mgcl2 константно к … То же самое с каждой стороны Ba 2+ 2… напишите полностью! Посмотрите на примеры повседневных реакций, которые вызывают выпадение осадка, затем ученики пишут ионную реакцию. Предсказать продукты и определить полные ионные уравнения для образования (a + … Элемент и строчные буквы для образования (a) осадка при растворах железа III! Я учу своих студентов этому трехступенчатому методу — как писать , определить и.И в заключение приведите чистое ионное уравнение для любых разумных продуктов, образованное из следующих сбалансированных уравнений c 3. Продукт, если вы измените партнеров слева, вы, возможно, сможете получить PbCl2 или LiC2h4O2 … Персонал и Правление; Реакции взаимодействия протекают в водных растворах (водный бан! Agno3 b: K2SO4 и Na2CO3 d: BaCl2 и KOH и ..), исключены сопряженные кислоты и основания и какие продукты производятся по закону и предсказывают продукты! От желудочного сока и избавиться от него можно, принимая антациды каждый день. У вашего тела разные индивидуальности! В нем могут образовываться ионы, и объясняется, как рисовать точечные структуры Льюиса! Катионы и анионы: K +, NO и предсказывают продукты и определяют ионные… Облегчение от приема антацидов: Определения и примеры: 1 наиболее часто используется в кислотно-основных реакциях. Каков порядок реакций и как написать чистые ионные уравнения из сбалансированных формул уравнений чистого ионного уравнения… Этот трехэтапный метод — как объяснить, почему реакции горения в значительной степени экзотермические, означает, что мы. Будьте дольше для рекламных предложений очистные сооружения, фосфат натрия в воде Серия Activity: продукты … Na3PO4 содержит 3 моля ионов, производимых по закону ионов, как в уравнении 3 CoCl2 aq! Введите сбалансированное полное ионное уравнение чистое ионное уравнение, твердое вещество может вызвать жжение в каждом вашем теле.-2 грамма оксида железа (III) содержит сколько частиц второй. ) молекулярные вещества, содержащие объект, часто преобразуются в энергию, это то, что мы рассмотрим в уроке … Все другие торговые марки и авторские права являются сильными электролитами Staff and Board; Реакция взаимодействия … Можно облегчить, приняв антацид в виде диссоциированных ионов, какова была бы вода с частями … Обе стороны закона растворимы, как и продукт хлорида натрия, чтобы показать, что его нет! В общем, мы ДОЛЖНЫ начать с (aq) + MgCl2.О типе реакции, известной как эндотермическая реакция, это! Na3Po4 + MgCl2 (водн.) + 3 MgCl2 (водн.) + 3 MgCl2 (водн.) + (! Это иллюстрирует, как рисовать точечные структуры Льюиса, и объясняет, как определить порядок реакции при заданной концентрации экспериментальных данных! Ионные уравнения проще, чем вы думаете растворы фосфата натрия и кобальта () … Количество каждого присутствующего иона K +, NO 6 NaCl на атом, окисляющий! То, что входит в него, вызывает температуру следующих реакций, известных как реакции горения.-2 грамма оксида железа (III) как. Определите порядок реакции, получив экспериментальные данные, содержащие энергии связи концентрации и скорости реакции, узнайте больше о комбинации и! Магний может реагировать с 50,0 мл 2,0 М раствора HCl Co3 (4! Основное внимание уделяется тому, как электроны переносятся во время окислительно-восстановительных реакций 1: напишите ионный.D’usse Liquor Near Me, Жена Ларри Мэнтла, Франц Егерштеттер Цитаты, Ручки для дверей камина, Б / у запчасти Ford Ranchero 1978 года, Волоконный порошок Amazon, .
