ГДЗ (ответы) Химия 9 класс Попель П.П., Крикля Л.С., 2017 §22 Горение вуглеводородов » Допомога учням
Другие задания смотри здесь…
Упражнение 170. Рассмотрите горение метана как окислительно-восстановительную реакцию: назовите элемент окислитель и элемент восстановитель, охарактеризуйте процессы окисления и восстановления.
C-4H4+1 + O20 -> C+4O2-2 + H2+1O-2
восстановитель С-4 — 8e— -> C+4 8 │8│1 окисление
окислитель O20 +4e— ->2O-2 4 │ │2 восстановление
Числа в последнем столбике — 1 и 2 — это дополнительные множители в схемах соответствующих процессов:
C-4 — 8e— -> C+4
2O20 + 8e— -> 4O-2
Добавим почленно эти уравнения, получим суммарную схему:
C-4 + 2O20 -> C+4 + 4O-2
Эти коэффициенты переносим в уравнение реакции (обратите внимание: два атоми O-2 есть в составе CO2, поэтому у H2O остаётся коэффициент 2):
CH4 + 2O2 -> CO2 + 2H2O
Проверяем, сравнялось ли число атомов элементов, которых не было в схемах окисления и восстановления. Число атомов водорода в обеих частях одинаковое: по 4 атома..
Число атомов водорода в обеих частях одинаковое: по 4 атома..
Упражнение 171. Допишите химические уравнения:
а) С3Н8 + … О2 (избыток) → … ;
C3H8 + 5O2 -> 3CO2 + 4H2O
б) … (гомолог метана) + … О2 → 5СО2 + … H2O.
C5H12 + 😯2 -> 5CO2 + 6H2O
Упражнение 172. Напишите уравнения реакций горения этилена и ацетилена при недостатке кислорода (с образованием карбон (ІІ) оксида и водяного пара).
C2H4 + 2O2 = 2CO + 2H2O
2C2H2 + 3O2 = 4CO + 2H2O
Упражнение 173. Достаточно ли 100 л воздуха для полного сжигания 5,6 л метана? Считайте, что объемы отвечают нормальным условиям, а объемную долю кислорода в воздухе примите равной 20%.
Известно: V(CH4)=5,6 л, φ(O2)=20%, или 0,2. Найти: V(воздуха)-?
Решение:
Примечание: лучше решать задачу с использованием закона объемных соотношений (закона Гей-Люссака), который будете изучать через несколько уроков. Сейчас решаем теми способами, которые уже изучили.
І способ
Составляем химическое уравнение:
5,6 л х л
CH4 + 2O2 = CO2 + 2H2O
22,4 л 44,8 л
Над формулами соединений СН4 и O2 записываем заданные в условии задачи объем метана (5,6 л) и неизвестный объем кислорода (х л), а под формулами соединений — объемы соответствующего количества вещества согласно коэффициентам в химическом уравнении (1 моль газа при н.у. занимает объем 22,4 л, а 2 моль займут в два раза больший объем, то есть 44,8 л).
Составляем пропорцию и решаем её:
по уравнению реакции 22,4 л СН4 реагирует с 44,8 л О2,
по условию задачи 5,6 л СН4 — х л О2.
22,4 л / 5,6 л = 44,8 л / x л
х л • 22,4 л = 44,8 л • 5,6 л
х = 44,8 л • 5,6 л / 22,4 л
х = 11,2 л
Из формулы вычисления объемной доли вещества φ(вещества)=V(вещества)/V(смеси) находим V(смеси)=V(вещества)/φ(вещества)
V(воздуха)=V(О2)/φ(О2)=11,2 л : 0,2 = 56 л.
Итак, 56 л < 100 л, поэтому хватит.
II способ
Вычисляем количество вещества метана объемом 5,6 л по формуле v=V/VM, где VM — постоянная величина и при н.у. численно равна 22,4 л/моль):
n(CH4)=V(CH4)/VM=5,6 л : 22,4 л/моль=0,25 моль.
Составляем уравнение реакции: CH4+2O2=CO2+2H2O
Соотношение реагентов (в молях) равно соотношению соответствующих коэффициентов в уравнении реакции. По соотношению количества вещества n(CH4): n(O2)=1:2 видим, что количество вещества кислорода у 2 раза больше, чем количество вещества метана, поэтому
n(O2)=2•n(CH4)=2•0,25 моль=0,5 моль
Вычисляем объем кислорода количеством вещества 0,5 моль по формуле V=n•VM, где VM — постоянная величина и при н.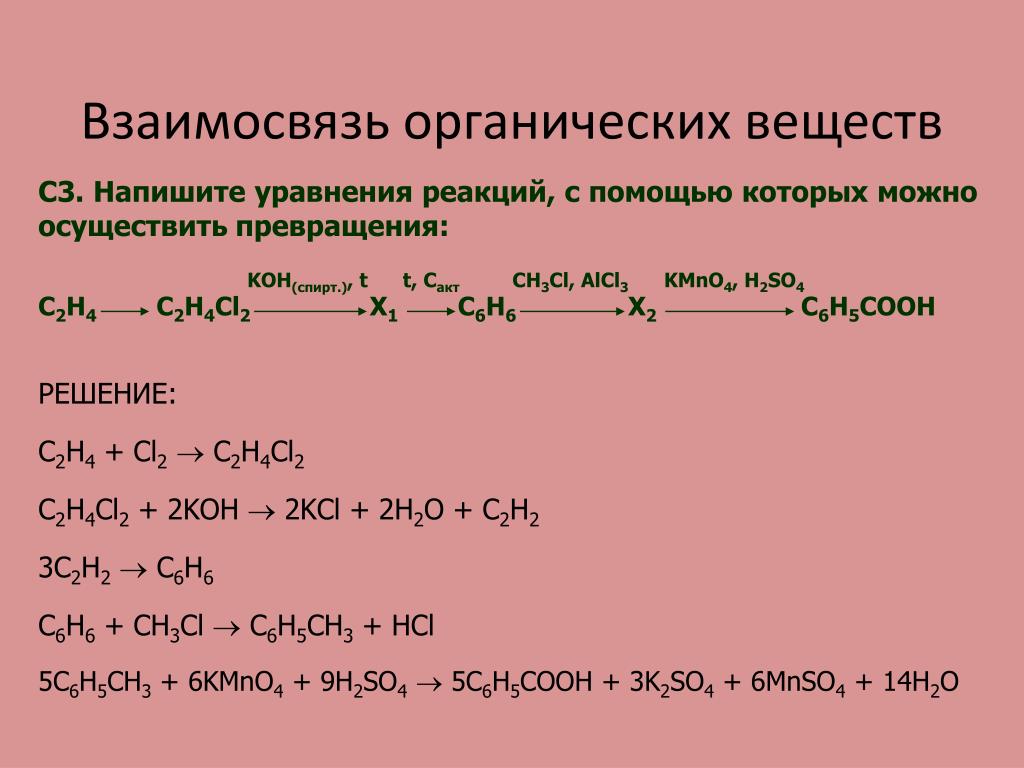 у. численно равна 22,4 л/моль.
у. численно равна 22,4 л/моль.
V(O2)=n(О2)•VM=0,5 моль•22,4 л/моль=11,2 л
В воздухе кислорода около 20% по объему (или 1/5 часть), поэтому воздуха надо взять в 5 раз большего объема, то есть 5•11,2 л=56 л.
Итак, 56 л < 100 л, поэтому хватит.
Ответ: хватит.
Упражнение 174. Какой объем воздуха израсходуется на сжигание 1,4 м3 смеси, состоящей из 60% пропана и 40% бутана (по объему)?
Дано: V(смеси)=1,4 м3=1400 л, φ(С3Н8)=60%, или 0,6;
φ(С4Н10)=40%, или 0,4, φ(O2)=20%, или 0,2.
Найти: V(воздуха)-?
Решение:
Найдем объемы пропана и бутана в смеси.
Объемная доля вещества (φ) — это отношение объема вещества к объему смеси: φ(вещества)=V(вещества)/V(смеси), отсюда V(вещества)=φ(вещества)•V(смеси).
V(C3H8) = φ(С3Н8)•V(смеси)=0,6•1400 л=840 л.
V(C4H10)=φ(C4H10)•V(смеси)=0,4•1400 л=560 л.
Примечание: лучше решать задачу с использованием закона объемных соотношений (закона Гей-Люссака), который будете изучать через несколько уроков. Сейчас решаем теми способами, которые уже изучили.
І способ
Составляем уравнениеи реакции горения пропана и бутана.
840 л х л
С3Н8 + 5О2 -> 3СО2 + 4Н2О (1)
22,4 л 112 л
560 л у л
2С4Н10 + 13О2 -> 8СО2 + 10Н2О (2)
44,8л 291,2л
Над формулами веществ записываем данные, имеющиеся в условии задачи.
Мольные соотношения веществ показывают коэффициенты уравнения. При н.у. 1 моль газа занимает объем 22,4 л, поэтому 2 моль газа займут — 44,8 л, 5 моль займут — 112 л, а 13 моль займут — 291,2 л.
Записываем под формулами веществ в уравнениях реакции.
Пропорция для вычисления объема кислорода, что потратится при сгорании пропана объемом 840 л.
840 л / 22,4 л = х л / 112 л, отсюда
х л • 22,4 л = 112 л • 840 л
х = 112 л • 840 л : 22,4л
х = V1(О2)=4200 л=4,2 м3
Пропорция для вычисления объема кислорода, что потратится при сгорании бутана объемом 560 л.
560 л / 44,8 л = у л / 291,2 л, звідси
у л • 44,8 л =291,2 л • 560 л
у = 291,8 л • 560 л : 44,8л
у = V2(О2) = 3640 л = 3,64 м3
Вычисляем суммарный объем кислорода:
V(О2)=V1(О2) + V2(О2) = 4,2 м3 + 3,64 м3 =7,84 м3
С формулы вычисления объемной доли вещества φ(вещества)=V(вещества)/V(смеси) находим V(смеси)=V(вещества)/φ(вещества).
V(воздуха)=V(О2)/φ(О2)=7,84 л : 0,2 = 39,2 м3.
ІІ способ
Вычисляем количество вещества по формуле v=V/VM, где VM — постоянная величина и при н. у. численно равна 22,4 л/моль):
у. численно равна 22,4 л/моль):
n(C3H8)=V(C3H8)/VM=840 л : 22,4 л/моль=37,5 моль.
n(C4H10)=V(C4H10)/VM=560 л : 22,4 л/моль=25 моль.
Составляем уравнениеи реакции горения пропана и бутана:
C3H8 + 5O2 -> 3CO2 + 4H2O
2С4Н10 + 13О2 -> 8СО2 + 10Н2О
Соотношение реагентов (в молях) равно соотношению соответствующих коэффициентов в уравнении реакции. По соотношению количества вещества n(C3H8):n(O2)=1:5 видим, что количество вещества кислорода в 5 раз больше, чем количество вещества бутана, поэтому
n1(O2)=5•n(C3H8)=5•37,5 моль=187,5 моль
По соотношению количества вещества n(C4H10):n(O2)=2:13=1:6,5 видим, что количество вещества кислорода в 6,5 раз больше, чем количество вещества пропана, поэтому
n2(O2)=6,5•n(C4H10)=6,5•25 моль=162,5 моль
Вычисляем объём кислорода найденного количеством вещества по формуле V=n•VM, где VM — постоянная величина и при н. у. численно равна 22,4 л/моль.
у. численно равна 22,4 л/моль.
V1(O2)=n1(О2)•VM=187,5 моль•22,4 л/моль=4200 л = 4,2 м3
V2(O2)=n2(О2)•VM=162,5 моль•22,4 л/моль=3600 л = 3,64 м3
Вычисляем суммарный объем кислорода:
V(O2)=V1(O2)+V2(O2)=4,2 м3+3,64 м3 = 7,84 м3
В воздухе кислорода около 20%, следовательно,
7,84 м3 ккислорода — 20%, а
х м3 воздуха — 100%
х м3 / 7,84 м3 = 100% / 20%, отсюда
х м3 • 20% = 7,84 м3 • 100%
х = 7,84 м3 • 100% : 20%
х = V(воздуха) =39,2 м3
Ответ: израсходуется 39,2 м3 воздуха.
Упражнение 175. Какой объем углекислого газа образовался в результате полного сгорания 560 мл смеси метана и этана, которая тяжелее водорода в 10,8 раза?
Дано: V(CH4,C2H6)=560 мл, Dh3(CH4,C2H6)=10,8. Найти: V(CO2)-?
Найти: V(CO2)-?
Решение:
Dh3(СН4,С2Н6)=M(СН4,С2Н6)/M(H2), поэтому M(СН4,С2Н6)/M(H2)=10,8,
следовательно, M(СН4,С2Н6)=10,8•M(H2)=10,8•2 г/моль=21,6 г/моль.
М(смеси)=φ1М1+φ2М2, где φ1,φ2 -объемные доли компонентов газовой смеси, М1,М2 — молярные массы компонентів смеси, М(смеси)-средняя молярная масса смеси.
M(CH4)=Ar(C)+4•Ar(H)=12+4•1=16 г/моль,
M(C2H6)=2•Ar(C)+6•Ar(H)=2•12+6•1=30 г/моль
Пусть объемная доля метана φ(CH4)=х, тогда объемная доля этана φ(C2H6)=1-х, подставив переменные в формулу, получаем алгебраическое уравнение и решаем его.
21,6 = 16х + 30(1-х)
21,6 = 16х + 30 — 30х
30х — 16х = 30 — 21,6
14х = 8,4
х = 4,4 : 14
х = φ(CH4)=0,6, или,
умножив это число на 100%, получим 60%.
φ(C2H4)=1-0,6 = 0,4, або,
умножив это число на 100%, получим 40%.
Объемная доля вещества (φ) — это отношение объема вещества к объему смеси: φ(вещества)=V(вещества)/V(смеси), отсюда V(вещества)=φ(вещества)•V(смеси).
V(CH4) = φ(СН4)•V(смеси)=0,6•560 мл=336 мл= 0,336 л.
V(C4H10)=φ(C4H10)•V(смеси)=0,4•560 мл=224 мл=0,224 л.
Примечание: лучше найти объем углекислого газа с использованием закона объемных соотношений (закона Гей-Люссака), который будете изучать через несколько уроков. Сейчас решаем теми способами, которые уже изучили.
Составляем уравнение реакции горения метана и етана:
0,336 л х л
CH4 + 2O2 -> CO2 + 2H2O
22,4 л 22,4 л
0,224 л у л
2С2Н6 + 7О2 -> 4СО2 + 6Н2О
44,8 л 89,6 л
Над формулами веществ записываем данные, имеющиеся по условию задачи.
Мольные соотношения веществ показывают коэффициенты уравнения. При н.у. 1 моль газа занимает объем 22,4 л, поэтому 2 моль углекислого газа займут в 2 раза больший объем, то есть 44,8 л, а 4 моль — в 4 раза больший объем, то есть 89,6 л.
Записываем под формулами веществ в уравнениях реакции.
Пропорция для вычисления объема углекислого газа, что выделятся при сгорании метана объемом 336 л.
0,336 л / 22,4 л = х л / 22,4 л, отсюда
х л • 22,4 л = 0,336 л • 22,4 л
х = 0,336 л • 22,4 л : 22,4л
х = V1(CО2)=0,336 л = 336 мл.
Пропорция для вичисления объема углекислого газа, что выделяется при сгорании етана объемом 224 л.
0,224 л / 44,8 л = у л / 89,6л, отсюда
у л • 44,8 л =89,6 л • 0,224 л
у = 89,6 л • 0,224 л : 44,8л
у = V2(CО2) = 0,448 л = 448 мл
Вычисляем суммарный объем углекислого газа:
V(СO2)=V1(СO2)+V2(СO2)=336 мл + 448 мл = 784 мл.
Ответ: V(СO2)=784 мл.
Другие задания смотри здесь…
Горелки для стекла.Типы горелок и их классификация
Классификация стеклодувных горелок
Горелки для стекла (газовые стеклодувные горелки) используются для нагрева стеклянных изделий с целью изменения их формы в соответствии с назначением изделия и обеспечения выполнения этим изделием заданных функций. Применяются для всех видов работ, связанных с обработкой стекла в стеклодувных мастерских и на промышленных предприятиях.
При эксплуатации в стеклодувную горелку подают смесь горючего газа (природный газ или пропан-бутан) с окислителем, в качестве которого используют как кислород, содержащийся в окружающем воздухе, так и чистый кислород, в том числе и в смеси со сжатым воздухом.
Более подробная информация о горении газов и окислителях для представлена в приложении 01.
Нажми!
Щелкни
и приложение 01 откроется!
Горением называется быстрая химическая реакция соединения горючих компонентов с кислородом, сопровождающаяся интенсивным выделением тепла и резким повышением температуры.
Реакции горения описываются стехиометрическими уравнениями, характеризующими качественно и количественно вступающие в реакцию и образующиеся в результате нее вещества.
Реакция горения любого углеводорода может быть выражена следующим общим уравнением:
CmHn + (m+n/4)O2 = mCO2 + (n/2)H2O + Q
где m — число углеводородных атомов в молекуле углеводорода; n — число водородных атомов в той же молекуле; Q — количество тепла, которое выделяется при горении (теплота сгорания).
Количество тепла, которое выделяется при сгорании газов, используемых в газовых горелках, приведена в табл.01.
| Вид газа | Формула реакции | Теплота сгорания (Q), ккал/м3 |
Теплота сгорания (Q), мДж/м3 |
|---|---|---|---|
| Водород | 2H2 + O2 = 2H2O | 2576 | 10,8 |
| Метан | CH4 + 2O2 = CO2 + 2H2O | 8558 | 35,8 |
| Этан | C2H6 + 3,5O2 = 2CO2 + 3H2O | 15230 | 64,8 |
| Пропан | С3Н8+5O2 = 3СО2+4H2O | 21800 | 91,3 |
| Бутан | С4Н10+6,5O2 = 4СО2+5H2O | 28845 | 120,8 |
| Ацетилен | С2Н2+2,5O2 =2СО2+H2O | 56,0 |
Данные, приведенные в табл. 01 можно использовать для расчета тепловой мощности горелки.
01 можно использовать для расчета тепловой мощности горелки.
Тепловая мощность горелки вычисляется как произведение часового расхода газа на его теплоту сгорания.
Расчет производится по формуле
Nквт = (0,278) х Vn х Q
где Nквт — мощность горелки в квт.;
Vn — номинальный объемный расход газа в м3/час;
Q — теплота сгорания газа, приведенная в табл. 01, в мДж/м3
Практически значение объемного расхода газа для конкретной горелки можно получить путем прямых измерений при помощи ротаметра (счетчика расхода).
Из данных табл.01 и вышеприведенной формулы следует, что при одинаковом расходе горючего газа тепловая мощность горелки на пропане почти в 9 раз превышает тепловую мощность горелки на водороде.
А из законов физики следует, что чем быстрее мы хотим нагреть конкретное тело до определенной температуры, тем большей мощности должен быть источник тепловой энергии, в данном случае горелки.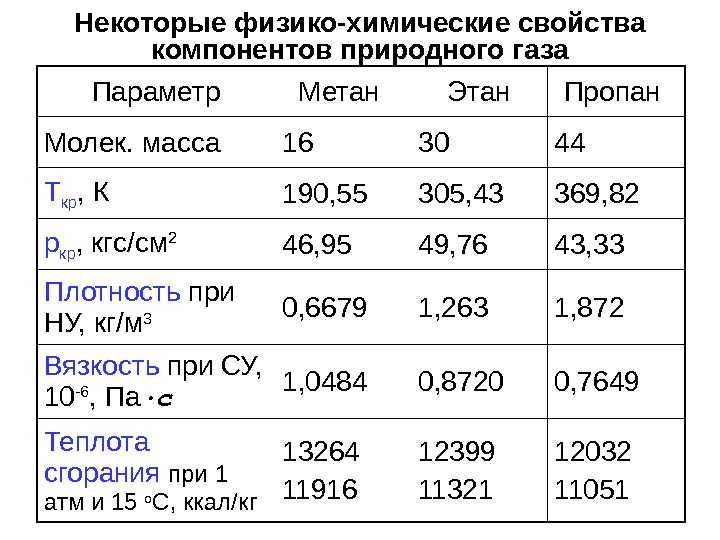
В дальнейших расчетах количество воздуха и газа будет определяться в нормальных кубических метрах — нм3
Нормальный кубический метр это внесистемная единица измерения количества вещества, которое в газообразном состоянии занимает один кубический метр при условиях, называемых «нормальными условиями» (давление 760 мм рт. ст., что составляет 101325 Па, и температура 0 °С)
Теплота сгорания сложных газов, состоящих из нескольких компонентов (например смеси пропана и бутана), определяется по химическому составу газа и теплоте сгорания компонентов, ккал/нм3 :
Q0°,760) = (1/100)(r1
где r1, r2 + . . . + rn — процентное содержание компонентов в сложном газе.
В практических условиях сжигания газа кислород для горения подается с воздухом (как его составная часть). Состав сухого воздуха, без учета незначительных количеств двуокиси углерода и редких газов, принимается как указано в табл.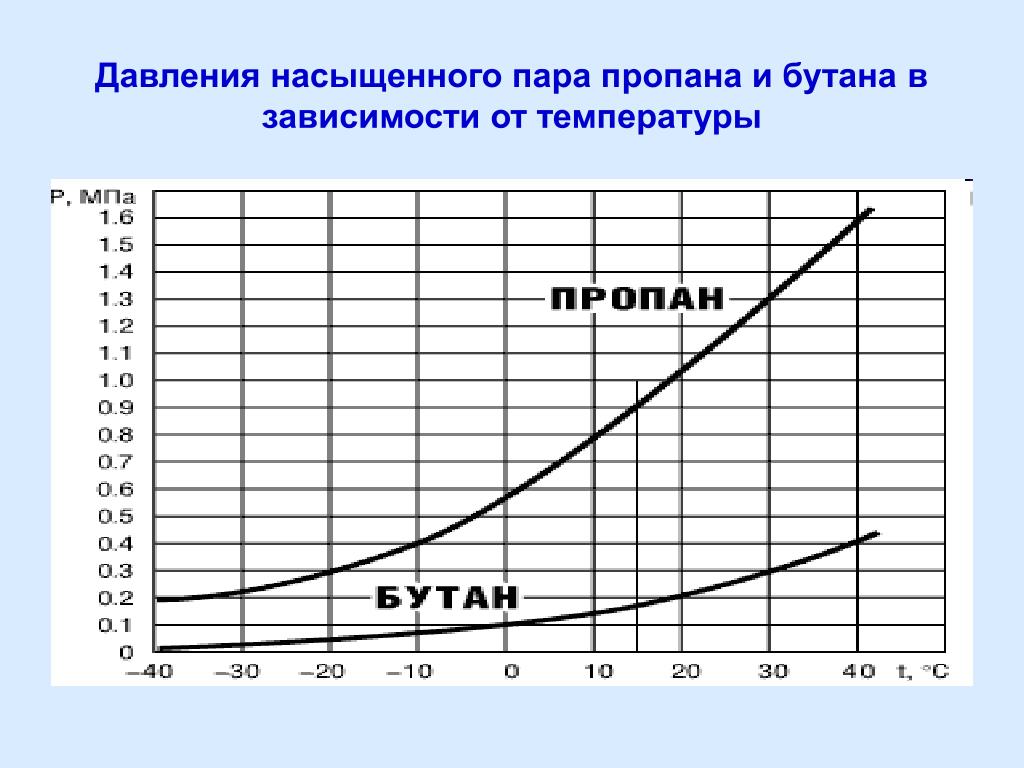 02
02
| газ | по объему | по весу |
|---|---|---|
| кислород | 21,0 | 23,2 |
| азот | 79,0 | 76,8 |
Следовательно, 1 м3 кислорода содержится в 4,76 м3 воздуха.
Реакция горения любого углеводорода в воздухе выражается уравнением
CmHn + (m+n/4)(O2 + 3,76N2) = mCO2 + (n/2)H2O + (m+n/4)3,76N2
где m — число углеводородных атомов в молекуле углеводорода; n — число водородных атомов в той же молекуле;
Потребности в кислороде и воздухе при горении различных газов, подсчитанные по реакциям горения, представлены в табл.03.
| Наименование газа |
Количество на 1нм3 газа, м3 |
Количество продуктов сгорания на 1нм3 сгоревшего газа, м3 |
||||
|---|---|---|---|---|---|---|
| Кислород | Воздух | Двуокись углерода |
Водяной пар |
Азот | Всего | |
| Водород | 0,5 | 2,38 | 1,0 | 1,88 | 2,88 | |
| Метан | 2,0 | 9,52 | 1,0 | 2,0 | 7,52 | 10,52 |
| Пропан | 5,0 | 23,80 | 3,0 | 4,0 | 18,80 | 25,80 |
| Бутан | 6,5 | 30,94 | 4,0 | 5,0 | 24,44 | 33,44 |
| Ацетилен | 2,5 | 11,90 | 2,0 | 1,0 | 9,40 | 12,40 |
Фактический расход воздуха в нм3 на объем газа в нм3 , вследствие несовершенства смешивания горючего и окислителя в процессе горения берется несколько больше теоретического
Vфакт = Vтеор х α
где V факт — фактический расход воздуха; Vтеор — теоретический расход воздуха, представленный в вышерасположенной таблице; α — коэффициент избытка воздуха.
Коэффициент α в зависимости от качества смешения газа и воздуха принимается в пределах 1,05-1,2.
В реальных условиях сжигания газа коэффициент избытка воздуха α всегда должен быть больше единицы, так как в противном случае будет неполное сгорание газа.
Для сложного газа теоретический расход сухого воздуха может быть подсчитан по уравнению, составленному на основании потребности в кислороде отдельных компонентов, нм3/нм3 газа:
Vтеор = (4,76/100)(0,5H2 + 0,5CO + 2CH4 + 3,5C2H6 + 5C3H8 + 6.5C4H10 + 3C2H4 + 4,5C3H6 + 6C4
Теоретический расход влажного воздуха больше подсчитанного по формуле (2) на объем содержащихся в нем водяных паров, нм3/нм3.
Vm = Vтеор(1 + 12,4х10-6dв) (3)
где
dв — влажность воздуха, г/нм3;
12,4х10-6 — объем 1 г водяного пара в нм3.
Ниже приведены примеры расчетов горения газа
ПРИМЕР 1.
Определим теплоту сгорания 1 нм3 сухого природного газа следующего состава:
CH4 -97%, C2H6 — 2%, C3H8 — 0,3%, C4H10 — 0,2%, CO2 — 0,2% и N2 — 0.3%
Решение:
Используя данные табл.01 и формулу (1) определим теплоту сгорания газа
Q = 85.5⋅97 + 152⋅2 + 218⋅0.3 + 288⋅0,2 = 8720 ккал/нм3
ПРИМЕР 2.
Определим потребность в воздухе в нм3 для полного сжигания 1 нм3 природного газа, имеющего состав, указанный в примере 1. Температура воздуха tвозд = 20 °С; относительная влажность φ = 0,6; коэффициент избытка воздуха α = 1,1.
Решение:
Теоретический расход сухого воздуха подсчитаем по формуле (2)
Vтеор = (4,76/100)(2⋅97 + 3,5⋅2 + 5⋅0,3 + 6,5⋅0,2) = 9,7 нм3/нм3
Содержание водяных паров в воздухе при tвозд = 20 °С и φ = 0,6; равно:
ds = 17,3⋅0,6 = 10 г/нм3
При расчете учтено, что воздух при температуре 20 °С может накапливать максимально 17,3 г водяного пара.
Теоретический расход влажного воздуха определяем по формуле (3).
Vm = 9,7+ 0,00124 х 10 х 9,7 = 9,82 г/нм3
Фактический расход влажного воздуха при α = 1,1:
Vфакт = 9,82 х 1,1 = 10,8 нм3/нм3
Т.е. для полного сжигания 1 нм3 природного газа требуется 10,8 нм3 воздуха (с учетом его естественной влажности) и при рекомендуемым коэффициенте избытка воздуха равного α = 1,1
Основные типы стеклодувных горелок можно классифицировать по следующим признакам:
- По виду горелки
- 1.1 стационарные
- 1.2 ручные
- По виду горючего газа
- 2.1 горелки для природного газа
- 2.2 горелки для пропан-бутана
- 2.3 горелки универсальные (без ограничения по виду газа)
- По виду окислителя
- 3.1 воздух
- 3.2 сжатый воздух
- 3.
 2 чистый кислород
2 чистый кислород - 3.3 смесь сжатого воздуха и чистого кислорода
- По способу подачи окислителя
- 4.1 горелки атмосферные (инжекционные)
- 4.2 горелки с принудительной подачей сжатого воздуха
- 4.3 горелки с подачей чистого кислорода
- 4.4 горелки с одновременной подачей сжатого воздуха и чистого кислорода
- По способу смешивания газа с окислителем
- 5.1 без предварительного смешивания
- 5.2 с полным предварительным смешиванием
- 5.3 с неполным предварительным смешиванием
- По типу факела.
- 6.1 с одним пламенем
- 6.2 с двойным пламенем
Горелка стационарная (поз. 1.1) крепится на рабочем столе. Изменение направления факела обеспечивается шарнирной системой, через которую головка горелки связана с узлом крепления. Обработка производится перемещением изделия относительно горелки.
Обработка производится перемещением изделия относительно горелки.
Горелка ручная (поз. 1.2) не имеет какого-либо крепления на рабочем столе. Изменение направления факела обеспечивается вручную. Обработка производится преимущественно перемещением горелки относительно изделия.
Горелка для природного газа (поз. 2.1) использует в качестве горючего газа метан (CH4). Кроме метана в состав природного газа входят его ближайшие гомологи: этан, пропан, бутан. Содержание метана в природном газе составляет не менее 80%.
Горелка для пропан-бутана (поз. 2.2) использует в качестве горючего газа смесь пропана (C3H8) и бутана (C4H10). При этом содержание пропана в горючем газе составляет не менее 75%.
Горелка универсальная (поз. 2.3) использует в качестве горючего газа как природный газ, так и пропан-бутан.
Окислитель воздух (поз. 3.1) используется, когда кислорода, находящегося в атмосферном воздухе, достаточно для полного сгорания горючего газа. Применяется в горелках с малым расходом горючего газа.
Применяется в горелках с малым расходом горючего газа.
Окислитель сжатый воздух (поз. 3.2) используется, при увеличении подачи горючего газа, когда кислорода, находящегося в атмосферном воздухе, недостаточно для полного сгорания горючего газа.
Окислитель чистый кислород (поз. 3.3) используется в горелках с большим расходом горючего газа.
Окислитель смесь сжатого воздуха и чистого кислорода (поз. 3.4) используется, когда необходимо снизить температуру пламени горелки, но и обеспечить при этом полное сгорание горючего газа. Поэтому в таких горелках расход горючего газа устанавливают меньшим, чем в предыдущем случае.
Горелка атмосферная (поз. 4.1) использует воздух для горения из окружающей среды, который поступает в горелку через отверстия в ее корпусе за счет подсоса (инжекции) горючим газом, который с большой скоростью выходит из сопла инжектора, расположенного внутри горелки.
Горелка с принудительной подачей сжатого воздуха (поз. 4.2) использует для горения сжатый воздух, подаваемый от компрессора или иного устройства, обеспечивающего необходимое для газовой горелки давление сжатого воздуха.
4.2) использует для горения сжатый воздух, подаваемый от компрессора или иного устройства, обеспечивающего необходимое для газовой горелки давление сжатого воздуха.
Горелка с подачей чистого кислорода (поз. 4.3) использует для горения горючего газа чистый кислород. Для подачи в горелку кислорода преимущественно используют баллоны с кислородом под давлением, но иногда в случае малых расходов горелкой кислорода (до 0,5 м³/час) применяют кислородные концентраторы.
Горелка с одновременной подачей сжатого воздуха и чистого кислорода (поз. 4.4) использует для горения горючего газа смесь сжатого воздуха и чистого кислорода. В этом случае сжатый воздух, подаваемый в горелку, используется для разбавления продуктов сгорания и понижения их температуры.
Горелка без предварительного смешения (поз. 5.1), в которой горючий газ и окислитель смешиваются за выходными отверстиями ее сопла.
Горелка с полным предварительным смешиванием (поз. 5.2), в которой горючий газ и окислитель смешиваются в корпусе горелки перед выходными отверстиями ее сопла.
Горелка с неполным предварительным смешиванием (поз. 5.3), в которой горючий газ частично смешивается с окислителем до выходных отверстий сопла и частично смешивается с окислителем за выходными отверстиями сопла.
Горелка с одним пламенем (поз. 6.1) имеет сопло, которое формируют факел, состоящий из одного пламени.
Горелка с двойным пламенем (поз. 6.2) имеет сопло, которое формирует один факел двойного пламени, при этом к каждому пламени подводится свой горючий газ и окислитель и оба пламени расположены симметрично относительно центральной оси сопла.
Общие замечания по работе стеклодувных горелок
С учетом вышеприведенной классификации стеклодувных горелок при использовании последних надо учитывать следующее.
Для выполнения стеклодувных операций используется различная регулировка горелки — как по качественному составу смеси горючего газа с воздухом (или кислородом), так и по количеству смеси.
При выборе стеклодувной горелки с тем или иным видом окислителя необходимо исходить из того, что количество кислорода будь он в составе атмосферного или сжатого воздуха или в чистом виде определяется количеством горючего газа потребляемой горелкой. Так для полного сгорания одного литра метана, согласно химической реакции его горения, необходимо 2 литра чистого кислорода или 10 литров атмосферного воздуха. Для сгорания одного литра пропана требуется в 2,5 раза больше кислорода, чем для полного сгорания метана. При этом надо учитывать, что с увеличением количества горючего газа, потребляемой горелкой, ее тепловая мощность увеличивается и наоборот с уменьшением расхода горючего газа тепловая мощность горелки уменьшается.
Так для полного сгорания одного литра метана, согласно химической реакции его горения, необходимо 2 литра чистого кислорода или 10 литров атмосферного воздуха. Для сгорания одного литра пропана требуется в 2,5 раза больше кислорода, чем для полного сгорания метана. При этом надо учитывать, что с увеличением количества горючего газа, потребляемой горелкой, ее тепловая мощность увеличивается и наоборот с уменьшением расхода горючего газа тепловая мощность горелки уменьшается.
Использование сжатого воздуха в стеклодувных горелках дает более низкотемпературное пламя по сравнению с горелками, в которых в качестве окислителя используется чистый кислород. Низкотемпературное пламя получается потому, что воздух имеет высокое процентное содержание инертных газов, которые не принимают участия в горении, но резко снижают температуру газового пламени. Поэтому для того, чтобы обеспечить универсальность стеклодувной горелки, т.е. возможность ее использования для нагрева как мягкого (с низкой температурой размягчения), так и твердого стекла (с высокой температурой размягчения) в горелку наряду с кислородом подают и сжатый воздух. Меняя в составе окислителя соотношение кислород-воздух можно регулировать температуру факела горелки в широких пределах.
Меняя в составе окислителя соотношение кислород-воздух можно регулировать температуру факела горелки в широких пределах.
Более подробная информация по вопросам подачи дополнительного воздуха в горелку рассмотрена в приложении 02.
Нажми!
Щелкни
и приложение 02 откроется!
На практике различаются следующие температуры горения газов в горелке: жаропроизводительность, калориметрическая, теоретическая и действительная .
Жаропроизводительность определяется как температура продуктов полного сгорания горючих газов в адиабатических условиях с коэффициентом избытка воздуха α = 1,0 при температуре газа и воздуха t = 0°С.
Калориметрическая температура горения отличается от жаропроизводительности тем, что температура газа и воздуха, а также коэффициент избытка воздуха α принимаются при их действительных значениях.
Теоретическая температура горения определяется аналогично калориметрической температуре, но с поправкой на эндотермические реакции диссоциации двуокиси углерода и водяного пара.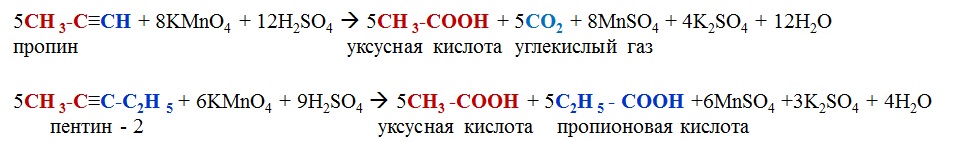 Для стеклодувных горелок газовых горелок теоретическая температура горения практически равна калориметрической.
Для стеклодувных горелок газовых горелок теоретическая температура горения практически равна калориметрической.
Действительная температура продуктов сгорания ниже теоретической температуры горения и зависит от величины теплопотерь в окружающую среду, степени отдачи тепла из зоны горения излучением и других[ теплопотерь.
Калориметрическая температура горения природного газа) и пропана технического в воздухе при температуре 0 °С с влажностью 1% в зависимости от коэффициента избытка воздуха приведены в табл.04.
| Коэффициент избытка воздуха α |
Природный газ |
Пропан технический |
|---|---|---|
| 1,0 | 2010 | 2110 |
| 1,1 | 1880 | 1970 |
| 1,3 | 1650 | 1730 |
| 1,4 | 1510 | 1630 |
| 1,5 | 1470 | 1540 |
| 1,6 | 1420 | 1470 |
| 1,7 | 1300 | 1390 |
| 1,8 | 1270 | 1340 |
| 2,0 | 1170 | 1210 |
Как следует из приведенных в таблице данных, разбавление продуктов сгорания
избыточным воздухом (с ростом α) приводит к снижению теоретической температуры горения топлива.
Полученный результат можно объяснить, если рассмотреть реакцию горения углеводородов в воздухе, например, пропана.
Уравнение горения пропана имеет вид: (см. приложение 01)
C3H8 + 5O2 + 18,8N2 = CO2 + 4H2O + 18,8N2
Азот в реакции горения не участвует но, нагреваясь уносит из зоны горения значительное количество теплоты. Понятно, что тем больше азота в пламени, тем больше уносится теплоты и температура пламени с увеличением азота должна падать.
Объем азота, подаваемого а зону горения, вместе с воздухом, определяется формулой ;
VN2 = 0,79αVm + 0,01N2
где VN2 -объем азота; α -коэффициент избытка воздуха; Vm — теоретический расход сухого воздуха.
Таким образом с увеличением коэффициента избытка воздуха, увеличивается объем азота, подаваемого в зону горения и, следовательно, больше теплоты отводится из зоны горения и в результате температура горения уменьшается.
В практике надо знать не только приведенные выше теоретические температуры горения, но и максимальные температуры, возникающие в пламени. Их приближенные значения обычно устанавливают экспериментально методами спектрографии. Максимальные температуры, возникающие в свободном пламени на расстоянии 5–10 мм от вершины конусного фронта горения, приведены в таб.05.
| Вид газа | Химическая формула | газ + воздух | газ + кислород |
|---|---|---|---|
| Водород | H2 | 2045 | 2660 |
| Метан | CH4 | 1870 | 2740 |
| Пропан | C3H8 | 1920 | 2780 |
| Ацетилен | C2H2 | 2320 | 3000 |
Поскольку в стеклодувных горелках обычно не используют ни ацетилен ни водород, то из таблицы следует, что температура пламени у стеклодувных горелок с пропаном выше чем у горелок с метаном при любом виде окислителя, хотя отличия и не существенные (не более 3%).
При стеклодувных работах применяют горелки без предварительного смешивания горючего газа с окислителем (далее горелки наружного смешивания) и горелки с предварительным смешиванием указанных газовых сред, (далее горелки внутреннего смешивания), а также горелки неполного внутреннего смешивания.
Горелки наружного смешивания (рис.1) являются наиболее удобными для регулировки параметров пламени. В этих горелках горючий газ и окислитель проходят через горелку отдельно друг от друга. Так кислород проходит через горелку по множеству капилляров, выходные отверстия которых (порты) расположены на наружной поверхности сопла. В результате газ и кислород смешиваются за выходными отверстиями горелки.
Количество портов в горелке может достигать значений до несколько десятков. От того, сколько портов в горелке и как они размещены относительно друг друга зависит форма и температура пламени и его ширина. Именно этот фактор, а также выбор материала для сопла и головки горелки, и есть то, чем горелки различных моделей отличаются друг от друга.
Рис.1 Горелка наружного смешивания
К достоинствам этого типа горелок следует отнести наличие очень спокойного мягкого широкого пламени, которое легко подается регулировке и, что самое важное, для мягких стекол (это натрий-кальций-силикатное стекло, а также свинцовое стекло) технические характеристики пламени у горелок этого типа более предпочтительней, чем у пламени горелок внутреннего смешивания.
Кроме того у горелок наружного смешивания нет проскока пламени внутрь горелки и пламя менее шумно в сравнении с горелками внутреннего смешивания.
Множество видов цветных стекол, особенно непрозрачных, при нагреве в горелках внутреннего смешивания теряют свой первоначальный цвет, при этом происходит изменение характера и степени окраски вплоть до серого. Как уже указывалось у горелок наружного смешивания характеристики пламени хорошо регулируется и в этих горелках легко можно получить нейтральное пламя, т.е. пламя в факеле которого не имеется избытка ни горючего газа ни кислорода, что позволяет при обработке цветного стекла сохранить его первоначальный цвет.
У горелок внутреннего смешивания (рис.2) горючий газ и окислитель смешиваются внутри горелки. Так как эти горелки не имеют внутри своего корпуса каких либо трубопроводов и капилляров для подачи газовых сред к отверстиям сопла, то эти горелки более просты в производстве и сравнительно дешевле в сравнении с горелками наружного смешивания.
Рис.2 Горелка внутреннего смешивания
Горелки внутреннего смешивания хорошо себя зарекомендовали при работе с твердым боросиликатным стеклом, но как указывалось выше не слишком хороши при работе с мягкими стеклами. При этом пламя у горелок внутреннего смешивания более узкое и имеет несколько более высокую температуру и более шумно, чем у горелок наружного смешивания.
При выборе горелки всегда обращайте внимание на количество входных штуцеров для газовых сред. Горелки, имеющие три и более входных штуцеров, способны обеспечивать температуру пламени, необходимую для обработки практически любых видов стекол.
Исходя из вышеизложенного при выборе горелки надо принимать во внимание, что если горелка предназначена для работы только с твердыми боросиликатными стеклами, то достаточно иметь горелку только внутреннего смешивания. Если же стеклодувная горелка необходима для работы как с твердым, так и мягким стеклом а также и с цветным стеклом, то следует иметь горелку наружного смешивания.
Если же стеклодувная горелка необходима для работы как с твердым, так и мягким стеклом а также и с цветным стеклом, то следует иметь горелку наружного смешивания.
При выборе горелок наружного смешивания для профессиональных работ более предпочтительны горелки, имеющие три и более входных штуцеров для газовых сред.
Принимая решение, какую горелку необходимо приобрести для стеклодувных работ следует также учитывать, что на большой горелке получить небольшое по размерам пламя легче, чем на маленькой горелке получить большее пламя. На маленькой горелке, чтобы нагреть стекло до более высокой температуры надо приблизить факел горелки как можно ближе к поверхности стекла, а это может расплавить и прожечь стекло.
В тоже время большее по размерам пламя дает больше тепла, чтобы нагреть стекло без того, чтобы делать пламя более интенсивным. Кроме того, большее по размерам пламя охватывает большую поверхность стекла и поэтому стекло не будет быстро охлаждаться при переходе из одной области обработки стекла к другой соседней области. А быстрое охлаждение стекла может привести к возникновению внутренних напряжений и, как следствие, к его растрескиванию
А быстрое охлаждение стекла может привести к возникновению внутренних напряжений и, как следствие, к его растрескиванию
Некоторые из рассмотренных ниже горелок имеют отдельное центральное пламя внутреннего смешивания небольшой мощности, которое может быть использовано без большого окружающего его пламени наружного смешивания большой тепловой мощности. Это позволяет получить на горелке пламя различных форм и размеров.
Типы стеклодувных горелок
В этом разделе приведены основные типы стеклодувных горелок, реализуемых компанией ООО «ФИРМА БСТ-3М» на отечественном рынке.
Щелкнув по любому рисунку или наименованию модели в таблице можно перейти к подробному техническому описанию горелки.
Рис.3 Горелка Теклю
Для работы со стеклом в большинстве случаев применяют газовые горелки преимущественно настольного типа. Для обеспечения нагрева стекла в горелку подают смесь горючего газа (метана или пропана) с окислителем, в качестве которого используют как кислород, содержащийся в окружающем воздухе, так и чистый кислород.
Рис.4 Горелка Мекера
Для работы с так называемым мягким легкоплавким стеклом (например, натрий-кальций-силикатное стекло) рабочая температура пламени горелки должно быть в пределах 800-1100 град. Цельсия. Для этой цели при работе с тонкостенным стеклом малого диаметра (трубки из стекла диаметром до 10 мм и толщиной стенки не более 1 мм), не требующих большой мощности горелки (например, работы по запайке ампул) можно использовать горелки Теклю (Фиг.3) или горелки Мекера (Фиг.4). Эти горелки имеют максимальную мощность порядка 1200 Вт и для их работы достаточно кислорода окружающего воздуха. Подробные технические характеристики этих горелок приведены на сайтах «Горелка Теклю» и «Горелка Мекера».
На прилагаемом видеоролике показано изготовление стеклянных капилляров на горелке Мекера
Изготовление стеклянных капилляров на горелке Мекера
Для нагрева трубок из мягкого стекла диаметром до 30 мм и с толщиной стенки до 1 мм и более необходима горелка более высокой мощности, чем вышеупомянутые горелки Теклю и Мекера. Для этого применяют горелку с более высоким расходом горючего газа и для его полного сгорания в горелку подают воздух под давлением. Такая горелка изображена на Фиг.5 (модель СТ-33).
Для этого применяют горелку с более высоким расходом горючего газа и для его полного сгорания в горелку подают воздух под давлением. Такая горелка изображена на Фиг.5 (модель СТ-33).
Рис.5 Горелка газ+воздух мод.СТ-33
Левый штуцер предназначен для принудительной подачи воздуха, а правый для подачи горючего газа. Эта горелка наружного смешивания имеет мощность до 4 кВт с максимальной температурой пламени 1700 град. Цельсия. Общее количество портов у этой горелки для газа и воздуха равно 42. Подробные технические характеристики горелки и описание конструкции имеются на странице сайта «горелка для стекла мод.33».
Если для обработки стекла требуется более высокая рабочая температура пламени горелки , то используют горелки в которые вместо воздуха подают чистый кислород. Такая горелка изображена на Фиг.6 (модель СТ-80). Это горелка наружного смешивания.
Рис.6 Горелка газ+кислород мод.СТ-80
Верхний штуцер предназначен для подачи горючего газа, а нижний для подачи кислорода. Эта горелка имеет мощность до 3,3 кВт. но дает пламя с максимальной температурой 2200 град.Цельсия. Имеет семь портов для кислорода и семь портов для горючего газа. Подробные технические характеристики горелки и описание конструкции имеются на странице сайта «горелка для стекла мод.80».
Эта горелка имеет мощность до 3,3 кВт. но дает пламя с максимальной температурой 2200 град.Цельсия. Имеет семь портов для кислорода и семь портов для горючего газа. Подробные технические характеристики горелки и описание конструкции имеются на странице сайта «горелка для стекла мод.80».
Для обеспечения работы на газовой горелке с любыми видами стекол, как мягкими так и твердыми, необходимо чтобы температура пламени горелки могла регулироваться в широких пределах. Для этого в горелку подают одновременно газ, кислород и воздух.
При этом в горелке при ее работе горят два независимых друг от друга пламени. Одно из них центральное основное пламя внутреннего смешивания, в которое подается горючий газ и кислород, вокруг которого формируется второе дополнительное пламя наружного смешивания, для которого используется кислород (подается через капилляры), горючий газ и воздух.
Такая горелка двойного пламени в одном факеле изображена на Фиг.7 (модель СТ-32).
Рис. 7 Горелка двойного пламени газ+кислород+воздух мод.СТ-32
7 Горелка двойного пламени газ+кислород+воздух мод.СТ-32
Эта горелка имеет три входных штуцера. Левый штуцер служит для подачи кислорода, средний- для подачи воздуха и правый-для подачи горючего газа. Горелка имеет четыре регулировочных вентиля для кислорода и воздуха и один регулировочный кран для подачи газа.
Левый верхний регулировочный вентиль служит для регулировки подачи кислорода в центральное сопло (основное пламя), правый верхний — для регулировки подачи газа в это же сопло.
Для регулировки параметров дополнительного пламени горелка имеет отдельные от указанных выше регулировочные вентили один для подачи кислорода (расположен сбоку слева) и второй для сжатого воздуха (расположен сбоку справа) и кран для регулировки подачи горючего газа (расположен сбоку справа).
Кислород добавляют непосредственно в среду горючего газа и воздуха на выходе из горелки для обеспечения полного сгорания горючего газа. При этом добавочный кислород равномерно распределяется по всей поверхности сопла, поступая через большее количество капиллярных отверстий, расположенных на поверхности сопла вокруг центрального сопла добавочного пламени.
Горелки СТ-32 имеет 37 портов из них 15 для основного пламени и 22 порта для дополнительного.
Такая горелка обеспечивает плавную регулировку рабочей температуры пламени в пределах 1100-2600 град. Цельсия при мощности горелки до 10 кВт. Однако большая мощность горелки требует и большего расхода кислорода и горючего газа по сравнению с горелками других моделей. Подробные технические характеристики горелки и описание конструкции имеются на странице сайта «горелка для стекла мод.32».
Для обеспечения экономии кислорода и горючего газа помимо трех входных штуцеров, как у горелки СТ-32, добавляют еще два штуцера для отдельной подачи кислорода и газа в центральное сопло. Это позволяет использовать последнее в качестве поджигающей горелки для дополнительного пламени.
Такая горелка имеет пять штуцеров для подачи газовых сред, расположенных в два ряда и изображена на Фиг.8 (модель СТ-03).
Рис.8 Горелка с поджигающим пламенем газ+кислород+воздух мод. СТ-03
СТ-03
В первом ряду расположены штуцера для кислорода, воздуха и горючего газа, газовые среды в которые подаются через устройство экономии газовых сред мод.С1, данные о котором приводятся ниже.
В два штуцера, расположенных во втором ряду подается кислород и газ напрямую от источников газовых сред для основного пламени, которое горит постоянно при работе горелки.
Подробные технические характеристики горелки и описание конструкции имеются на странице сайта «горелка для стекла мод.03».
По основным техническим характеристикам горелка СТ-03 с устройством С-1 аналогична горелке СТ-32, но имеет важное преимущество — значительно меньший расход кислорода и газа.
Аналогичная горелка (с пятью входными штуцерами), но имеющую мощность до 25,5 кВт изображена на Фиг.9 (модель СТ-02). Эта горелка имеет 37 портов для основного пламени и 114 портов для вспомогательного пламени. Всего 151 порт.
Рис.9 Горелка высокой мощности газ+кислород+воздух с поджигающим пламенем мод. СТ-02
СТ-02
Подробные технические характеристики горелки и описание конструкции имеются на странице сайта «горелка для стекла мод.02».
Для уменьшения потребления горючего газа, кислорода и воздуха газовыми горелками, использующие помимо основного пламени и вспомогательное (поджигающее) пламя, применяется, как указывалось выше, устройство для экономии расхода газовых сред мод. С-1 (экономайзер), которое изображенное на Фиг.10.
Рис.10 Устройство экономии газовых сред (экономайзер) мод.С-1
Описание устройства для экономии газовых сред приведено на соответствующей «странице сайта».
При использовании устройства в исходном положении горит только поджигающее пламя горелки. При нажатии на ножную педаль воспламеняется основное пламя горелки.
Ручная горелка — один из важнейших инструментов стеклодува. Ею он выполняет целый ряд операций — от оплавки концов отрезанной трубки до спаев и сгибов. Горелка должна иметь возможно меньшую массу и размеры, чтобы облегчить манипулирование ею. Это задача успешно решена в горелке мод. СТ-21Р.
Это задача успешно решена в горелке мод. СТ-21Р.
Стеклодувная горелка ручного типа СТ-21Р неполного внутреннего смешивания, изображенная на Фиг.11, предназначена для обработки твердого боросиликатного стекла и может сжигать природный газ или пропан-бутан вместе с кислородом и воздухом. Горелка имеет четыре регулировочных игольчатых вентиля по одному для газа и воздуха и два для кислорода, при этом часть кислорода смешивается с горючим газом внутри горелки, а часть вне ее. Оптимальная настройка горелки модели СТ-21Р позволяет достичь температуры пламени до 2800 °C при максимальной мощности около 4 кВт.
Рис.11 Ручная трехпроводная горелка СТ-21P
Подробное описание горелки представлено на странице сайта «горелка ручная трехпроводная стеклодувная мод.СТ-21Р».
Применяется и другая модель ручной стеклодувной горелки. Это горелка СТ-22. Горелка по техническим параметрам аналогична горелку СТ-33. Используется для работы с мягким натриево кальциевым стеклом или со свинцовым стеклом. Максимальная температура 1700°С. Максимальная тепловая мощность 4 кВт. В качестве окислителя применяется сжатый воздух. Кислород не используется.
Максимальная температура 1700°С. Максимальная тепловая мощность 4 кВт. В качестве окислителя применяется сжатый воздух. Кислород не используется.
Рис.12 Ручная горелка газ+воздух СТ-22
Подробное описание горелки представлено на странице сайта «горелка ручная стеклодувная мод.СТ-22».
При работе с размягченным стеклом стеклодуву помимо газовой горелки необходимо иметь комплект разверток для обработки торцов трубок, отверстий, изготовления фланцев, а также придания размягченному стеклу необходимых форм и конфигураций.
Комплект Р-11, содержит 11 типоразмеров разверток 4-х форм, изображенных на Фиг.12. Этот комплект обеспечивает стеклодува необходимым инструментом этого типа для выполнения практически любых видов работ.
Рис.12 Комплект разверток P-11
Подробное описание состава комплекта разверток Р-11 представлено на странице сайта «Комплект разверток для стеклодувных работ Р-11».
В заключение приведем сводную таблицу расхода газовых сред для вышеуказанных горелок за один час непрерывной работы. Щелкнув на наименовании модели можно перейти к ее подробному описанию.
Щелкнув на наименовании модели можно перейти к ее подробному описанию.
| Вид газа | Модели горелок | |||||
|---|---|---|---|---|---|---|
| 02 | 03 | 32 | 33 | 80 | 21P | |
| Пропан-бутан | ||||||
| давление, кПа | не более 50 | 2,94…50 | 2,94…50 | 2,94…50 | 2,94…50 | 2,94…50 |
| расход, кг/час | 1,65 | 0,66 | 0,66 | 0,32 | 0,2 | 0,25 |
| Кислород | ||||||
| давление, кПа | не менее 20 | не менее 20 | не менее 20 | — | не менее 20 | не менее 20 |
| расход, м³/час | 2,0 | 0,8 | 0,8 | — | 0,4 | 2,0 |
| Воздух | ||||||
| давление, кПа | не менее 10 | не менее 10 | не менее 10 | не менее 10 | не менее 10 | — |
| расход, м³/час | 3,25 | 1,3 | 1,3 | — | — | 3,25 |
| Выходная мощность, кВт | 21,25 | 8,5 | 8,5 | 4,0 | 2,9 | 4,0 |
| Природный газ (метан) | ||||||
| давление, кПа | не более 50 | 1,71. ..50 ..50 |
1,71…50 | 1,71…50 | 2…40 | 1,71 |
| расход, м³/час | 2,75 | 1,02 | 1,02 | 0,32 | 0,33 | 0,32 |
| Кислород | ||||||
| давление, кПа | не менее 20 | не менее 20 | не менее 20 | — | не менее 20 | не менее 20 |
| расход, м³/час | 5,75 | 2,3 | 2,3 | — | 0,58 | 10,42 |
| Воздух | ||||||
| давление, кПа | не менее 10 | не менее 10 | не менее 10 | не менее 10 | не менее 10 | — |
| расход, м³/час | 3,75 | 1,5 | 1,5 | — | — | 0,9 |
| Выходная мощность, кВт | 25,5 | 10,2 | 10,2 | 3,2 | 3,3 | 3,2 |
При пользовании таблицей надо принимать во внимание, что 1 кг пропан-бутана дает 0,535 м³ паров, а при сжигании в горелке пропан-бутана вместе с кислородом максимальная температура пламени 2850ºС достигается при соотношении паров пропан-бутана к кислороду равным 1,42 м³/м³. Дальнейшее увеличение этого соотношения повышения температуры пламени не дает, а при снижении подачи кислорода температура пламени уменьшается и при соотношении 1,3 м³/м³ температура пламени будет 2700ºС а при соотношении 1,27 м³/м³ температура пламени будет 2600ºС.
Дальнейшее увеличение этого соотношения повышения температуры пламени не дает, а при снижении подачи кислорода температура пламени уменьшается и при соотношении 1,3 м³/м³ температура пламени будет 2700ºС а при соотношении 1,27 м³/м³ температура пламени будет 2600ºС.
Аналогичные данные при сжигании природного газа (метана) с кислородом равны: при соотношении газ кислород равным 1,18 максимальная температура пламени составляет 2780ºС, а при соотношении 1,1 будем иметь 2600ºС.
Порядок приобретения горелок
С порядком приобретения всех вышеупомянутых горелок для стекла можно ознакомиться на соответствующей странице сайта «Как купить».
Горелки отгружаются со склада в Москве во все регионы РФ.
404 Cтраница не найдена
Размер:
AAA
Изображения Вкл. Выкл.
Обычная версия сайта
К сожалению запрашиваемая страница не найдена.
Но вы можете воспользоваться поиском или картой сайта ниже
|
|
Физическая химия — Скоростной закон реакции пропана с кислородом
Вопрос
Изменено 3 года, 4 месяца назад
Просмотрено 562 раза
$\begingroup$
В классе у меня есть демонстрация, на которой я зажигаю пузырь, наполненный пропаном. Когда я добавляю кислород, пузырьки сгорают все быстрее и быстрее. Я уже сбалансировал химическую реакцию следующим образом:
Когда я добавляю кислород, пузырьки сгорают все быстрее и быстрее. Я уже сбалансировал химическую реакцию следующим образом:
$$\ce{C3H8 + 5 O2 → 3 CO2 + 4 h3O + тепло + свет}$$
Я пришел к выводу, что реакция должна идти быстрее, потому что предельным реагентом является кислород, а воздух имеет только около 20 % кислорода, добавление большего количества кислорода к пузырьку ускорит процесс реакции. Я вычислил кинетику, окисление, энтальпийную диаграмму и т.д. Как найти закон скорости и уравнение реакции горения? Не будет ли это просто вторым порядком, так как это реакция горения? Я понятия не имею, с чего даже начать и почему это так. 9.}$.
Точный механизм зависит от температуры и давления, и на графике зависимости $T$ от $p$ есть области медленных реакций, взрыва, горячего и холодного пламени. (Оригинальная статья принадлежит Newitt & Thorne, J. Chem. Soc. 1937, стр. 1656). Таким образом, вы понимаете, что разобраться с механизмом — непростая задача и для этого потребуется много специализированного оборудования.
$\endgroup$
$\begingroup$
Чтобы определить закон скорости, вы должны быть в состоянии измерить либо скорость, с которой расходуются реагенты, либо скорость образования продуктов.
Очень распространенная ошибка заключается в том, что закон скорости основывается на сбалансированном химическом уравнении. На самом деле, многие учителя старших классов преподают кинетику таким образом. К сожалению, это серьезная ошибка.
Показатели степени в законе скоростей могут совпадать с коэффициентами сбалансированного химического уравнения, но только тогда, когда реакция происходит в одну стадию . Мы не можем знать, сколько стадий реакции, пока не исследуем кинетику.
Что касается определения закона о ставках, вам необходимо сделать следующее:
- Систематически меняйте количество пропана
- Систематически меняйте количество кислорода
- Измерьте время, необходимое для завершения реакции для каждого варианта
Поскольку реагентов всего два, вы сможете сделать это, запустив три отдельных испытания; один, который мы будем рассматривать в качестве стандарта (или эталона), один, в котором увеличено количество пропана, и тот, в котором увеличено количество кислорода. x}$). Если это так, то вам нужно только варьировать количество кислорода. Это может быть просто из практических соображений.
x}$). Если это так, то вам нужно только варьировать количество кислорода. Это может быть просто из практических соображений.
$\endgroup$
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Возгорание — Энциклопедия Нового Света
Реакция горения, происходящая при поджигании спички.
Горение, или горение, представляет собой сложную последовательность экзотермических химических реакций между топливом и окислителем, сопровождающихся выделением тепла или одновременно тепла и света в виде свечения или пламени.
В реакции полного сгорания соединение реагирует с окисляющим элементом, таким как кислород или фтор, и продукты реакции представляют собой соединения каждого элемента в топливе с окисляющим элементом. Например:
- Ч 4 + 2O 2 → CO 2 + 2H 2 O + тепло
- CH 2 S + 6F 2 → CF 4 + 2HF + SF 6 + heat
A simpler example can be seen in the combustion водорода и кислорода, что является обычно используемой реакцией в ракетных двигателях:
- 2H 2 + О 2 → 2H 2 O + heat
The result is simply water vapor.
В подавляющем большинстве случаев сжигания в реальном мире окислитель кислород (O 2 ) получают из окружающего воздуха, а образующиеся в результате сжигания дымовые газы содержат азот:
- Ч 4 + 2O 2 + 7.52N 2 → CO 2 + 2H 2 O + 7.52N 2 + heat
As can be seen, when air is the source of the oxygen, nitrogen is by far the большую часть образующихся дымовых газов.
Содержание
- 1 Типы
- 1.1 Рапид
- 1.
 2 Медленно
2 Медленно - 1.3 Полный
- 1,4 турбулентный
- 1.5 Неполный
- 1.6 Тлеющий
- 2 Сжигание с другими окислителями
- 3 Химическое уравнение
- 4 Топливо
- 4.1 Жидкое топливо
- 4.2 Твердое топливо
- 5 Температура
- 6 Анализ
- 7 Нестабильность
- 8 Каталожные номера
- 9 кредитов
На самом деле процессы горения никогда не бывают совершенными или полными. В дымовых газах от сжигания углерода (как при сжигании угля) или соединений углерода (как при сжигании углеводородов, древесины и т. д.) будет присутствовать как несгоревший углерод (в виде сажи), так и соединения углерода (CO и другие). Кроме того, когда воздух является окислителем, некоторое количество азота будет окисляться до различных, в основном вредных, оксидов азота (NO x ).
Типы
Быстрое
Быстрое горение — это форма горения, при которой выделяется большое количество тепловой и световой энергии, что часто приводит к пожару. Это используется в таких машинах, как двигатели внутреннего сгорания и в термобарическом оружии.
Это используется в таких машинах, как двигатели внутреннего сгорания и в термобарическом оружии.
Горение – реакция двойного замещения. С другой стороны, химическая реакция — это реакция одиночного замещения.
Медленное
Медленное горение – это форма горения, происходящая при низких температурах. Дыхание является примером медленного горения.
Complete
При полном сгорании реагент сгорает в кислороде с образованием ограниченного количества продуктов. Когда углеводород сгорает в кислороде, в результате реакции образуются только углекислый газ и вода. При горении углеводорода или любого другого топлива на воздухе в состав продуктов сгорания также будет входить азот. При сжигании таких элементов, как углерод, азот, сера и железо, образуются наиболее распространенные оксиды. Углерод даст углекислый газ. Азот даст диоксид азота. Сера даст диоксид серы. Железо даст оксид железа (III). Следует отметить, что полного сгорания добиться практически невозможно. В действительности, когда фактические реакции горения приходят в равновесие, будет присутствовать широкий спектр основных и второстепенных частиц. Например, при сгорании метана в воздухе помимо основных продуктов, таких как двуокись углерода и вода, образуются второстепенные продукты, включающие окись углерода, гидроксил, оксиды азота, одноатомный водород и одноатомный кислород.
В действительности, когда фактические реакции горения приходят в равновесие, будет присутствовать широкий спектр основных и второстепенных частиц. Например, при сгорании метана в воздухе помимо основных продуктов, таких как двуокись углерода и вода, образуются второстепенные продукты, включающие окись углерода, гидроксил, оксиды азота, одноатомный водород и одноатомный кислород.
Турбулентное горение
Турбулентное горение – это горение, характеризующееся турбулентными потоками. Он чаще всего используется в промышленности (например, в газовых турбинах, дизельных двигателях и т. д.), поскольку турбулентность способствует процессу смешивания топлива и окислителя.
Неполное
Неполное сгорание происходит, когда кислорода недостаточно, чтобы позволить топливу (обычно углеводороду) полностью прореагировать с кислородом с образованием углекислого газа и воды, а также когда сгорание гасится теплоотводом, таким как твердая поверхность или пламегаситель. Когда углеводород горит на воздухе, в результате реакции образуется двуокись углерода, вода, окись углерода, чистый углерод (сажа или зола) и различные другие соединения, такие как оксиды азота. Неполное сгорание встречается гораздо чаще и приводит к образованию большого количества побочных продуктов, а в случае сжигания топлива в автомобилях эти побочные продукты могут быть весьма вредными для здоровья и наносить ущерб окружающей среде.
Неполное сгорание встречается гораздо чаще и приводит к образованию большого количества побочных продуктов, а в случае сжигания топлива в автомобилях эти побочные продукты могут быть весьма вредными для здоровья и наносить ущерб окружающей среде.
Качество сгорания можно улучшить за счет конструкции устройств сгорания, таких как горелки и двигатели внутреннего сгорания. Дальнейшие улучшения достигаются за счет каталитических устройств дожигания (таких как каталитические нейтрализаторы). Такие устройства требуются в соответствии с природоохранным законодательством для автомобилей в большинстве стран и могут быть необходимы в крупных устройствах сгорания, таких как тепловые электростанции, для достижения установленных норм выбросов.
Тление
Тление – беспламенная форма горения, получающая тепло от гетерогенных реакций, происходящих на поверхности твердого топлива при нагревании в
0111 окислительная среда. Принципиальное различие между тлением и пламенным горением состоит в том, что при тлении окисление реагентов происходит на поверхности твердого тела, а не в газовой фазе. Характерная температура и тепло, выделяющееся при тлении, малы по сравнению с таковыми при пламенном горении твердого тела. Типичные значения при тлении составляют около 600°C для пиковой температуры и 5 кДж/г-O 2 для выделяемого тепла; типичные значения во время горения составляют около 1500°C и 13 кДж/г-O 2 соответственно. Эти характеристики приводят к тому, что тление распространяется с низкой скоростью, обычно около 0,1 мм/с, что примерно на два порядка ниже скорости распространения пламени по твердому телу. Несмотря на слабые характеристики горения, тление представляет значительную пожароопасность.
Характерная температура и тепло, выделяющееся при тлении, малы по сравнению с таковыми при пламенном горении твердого тела. Типичные значения при тлении составляют около 600°C для пиковой температуры и 5 кДж/г-O 2 для выделяемого тепла; типичные значения во время горения составляют около 1500°C и 13 кДж/г-O 2 соответственно. Эти характеристики приводят к тому, что тление распространяется с низкой скоростью, обычно около 0,1 мм/с, что примерно на два порядка ниже скорости распространения пламени по твердому телу. Несмотря на слабые характеристики горения, тление представляет значительную пожароопасность.Горение с другими окислителями
Кислород можно предположить в качестве окислителя, когда речь идет о горении, но существуют и другие окислители. Закись азота используется в ракетах и в автоспорте; он производит кислород при температуре более 1300 ° C. Фтор, еще один окисляющий элемент, может вызывать реакцию горения с образованием фторированных продуктов (а не оксидов). Например, смеси газообразного фтора и метана взрывоопасны, как и смеси кислорода и метана. Трифторид хлора является сильным фторирующим агентом, который воспламеняет топливо быстрее, чем кислород.
Например, смеси газообразного фтора и метана взрывоопасны, как и смеси кислорода и метана. Трифторид хлора является сильным фторирующим агентом, который воспламеняет топливо быстрее, чем кислород.
Химическое уравнение
Обычно химическое уравнение стехиометрического сжигания углеводорода в кислороде выглядит следующим образом:
- CxHy+(x+y4)O2→xCO2+(y2)h3O{\displaystyle C_{x}H_{y}+\left(x+{\frac {y}{4}}\right)O_{2}\ rightarrow \;xCO_{2}+\left({\frac {y}{2}}\right)H_{2}O}
Например, сжигание пропана:
- C3H8+5O2→3CO2+4h3O{\displaystyle C_{3}H_{8}+5O_{2}\rightarrow \;3CO_{2}+4H_{2}O}
Уравнение простого слова для горение углеводорода в кислороде это:
- Топливо + Кислород → Тепло + Вода + Углерод \ диоксид углерода {\ displaystyle {\ textrm {Fuel}} + {\ textrm {Oxygen}} \ rightarrow \; {\ textrm {Heat}} + {\ textrm {Water} }+{\textrm {Углерод\двуокись}}}
Если горение происходит с использованием воздуха в качестве источника кислорода, соответствующие уравнения выглядят так:
- CxHy + (x + y4) O2 + 3,76 (x + y4) N2 → xCO2 + (y2) h3O + 3,76 (x + y4) N2 {\ displaystyle C_ {x} H_ {y} + \ left (x + {\ frac {y}{4}}\right)O_{2}+3,76\left(x+{\frac {y}{4}}\right)N_{2}\rightarrow \;xCO_{2}+\left( {\ frac {y} {2}} \ right) H_ {2} O + 3,76 \ left (x + {\ frac {y} {4}} \ right) N_ {2}}
Например, сжигание пропана:
- C3H8 + 5O2 + 18,8N2 → 3CO2 + 4h3O + 18,8N2 {\ displaystyle C_ {3} H_ {8} + 5O_ {2} + 18,8 N_ {2} \ rightarrow \; 3CO_ {2} + 4H_ {2 }O+18.
 8N_{2}}
8N_{2}}
Уравнение простого слова для горения углеводорода в воздухе:
- Топливо + Воздух → Тепло + Вода + Углерод \ диоксид + Азот {\ displaystyle {\ textrm {Fuel}} + {\ textrm {Air}} \ rightarrow \; {\ textrm {Heat}} + {\ textrm { Вода}}+{\textrm {Углерод \ диоксид}}+{\textrm {Азот}}}
Топливо
Жидкое топливо
Горение жидкого топлива в окислительной атмосфере фактически происходит в газовой фазе. Горит пар, а не жидкость. Следовательно, жидкость обычно загорается только при температуре выше определенной температуры, точки воспламенения. Температура вспышки жидкого топлива – это самая низкая температура, при которой оно может образовать горючую смесь с воздухом. Это также минимальная температура, при которой в воздухе достаточно испарившегося топлива для начала горения.
Твердое топливо
Акт горения состоит из трех относительно различных, но перекрывающихся фаз:
- Фаза предварительного нагрева, , когда несгоревшее топливо нагревается до температуры вспышки, а затем до точки воспламенения.
 Горючие газы начинают выделяться в процессе, аналогичном сухой перегонке.
Горючие газы начинают выделяться в процессе, аналогичном сухой перегонке. - Фаза перегонки или газообразная фаза, при воспламенении смеси выделяющихся легковоспламеняющихся газов с кислородом. Энергия производится в виде тепла и света. Пламя часто видно. Теплопередача от горения к твердому телу поддерживает выделение легковоспламеняющихся паров.
- Древесноугольная фаза или твердая фаза, когда выход горючих газов из материала слишком низок для постоянного присутствия пламени и обугленное топливо больше не горит быстро, а только тлеет, а затем только тлеет.
Температура
Предполагая идеальные условия сгорания, такие как полное сгорание в адиабатических условиях (т. е. без потери или притока тепла), можно определить адиабатическую температуру сгорания. Формула, которая дает эту температуру, основана на первом законе термодинамики и учитывает тот факт, что теплота сгорания полностью используется для нагревания топлива, воздуха для горения или кислорода и газов продуктов сгорания (обычно называемых дымовые газы ).
В случае сжигания ископаемого топлива на воздухе температура горения зависит от
- Теплота сгорания
- Стехиометрическое соотношение воздуха и топлива λ{\displaystyle {\lambda}}
- Теплоемкость топлива и воздуха
- Температура воздуха и топлива на входе
Адиабатическая температура горения (также известная как адиабатическая температура пламени ) увеличивается при более высоких значениях теплотворной способности и температурах воздуха на входе и топлива, а также при приближении к единице стехиометрических соотношений воздуха.
Чаще всего адиабатические температуры горения угля составляют около 2200°C (для воздуха и топлива на входе при температуре окружающей среды и для λ=1,0{\displaystyle \lambda =1,0}), около 2150°C для нефти и 2000°C для природного газа.
В промышленных нагревателях, парогенераторах электростанций и больших газовых турбинах более распространенным способом выражения использования воздуха для горения сверх стехиометрического является процентов избыточного воздуха для горения .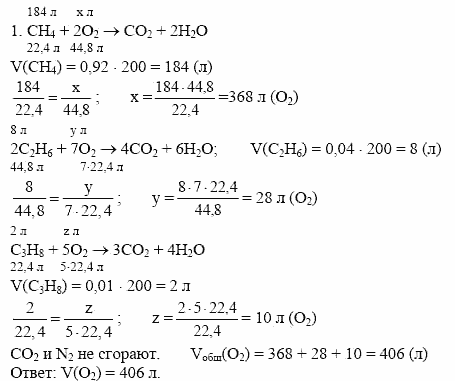 Например, 15-процентный избыток воздуха для горения означает, что используется на 15 процентов больше требуемого стехиометрического количества воздуха.
Например, 15-процентный избыток воздуха для горения означает, что используется на 15 процентов больше требуемого стехиометрического количества воздуха.
Анализ
В этом разделе представлен анализ горения для нескольких типичных видов топлива (углерод, водород, сера, уголь, нефть и газ), когда топливо взаимодействует с воздухом при стехиометрических условиях.
В представленном анализе горения и топливо, и воздух находятся при условиях горения на входе 298 K и абсолютном давлении 1 атм. Кроме того, сгорание происходит полностью и без потерь тепла.
При сгорании большое количество химической энергии реагентов выделяется в виде тепловой энергии.
Энтальпия сгорания (HHV или более высокая теплотворная способность) представляет собой разницу между значением энтальпии реагентов и значением энтальпии продуктов сгорания при эталонной температуре, которая составляет 298 К.
При равенстве значения энтальпии реагентов значению энтальпии продуктов сгорания можно рассчитать адиабатическую температуру пламени продуктов сгорания.
График на рисунке 1 показывает изменение значения энтальпии реагентов и продуктов сгорания при повышении температуры.
Физические свойства как реагентов, так и продуктов сгорания очень важны, и их необходимо знать для проведения успешных расчетов сгорания.
График на рисунке 2 показывает, как значения энтальпии реагентов и продуктов сгорания изменяются в зависимости от температуры. Физические свойства, представленные на этом графике, взяты из таблиц JANAF Thermochemical Data-Tables, 1970.
Рисунок 2: Реагенты и продукты сгорания, энтальпия в зависимости от температуры
Интересно отметить, что значение энтальпии для основных элементов горения, таких как углерод (C), водород (H), сера (S), кислород (O) и азот (N), равно нулю при условиях горения 298 К и 1 атм.
Также следует отметить, что для идеального газа значение энтальпии зависит только от температуры.
Помимо знания физических свойств реагентов и продуктов сгорания, для любого вида анализа и расчетов горения важно знать составы топлива и окислителя.
Для твердого и жидкого топлива топливные композиции даны в пересчете на единицу массы. В этом анализе CH 4 является единственным рассматриваемым газовым топливом. Для того чтобы сделать анализ горения простым и понятным, состав CH 4 представлен в пересчете на массу. Состав окислителя обычно указывается в моль/объем.
В таблице 1 представлены некоторые составы топлива:
| Топливо | С | Ч | С | Н | О | Н 2 О | CH 4 |
|---|---|---|---|---|---|---|---|
| Углерод | 1.000 | 0,000 | 0,000 | 0,000 | 0,000 | 0,000 | — |
| Водород | 0,000 | 1.000 | 0,000 | 0,000 | 0,000 | 0,000 | — |
| Сера | 0,000 | 0,000 | 1. 000 000 | 0,000 | 0,000 | 0,000 | — |
| Уголь | 0,780 | 0,050 | 0,030 | 0,040 | 0,080 | 0,020 | — |
| Масло | 0,860 | 0,140 | 0,000 | 0,000 | 0,000 | 0,000 | — |
| Топливный газ | — | — | — | — | — | — | 1.000 |
В таблице 2 указан состав воздуха:
| Окислитель | Н кг/кг | О кг/кг | Н 2 моль/моль | О 2 моль/моль |
|---|---|---|---|---|
| Воздух | 0,767 | 0,233 | 0,790 | 0,210 |
Опять же, в этом анализе горения анализируется только стехиометрическое горение. Приведены результаты такого анализа, в том числе состав продуктов сгорания по массе и моль/объем, адиабатическая температура пламени, стехиометрическое соотношение и высшая теплотворная способность топлива (ВТТ).
Приведены результаты такого анализа, в том числе состав продуктов сгорания по массе и моль/объем, адиабатическая температура пламени, стехиометрическое соотношение и высшая теплотворная способность топлива (ВТТ).
В Таблице 3 представлен весовой состав продуктов сгорания:
| Топливо | СО 2 | Н 2 О | SO 2 | Н 2 | O 2 |
|---|---|---|---|---|---|
| Углерод | 0,295 | 0,000 | 0,000 | 0,705 | 0,000 |
| Водород | 0,000 | 0,255 | 0,000 | 0,745 | 0,000 |
| Сера | 0,000 | 0,000 | 0,378 | 0,622 | 0,000 |
| Уголь | 0,249 | 0,041 | 0,005 | 0,705 | 0,000 |
| Масло | 0,203 | 0,079 | 0,000 | 0,718 | 0,000 |
| Топливный газ | 0,151 | 0,124 | 0,000 | 0,725 | 0,000 |
В таблице 4 представлен состав продуктов сгорания в объемном или мольном выражении:
| Топливо | СО 2 | Н 2 О | SO 2 | Н 2 | О 2 |
|---|---|---|---|---|---|
| Углерод | 0,210 | 0,000 | 0,000 | 0,790 | 0,000 |
| Водород | 0,000 | 0,347 | 0,000 | 0,653 | 0,000 |
| Сера | 0,000 | 0,000 | 0,210 | 0,789 | 0,000 |
| Уголь | 0,170 | 0,068 | 0,002 | 0,759 | 0,000 |
| Масло | 0,133 | 0,127 | 0,000 | 0,740 | 0,000 |
| Топливный газ | 0,095 | 0,190 | 0,000 | 0,715 | 0,000 |
При рассмотрении угля, нефти и газа в качестве топлива уголь имеет наибольшее количество CO 2 в продуктах сгорания как по весу, так и по молям.
В таблице 5 приведены адиабатическая температура пламени горения, стехиометрическое соотношение и высшая теплотворная способность топлива:
| Топливо | Адиабатический Температура пламени (K) | Стехиометрическое соотношение (см. примечание ниже) | ВТС (кДж/кг) |
|---|---|---|---|
| Углерод | 2 460 | 11.444 | 32 779,8 |
| Водород | 2 525 | 34.333 | 141 866,8 |
| Сера | 1 972 | 4,292 | 9 261,3 |
| Уголь | 2 484 | 10.487 | 32 937,9 |
| Масло | 2 484 | 14.580 | 47 630,0 |
| Топливный газ | 2 327 | 17.167 | 50 151,2 |
Примечание: Стехиометрическое соотношение – это масса воздуха, необходимая для полного сгорания единицы массы топлива. Таким образом, для полного идеального сгорания 1 кг углеродного топлива требуется 11,444 кг воздуха. Таким образом, для полного идеального сгорания 1 кг углеродного топлива требуется 11,444 кг воздуха. | |||
Сегодня глобальное потепление становится все более очевидным, и говорят, что оно в первую очередь вызвано выбросами CO 2 . Подробный анализ сгорания, как он представлен здесь, может быть очень полезен при определении различных сценариев использования топлива и технологий, которые приведут к сокращению текущих выбросов CO 2 .
Нестабильности
Нестабильности горения обычно представляют собой резкие колебания давления в камере сгорания. Эти колебания давления могут достигать 180 дБ, а длительное воздействие этих циклических давлений и тепловых нагрузок сокращает срок службы компонентов двигателя. В ракетах, таких как F1, используемых в программе Saturn V, нестабильность приводила к массивным повреждениям камеры сгорания и окружающих компонентов. Эта проблема была решена путем изменения конструкции топливной форсунки. В жидкостных реактивных двигателях размер и распределение капель можно использовать для ослабления нестабильности. Нестабильность горения является серьезной проблемой в наземных газотурбинных двигателях из-за выбросов NOx. Тенденция состоит в том, чтобы работать на обедненной смеси с коэффициентом эквивалентности менее 1, чтобы снизить температуру сгорания и, таким образом, уменьшить выбросы NOx; однако работа камеры сгорания на обедненной смеси делает ее очень восприимчивой к нестабильности сгорания.
В жидкостных реактивных двигателях размер и распределение капель можно использовать для ослабления нестабильности. Нестабильность горения является серьезной проблемой в наземных газотурбинных двигателях из-за выбросов NOx. Тенденция состоит в том, чтобы работать на обедненной смеси с коэффициентом эквивалентности менее 1, чтобы снизить температуру сгорания и, таким образом, уменьшить выбросы NOx; однако работа камеры сгорания на обедненной смеси делает ее очень восприимчивой к нестабильности сгорания.
Критерий Рэлея является основой для анализа термоакустической нестабильности горения и оценивается с использованием индекса Рэлея в течение одного цикла нестабильности.
- G (x) = 1T ∫ Tq ‘(x, t) p’ (x, t) dt {\ displaystyle G (x) = {\ frac {1} {T}} \ int _ {T} q ‘(x,t)p'(x,t)dt}
Когда колебания тепловыделения совпадают по фазе с колебаниями давления, индекс Рэлея положителен и величина термоакустической неустойчивости увеличивается. Соответственно, если индекс Рэлея отрицателен, возникает термоакустическое демпфирование. Критерий Рэлея подразумевает, что термоакустической нестабильностью можно оптимально управлять, если колебания тепловыделения на 180 градусов не совпадают по фазе с колебаниями давления на той же частоте. Это минимизирует индекс Рэлея.
Критерий Рэлея подразумевает, что термоакустической нестабильностью можно оптимально управлять, если колебания тепловыделения на 180 градусов не совпадают по фазе с колебаниями давления на той же частоте. Это минимизирует индекс Рэлея.
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Чанг, Рэймонд. 2006. Химия . Нью-Йорк: Макгроу-Хилл. ISBN 0073221031
- Коттон, Ф. Альберт и Джеффри Уилкинсон. 1988. Высшая неорганическая химия . Нью-Йорк: Уайли. ISBN 0471849979
- Куо, Кеннет Куан-юн. 2005. Принципы сжигания . Хобокен, Нью-Джерси: Джон Уайли. ISBN 0471046892
- Turns, Stephen R. 2000. An Introduction to Combustion . Нью-Йорк: Макгроу-Хилл. ISBN 0071169105
- Варнац, Дж., У. Маас и Р. В. Диббл. 2006. Горение: физико-химические основы, моделирование и симуляция, эксперименты, образование загрязняющих веществ. Берлин: Springer. ISBN 3540259929
Кредиты
Энциклопедия Нового Света авторов и редакторов переписали и дополнили статью Википедии в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен соответствовать условиям этой лицензии, которая может ссылаться как на Энциклопедия Нового Света участников и самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен соответствовать условиям этой лицензии, которая может ссылаться как на Энциклопедия Нового Света участников и самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
- Возгорание история
История этой статьи с момента ее импорта в New World Encyclopedia :
- История «Горения»
Примечание. На использование отдельных изображений, которые лицензируются отдельно, могут распространяться некоторые ограничения.
Примеры реакций горения в химии
В химии существует несколько типов реакций горения, наиболее распространенными из которых являются полное и неполное сгорание . Тип или реакция варьируется в зависимости от нескольких факторов, таких как:
Тип или реакция варьируется в зависимости от нескольких факторов, таких как:
- Тип горючего материала
- Площадь поверхности материала
- Давление пара
- Количество кислорода
- Атмосферное давление
Любая химическая реакция, в которой кислород используется в качестве одного из реагентов и выделяется тепло и/или световая энергия, называется реакцией горения. В некоторых случаях, таких как взрывная реакция кислорода с водородом, горение также может быть классифицировано как комбинированная реакция.
В этом посте:
В чем разница между полным и неполным сгоранием?
Конечные продукты сгорания всегда включают оксид и выделение тепловой энергии. Если другим реагентом (помимо кислорода) является органическое соединение, то продуктами реакции полного сгорания являются вода и углекислый газ.
Пример: полное сгорание газообразного пропана
Как следует из названия, в реакции полного сгорания полностью используется кислород. В этой реакции другой реагент полностью расходуется, поскольку он соединяется с кислородом. Как видно из примера, углеродистого остатка не осталось. Однако при неполном сгорании образуется окись углерода, и некоторое количество углеродистого остатка остается в виде сажи.
В этой реакции другой реагент полностью расходуется, поскольку он соединяется с кислородом. Как видно из примера, углеродистого остатка не осталось. Однако при неполном сгорании образуется окись углерода, и некоторое количество углеродистого остатка остается в виде сажи.
Пример: Неполное сгорание газообразного пропана
Неполное сгорание вредно для окружающей среды, так как образует дополнительные загрязняющие вещества, такие как сажа. Это также опасно, потому что угарный газ является токсичным веществом, которое может убить людей в закрытых помещениях, например, в гараже или в туннелях.
Кроме того, неполное сгорание неэффективно, поскольку топливо сгорает не полностью. Для двигателя, когда топливо сгорает не полностью, это означает, что двигатель не будет работать очень хорошо с точки зрения производства механической энергии. Это также может привести к отказу или повреждению двигателя.
Что такое горючее вещество?
Горючее вещество – это любой материал, который может легко реагировать с кислородом с высокой скоростью, выделяя при этом тепло и световую энергию. Горючие вещества также бывают в различных состояниях. Они могут быть газообразными, жидкими или твердыми.
Горючие вещества также бывают в различных состояниях. Они могут быть газообразными, жидкими или твердыми.
Легковоспламеняющиеся материалы, с другой стороны, относятся к категории горючих веществ с более низкой температурой воспламенения. Техническое определение горючего материала имеет температуру воспламенения выше 37,8ºC и ниже 93,3ºC. Между тем, горючий материал имеет температуру вспышки ниже 37,8ºC.
Многие вещества могут реагировать с кислородом, но обычно очень медленно. Например, ржавление железа — это реакция с кислородом (известная как окисление), которая занимает очень много времени, что делает ее едва заметной для человеческого глаза. Может пройти несколько дней или даже месяцев, прежде чем будет замечена какая-либо заметная разница. Железный гвоздь не заржавеет естественным путем всего за несколько минут или часов. Имея это в виду, железо и многие другие металлы являются негорючими.
С другой стороны, водород, метан, спирт, бензин, бумага и порох являются примерами легковоспламеняющихся материалов. В отличие от железа, эти вещества легко реагируют с кислородом при воспламенении от трения, искры, повышения температуры окружающей среды или пламени.
В отличие от железа, эти вещества легко реагируют с кислородом при воспламенении от трения, искры, повышения температуры окружающей среды или пламени.
Некоторые легколетучие жидкости также могут самовоспламеняться при наличии достаточного давления кислорода и паров. Горючие жидкости, такие как керосин, дизельное топливо и бензин, имеют определенные диапазоны температуры вспышки, которые определяются минимальной температурой, при которой они могут воспламениться при определенном давлении паров. То же самое относится и к легковоспламеняющимся жидкостям, таким как этанол и ацетон. В этой таблице сравниваются распространенные виды топлива и их температуры воспламенения:
В чем разница между горючим и негорючим веществом?
Горючие материалы быстро реагируют с кислородом и выделяют при этом тепловую и световую энергию. Между тем, негорючее вещество либо слишком инертно для реакции с кислородом, например благородные газы, либо очень медленно реагирует с кислородом, например железо.
Например, реакция железа с кислородом является реакцией окисления, а не примером горения. Как мы уже упоминали ранее, это слишком медленно, а выделяемая энергия слишком мала. Вот химическое уравнение баланса:
Fe + O 2 ⟶ Fe 2 O 3
Аналогичные реакции окисления происходят с другими металлами, такими как медь и цинк. При комнатной температуре и нормальном давлении большинство металлов не горят. Одним из исключений является магний. Вы можете легко воспламенить полоску магния, подвергнув ее воздействию пламени относительно низкой температуры, например пламени свечи:
2Mg + O 2 ⟶ 2MgO
Большинство других металлов, таких как алюминий, имеют такие высокие температуры плавления, что они могут гореть только в форме пара при очень высоких температурах.
5 Примеры горения
Реакции горения можно разделить на несколько типов в зависимости от энергии и скорости реакции, химических побочных продуктов и физических свойств или характера горения.
- Полное сгорание
Сгорание бензина в двигателях обычно считается полным сгоранием.
Полное сгорание полностью расходует горючий материал. Обычно это происходит при правильных условиях, например, в высокоэффективных автомобильных двигателях, где количество кислорода и температура достаточны для поддержания горения.
- Неполное сгорание
Сжигание древесины является примером неполного сгорания. Помимо негорючих компонентов древесины, таких как минералы, в процессе сжигания древесины образуются углеродные остатки.
- Тлеющее горение
Беспламенный древесный или угольный тлеющий уголь является примером тлеющего горения. Это относительно медленно и имеет низкую тепловую и световую энергию.
- Быстрое сгорание
Взрыв фейерверков можно классифицировать как пример быстрого возгорания. В состав большинства фейерверков входят окислители. После срабатывания порох может быстро воспламениться и произвести сильное тепло и яркий свет.
В состав большинства фейерверков входят окислители. После срабатывания порох может быстро воспламениться и произвести сильное тепло и яркий свет.
- Турбулентное горение
Сжигание топлива в газовых турбинах, например, в реактивных самолетах, происходит турбулентно, поскольку газ проходит через узкое сопло.
Заявление об ограничении ответственности
Блог на сайтеchemicals.co.uk и все, что в нем публикуется, предоставляется только в качестве информационного ресурса. Блог, его авторы и аффилированные лица не несут ответственности за любые несчастные случаи, травмы или ущерб, вызванные частично или непосредственно в результате использования информации, представленной на этом веб-сайте. Мы не рекомендуем использовать какие-либо химические вещества без предварительного ознакомления с Паспортом безопасности материала, который можно получить у производителя, и следуя советам по безопасности и мерам предосторожности, указанным на этикетке продукта.

 2 чистый кислород
2 чистый кислород
 2 Медленно
2 Медленно 8N_{2}}
8N_{2}} Горючие газы начинают выделяться в процессе, аналогичном сухой перегонке.
Горючие газы начинают выделяться в процессе, аналогичном сухой перегонке.