Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука
| Похожие вопросы |
Решено
В прямоугольном треугольнике гипотенуза равна 41 см, а один из катетов 9 см.
Пользуйтесь нашим приложением
Химические свойства солей — реакции, определение и примеры
Поможем понять и полюбить химию
Начать учиться
Впервые школьники знакомятся с химическими свойствами солей в 8 классе, и для понимания дальнейшего материала без этой темы никуда. Наша статья поможет освежить знания перед контрольной или экзаменом: вспомним, какие бывают соли и как они образуются, рассмотрим типичные реакции с ними.
Соли — это сложные вещества, в состав которых входят катионы металла и анионы кислотного остатка. Иногда в состав солей входят водород или гидроксид-ион.
Классификация и номенклатура солей
Так как соли — это продукт полного или частичного замещения металлом атома водорода в кислоте, по составу их можно классифицировать следующим образом.
Кислые соли
Образованы неполным замещением атомов водорода на металл в кислоте.
В наименованиях кислых солей указывают количество водорода приставками «гидро-» или «дигидро-», название кислотного остатка и название металла. Если металл имеет переменную валентность, то в скобках указывают валентность.
Примеры кислых солей и их наименования:
LiHCO3 — гидрокарбонат лития,
NaHSO4 — гидросульфат натрия,
NaH2PO4 — дигидрофосфат натрия.
Средние соли
Образованы полным замещением атомов водорода в кислоте на металл.
Наименования средних солей складываются из названий кислотного остатка и металла. При необходимости указывают валентность.
Примеры средних солей с названиями:
CuSO4 — сульфат меди (II),
CaCl2 — хлорид кальция.

Основные соли
Продукт неполного замещения гидроксогрупп на кислотный остаток.
В наименованиях основных солей указывают количество гидроксид-ионов приставкой «гидроксо-» или «дигидроксо-», название кислотного остатка и название металла с указанием валентности.
Пример: Mg(OH)Cl — гидроксохлорид магния.
Двойные соли
В состав входят два разных металла и один кислотный остаток.
Наименование складывается из названия аниона кислотного остатка и названий металлов с указанием валентности (если металл имеет переменную валентность).
Примеры двойных солей и их наименования:
KNaSO4 — сульфат калия-натрия,
KAl(SO4)2 — сульфат калия-алюминия.
Смешанные соли
Содержат один металл и два разных кислотных остатка.
Наименования смешанных солей складываются из названия кислотных остатков (по усложнению) и названия металла с указанием валентности (при необходимости).
Примеры смешанных солей с наименованиями:
CaClOCl — хлорид-гиполхорит кальция,
PbFCl — фторид-хлорид свинца (II).
Комплексные соли
Образованы комплексным катионом или анионом, связанным с несколькими лигандами.
Называют комплексные соли по схеме: координационное число + лиганд с окончанием «-о» + комплексообразователь с окончанием «-ат» и указанием валентности + внешняя сфера, простой ион в родительном падеже.
Пример: K[Al(OH)4] — тетрагидроксоалюминат калия.
Гидратные соли
В состав входит молекула кристаллизационной воды.
Число молекул воды указывают численной приставкой к слову «гидрат» и добавляют название соли.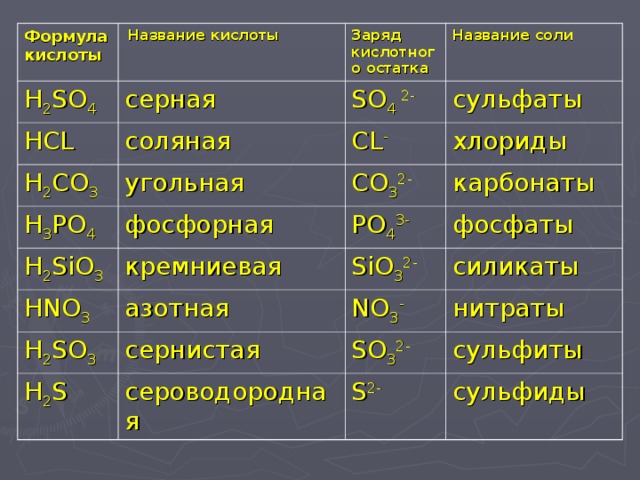
Пример: СuSO4∙5H2O — пентагидрат сульфата меди (II).
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Получение солей
Получение средних солей
Средние соли можно образовать в ходе следующих реакций:
Металл + неметалл:
2Na + Cl2 = 2NaCl
Fe + S =FeS
Так получают только соли бескислородных кислот.
Металл, стоящий левее h3 в ряду активности, с раствором кислоты:
Mg + 2HCl = MgCl2 + h3
Металл с раствором соли менее активного металла:
Fe + CuCl2 = FeCl2 + Cu
Основный оксид + кислотный оксид:
Na2O + CO2 = Na2CO3
Основный оксид и кислота:
Основание с кислотным оксидом:
2NaOH + SO3 = Na2SO4 + H2O
Основание с кислотой (реакция нейтрализации):
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Взаимодействие соли с кислотой:
MgCO3 + 2HCl = MgCl2 + H2O + CO2
BaCl2 + H2SO4 = BaSO4 + 2HCl
Взаимодействие возможно, если одним из продуктов реакции будет нерастворимая соль, вода или газ.

Реакция раствора основания с раствором соли:
2NaOH + CuSO4 = Na2SO4 + Ba(OH)2
Взаимодействие растворов двух солей с образованием новых солей:
NaCl + AgNO3 = AgCl + NaNO3
Получение кислых солей
Кислые соли образуются при взаимодействии:
Кислот с металлами:
Zn + 2H2SO4 = H2 + Zn(HSO4)2
Кислот с оксидами металлов:
CaO + H3PO4 = CaHPO4 + H2O
Гидроксидов металлов с кислотами:
Ba(OH)2 + H3PO4 = BaHPO4 + 2H2O
Кислот с солями:
Ca3PO4 + 4H3PO4 = 3Ca(H2PO4)2
Аммиака с кислотами:
NH3 + H3PO4 = NH4H2PO4
Получение кислых солей возможно, если кислота в избытке.
Также кислые соли образуются в ходе реакции основания с избытком кислотного оксида:
KOH + CO2 = KHCO3
2SO2 + Ca(OH)2 = Ca(HSO3)2
Получение основных солей
Взаимодействие кислоты с избытком основания:
Fe(OH)3 + HCl = Fe(OH)2Cl + H2O
Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов:
Cu(NO3)2 + NaOH = CuOHNO3 + NaNO3
Взаимодействие солей слабых кислот со средними солями:
2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3 + CO2 + 4NaCl
Растворимые соли являются электролитами, следовательно, могут распадаться на ионы.
 Средние соли диссоциируют сразу:
Средние соли диссоциируют сразу:NaCl → Na+ + Cl—
Термическое разложение:
CaCO3 = CaO + CO2
Нитраты разлагаются в зависимости от активности металла соли:
Получение комплексных солей
Реакции солей с лигандами:
AgCl + 2Nh4 = [Ag(NH3)2]Cl
FeCl3 + 6KCN = K3[Fe(CN)6] + 3KCl
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Al2O3 + 2NaOH +3H2O = 2Na[Al(OH)4]
Получение двойных солей
Двойные соли получают совместной кристаллизацией двух солей:
Cr2(SO4)3 + K2SO4 + 24H2O = 2[KCr(SO4) 2 • 12H2O]
Химические свойства солей
Химические свойства средних солей
| Металл | Левее Mg, кроме Li | От Mg до Cu | Правее Cu |
| Продукты | MeNO3 + O2 | MexOy + NO2 + O2 | Me + NO2 + O2 |
| Пример | 2NaNO3 = 2NaNO2 + O2 | 2Cu(NO3)2 = 2CuO + 4NO2 + O2 | 2AgNO3= 2Ag + 2NO2 + O2 |
Соли аммония разлагаются с выделением азота или оксида азота (I), если в составе анион, проявляет окислительные свойства.
 В остальных случаях разложение солей аммония сопровождается выделением аммиака:
В остальных случаях разложение солей аммония сопровождается выделением аммиака:NH4Cl = NH3 + HCl
Взаимодействие солей с металлами:
Fe + CuSO4 = FeSO4 + Cu
Более активные металлы вытесняют менее активные металлы из растворов солей.
Некоторые соли подвержены гидролизу:
Na2CO3 + H2O = NaOH + NaHCO3
FeCl3+ H2O = Fe(OH)Cl2 + HCl
Обменные реакции соли и кислоты, соли с основаниями и взаимодействие солей с солями:
K2CO3 + 2HCl = 2KCl + CO2+H2O
Fe(NO3)3 + 3NaOH = Fe(OH)3 + 3NaNO3
AgCl + 2Na2S2O3 = Nа3[Ag(S2O3)2] + NaCl
Окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона:
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Химические свойства кислых солей
Диссоциация.
 Кислые соли диссоциируют ступенчато:
Кислые соли диссоциируют ступенчато:NaHCO3 → Na+ +HCO3−
HCO3− → H+ + CO32−
Термическое разложение с образованием средней соли:
Ca(HCO3)2 = CaCO3 + CO2 + H2O
Взаимодействие солей со щелочью. В результате образуется средняя соль:
Ba(HCO3)2 + Ba(OH)2 = 2BaCO3 + 2H2O
Химические свойства основных солей
Термическое разложение:
[Cu(OH)]2CO3 = 2CuO + CO2 + H2O
Реакции солей с кислотами — образование средней соли:
Sn(OH)Cl + HCl = SnCl2 + H2O
Диссоциация — так же как и кислые соли, основные соли диссоциируют ступенчато.

Химические свойства комплексных солей
Избыток сильной кислоты приводит к разрушению комплекса и образованию двух средних солей и воды:
Na[Al(OH)4] + 4HCl(изб.) = NaCl + AlCl3 + 4H2O,
Недостаток сильной кислоты приводит к образованию средней соли активного металла, амфотерного гидроксида и воды:
Na[Al(OH)4] + HCl = NaCl + Al(OH)3 + H2O,
Взаимодействие слабой кислоты с солью образует кислую соль активного металла, амфотерный гидроксид и воду:
Na[Al(OH)4] + H2S = NaHS + Al(OH)3 + H2O,
При действии углекислого или сернистого газа получаются кислая соль активного металла и амфотерный гидроксид:
K3[Cr(OH)6] + 3SO2 = 3KHSO3 + Cr(OH)3,
Реакция солей, образованных сильными кислотами с катионами Fe3+, Al3+ и Cr3+, приводит к взаимному усилению гидролиза.
 Продукты реакции — два амфотерных гидроксида и соль активного металла:
Продукты реакции — два амфотерных гидроксида и соль активного металла:K3[Cr(OH)6] +Al(NO3)3 = Al(OH)3 + Cr(OH)3 + 3KNO3
Разлагаются при нагревании:
K3[Cr(OH)6] =KCrO2 + 2H2O + 2KOH
Вопросы для самопроверки
С чем взаимодействуют средние соли?
Назовите типичные реакции солей.
Из предложенного списка солей выберите те, которые не реагируют с цинком: нитрит калия, бромид железа, карбонат цезия, сульфат меди.
Формула какого вещества пропущена в уравнении реакции:
MgO + … → MgCl2 + Н2O
HCl
Cl2
Cl2O7
HClO3
Татьяна Сосновцева
К предыдущей статье
Изомеры
К следующей статье
Качественные реакции
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Какова химическая реакция HCl и Na2CO3? – Gzipwtf.
 com
comПолезные советы
Диана Монтгомери
Какова химическая реакция HCl и Na2CO3?
При смешивании растворов карбоната натрия и соляной кислоты уравнение гипотетической реакции двойного замещения имеет вид: Na2CO3 + 2 HCl → 2 NaCl + h3CO3 При смешивании этих растворов выделяются пузырьки бесцветного газа.
Что произошло, когда вы добавили HCl в Na2CO3?
Что происходит, когда карбонат натрия реагирует с соляной кислотой? Ответ: При взаимодействии разбавленной соляной кислоты с карбонатом натрия образуется хлорид натрия, углекислый газ и вода. Наблюдается бурное вскипание при выделении углекислого газа.
Какой газ образуется при смешивании растворов HCl и Na2CO3?
Как и похожее по звучанию соединение бикарбонат натрия — пищевая сода — оно является щелочным и может вступать в реакцию с кислотами. HCl, или соляная кислота, является сильной кислотой, которая реагирует с карбонатом натрия. В результате реакции образуется большое количество углекислого газа, воды и поваренной соли.
В результате реакции образуется большое количество углекислого газа, воды и поваренной соли.
Как называется Na2CO3?
НАТРИЯ КАРБОНАТ
Натрия карбонат
| PubChem CID | 10340 |
|---|---|
| Молекулярная формула | Na2CO3 или CNa2O3 |
| Синонимы | НАТРИЯ КАРБОНАТ 497-19-8 Двунатриевая соль Двунатриевая соль угольной кислоты Кальцинированная сода Подробнее… |
| Молекулярный вес | 105,988 |
| Исходное соединение | CID 767 (угольная кислота) |
Является ли Na2CO3 HCl?
Это кислотно-щелочная реакция (нейтрализация): Na 2CO 3 является основанием, HCl является кислотой. Это реакция газовыделения, СО 2 – образующийся газ….
| 1 | HCl + Na2CO3 → h3O + CO2 + NaCl |
|---|---|
| 2 | HCl + Na2CO3 + CaNO3 → h3O + CO2 + NaCl + NO2 + CaCl2 |
| 3 | HCl + Na2CO3 + NaHCO3 → h3O + CO2 + NaCl |
Какой газ образуется при добавлении соляной кислоты HCl к водному раствору соли, содержащей карбонат-ионы co_3 2 -} 3 2 — )?
CO32- + h3O ⇌ HCO3- + OH- Карбонаты реагируют с кислотами, образуя соли металла, газообразный диоксид углерода и воду. Это реакция, которая возникает, когда антацид, содержащий активный ингредиент карбонат кальция (CaCO3), вступает в реакцию с желудочной кислотой (соляной кислотой).
Это реакция, которая возникает, когда антацид, содержащий активный ингредиент карбонат кальция (CaCO3), вступает в реакцию с желудочной кислотой (соляной кислотой).
Как образуется Na2CO3?
Безводная соль или безводный Na2CO3 также известна как кальцинированная сода и образуется при нагревании гидратов. Кроме того, он также образуется при нагревании (кальцинировании) гидрокарбоната натрия, как на заключительном этапе процесса Сольве.
Каково соотношение Na2CO3 и HCl?
Когда молярное соотношение Na2CO3 и HCl достигает 1:1, весь Na2CO3 превращается в NaHCO3.
Можно ли добавлять HCl к твердому Na2CO3?
Также к твердому Na 2 CO 3 можно добавить HCl. В этом уроке мы обсудим различные характеристики реакции карбоната натрия и кислоты HCl. Водная соляная кислота (HCl) является сильной кислотой. Когда сильная кислота добавляется к соединению карбоната металла, выделяется углекислый газ.
Какой тип реакции NaHCO3 HCl NaCl h3CO3?
NaHCO3 (бикарбонат натрия) представляет собой основание, а HCl (соляная кислота) представляет собой кислоту. Однако их реакция образует соль и кислоту! NaHCO3 + HCl >> NaCl + h3CO3. Он образует соль и угольную кислоту! Надеюсь это поможет!
Однако их реакция образует соль и кислоту! NaHCO3 + HCl >> NaCl + h3CO3. Он образует соль и угольную кислоту! Надеюсь это поможет!
Какое химическое уравнение для карбоната натрия и соляной кислоты?
Уравнение первой стадии реакции между карбонатом натрия и соляной кислотой снова показано ниже: Na2CO3(водн.) + HCl(водн.) → NaHCO3 (водн.) + NaCl (водн.) Из уравнения видно, что 1 моль Na2CO3 будет реагировать с 1 молем HCl. Какое молекулярное уравнение для карбоната натрия и серной кислоты?
Что происходит при добавлении карбоната натрия к Na2CO3?
Добавление раствора HCl к твердому Na 2 CO 3 Если водный раствор HCl добавить к твердому карбонату натрия, из реакции немедленно выделяется газообразный диоксид углерода. Эту реакцию можно использовать для идентификации карбоната натрия из сульфата натрия. Вопросы, заданные студентами
youtube.com/embed/ciEpkUklLfY?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»> Категория: Полезные советыТитрование карбоната натрия соляной кислотой
••• Sinhyu/iStock/GettyImages
Обновлено 11 апреля 2018 г.
Автор Chris Deziel
Методом титрования можно определить концентрацию раствора карбоната натрия, используя раствор с известной концентрацией соляной кислоты, или наоборот. HCl постепенно снижает щелочность раствора до тех пор, пока pH не станет равным 7. Поскольку реакция между карбонатом натрия и соляной кислотой протекает в две стадии, можно использовать более одного индикатора. Для первого этапа подойдет фенолфталеин, а для второго лучше всего подойдет метиловый оранжевый.
TL;DR (слишком длинный; не читал)
Используйте фенолфталеин для первого титрования карбоната натрия соляной кислотой, затем проверьте свои результаты, выполнив второе титрование метилоранжем.
Двухстадийная реакция
При добавлении раствора соляной кислоты (HCl) к раствору карбоната натрия (Na 2 CO 3 ) ион водорода в HCl меняется местами с одним из ионов натрия в Na 2 CO 3 для производства гидрокарбоната натрия, также известного как бикарбонат натрия (пищевая сода) и хлорид натрия (соль).
Na 2 CO 3 (водн.) + HCl (водн.) → NaHCO 3 (водн.) + NaCl (водн.)
Гидрокарбонат натрия является щелочным, и он реагирует с еще находящейся в растворе HCl с образованием натрия хлорид, углекислый газ и вода.
NaHCO 3 (водн.) + HCl (водн.) → NaCl (водн.) + CO 2 (г) + H 2 O(ж)
Фенолфталеин является хорошим индикатором первой реакции, т.к. к изменению рН, вызванному образованием гидрокарбоната натрия. Он розовый в основных растворах и становится бесцветным, как только раствор становится кислым. Метиловый оранжевый, с другой стороны, реагирует на изменения pH, связанные с образованием NaCl, меняя цвет с желтого на красный по мере того, как раствор становится более кислым. В нейтральном состоянии это отчетливый оранжевый цвет.
Метиловый оранжевый, с другой стороны, реагирует на изменения pH, связанные с образованием NaCl, меняя цвет с желтого на красный по мере того, как раствор становится более кислым. В нейтральном состоянии это отчетливый оранжевый цвет.
Основная процедура
Для титрования обычно требуются мензурки с точной градуировкой и пипетки для переноса раствора из одной мензурки в другую. Наденьте защитные очки и перчатки для защиты от агрессивных химикатов.
Отмерьте необходимое количество раствора карбоната натрия неизвестной концентрации и раствора соляной кислоты известной концентрации в отдельные мерные стаканы.
Добавьте несколько капель фенолфталеина в раствор карбоната натрия. Индикатор станет розовым.
Осторожно добавляйте HCl к раствору карбоната натрия, пока раствор не станет бесцветным. Запишите объем добавленного раствора HCl.
Рассчитайте количество молей HCl в исходном растворе и получите из него количество молей Na 2 CO 3 в целевом растворе, имея в виду, что 1 моль HCl реагирует с 1 молем Na 2 СО 3 .

 03.21
03.21

 Средние соли диссоциируют сразу:
Средние соли диссоциируют сразу: В остальных случаях разложение солей аммония сопровождается выделением аммиака:
В остальных случаях разложение солей аммония сопровождается выделением аммиака: Кислые соли диссоциируют ступенчато:
Кислые соли диссоциируют ступенчато:
 Продукты реакции — два амфотерных гидроксида и соль активного металла:
Продукты реакции — два амфотерных гидроксида и соль активного металла: