ОглавлениеПРЕДИСЛОВИЕ К ПЕРВОМУ ИЗДАНИЮПРЕДИСЛОВИЕ КО ВТОРОМУ ИЗДАНИЮ ПРЕДИСЛОВИЕ К ТРЕТЬЕМУ ИЗДАНИЮ ВВЕДЕНИЕ § 1. Анализ и синтез § 2. Предмет аналитической химии § 3. Развитие аналитической химии § 4. Качественный и количественный анализ ГЛАВА I. ПРИМЕНЕНИЕ ЗАКОНА ДЕЙСТВИЯ МАСС В АНАЛИТИЧЕСКОЙ ХИМИИ § 1. Влияние среды на состояние ионов в растворах § 2. Обратимые и необратимые аналитические реакции § 3. Направление аналитических реакций; правила обменного разложения § 4. Закон действия масс и следствие из него § 5. Границы применимости закона действия масс § 6. Сильные и слабые электролиты § 7. Активность § 8. Коэффициент активности и ионная сила Б. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ (В ГОМОГЕННЫХ СИСТЕМАХ) § 9. Гомогенные и гетерогенные системы § 10. Ионное произведение воды § 11. Ионы гидроксония § 12. Равновесие ионов в водных растворах; понятие о pH § 13.  Равновесие в водных растворах слабых электролитов Равновесие в водных растворах слабых электролитов§ 14. Влияние сильных кислот или сильных оснований на степень электролитической диссоциации слабых электролитов § 15. Приближенные формулы для расчета [H+] и [OH-] в водных растворах кислот и оснований В. РАВНОВЕСИЯ В БУФЕРНЫХ РАСТВОРАХ § 16. Буферные растворы § 17. Применение буферных растворов в химическом анализе Г. РАВНОВЕСИЯ В РАСТВОРАХ ГИДРОЛИЗУЮЩИХСЯ СОЛЕЙ § 18. Теоретические основы гидролиза § 19. Механизм гидролитического расщепления § 20. Подавление и усиление гидролиза солей Д. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ ТИПИЧНО АМФОТЕРНЫХ ЭЛЕКТРОЛИТОВ § 21. Поведение амфотерных гидроокисей в водных растворах § 22. Константы электролитической диссоциации амфотерных гидроокисей Е. РАВНОВЕСИЯ В СИСТЕМАХ: ОСАДОК-НАСЫЩЕННЫЙ РАСТВОР § 24. Произведение растворимости § 25. Произведение активностей § 26. Вычисление растворимости электролитов в воде по величине произведения растворимости § 27.  Влияние различных факторов на растворимость малорастворимых электролитов Влияние различных факторов на растворимость малорастворимых электролитовЖ. ОСНОВЫ ТЕОРИИ ОБРАЗОВАНИЯ И РАЗЛОЖЕНИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИИ, ПРИМЕНЯЕМЫХ В АНАЛИТИЧЕСКОЙ ХИМИИ § 28. Характеристика комплексных соединений, имеющих значение в химическом анализе § 29. Квантовомеханические представления о строении комплексов § 30. Равновесия в растворах комплексных соединений § 31. Константы нестойкости комплексов § 32. Внутрикомплексные соединения § 33. Методы разложения и образования комплексов, применяемых в аналитической химии § 34. Применение метода комплексообразования в химическом анализе ГЛАВА II. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ, ПРИМЕНЯЕМЫХ В АНАЛИТИЧЕСКОЙ ХИМИИ § 1. Окисление—восстановление как один из основных методов химического анализа § 2. Направление реакций окисления—восстановления § 3. Окислительно-восстановительные потенциалы § 4. Зависимость между величинами окислительно-восстановительных потенциалов и условиями, в которых протекают реакции окисления—восстановления § 5.  Вычисление окислительно-восстановительных потенциалов Вычисление окислительно-восстановительных потенциалов§ 6. Вычисление окислительно-восстановительных потенциалов с учетом коэффициентов активности ГЛАВА III. ВВЕДЕНИЕ В КАЧЕСТВЕННЫЙ АНАЛИЗ § 1. Обнаружение отдельных элементов § 2. Анализ мокрым и сухим путем § 3. Химические и физические методы качественного анализа § 4. Макро-, полумикро- и микрометоды § 5. Капельный анализ § 7. Метод растирания порошков § 8. Методы анализа, основанные на нагревании и сплавлении веществ § 9. Спектральный качественный анализ § 10. Хроматографический метод анализа § 11. Кинетические методы анализа Б. УСЛОВИЯ ВЫПОЛНЕНИЯ КАЧЕСТВЕННЫХ РЕАКЦИЙ § 12. Специфичность и чувствительность реакций § 13. Максимальная чувствительность аналитических реактивов § 14. Способы повышения чувствительности реакций § 15. Маскировка мешающих ионов § 16. Определение pH среды § 17. Регулирование pH среды в процессе аналитических определений В.  РЕАКТИВЫ РЕАКТИВЫ§ 18. Понятие о химических реактивах § 19. Концентрация применяемых реактивов § 20. Техника пользования реактивами Г. ПОСУДА И ПРИБОРЫ, ПРИМЕНЯЕМЫЕ В КАЧЕСТВЕННОМ АНАЛИЗЕ § 21. Химическая посуда § 22. Приборы Д. АНАЛИТИЧЕСКИЕ ГРУППЫ § 23. Дробный и систематический анализ § 24. Аналитическая классификация катионов § 25. Сводные таблицы действия реактивов на катионы и анионы Е. ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА И АНАЛИТИЧЕСКАЯ КЛАССИФИКАЦИЯ ИОНОВ § 26. Значение периодического закона в аналитической химии § 27. Периодическая система элементов Д. И. Менделеева как классификация атомов по их строению § 28. Зависимость некоторых химических свойств элементов от положения их в периодической системе Д. И. Менделеева § 29. Растворимость химических соединений в связи с положением элементов в периодической системе Д. И. Менделеева § 30. Открытие новых аналитических реакций § 31. Аналитические группы и периодическая система элементов Д.  И. Менделеева И. МенделееваОБНАРУЖЕНИЕ ИНДИВИДУАЛЬНЫХ КАТИОНОВ И АНАЛИЗ СМЕСЕЙ КАТИОНОВ § 2. Общие реакции катионов первой аналитической группы РЕАКЦИИ КАТИОНОВ 1-й ПОДГРУППЫ § 3. Обнаружение NН-ионов § 4. Методы разложения и удаления солей аммония § 5. Обнаружение K-ионов § 6. Обнаружение Rb-ионов § 7. Обнаружение Cs-ионов § 8. Анализ смеси катионов первой подгруппы РЕАКЦИИ КАТИОНОВ 2-й ПОДГРУППЫ § 9. Обнаружение Li-ионов § 10. Обнаружение Na-ионов § 11. Обнаружение Mg-ионов § 12. Обзор действия реактивов на катионы первой аналитической группы § 13. Анализ смеси катионов второй подгруппы § 14. Анализ смеси ионов § 15. Анализ смеси ионов ГЛАВА V. ВТОРАЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ § 1. Характеристика второй аналитической группы катионов § 2. Общие реакции катионов второй аналитической группы § 3. Обнаружение Ca-ионов § 4. Обнаружение Sr-ионов § 5. 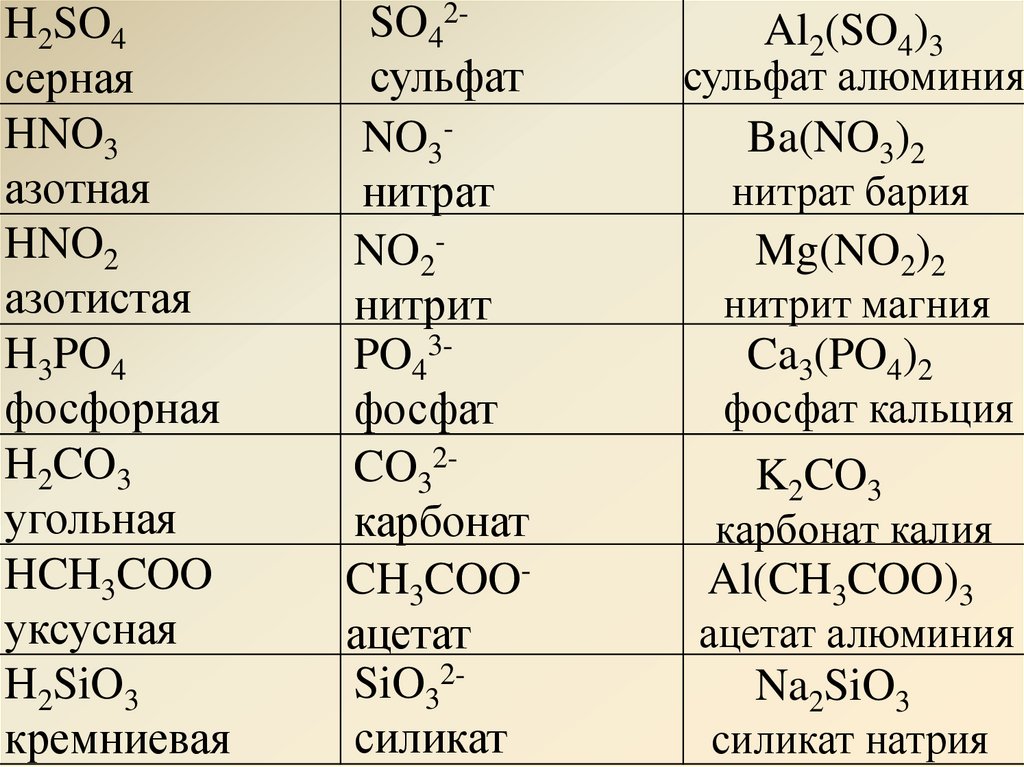 Обнаружение Ba-ионов Обнаружение Ba-ионов§ 6. Обзор действия реактивов на катионы второй аналитической группы § 7. Основы теории осаждения катионов второй аналитической группы групповым реактивом—карбонатом аммония § 8. Систематический ход анализа смеси катионов первой и второй аналитических групп § 9. Систематический ход анализа смеси катионов первой и второй аналитических групп в присутствии ионов § 10. Теоретические основы перевода сульфатов катионов второй аналитической группы в карбонаты ГЛАВА VI. ТРЕТЬЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ § 1. Характеристика третьей аналитической группы катионов § 2. Общие реакции катионов третьей аналитической группы § 3. Обнаружение Be-ионов § 4. Обнаружение Al-ионов § 5. Обнаружение ионов титана (IV) § 6. Обнаружение Cr-ионов § 7. Обнаружение Mn-ионов § 8. Обнаружение Fe-ионов § 9. Обнаружение Fe-ионов § 10. Обнаружение Co-ионов § 13. Обнаружение ионов циркония (IV) § 15.  Обзор действия реактивов на катионы третьей аналитической группы Обзор действия реактивов на катионы третьей аналитической группы§ 16. Использование коллоидных систем в химическом анализе § 17. Основы теории осаждения катионов третьей аналитической группы групповым реактивом — сульфидом аммония § 18. Теоретические основы применения органических реактивов в качественном анализе неорганических веществ § 19. Методы разделения некоторых катионов третьей аналитической группы § 20. Систематический ход анализа смеси катионов третьей аналитической группы § 21. Систематический ход анализа смеси катионов первой, второй и третьей аналитических групп § 22. Систематический ход анализа смеси катионов первой, второй и третьей аналитических групп в присутствии PO-ионов ГЛАВА VII. ЧЕТВЕРТАЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ § 1. Характеристика четвертой аналитической группы катионов § 2. Общие реакции катионов четвертой аналитической группы РЕАКЦИИ КАТИОНОВ ПЕРВОЙ ПОДГРУППЫ (ПОДГРУППЫ МЕДИ) § 3. Обнаружение Hg-ионов § 4.  Обнаружение Cu-ионов Обнаружение Cu-ионов§ 5. Обнаружение Cd-ионов § 6. Обнаружение Bi-ионов РЕАКЦИИ КАТИОНОВ ВТОРОЙ ПОДГРУППЫ (ПОДГРУППЫ МЫШЬЯКА) § 7. Обнаружение ионов мышьяка (III) § 8. Обнаружение ионов мышьяка (V) § 9. Общие реакции обнаружения § 10. Обнаружение ионов сурьмы (III) § 11. Обнаружение ионов сурьмы (V) § 12. Общие реакции обнаружения Sb § 13. Обнаружение ионов олова (II) § 14. Обнаружение ионов олова (IV) § 15. Общие реакции обнаружения ионов олова (II) и олова (IV) § 16. Отделение ионов олова от других ирнов четвертой аналитической группы § 17. Обнаружение ионов германия (IV) § 18. Отделение ионов германия от других ионов четвертой аналитической группы § 19. Обзор действия реактивов на катионы четвертой аналитической группы § 21. Систематический ход анализа смеси катионов четвертой аналитической группы ГЛАВА VIII.  ПЯТАЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ (ГРУППА СЕРЕБРА) ПЯТАЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ (ГРУППА СЕРЕБРА)§ 1. Характеристика пятой аналитической группы катионов § 2. Общие реакции катионов пятой аналитической группы § 3. Обнаружение Ag-ионов § 4. Обнаружение [Hg]-ионов § 5. Обнаружение Pb-ионов § 6. Обзор действия реактивов на катионы пятой аналитической группы § 7. Систематический ход анализа смеси катионов пятой аналитической группы ГЛАВА IX. АНАЛИЗ СМЕСИ ИОНОВ ВСЕХ ПЯТИ АНАЛИТИЧЕСКИХ ГРУПП § 1. Сероводородный метод анализа § 2. Недостатки сероводородного метода анализа § 3. Ошибки, возникающие при анализе смеси ионов пяти аналитических групп § 4. Бессероводородные методы анализа ОБНАРУЖЕНИЕ ИНДИВИДУАЛЬНЫХ АНИОНОВ И АНАЛИЗ СМЕСЕЙ АНИОНОВ § 1. Аналитическая классификация анионов § 2. Групповые реактивы на анионы § 3. Классификация методов анализа анионов ГЛАВА XI. ПЕРВАЯ АНАЛИТИЧЕСКАЯ ГРУППА АНИОНОВ § 1. Характеристика первой группы анионов § 2. Реакции анионов первой группы § 3.  Обнаружение CI-ионов Обнаружение CI-ионов§ 4. Обнаружение Br-ионов § 5. Обнаружение I-ионов § 6. Обнаружение CN-ионов § 7. Обнаружение SCN-ионов § 8. Обнаружение [Fe(CN)]-ионов § 9. Обнаружение Fe(CN)-ионов § 10. Обнаружение NO-ионов § 11. Обнаружение NO2-ионов § 12. Обнаружение S-ионов § 13. Обнаружение Ch4COOO-ионов § 14. Обнаружение BrO3-ионов § 15. Обнаружение ClO3-ионов § 16. Обнаружение ClO4-ионов § 17. Обзор действия реактивов на анионы первой группы МЕТОДЫ АНАЛИЗА НЕКОТОРЫХ СМЕСЕЙ АНИОНОВ § 18. Анализ смеси Cl, Br и I-ионов § 19. Анализ смеси Cl, Br, I и SCN-ионов § 20. Анализ смеси Cl, ClO3 и ClO4-ионов § 21. Анализ смеси NO2 и NO3-ионов § 22. Анализ смеси анионов первой группы ГЛАВА XII. ВТОРАЯ АНАЛИТИЧЕСКАЯ ГРУППА АНИОНОВ § 1. Характеристика второй группы анионов § 2. Общие реакции анионов второй группы § 3. Обнаружение SO3-ионов § 4. Обнаружение S2O3-ионов § 5. Обнаружение S2O3 в присутствии SO3-ионов § 6.  Обнаружение SO4-ионов Обнаружение SO4-ионов§ 7. Обнаружение CO3-ионов § 8. Обнаружение CO3-ионов в присутствии SO3 и S2O3-ионов § 9. Обнаружение PO4-ионов § 10. Обнаружение CrO4-ионов § 11. Обнаружение AsO3-ионов § 12. Обнаружение AsO4-ионов § 13. Обнаружение BO2 и BO3-ионов § 14. Обнаружение SiO3-ионов § 15. Обнаружение F-ионов § 16. Обнаружение C2O4-ионов § 17. Обнаружение VO3-ионов § 18. Обнаружение MoO4-ионов § 19. Обнаружение WO4-ионов § 20. Обзор действия реактивов на анионы второй группы МЕТОДЫ АНАЛИЗА НЕКОТОРЫХ СМЕСЕЙ АНИОНОВ § 21. Анализ смеси ионов § 22. Анализ смеси SO3, SO4, S2O3 и CO3-ионов § 23. Анализ смеси VO2, MoO4 и WO4-ионов § 24. Анализ смеси анионов второй группы § 25. Анализ смеси анионов первой и второй групп ГЛАВА XIII. ОБНАРУЖЕНИЕ СВОБОДНЫХ МЕТАЛЛОВ И НЕМЕТАЛЛОВ, ИДЕНТИФИЦИРОВАНИЕ СОЛЕЙ И ДРУГИХ ИНДИВИДУАЛЬНЫХ СОЕДИНЕНИЙ И АНАЛИЗ ИХ СМЕСЕЙ § 1. Подготовка вещества к анализу § 2. Предварительные испытания § 3.  Растворение анализируемого вещества в воде, кислотах и щелочах Растворение анализируемого вещества в воде, кислотах и щелочах§ 4. Переведение в растворимое состояние веществ, нерастворимых в воде, кислотах и щелочах § 5. Анализ неизвестного вещества § 6. Обнаружение свободных элементов § 7. Идентифицирование солей и других индивидуальных соединений § 8. Обнаружение микропримесей § 9. Анализ сплавов § 10. Анализ силикатов и алюмосиликатов § 11. Анализ смеси неорганических веществ § 12. Экспрессный метод анализа смесей катионов и анионов § 13. Идентифицирование нерастворимых веществ ЛИТЕРАТУРА |
Химические свойства карбоновых кислот | CHEMEGE.RU
| Карбоновые кислоты – это вещества, в молекулах которых содержится одна или несколько карбоксильных групп СООН. |
Общая формула предельных одноосновных карбоновых кислот: СnH2nO2
Строение, изомерия и гомологический ряд карбоновых кислот
Химические свойства карбоновых кислот
Способы получения карбоновых кислот
.
Для карбоновых кислот характерны следующие свойства:
|
1. Кислотные свойства
| Кислотные свойства карбоновых кислот возникают из-за смещения электронной плотности к карбонильному атому кислорода и вызванной этим дополнительной (по сравнению со спиртами и фенолами) поляризацией связи О–Н. |
| Карбоновые кислоты – кислоты средней силы. В водном растворе карбоновые кислоты частично диссоциируют на ионы: R–COOH ⇆ R-COO– + H+ |
1.
 1. Взаимодействие с основаниями
1. Взаимодействие с основаниями Карбоновые кислоты реагируют с большинством оснований. При взаимодействии карбоновых кислот с основаниями образуются соли карбоновых кислот и вода.
CH3COOH + NaOH = CH3COONa + H2O
Карбоновые кислоты реагируют с щелочами, амфотерными гидроксидами, водным раствором аммиака и нерастворимыми основаниями.
| Например, уксусная кислота растворяет осадок гидроксида меди (II) |
Видеоопыт взаимодействия уксусной кислоты с гидроксидом натрия можно посмотреть здесь.
| Например, уксусная кислота реагирует с водным раствором аммиака с образованием ацетата аммония |
CH3COOH + NH3 = CH3COONH4
1.2. Взаимодействие с металлами
Карбоновые кислоты реагируют с активными металлами. При взаимодействии карбоновых кислот с металлами образуются соли карбоновых кислот и водород.
При взаимодействии карбоновых кислот с металлами образуются соли карбоновых кислот и водород.
| Например, уксусная кислота взаимодействует с кальцием с образованием ацетата кальция и водорода. |
Видеоопыт взаимодействия уксусной кислоты с магнием и цинком можно посмотреть здесь.
1.3. Взаимодействие с основными оксидами
Карбоновые кислоты реагируют с основными оксидами с образованием солей карбоновых кислот и воды.
| Например, уксусная кислота взаимодействует с оксидом бария с образованием ацетата бария и воды. |
| Например, уксусная кислота реагирует с оксидом меди (II) |
2СН3СООН + CuO = H2О + ( CH3COO)2 Cu
Видеоопыт взаимодействия уксусной кислоты с оксидом меди (II) можно посмотреть здесь.
1.4. Взаимодействие с с солями более слабых и летучих (или нерастворимых) кислот
Карбоновые кислоты реагируют с солями более слабых, нерастворимых и летучих кислот.
| Например, уксусная кислота растворяет карбонат кальция |
| Качественная реакция на карбоновые кислоты: взаимодействие с содой (гидрокарбонатом натрия) или другими гидрокарбонатами. В результате наблюдается выделение углекислого газа |
2. Реакции замещения группы ОН
| Для карбоновых кислот характерны реакции нуклеофильного замещения группы ОН с образованием функциональных производных карбоновых кислот: сложных эфиров, амидов, ангидридов и галогенангидридов. |
2.1. Образование галогенангидридов
Под действием галогенагидридов минеральных кислот-гидроксидов (пента- или трихлорид фосфора) происходит замещение группы ОН на галоген.
| Например, уксусная кислота реагирует с пентахлоридом фосфора с образованием хлорангидрида уксусной кислоты |
2.2. Взаимодействие с аммиаком
При взаимодействии аммиака с карбоновыми кислотами образуются соли аммония:
При нагревании карбоновые соли аммония разлагаются на амид и воду:
2.3. Этерификация (образование сложных эфиров)
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
2.4. Получение ангидридов
С помощью оксида фосфора (V) можно дегидратировать (то есть отщепить воду) карбоновую кислоту – в результате образуется ангидрид карбоновой кислоты.
| Например, при дегидратации уксусной кислоты под действием оксида фосфора образуется ангидрид уксусной кислоты |
3. Замещение атома водорода при атоме углерода, ближайшем к карбоксильной группе
| Карбоксильная группа вызывает дополнительную поляризацию связи С–Н у соседнего с карбоксильной группой атома углерода (α-положение). Поэтому атом водорода в α-положении легче вступает в реакции замещения по углеводородному радикалу. |
В присутствии красного фосфора карбоновые кислоты реагируют с галогенами.
| Например, уксусная кислота реагирует с бромом в присутствии красного фосфора |
4. Свойства муравьиной кислоты
Особенности свойств муравьиной кислоты обусловлены ее строением, она содержит не только карбоксильную, но и альдегидную группу и проявляет все свойства альдегидов. |
4.1. Окисление аммиачным раствором оксида серебра (I) и гидроксидом меди (II)
Как и альдегиды, муравьиная кислота окисляется аммиачным раствором оксида серебра. При этом образуется осадок из металлического серебра.
При окислении муравьиной кислоты гидроксидом меди (II) образуется осадок оксида меди (I):
4.2. Окисление хлором, бромом и азотной кислотой
Муравьиная кислота окисляется хлором до углекислого газа.
4.3. Окисление перманганатом калия
Муравьиная кислота окисляется перманганатом калия до углекислого газа:
5HCOOH + 2KMnO4 + 3H2SO4 → 5CO2 + 2MnSO4 + K2SO4 + 8H2O
Видеоопыт взаимодействия муравьиной кислоты с перманганатом калия можно посмотреть здесь.
4.4. Разложение при нагревании
При нагревании под действием серной кислоты муравьиная кислота разлагается с образованием угарного газа:
Видеоопыт разложения муравьиной кислоты можно посмотреть здесь
5.
 Особенности бензойной кислоты
Особенности бензойной кислоты 5.1. Разложение при нагревании
При нагревании бензойная кислота разлагается на бензол и углекислый газ:
4.2. Реакции замещения в бензольном кольце
| Карбоксильная группа является электроноакцепторной группой, она уменьшает электронную плотность бензольного кольца и является мета-ориентантом. |
6. Особенности щавелевой кислоты 6.1. Разложение при нагревании
При нагревании щавелевая кислота разлагается на угарный газ и углекислый газ:
6.2. Окисление перманганатом калия
Щавелевая кислота окисляется перманганатом калия до углекислого газа:
7. Особенности непредельных кислот (акриловой и олеиновой)
7.1. Реакции присоединения
Присоединение воды и бромоводорода к акриловой кислоте происходит против правила Марковникова, т. к. карбоксильная группа является электроноакцепторной:
к. карбоксильная группа является электроноакцепторной:
К непредельным кислотам можно присоединять галогены и водород. Например, олеиновая кислота присоединяет водород:
6.2. Окисление непредельных карбоновых кислот
Непредельные кислоты обесцвечивают водный раствор перманганатов. При этом окисляется π-связь и у атомов углерода при двойной связи образуются две гидроксогруппы:
3CH2=CH-COOH + 2KMnO4 + 3H2O = 3CH2(OH)-CH(OH)-COOK + KOH + 2MnO2
Понравилось это:
Нравится Загрузка…
Какие продукты образуются при реакции карбоната кальция и уксусной кислоты?
Последняя обновленная Дата: 22 -го февраля 2023 г.
•
Общее представление: 170,1K
•
Просмотры сегодня: 4,56K
Ответ
Проверено
170,1K+ Просмотры
HINT: 202020202 реакция, при которой кислота и основание количественно реагируют друг с другом. При реакции в воде эффект нейтрализации при отсутствии дополнительных ионов водорода или гидроксида дает ответ. рН нейтрализованного ответа зависит от кислотной энергии реагентов
При реакции в воде эффект нейтрализации при отсутствии дополнительных ионов водорода или гидроксида дает ответ. рН нейтрализованного ответа зависит от кислотной энергии реагентов
Полный ответ:
Ацетат кальция, диоксид углерода и вода
Реакция между карбонатом кальция и уксусной кислотой приведет к производству продукта, состоящего из ацетата кальция, диоксида углерода и воды с использованием продуктов. Это своего рода кислотно-щелочной ответ, который иногда также называют реакцией нейтрализации.
\[CaC{O_3} + C{H_3}COOH \to Ca{(C{H_3}COO)_2} + C{O_2} + {H_2}O\]
\[Ca{(C{H_3}COO) _2}\] – ацетат кальция.
В этом ответе карбонат кальция работает как основание, в то время как уксусная кислота является кислой, а беспристрастным продуктом, который получается при этом, является ацетат кальция.
Когда крепкая кислота нейтрализуется с помощью прочного основания, в ответе не остается лишних ионов водорода. Ответ заявлен как беспристрастный, так как он далеко не кислый и не щелочной. pH одного из этих ответов близок к цене 7; точная цена pH зависит от температуры ответа.
pH одного из этих ответов близок к цене 7; точная цена pH зависит от температуры ответа.
Примечание:
Методы химического титрования используются для измерения кислот или оснований, чтобы определить неизвестную концентрацию. Можно использовать либо рН-метр, либо рН-индикатор, который указывает коэффициент нейтрализации с помощью прекрасного альтернативного цвета. Простые стехиометрические расчеты с признанным объемом неизвестного и признанным объемом и молярностью введенного химического вещества предлагают молярность неизвестного.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из нижеперечисленного имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Который из следующего является истинным пероксидом A rmSrmOrm2 класс 12 по химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом A класс 11 по химии JEE_Main
Фосфин получают из следующей руды A кальций класс 12 по химии JEE_Main
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из нижеперечисленного является истинным пероксидом A rmSrmOrm2 класс 12 по химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом A 11 класс по химии JEE_Main
Фосфин получают из следующей руды A Кальций 12 класса по химии JEE_Main
Актуальные сомнения
Судьба карбоната кальция
Вы, наверное, слышали о химическом кальции в молоке. Но кальций присутствует и во многих других вещах. Например, твердая часть ваших костей и зубов состоит из кальция, связанного с химическим веществом под названием «фосфат». Вместе они образуют вещество фосфат кальция. Тротуарный мел сделан из кальция и сульфата, из которого получается сульфат кальция. Одно из наиболее распространенных химических веществ, связанных с кальцием, называется «карбонат», и вместе они образуют карбонат кальция.
Но кальций присутствует и во многих других вещах. Например, твердая часть ваших костей и зубов состоит из кальция, связанного с химическим веществом под названием «фосфат». Вместе они образуют вещество фосфат кальция. Тротуарный мел сделан из кальция и сульфата, из которого получается сульфат кальция. Одно из наиболее распространенных химических веществ, связанных с кальцием, называется «карбонат», и вместе они образуют карбонат кальция.
Карбонат кальция содержится в яичной скорлупе, морских раковинах, камне, называемом мрамором, и в антацидных таблетках, таких как Tums и Rolaids. В этом упражнении вы можете использовать обычную жидкость для обнаружения карбоната кальция!
Что делать:
- Накройте рабочую поверхность газетами или бумажными полотенцами. Положите на рабочую поверхность немного яичной скорлупы и таблетку антацида.
- Тыльной стороной столовой ложки раздавите яичную скорлупу как можно сильнее.
- Вытрите ложку и раздавите ею таблетку антацида.
 Если его очень трудно раздавить, попросите своего взрослого партнера помочь вам раздавить его. (Планшет легче раздавить, если начать с края, а не с середины.)
Если его очень трудно раздавить, попросите своего взрослого партнера помочь вам раздавить его. (Планшет легче раздавить, если начать с края, а не с середины.)
- Поместите измельченную яичную скорлупу и таблетку антацида на лист бумаги.
- Поместите по 1 столовой ложке воды и 1 столовой ложке уксуса в каждую из двух маленьких пластиковых чашек.
- Возьмите примерно одинаковое количество яичной скорлупы в каждую руку и поместите ее в каждую чашку одновременно. Что вы наблюдаете примерно через 2-3 минуты?
- Повторите шаги 5 и 6 для таблетки антацида. Что вы наблюдаете?
Яичная скорлупа и таблетка антацида не должны делать ничего интересного в воде, но они должны вызывать появление пузырьков в уксусе.
Что там происходит?
Уксус представляет собой кислоту, называемую уксусной кислотой. Когда он соединяется с карбонатом кальция в яичной скорлупе и в таблетке антацида, происходит химическая реакция. В ходе реакции атомы уксусной кислоты и карбоната кальция расходятся и перестраиваются по-разному, образуя новые химические вещества. Одним из таких химических веществ является углекислый газ. Вот почему вы видите пузыри!
В ходе реакции атомы уксусной кислоты и карбоната кальция расходятся и перестраиваются по-разному, образуя новые химические вещества. Одним из таких химических веществ является углекислый газ. Вот почему вы видите пузыри!
Если уксус и карбонат кальция вступают в реакцию с образованием разных химических веществ, карбоната кальция, который был в начале реакции, в конце реакции уже нет. Как вы думаете, что произойдет с сырым яйцом, если его оставить в уксусе на пару дней? Давайте попробуем и узнаем!
Что вам понадобится:
- Яйцо
- Уксус
- Прозрачная чашка или банка
- Алюминиевая фольга
- Столовая ложка
Будьте в безопасности
Прежде чем продолжить, обязательно ознакомьтесь с инструкциями по технике безопасности на стр. 1.
Что делать:
- Накройте рабочую поверхность газетами или бумажными полотенцами. Аккуратно поместите яйцо в чашку и добавьте достаточное количество уксуса, чтобы полностью покрыть яйцо.



 Если его очень трудно раздавить, попросите своего взрослого партнера помочь вам раздавить его. (Планшет легче раздавить, если начать с края, а не с середины.)
Если его очень трудно раздавить, попросите своего взрослого партнера помочь вам раздавить его. (Планшет легче раздавить, если начать с края, а не с середины.)