| Химическая формула | h3CO3 | |
|---|---|---|
| Внешний вид | бесцветный раствор | |
| Свойства | ||
| Молярная масса | 62,03 г/моль | |
| Константа диссоциации pKa | реальные: 1) 3,60; | |
| Растворимость в воде | 0,21 г/100 мл | |
| Термодинамические свойства | ||
| Стандартная энтальпия образования | −700 кДж/моль | |
| Стандартная молярная энтропия | +187 Дж/(К·моль) | |
| Стандартная энергия образования Гиббса | −623 кДж/моль | |
| Классификация | ||
| Регистрационный номер CAS | 463-79-6 | |
| Код SMILES | C(=O)(O)O | |
| Класс соединений | Пример соединения |
|---|---|
| Сложные эфиры | поликарбонаты |
| Хлорангидриды | фосген |
| Амиды | мочевина |
| Нитрилы | циановая кислота |
| Ангидриды | пироугольная кислота |
См. также
- Оксид углерода(IV)
- Карбонаты
- Гидрокарбонаты
- Карбоновые кислоты
- Газированная вода
Примечания
- ↑ 1 2 3 В водном растворе бо́льшая часть угольной кислоты обратимо переходит в гидрат диоксида углерода по реакции h3CO3 ⇄ CO2·h3O
- ↑ Угольная кислота теперь обнаружена и в газовой фазе — пора снова переписывать учебники
- ↑ Нейланд О. Я. Органическая химия. — М.: Высшая школа, 1990. — С. 640—652. — 751 с. — ISBN 5-06-001471-1.
Литература
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2.
- Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5.
| Оксиды углерода | ||
|---|---|---|
| Обычные оксиды | CO2 · CO | |
| Экзотические оксиды | C2O2 · C2O3 · C3O2 · C4O2 · C4O6 · C5O2 · C2O · CO3 · CO4 · C12O9 · C12O12 | |
| Полимеры | Оксид графита · C3O2 · CO · CO2 | |
| Производные оксидов углерода | Карбонилы металлов · | |
угольная кислота, угольная кислота и ее соли, угольная кислота формула
Угольная кислота Информацию О

Угольная кислота Комментарии
Угольная кислота
Угольная кислота
Угольная кислота Вы просматриваете субъект
Угольная кислота что, Угольная кислота кто, Угольная кислота описание
There are excerpts from wikipedia on this article and video
www.turkaramamotoru.com
Угольная кислота — Википедия. Что такое Угольная кислота
У́гольная кислота́ — слабая двухосновная кислота с химической формулой H2CO3, образуется в малых количествах при растворении углекислого газа в воде [1], в том числе и углекислого газа из воздуха. В водных растворах неустойчива. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Физические свойства
Угольная кислота существует в водных растворах в равновесии с диоксидом углерода, причём равновесие сильно сдвинуто в сторону разложения кислоты.
Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp²-гибридизацию. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи. Длина связи C—O в карбонат-ионе составляет 130 пм.
Безводная угольная кислота представляет собой бесцветные кристаллы, устойчивые при низких температурах, сублимирующиеся при температуре -30 градусов Цельсия, а при дальнейшем нагревании полностью разлагающиеся. Поведение чистой угольной кислоты в газовой фазе исследовано в 2011 году австрийскими химиками[2].
Химические свойства
Равновесие в водных растворах и кислотность
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода:
- CO2⋅h3O(p)⇄h3CO3(p){\displaystyle {\mathsf {CO_{2}\cdot H_{2}O_{(p)}\rightleftarrows H_{2}CO_{3(p)}}}}, константа равновесия при 25 °C Kp=[h3CO3][CO2⋅h3O]=1,70⋅10−3{\displaystyle K_{p}={\frac {\mathsf {[H_{2}CO_{3}]}}{\mathsf {[CO_{2}\cdot H_{2}O]}}}=1,70\cdot 10^{-3}}
Скорость прямой реакции 0,039 с−1, обратной — 23 с−1.
В свою очередь растворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода:
- CO2⋅h3O(p)⇄CO2↑+ h3O{\displaystyle {\mathsf {CO_{2}\cdot H_{2}O_{(p)}\rightleftarrows CO_{2}\uparrow +\ H_{2}O}}}
Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево (подробнее см. Абсорбция газов).
Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду:
- h3CO3+ h3O⇄HCO3−+ h4O+{\displaystyle {\mathsf {H_{2}CO_{3}+\ H_{2}O\rightleftarrows HCO_{3}^{-}+\ H_{3}O^{+}}}}, константа кислотности при 25 °C Ka1=[HCO3−]⋅[h4O+][h3CO3]=2,5⋅10−4{\displaystyle K_{a1}={\frac {\mathsf {[HCO_{3}^{-}]\cdot [H_{3}O^{+}]}}{\mathsf {[H_{2}CO_{3}]}}}=2,5\cdot 10^{-4}}
Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода:
- Ka′=[HCO3−]⋅[h4O+][CO2⋅h3O]=4,27⋅10−7{\displaystyle K_{a}’={\frac {\mathsf {[HCO_{3}^{-}]\cdot [H_{3}O^{+}]}}{\mathsf {[CO_{2}\cdot H_{2}O]}}}=4,27\cdot 10^{-7}}
Гидрокарбонат-ион подвергается дальнейшему гидролизу по реакции
- HCO3−+ h3O⇄CO32−+ h4O+{\displaystyle {\mathsf {HCO_{3}^{-}+\ H_{2}O\rightleftarrows CO_{3}^{2-}+\ H_{3}O^{+}}}}, константа кислотности при 25 °C Ka2=[CO32−]⋅[h4O+][HCO3−]=4,68⋅10−11{\displaystyle K_{a2}={\frac {\mathsf {[CO_{3}^{2-}]\cdot [H_{3}O^{+}]}}{\mathsf {[HCO_{3}^{-}]}}}=4,68\cdot 10^{-11}}
Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система, которую можно изобразить в общем виде следующим образом:
- CO2↑⇄h3OCO2⋅h3O⇄h3CO3⇄−H+HCO3−⇄−H+CO32−(∗){\displaystyle {\mathsf {CO_{2}\uparrow {\stackrel {H_{2}O}{\rightleftarrows }}CO_{2}\cdot H_{2}O\rightleftarrows H_{2}CO_{3}{\stackrel {-H^{+}}{\rightleftarrows }}HCO_{3}^{-}{\stackrel {-H^{+}}{\rightleftarrows }}CO_{3}^{2-}(*)}}}
Значение водородного показателя pH в такой системе, соответствующего насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., можно рассчитать по формуле:
- pH≈−12lg(Ka′⋅L)=3,9{\displaystyle {\mathsf {pH}}\approx -{\frac {1}{2}}\lg(K_{a}’\cdot L)=3,9}, где L = 0,034 моль/л — растворимость CO2 в воде при указанных условиях.
Разложение
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие смещается в сторону разложения угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
- h3CO3⟶h3O+ CO2↑{\displaystyle {\mathsf {H_{2}CO_{3}\longrightarrow H_{2}O+\ CO_{2}\uparrow }}}
Взаимодействие с основаниями и солями
Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли — карбонаты и гидрокарбонаты соответственно:
- h3CO3+2 NaOH{\displaystyle {\mathsf {H_{2}CO_{3}+2\ NaOH}}}(конц.)⟶Na2CO3+2 h3O{\displaystyle {\mathsf {\longrightarrow Na_{2}CO_{3}+2\ H_{2}O}}}
- h3CO3+ NaOH{\displaystyle {\mathsf {H_{2}CO_{3}+\ NaOH}}}(разб.)⟶NaHCO3+ h3O{\displaystyle {\mathsf {\longrightarrow NaHCO_{3}+\ H_{2}O}}}
- h3CO3+ Ca(OH)2⟶CaCO3↓+2 h3O{\displaystyle {\mathsf {H_{2}CO_{3}+\ Ca(OH)_{2}\longrightarrow CaCO_{3}\downarrow +2\ H_{2}O}}}
- h3CO3+ Nh4⋅h3O⟶Nh5HCO3+ h3O{\displaystyle {\mathsf {H_{2}CO_{3}+\ NH_{3}\cdot H_{2}O\longrightarrow NH_{4}HCO_{3}+\ H_{2}O}}}
При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты:
- h3CO3+ Na2CO3⟶2 NaHCO3{\displaystyle {\mathsf {H_{2}CO_{3}+\ Na_{2}CO_{3}\longrightarrow 2\ NaHCO_{3}}}}
- h3CO3+ CaCO3⟶Ca(HCO3)2{\displaystyle {\mathsf {H_{2}CO_{3}+\ CaCO_{3}\longrightarrow Ca(HCO_{3})_{2}}}}
Получение
Угольная кислота образуется при растворении в воде диоксида углерода:
- CO2+h3O⇄CO2⋅h3O⇄h3CO3{\displaystyle {\mathsf {CO_{2}+H_{2}O\rightleftarrows CO_{2}\cdot H_{2}O\rightleftarrows H_{2}CO_{3}}}}
Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа.
Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода:
- Na2CO3+2 HCl⟶2 NaCl+ h3CO3{\displaystyle {\mathsf {Na_{2}CO_{3}+2\ HCl\longrightarrow 2\ NaCl+\ H_{2}CO_{3}}}}
- h3CO3⟶h3O+ CO2↑{\displaystyle {\mathsf {H_{2}CO_{3}\longrightarrow H_{2}O+\ CO_{2}\uparrow }}}
Применение
Угольная кислота всегда присутствует в водных растворах углекислого газа (см. Газированная вода).
В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора. Также применяется для производства хладагента, солнечных генераторов и морозильников.
Органические производные
Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот[3].
Некоторые представители подобных соединений перечислены в таблице.
Примечания
- ↑ 1 2 3 В водном растворе бо́льшая часть угольной кислоты обратимо переходит в гидрат диоксида углерода по реакции H2CO3 ⇄ CO2·H2O
- ↑ International first: Gas-phase carbonic acid isolated
- ↑ Нейланд О. Я. Органическая химия. — М.: Высшая школа, 1990. — С. 640—652. — 751 с. — ISBN 5-06-001471-1.
Литература
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2.
- Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5.
wiki.sc
Угольная кислота Википедия
У́гольная кислота́ — слабая двухосновная кислота с химической формулой H2CO3, образуется в малых количествах при растворении углекислого газа в воде[1], в том числе и углекислого газа из воздуха. В водных растворах неустойчива. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Физические свойства
Угольная кислота существует в водных растворах в равновесии с диоксидом углерода, причём равновесие сильно сдвинуто в сторону разложения кислоты.
Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp²-гибридизацию. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи. Длина связи C—O в карбонат-ионе составляет 130 пм.
Безводная угольная кислота представляет собой бесцветные кристаллы, устойчивые при низких температурах, сублимирующиеся при температуре –30 °C, а при дальнейшем нагревании полностью разлагающиеся. Поведение чистой угольной кислоты в газовой фазе исследовано в 2011 г. австрийскими химиками[2].
Химические свойства
Равновесие в водных растворах и кислотность
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода:
- CO2⋅h3O(p)⇄h3CO3(p){\displaystyle {\mathsf {CO_{2}\cdot H_{2}O_{(p)}\rightleftarrows H_{2}CO_{3(p)}}}}, константа равновесия при 25 °C Kp=[h3CO3][CO2⋅h3O]=1,70⋅10−3{\displaystyle K_{p}={\frac {\mathsf {[H_{2}CO_{3}]}}{\mathsf {[CO_{2}\cdot H_{2}O]}}}=1,70\cdot 10^{-3}}
Скорость прямой реакции 0,039 с−1, обратной — 23 с−1.
В свою очередь растворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода:
- CO2⋅h3O(p)⇄CO2↑+ h3O{\displaystyle {\mathsf {CO_{2}\cdot H_{2}O_{(p)}\rightleftarrows CO_{2}\uparrow +\ H_{2}O}}}
Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево (подробнее см. Абсорбция газов).
Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду:
- h3CO3+ h3O⇄HCO3−+ h4O+{\displaystyle {\mathsf {H_{2}CO_{3}+\ H_{2}O\rightleftarrows HCO_{3}^{-}+\ H_{3}O^{+}}}}, константа кислотности при 25 °C Ka1=[HCO3−]⋅[h4O+][h3CO3]=2,5⋅10−4{\displaystyle K_{a1}={\frac {\mathsf {[HCO_{3}^{-}]\cdot [H_{3}O^{+}]}}{\mathsf {[H_{2}CO_{3}]}}}=2,5\cdot 10^{-4}}
Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода:
- Ka′=[HCO3−]⋅[h4O+][CO2⋅h3O]=4,27⋅10−7{\displaystyle K_{a}’={\frac {\mathsf {[HCO_{3}^{-}]\cdot [H_{3}O^{+}]}}{\mathsf {[CO_{2}\cdot H_{2}O]}}}=4,27\cdot 10^{-7}}
Гидрокарбонат-ион подвергается дальнейшему гидролизу по реакции
- HCO3−+ h3O⇄CO32−+ h4O+{\displaystyle {\mathsf {HCO_{3}^{-}+\ H_{2}O\rightleftarrows CO_{3}^{2-}+\ H_{3}O^{+}}}}, константа кислотности при 25 °C Ka2=[CO32−]⋅[h4O+][HCO3−]=4,68⋅10−11{\displaystyle K_{a2}={\frac {\mathsf {[CO_{3}^{2-}]\cdot [H_{3}O^{+}]}}{\mathsf {[HCO_{3}^{-}]}}}=4,68\cdot 10^{-11}}
Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система, которую можно изобразить в общем виде следующим образом:
- CO2↑⇄h3OCO2⋅h3O⇄h3CO3⇄−H+HCO3−⇄−H+CO32−(∗){\displaystyle {\mathsf {CO_{2}\uparrow {\stackrel {H_{2}O}{\rightleftarrows }}CO_{2}\cdot H_{2}O\rightleftarrows H_{2}CO_{3}{\stackrel {-H^{+}}{\rightleftarrows }}HCO_{3}^{-}{\stackrel {-H^{+}}{\rightleftarrows }}CO_{3}^{2-}(*)}}}
Значение водородного показателя pH в такой системе, соответствующего насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., можно рассчитать по формуле:
- pH≈−12lg(Ka′⋅L)=3,9{\displaystyle {\mathsf {pH}}\approx -{\frac {1}{2}}\lg(K_{a}’\cdot L)=3,9}, где L = 0,034 моль/л — растворимость CO2 в воде при указанных условиях.
Разложение
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие смещается в сторону разложения угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
- h3CO3⟶h3O+ CO2↑{\displaystyle {\mathsf {H_{2}CO_{3}\longrightarrow H_{2}O+\ CO_{2}\uparrow }}}
Взаимодействие с основаниями и солями
Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли — карбонаты и гидрокарбонаты соответственно:
- h3CO3+2 NaOH{\displaystyle {\mathsf {H_{2}CO_{3}+2\ NaOH}}}(конц.)⟶Na2CO3+2 h3O{\displaystyle {\mathsf {\longrightarrow Na_{2}CO_{3}+2\ H_{2}O}}}
- h3CO3+ NaOH{\displaystyle {\mathsf {H_{2}CO_{3}+\ NaOH}}}(разб.)⟶NaHCO3+ h3O{\displaystyle {\mathsf {\longrightarrow NaHCO_{3}+\ H_{2}O}}}
- h3CO3+ Ca(OH)2⟶CaCO3↓+2 h3O{\displaystyle {\mathsf {H_{2}CO_{3}+\ Ca(OH)_{2}\longrightarrow CaCO_{3}\downarrow +2\ H_{2}O}}}
- h3CO3+ Nh4⋅h3O⟶Nh5HCO3+ h3O{\displaystyle {\mathsf {H_{2}CO_{3}+\ NH_{3}\cdot H_{2}O\longrightarrow NH_{4}HCO_{3}+\ H_{2}O}}}
При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты:
- h3CO3+ Na2CO3⟶2 NaHCO3{\displaystyle {\mathsf {H_{2}CO_{3}+\ Na_{2}CO_{3}\longrightarrow 2\ NaHCO_{3}}}}
- h3CO3+ CaCO3⟶Ca(HCO3)2{\displaystyle {\mathsf {H_{2}CO_{3}+\ CaCO_{3}\longrightarrow Ca(HCO_{3})_{2}}}}
Получение
Угольная кислота образуется при растворении в воде диоксида углерода:
- CO2+h3O⇄CO2⋅h3O⇄h3CO3{\displaystyle {\mathsf {CO_{2}+H_{2}O\rightleftarrows CO_{2}\cdot H_{2}O\rightleftarrows H_{2}CO_{3}}}}
Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа.
Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода:
- Na2CO3+2 HCl⟶2 NaCl+ h3CO3{\displaystyle {\mathsf {Na_{2}CO_{3}+2\ HCl\longrightarrow 2\ NaCl+\ H_{2}CO_{3}}}}
- h3CO3⟶h3O+ CO2↑{\displaystyle {\mathsf {H_{2}CO_{3}\longrightarrow H_{2}O+\ CO_{2}\uparrow }}}
Применение
Угольная кислота всегда присутствует в водных растворах углекислого газа (см. Газированная вода).
В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора. Также применяется для производства хладагента, солнечных генераторов и морозильников.
Органические производные
Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот[3].
Некоторые представители подобных соединений перечислены в таблице.
Примечания
- ↑ 1 2 3 В водном растворе бо́льшая часть угольной кислоты обратимо переходит в гидрат диоксида углерода по реакции H2CO3 ⇄ CO2·H2O
- ↑ International first: Gas-phase carbonic acid isolated
- ↑ Нейланд О. Я. Органическая химия. — М.: Высшая школа, 1990. — С. 640—652. — 751 с. — ISBN 5-06-001471-1.
Литература
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2.
- Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5.
wikiredia.ru
Угольная кислота Химическая формула H 2 CO
 Угольная кислота
Угольная кислота
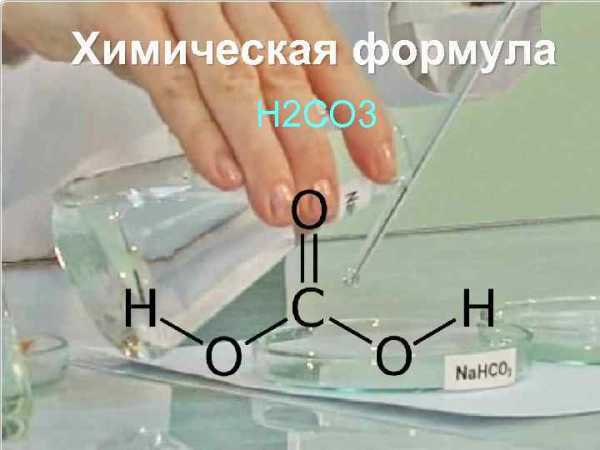 Химическая формула H 2 CO 3
Химическая формула H 2 CO 3
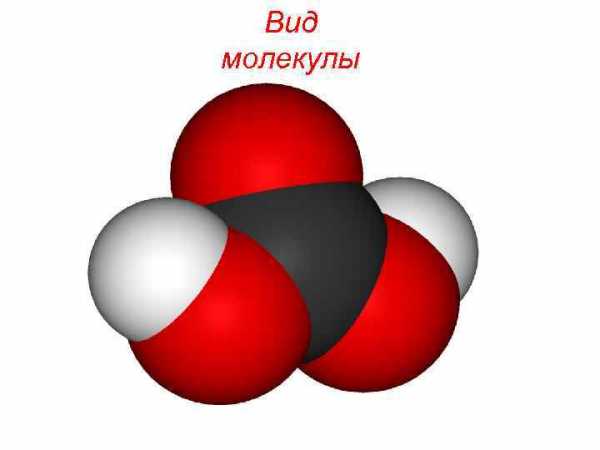 Вид молекулы
Вид молекулы
 Общие сведения Угольная кислота — слабая двухосновная кислота. В чистом виде не выделена. Образуется в малых количествах при растворении углекислого газа в воде, в том числе и углекислого газа из воздуха. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Общие сведения Угольная кислота — слабая двухосновная кислота. В чистом виде не выделена. Образуется в малых количествах при растворении углекислого газа в воде, в том числе и углекислого газа из воздуха. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
 Химические свойства
Химические свойства
 Разложение При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие в системе смещается влево, что приводит к разложению части угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
Разложение При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие в системе смещается влево, что приводит к разложению части угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
 Получение Угольная кислота образуется при растворении в воде диоксида углерода. Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа. Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода
Получение Угольная кислота образуется при растворении в воде диоксида углерода. Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа. Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода
 Применение Угольная кислота всегда присутствует в водных растворах углекислого газа (газированная вода). В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением p. H раствора
Применение Угольная кислота всегда присутствует в водных растворах углекислого газа (газированная вода). В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением p. H раствора
 Спасибо за внимание
Спасибо за внимание
present5.com
Кислота угольная — Справочник химика 21
Угольные ткани применяют для армированных покрытий и конструкционных углепластиков в тех случаях, когда определяющим является стойкость в плавиковой или кремнефтористоводородной кислотах. Угольные ткани получают карбонизацией без доступа воздуха при высоких температурах вискозного или полиакрилонитрильного волокна. Наибольшее применение в противокоррозионной технике нашла ткань угольная УТМ-8 (ТУ 48-20-17—77) с разрывной нагрузкой по основе не менее 500 Н, а по утку 200 Н. [c.88]Как двухосновная кислота, угольная кислота образует два ряда солей — средние и кислые средние соли называются карбона т а м и, кислые — гидрокарбонатами. [c.439]
В каждой группе расположите соединения в порядке уменьшения кислотности а) серная кислота, угольная кислота, фенол, вода б) фенол, бензиловый спирт, бензойная кислота [c.165]
Этиленхлоргидрин (монохлоргидрин или 2-хлорэтанол) впервые был получен Вюрцем в 1859 г. нагреванием в запаянной трубке этиленгликоля, насыщенного хлористым водородом. В поисках промышленных методов получения этиленхлоргидрина длительное время придерживались принципа получения его из этилена и хлорноватистой кислоты, считая последнюю необходимым компонентом реакции. Исходя из этого, предлагалось получение этиленхлоргидрина из этилена и гипохлоритов в присутствии слабых кислот (угольная, борная и др.) или хлора [28]. Дальнейшие исследования привели к получению этиленхлоргидрина из этилена, хлора и воды. Промышленное получение его описано И. И. Юкельсоном [76]. Подробные методы получения этиленхлоргидрина описаны в главе V. [c.383]
Кислые соли образуются при гидролизе солей слабых многоосновных кислот — угольной, ортофосфорной и т. д. [c.206]
Кислота угольная Н СОз Карбонат ион [c.416]
Угольная кислота. Угольная кислота существует только в растворе. При нагревании она разлагается на окснд углерода (IV) и воду. В молекуле угольной кислоты атомы водорода связаны с атомами кислорода [c.211]
К слабым электролитам относятся почти все органические кислоты (муравьиная, уксусная, бензойная), цианистоводородная кислота, борная кислота, угольная кислота, сероводородная кислота, гидроксид аммония, вода, а также некоторые соли (Hg l2, СёСЬ). Для растворов слабых электролитов характерна очень небольшая величина электрической проводимости. [c.111]
Муравьиная кислота Уксусная кислота Пропионовая кислота Масляная кислота Угольная кислота К К-2 [c.199]
Можно ли объяснить смещение равновесия в направлении образования кремниевой кислоты только исходя из различия в силе кислот — угольной и кремниевой, на основе сопоставления их констант диссоциации Какие свойства кремниевой кислоты особенно следует учитывать при этом [c.208]
Аминолиз проводится в органических или водных средах, а также в смешанных растворителях (при контролируемом pH) [62]. Аминолиз ангидрида можно проводить с высокой селективностью с преимущественным образованием а-изомера. С этой целью необходимо вести процесс при низкой температуре в избытке аминокислоты и в присутствии следующих добавок [53] 1) уксусная кислота [53], ортофосфорная кислота, угольная кислота [53—55] 2 смеси слабых кислот и низших алифатических спиртов [53] 3) смеси сильных кислот и спиртов [61—65]. На практике аминолиз ангидрида аспарагиновой кислоты проводят в водных растворах неорганических соединений [66].
Если к раствору карбоната натрия прилить раствор серной кислоты, то происходит образование новой соли и новой кислоты— угольной, распадающейся на воду и углекислый газ. [c.17]
Соли щелочных металлов и слабых кислот (угольной, сероводородной и др.) гидролизуются, водные растворы их имеют щелочную реакцию (рН>7). [c.288]
Хлорангидриды угольной кислоты. Угольной кислоте,, как двухосновной кислоте, соответствуют два хлорангидрида полный хлорангидрид—фосген и неполный хлорангидрид— хлоругольная кислота, называемая также хлормуравьиной кислотой [c.411]
Вы не приняли во внимание основность угольной кислоты. Угольная кислота Н2СО3 является двухосновной кислотой, т.е. ее основность равна двум. [c.238]
Кислотностью называется общее содержание в воде веществ, реагирующих с сильными основаниями. К этим соединениям относятся сильные кислоты (соЛяная, серная и др.), слабые кислоты (угольная, свободный сероводород и др.) и соли слабых оснований (аммиачные, соли железа.и алюминия). Определение кислотности производят только в водах, имеющих кислую реакцию (рН[c.72]
Коррозийный износ. Основной причиной износа двигателя является коррозия в результате химического воздействия влаги и кислот, образующихся при сгорании топлива. На каждый литр сгоревшего в двигателе топлива в камере сгорания образуется приблизительно 1 л воды. При сгорании топлива образуются также двуокись углерода и небольшое количество окислов серы из органических сернистых соединений, входящцх в состав топлива, следы окиси азота в результате окисления азота при высокой температуре сгорания и небольшое количество соединений брома или хлора, выделяемых из тетраэтилсвинца, содержавшегося в топливе. Все эти продукты сгорания путем конденсации или химического взаимодействия с водой образуют кислоты (угольную, серную, сернистую, азотную и азотистую, бромистоводородную, хлористоводородную) и другие продукты, способные вызвать коррозию. В двигателях, работающих при достаточно жестких температурных режимах, эти продукты сгорания в основном выносятся с выхлопными газами, что ограничивает возможность появления коррозии двигателя. Однако нри работе двигателя с пониженной температурой стенок цилиндра влага и продукты окисления могут легко конденсироваться и скопляться, что способствует коррозийному разрушению поверхности стенок и поршневых колец и попаданию при работе продуктов окисления и коррозии внутрь двигателя и в картерное масло. Высокие окисляющие и корродирующие свойства этих продуктов описаны в главе XII. [c.386]
При окислении азотной кислотой горчичные масла дают серную кислоту, угольный ангидрид и амин [c.93]
Сам анилин не образует солей со слабыми кислотами-угольной, циановодородной, сернистой, сероводородной итд [c.234]
Появляется железо в природных водах в результате перехода его из раз-.личных горных пород под действием окислителей (кислорода) или кислот (угольной, органических). [c.180]
В соединениях с кислородом углерод и кремний образуют соединения, в которых их окислительное число +2 и +4 СО, 510, СО и Более устойчивы из них СО2 и 5102. Оксиды СО и 510 относятся к несолеобразующим, СО и 5Юз обладают кислотными свойствами. Им соответствуют кислоты угольная Н2СО3 и кремниевая Н2510з, причем кислотные свойства кремниевой кислоты выражены слабее, чем угольной. [c.204]
www.chem21.info
УГОЛЬНАЯ КИСЛОТА — это… Что такое УГОЛЬНАЯ КИСЛОТА?
- УГОЛЬНАЯ КИСЛОТА
УГОЛЬНАЯ КИСЛОТА (H2CO3) — очень слабая и непрочная двухосновная кислота, образующаяся при растворении в воде диоксида углерода (углекислого газа) CO2. Дает 2 ряда солей: карбонаты и бикарбонаты (гидрокарбонаты). В природе широко распространены нормальные карбонаты, напр. витерит BaCO3, сидерит FeCO3, магнезит MgCO3, кальцит CaCO3 и др. Их применяют в химической промышленности, строительстве и др. отраслях. Среди кислых солей (гидрокарбонатов) наиболее известен гидрокарбонат натрия (питьевая сода) NaHCO3. Большое практическое значение имеют карбонат аммония (NH4)2CO3 и бикарбонат аммония NH4HCO3 — применяют в текстильной и пищевой промышленности, медицине и т. д.
Российская энциклопедия по охране труда. — М.: НЦ ЭНАС. Под ред. В. К. Варова, И. А. Воробьева, А. Ф. Зубкова, Н. Ф. Измерова. 2007.
- УГЛЕВОДОРОДЫ
- УГРОЗА ПОЖАРА
Смотреть что такое «УГОЛЬНАЯ КИСЛОТА» в других словарях:
Угольная кислота — Угольная кислота … Википедия
УГОЛЬНАЯ КИСЛОТА — Н2СО3, очень слабая и непрочная двухосновная кислота. Образуется при растворении диоксида углерода в воде. Дает соли карбонаты и гидрокарбонаты … Большой Энциклопедический словарь
Угольная кислота — УГОЛЬНАЯ КИСЛОТА, h3CO3, образуется при растворении углерода диоксида в воде. Важнейшие производные карбонаты, мочевина (карбамид). … Иллюстрированный энциклопедический словарь
угольная кислота — Н2СО3, очень слабая и непрочная двухосновная кислота. Образуется при растворении диоксида углерода в воде. Даёт соли карбонаты и гидрокарбонаты. * * * УГОЛЬНАЯ КИСЛОТА УГОЛЬНАЯ КИСЛОТА, Н2СО3, очень слабая и непрочная двухосновная кислота.… … Энциклопедический словарь
Угольная кислота — h3CO3, слабая двухосновная кислота, при нормальных условиях существующая только в разбавленных водных растворах. У. к. образуется при растворении в воде двуокиси углерода: 2, при нормальных условиях не превышает 1% от содержания CO2.… … Большая советская энциклопедия
УГОЛЬНАЯ КИСЛОТА — Н2СО3, очень слабая и непрочная двухосновная кислота. Образуется при растворении диоксида углерода в воде. Даёт соли карбонаты и гидрокарбонаты … Естествознание. Энциклопедический словарь
Угольная кислота — (медико санит.) см. Углерод … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
УГОЛЬНАЯ КИСЛОТА — h3CO3, образуется при растворении CO2 в воде. Проявляет св ва слабой к ты. Равновесие CO2+h3O h3CO3 смещено влево, поэтому меньшая часть CO2 находится в р ре в виде h3CO3. Для У. к. константы диссоциации K1=4,27 … Химическая энциклопедия
УГОЛЬНАЯ КИСЛОТА — Н2СО3 очень слабая к та, существующая только в водном р ре. У. к. образуется при растворении углерода диоксида в воде (h3О + CO2<=>h3CO3). Как двухосновная к та У. к. даёт 2 ряда солей: средние карбонаты и кислые гидрокарбонаты … Большой энциклопедический политехнический словарь
УГОЛЬНАЯ КИСЛОТА, h3CO3 — УГОЛЬНАЯ КИСЛОТА, h3CO3, образуется при растворении углерода диоксида в воде. Важнейшие производные карбонаты, мочевина (карбамид) … Современная энциклопедия
Книги
- Органическая химия. Книга 3. Азотсодержащие и карбонильные соединения. Карбоновые кислоты, Галочкин Александр Иванович, Ананьина Ирина Викторовна, В книге изложены номенклатура, изомерия, способы получения, применение, спектральные методы идентификации, физические и химические свойства, механизмы реакций и реакционная способность… Категория: Химические науки Серия: Учебники для вузов. Специальная литература Издатель: Лань, Подробнее Купить за 3577 руб
- Органическая химия. Книга 3. Азотсодержащие и карбонильные соединения. Карбоновые кислоты и их производные. Учебное пособие. Гриф УМО по классическому университетскому образованию, Галочкин Александр Иванович, В книге изложены номенклатура, изомерия, способы получения, применение, спектральные методы идентификации, физические и химические свойства, механизмы реакций и реакционная способность… Категория: Учебники для ВУЗов Серия: Учебники для вузов. Специальная литература Издатель: Лань, Производитель: Лань, Подробнее Купить за 2370 грн (только Украина)
- Органическая химия. Книга 3. Азотсодержащие и карбонильные соединения. Карбоновые кислоты и их производные. Учебное пособие. Гриф УМО по классическому университетскому образованию, Галочкин Александр Иванович, В книге изложены номенклатура, изомерия, способы получения, применение, спектральные методы идентификации, физические и химические свойства, механизмы реакций и реакционная способность… Категория: Учебники: доп. пособия Серия: Учебники для ВУЗов. Специальная литература Издатель: Лань, Подробнее Купить за 2280 руб
labor_protection.academic.ru
Угольная кислота — Википедия
У́гольная кислота́ — слабая двухосновная кислота с химической формулой H2CO3, образуется в малых количествах при растворении углекислого газа в воде[1], в том числе и углекислого газа из воздуха. В водных растворах неустойчива[2]. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Физические свойства[править]
Угольная кислота существует в водных растворах в равновесии с диоксидом углерода, причём равновесие сильно сдвинуто в сторону разложения кислоты.
Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp²-гибридизацию. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи. Длина связи C—O в карбонат-ионе составляет 129 пм.
Безводная угольная кислота представляет собой бесцветные кристаллы, устойчивые при низких температурах, сублимирующиеся при температуре -30 градусов Цельсия, а при дальнейшем нагревании полностью разлагающиеся. Поведение чистой угольной кислоты в газовой фазе исследовано в 2011 году австрийскими химиками[3].
Химические свойства[править]
Равновесие в водных растворах и кислотность[править]
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода:
- , константа равновесия при 25 °C
Скорость прямой реакции 0,039 с−1, обратной — 23 с−1.
В свою очередь растворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода:
Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево (подробнее см. Абсорбция газов).
Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду:
- , константа кислотности при 25 °C
Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода:
Гидрокарбонат-ион подвергается дальнейшему гидролизу по реакции
- , константа кислотности при 25 °C
Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система, которую можно изобразить в общем виде следующим образом:
Значение pH в такой системе, соответствующей насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., можно рассчитать по формуле:
- , где L = 0,034 моль/л — растворимость CO2 в воде при указанных условиях.
Разложение[править]
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие смещается в сторону разложения угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
Взаимодействие с основаниями и солями[править]
Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли — карбонаты и гидрокарбонаты соответственно:
- (конц.)
- (разб.)
При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты:
Угольная кислота образуется при растворении в воде диоксида углерода:
Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа.
Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода:
Угольная кислота всегда присутствует в водных растворах углекислого газа (см. Газированная вода).
В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора.
Органические производные[править]
Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот[4].
Некоторые представители подобных соединений перечислены в таблице.
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2.
- Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5.
www.wikiznanie.ru
