Электролиты и неэлектролиты
HomeНЕОРГАНИЧЕСКАЯ ХИМИЯ Электролиты и неэлектролиты
1. Электролиты — это вещества, растворы или расплавы которых проводят электрический ток.
2. К электролитам относятся щелочи, растворимые соли и кислоты.
3. В водных растворах электролиты распадаются на ионы.
4. Неэлектролиты — вещества, растворы которых не проводят электрический ток.
5. К неэлектролитам относят простые вещества (металлы и неметаллы), оксиды, большинство органических веществ: углеводороды, спирты, альдегиды, углеводы, простые и сложные эфиры и др.
6. Слабые кислоты: H2S, H2CO3, HF, H2SO3, H2SiO3, органические кислоты
Давайте порассуждаем вместе
1. К электролитам относится
1) метанол
2) железо
3) хлорид железа (II)
4) оксид железа (III)
Ответ: электролитом является хлорид железа (II) — растворимая соль
2. К электролитам относится
К электролитам относится
1) фосфор
2) сера
3) глюкоза
4) уксусная кислота
Ответ: электролитом является уксксная кислота — т.к. это растворимая кислота.
3. К слабым электролитам не относится
1) соляная кислота
2) сероводород
3) угольная кислота
4) уксусная кислота
Ответ: соляная кислота не относится к слабым электролитам, это сильный электролит
4. К сильным электролитам не относится
1) бромоводород2) хлороводород
3) сероводород
4) серная кислота
Ответ: сероводород — это слабый электролит, не относится к сильным электролитам
5. Сильным электролитом является
Сильным электролитом является
1) угольная кислота
2) серная кислота
3) сахароза
4) метан
Ответ: серная кислота — сильный электролит
6. Не является электролитом
1) поваренная соль
2) щелочь
3) азотная кислота
4) спирт
Ответ: спирт не является электролитом
7. К электролитам относится
1) C2H5OH
2) C2H4
3) Ca(OH)2
4) CO
Ответ: Ca(OH)2 — малорастворимое основание, значит относится к электролитам
НАШИ УСЛУГИ
Примеры решения задач по электротехнике
Типовые задания
Наши статьи
«Угольная кислота и её соли»
Угольная кислота и её соли
Цель: формирование представлений о строении, свойствах и применении угольной кислоты и её солей, жёсткости воды.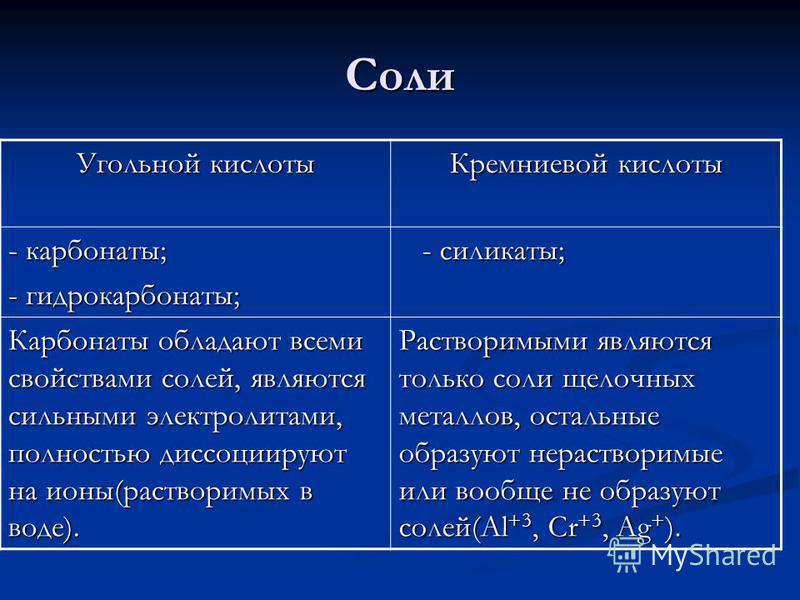
Характеристика H 2 СO 3
- По основности:
двухосновная
2. По содержанию «О»:
кислородсодержащая
3. По растворимости в воде:
растворимая
4. По стабильности:
нестабильная
5. По степени диссоциации:
слабая
(α 1 α 2 )
+1 +4 -2
Н 2 СО 3 Н 2 О + СО 2 ↑
Н 2 СО 3 Н + + НСО 3 ─
НСО 3 ─ 2Н + + СО 3 2─
Na 2 CO 3 CaCO 3 почти все карбонаты, кроме карбонатов ЩМ и NH 4 + ,
нерастворимы в воде
NaHCO 3 Ca(HCO 3 ) 2 все гидрокарбонаты растворимы в воде
Взаимопревращения
карбонатов и гидрокарбонатов
= Ca(HCO 3 ) 2
—
Взаимопревращения карбонатов и гидрокарбонатов
Дождевая вода, насыщенная
СО 2 , стекает
по пластам известняка и частично их растворяет.
Так образуются карстовые пещеры.
сталактиты
Просачиваясь в пещеру сверху, вода понемногу
капает, а растворённые материалы свисают с потолка.
Так образуются сталактиты .
Взаимопревращения карбонатов и гидрокарбонатов
сталагмиты
Стекая со стен пещеры и попадая на дно, раствор гидрокарбоната кальция начинает испаряться, а сама соль разлагается с образованием кристаллов
нерастворимого карбоната кальция.
Понятие о жёсткости воды
временная жёсткость постоянная жёсткость
Способы устранения временной жёсткости
Термическое умягчение (кипячение):
Реагентное умягчение :
2
2
Н 2 О
2
Способы устранения постоянной жёсткости
Реагентное умягчение (добавление соды):
CaCl 2 + Na 2 CO 3 =
CaCO 3 ↓ + NaCl
2
Ca 2+ + CO 3 2- = CaCO 3 ↓
Качественная реакция на карбонат — ион
Na 2 CO 3 + HCl =
2 2
Химичес-
кая формула
Химическое название
Na 2 CO 3
Карбонат натрия
NaHCO 3
Техническое название
Гидрокарбо-нат натрия
Области применения
Сода
K 2 CO
CaCO 3
Карбонат калия
Питьевая сода
кальциниро-
Производство стекла, мыла.
Огнетушители. Кондитерские изделия.
Карбонат кальция
ванная
Поташ
Медицина.
Жидкое мыло
Известняк, мрамор, мел
Строительство
Зубная паста
Стекло, цемент
Карбонаты в природе
Карбонаты в природе
магнезит
малахит
MgCO 3
(CuOH) 2 CO 3
Сидерит FeCO 3
Гидрокарбонаты в природе (лечебно-столовая питьевая вода «Нижне — Ивкинская №2К»)
Химический состав
Содержание в мг/л
гидрокарбонаты
200-300
хлориды
100-200
сульфаты
1200-1500
магний
натрий-калий
50-100
100-200
кальций
400-800
нитраты
Не более 50
нитриты
2
Общая минерализация
2,2-2,8
Верите ли вы, что…
1. Угольная кислота – сильный электролит.
Угольная кислота – сильный электролит.
2.Угольная кислота образует кислые и средние соли.
3.Карбонат кальция – основа мела, известняка, малахита.
4. Гидрокарбонат кальция обусловливает жёсткость воды, которую можно устранить кипячением.
5. Для распознавания карбонат – ионов используют
взаимодействие с ионами водорода сильных кислот.
§ 29, №7(а) с.138
Объясните исторический факт с химической точки зрения
- В романе Г.Г. Хаггарда «Клеопатра» написано:
«… она вынула из уха одну из трёх огромных жемчужин и опустила жемчужину в уксусную кислоту. Наступило молчание. Потрясённые гости, замерев, наблюдали,
как несравненная жемчужина медленно растворяется. Вот от неё не осталось и следа, и тогда Клеопатра подняла кубок, покрутила его, взбалтывая, и выпила всё до последней капли».
Что же произошло с жемчужиной, и почему Клеопатра смогла выпить «крепкий уксус»?
Что такое жемчуг?
Что объединяет жемчуг с мрамором?
Происхождение жемчуга
Жемчуг образуется
в раковине моллюска,
который реагирует на раздражитель, например песчинку, и выделяет
вещество– перламутр,
который обволакивает песчинку и превращает
её в жемчуг.
Перламутр состоит из органического вещества арагонита и карбоната кальция.
Задание .
Запишите уравнение реакции растворения жемчужины в уксусной кислоте.
2+ —
CaCO 3 + CH 3 COOH =
Ca(CH 3 COO) 2 + CO 2 ↑+H 2 O
2
ацетат кальция
Сильные и слабые кислоты
Вещества, которые полностью диссоциируют на ионы при помещении в воду, называются сильные электролиты , потому что высокая концентрация ионов позволяет электрическому току проходить через раствор. Так ведет себя большинство соединений с ионными связями; например, хлорид натрия.
Напротив, другие вещества, такие как простая сахарная глюкоза, вообще не диссоциируют и существуют в растворе в виде молекул, удерживаемых прочными ковалентными связями. Есть также такие вещества, как карбонат натрия (Na 2 CO 3 ), которые содержат как ионные, так и ковалентные связи.
Рисунок 1. Ионная и ковалентная связь в Na 2 CO 3 .
Карбонат натрия является сильным электролитом, и каждая формульная единица полностью диссоциирует с образованием трех ионов при помещении в воду.
Карбонат-анион удерживается нетронутым благодаря своим внутренним ковалентным связям.
Вещества, содержащие полярные связи промежуточного характера, обычно подвергаются лишь частичной диссоциации при помещении в воду; такие вещества классифицируются как слабые электролиты . Пример сернистой кислоты:
В растворе сернистой кислоты преобладают молекулы H 2 SO 3 с относительно небольшим количеством H 3 O + и ионов. Убедитесь, что вы понимаете разницу между этим случаем и предыдущим примером сильного электролита Na 2 CO 3 , который полностью диссоциирует на ионы.
Кислоты и основания целесообразно сортировать на сильные и слабые классы в зависимости от степени их ионизации в водном растворе.
Диссоциацию любой кислоты можно записать в виде равновесной реакции:
, где А обозначает анион конкретной кислоты. Концентрации трех растворенных веществ связаны уравнением равновесия
, где K a — константа кислотной ионизации (или просто кислотная константа). Разные кислоты имеют разные значения K a — чем выше значение, тем выше степень ионизации кислоты в растворе. Следовательно, сильные кислоты имеют большее K a чем слабые кислоты.
В таблице 1 приведены константы кислотной ионизации для некоторых известных кислот при 25°C. Значения для сильных кислот точно не определены; поэтому значения указаны только в порядке величины. Изучите колонку «Ионы» и посмотрите, как каждая кислота образует ион гидроксония и комплементарный анион в растворе.
Используйте уравнение равновесия и данные из предыдущей таблицы для расчета концентрации растворенных веществ в 1 М растворе угольной кислоты. Неизвестные концентрации трех видов могут быть записаны
Неизвестные концентрации трех видов могут быть записаны
, где x представляет собой количество H 2 CO 3 , которое диссоциировало на пару ионов. Подставляя эти алгебраические значения в уравнение равновесия,
Чтобы решить квадратное уравнение в приближении, предположим, что x настолько меньше 1 (углекислота слабая и лишь слегка ионизированная), что знаменатель 1 – x можно приблизить к 1, что дает гораздо более простое уравнение
х 2 = 4,3 × 10 –7
х = 6,56 х 10 –4 = [Н 3 О + ]
Эта концентрация H 3 O + , как предполагается, намного меньше, чем почти 1 молярность H 2 CO 3 , поэтому приближение верно. Концентрация ионов гидроксония 6,56 × 10 –4 соответствует рН 3,18.
Вы помните из обзора органической химии, что карбоновые кислоты имеют один водород, связанный с кислородом в функциональной группе.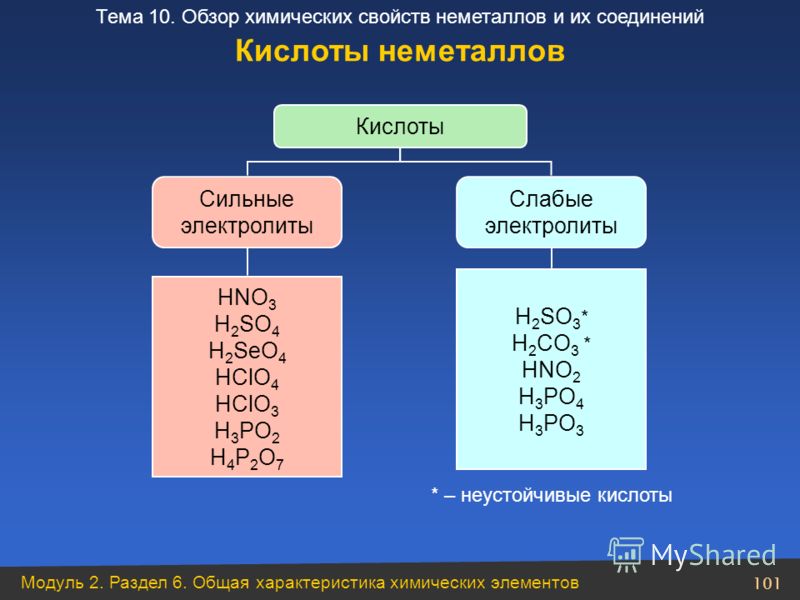 (См. рис. 2.) В очень небольшой степени этот водород может диссоциировать в водном растворе. Следовательно, представители этого класса органических соединений являются слабыми кислотами.
(См. рис. 2.) В очень небольшой степени этот водород может диссоциировать в водном растворе. Следовательно, представители этого класса органических соединений являются слабыми кислотами.
Карбоновые кислоты.
Подведите итог лечения кислотами на данный момент. Сильная кислота практически полностью диссоциирует в водном растворе, поэтому концентрация H 3 O + практически идентична концентрации раствора — для 0,5 М раствора HCl [H 3 O + ] = 0,5 М. Но поскольку слабые кислоты диссоциируют слабо, концентрации ионов в таких кислотах необходимо рассчитывать с использованием соответствующей кислотной константы.
- Если водный раствор уксусной кислоты должен иметь рН 3, сколько молей уксусной кислоты потребуется для приготовления 1 л раствора?
21.12: Сильные и слабые кислоты и константа кислотной ионизации \(\left( K_\text{a} \right)\)
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53941
Травление стекла — это медленный процесс, который позволяет создавать прекрасные произведения искусства. Традиционно стекло обрабатывали разбавленной плавиковой кислотой, которая постепенно растворяла стекло под ним. Части изделия, которые не следует травить, покрывают воском или каким-либо другим нереактивным материалом. В последнее время стали использовать такие соединения, как бифторид аммония. Какое бы химическое вещество не использовалось, художник должен быть очень осторожным, чтобы оно не попало на кожу. 9+}\) и снова становится \(\ce{HCl}\). Как правило, чем сильнее кислота, тем слабее сопряженное с ней основание. Точно так же, чем слабее кислота, тем сильнее ее сопряженное основание.
Традиционно стекло обрабатывали разбавленной плавиковой кислотой, которая постепенно растворяла стекло под ним. Части изделия, которые не следует травить, покрывают воском или каким-либо другим нереактивным материалом. В последнее время стали использовать такие соединения, как бифторид аммония. Какое бы химическое вещество не использовалось, художник должен быть очень осторожным, чтобы оно не попало на кожу. 9+}\) и снова становится \(\ce{HCl}\). Как правило, чем сильнее кислота, тем слабее сопряженное с ней основание. Точно так же, чем слабее кислота, тем сильнее ее сопряженное основание.
| Кислота | Основа сопряжения |
|---|---|
| Сильные кислоты |
Сильные кислоты \(100\%\) ионизированы в растворе. -} \left( aq \right)\nonumber \] 9-} \right]}{\left[ \ce{HA} \right]}\nonumber \]
-} \left( aq \right)\nonumber \] 9-} \right]}{\left[ \ce{HA} \right]}\nonumber \]
Ионизация кислотой представляет собой долю исходной кислоты, которая была ионизирована в растворе. Следовательно, числовое значение \(K_\text{a}\) является отражением силы кислоты. Слабые кислоты с относительно более высокими значениями \(K_\text{a}\) сильнее, чем кислоты с относительно более низкими значениями \(K_\text{a}\). Поскольку сильные кислоты по существу \(100\%\) ионизированы, концентрация кислоты в знаменателе близка к нулю, а значение \(K_\text{a}\) приближается к бесконечности. По этой причине значения \(K_\text{a}\) обычно указываются только для слабых кислот.
В таблице ниже перечислены константы кислотной ионизации для нескольких кислот. Обратите внимание, что полипротонные кислоты имеют различную константу ионизации для каждого шага ионизации, причем каждая последующая константа ионизации меньше предыдущей.
| Название кислоты | Уравнение ионизации | \(К_\текст{а}\) |
|---|
Резюме
- Сильная кислота – это кислота, полностью ионизированная в водном растворе.


