Урок для 9 класса. Угольная кислота и ее соли
урок по химии в 9 классе по теме: « Угольная кислота и ее соли».
«…У школьного мела,
у стен дворца и
у стен пирамиды
один источник,
одна основа….»
Цели урока: изучить свойства солей угольной кислоты карбонатов и гидрокарбонатов.
Задачи урока:
Образовательная:
— повторить средние и кислые соли на примере карбонатов и гидрокарбонатов.
-выявить качественную реакцию на карбонат — ион.
-отработать навыки в решении расчетных и экспериментальных задачах;
— повторить свойства и строение угольной кислоты, гидролиз солей и реакции обмена;
Воспитательная: воспитывать
коммуникативную культуру, уверенность в себе и своих знаниях, навыки контроля и
самоконтроля.
Развивающая: Развитие познавательной активности и самостоятельности учащихся,
формирование исследовательских навыков.
Формы организации деятельности на уроке – парная, индивидуальная, фронтальная.
Методы обучения – частично-поисковый, проблемный, исследовательский.
Ведущий вид деятельности учащихся – лабораторные опыты.
Оборудование: раствор Na2CO3; раствор HCl, h3SO4, Ca(OH)2, Na2CO3 твердая, индикатор – лакмус, штатив, газоотводная трубка; карточки – задания. Лимонад, отрывки текстов из произведений
Ход урока
I. Организационный момент.
Открывая бутылку лимонада, “Пепси-колы” или любого другого газированного напитка мы сталкиваемся с нашей незнакомкой. Это она, угольная кислота. Как часто предательски вырывается она из бутылки, разбрызгиваясь вокруг. Это происходит от того, что молекулы её крайне неустойчивы, а в бутылке она находится под большим давлением, когда мы открываем крышку , она сразу разлагается: ( показываю на практике
)H2CO3=H2O + CO2
II. Проверка знаний.
Проверка знаний.
На карточках приведены отрывки из произведений, вопрос к отрывку и ответы на выбор. Учащиеся по ним должны выбрать ответы на вопросы в виде букв. Ответ может быть не один.
1.Уголь – ценнейшее из полезных ископаемых, – ответил инженер, — и природа как будто решила доказать это, создав алмаз, ибо он, в сущности, не что иное, как кристаллический углерод.
Ж.Верн «Таинственный остров»
1.Какие аллотропные модификации углерода, кроме алмаза вам известны
Б) озон, К) графит, А) карбин , Р) фуллерен
2.Между тем Рукодельница воротится, воду процедит, в кувшины нальет, да
еще какая затейница: коли вода нечиста, так свернет лист бумаги, положит в нее
угольков да песку крупного насыплет, вставит ту бумагу в кувшин да нальет в нее
воды, а вода-то, знай проходит сквозь песок да сквозь уголья и капает в кувшин
чистая, словно хрустальная.
Русская народная сказка «Мороз Иванович»
2.Какие методы очистки использует Рукодельница?
Б) фильтрование, А) дистилляция, О) адсорбция, М) кристаллизация
3.Угарный газ! – вскричал Холмс.- Подождите немного. Сейчас он уйдет.
Заглянув в дверь, мы увидели, что комнату освещает только тусклое синее пламя, мерцающее в маленькой медной жаровне посредине… В раскрытую дверь тянуло страшным ядовитым чадом, от которого мы задыхались и кашляли.
А.К.Дойл «Случай с переводчиком»
3.Найдите химические ошибки в прочитанном отрывке. Почему Холмс и его спутники не могли по описанным признакам определить присутствие угарного газа в помещении.
Н) угарный газ не имеет запаха, Г) угарный газ имеет приятный запах
А) при отравлении угарным газом человек не кашляет
4. В аравийской пустыне растет дерево Caratina silikva (каратина силиква), косточки
плодов которого всегда имеют одинаковый вес в любой год и на любом дереве.
Поэтому ювелиры древности и применяли для своих весов такие гирьки, называя их каратами.
В наши дни существует каратная проба золота и драгоценных камней
В аравийской пустыне растет дерево Caratina silikva (каратина силиква), косточки
плодов которого всегда имеют одинаковый вес в любой год и на любом дереве.
Поэтому ювелиры древности и применяли для своих весов такие гирьки, называя их каратами.
В наши дни существует каратная проба золота и драгоценных камней
4. Чему равна масса одного карата?
И) 100 г, З) 0,5 г, Т) 0,2 г, Р) 0,1 г
5. — Вы слышали об эффекте «собачьей пещеры» в Италии? Есть там такая пещера — яма. Человек войдет и ходит, а собака или кролик погибают через несколько минут.
— Почему?
— Из вулканической трещины выделяется углекислый газ…
В.Короткевич «Черный замок Ольшанский»
5. Почему в «собачьей пещере» человек остается живым, а собаки и другие мелкие животные гибнут?
Ы) СО2 тяжелее воздуха и скапливается внизу
А) СО2 безопасен для человека, но вреден для животных
Ж) человек входит в пещеру в противогазе
Ответ: — карбонаты.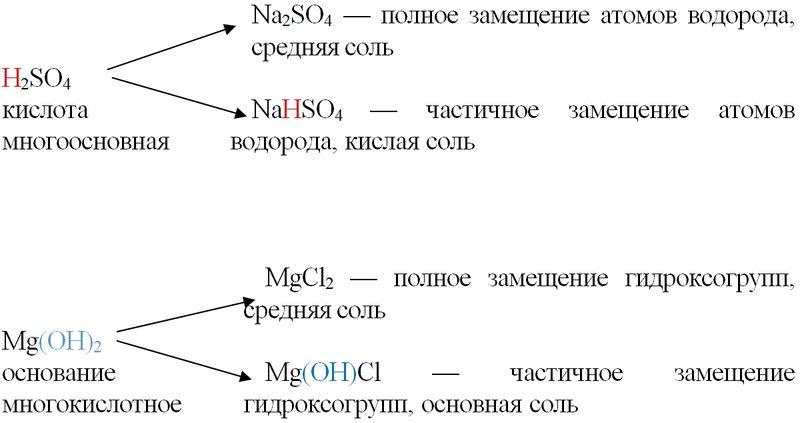 Что это? Это
соли угольной кислоты.
Что это? Это
соли угольной кислоты.
Тема урока: Угольная кислота и ее соли».
III. Изучение новой темы.
1.Угольная кислота
Угольная кислота- это тот редкий случай вещества, формулу которого принято считать условной, т. е. такой молекулы не существует, однако возможно рассматривать не только свойства её соединений, но и собственные свойства этой кислоты.
1.Химическая формула — У́гольная кислота́ — слабая двухосновная кислота с химической формулой H2CO3
2.Структурная формула – все связи ковалентные полярные:
Кислота слабая, существует только в водном растворе, очень непрочная, разлагается на углекислый газ и воду:
CO2 + h3O ↔ h3CO3
Вопрос:
что вы будете наблюдать при длительном пропускании углекислого газа через дистиллированную воду, подкрашенную фиолетовым лакмусом?
1. образование белого осадка;
образование белого осадка;
2. появление синей окраски раствора;
3. видимых изменений не происходит;
4. появление красноватой окраски раствора
Учащиеся предлагают варианты ответов и выбирают правильный
3. Опыт «Получение угольной кислоты»
Получение угольной кислоты
Получаем CO2, пропускаем через воду, подкрашенную лакмусом
Углекислый газ CO2 растворяется в воде. При растворении происходит его частичное взаимодействие с водой с образованием угольной кислоты.
CO2 + h3O ↔ h3CO3
Углекислый газ получаем действием соляной кислоты на мрамор — карбонат кальция.
CaCO3 + 2HCl = CaCl2 + CO2↑ + h3O
Направим углекислый газ в стакан с раствором лакмуса. Фиолетовый лакмус становится красным – в стакане с водой появилась кислота.
Оборудование: пробирка, воронка, газоотводная трубка, штатив, пинцет, химический стакан.
Техника безопасности.
Следует соблюдать правила работы с растворами кислот. Не допускать попадания кислот на кожу и слизистые оболочки.
4.Химические свойства:
Для угольной кислоты характерны все свойства кислот.
1) Диссоциация – двухосновная кислота, диссоциирует слабо в две ступени, индикатор — лакмус краснеет в водном растворе:
h3CO3 ↔ H+ + HCO3-(гидрокарбонат-ион)
HCO3- ↔ H+ + CO32- (карбонат-ион)
Общие химические свойства Н2 СО3
1) кислота + акт.Me =
2) кислота + осн.оксид. =
3) кислота + основан = ср.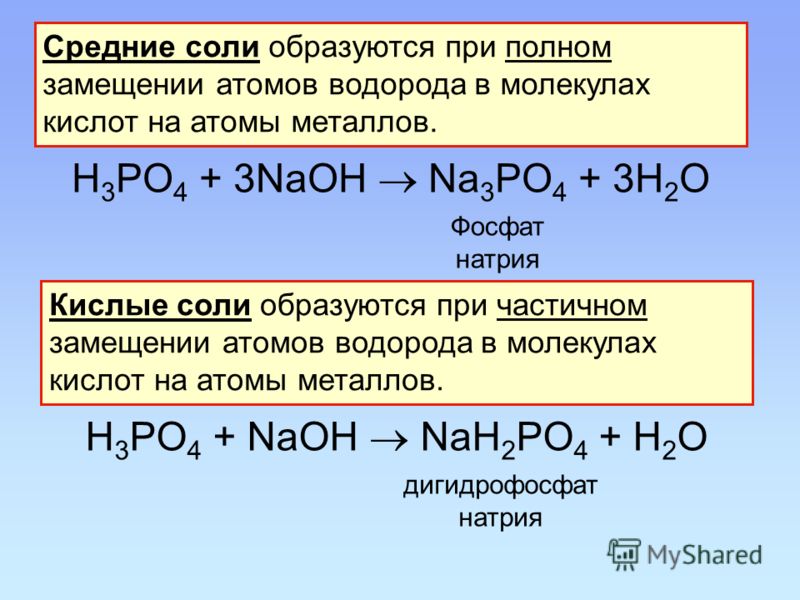 соли
соли
4) кислота + основан. = кислые соли
Особенные свойства:
1)непрочная кислота Н2СО 3 Н2О + СО2
5. Получение: СО2 + Н2О Н2 СО3
6. Применение: в основном в напитках
7. В природе встречаются в виде солей
CaCO3 (Мел, мрамор, известняк)
NaHCO3 – питьевая сода
K2CO3(поташ, в золе растений)
Na2CO3 – сода, кальцинированная сода
Na2CO3 x 10h3O – кристаллическая сода
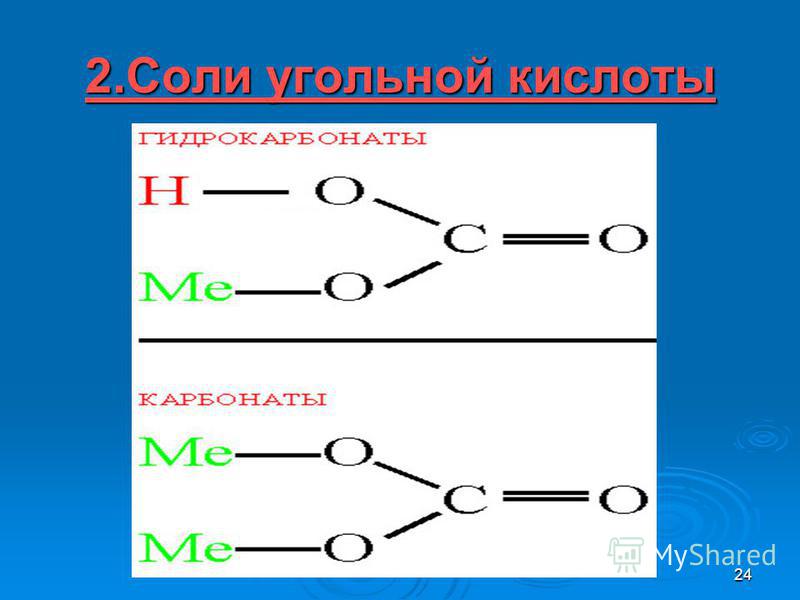
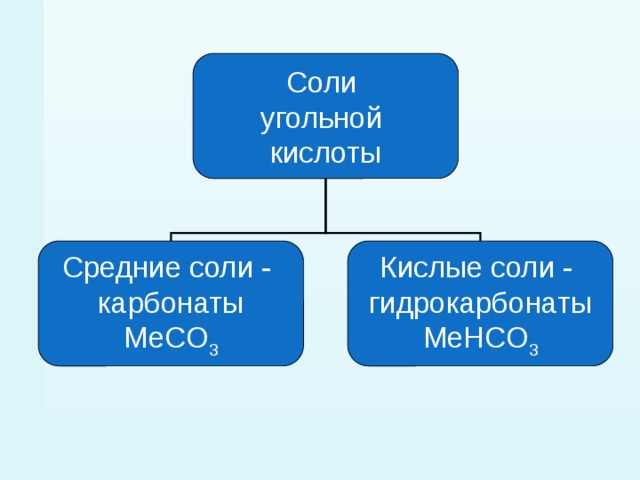
2.Соли угольной кислоты
Соли угольной кислоты – карбонаты и гидрокарбонаты
Угольная кислота образует два ряда солей:
Средние соли — карбонаты Na2СO3, (Nh5)2CO3
Кислые соли — бикарбонаты, гидрокарбонаты NaHCO3 , Ca(HCO3)2
2. 1.Физические
свойства:
1.Физические
свойства:
Все карбонаты – твёрдые кристаллические вещества. Большинство из них в воде не растворяются. Гидрокарбонаты растворяются в воде.
2.2.Химические свойства солей угольной кислоты:
1) при нагревании
разлагаются. СаСО
(кроме солей. щел.Ме)
2) гидрокарбонаты t карбонаты
а) 2 NaHCO3 Na2CO3 + H2O + CO2
б) при изб. CO2 обратная реакция
3) ионообменная реакция с другими солями:
Na2CO3 + CaCI2 CaCO3 + 2 Na CI
в полном ионном виде
в сокращенном ионном виде
2. 3.Особенные свойства: реакция с сильными кислотами — характерная реакция
3.Особенные свойства: реакция с сильными кислотами — характерная реакция
на карбонаты
Na2CO3 + 2 HCI 2NaCI + H2O + CO2
«вскипание»
в полном ионном виде
в сокращенном ионном виде
2.4.Лабораторный опыт:
Карбонаты + HCI «вскипание»
1) Подвергаются ли гидролизу карбонаты?
2) Какая реакция среды?
Na2CO3 — (сильное основание + слабая кислота)
Na2CO3 2 Na+ + CO32-
CO2-3 + H2O HCO—3 + OH—
щелочная реакция
Демонстрационный
опыт: раствор Na2CO3 + фенолфталеин малиновое окрашивание.
Вывод: Карбонаты гидролизу подвергаются, реакция среды щелочная.
Получение:4. Есть необходимость получать карбонаты в промышленности?
(В основном в природе имеются).
5. Применение: в строительстве, хлебопечении, в медицине,
производство соды, стекла, моющих средств.
IV.Рефлексия
В романе Г.Р.Хагарда «Клеопатра» описывается процесс растворения жемчуга в кислоте.
… Она вынула из уха одну из тех огромных жемчужин… и опустила жемчужину в уксус. Наступило молчание, потрясенные гости, замерев наблюдали – как несравненная жемчужина медленно растворяется в уксусе. Вот от нее не осталось и следа, и тогда Клеопатра подняла кубок, покрутила его, взбалтывая уксус, и выпила до последней капли».
Написать уравнение реакции взаимодействия уксусной кислоты с жемчугом в сокращенном ионном виде
По формуле, как ни смотри,
они
не разнятся никак.
Все те же кальций це о три,
Как мрамор, так и известняк.
Н.М.Федоровский.
1. На Земле живут три брата Из семейства карбонатов. Старший брат– красавец –Мрамор, Славен именем Карары, Превосходный зодчий. Он Строил Рим и Парфенон. Всем известен Известняк, Потому и назван так. Знаменит своим трудом, Возводя за домом дом.
| 2. И способен и умел Младший мягкий братец Мел. Как рисует, посмотри, Этот СаСО3. Любят братья порезвиться, В жаркой печке прокалиться. CaO да CO2 образуются тогда. Это углекислый газ, Каждый с ним знаком из вас, Выдыхаем мы его.
|
3. Ну а это CaO – Жарко обожженная ИЗВЕСТЬ НЕГАШЕННАЯ. Добавляем к ней воды, тщательно мешая, Чтобы не было беды, руки защищаем. Круто замешанная ИЗВЕСТЬ, но ГАШЕННАЯ! Известковым молоком величается.
| 4. Светлый дом повеселел, Превратив известку в мел. Фокус- покус для народа: Стоит лишь подуть сквозь воду, Как она легко-легко превратится в молоко! А теперь довольно ловко получаю газировку: Молоко плюс уксус, Ай! Льется пена через край! Все в заботах, все в работе От зари и до зари – Эти братья Карбонаты, Эти CaCO3!
|
V. Домашнее задание:
§26, заполнить таблицу
Домашнее задание:
§26, заполнить таблицу
Химическая формула вещества | Тривиальное (историческое) название | Современное название | Применение вещества |
ZnCO3 | |||
Na2CO3 | |||
NaHCO3 | |||
Na2CO3·10H2O | |||
MgCO3 | |||
Смесь MgCO3 и CaCO3 (1:1) | |||
(CuOH)2CO3 | |||
K2CO3 | |||
CaCO3 |
Ответ к таблице
Химическая формула вещества | Тривиальное (историческое) название | Современное название | Применение вещества |
ZnCO3 | Галмей | Карбонат цинка | Производство
красок. |
Na2CO3 | Кальцинированная сода | Карбонат натрия | Умягчение воды, производство стекла. |
NaHCO3 | Питьевая сода | Гидрокарбонат натрия | В пищевой про-мышленности, в медицине. |
Na2CO3·10H2O | Кристаллическая сода | Десятиводный гидрат карбоната натрия | Для
умягчения воды при стирке белья. |
MgCO3 | Жжённая магнезия | Карбонат магния | В медицине. |
Смесь MgCO3 и CaCO3 (1:1) | Доломит | Смесь карбонатов магния и кальция | В строительстве. |
(CuOH)2CO3 | Малахит | Основной карбонат меди (II) | Поделки,
ювелирные украшения. |
K2CO3 | Поташ | Карбонат калия | Пр-во стекла, керамики, цемента, удобрение. |
CaCO3 | Мел, мрамор, известняк | Карбонат кальция | Пр-во строительных материалов. |
Открытый урок по химии в 9 классе по теме: « Угольная кислота и ее соли». | План-конспект урока по химии на тему:
Открытый урок по химии в 9 классе по теме:
« Угольная кислота и ее соли».
Учитель химии
Габуева Неза Тотразовна
Цели урока: изучить свойства солей угольной кислоты карбонатов и гидрокарбонатов.
Задачи урока:
Образовательная:
— повторить средние и кислые соли на примере карбонатов и гидрокарбонатов.
-выявить качественную реакцию на карбонат — ион.
-отработать навыки в решении расчетных и экспериментальных задачах;
— повторить свойства и строение угольной кислоты, гидролиз солей и реакции обмена;
Воспитательная: воспитывать коммуникативную культуру, уверенность в себе и своих знаниях, навыки контроля и самоконтроля.
Развивающая: Развитие познавательной активности и самостоятельности учащихся,
формирование исследовательских навыков.
Формы организации деятельности на уроке – парная, индивидуальная, фронтальная.
Методы обучения – частично-поисковый, проблемный, исследовательский.
Ведущий вид деятельности учащихся – лабораторные опыты.
Оборудование: раствор Na2CO3; раствор HCl, h3SO4, Ca(OH)2, Na2CO3 твердая, индикатор – фенолфталеин, штатив, газоотводная трубка; карточки – задания
Ход урока
I. Оргмомент.
Оргмомент.
II. Проверка домашнего задания.
III Основная часть . Изучение новой темы.
Химическая формула — h3CO3
Структурная формула – все связи ковалентные полярные:
Кислота слабая, существует только в водном растворе, очень непрочная, разлагается на углекислый газ и воду:
CO2 + h3O ↔ h3CO3
Опыт «Получение угольной кислоты»
Получение угольной кислоты
Углекислый газ CO2 растворяется в воде. При растворении происходит его частичное взаимодействие с водой с образованием угольной кислоты.
CO2 + h3O ↔ h3CO3
Чтобы заметить появление кислоты, добавим в стакан с водой лакмус. В нейтральной среде лакмус остается фиолетовым.
Углекислый газ получаем действием соляной кислоты на мрамор — карбонат кальция.
CaCO3 + 2HCl = CaCl2 + CO2↑ + h3O
Направим углекислый газ в стакан с раствором лакмуса. Фиолетовый лакмус становится красным – в стакане с водой появилась кислота.
Оборудование: пробирка, воронка, газоотводная трубка, штатив, пинцет, химический стакан.
Техника безопасности.
Следует соблюдать правила работы с растворами кислот. Не допускать попадания кислот на кожу и слизистые оболочки.
Химические свойства:
Для угольной кислоты характерны все свойства кислот.
1) Диссоциация – двухосновная кислота, диссоциирует слабо в две ступени, индикатор — лакмус краснеет в водном растворе:
h3CO3 ↔ H+ + HCO3-(гидрокарбонат-ион)
HCO3- ↔ H+ + CO32- (карбонат-ион)
2) с активными металлами
h3CO3 + Ca = CaCO3 + h3↑
3) с основными оксидами
h3CO3 + CaO = CaCO3 + h3O
4) с основаниями
h3CO3(изб) + NaOH = NaHCO3 + h3O
h3CO3 + 2NaOH = Na2CO3 + 2h3O
5) Очень непрочная кислота – разлагается
Соли угольной кислоты – карбонаты и гидрокарбонаты
Угольная кислота образует два ряда солей:
· Средние соли — карбонаты Na2СO3, (Nh5)2CO3
· Кислые соли — бикарбонаты, гидрокарбонаты NaHCO3 , Ca(HCO3)2
В природе встречаются:
CaCO3
Мел
мрамор
известняк
NaHCO3 – питьевая сода
K2CO3(поташ, в золе растений)
Na2CO3 – сода, кальцинированная сода
Na2CO3 x 10h3O – кристаллическая сода
Физические свойства:
Все карбонаты – твёрдые кристаллические вещества.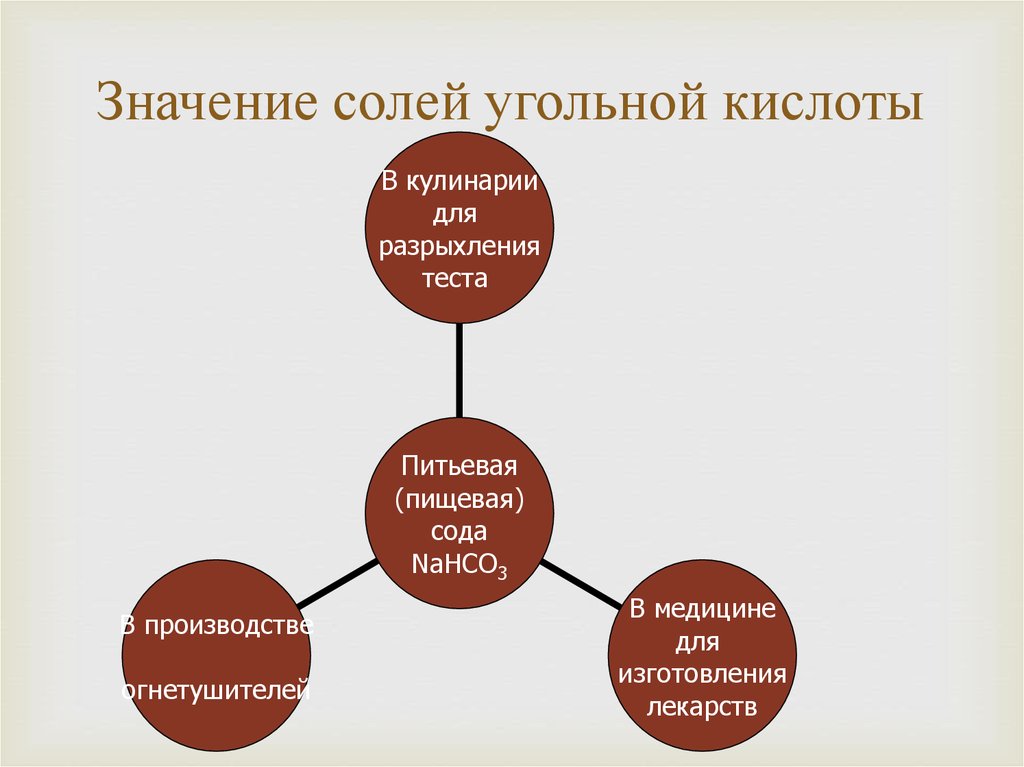 Большинство из них в воде не растворяются. Гидрокарбонаты растворяются в воде.
Большинство из них в воде не растворяются. Гидрокарбонаты растворяются в воде.
Химические свойства солей угольной кислоты:
Общие свойства солей:
1) Вступают в реакции обмена с другими растворимыми солями
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
2) Разложение гидрокарбонатов при нагревании
NaHCO3 t˚C → Na2CO3 + h3O + CO2↑
3) Разложение нерастворимых карбонатов при нагревании
CaCO3 t˚C → CaO+ CO2↑
4) Карбонаты и гидрокарбонаты могут превращаться друг в друга:
Опыт Взаимопревращение карбонатов и гидрокарбонатов
Пропускаем через раствор гидроксида кальция углекислый газ, получается нерастворимый карбонат кальция.
Ca(OH)2 + CO2 = CaCO3 ↓ + h3O
Карбонаты – соли угольной кислоты, в которых замещены оба иона водорода. Когда замещен только один ион водорода – получаются гидрокарбонаты. Большинство карбонатов – нерастворимые соединения, все гидрокарбонаты – растворимые. Нерастворимый карбонат превращается в растворимый гидрокарбонат при пропускании через раствор углекислого газа.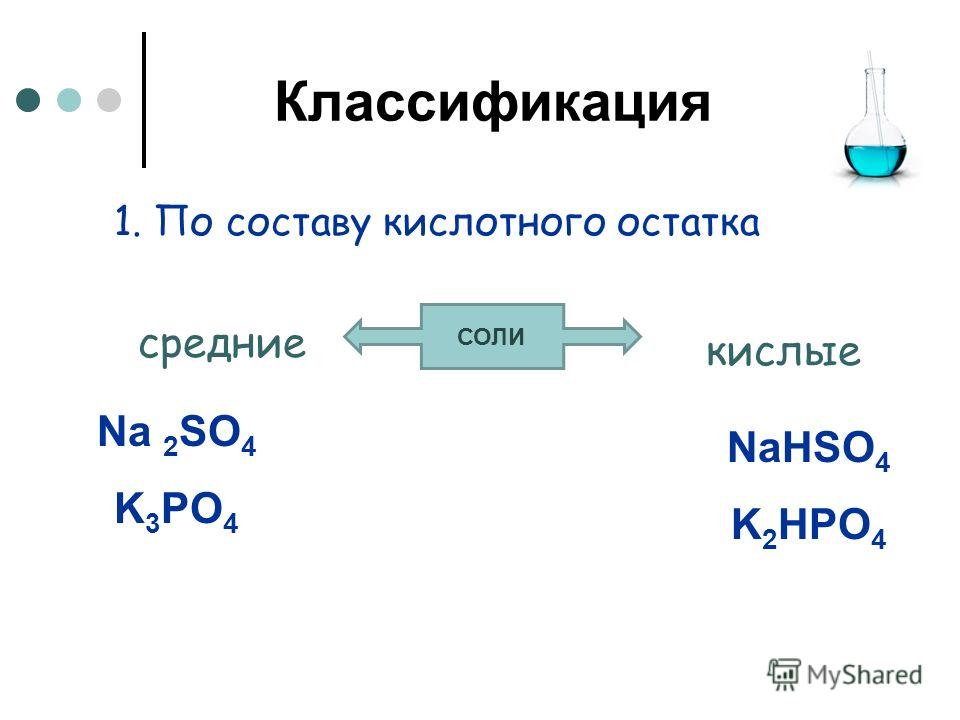
CaCO3 + CO2 + h3O ↔ Ca(HCO3)2
При нагревании раствора гидрокарбоната выделяется углекислый газ, и вновь образуется нерастворимый карбонат кальция.
Ca(HCO3)2 = CaCO3↓ + CO2 + h3O
Оборудование: пробирка, воронка, газоотводная трубка, штатив, пинцет, спиртовка, держатель, химический стакан.
Техника безопасности. Следует соблюдать правила работы с растворами кислот. Не допускать попадания кислот на кожу и слизистые оболочки.
гидрокарбонаты в карбонаты
Me(HCO3)n + Me(OH)n → MeCO3+h3O
Me(HCO3)n t˚C → MeCO3↓+h3O+CO2↑
карбонаты в гидрокарбонаты
MeCO3+h3O+CO2= Me(HCO3)n
Специфические свойства:
1) Качественная реакция на CO32- карбонат – ион «вскипание» при действии сильной кислоты:
Na2CO3 + 2HCl = 2NaCl + h3O + CO2↑
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№ 1. Закончите уравнения осуществимых химических реакций:
CO 2+ KOH =
CO + Al =
h3CO3+ K2SO4 =
CO2( изб ) + NaOH =
С O2+ Na2O =
CaCO3+ CO2 + h3O =
CO2+ Ca(OH)2 =
CO + CaO =
CO2+ h3SO4 =
Ca(HCO3)2+ Ca(OH)2=
h3CO3+ NaCl =
C + ZnO =
№2.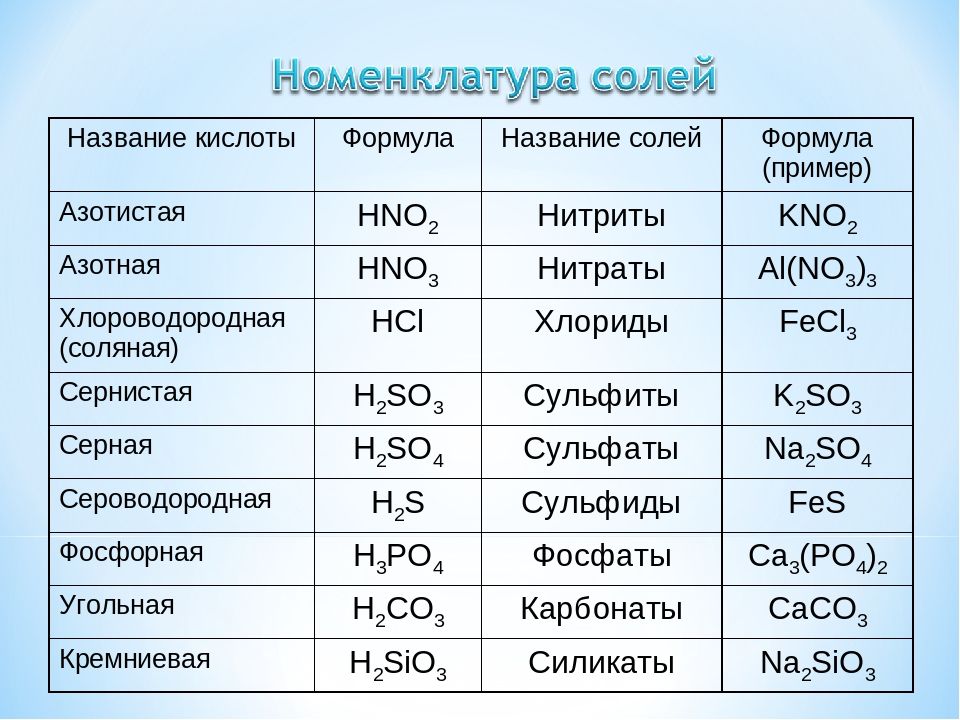
Осуществите превращения по схеме:
1) Al 4 C 3→ CH 4→ CO 2→ CaCO 3→ Ca ( HCO 3)2→ CaCO 3
2) Ca → CaC 2→ Ca ( OH )2→ CaCO 3→ CO 2→ C
3) CO2 → h3CO3 → Na2CO3 → CO2
4) CaCO3 → CO2 → NaHCO3 → Na2CO3
№3. Решите задачи
1.Какой объем СО2 выделится (при н.у.) при обжиге 230 кг известняка, содержащего 10 % примесей.
2.Какой объём углекислого газа выделится при обжиге карбоната кальция массой 200 г
3. Сколько угольной кислоты можно получить при взаимодействии 2 л углекислого газа (н.у.) с водой, если выход кислоты составил 90% по сравнению с теоретическим
Рефлексия
- Я узнал (а) много нового…
- Мне это пригодится в моей жизни …
- На уроке было над, чем подумать …
- На все возникшие вопросы я получил (а) ответы ….
- На уроке я работал (а) добросовестно…
Домашнее задание
П. 27-29, упр. 14-20, задача 3 на стр. 91.
Насколько кислой является угольная кислота?
1. Шмидт Р.Ф., Thews G, ред. Физиология человека. Спрингер-Верлаг; Berlin: 1980. [Google Scholar]
Шмидт Р.Ф., Thews G, ред. Физиология человека. Спрингер-Верлаг; Berlin: 1980. [Google Scholar]
2. Во А., Грант А. Росс и Уилсон Анатомия и физиология здоровья и болезней. 10. Черчилль Ливингстон, Elsevier; Лондон: 2007. с. 22. [Google Scholar]
3. Честер Р., Джикелс Т. Морская геохимия. 3. Уайли-Блэквелл; Чичестер, Великобритания: 2012. [Google Scholar]
4. Миллс Г.А., Юри Х.К. Кинетика изотопного обмена между двуокисью углерода, бикарбонат-ионом, карбонат-ионом и водой. J Am Chem Soc. 1940;62:1019–1026. [Google Scholar]
5. Roughton FJW. Кинетика и быстрая термохимия угольной кислоты. J Am Chem Soc. 1941; 63: 2930–2934. [Google Scholar]
6. Ho C, Sturtevant JM. Кинетика гидратации углекислого газа при 25 град. Дж. Биол. Хим. 1963; 238 (10): 3499–3501. [PubMed] [Google Scholar]
7. Loerting T, Bernard J. Aqueous Carbonic Acid (h3CO3) Chem Phys Chem. 2010;11:2305–2309. [PubMed] [Google Scholar]
8. Landon J, Fawcett JK, Wynn V. Концентрация пирувата в крови, измеренная специальным методом у контрольных субъектов. Джей Клин Патол. 1962;15:579–584. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Джей Клин Патол. 1962;15:579–584. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Hildebrand A, Lormes W, Emmert J, Liu Y, Lehmann M, Steinacker JM. Концентрация лактата в плазме и эритроцитах во время дополнительных упражнений. Int J Sports Med. 2000; 21: 463–468. [PubMed] [Google Scholar]
10. Dewick PM. Основы органической химии: для студентов факультетов фармации, медицинской химии и биологической химии. Уайли; Чичестер, Великобритания: 2006. [Google Scholar]
11. Tossell JA. Борная кислота, «угольная» кислота и N-содержащие оксикислоты в водном растворе: Ab Initio исследования структуры, pKa, сдвигов ЯМР и изотопных фракций. Геохим Космохим Акта. 2005;69: 5647–5658. [Google Scholar]
12. Штумм В., Морган Дж.Дж. Водная химия. 3. Уайли; New York: 1996. [Google Scholar]
13. Adamczyk K, Premont-Schwarz M, Pines D, Pines E, Nibbering ETJ. Наблюдение в реальном времени за образованием угольной кислоты в водном растворе. Наука. 2009;326(5960):1690–1694. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
14. Гиббонс Б.Х., Эдсолл Дж.Т. Скорость гидратации углекислого газа и дегидратации угольной кислоты при 25 град. Дж. Биол. Хим. 1963; 238 (10): 3502–3507. [PubMed] [Академия Google]
15. Росси-Бернарди Л., Бергер Р.Л. Экспресс-измерение pH стеклянным электродом — кинетика дегидратации угольной кислоты при 25 и 37 градусах. Дж. Биол. Хим. 1968;243(6):1297–1302. [PubMed] [Google Scholar]
16. Welch MJ, Lifton JF, Seck JA. Индикаторные исследования с радиоактивным кислородом-15. Обмен между углекислым газом и водой. J Phys Chem. 1969;73(10):3351–3356. [Google Scholar]
17. Магид Э., Турбек Б.О. Скорости спонтанной гидратации СО2 и реципрокной реакции в нейтральных водных растворах от 0 до 38 градусов. Biochim Biophys Acta, Gen Subj. 1968;165(3):515–524. [PubMed] [Google Scholar]
18. Pocker Y, Bjorkquist DW. Исследования гидратации углекислого газа и дегидратации бикарбоната в остановленном потоке в H3O и D2O — кислотно-основный и металлоионный катализ.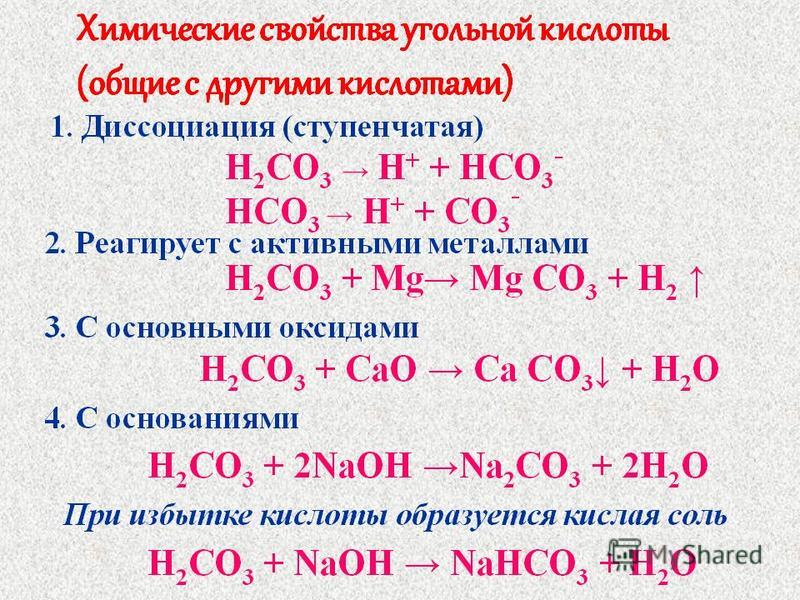 J Am Chem Soc. 1977; 99 (20): 6537–6543. [Google Scholar]
J Am Chem Soc. 1977; 99 (20): 6537–6543. [Google Scholar]
19. Marlier JF, O’Leary MH. Влияние кинетических изотопов углерода на гидратацию углекислого газа и дегидратацию иона бикарбоната. J Am Chem Soc. 1984;106(18):5054–5057. [Google Scholar]
20. Соли А.Л., Бирн Р.Х. Кинетика гидратации и дегидратации системы CO2 и равновесное соотношение CO2/h3CO3 в водном растворе NaCl. Мар хим. 2002; 78: 65–73. [Академия Google]
21. Wang X, Conway W, Burns R, McCann N, Maeder M. Комплексное исследование реакций гидратации и дегидратации углекислого газа в водном растворе. J Phys Chem A. 2010;114:1734–1740. [PubMed] [Google Scholar]
22. Stirling A, Papai I. H 2 CO 3 Формы через HCO 3 − в воде. J Phys Chem B. 2010;114:16854–16859. [PubMed] [Google Scholar]
23. Мичелетти С., Лайо А., Парринелло М. Реконструкция плотности состояний с помощью метадинамики, зависящей от истории. Phys Rev Lett. 2004;92:170601. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
24. Галиб М., Ханна Г. Механическое понимание диссоциации и разложения угольной кислоты в воде через гидроксидный путь: исследование метадинамики Ab Initio. J Phys Chem B. 2011;115:15024–15035. [PubMed] [Google Scholar]
25. Forster T. Elektrolytische Dissoziation Angeregter Molecüle. З Электрохим. 1950;54:42. [Google Scholar]
26. Rini M, Magnes BZ, Pines E, Nibbering ETJ. Наблюдение в режиме реального времени за бимодальным переносом протона в кислотно-основных парах в воде. Наука. 2003;301(5631):349–352. [PubMed] [Google Scholar]
27. Rini M, Pines D, Magnes BZ, Pines E, Nibbering ETJ. Бимодальный перенос протона в кислотно-основных реакциях в воде. J Chem Phys. 2004;121(19):9593–9610. [PubMed] [Google Scholar]
28. Мохаммед О.Ф., Пайнс Д., Дрейер Дж., Пайнс Э., Нибберинг ETJ. Последовательный перенос протона через водные мостики в кислотно-основных реакциях. Наука. 2005;310(5745):83–86. [PubMed] [Google Scholar]
29. Мохаммед О.Ф., Пайнс Д., Нибберинг ETJ, Пайнс Е. Переключение растворителя, индуцированное основанием, в кислотно-основных реакциях. Angew Chem, Int Ed. 2007;46(9): 1458–1469. [PubMed] [Google Scholar]
Мохаммед О.Ф., Пайнс Д., Нибберинг ETJ, Пайнс Е. Переключение растворителя, индуцированное основанием, в кислотно-основных реакциях. Angew Chem, Int Ed. 2007;46(9): 1458–1469. [PubMed] [Google Scholar]
30. Мохаммед О.Ф., Пайнс Д., Пайнс Э., Нибберинг ETJ. Водный бимолекулярный перенос протона при кислотно-основной нейтрализации. хим. физ. 2007;341(1–3):240–257. [Google Scholar]
31. Siwick BJ, Bakker HJ. О роли воды в реакциях межмолекулярного переноса протона. J Am Chem Soc. 2007;129(44):13412–13420. [PubMed] [Google Scholar]
32. Siwick BJ, Cox MJ, Bakker HJ. Дальний перенос протона в водных кислотно-основных реакциях. J Phys Chem B. 2008; 112 (2): 378–389.. [PubMed] [Google Scholar]
33. Cox MJ, Bakker HJ. Параллельные пути переноса протона в водных кислотно-основных реакциях. J Chem Phys. 2008;128(17):174501. [PubMed] [Google Scholar]
34. Pines E, Huppert D. Наблюдение рекомбинации близнецов в переносе протона в возбужденном состоянии. J Chem Phys. 1986;84(6):3576–7. [Google Scholar]
1986;84(6):3576–7. [Google Scholar]
35. Pines E, Huppert D. Geminate Recombination Proton Transfer Reactions. Письмо о хим. физике. 1986;126(1):88–91. [Google Scholar]
36. Pines E, Huppert D, Agmon N. Рекомбинация близнецов в реакциях переноса протона в возбужденном состоянии — численное решение уравнения Дебая-Смолуховского с обратной реакцией и сравнение с экспериментальными результатами. J Chem Phys. 1988;88(9):5620–5630. [Google Scholar]
37. Agmon N, Pines E, Huppert D. Рекомбинация близнецов в реакциях переноса протона 0.2. Сравнение диффузионной и кинетической схем. J Chem Phys. 1988; 88: 5631–5638. [Google Scholar]
38. Крисинель Э.Б., Агмон Н. Сферическая симметричная задача диффузии. J Comput Chem. 1996; 17:1085–1098. [Google Scholar]
39. Дебай П. Скорость реакции в ионных растворах. Транс Электрохим Соц. 1942; 82: 265–272. [Google Scholar]
40. фон Смолуховски М. Versuch Einer Mathematischen Theorie der Koagulationskinetik Kolloider Lösungen. Z Phys Chem. 1917;92:129–168. [Google Scholar]
Z Phys Chem. 1917;92:129–168. [Google Scholar]
41. Collins FC, Kimball GE. Скорости реакций, контролируемые диффузией. J Коллоидная наука. 1949; 4: 425–437. [Google Scholar]
42. Сабо А. Теория диффузионного тушения флуоресценции. J Phys Chem. 1989; 93: 6929–6939. [Google Scholar]
43. Genosar L, Cohen B, Huppert D. Сверхбыстрая прямая фотокислотно-основная реакция. J Phys Chem A. 2000;104(29):6689–6698. [Google Scholar]
44. Коэн Б., Хупперт Д., Агмон Н. Неэкспоненциальная динамика Смолуховского в быстрой кислотно-основной реакции. J Am Chem Soc. 2000;122(40):9838–9839. [Google Scholar]
45. Коэн Б., Хупперт Д., Агмон Н. Диффузионно-ограниченная кислотно-основная неэкспоненциальная динамика. J Phys Chem A. 2001;105(30):7165–7173. [Google Scholar]
46. Хайнс Дж.Т. Физическая химия — перипатетический протон. Природа. 2007;446(7133):270. [PubMed] [Google Scholar]
47. Gösele UM. Кинетика реакций и диффузия в конденсированных средах.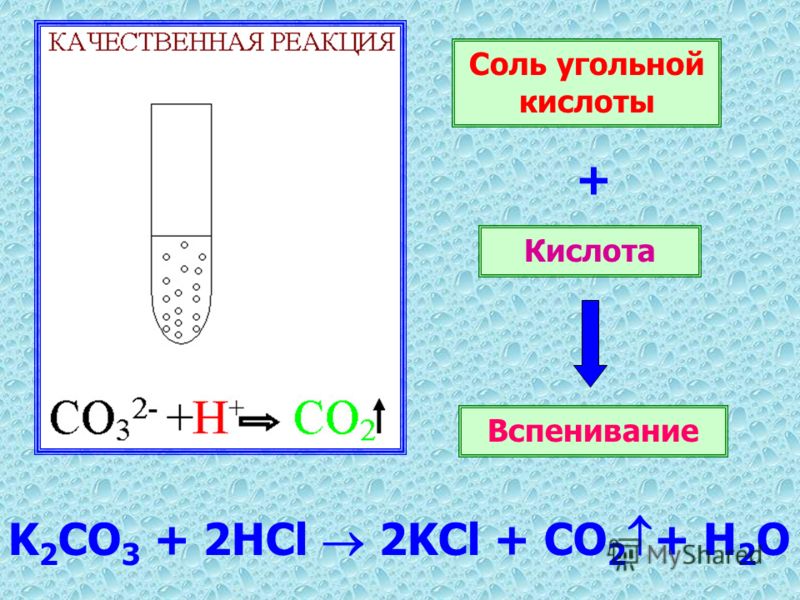 Прога Реакт Кинет. 1984; 13: 63–161. [Google Scholar]
Прога Реакт Кинет. 1984; 13: 63–161. [Google Scholar]
48. Райс С.А. Диффузионно-ограниченные реакции. Эльзевир; Амстердам: 1985. [Google Scholar]
49. Пайнс Д., Пайнс Э. Прямое наблюдение за степенным законом поведения в асимптотической релаксации к равновесию обратимой бимолекулярной реакции. J Chem Phys. 2001;115(2):951–3. [Google Scholar]
50. Лиде Д.Р., Кехиаян Х.В., редакторы. Справочник CRC по теплофизическим и термохимическим данным. КПР Пресс; Бока-Ратон, Флорида, США: 1994. [Google Scholar]
51. Yaws CL. Справочник Yaws по термодинамическим и физическим свойствам химических соединений. Кновель; Нью-Йорк: 2003. [Google Scholar] 9.0003
52. Вандер Донкт Э. Кислотно-основные свойства возбужденных состояний. Прога Реакт Кинет. 1970; 5: 273–299. [Google Scholar]
53. Мартынов И.Ю., Демяшкевич А.Б., Ужинов Б.М., Кузьмин М.Г. Реакции переноса протона в возбужденных электронных состояниях ароматических молекул. Russ Chem Rev. 1977;46(1):1–15. [Google Scholar]
[Google Scholar]
54. Сосны Э., Сосны Д. Диссоциация протона и взаимодействие растворенного вещества с растворителем после электронного возбуждения фотокислот. В: Elsaesser T, Van den Akker HJ, редакторы. Динамика сверхбыстрых водородных связей и процессы переноса протона в конденсированной фазе. Том. 23. Клювер Академик; Дордрехт, Нидерланды: 2002. стр. 155–184. [Академия Google]
55. Сосны D, Сосны E. Фотокислотность с помощью растворителя. В: Hynes JT, Klinman JP, Limbach HH, Schowen RL, редакторы. Реакции переноса водорода. Том. 1. Вайлей-ВЧ; Вайнхайм, Германия: 2007. стр. 377–415. Физико-химические аспекты I–III. [CrossRef] [Google Scholar]
56. Эйген М., Крузе В., Маасс Г., ДеМайер Л. Константы скорости протолитических реакций в водном растворе. Прога Реакт Кинет. 1964; 2:285. [Google Scholar]
57. Шоуп Д., Сабо А. Роль диффузии в связывании лиганда с макромолекулами и клеточными рецепторами. Биофиз Дж. 1982;40:33–39. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Fuoss RM, Kraus CA. Свойства растворов электролитов. XV. Термодинамические свойства очень слабых электролитов. J Am Chem Soc. 1935; 57: 1–4. [Google Scholar]
Fuoss RM, Kraus CA. Свойства растворов электролитов. XV. Термодинамические свойства очень слабых электролитов. J Am Chem Soc. 1935; 57: 1–4. [Google Scholar]
59. Эйген М., Уилкинс Р.Г. Кинетика и механизм образования металлокомплексов. В: Клейнберг Дж., Мурманн Р.К., Фрейзер РТМ, Бауман Дж., редакторы. Механизмы неорганических реакций. Том. 49. Серия «Достижения в области химии». Американское химическое общество; Вашингтон, округ Колумбия, США: 1965. с. 55. [CrossRef] [Google Scholar]
60. Леффлер Дж. Э. Параметры описания переходных состояний. Наука. 1953; 117: 340–341. [PubMed] [Google Scholar]
61. Hammond GS. Корреляция скоростей реакции. J Am Chem Soc. 1955; 77: 334–338. [Google Scholar]
62. Kiefer PM, Hynes JT. Нелинейные соотношения свободной энергии для адиабатических реакций переноса протона в полярной среде. I. Фиксированное разделение донора и акцептора протонов. J Phys Chem A. 2002;106(9):1834–1849. [Академия Google]
63. Кифер П.М. , Хайнс Дж.Т. Нелинейные соотношения свободной энергии для адиабатических реакций переноса протона в полярной среде. II. Учет колебаний водородной связи. J Phys Chem A. 2002;106(9):1850–1861. [Google Scholar]
, Хайнс Дж.Т. Нелинейные соотношения свободной энергии для адиабатических реакций переноса протона в полярной среде. II. Учет колебаний водородной связи. J Phys Chem A. 2002;106(9):1850–1861. [Google Scholar]
64. Kiefer PM, Hynes JT. Кинетические изотопные эффекты для адиабатических реакций переноса протона в полярной среде. J Phys Chem A. 2003;107(42):9022–9039. [Google Scholar]
65. Kiefer PM, Hynes JT. Адиабатическая и неадиабатическая константы скорости переноса протона в растворе. Ионика твердого тела. 2004;168(3–4):219–224. [Google Scholar]
66. Kiefer PM, Hynes JT. Влияние полярности растворителя в зависимости от температуры на константы скорости адиабатического переноса протона и кинетические изотопные эффекты. Isr J Chem. 2004;44(1–3):171–184. [Google Scholar]
67. Криевой М.М., Конасевич Д.Е. Brønsted α и эффект первичного изотопа водорода: проверка теории Маркуса. Adv Chem Phys. 1972; 21: 243–252. [Google Scholar]
68. Криевой М. М., О С.В. Соотношения между константами скорости и равновесия для реакций переноса протона. J Am Chem Soc. 1973;95:4805–4810. [Google Scholar]
М., О С.В. Соотношения между константами скорости и равновесия для реакций переноса протона. J Am Chem Soc. 1973;95:4805–4810. [Google Scholar]
69. Kresge AJ. В кн.: Влияние изотопов на реакции, катализируемые ферментами. Клиланд В.В., О’Лири М.Х., Northrop DB, редакторы. Издательство Юниверсити-Парк; Балтимор, Мэриленд, США: 1977. с. 37. [Google Scholar]
70. Маркус Р.А. Необычные наклоны графиков свободной энергии в кинетике. J Am Chem Soc. 1969; 91 (26): 7224–7225. [Google Scholar]
71. Маркус Р.А. Энергетические и динамические аспекты реакций переноса протона в растворе. Faraday Symp Chem Soc. 1975; 10: 60–68. [Академия Google]
72. Маркус Р.А. Теоретические отношения между константами скоростей, барьерами и наклонами Бренстеда химических реакций. J Phys Chem. 1968; 72: 891–899. [Google Scholar]
73. Коэн А.О., Маркус Р.А. Наклон графиков свободной энергии в химической кинетике. J Phys Chem. 1968; 72: 4249–4256. [Google Scholar]
74. Маркус Р. А. Химическая и электрохимическая теория переноса электрона. Annu Rev Phys Chem. 1964; 15: 155–196. [Google Scholar]
А. Химическая и электрохимическая теория переноса электрона. Annu Rev Phys Chem. 1964; 15: 155–196. [Google Scholar]
75. Маркус Р.А., Сутин Н. Электронные переносы в химии и биологии. Биохим Биофиз Акта, Rev Bioenerg. 1985;811(3):265–322. [Google Scholar]
7.8: Кислотно-основные свойства солей
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 15161
Соли, помещенные в воду, часто реагируют с водой с образованием H 3 O + или OH — . Это известно как реакция гидролиза. В зависимости от того, насколько сильно ион действует как кислота или основание, он будет создавать различные уровни pH. Когда вода и соли реагируют, существует много возможностей из-за различной структуры солей. Соль может состоять из слабой кислоты и сильного основания, сильной кислоты и слабого основания, сильной кислоты и сильного основания или слабой кислоты и слабого основания. Реагенты состоят из соли и воды, а продукты состоят из сопряженного основания (из кислоты реакционной стороны) или сопряженной кислоты (из основания реакционной стороны). В этом разделе химии мы обсудим значения pH солей на основе нескольких условий.
Соль может состоять из слабой кислоты и сильного основания, сильной кислоты и слабого основания, сильной кислоты и сильного основания или слабой кислоты и слабого основания. Реагенты состоят из соли и воды, а продукты состоят из сопряженного основания (из кислоты реакционной стороны) или сопряженной кислоты (из основания реакционной стороны). В этом разделе химии мы обсудим значения pH солей на основе нескольких условий.
Когда солевой раствор является щелочным или кислым?
Существует несколько руководящих принципов, обобщающих результаты:
- Соли, полученные из сильных оснований и сильных кислот, не гидролизуются. pH останется нейтральным при 7. Галогениды и щелочные металлы диссоциируют и не влияют на H + , поскольку катион не изменяет H + , а анион не притягивает H + из воды. Вот почему NaCl является нейтральной солью. Всего: Соли, содержащие галогениды (кроме F —) и щелочные металлы (кроме Be 2 + ), будут диссоциировать на ионы-спектаторы.

- Соли, состоящие из сильных оснований и слабых кислот, гидролизуются, что придает им рН выше 7. вода в реакции. Это приведет к тому, что вода будет действовать как кислота, которая в этом случае оставит ион гидроксида (OH —) . Катион будет из сильного основания, то есть из щелочного или щелочноземельного металла, и, как и прежде, он диссоциирует на ион и не повлияет на H + .
- Соли слабых оснований и сильных кислот гидролизуются, в результате чего его рН составляет менее 7 . Это связано с тем, что анион станет ионом-спектатором и не сможет притягивать H + , а катион слабого основания отдаст воде протон , образуя ион гидроксония.
- Соли слабого основания и слабой кислоты также гидролизуются, как и другие, но немного сложнее и требуют учета K a и K b . Какая бы кислота ни была сильнее, она будет доминирующим фактором при определении того, является ли она кислотной или основной.
 Катион будет кислотой, а анион будет основанием и будет образовывать либо ион гидроксония, либо ион гидроксида, в зависимости от того, какой ион легче реагирует с водой.
Катион будет кислотой, а анион будет основанием и будет образовывать либо ион гидроксония, либо ион гидроксида, в зависимости от того, какой ион легче реагирует с водой.
Соли полипротоновых кислот
Не пугайтесь солей полипротоновых кислот. Да, они крупнее и «круче», чем большинство других солей. Но с ними можно обращаться точно так же, как и с другими солями, только с немного большей математикой. Во-первых, мы знаем несколько вещей:
- Это все еще просто соль. Все вышеперечисленные правила остаются в силе. К счастью, поскольку мы имеем дело с кислотами, pH соли полипротонной кислоты всегда будет больше 7.
- Так же, как полипротонные кислоты теряют H 9{-11}\).
Это означает, что при расчете значений K b CO 3 2 — , K b первой реакции гидролиза будет \(K_{b1} = \dfrac{K_w} {K_{a2}}\), так как он пойдет в обратном порядке.
Краткое изложение кислотно-основных свойств солей Тип решения Катионы Анионы рН Кислотный Из слабых оснований NH 4 + , Al 3 + , Fe 3+
Из сильных кислот: Cl — , Br — , I — , NO 3 — , ClO 4 —
< 7 Базовый С сильных оснований: Группа 1 и Группа 2, но не Be 2+ Из слабых кислот: F — , NO 2 — , CN — , CH 3 COO —
> 7 Нейтральный С сильных оснований: Группа 1 и Группа 2, но не Be 2 + .

Из сильных кислот: Cl — , Br — , I — , NO 3 — , ClO 4 —
= 7 Вопросы
- Предскажите, является ли рН каждой из следующих солей, помещенных в воду, кислой, щелочной или нейтральной.
- NaOCl (т)
- КСН (с)
- NH 4 NO 3 (s)
- Найти рН раствора 0,200 М NH 4 NO 3 где (К a = 1,8 * 10 -5 ).
- Найти рН раствора 0,200 М Na 3 PO 4 где (К а 1 = 7,25 * 10 -5 , К а2 50 2 50 — = 16,33 К а3 = 3,98*10 9-]\]
\[pH = 12,77\]
Практические вопросы
- Почему соль, содержащая катион сильного основания и анион слабой кислоты, образует щелочной раствор?
- Почему соль, содержащая катион слабого основания и анион сильной кислоты, образует кислый раствор?
- Как значения K a или K b помогают определить, будет ли доминирующей движущей силой реакции слабая кислота или слабое основание?
Ответы на эти вопросы можно найти в разделе прикрепленных файлов внизу страницы.

- Предскажите, является ли рН каждой из следующих солей, помещенных в воду, кислой, щелочной или нейтральной.





 Катион будет кислотой, а анион будет основанием и будет образовывать либо ион гидроксония, либо ион гидроксида, в зависимости от того, какой ион легче реагирует с водой.
Катион будет кислотой, а анион будет основанием и будет образовывать либо ион гидроксония, либо ион гидроксида, в зависимости от того, какой ион легче реагирует с водой.
