Тема 38. Угольная кислота и её соли.
Часть I
1. Угольная кислота – h3CO3.
Классификационная характеристика:
а) по кислороду – кислородсодержащая
б) по водороду – двухосновная
в) по степени диссоциации – слабая
г) по стабильности – нестабильная
2. Диссоциирует в две ступени и поэтому образует два ряда солей:

3. Переход карбоната в гидрокарбонат и обратно можно выразить схемой:
4. Жёсткость воды и способы её устранения.
Вода называется жёсткой, если в ней содержатся катионы Са2+ и Mg2+ в большом количестве.

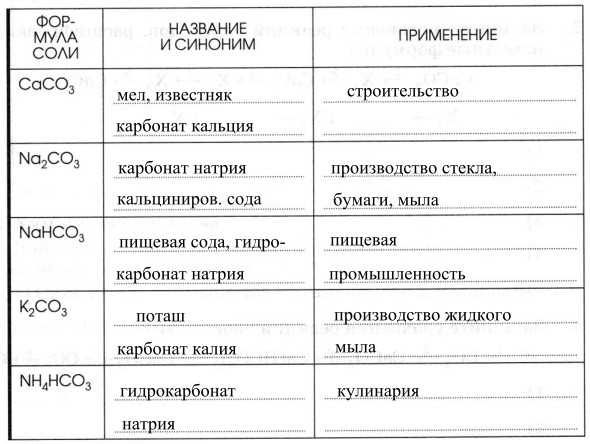
5. Заполните таблицу «Применение солей угольной кислоты».
Часть II
1. Образец природной воды характеризуется постоянной жёсткостью. Запишите формулы и названия соединений, которые обусловливают постоянную жёсткость.
1) CaSO4 сульфат кальция
2) MgSO4 сульфат магния
3) CaCl2 хлорид кальция
4) MgCl2 хлорид магния
2. Способы устранения постоянной жёсткости воды можно условно назвать карбонатным и фосфатным. Запишите уравнения реакций для каждого способа в молекулярной и ионной формах.
3. Запишите уравнения реакций переходов, расшифровав неизвестные формулы:
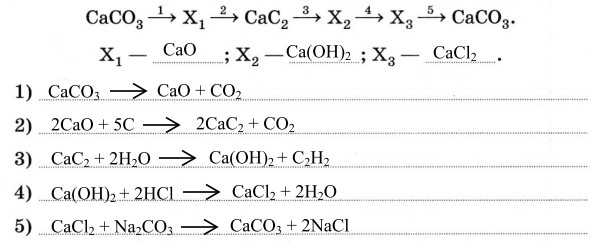
4. Запишите уравнения реакций переходов:

5. Подготовьте презентацию на тему «Карбонат кальция в живой и неживой природе». Запишите план презентации в особой тетради.
superhimik.ru
Алмаз. Графит. Оксиды углерода. Угольная кислота и ее соли
Билет № 18
1. Углерод: положение этого химического элемента в периодической системе, строение его атома. Алмаз. Графит. Оксиды углерода, их принадлежность к подклассам оксидов. Угольная кислота и ее соли
Положение в периодической системе: углерод находится во 2 периоде, IV группе, главной (А) подгруппе.
Атомный номер углерода 6, следовательно, заряд атома равен +6, число электронов 6. Два электронных уровня (равно периоду), на внешнем уровне 4 электрона (равно номеру группы для главных подгрупп).
Схема расположения электронов по уровням:
6C ) )
2 4
Ядро атома углерода 12C содержит 6 протонов (равно заряду ядра) и 6 нейтронов (атомная масса минус число протонов: 12 − 6 = 6).
Углерод как простое вещество образует две аллотропные модификации: графит и алмаз.
Алмаз — прозрачные бесцветные кристаллы. У алмаза атомная кристаллическая решетка. Каждый атом в кристаллической решетке алмаза соединен ковалентными связями с четырьмя соседними атомами, так что кристалл алмаза поэтому сравнивают с единой молекулой. Атомные кристаллические решетки обладают большой прочностью: алмаз — самое твердое из природных веществ. Мелкие алмазы используют для бурения горных пород, в стеклорезах. Алмазный порошок используется для шлифовки драгоценных камней. Огранённые алмазы называются бриллиантами.
Графит — темно-серое вещество со слабым металлическим блеском. Кристалл графита состоит из слоев, в которых атомы связаны ковалентными связями. Связь между слоями обладает свойствами металлической связи (т. е. электроны принадлежат всем атомам). Поэтому графит проводит электрический ток. Слои графита слабо связаны: расслаиваются и скользят относительно друг друга, поэтому графит применяется в простых карандашах и в графитовой смазке.
Сажу, древесный уголь, кокс рассматривают как аморфную (состоящую из мелких частиц) разновидность графита.
Сажа используется как наполнитель для черной резины, получения черной краски. Древесный уголь в виде порошка применяется в противогазах, таблетках и фильтрах для воды, т. к. поглощает, адсорбирует на своей поверхности различные примеси, вредные вещества. Кокс в металлургии применяется для выплавки чугуна. Угольные (графитовые) стержни применяются в качестве электродов.
Углеродом образованы также графен, лонсдейлит, карбин, фуллерит.
Графит сгорает в кислороде с образованием оксида углерода (IV), или углекислого газа:
C + O2 = CO2
При высокой температуре этот оксид реагирует с раскаленным углем, получается оксид углерода (II) — угарный газ:
CO2 + C = 2CO
Угарный газ горит голубоватым пламенем:
2CO + O
Угарный газ чрезвычайно ядовит, так как соединяется с гемоглобином крови, делая невозможным перенос кровью кислорода. Отравление вызывает головную боль, нередко смерть. При отравлении угарным газом необходимо дышать свежим воздухом, лучше кислородом, чтобы вывести оксид углерода (II) из крови. Следует помнить, что угарный газ не задерживается обычным угольным противогазом!!!
Углекислый газ необходим растениям для фотосинтеза. Считается одним из «главных виновников» парникового эффекта, способствующего потеплению климата. Замороженный углекислый газ — сухой лёд — при нагревании испаряется, минуя жидкую фазу и поглощая много тепла, поэтому используется в тележках с мороженым и т. п. для сохранения низкой температуры.
Оба этих оксида являются кислотными, т. е. реагируют со щелочами с образованием солей. Углекислый газ реагирует с известью, получается карбонат кальция:
CO2 + Ca(OH)2 = CaCO 3 + H2O
Оксид углерода (II) иногда относят к несолеобразующим оксидам, но он реагирует при нагревании с гидроксидом натрия с образованием соли — формиата натрия:
CO + NaOH = HCOONa (эти реакции не для запоминания! Изучаются в 10–11 классах)Ему соответствует муравьиная кислота HCOOH, и он может быть получен из нее при нагревании с концентрированной серной кислотой (отнимает воду):
HCOOH = CO↑ + H2O
Углекислому газу соответствует угольная кислота H2CO3 — слабая, существует только в растворе. Ее соли — карбонаты. Карбонат кальция широко встречается в природе в виде мела, известняка, мрамора. Применяется в строительстве: известняк в виде щебня и для кладки стен, мел как наполнитель, мрамор для облицовки зданий, станций метрополитена. Обжигом мела и известняка получают жженую известь CaO:
CaCO3 = CaO + CO2↑
Карбонат натрия Na2CO
Питьевая сода разлагается при нагревании с выделением углекислого газа, но лучше добавлять к соде лимонную кислоту:
NaHCO3 + H+ = Na+ + H2O + CO2↑
2. Опыт. Распознавание раствора соли соляной (хлороводородной) кислоты среди трех предложенных растворов
Качественная реакция на хлорид-ион — при сливании с раствором соли серебра, образуется белый творожистый осадок, нерастворимый в концентрированной азотной кислоте.
Добавляем во все три пробирки немного нитрата серебра. В которой выпадет белый творожистый осадок — находится соль соляной кислоты (хлорид):
AgNO3 + NaCl = NaNO3 + AgCl↓
или в ионном виде:
Ag+ + Cl− = AgCl↓
Если в одной из пробирок к тому же имеется соляная кислота (даст такой же осадок), сначала
- Делим каждый раствор на две пробирки (получаем два набора по три)
- Капаем по очереди в первые три — индикатор метилоранж или лакмус. Где покраснеет индикатор, там кислота — отмечаем эту пробирку.
- В оставшиеся две пробирки капаем нитрат серебра.
Ион серебра дает осадок со многими солями (смотрите таблицу растворимости). Чтобы творожистый характер осадка был лучше виден, не следует трясти пробирку, перемешивать растворы. При наличии хлорида осадок выпадает сразу очень заметный, похожий на простоквашу.
Если возникают сомнения, можно было бы попробовать растворить осадок в концентрированной азотной кислоте, но учащимся работать с концентрированными кислотами ЗАПРЕЩЕНО.
автор: Владимир Соколов
staminaon.com
Урок «Угольная кислота и её соли»
Тарбагатайская средняя школа Петровск – Забайкальского района
Читинской области.
Урок – исследование в 9 кл.
Учитель: Шишмарева С. Л
Разряд: 14
Стаж: 22 г.
Задачи: дидактическая: изучить свойства угольной кислоты и ее солей, их превращения из одних соединений в другие, их роль в круговороте веществ и формировании облика планеты, изучить взаимосвязь строения, свойств и применения веществ.
Развивающая : развивать логическое мышление , способность к рефлексии и познавательный интерес.
Воспитательная: формировать гражданскую позицию на примере решения проблемы загрязнения окружающей среды , любовь к природе , экологически целесообразное поведение .
Оборудование: на столе учителя : стеклянная палочка , лакмус , стакан с водой , демонстрационная пробирка , хлорид меди , сода , соляная кислота в банке , яйцо .
На столе учащихся : NaHCO3 , Na2CO3 , CaCL2 , универсальный индикатор ,
HCL , почва в пробирке , держатель , фенолфталеин , тигель , спиртовка , стеклянная трубка. На доске таблица » круговорот углерода в природе .»
Первый этап мотивационный .
Химия многолика . Мы еще раз убедились в этом , начав изучение темы
: «углерод и его соединения «
Наш урок мы начнем необычно, сказкой » Алмаз и графит «.
Давным-давно в одной семье родились два мальчика. Но они совсем были не похожи. » Ах, какой красавец, восклицали все , » – глядя на маленького Алмаза . Ах как искрятся его грани , как играют солнечные блики на его прекрасных боках . Ну а братец то какой урод . Просто » гадкий утенок » , лицом черен , как уголь . Разве сравнишь его с красивым братом . Шли годы , братья выросли и все вдруг увидели, что Алмаз то вырос заносчивым , высокомерным , гордым , холодным . Зато братец Графит был полной его противоположностью . Очень добрый , мягкий , теплый в отношении с другими . Страной , где жили братья , правила прекрасная принцесса . Жила она в огромном замке , за холмами .Не так то просто было добраться до нее . Перед холмами расстилалась большая белая пустыня , пересечь которую удавалось не каждому . Раз в год принцесса объезжала свою страну, чтобы посмотреть на подданных. И вот однажды она увидела братьев » Как она прекрасна , » – подумали братья . И любовь вспыхнула в их сердцах . Но только в холодном сердце Алмаза любовь была не столько к принцессе , сколько к ее титулам . А любовь Графита была горяча как огонь . » Кто пересечет пустыню, тот и станет моим мужем » , — сказала принцесса , глядя на красивого Алмаза ,
но только после того, как пробъет скалу , стоящую перед дворцом . » Конечно, это буду я , «- подумал Алмаз , ведь я самый твердый . Отправились они в путь . В первые же дни пути Алмаз решил вернуться .
» Ах, солнце испарит меня, я почернею и стану таким же, как Графит «.
А Графит продолжал свой путь, оставляя свои следы на белом песк.
» Я люблю тебя, принцесса, » – можно было прочитать написанное на белом песке Графитом. А вот и не пробиваемая скала . Как же мягкому графиту пробить ее ? Но любовь способна на все. Ее огонь разгорался все сильнее и сильнее и графит превратился в прекрасный алмаз . Он легко пробил скалу и пришел к прекрасной принцессе так любовь преодолела все преграды .
В : О каком химическом явлении идет речь в сказке ?
В : Назовите аллотропные модификации .
В : Назовите свойства , о которых идет речь в сказке .
В : Это простые вещества , а какие сложные соединения углерода мы изучили на прошлом уроке ?
О : Оксиды углерода : CO и CO2 .
В: Какой оксид имеет огромное значение в природе?
Звучит тихая медленная музыка.
Когда- то, где- то на землю упал луч солнца, но он упал не на бесплодную почву, он упал на зеленую былинку пшеничного ростка, или лучше сказать на хлорофилловое зерно. Ударяясь об него, он потух, перестал быть светом, но не исчез. Он только затратился на внутреннюю работу, он рассек, разорвал связь между углеродом и кислородом, соединенными в угле кислоте. Освобожденный углерод , соединяясь с
водой, образовал крахмал. Этот крахмал, превратясь в растворенный сахар,
после долгих странствий по растению, отложился, наконец, в зерне в виде крахмала или клейковины. В той или иной форме он вошел в состав хлеба, который послужил нам пищей. Он преобразился в наши мускулы, в наши нервы. И вот теперь атомы углерода стремятся в наших организмах вновь соединиться с кислородом, который кровь разносит во все концы нашего тела. При этом луч солнца, таившийся в них в виде химического напряжения, вновь принимает форму явной силы. Этот луч согревает нас. Он приводит нас в движение. Быть может в эту минуту он играет в нашем мозгу.
В: О каком процессе идет речь в отрывке Тимирязева?
О: О процессе фотосинтезе, главную роль в котором играет углекислый газ.
Изучая новую тему, у нас возникает вопрос, а зачем она нужна? Чем она интересна и значима? Как поступает СО2 в атмосферу, кроме процесса дыхания? Какие превращения, преобразования из одних форм хим. соединений в другие он испытывает. Поэтому есть смысл говорить о различных сложных веществах углерода и их роли в круговороте веществ.
В мире вечного движения
В превращеньях вещества
Возникают на мгновенья
Все живые существа.
Но явившись на мгновенье,
Знать уж хочет существо,
В чем же вечное движенье?
Что такое вещество?
Демонстрационный опыт.
В стакан с водой добавили лакмус. Окраска не изменилась, затем продули воздух через стеклянную трубку, вода окрасилась в розовый цвет.
Он в стакане растворился
И цвет воды вдруг изменился
От лакмуса мельчайшей дозы
Была бесцветной, стала розовой
В: Какое явление мы наблюдали?
В: Какое химическое вещество образовалось в стакане? Почему вы сделали такой вывод?
Итак, тема «Угольная кислота и ее соли»
Наша задача на уроке исследовать сложные соединения углерода, их роль в круговороте веществ и формирование облика планеты
Девиз урока:
Как формула, как график трудовой,
Строй менделеевской системы строгой.
Вокруг тебя творится мир живой
Входи в него, вдыхай, руками трогай
Щипачев.
2 этап. Исследовательский.
За каждый вопрос или элемент работы ставим 1 балл.
1 В: Какова формула угольной кислоты?
Н2СО3 1 балл.
В: Какова степень окисления углерода?
+ 4 1 балл.
В: Как мы получили угольную кислоту? Составить уравнение реакции.
Н2О + СО2 = Н2СО3 = Н + НСО3 1 б.
НСО3= Н + СО3 1 б.
В: Какая это кислота?
О: Слабая, то есть разлагается.
В: Диссоциирует?
О: Да.
В: Как диссоциирует?
О: Ступенчато.
При растворении в воде устанавливается хим. равновесие. Отсюда
В: Какие виды солей может образовать угольная кислота?
О: Кислые и средние.
В: Приведите примеры.
О: NaHCO3, Ca(HCO3)2. 1 балл.
Среднее Na2CO3, CaCO3. 1 балл.
Демонстрационный опыт.
Получение малахита.
CuCl2 + Na2CO3 → выпадает осадок
В: Какая это соль?
О: Средняя, не верно, так как идет гидролиз, отсюда
2 CuCl2 + 3 Na2CO3 + 2 h3O → (CuOH)2CO3 + 6 Na+ + 4Cl — + 2 HCO3— 1балл.
Исследуем свойство солей.
В: Какую среду имеют соли?
О: Щелочную. 1 балл.
Опыт с лакмусовой бумажкой (синеет).
В: В какие реакции вступают соли?
О: В реакции обмена с другими солями.
Лабораторная работа.
Проделать реакцию CaCl2 с Na2CO3В стакане, часть отлить в другой.
Продуть через стеклянную трубку. Сравнить. Вывод: в стакане, через который продували осадок исчезает, следовательно, образуется растворимая соль.
СаСО3 + СО2 +Н2О→Са(НСО3)2 1 балл.
Этот процесс повсеместно протекает в природе в толщах известняковых пород с образованием сталактитов и сталагмитов.
Сообщение учащихся об этом.
Вывод: Играют роль соли угольной кислоты в круговороте веществ и формировании облика планеты.
Разлагаются при температуре.
Разложим NaHCO3, наблюдаем выделение CO2.
2 NaHCO3 → Na2CO3 + CO2 + h3O
Затем выделение прекращается, вывод, средние соли щелочных металлов не разлагаются.
В: А не щелочных?
Написать уравнения реакции.
CaCO3 → CaO + h3O
CaO + h3O → Ca(OH)2
CaCO3 в тигле нагрели, прилили воды и прилили фенолфталеин.
В: Почему окраска изменилась.
О: Так как идут процессы, уравнения которых указаны выше.
Знаю, парен я отличный,
Но к кислотам безразличный.
Только к щелочам попал,
Сразу, братцы, я пропал.
Засмущался, стал не смел,
В один миг порозовел.
Такие процессы происходят в природе. Средние и кислые соли участвуют в круговороте веществ в природе.
По формуле, как не смотри,
Они не разнятся никак.
Все те же CaCO3
Мел, мрамор также известняк.
CaCO3 – это одна из самых распространенных горных пород. И имеет биогенное происхождение, т.е. образовался из остатков живых организмов.
В Египте пирамиды сложены из осадочных известняков, остатков нуммулитов, организмов, живших миллионы лет назад, одноклеточных, размеров 10 – 16 см. В переводе с латинского, нуммулиты – это каменные монеты. По легенде – деньги богача, не подавшего милостыню нищему.
Вывод: играют роль в формировании облика планеты.
Кремнистый скат иль мраморный утес
Из мириадов тварей рос.
Он из частиц слагался минеральных.
Полипов, рифов, раковин спиральных.
Пока огонь подземный тот утес
Как остров над водою не вознес.
От полюса до полюса в равнины
Пески простерлись, уголь, известняк и глины,
И цинк, и черный марганец средь жил,
И кряж железа полн магнитных сил.
Все это в кряжах, глубинах болотных,
Остатки лишь растений и животных.
Песня:
Белые кораблики, белые кораблики
По небу плывут
Белые кораблики, белые кораблики
Дождики везут.
Дождики кислотные, дождики кислотные
Льются свысока.
Их несут по небу нам, их несут по небу нам
Наши облака.
Попадают в дерево, стебельки и листики
Разрушают все.
Что с природой сделали, лучше вы не сыщете
Красоты ее.
В: О какой экологической проблеме идет речь?
О: Кислотные дожди повышают кислотность почвы.
Исследовательская работа учащихся «Исследование кислотности почвы пос. Тарбагатай».
Мы определили PH водной вытяжки почвы колориметрическим цветным методом, который основан на свойствах красящих веществ – индикаторов. Ход анализа: образцы взяли из пахотных горизонтов почвы. Из средней пробы почвы отбросили включения, комки раздавили и просеяли через сито, отверстием 1 миллилитр. Этой почвой заполнили пробирки по 2 миллилитра с каждого участка. К почве прилили 5 миллилитров дистиллированной воды, закрыли чистой пробкой и взболтали 5 минут. Отношение объема почвы к воде 1: 2,5. Пробирки оставили для осаждения мути. Пипеткой взяли прозрачный раствор из почвенной суспензии. К 1 миллилитру вытяжки добавили 2-3 капли индикатора или опустили лакмусовую бумажку, и сравнили окраску с эталонными окрасками стандартной шкалы. Почва в поселке – нейтральная, за речкой Тарбагатайка – слабо кислая. От повышенной кислотности страдают: лук, чеснок, бобы, горох, капуста, огурцы. Кислотовыносливые: овес, рожь, салат, шпинат, редис. В широком интервале РН можно вырастить картофель, топинамбур, укроп, сельдерей.
Чтобы понизить кислотность вносят CaCO3. Этот метод – известкование.
В: Что происходит при внесении CaCO3 в почву?
CaCO3 + 2 H+ → Ca2+ + CO2 + h3O 1 балл.
Этот метод основан на свойстве всех солей угольной кислоты взаимодействовать с ионами водорода. Это качественная реакция на соли угольной кислоты.
Качественная задача.
В двух пробирках NaCl и Na2CO3
В: В какой пробирке Na2CO3? 1балл.
Демонстрационный опыт.
В банку с HCl бросили яйцо. Оно тонет, затем всплывает.
В: Объясните почему. Какая химическая реакция лежит в основе этого опыта? 1 балл.
Прилить кислоту в пробирку с почвой.
В: Что наблюдаем?
О: Пузырьки.
В: Что это за газ?
О: CO2
Следовательно, в почве содержаться карбонаты.
Мы провели расчет массовой доли СО2 в воздухе.
Сообщения учащихся.
Мы исследовали воздух на содержание СО2, РН (NaOH) = 10 в фенолфталеине окрашивается в ярко малиновый цвет. При пропускании СО2 окраска исчезает. Это происходит при РН NaOH = 8,2
По уравнению реакции 2 NaOH + CO2 → Na2CO3 + h3O
Через 100 мл. NaOH пропускаем СО2 – окраска исчезает. Концентрация щелочи меняется, она уменьшается. В начале реакции РН (NaOH) = 10
РОН = 14- PН=14 – 10 = 4 РОН = — lg[OH]=1O-4
[OH]=1O-4 0,0001=υ_ υ=0,00001 m(NаОН)= 10-5 x 40Г⁄М =4 x 10-4
0,1
В конце реакции: РН = 8,2, РОН = 14 – 8,2 = 5,8,
lg [OH]=-5,8 [OH]
[OH]=1,6 x 10-6 г.ион/литр
1,6 х 10-6 = υ_ υ = 1,6 х 10-7 m = 1,6 х 10-7 х 40= 6,4 х 10-6
0,1
m (NaOH) = 4 х 10-4 – 6,4 х 10-6 = 3,94 х 10-4
По уравнению:
V (CO2) = 3,94 х 10-4 х 22400 мл. = 0,12 мл.
80 гр.
W (CO2) = 0,12 х 100%
V х n
Где V – это объем груши, через которую продували воздух, n – это число нажатий.
W (CO2) = 0,12 х 100 = 0,033%
60х6
Таким образом, делаем вывод.
Соединения углерода находятся в земной коре, в атмосфере, в живых организмах.
Загадка: Из меня состоит все живое
Я графит, антрацит и алмаз.
Я на улице, в школе и в поле.
Я в деревьях и в каждом из вас.
(углерод) 1 балл.
Итак: Соединения углерода взаимопревращаются. Их превращения можно свести в единую, цельную картину.
Атомы углерода находятся в постоянном движении, преобразовании из одних форм химических соединений в другие. Эти превращения объединяются в сложную систему взаимопревращающихся циклов.
Подсчитаем количество баллов.
Д/з. §19.10 стр. 131 – 132
таблица 19.4 стр. 133
упр. 30 стр. 137
infourok.ru
Угольная кислота и ее соли
Цель: приобретение знаний о свойствах угольной кислоты и её солей и их применении.
Задачи:
Образовательные.
Изучить общие и специфические свойства угольной кислоты и её солей.
Раскрыть особенности угольной кислоты и её солей и их применения.
Продолжить формирование навыков составления уравнений реакций.
Воспитательные.
Создать условия для:
Повышения познавательной активности учащихся;
Развития умения работать в коллективе;
Воспитания общей культуры;
Воспитания ответственности и аккуратности, коммуникативных навыков, уважения к товарищам;
Воспитания позитивного отношения к химии;
Развивающие.
Создать условия для развития УУД:
1) Познавательных:
Общеучебные универсальные действия:
Осознанное и произвольное построение речевого высказывания.
Смысловое чтение, определение основной и второстепенной информации.
Выбор наиболее эффективных способов решения задач.
Рефлексивные УУД.
Структурирование знаний.
Знаково-символические действия:
Написание уравнений реакций (знаково-символическое).
Логические универсальные действия:
Анализ объектов с целью выделения признаков.
Установление причинно-следственных связей.
Умение анализировать, строить план исследования, наблюдать и делать выводы на основе эксперимента, делать дедуктивные и индуктивные умозаключения.
Использование опыта как источника знаний; умение проводить и описывать эксперимент, наблюдать и делать выводы на химическом языке.
Выдвижение гипотез, их обоснование.
Постановка и решение проблемы.
2) Личностных: самостоятельное создание способов решения проблем поискового характера.
3) Коммуникативных:
Постановка вопросов,
Умение точно выразить свои мысли,
Владение диалогической речи,
Струдничество в группе.
4) Регулятивны:
Целеполагание.
Планирование.
Контроль в форме сличения результата действия с заданным эталоном с целью обнаружения отклонений и отличий от эталона.
Оценка.
Саморегуляция.
Тип урока: Урок изучения нового материала.
Критерии достижения цели урока: ученик должен
ЗНАТЬ:
1) Химические свойства угольной кислоты и её солей.
2) Качественную реакцию на карбонат-ион.
3) Природные соединения угольной кислоты.
4) Названия солей угольной кислоты и их практическое применение.

УМЕТЬ:
1) Давать характеристику угольной кислоте и её солей.
2) Записывать формулы кислых и средних солей и их называть.
3) Записывать уравнения реакций, подтверждающие основные химические свойства солей в молекулярном и ионном виде.
4) Практически определять наличие анионов СО3 2-и НСО3 — в растворе.
5) Объяснять взаимопревращения карбонатов и гидрокарбонатов в природе.
Методы обучения: активные методы обучения: эвристическая беседа, работа в группах — лабораторная работа в исследовательском варианте.
Этапы урока.
I. Организационный момент.
Деятельность учителя:
Приветствует обучающихся. Определяет готовность к уроку.
Деятельность ученика:
Приветствуют учителя. Проверяют свои рабочие места.
II. Актуализация знаний и фиксация затруднений в деятельности.
Деятельность учителя:
В природе ¾ объёма поверхности Земли занимает H2O, а CО2 — обязательный компонент атмосферы. Какой это оксид по классификации? Что он образует с Н2О.
Задание 1. Составить уравнения реакций взаимодействия углекислого газа с водой и дать физико-химическую характеристику этой реакцииCО2 + H2O= Н2СО3
Дайте характеристику угольной кислоте.
Т.к. кислота двухосновная, какие типы солей может образовывать?
Анализирует ошибки обучающихся.
Деятельность ученика:
Пишут уравнения. Называют кислоту.
Дают физико-химическую характеристику этой реакции:
-соединения
— обратимая
-не ОВР
— гетерогенная
— некаталитическая
— экзотермическая
— кислородосодержащая
— двухосновная
— слабая
— нестабильная
Кислые и средние.
III. Мотивация и целеполагание.
Деятельность учителя:
Предлагает сформулировать тему и цель урока. На слайде вопросительные слова: Что? Какие? Для чего? Как будем изучать?
Деятельность ученика:
Составляют вопросы к теме. Формулируют тему и цель урока – исследовать свойства угольной кислоты и её солей.
IV. Этап «открытия новых знаний».
Деятельность учителя:
Направляет ход построения плана исследования свойств солей угольной кислоты с помощью заданий.
Запишите формулы средних и кислых солей угольной кислоты.
Сравните растворимость этих солей NaHCO3 и CаCO3.
Предложите гипотезу и план исследования солей угольной кислоты.
При составлении плана исследования воспользуйтесь параграфом учебника. Предлагает сверить план исследования с эталоном.
Деятельность ученика:
Обсуждают и анализируют:
— Средние:
— Кислые:
По таблице растворимости соли растворимы и нерастворимы.
Выдвигают гипотезу:
а) соли угольной кислоты обладают общими свойствами солей,
б) должны обладать специфическими свойствами.
Намечают план исследования свойств солей угольной кислоты
1. Исследовать отношение
а) к солям,
б) к кислотам,
в) взаимопревращения средних и кислых солей.
Выполняют план эксперимента по инструкции. Обсуждают результаты – запись уравнений реакций и выводов. Обращают внимание на условия протекания реакций.
Весь материал — в архиве.
videouroki.net
Урок по теме «Углекислый газ. Угольная кислота и ее соли»
Урок химии 9 класс
Тема: «Углекислый газ. Угольная кислота и ее соли»
Цели урока:
Создать условия для формирования знаний об углекислом газе, угольной кислоте и ее солях
Создать условия для развития речи (обогащения и усложнения словарного запаса), развития мышления (анализировать, выделять главное, обобщать), формирования умений составлять опорный сигнал
Создать условия для развития личностных качеств: трудолюбия, аккуратности, самоуважения, товарищества.
Тип урока — комбинированный.
Оборудование – учебник, реактивы — угольная кислота, карбонаты, гидрокарбонаты, соляная кислота, индикаторы.
Ход урока:
1. Организационный момент.
2. Опрос по теме «Оксид углерода II» Фронтальный опрос.
Строение молекулы. Физические и химические свойства. Влияние СО на организм человека. Первая медицинская помощь при отравлении угарным газом.
3. Основная часть. Изучение новой темы начинается с загадки или с интересных фактов из истории углекислого газа (слайд 1, 2):
— Это вещество входит в состав воздуха (0,03% по объему).
— Это вещество – поглощает инфракрасные лучи и мешает отведению тепла от поверхности Земли.
— Благодаря этому веществу английский химик Дж. Пристли в 1767 году сделал первую бутылку газировки.
— Это вещество – главный источник фотосинтеза и важнейший регулятор кровообращения и дыхания.
Загадка:
Чтоб появиться я сумел,
Прокаливают белый мел.
Меня дает огонь в печи,
И пламя маленькой свечи.
И стоит только сделать вздох,
Чтоб я на свет явиться мог.
Я в газированной воде,
Я в хлебе, в соде; я везде.
Учащиеся определяют тему урока (слайд 3) и отвечают на вопрос: «Что мы знаем по этой теме? Что нужно изучить?»
Учащиеся определяют цели урока и план изучения вещества (слайд 4):
Строение молекулы
Физические свойства
Получение
Химические свойства
Применение
Сообщение учащегося по теме урока (опережающее обучение) (слайд 5, 6)
Один из учащихся на доске изображает схему строения молекулы углекислого газа, другой рисует опорный сигнал по физическим свойствам углекислого газа (слайд 7).
Углекислый газ СО2 – бесцветный газ, без запаха, в 1,5 раза тяжелее воздуха, при обычных условиях в 1 объёме воды растворяется 1 объём углекислого газа. При давлении в 60 атмосфер CO2 превращается в бесцветную жидкость. При испарении жидкого СО2 образуется снегообразная масса, которую прессуют – «сухой лёд» — для хранения пищевых продуктов.
Получение СО2 (опрос учащихся) слайд 8
Химические свойства (записывают у доски) слайд 9, 10. 11
СО2 – кислотный оксид (реагирует со щелочами, основными оксидами и водой).
СО2 + NaOH = NaHCO3 СО2 + 2NaOH = Na2CO3 + H2O
СО2 + Ca(OH)2 = CaCO3↓ + H2O СО2 + CaO = CaCO3 СО2 + H2O = H2CO3
СО2 не горит и не поддерживает горение, однако магний Mg горит в СО2:
СО2 + 2Mg = 2MgO + С (сажа) (разбирают с точки зрения ОВР)
Применение углекислого газа (слайд 12, 13)
Немного истории
Английский химик Дж Пристли в 1767 году сделал первую бутылку газировки. Усовершенствовал технологию и изобрел первый аппарат по газированию воды его коллега – шведский ученый Торберн Бергман. Прибор насыщал воду углекислым газом под большим давлением и был назван САБУРАТОРОМ. Чуть позже состав газировок стали видоизменять: чтобы добиться новых видовых оттенков, в воду стали добавлять ягодные соки или лимонный экстракт, отсюда, кстати, и пошло слово «лимонад».
Вопрос учителя: При взаимодействии углекислого газа образуется нестойкое соединение, какое? слайд 14
Угольная кислота H2CO3 – неустойчивая, равновесие смещается влево.
В свободном виде не существует, так как разлагается на CO2 и H2O
Угольная кислота H2CO3 – двухосновная кислота => 2 ряда солей (слайд15)
1) средние – карбонаты и 2) кислые – гидрокарбонаты. Из карбонатов в воде растворимы только соли К+, Na+, NH4+. Кислые соли растворимы в воде.
CaCO3 + H2O + СО2 (изб.) → Сa(HCO3)2.
Химические свойства (учащиеся записывают самостоятельно)
Общие для кислотСпецифические
1. С активными металлами
H2CO3+Mg → MgCO3+H2
2. С оксидами металлов
H2CO3 + CaO → CaCO3 + H2O
3. С гидроксидами металлов
H2CO3 + 2 NaOH → Na2CO3+2 H2O
H2CO3 + NaOH → NaHCO3
4. С солями сильных кислот
H2CO3 + BaCl2→ BaCO3 +2HCl
1. Непрочная
H2CO3→ CO2 + H2O
2.Диссоциация
Кислота слабая, лакмус розовый
Применение угольной кислоты (учитель читает сказку, учащиеся самостоятельно делают вывод) слайд 16, 17, 18, 19, 20
Сказка о братьях карбонатах
На земле живут три брата
Из семейства Карбонатов
Старший брат – красавец МРАМОР,
Славен именем Карары,
Превосходный зодчий. Он
Строил Рим и Парфенон.
Всем известен ИЗВЕСТНЯК,
Потому и назван так.
Знаменит своим трудом,
Возводя за домом дом.
И способен, и умел
Младший мягкий братец МЕЛ.
Как рисует, посмотри,
Этот CaCO3!
Любят братья порезвиться,
В жаркой печке прокалиться.
CaO да CO2 образуются тогда.
Сталактиты и сталагмиты
Вода, проникающая в пещеру, растворяет известняк в химической реакции:
CaCO3 + H2O + CO2 <=> Ca2+ + 2 HCO3—
При определённых условиях (разница в парциальном давлении углекислого газа в растворе и воздухе) реакция идёт в обратную сторону, и происходит отложение карбоната кальция — растут сталактиты. Происходит это весьма медленно, характерное время — десятки, сотни лет. Длина сталактитов в отдельных случаях достигает нескольких метров.
При достаточном количестве карбоната кальция в растворе в месте падения капель с конца сталактита на полу пещеры вырастает встречное образование — сталагмит, сливаясь со временем, сталактит со сталагмитом образуют колонну — сталагнат.
Карбонаты (CO3 2- ) и Гидрокарбонаты (HCO3 —)
Na2CO3 – кальцинированная сода NaHCO3 – питьевая сода
CaCO3 –мел, мрамор, известняк
К2CO3 — поташ
Получение:
1. В промышленности: 2 NaHCO3 =Na2CO3+ CO2 + H2O
Na2CO3+ CO2 + H2O=2 NaHCO3
2. В лаборатории:
BaCl2 + CO2 + H2O =BaCO3 + 2 HCl
CO2 + Ca(OH)2=CaCO3+ H2O
Химические свойства (слайд 21 – качественная реакция на карбонаты)
1. С солямиNa2CO3+ Ca Cl2 = CaCO3 + 2 NaCl
2. Разложение ( кроме карбонатов щелочных металлов)
CaCO= CaO+ CO2
3. Гидрокарбонатыà карбонаты
NaHCO3+ NaOH= Na2CO3+H2O
Mg(HCO3)2—MgCO3+ CO2 + H2O
4. Карбонатыà гидрокарбонаты
MgCO3+ CO2 + H2O- Mg(HCO3)2
1. Качественная реакция-«вскипание»
Na2CO3+2 HCl =2 NaCl+ CO2 + H2O
NaHCO3+ HCl =NaCl+ CO2 + H2O
4.Закрепление.
1.Какую воду можно замутить своим дыханием?
2. Почему горящий магний нельзя тушить углекислым газом?
3. Докажите опытным путём, что скорлупа куриного яйца содержит карбонат кальция?
4. Как человек использует карбонаты в своей жизни?
5. Рефлексия. Учащиеся заполняют анкету:
6. Итоги урока.
Учащиеся получают в подарок рецепт Домашнего лимонада:
Углекислый газ в напитках увеличивает их освежающее действие. Ты можешь в любое время приготовить пенящийся лимон. Для этого надо: Лимонной кислоты 12 ч л, сахарной пудры 4 ст л, сода пищевой 6 ст л.
Приготовление: Сначала приготовим порошковую смесь:
Для этого возьмем совершенно сухую емкость, для верности ее лучше дополнительно протереть.
Насыпаем сначала соду, затем лимонную кислоту и хорошо перемешиваем ложкой до полной однородности.
Соду лучше брать из новой пачки, чтобы она наверняка была сухой и без комков.
Добавляем к полученной смеси сахарную пудру и вновь хорошо перемешиваем. Делать это можно металлической ложкой, но удобнее будет использовать деревянную палочку, как для мороженого.
Пересыпаем полученный порошок в банку с крышкой и убираем в темное сухое место.
Доставая по мере необходимости, храним до 1 месяца.
Готовим лимонад из расчета 1 ч.л. с горкой сухой смеси на 200 мл холодной воды. Сахар по желанию добавляем дополнительно. Насыпаем сначала порошок, затем наливаем ½ стакана жидкости и хорошо перемешиваем до полного растворения. Затем доливаем оставшийся объем и подаем.
7.Домашнее задание: § 27-28, упр 14-20 (стр 90-91)
infourok.ru
Кислородные соединения углерода. Угольная кислота и её соли. Карбонаты, их роль в организме.
В соответствии с возможными степенями окисления атома углерода, он образует два оксида: CO (оксид углерода(2)) – угарный газ, CO2 (оксид углерода (4)) – углекислый газ.
Оксид углерода (2) получают из муравьиной кислоты при нагревании в присутствии концентрированной серной кислоты как водоотнимающего средства:
HCOOH = H2O + CO
Оксид угдерода (4) получают действием кислоты на твердые карбонаты:
CaCO3 + 2HCl = CaCl2 + H2O + CO2
Физические свойства.
Оксид углерода (2) – угарный газ, бесцветный, без запаха, немного легче воздуха, плохо растворим в воде, ЯДОВИТ!
Оксид углерода (4) – углекислый газ бесцветный, без запаха, малорастворим в воде, тяжелее воздуха, является солеобразующим оксидом.
Химические свойства.
Оксид углерода(2).
1. Взаимодействие с кислородом:
2CO + O2 = 2CO2
2. Взаимодействие с оксидом меди (2):
CO + CuO = Cu + CO2
Оксид углерода(4).
1. Взаимодействует с основными оксидами:
CO2 + CaO = CaCO3
2. Взаимодействует с основаниями:
CO2 + Ca(OH)2 = CaCO2 + H2O
Угольная кислота и ее соли.
Угольная кислота существует только в растворе. Её можно получить растворением оксида углерода (4) в воде:
CO2 + H2O = H2CO3
При нагревании угольная кислота разлагается на оксид углерода (4) и воду, эта реакция обратима.
Угольная кислота образует два ряда солей: средние – карбонаты и кислые – гидрокарбонаты. Например, Na2CO3 – карбонат натрия, NaHCO3 – гидрокарбонат натрия.
Соли угольной кислоты – устойчивые соединения. Их получают, пропуская оксид углерода (4) через раствор щелочи:
CO2 + 2NaOH = Na2CO3 + H2O
При длительном пропускании оксида углерода (4) через раствор щелочи образуется кислая соль:
Na2CO3 + H2O + CO2 = 2NaHCO3
Все гидрокарбонаты хорошо растворимы в воде в отличие от карбонатов, из которых растворимы только карбонаты щелочных металлов и аммония.
Химические свойства.
1. Карбонаты и гидрокарбонаты при действии даже слабых кислот разлагаются с выделением CO2:
K2CO3 + 2HCl = 2KCl + H2O + CO2
KHCO3 + HCl = KCl + H2O + CO2
2. Растворимые карбонаты взаимодействуют с другими растворимыми солями:
K2CO3 + BaCl2 = BaCO3 + 2KCl
3. При нагревании многие карбонаты разлагаются с выделением CO2:
CaCO3 = CaO + CO2
а гидрокарбонаты переходят в карбонаты:
2NaHCO3 = Na2CO3 + H2O + CO2
Карбонаты кальция (пищевая добавка Е170) – это обычный белый мел. Краситель Е170 представляет собой химическое соединение — соль угольной кислоты, нерастворимую вводе и этаноле. В природе карбонаты кальция распространены достаточно широко, встречаются в виде минералов кальцита, арагонита и ватерита. Большинство групп беспозвоночных (моллюски, губки) состоят из различных форм карбоната кальция. Пищевая добавка Е170 обычно поставляется на производство в виде мелкого белого порошка. Химическая формула карбоната кальция (красителя Е170): CaCO3.
Вопрос№55.
Кремний распространение в природе. Важнейшие минералы и горные породы, содержащие кремний (силикаты).
Содержание кремния в земной коре составляет по разным данным 27,6—29,5 % по массе. Таким образом по распространённости в земной коре кремний занимает второе место после кислорода. Концентрация в морской воде 3 мг/л.
Чаще всего в природе кремний встречается в виде кремнезёма — соединений на основе диоксида кремния (IV) SiO2 (около 12 % массы земной коры). Основные минералы, образуемые диоксидом кремния — это песок (речной и кварцевый), кварц и кварциты, кремень. Вторую по распространённости в природе группу соединений кремния составляют силикаты и алюмосиликаты.
Вопрос№56.
Кремниевый ангидрид. Кремниевая кислота и её соли. Их значение.
Oксид кремния(IV) (диоксид кремния, кремнезём) SiO2) — бесцветные кристаллы, tпл 1713—1728 °C, обладают высокой твёрдостью и прочностью.
Свойства.
· Относится к группе кислых оксидов
· При нагревании взаимодействует с основными оксидами и щелочами
· Растворяется в плавиковой кислоте
· SiO2 относится к группе стеклообразующих оксидов, т.е. склонен к образованию переохлажденного расплава — стекла.
· Диэлектрик (электрический ток не проводит)
Кремниевая кислота (H2SiO3) – кислота очень слабая, в воде мало растворима. При нагревании легко распадается аналогично угольной кислоте:
H2SiO3 = H2O + SiO2
Соли кремниевой кислоты называются силикатами. Их состав обычно изображают формулой в виде соединений оксидов элементов. Например, силикат кальция CaSiO3 можно выразить так: СаO•SiO2.
Силикаты обычно нерастворимы в воде. Исключение составляют силикаты натрия и калия, получаемые сплавлением SiO2 с соответствующими гидроокисями или карбонатами, например:
SiO2 + Na2CO3 = CO2 + Na2SiO3
Вопрос№57.
Подгруппа меди: характеристика. Распространение меди в природе, ее свойства, применение. Оксиды и гидроксиды меди. Соли двухвалентной меди. Комплексные соединения меди. Медь как микроэлемент. Медьсодержащие пестициды. Применение соединений меди в животноводстве. Серебро. Антисептические свойства соединений серебра.
Распространение в природе. Среднее содержание М. в земной коре (кларк) 4,7·10-3 % (по массе), в нижней части земной коры, сложенной основными породами, её больше (1·10-2 %), чем в верхней (2·10-3 %), где преобладают граниты и другие кислые изверженные породы. М. энергично мигрирует как в горячих водах глубин, так и в холодных растворах биосферы; сероводород осаждает из природных вод различные сульфиды М., имеющие большое промышленное значение. Среди многочисленных минералов М. преобладают сульфиды, фосфаты, сульфаты, хлориды, известны также самородная М., карбонаты и окислы.
М. — важный элемент жизни, она участвует во многих физиологических процессах. Среднее содержание М. в живом веществе 2·10-4 %, известны организмы — концентраторы М. В таёжных и других ландшафтах влажного климата М. сравнительно легко выщелачивается из кислых почв, здесь местами наблюдается дефицит М. и связанные с ним болезни растений и животных (особенно на песках и торфяниках). В степях и пустынях (с характерными для них слабощелочными растворами) М. малоподвижна; на участках месторождений М. наблюдается её избыток в почвах и растениях, отчего болеют домашние животные.
В речной воде очень мало М., 1·10-7 %. Приносимая в океан со стоком М. сравнительно быстро переходит в морские илы. Поэтому глины и сланцы несколько обогащены М. (5,7·10-3 % ), а морская вода резко недосыщена М. (3·10-7 %).
В морях прошлых геологических эпох местами происходило значительное накопление М. в илах, приведшее к образованию месторождений (например, Мансфельд в ГДР). М. энергично мигрирует и в подземных водах биосферы, с этими процессами связано накопление руд М. в песчаниках.
Химические свойства
Химическая активность небольшая, убывает с увеличением атомного номера.
Медь и её соединения
Получение
1. Пирометаллургия
CuO + C = Cu + CO
CuO + CO = Cu + CO2
2. Гидрометаллургия
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + Fe = FeSO4 + Cu
электролиз:
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4
(на катоде) (на аноде)
Химические свойства
Взаимодействует с неметаллами при высоких температурах:
2Cu + O2 = 2CuO
Cu + Ci2 = CuCl2
Медь стоит в ряду напряжений правее водорода, поэтому не реагирует с разбавленными соляной и серной кислотами, но растворяется в кислотах – окислителях:
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 2H2O
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
Cu + 2H2SO4(конц.) = CuSO4 + SO2 +2H2O
Применение. Большая роль М. в технике обусловлена рядом её ценных свойств и прежде всего высокой электропроводностью, пластичностью, теплопроводностью. Благодаря этим свойствам М. — основной материал для проводов; свыше 50 % добываемой М. применяют в электротехнической промышленности. Все примеси понижают электропроводность М., а потому в электротехнике используют металл высших сортов, содержащий не менее 99,9 % Cu. Высокие теплопроводность и сопротивление коррозии позволяют изготовлять из М. ответственные детали теплообменников, холодильников, вакуумных аппаратов и т. п. Около 30—40 % М. используют в виде различных сплавов, среди которых наибольшее значение имеют латуни (от 0 до 50 % Zn) и различные виды бронз; оловянистые, алюминиевые, свинцовистые, бериллиевые и т. д. (подробнее см. Медные сплавы). Кроме нужд тяжёлой промышленности, связи, транспорта, некоторое количество М. (главным образом в виде солей) потребляется для приготовления минеральных пигментов, борьбы с вредителями и болезнями растений, в качестве микроудобрений, катализаторов окислительных процессов, а также в кожевенной и меховой промышленности и при производстве искусственного шёлка.
Соединения одновалентной меди
Встречаются либо в нерастворимых соединениях (Cu2O, Cu2S, CuCl), либо в виде растворимых комплексов (координационное число меди – 2):
CuCl + 2NH3 = [Cu(NH3)2]Cl
Оксид меди (I) — красного цвета, получают восстановлением соединений меди (II), например, глюкозой в щелочной среде:
2CuSO4 + C6H12O6 + 5NaOH = Cu2O + 2Na2SO4 + C6H11O7Na + 3H2O
Соединения двухвалентной меди
Оксид меди (II) — чёрного цвета. Восстанавливается под действием сильных восстановителей (например, CO) до меди. Обладает основным характером, при нагревании растворяется в кислотах:
CuO + H2SO4 = CuSO4 + H2O
CuO + 2HNO3 = Cu(NO3)2 + H2O
Гидроксид меди (II) Cu(OH)2 — нерастворимое в воде вещество светло-голубого цвета. Образуется при действии щелочей на соли меди (II):
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
При нагревании чернеет, разлагаясь до оксида:
Cu(OH)2 = CuO + H2O
Типичное основание. Растворяется в кислотах.
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
Растворяется в растворе аммиака с образованием комплексного соединения (координационное число меди – 4) василькового цвета (реактив Швейцера, растворяет целлюлозу):
Cu(OH)2 + 4NH3 = [Cu(HN3)4](OH)2
Малахит Cu2(OH)2CO3. Искусственно можно получить по реакции:
2CuSO4 + 2Na2CO3 + H2O = Cu2(OH)2CO3 + 2Na2SO4 + CO2
Разложение малахита:
Cu2(OH)2CO3 = 2CuO + CO2 + H2O
Медь как микроэлемент.Медь присутствует во всех организмах и принадлежит к числу микроэлементов, необходимых для их нормального развития. В растениях и животных содержание меди варьируется от 10–15 до 10–3%. Мышечная ткань человека содержит 1·10–3% меди, костная ткань — (1-26)·10–4 %, в крови присутствует 1,01 мг/л меди. Всего в организме среднего человека (масса тела 70 кг) содержится 72 мг меди. Основная роль меди в тканях растений и животных — участие в ферментативном катализе. Медь служит активатором ряда реакций и входит в состав медьсодержащих ферментов, прежде всего оксидаз, катализирующих реакции биологического окисления. Медьсодержащий белок пластоцианин участвует в процессе фотосинтеза. Другой медьсодержащий белок, гемоцианин, выполняет роль гемоглобина у некоторых беспозвоночных. Так как медь токсична, в животном организме она находится в связанном состоянии. Значительная ее часть входит в состав образующегося в печени белка церулоплазмина, циркулирующего с током крови и деставляющего медь к местам синтеза других медьсодержащих белков. Церулоплазмин обладает также каталитической активностью и участвует в реакциях окисления. Медь необходима для осуществления различных функций организма — дыхания, кроветворения (стимулирует усвоение железа и синтез гемоглобина), обмена углеводов и минеральных веществ. Недостаток меди вызывает болезни как растений, так и животных и человека. С пищей человек ежедневно получает 0,5-6 мг меди.
Сульфат меди и другие соединения меди используют в сельском хозяйстве в качестве микроудобрений и для борьбы с различными вредителями растений. Однако при использовании соединений меди, при работах с ними нужно учитывать, что они ядовиты. Попадание солей меди в организм приводит к различным заболеваниям человека. ПДК для аэрозолей меди составляет 1 мг/м3, для питьевой воды содержание меди должно быть не выше 1,0 мг/л.
Вопрос№58.
Рекомендуемые страницы:
Воспользуйтесь поиском по сайту:
megalektsii.ru
Угольная кислота и ее соли
Растворяясь в воде, углекислый газ частично взаимодействует с ней, образуя угольную кислоту H2CO3; при этом устанавливаются равновесия:
К1 = 4×10-7 К2 = 4,8×10-11 – слабая, неустойчивая, кислородсодержащая, двухосновная кислота. Гидрокарбонаты растворимы в Н2О. Карбонаты нерастворимы в воде, кроме карбонатов щелочных металлов, Li2CO3 и (NH4)2CO3. Кислые соли угольной кислоты получают, пропуская избыток СО2 в водный раствор карбоната:
,
либо постепенным (по каплям) добавлением сильной кислоты в избыток водного раствора карбоната:
Na2CO3 + HNO3 ® NaHCO3 + NaNO3
При взаимодействии со щелочами или нагревании (прокаливании) кислые соли переходят в средние:
Соли гидролизуются по уравнению:
I ступень
Из-за полного гидролиза из водных растворов нельзя выделить карбонаты Gr3+, Al3+, Ti4+, Zr4+ и др.
Практическое значение имеют соли — Na2CO3 (сода), CaCO3 (мел, мрамор, известняк), K2CO3 (поташ), NaHCO3 (питьевая сода), Са(НСО3)2 и Mg(HCO3)2 обусловливают карбонатную жесткость воды.
Сероуглерод (CS2)
При нагревании (750-1000°С) углерод реагирует с серой, образуясероуглерод, органический растворитель (бесцветная летучая жидкость, реакционноспособное вещество), огнеопасен и летуч.
Пары CS2 – ядовиты, применяется для фумигации (окуривания) зернохранилищ против насекомых — вредителей, в ветеринарии служит для лечения аскаридоза лошадей. В технике – растворитель смол, жиров, йода.
С сульфидами металлов CS2 образует соли тиоугольной кислоты – тиокарбонаты.
.
Эта реакция аналогична процессу
.
Тиокарбонаты – желтые кристаллические вещества. При действии на них кислот выделяется свободная тиоугольная кислота.
Она более стабильна чем Н2СО3 и при низкой температуре выделяется из раствора в виде желтой маслянистой жидкости, легко разлагающейся на:
Соединения углерода с азотом (СN)2 или С2N2 – дициан, легко воспламеняющийся бесцветный газ. Чистый сухой дициан получают путем нагревания сулемы с цианидом ртути (II).
HgCl2 + Hg(CN)2 ® Hg2Cl2 + (С N)2
Другие способы получения:
4HCNг + О2 2(CN)2 +2H2O
2HCNг + Сl2 (CN)2 + 2HCl
Дициан по свойствам похож на галогены в молекулярной форме X2. Так в щелочной среде он, подобно галогенам, диспропорционирует:
(С N)2 + 2NaOH = NaCN + NaOCN
Циановодород — НСN ( ), ковалентное соединение, газ, растворяющийся в воде с образованием синильной кислоты (бесцветная жидкость и ее соли чрезвычайно ядовиты). Получают:
Циановодород получают в промышленности по каталитическим реакциям.
.
Соли синильной кислоты – цианиды, подвержены сильному гидролизу. CN— — ион изоэлектронный молекуле СО, входит как лиганд в большое число комплексов d-элементов.
Обращение с цианидами требует строгого соблюдения мер предосторожности. В сельском хозяйстве применяют для борьбы с особо опасными насекомыми – вредителями.
Цианиды получают:
.
.
Соединения углерода с отрицательной степенью окисления:
1) ковалентные (SiC карборунд) ;
2) ионноковалентные;
3) металлические карбиды.
Ионноковалентные разлагаются водой с выделением газа, в зависимости от того какой выделяется газ, их делят на:
метаниды (выделяется СН4)
ацетилениды(выделяется С2Н2)
Металлические карбиды – соединения стехиометрического состава образованные элементами 4, 7,8 групп посредством внедрения атомов Ме в кристаллическую решетку углерода.
Химия кремния
Отличие химии кремния от углерода обусловлено большими размерами его атома и возможностью использования 3d-орбиталей. Из-за этого связи Si – O — Si, Si — F более прочны, чем у углерода.
Для кремния известны оксиды состава SiO и SiO2.Монооксид кремния существует только в газовой фазе при высоких температурах в инертной атмосфере; он легко окисляется кислородом с образованием более стабильного оксида SiO2.
2SiO + О2t® 2SiO2
SiO2 – кремнезем, имеет несколько кристаллических модификаций. Низкотемпературная – кварц, обладает пьезоэлектрическими свойствами. Природные разновидности кварца: горный хрусталь, топаз, аметист. Разновидности кремнезема – халцедон, опал, агат, песок.
Известно большое разнообразие силикатов (точнее оксосиликатов). В строении их общая закономерность: все состоят из тетраэдров SiO44- которые через атом кислорода соединены друг с другом.
Сочетания тетраэдров могут соединяться в цепочки, ленты, сетки и каркасы.
Важные природные силикаты 3MgO×H2O×4SiO2 тальк, 3MgO×2H2O×2SiO2 асбест.
Как и для SiO2 для силикатов характерно (аморфное) стеклообразное состояние. При управляемой кристаллизации можно получить мелкокристаллическое состояние – ситаллы – материалы повышенной прочности. В природе распространены алюмосиликаты – каркасные ортосиликаты, часть атомов Si заменены на Al, например Na12[(Si,Al)O4]12.
Наиболее прочный галогенид SiF4 разлагается только под действием электрического разряда.
гексафторокремниевая кислота (по силе близка к H2SO4).
(SiS2)n – полимерное вещество, разлагается водой:
Кремниевые кислоты.
Соответствующие SiO2 кремниевые кислоты не имеют определенного состава, обычно их записывают в виде xH2O • ySiO2 – полимерные соединения
Известны:
H2SiO3 (H2O×SiO2) – метакремниевая (не существует реально)
H4SiO4 (2H2O×SiO2) – ортокремниевая (простейшая реально существующая только в растворе)
H2Si2O5 (H2O×2SiO2) – диметакремниевая.
Кремниевые кислоты – плохо растворимые вещества, для H4SiO4 характерно коллоидное состояние, как кислота слабее угольной (Si менее металличен, чем С).
В водных растворах идет конденсация ортокремневой кислоты, в результате образуются поликремниевые кислоты.
Силикаты – соли кремневых кислот, в воде нерастворимы, кроме силикатов щелочных металлов.
Растворимые силикаты гидролизуются по уравнению
Желеобразные растворы натриевых солей поликремневых кислот называются «жидким стеклом». Широко применяются как силикатный клей и в качестве консерванта древесины.
Сплавлением Na2CO3, CaCO3 и SiO2 получают стекло, которое является переохлажденным взаимным раствором солей поликремниевых кислот.
Силикат записан как смешанный оксид.
Силикаты больше всего используются в строительстве. 1 место в мире по выпуску силикатной продукции – цемент, 2-е – кирпич, 3 – стекло.
Строительная керамика – облицовочная плитка, керамические трубы. Для изготовления санитарно-технических изделий – стекло, фарфор, фаянс, глиняная керамика.
stydopedia.ru
