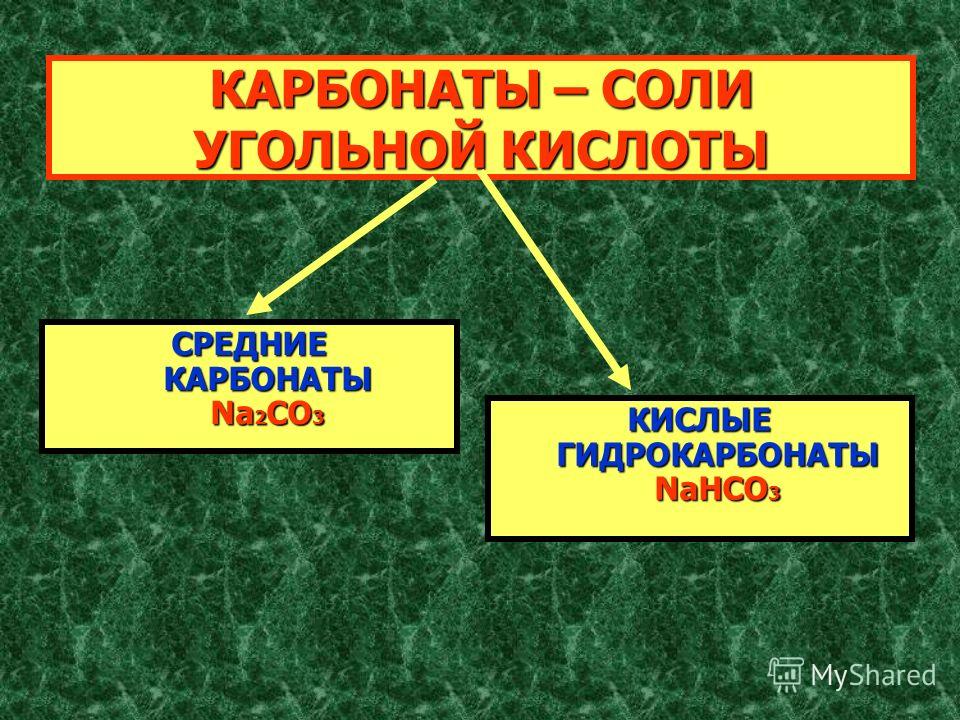
Соли угольной кислоты
Соли угольной кислоты — твердые кристаллические вещества.
Карбонат натрия Na2CO3 — сода — важнейший продукт химической промышленности.
Применяется:
- Для снижения жесткости воды, так как соли кальция и магния, присутствие которых обуславливает жесткость воды, взаимодействуют с карбонатом натрия с образованием осадка:
CaCl2 + Na2CO3 = 2NaCl + CaCO3↓ (1) - В качестве моющего средства, так как раствор соды обладает щелочной реакцией вследствие гидролиза (взаимодействия с водой):
CO32− + HOH = HCO3−+ OH− (2) - В производстве стекла, мыла. В нефтяной, целлюлозно-бумажной промышленности.
Соду в промышленности получают прокаливанием гидрокарбоната натрия — питьевой соды:
2NaHCO3 = Na2CO3 + H2O+ CO
Питьевая сода применяется:
- для выпечки в качестве разрыхлителя, лучше с добавлением лимонной кислоты:
NaHCO3 + H+ = Na+ + H2O+ CO2↑ - 2%-ный раствор — для нейтрализации кислоты, попавшей на кожу (та же реакция)
- Питьевая сода тоже гидролизуется и обладает щелочной реакцией раствора, поэтому применяется для мытья посуды, чистки сантехники и т.
 п.
п. - В составе наполнителя в пенных огнетушителях.
Химику полезно знать, что из-за образования большого количества газа сода не используется при попадании кислоты в пищеварительный тракт. В этом случае применяется оксид магния.
Карбонат калия K2CO3 — пота́ш. Белый порошок, расплывающийся во влажном воздухе и хорошо растворимый в воде.
Применяется для получения жидкого мыла, тугоплавкого и хрустального стекла.
Карбонат кальция широко встречается в природе в виде мела, известняка, мрамора (минерал кальцит). Нерастворим в воде, гидрокарбонат кальция малорастворим.
Применение:
- В строительстве. Известняк — для кладки стен и, в виде щебня, для бетонных работ, строительства дорог. Мел — в виде порошка как наполнитель в шпаклевках, замазках, масти́ках. Мрамор — для облицовки зданий и станций метрополитена.
- О́бжигом известняка в промышленности получают жжёную известь и углекислый газ:
CaCO3 = CaO + CO2↑ (4) - Для известкования кислых почв.
 Известняк нейтрализует почвенные кислоты, при этом выделяется углекислый газ, повышая рыхлость почвы:
Известняк нейтрализует почвенные кислоты, при этом выделяется углекислый газ, повышая рыхлость почвы:
CaCO3 + 2H+ = Ca2+ + H2O +CO2↑
Для распознавания карбонатов приливают раствор соляной кислоты, происходит бурное выделение газа:
CaCO3 + 2HCl = CaCl2 + H2O +CO2↑ (5)
Хотя в формулировке вопроса билета нет химических свойств, в старых «билетниках» они перечисляются и преподаватель может задать такой вопрос. В этом случае назовите:
- Реакции обмена с солями (уравнение 1)
- Гидролиз (уравнение 2)
- Взаимопревращения карбонатов и гидрокарбонатов (уравнение 3 — реакция обратимая)
- Разложение при нагревании, кроме солей щелочных металлов (уравнение 4)
- Взаимодействие с кислотами (уравнение 5)
автор: Владимир Соколов
Угольная кислота и ее соли
Похожие презентации:
Сложные эфиры.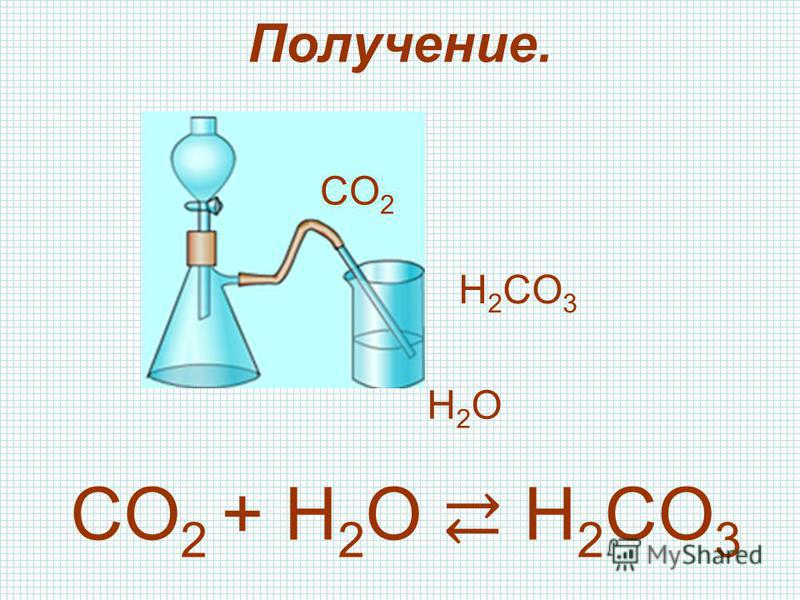 Жиры
Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
«Уголь – ценнейшее из полезных ископаемых,
– ответил инженер, — и природа как будто
решила доказать это, создав алмаз, ибо он, в
сущности, не что иное, как кристаллический
углерод…»
Ж. Верн «Таинственный остров»
9 класс
1.Какие аллотропные модификации углерода, кроме алмаза
вам известны?
1) Озон;
2) Графит;
3) Карбин;
4) Фуллерен.
2. Между тем Рукодельница воротится, воду
процедит, в кувшины нальет, да еще какая
затейница: коли вода нечиста, так свернет
лист бумаги, положит в нее угольков да песку
крупного насыплет, вставит ту бумагу в кувшин
да нальет в нее воды, а вода-то, знай проходит
сквозь песок да сквозь уголья и капает в кувшин
чистая, словно хрустальная.
Русская народная сказка «Мороз Иванович»
2. Какие методы очистки использует Рукодельница?
1) фильтрование
2) дистилляция
3) адсорбция
4) кристаллизация
3.Угарный газ! – вскричал Холмс.- Подождите
немного. Сейчас он уйдет.
Заглянув в дверь, мы увидели, что комнату
освещает только тусклое синее пламя, мерцающее
в маленькой медной жаровне посредине… В
раскрытую дверь тянуло страшным ядовитым
чадом, от которого мы задыхались и кашляли.
А. К. Дойл «Случай с переводчиком»
3. Найдите химические ошибки в прочитанном отрывке.
Почему Холмс и его спутники не могли по описанным признакам
определить присутствие угарного газа в помещении?
1) угарный газ не имеет запаха;
2) угарный газ имеет приятный запах;
3) при отравлении угарным газом человек не кашляет.
4. — Вы слышали об эффекте «собачьей пещеры» в Италии? Есть
там такая пещера-яма. Человек войдет и ходит, а собака или
кролик погибают через несколько минут.

— Почему?
— Из вулканической трещины выделяется углекислый газ…
В.Короткевич «Черный замок Ольшанский»
5. Почему в «собачьей пещере» человек остается живым, а
собаки и другие мелкие животные гибнут?
1) СО2 тяжелее воздуха и скапливается внизу;
2) безопасен для человека, но вреден для животных;
3) человек входит в пещеру в противогазе.
9. Угольная кислота h3CO3
Солиугольной
кислоты
Средние соли карбонаты
MeCO3
Кислые соли гидрокарбонаты
MeHCO3
10. Значение солей угольной кислоты
Строительныематериалы
(мел, мрамор,
известняк)
Карбонат кальция
CaCO3
(мел, мрамор,
известняк)
Поделочный
камень
в скульптуре
Для
известкования
почв при их
излишней
кислотности.
КАРБОНАТЫ
В СКУЛЬПТУРЕ И АРХИТЕКТУРЕ
Ника Самофракийская
(11 век до н.э. Лувр. Париж)
Парфенон (5 век до н.э. Афины)
12. Значение солей угольной кислоты
Содакальцинированная
Na2CO3
и сода
кристаллическая
Na2CO3·10 h3O
Производство
мыла, в быту
как моющее
средство.
Производство
стекла.
Производство
бумаги
13. Значение солей угольной кислоты
В кулинариидля
разрыхления
теста
Питьевая
(пищевая)
cода
NaHCO3
В производстве
огнетушителей
В медицине
для
изготовления
лекарств
14. Общие химические свойства
1. Разложение при нагреванииMeCO3 → MeO + CО2 (исключ. карбонаты металлов I A группы)
MeHCO3 → MeСO3 + CO2 + h3O
2. Все соли взаимодействуют с кислотами – дают качественную реакцию на
ионы CO32- и HCO3 MeCO3 + HnKO → MeKO + CO2↑ + h3O
MeHCO3 + HnKO → MeKO + CO2↑ + h3O
3. Соли угольной кислоты вступают в реакции обмена с другими солями, если
образуются нерастворимые или малорастворимые вещества.
4. Карбонаты превращаются в гидрокарбонаты при избытке углекислого газа и
воды.
MeCO3 + CO2 + h3O → MeHCО3
Гидрокарбонаты обуславливают временную жесткость воды.
15. Способы устранения временной жесткости воды
1. КипячениеПри кипячении растворимые гидрокарбонаты кальция и
магния превращаются в нерастворимые карбонаты.

2. Добавление соды (Na2CO3)
Устраняется не только временная, но и постоянная
жесткость воды, создаваемая хлоридами и сульфатами
кальция и магния.
16. Установите соответствие между левыми и правыми частями уравнений
левые части уравненийправые части уравнений
нагревание
1)2KHCO3 =
а)K2SO4 + 2CO2 + 2h3O
нагревание
2)CaCO3 =
3)Na2CO3 + 2HCI =
4)СaCO3+CO2+h3O =
5)2KHCO3 + h3SO4 =
б)Ca(HCО3)2
в)K2CO3 + CO2 + h3O
г)CaO + CO2
д)2NaCI + CO2 + h3O
17. ответы
1-в2-г
3-д
4-б
5-а
19. Домашнее задание
§30 №6,7English Русский Правила
Углекислота и карбонатные соли
В химии угольная кислота определяется как двухосновная кислота, имеющая химическую формулу h3CO3. Это чистое соединение разлагается при температуре выше Ca, -80 ° C. В биохимии слово «угольная кислота» часто применяется к водным растворам углекислого газа, играющим важную роль в бикарбонатной буферной системе, которая используется для поддержания кислотно-щелочного гомеостаза.
Карбонатные соли являются негорючими материалами. Они действуют как слабые основания и, таким образом, участвуют в кислотно-щелочных реакциях, в результате которых выделяется тепло и выделяется CO2.
Структура и связь
Рассмотрим структуру и связь ионов карбоната.
Простейшим оксоуглеродным анионом является карбонат-ион. Он имеет тригональную плоскую структуру с одним атомом углерода, окруженным тремя атомами кислорода, с молекулярной симметрией D3h. Он также имеет общий формальный заряд 2,01 и молекулярную массу 60,01 г/моль. Это сопряженное основание иона гидрокарбоната (который является бикарбонатом), HCO-3, сопряженное основание h3CO3, угольной кислоты.
Структура Льюиса карбонат-иона имеет две (длинные) одинарные связи с отрицательными атомами кислорода и одну короткую двойную связь с нейтральным кислородом.
[Изображение будет загружено в ближайшее время]
Такое расположение несовместимо с наблюдаемой симметрией иона, что означает, что три связи имеют одинаковую длину и три атома кислорода считаются подобными. Как и в случае изоэлектронного нитрат-иона, симметрия может быть достигнута за счет резонанса между тремя структурами, приведенными ниже:
Как и в случае изоэлектронного нитрат-иона, симметрия может быть достигнута за счет резонанса между тремя структурами, приведенными ниже:
[Изображение будет загружено в ближайшее время]
Этот резонанс можно обобщить с помощью модели с делокализованными зарядами и дробными связями:
[Изображение будет загружено в ближайшее время]
Образование
Угольная кислота и карбонатные соли
Угольная кислота (с химической формулой h3CO3) может образовываться в небольших количествах при растворении ее двуокиси углерода (CO2), ангидрида, в воде.
CO 2 + H 2 O⇌ H 2 CO 3
Проще говоря, преобладающими видами могут быть слабогидратированные молекулы CO2. Угольную кислоту можно рассматривать как двухосновную кислоту, из которой могут быть образованы два ряда солей, а именно гидрокарбонаты, содержащие HCO3-, и карбонаты, содержащие CO32-.
H 2 CO 3 + H 2 O ⇌ H 3 O + + HCO 3 —
HCO 3 — 3 2 — + H + H 2 — — + H . 3 O + + CO 3 2-
Однако поведение кислотно-основной угольной кислоты зависит от различных скоростей некоторых вовлеченных реакций, а также их зависимости от pH системы. . Например, при рН ниже 8 основные реакции, включая их относительную скорость, представлены следующим образом:
CO 2 + H 2 O⇌H 2 CO 3 (slow)
H 2 CO 3 +OH — ⇌HCO 3 — + H 2 O (Fast)
Выше pH 10, реакции, приведенные ниже, важны:
CO 2 +OH — ⇌ HCO 3 — (медленное)
HCO 3 —
HCO 3 —
HCO 3 —
HCO 3 — + OH — ⇌CO 3 2- + H 2 O (быстро)
При значениях pH 8 и 10 все приведенные выше равновесные реакции являются значимыми.
Карбонатные и гидрокарбонатные соли
Эти специфические соли могут быть получены реакцией диоксида углерода с оксидами и гидроксидами металлов соответственно.
CO 2 + O 2 → CO 3 2-
CO 2 + OH — → HCO 3 —
например, SODIUDE). водный раствор насыщается углекислым газом, в растворе может образовываться гидрокарбонат натрия (NaHCO3).
Na + + OH — + CO 2 → Na + + HCO 3 —
Когда из него удаляют воду или также известное как бикарбонат натрия, твердое соединение пищевая сода. Например, когда при приготовлении пищи используется пищевая сода, которая вызывает подъем пирога или хлеба, этот эффект возникает из-за реакции основного аниона гидрокарбоната (HCO3-) с добавленной кислотой, такой как KHC4h5O6, гидротартрат калия. (винный камень) или дигидрофосфат кальция Ca(h3PO4)2.
(винный камень) или дигидрофосфат кальция Ca(h3PO4)2.
Пока сода сухая, реакции не происходит. При добавлении молока или воды происходит кислотно-щелочная нейтрализация с образованием воды и газообразного диоксида углерода. Затем CO2 задерживается в тесте, а при нагревании газ расширяется, создавая текстуру печенья и характеристики хлеба.
Карбонаты являются умеренно сильными основаниями. Водные растворы являются основными по той причине, что карбонатный анион может принимать ион водорода из воды.
СО 3 2- + H 2 O ⇌ HCO 3 — + OH —
Реакция кислот с карбонатами
кислоты и карбонаты металлов
Water, и Carbonxed Carbonde и Metal. когда кислоты реагируют с карбонатами, такими как карбонат кальция (содержится в известняке, меле и мраморе).
Кислота + Карбонат металла → Соль + Вода + CO 2
Серная кислота + Карбонат железа (II) → Сульфат железа (II) + Вода + CO 2
H 2 SO 4 + FECO 3 → FESO 4 + H 2 O + CO 2
Причины CO2 являются пузыряющими в срок. как шипение. Его можно обнаружить, пропуская газ через известковую воду, которая мутнеет.
как шипение. Его можно обнаружить, пропуская газ через известковую воду, которая мутнеет.
А реакция карбонатов металлов с кислотами экзотермическая (т.е. выделяется тепловая энергия).
Этот тип реакции можно использовать для проверки неизвестных растворов на предмет кислотности. Просто добавьте к раствору раствор карбоната натрия, и если выделяется углекислый газ, раствор становится кислым.
Этот тип реакции можно также использовать для проверки неизвестных растворов на присутствие ионов карбоната (то есть CO3–). Просто добавьте в раствор кислоту, и если появятся пузырьки CO2, раствор будет содержать ионы карбоната.
Гидрокарбонаты металлов
Гидрокарбонаты металлов представляют собой разновидность основания, которое также производит воду, соль и CO2 при взаимодействии с кислотой. Их также иногда называют бикарбонатами металлов.
Углекислота | НаркоБанк Онлайн
Все категории. Гипотетическая кислота из углекислого газа и воды. Он существует только в виде солей (карбонатов), кислых солей (гидрокарбонатов), аминов (карбаминовая кислота) и хлорангидридов (карбонилхлорид). (Из Химического словаря Гранта и Хака, 5-е изд.)
Он существует только в виде солей (карбонатов), кислых солей (гидрокарбонатов), аминов (карбаминовая кислота) и хлорангидридов (карбонилхлорид). (Из Химического словаря Гранта и Хака, 5-е изд.)

 п.
п. Известняк нейтрализует почвенные кислоты, при этом выделяется углекислый газ, повышая рыхлость почвы:
Известняк нейтрализует почвенные кислоты, при этом выделяется углекислый газ, повышая рыхлость почвы:
