Угольная кислота — frwiki.wiki
В этой статье представлены серьезные вопросы ( список ).
Вы можете помочь улучшить его или обсудить проблемы на его странице обсуждения .
- Эта статья не цитирует никаких источников и может содержать неверную информацию. Если у вас есть справочники или статьи или вы знаете качественные веб-сайты, посвященные обсуждаемой здесь теме, пожалуйста, завершите статью, указав ссылки, полезные для ее проверки, и соединив их с разделом « Примечания » и ссылками ». (Теги с апреля 2019 г.)
Угольная кислота представляет собой химическое соединение по формуле Н 2 СО 3. Это слабая кислота , сопряженными основаниями которой являются анионы HCO 3 —( бикарбонат ) и CO  Он образуется в воде , в частности , путем сольватации из двуокиси углерода :
Он образуется в воде , в частности , путем сольватации из двуокиси углерода :
- CO 2 (водн.)+ H 2 O (л) ⇌{\ displaystyle \ rightleftharpoons} H 2 CO 3 (водн.),
с константой равновесия в гидратной будучи стоит K ч = [Н 2 СО 3] / [CO 2] ≈ 1,70 × 10 -3 при 25 ° C , что означает, что угольная кислота является нестабильной молекулой, при этом очень небольшое количество молекул углекислого газа фактически гидратируется до угольной кислоты, как в газированной воде и крови .
Резюме
- 1 Кислотность
- 2 роль
- 2.1 Натуральный
- 2.2 Пищевая промышленность
- 3 Производные
- 4 Примечания и ссылки
- 5 См. Также
- 5.1 Связанные статьи
Кислотность
В водном растворе угольная кислота H 2 CO 3представляет собой двухосновную кислоту , т.е. она может дважды диссоциировать в воде, каждый раз высвобождая протон в виде катиона H 3 O + :
- H 2 O

- H 2 O+ HCO 3 —→ H 3 O ++ CO 3 2- : pK a2 = 10,32.
Когда угольная кислота соединяется с катионом , могут образовываться соли, называемые бикарбонатами и карбонатами . Например, в сочетании с известью ( гидроксид кальция ) он образует карбонат кальция (основной компонент известняка, мела ).
Роль
Естественный
С увеличением выбросов CO 2 в атмосферу мы можем заметить подкисление океанов ;
CO 2 + H 2 O → H 2 CO 3
Вода образует угольную кислоту, смешиваясь с CO 2, поглощаемым океанами. Эта кислота растворяет карбонат кальция , основное соединение моллюсков (сам планктон страдает от этого подкисления).
В разбавленном виде играет главную роль в образовании пещер .
Пищевая промышленность
Углекислота присутствует в безалкогольных напитках . В воде CO 2 образует угольную кислоту, которая вызывает покалывание на языке, усиливает вкус и действует как мягкий бактерицид. Он активирует прохождение пищи из желудка в кишечник.
Его использовали для консервирования мяса .
Производные
У угольной кислоты много производных, например:
- Карбаминовые кислоты ;
- Карбамиды или мочевины;
- Карбаматы или уретаны;
- Фосген .
Примечания и ссылки
- ↑ рассчитывается молекулярная масса от « атомных весов элементов 2007 » на www.chem.qmul.ac.uk .
- ↑ a b и c « Угольная кислота » , на www.reciprocalnet.org (по состоянию на 12 декабря 2009 г. )
Смотрите также
Статьи по Теме
- известняк
- бикарбонат
- карбонат
- углекислый газ
Водородные соединения | |
|---|---|
| HAsO 2 · H 3 AsO 3 · H 3 AsO 4 · HAt · HSO 3 F · HBF 4 · HBr · HBrO · HBrO 2 · HBrO 3 · HBrO 4 · HCl · HClO · HClO 2 · HClO 3 · HClO 4 · HCN · HCNO · H 2 CrO 4 / H 2 Cr 2 O 7 · H 2 CO 3 · H 2 CS 3 · HF · HFΟ · H 2 Hg · HI · HIO · HIO 2 · HIO 3 · HIO 4 · HMnO 4 · H 2 MoO 4 · HNC · HNCO · HNO · HNO 3 · H 2 N 2 O 2 · HNO 5 S · H 3 NSO 3 · H 2 O · H 2 O 2 · H 2 O 3 · H 3 O · H 3 PO 2 · H 3 PO 3 · H 3 PO 4 · H 4 P 2 O 7 · H 5 P 3 O 10 · H |
<img src=»https://fr.
Угольная кислота и её соли
- Знаете ли вы, что…..?
- 24 апреля 1833 года в США была запатентована газированная содовая вода. Впервые газированный напиток был получен в 1767 году гениальным английским химиком Джозефом Пристли . Он открыл одно из свойств диоксида углерода, с помощью которого и стало возможным производство газированной воды.
Состав газированной воды
- Газированную воду в бутылках обогащают СО 2 , который очищает воду от микробов. Углекислый газ также способствует увеличению сроков хранения воды и играет роль консерванта. Наличие в напитке или воде двуокиси углерода как консерванта отмечается на этикетке кодом Е290.
- При соединении углекислого газа с водой образуется угольная кислота .
Угольная кислота
- Химическая формула — H 2 CO 3
- Структурная формула – все связи ковалентные полярные
- Кислота слабая, существует только в водном растворе, очень непрочная, разлагается на углекислый газ и воду:
- CO 2 + H 2 O ↔ H 2 CO 3
- В ионных уравнениях записываем
- H 2 CO 3 ↔ H 2 O + CO 2
Угольная кислота
- Двухосновная, образует соли:
- -средние – карбонаты (ионы CO 3 2- )
- — кислые – гидрокарбонаты (ионы Н CO 3 — )
Угольная кислота H 2 CO 3
Соли
угольной
кислоты
Средние соли —
Кислые соли —
карбонаты
гидрокарбонаты
MeCO 3
MeHCO 3
Соли угольной кислоты
гидро карбонаты
карбонаты
- твёрдые кристаллические вещества.

- большинство из них в воде не растворяются
- Диссоциация: с образованием карбонат-анионов
- твёрдые кристаллические вещества.
- растворяются в воде
- Диссоциация: с образованием катиона водорода , карбонат-аниона .
Химические свойства карбонатов и гидрокарбонатов
1) Качественная реакция на CO 3 2- карбонат – ион «вскипание» при действии сильной кислоты :
Мел:
СаCO 3 + 2HCl = СaCl 2 + H
Питьевая сода:
NaНCO3 + HCl = NaCl + H 2 O + CO 2 ↑
Химические свойства карбонатов и гидрокарбонатов
2) Вступают в реакции обмена с другими растворимыми солями
Na 2 CO 3 + CaCl 2 = CaCO 3 ↓ + 2NaCl
Химические свойства карбонатов и гидрокарбонатов
3) Карбонаты и гидрокарбонаты могут превращаться друг в друга
Са(ОН) 2 + СО 2 = CaCO 3 ↓ + Н 2 О
СаСО 3 + СО 2 + Н 2 О = Са(НСО 3 ) 2
Химические свойства карбонатов и гидрокарбонатов
4) Разложение гидрокарбонатов и карбонатов при нагревании
2NaHCO 3 t˚C → Na 2 CO 3 + H 2 O + CO 2 ↑
CaCO 3 t˚C → CaO + CO 2 ↑
Качественные реакции
на карбонаты,
гидрокарбонаты
Питьевая сода
мел
CaCO 3
NaHCO 3
Чтобы проверить наличие карбонатов необходимо добавить любую кислоту
СаСО3 + 2Н+ ↔ Са2+ + Н2О + СО2↑
12
Красная пещера , или Кизил-Коба , самая крупная из 800 пещер Крыма. Она расположена в 3,5 км от села Перевальное в живописном урочище Кизил-Коба, которое является памятником природы и охраняется государством. Общая протяженность изученной части пещеры составляет 14 км. Не пройденная часть между пещерой Провал и Пятым обвальным залом — это еще примерно 3,5 км. Кизил-Коба – это сложный, запутанный лабиринт, расположенный в шесть этажей с амплитудой в 135 м. Возраст самого древнего шестого этажа около двух миллионов лет.
Она расположена в 3,5 км от села Перевальное в живописном урочище Кизил-Коба, которое является памятником природы и охраняется государством. Общая протяженность изученной части пещеры составляет 14 км. Не пройденная часть между пещерой Провал и Пятым обвальным залом — это еще примерно 3,5 км. Кизил-Коба – это сложный, запутанный лабиринт, расположенный в шесть этажей с амплитудой в 135 м. Возраст самого древнего шестого этажа около двух миллионов лет.
Сталагмиты
Сталактит «Пузатый»
Сталактит «Огненный»
Пещера «Эмине-Баир-Хосар» в Крыму
Сталактиты и сталагмиты в пещере Авшалом, Израиль
Памуккале — местность в Турции с геотермальными источниками, аналогов которым нет нигде в мире. Уникальный курорт и потрясающая природная достопримечательность находится на юго-западе страны, в 20 километрах от города Денизли. Комплекс из 17 минеральных источников, известный ещё с античных времён, внесён в список Всемирного наследия ЮНЕСКО и представляет собой окраину древнего вулканического плоскогорья, возвышающегося над равниной на 100 метров.
Комплекс из 17 минеральных источников, известный ещё с античных времён, внесён в список Всемирного наследия ЮНЕСКО и представляет собой окраину древнего вулканического плоскогорья, возвышающегося над равниной на 100 метров.
Применение солей угольной кислоты
Химическая формула вещества
Тривиальное (историческое) название
ZnCO 3
Современное название
Галмей
Na 2 CO 3
NaHCO 3
Применение вещества
Карбонат цинка
Кальцинированная сода
Na 2 CO 3 ·10H 2 O
Питьевая сода
Карбонат натрия
Производство красок.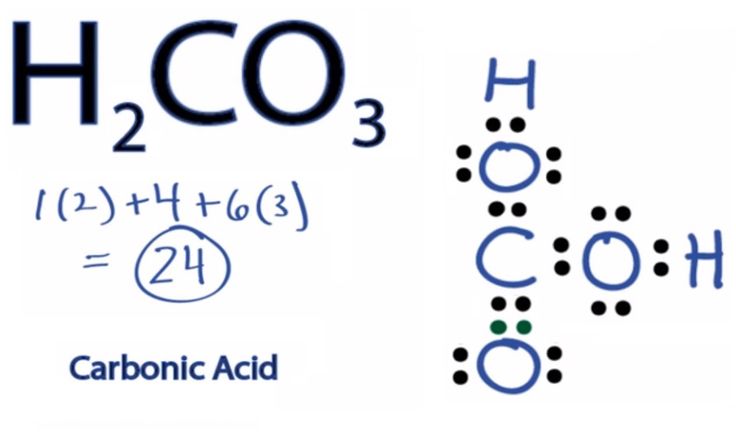
Умягчение воды, производство стекла.
Гидрокарбонат натрия
Кристаллическая сода
MgCO 3
В пищевой про-мышленности, в медицине.
Десятиводный гидрат карбоната натрия
Жжённая магнезия
Смесь MgCO 3 и CaCO 3 (1:1)
Для умягчения воды при стирке белья.
Карбонат магния
Доломит
(CuOH) 2 CO 3
В медицине.
Смесь карбонатов магния и кальция
Малахит
K 2 CO 3
CaCO 3
В строительстве.
Основной карбонат меди (II)
Поташ
Мел, мрамор, известняк
Поделки, ювелирные украшения.
Карбонат калия
Производство стекла, керамики, цемента, удобрение.
Карбонат кальция
Производство строительных материалов.
Домашнее задание: §31
углекислота-атаман kimya
Номер CAS: 463-79-6
EC Номер: 610-295-3
Молекулярная формула: CH3O3 (H3CO3)
Молекулярный вес: 62. 025
025
IUPAC Наименование: Carbonic Acid Anid
2
2
2
2
9 Углекислота представляет собой соединение элементов водорода, углерода и кислорода.
Углекислота образуется в небольших количествах при растворении ее ангидрида, двуокиси углерода (СО2), в воде.
В химии угольная кислота представляет собой двухосновную кислоту с химической формулой h3CO3.
Чистое соединение разлагается при температурах выше ок. −80 °С.
В биохимии и физиологии название «угольная кислота» часто применяется к водным растворам диоксида углерода, которые играют важную роль в бикарбонатной буферной системе, используемой для поддержания кислотно-щелочного гомеостаза
В водном растворе угольная кислота ведет себя как двухосновное кислота.
График Бьеррума показывает типичные равновесные концентрации в растворе, в морской воде, двуокиси углерода и различных производных от нее соединений в зависимости от рН.
Подкисление природных вод вызвано увеличением концентрации углекислого газа в атмосфере, что вызвано сжиганием все большего количества угля и углеводородов.
Ожидаемое изменение относится к прогнозируемому эффекту продолжающегося закисления океана.
Углекислота подсчитала, что увеличение растворенного диоксида углерода привело к снижению среднего значения рН поверхности океана примерно на 0,1 по сравнению с доиндустриальным уровнем.
База данных констант стабильности содержит 136 записей со значениями общих констант протонирования β1 и β2 карбонат-иона.
В небиологических растворах:
Константа равновесия гидратации при 25 °C называется Kh, которая в случае угольной кислоты составляет [h3CO3]/[CO2] ≈ 1,7×10–3 в чистой воде[9] и ≈ 1,2×10–3 в морской воде.
Следовательно, большая часть углекислого газа не превращается в угольную кислоту, оставаясь в виде молекул СО2.
В отсутствие катализатора равновесие достигается довольно медленно.
Константы скорости прямой реакции составляют 0,039 с–1, обратной – 23 с–1.
В природе известняк может реагировать с дождевой водой, образуя раствор бикарбоната кальция; выпаривание такого раствора приведет к повторному образованию твердого карбоната кальция.
Эти процессы происходят при образовании сталактитов и сталагмитов.
Использование термина «угольная кислота»:
Строго говоря, термин «угольная кислота» относится к химическому соединению с формулой h3CO3.
Поскольку pKa1 имеет значение ок. 6.8, при равновесии угольная кислота будет почти на 50% диссоциирована во внеклеточной жидкости (цитозоле), рН которой составляет около 7,2. Обратите внимание, что растворенный диоксид углерода во внеклеточной жидкости часто называют «угольной кислотой» в литературе по биохимии по историческим причинам.
Реакция, в которой он образуется HCO3− + H+ ⇌ CO2 + h3O, в биологических системах протекает быстро.
Углекислый газ можно описать как ангидрид угольной кислоты.
Чистая угольная кислота:
Угольная кислота, h3CO3, стабильна при температуре окружающей среды в строго безводных условиях.
Угольная кислота разлагается с образованием углекислого газа в присутствии любых молекул воды.
Углекислота образуется как побочный продукт облучения CO2/h3O, в дополнение к монооксиду углерода и радикалам (HCO и CO3).
Другим путем образования угольной кислоты является протонирование бикарбонатов (HCO3-) водным раствором HCl или HBr.
Это необходимо делать в криогенных условиях, чтобы избежать немедленного разложения h3CO3 на CO2 и h3O.
Аморфный h3CO3 образуется при температуре выше 120 K, а кристаллизация происходит при температуре выше 200 K с образованием «β-h3CO3», как определено с помощью инфракрасной спектроскопии.
Спектр β-h3CO3 очень хорошо согласуется со спектром побочного продукта после облучения CO2/h3O.
β-h3CO3 возгоняется при 230–260 К практически без разложения.
Инфракрасная спектроскопия с матричной изоляцией позволяет регистрировать одиночные молекулы h3CO3.
Тот факт, что угольная кислота может образовываться при облучении твердой смеси h3O + CO2 или даже при протонной имплантации только сухого льда, дал основания предположить, что h3CO3 можно найти в космосе или на Марсе, где замороженные льды h3O и CO2, а также космические лучи.
Удивительная стабильность сублимированного h3CO3 вплоть до довольно высоких температур 260 К допускает существование даже газообразного h3CO3, например, над полярными шапками Марса.
Расчеты ab initio показали, что одна молекула воды катализирует разложение газофазной молекулы угольной кислоты на углекислый газ и воду.
Предполагается, что в отсутствие воды диссоциация газообразной угольной кислоты будет очень медленной, с периодом полураспада в газовой фазе 180 000 лет при 300 К.
Это применимо только в том случае, если молекул мало и они находятся далеко друг от друга, потому что также было предсказано, что газообразная угольная кислота будет катализировать собственное разложение, образуя димеры, которые затем распадаются на две молекулы, каждая из которых состоит из воды и углекислого газа.
Утверждается, что твердая «α-угольная кислота» образуется криогенной реакцией бикарбоната калия и раствора HCl в метаноле.
Это утверждение было оспорено в докторской диссертации, представленной в январе 2014 года.
Вместо этого эксперименты по изотопной маркировке указывают на участие монометилового эфира угольной кислоты (САМЭ).
Кроме того, предполагалось, что сублимированное твердое вещество содержит мономеры и димеры CAME, а не мономеры и димеры h3CO3, как утверждалось ранее.
Последующие инфракрасные спектры с выделением матрицы подтвердили, что CAME, а не угольная кислота, находится в газовой фазе над «α-угольной кислотой».
Присвоение CAME дополнительно подтверждается матричным выделением вещества, полученного в газовой фазе путем пиролиза.
При высоком давлении:
Хотя молекулы h3CO3 не составляют значительной части растворенного углерода в водной «угольной кислоте» в условиях окружающей среды, значительные количества молекулярного h3CO3 могут существовать в водных растворах, находящихся под давлением в несколько гигапаскалей (десятки тысяч атмосфер), например может происходить в недрах планет.
Углекислота должна быть стабилизирована при давлениях 0,6–1,6 ГПа при 100 К и 0,75–1,75 ГПа при 300 К.
Эти давления достигаются в ядрах больших ледяных спутников, таких как Ганимед, Каллисто и Титан, где присутствуют вода и углекислый газ.
Чистая угольная кислота, будучи более плотной, погрузится под слои льда и отделит их от каменистых ядер этих спутников
Несмотря на сложную историю угольной кислоты, угольная кислота все еще может проявляться в виде отдельных полиморфов.
Углекислота образуется при окислении СО радикалами ОН.
Угольная кислота Неясно, следует ли рассматривать полученную таким образом угольную кислоту как γ-h3CO3.
Структуры β-h3CO3 и γ-h3CO3 кристаллографически не охарактеризованы.
Углекислота играет роль в формировании пещер и пещерных образований, таких как сталактиты и сталагмиты.
Самые большие и наиболее распространенные пещеры образуются в результате растворения известняка или доломита под действием воды, богатой углекислотой, полученной в результате недавних дождей.
Кальцит в сталактитах и сталагмитах происходит из вышележащего известняка вблизи границы раздела коренной породы и почвы.
Дождевая вода, просачиваясь через почву, поглощает углекислый газ из богатой углекислым газом почвы и образует разбавленный раствор угольной кислоты.
Когда эта кислая вода достигает основания почвы, она вступает в реакцию с кальцитом в известняковой породе и переводит часть его в раствор.
Вода продолжает свой нисходящий поток через узкие трещины и трещины в ненасыщенной зоне с незначительной дальнейшей химической реакцией.
Когда вода выходит из свода пещеры, углекислый газ теряется в атмосфере пещеры, а часть карбоната кальция выпадает в осадок.
Проникающая вода действует как кальцитовый насос, удаляя его с верхней части коренной породы и повторно откладывая в пещере внизу.
Углекислота играет важную роль в переносе углекислого газа кровью.
Углекислый газ поступает в кровь в тканях, потому что его местное парциальное давление больше, чем его парциальное давление в крови, протекающей через ткани.
Когда углекислый газ попадает в кровь, он соединяется с водой с образованием угольной кислоты, которая диссоциирует на ионы водорода (H+) и ионы бикарбоната (HCO3-).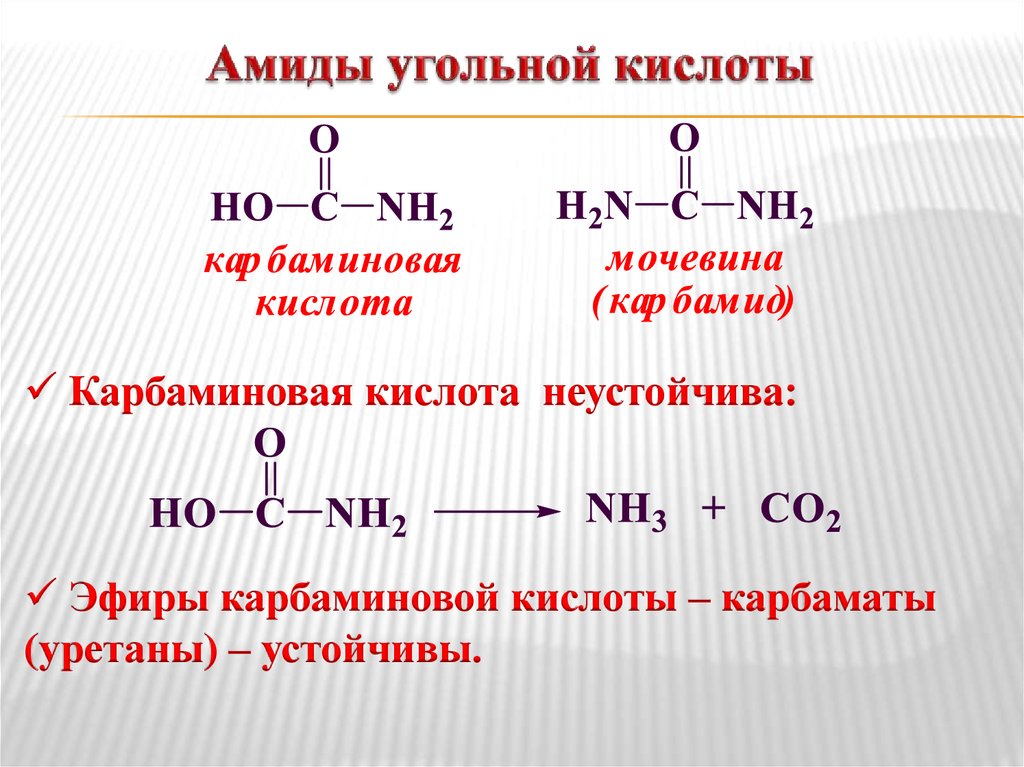
Высвобождаемые ионы водорода минимально влияют на кислотность крови, поскольку белки крови, особенно гемоглобин, являются эффективными буферными агентами.
Естественная конверсия диоксида углерода в угольную кислоту является относительно медленным процессом; однако карбоангидраза, белковый фермент, присутствующий внутри эритроцита, катализирует эту реакцию с достаточной скоростью, чтобы она выполнялась всего за долю секунды.
Поскольку фермент присутствует только внутри эритроцита, бикарбонат накапливается в нем в гораздо большей степени, чем в плазме.
Способность крови переносить углекислый газ в виде бикарбоната усиливается за счет системы переноса ионов внутри мембраны эритроцитов, которая одновременно перемещает ион бикарбоната из клетки в плазму в обмен на ион хлорида.
Одновременный обмен этих двух ионов, известный как сдвиг хлоридов, позволяет использовать плазму в качестве места хранения бикарбоната без изменения электрического заряда ни плазмы, ни эритроцита.
Только 26 процентов общего содержания углекислого газа в крови находится в виде бикарбоната внутри эритроцита, а 62 процента существует в виде бикарбоната в плазме; однако основная масса ионов бикарбоната сначала образуется внутри клетки, а затем транспортируется в плазму.
Обратная последовательность реакций возникает, когда кровь достигает легких, где парциальное давление углекислого газа ниже, чем в крови.
Угольная кислота представляет собой углеродсодержащее соединение, имеющее химическую формулу h3CO3.
Растворы углекислого газа в воде содержат небольшое количество этого соединения.
Химическая формула угольной кислоты также может быть записана как OC(OH)2, так как в этом соединении существует одна двойная связь углерод-кислород.
Углекислота часто описывается как респираторная кислота, поскольку это единственная кислота, которая выдыхается в газообразном состоянии легкими человека.
Угольная кислота является слабой кислотой и образует карбонатные и бикарбонатные соли.
h3CO3 может растворять известняк, что приводит к образованию бикарбоната кальция (Ca(HCO3)2.
Это причина многих особенностей известняка, таких как сталагмиты и сталактиты.
Препараты угольной кислоты:
Из приведенной выше иллюстрации можно понять, что структура угольной кислоты состоит из одной двойной связи углерод-кислород и двух одинарных связей углерод-кислород.
Атомы кислорода, участвующие в одинарной связи с углеродом, имеют по одному присоединенному к ним атому водорода.
Углекислота, образующаяся при растворении и гидролизе CO2 в воде, является основным естественным выщелачивающим агентом во многих экосистемах умеренного пояса.
Угольная кислота слаба и нестабильна и быстро диссоциирует на ионы водорода (H+) и ионы бикарбоната (HCO3–)
Углекислый газ при растворении в воде участвует в следующем химическом равновесии:
CO2 + h3O ⇌ h3CO3
Однако только небольшое количество диоксида углерода превращается в угольную кислоту в описанном выше химическом равновесии.
Физические свойства:
— Молярная масса угольной кислоты составляет 62,024 грамма на моль.
— Плотность углекислоты в стандартном состоянии составляет 1,668 грамма на кубический сантиметр.
— Соединение h3CO3 имеет значение pKa 6,35.
— Сопряженное основание, соответствующее угольной кислоте, представляет собой бикарбонат.
-Это соединение обычно существует в виде раствора. Однако сообщалось, что ученые НАСА подготовили твердые образцы h3CO3.
Химические свойства:
-h3CO3 является слабой кислотой и неустойчива по своей природе.
-Углекислота подвергается частичной диссоциации в присутствии воды с образованием ионов H+ и HCO3– (бикарбонат).
-Углекислота является двухосновной кислотой и, следовательно, может образовывать два типа солей, а именно бикарбонаты и карбонаты.
— Добавление небольшого количества основания к h3CO3 дает бикарбонатные соли, тогда как добавление основания в избытке дает карбонатные соли.
Угольная кислота Можно отметить, что угольную кислоту можно получить как побочный продукт промышленных процессов ферментации или сжигания ископаемого топлива в промышленных масштабах.
Использование угольной кислоты:
h3CO3 — очень важное соединение с широким спектром применения.
Некоторые из этих применений угольной кислоты перечислены ниже.
— Приготовление газированной воды, игристых вин и других газированных напитков связано с использованием угольной кислоты.
-Углекислота используется при осаждении многих солей аммония, таких как персульфат аммония.
-Углекислота помогает в транспортировке углекислого газа из организма.
— Различные основания, содержащие азот в сыворотке крови, протонируются с помощью h3CO3
.
— Стригущий лишай и другие дерматиты лечатся путем нанесения угольной кислоты на пораженный участок.
-Растворы, содержащие это соединение, очень эффективны при очистке контактных линз.
— Углекислоту можно употреблять перорально, чтобы вызвать рвоту, когда это необходимо (например, в случаях передозировки наркотиков).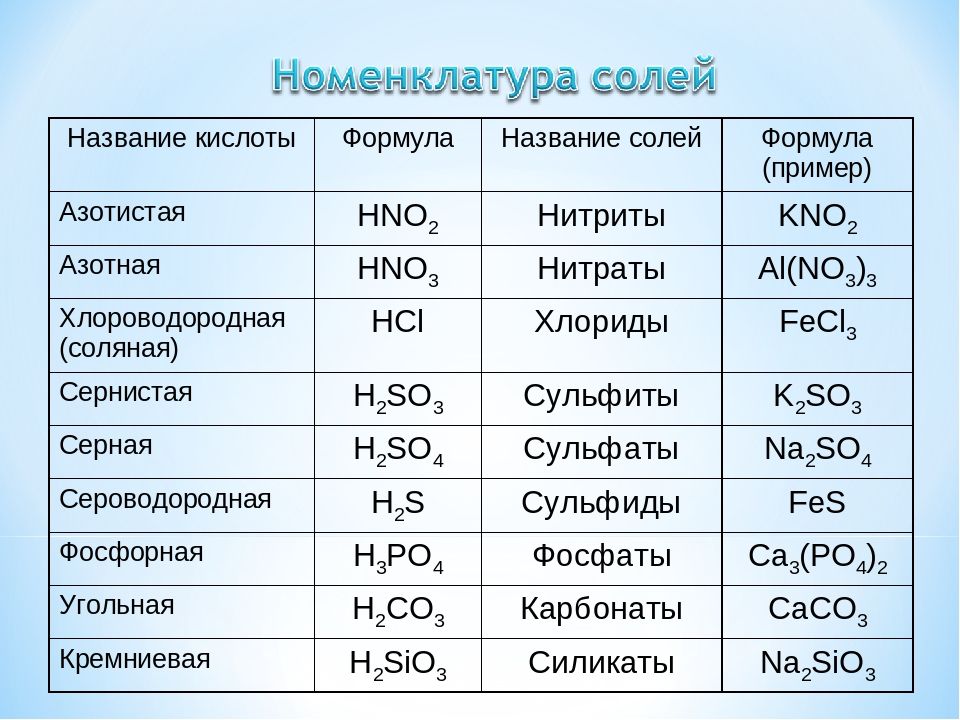
— Наиболее распространено использование угольной кислоты в виде солей.
— В крови: бикарбонат, форма соли угольной кислоты, действует как промежуточное звено для транспортировки CO2 из организма посредством дыхательного газообмена.
Углекислота также играет жизненно важную роль в протонировании многих азотистых оснований в сыворотке крови.
Углекислота является основным буферным элементом в организме человека и расщепляется на углекислый газ ферментом, называемым карбоангидразой.
— В напитках: угольная кислота широко используется для приготовления шипучих напитков.
-Для лечения дерматитов: обычно используется для лечения дерматитов, таких как стригущий лишай.
-Углекислота также используется в качестве жидкости для полоскания рта или вагинального душа.
— В случае отравления или передозировки препарата углекислота дается перорально для вызывания рвоты.
-Для очистки контактных линз очень эффективна углекислота, она также используется в качестве газа для сварки, пищевой промышленности и косметики.
Для гидролиза крахмала также используется угольная кислота.
Важность угольной кислоты в крови:
Известно, что ион бикарбоната является промежуточным звеном при транспортировке углекислого газа из организма человека в процессе дыхательного газообмена.
Реакции гидратации под действием диоксида углерода протекают довольно медленно, особенно в отсутствие подходящего катализатора.
Однако присутствие семейства ферментов, известных как карбоангидразы, в эритроцитах увеличивает скорость реакции.
Ферменты карбоангидразы катализируют превращение углекислого газа и воды в диссоциированные ионы угольной кислоты.
При этом образуются анионы бикарбоната, которые растворяются в плазме крови.
Катализируемая реакция в легких обращается вспять, что приводит к образованию СО2, который затем выдыхается.
Значение угольной кислоты в океанах:
Считается, что поглощение избытка углекислого газа в атмосфере (в основном из-за деятельности человека) океанами вызвало сдвиг pH океанской воды примерно на -0,1.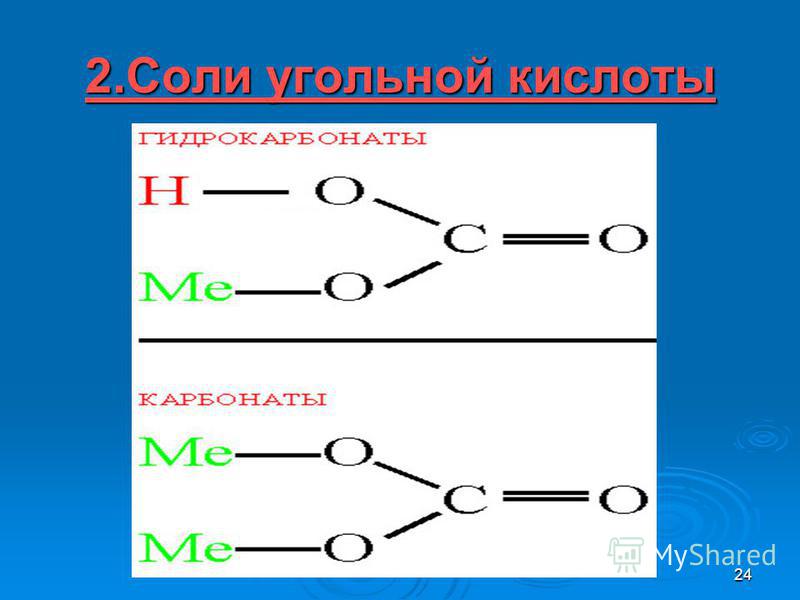
Поглощенный углекислый газ реагирует с океанской водой и образует h3CO3.
Этот процесс обычно называют подкислением океана.
Для чего используется угольная кислота?
Углекислота широко используется в производстве безалкогольных напитков, искусственно газированных игристых вин и других шипучих напитков.
Соли угольной кислоты называются гидрокарбонатами (или карбонатами водорода) и карбонатами.
Комментарий по кислотности угольной кислоты:
Угольная кислота представляет собой карбоновую кислоту, которая содержит замещенную гидроксильную группу.
Углекислота также является полипротонной кислотой.
Это соединение на самом деле является дипротонным и, следовательно, имеет два протона, которые диссоциируют от первичной исходной молекулы.
Следовательно, существуют две константы диссоциации, первая из которых предназначена для диссоциации на бикарбонат-ион.
Какова роль угольной кислоты в крови?
Бикарбонат является промежуточным звеном в обмене дыхательного газа для выведения CO2 из организма.
В целом реакция гидратации CO2 протекает очень медленно в отсутствие катализатора, но эритроциты содержат вещество, известное как карбоангидраза, которое увеличивает скорость реакции, создавая растворенный бикарбонат (HCO3-) в плазме крови.
Является ли угольная кислота сильной кислотой?
Нет, угольная кислота не является сильной кислотой.
h3CO3 — слабая кислота, диссоциирующая на протон (катион H+) и ион бикарбоната (анион HCO3-).
Это соединение лишь частично диссоциирует в водных растворах.
Кроме того, сопряженное основание угольной кислоты, которым является бикарбонат-ион, является относительно хорошим основанием.
Это причины, по которым угольная кислота классифицируется как слабая кислота, а не как сильная кислота.
Угольная кислота — слабая двухосновная кислота h3CO3, известная только в растворе, который реагирует с основаниями с образованием карбонатов.
Угольная кислота представляет собой оксокислоту углерода и халькоугольную кислоту.
Углекислота играет роль метаболита мыши.
Углекислота представляет собой сопряженную кислоту гидрокарбоната.
Гипотетическая кислота из углекислого газа и воды.
Угольная кислота существует только в виде солей (карбонатов), кислых солей (гидрокарбонатов), аминов (карбаминовая кислота) и хлорангидридов (карбонилхлорид).
Углекислота является причиной образования некоторых пещер.
Это происходит, когда дождевая вода соединяется с углекислым газом и образует угольную кислоту, которая вступает в реакцию с кальцием в известняке и со временем разрушает его.
Точно так же, как угольная кислота может разъедать известняк, она также может разъедать сталь.
Карбонат железа образуется при контакте угольной кислоты с некоторыми сталями.
Карбонат железа может вызвать более высокую скорость потери железа из основной стали, чем если бы карбонат железа не образовывался.
В относительно небольших количествах углекислота представляет собой химическое вещество, которое можно найти в таких источниках, как человеческая кровь, газированные напитки и даже дождевая вода.
Углекислота — это слабая кислота, которая образуется в результате реакции углекислого газа, растворенного в воде.
Давайте прогуляемся по закоулкам памяти и рассмотрим концепцию слабых кислот.
По определению, слабая кислота лишь частично ионизируется в растворе.
Другими словами, слабые кислоты не полностью диссоциируют или распадаются на ионы в растворе.
Используя диаграмму 1 в качестве примера (см. видео), допустим, вы решили поместить уксусную кислоту, компонент уксуса, в воду.
Одни молекулы уксусной кислоты распадаются, а другие нет.
Происходит частичная диссоциация в растворе.
Итак, что побуждает слабую кислоту диссоциировать?
Такие факторы, как сила слабой кислоты, могут влиять на эту степень диссоциации.
В отношении всех слабых кислот, таких как угольная кислота, следует помнить, что существует состояние равновесия между диссоциацией и рекомбинацией.
Точно так же, как вы видели, как эти молекулы уксусной кислоты распадаются в растворе при равновесии, те же самые кусочки могут повторно объединяться, образуя молекулы уксусной кислоты.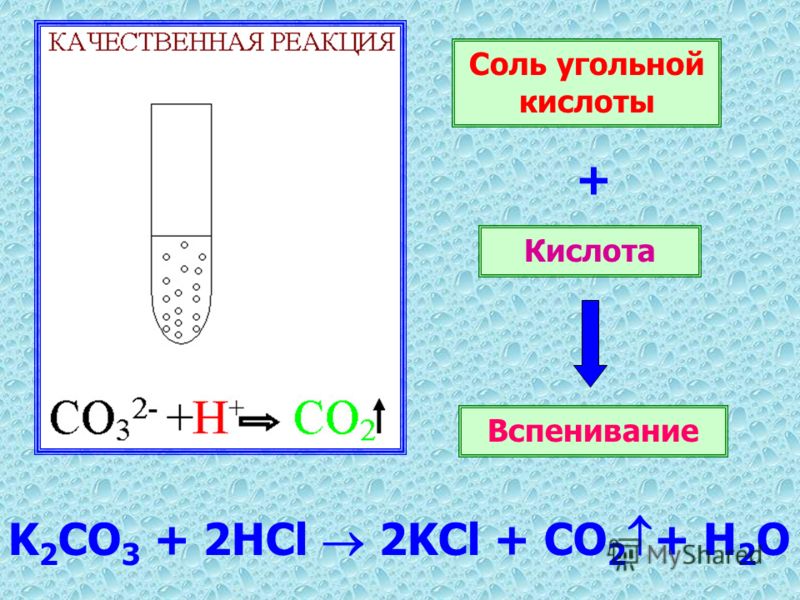
Это состояние равновесия между диссоциацией и рекомбинацией слабой кислоты важно, когда мы говорим об образовании угольной кислоты.
Химическая структура:
Химическая формула угольной кислоты: h3CO3.
Химическая структура углекислоты показана на диаграмме 2 (см. видео).
Вы можете видеть, что эта кислота состоит из карбоксильной группы (C=O) с двумя связанными гидроксильными группами (OH).
Поскольку в этой молекуле присутствует атом углерода, мы можем идентифицировать ее как органическое соединение.
Поскольку эта молекула также обладает кислотными свойствами, которые обсуждались ранее в отношении слабых кислот, мы можем назвать эту молекулу кислотой.
Угольная кислота представляет собой химическое соединение с химической формулой h3CO3 и молекулярной формулой Ch3O3. Это неорганическая слабая кислота, которая существует только в виде раствора.
Углекислота также известна как воздушная кислота, воздушная кислота или дигидрокарбонат.
Угольная кислота образует два вида солей: карбонаты и бикарбонаты.
Ph угольной кислоты составляет 4,68 в 1 мМ.
Углекислота является специфически двухпротонной кислотой, что означает, что она имеет два протона, которые могут диссоциировать от исходной молекулы.
Таким образом, есть две константы диссоциации, первая для диссоциации иона бикарбоната и вторая для диссоциации иона бикарбоната в ион карбоната.
СОБЫТИЕ:
Углекислота присутствует в крови в организме человека.
Углекислота образуется в организме человека при растворении воды с углекислым газом.
Углекислота также присутствует в:
-дождевая вода
-кальцит
-ферментация
-уголь
-подземные воды
-метеоры
-вулканы
-аминокислоты
-белки
-океаны
-растения
-эритроциты
— месторождения серы
-соли
-caves
Гидрокарбонат, также известный как h3CO3 или [co(OH)2], относится к классу органических соединений, известных как органические угольные кислоты.
Органические угольные кислоты представляют собой соединения, содержащие функциональную группу угольной кислоты.
Бикарбонат также регулирует pH в тонком кишечнике.
Гидрокарбонат представляет собой очень слабокислотное соединение (исходя из его pKa).
Параллельным примером является бисульфит натрия (NaHSO3).
Карбонат водорода присутствует во всех живых организмах, от бактерий до человека.
У людей гидрокарбонат участвует в метаболическом расстройстве, называемом путем расстройства Хартнапа.
Вне человеческого тела карбонат водорода был обнаружен, но не определен количественно, в нескольких различных продуктах, таких как любисток, лимская фасоль, древовидный папоротник, горный ямс и налим.
Это может сделать гидрокарбонат потенциальным биомаркером потребления этих продуктов.
Таким образом, он является важным поглотителем в углеродном цикле.
Углекислота изоэлектронна азотной кислоте HNO3.
Угольная кислота Относится к классу органических соединений, известных как органические угольные кислоты.
Органические угольные кислоты представляют собой соединения, содержащие функциональную группу угольной кислоты.
Заместители:
-угольная кислота
-Органическое кислородное соединение
-Органический оксид
— Углеводородная производная
-Органическое кислородное соединение
-Карбонильная группа
-Алифатическое ациклическое соединение
ФИЗИЧЕСКИЕ СВОЙСТВА УГОЛЬНОЙ КИСЛОТЫ:
-Молекулярный вес: 62,025
-Точная масса: 62,000393922
-Моозотопическая масса: 62,000393922
-Topological Polar Preate: 57,5 Ų
-ФИЗИЧЕСКОЕ ОПИСАНИЕ: Сплошной
-Color: Бесплатный
-Melting Point: 720 ° C
-SOLability: Свободное солеточнее вода. В этаноле
-Solubility в воде: 12,8 мг/мл
-Полярная площадь поверхности: 57,53 Ų
-растворимость водой: 231 г/л
-Logp: 0,6
-Logp: 0,25
-Logs: 0,57
-Logp: 0,25
-Logs: 0,577
-pKa (сильнейшая кислота): 6.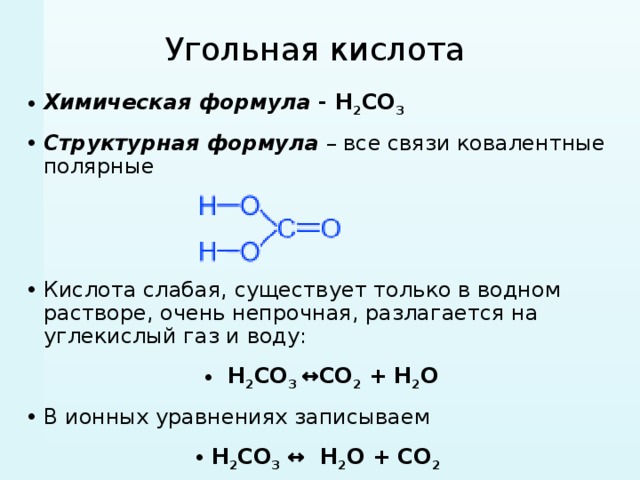 05
05
Угольная кислота — неорганическое соединение с формулой h3CO3.
Углекислота состоит из воды и углекислого газа.
Углекислота имеет молярную массу около 62 г/моль.
Углекислота, хотя и относительно слабая по сравнению с другими кислотами, может вызывать коррозию в зависимости от химического состава материала.
Углекислота является одной из наиболее распространенных причин низкого уровня pH в воде.
Угольная кислота является очень распространенным типом кислоты из-за обилия углекислого газа и воды.
Углекислота уникальна тем, что содержит углерод, но является неорганическим соединением.
Углекислота обнаружена в кровотоке.
Углекислый газ в крови связывается с водой в крови.
Углекислота также широко используется для газирования напитков.
Углекислота также имеет много других промышленных применений.
ХИМИЧЕСКИЕ СВОЙСТВА УГОЛЬНОЙ КИСЛОТЫ:
-XLogP3-AA: -0,1
-Количество акцепторов водородной связи: 3
-ROTATABLE CONCE: 0
-HEAVY ATOM COUNT: 4
-Формальный заряд: 0
-Complexity: 26,3
-зотоп. Количество атомов: 0
Количество атомов: 0
-определенные стереоцентровые стереоцентеры: 0
-UNDEFINED. Счетчик стереоцентров атома: 0
— Счетчик стереоцентров определенной связи: 0
— Счетчик стереоцентров неопределенной связи: 0
— Счетчик ковалентно-связанных единиц: 1
— Канонизированное соединение: Да
— Преломление: 9,5 м³·моль⁻¹
— Поляризуемость: 4,23 ų
ХРАНЕНИЕ УГОЛЬНОЙ КИСЛОТЫ:
— Углекислоту следует хранить в пластиковых бутылях.
— Угольная кислота должна храниться в сухом месте.
-Углекислоту следует хранить в проветриваемых помещениях.
— Углекислота должна быть в сухих и чистых контейнерах.
-Углекислота должна храниться при постоянной температуре.
-Углекислота должна находиться под постоянным давлением.
— Углекислота Следует хранить отдельно от сильных оснований.
— Угольную кислоту следует хранить вдали от непосредственных реагентов.
СИНОНИМЫ:
Гидроксимуравьиная кислота
Гидроксиметановая кислота
Дигидроксикарбонил
угольная кислота
гидроксикетон
гидроксикетон
гидроксидиоксидоуглерод(. )
)
Ацидозан
Джусонин
Солудал
Мейлон
Нойт
компонент Col-Evac
Кристалл карбонат
Кальцинированная сода
компонент Pretts
Гидрокарбонат натрия
Дигидрокарбонат
дигидроксикетон
гидроксикетон
Коленсор
гидроксилкетон
Углекислота-
бикарбонат водорода
водородугольная кислота
дигидроксиоксидоуглерод
гидроксикарбоновая кислота
гидрогентриоксокарбонат
Каковы свойства и области применения угольной кислоты?
Когда вы берете в руки бутылку с газированным напитком, вполне вероятно, что вы найдете на ее этикетке характерный ингредиент — здесь речь идет о H 2 CO 3 , то есть углекислоте. Применение и свойства этого химического соединения заслуживают внимания, так как это одна из самых нестабильных и в то же время самых популярных кислот, нашедших широкое применение в пищевой промышленности и за ее пределами.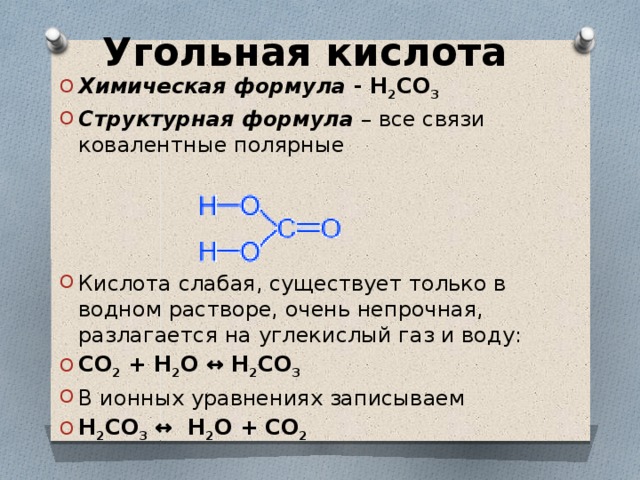 Что нужно знать об углекислоте? Вот немного полезной информации.
Что нужно знать об углекислоте? Вот немного полезной информации.
Производство и разложение угольной кислоты
Процесс производства угольной кислоты не сложен. Он также не требует слишком большого количества ингредиентов или использования передовых технологий. Как производится H 2 CO 3 или угольная кислота? Структурная формула этого химического вещества указывает на то, что оно образуется при растворении двуокиси углерода (CO 2 ) в воде (H 2 O). Химическое вещество, полученное в ходе этой реакции, проявляет несколько специфических свойств, которые мы обсудим ниже.
Свойства угольной кислоты
Что следует знать о физических и химических свойствах угольной кислоты ? Это соединение:
- очень слабое и нестабильное,
- без запаха,
- жидкий,
- имеет слабокислый вкус,
- существует только в разбавленных растворах,
- легко разлагается до воды и углекислого газа,
- цвета метиловый оранжевый красный,
- образует соли угольной кислоты (карбонаты).

Двухосновная кислота H 2 CO 3 образует два типа солей: кислые (бикарбонаты) и нейтральные. Кроме того, угольную кислоту нельзя производить в концентрированной форме. Современные ученые также установили, что угольную кислоту можно получить в газообразной форме в следовых количествах, хотя это очень трудная задача.
Что такое диссоциация угольной кислоты?Угольная кислота в водных растворах постепенно разлагается. Это явление называется ионной диссоциацией. Это двухстадийный процесс, который состоит в постепенном отсоединении ионов водорода – сначала отпадает один катион, затем другой. В результате диссоциации весь химикат распадается на 2 положительных иона водорода и отрицательные ионы карбоната.
Возникновение и применение угольной кислоты
Угольная кислота отличается тем, что она встречается только в водных растворах. Это свойство было использовано более 200 лет назад первыми производителями газировки, которые придумали пропускать углекислый газ через воду. СО 2 получен в результате реакции уксусной кислоты с бикарбонатом натрия (пищевой содой). После насыщения им воды выяснилось, что газированный напиток гораздо более освежает, чем любой другой известный безалкогольный напиток.
СО 2 получен в результате реакции уксусной кислоты с бикарбонатом натрия (пищевой содой). После насыщения им воды выяснилось, что газированный напиток гораздо более освежает, чем любой другой известный безалкогольный напиток.
В настоящее время диапазон применения угольной кислоты (H 2 CO 3 ) в производстве газированных напитков очень широк. Можно с уверенностью сказать, что без этого ингредиента мы бы никогда не узнали вкус культовых напитков, таких как классическая газированная вода, газированная минеральная вода или безалкогольные газированные напитки, такие как апельсинад, кока-кола, пепси или спрайт.
Углекислота также находит применение в лабораториях химической промышленности, а также в косметологии – она используется для приготовления передовых процедур очищения и омоложения кожи. В медицине это соединение используется, например, в здравницах для приготовления углекислых ванн (рекомендуется в основном гипертоникам и больным сердечно-сосудистыми заболеваниями).



