Открытое учебное занятие по теме «Угольная кислота и ее соли»
Тема: Угольная кислота и ее соли
Цель: познакомить учащихся с особенностями угольной кислоты; основными её природными соединениями.
Задачи:
1. изучить химические свойства и применение солей угольной кислоты – карбонатов и гидрокарбонатов;
2.содействовать развитию мышления, способствовать формированию приемов учебной работы, умение работать с информацией;
3.содействовать воспитанию доброжелательного отношения друг к другу, чувства взаимопомощи и сотрудничества.
Тип урока: урок формирования новых знаний и умений.
Метод: словесный, наглядный, практический.
Средства обучения: учебник, презентация, коллекция солей карбоната кальция.
Технологическая карта
Этап урока | Деятельность учителя | Деятельность учеников |
| Приветствие, проверка готовности к учебному занятию, проверка отсутствующих | Приветствие, подготовка к учебному занятию |
2. (3 мин) 2.2.Мотивация (1 мин) | Предлагает найти соответствие Мотивирует на изучение новой темы, обеспечивает включение учащихся в изучение новой темы | Работу выполняет весь класс Осмысливают, анализируют тему |
(27 мин) 3.1.Состав и свойства угольной кислоты (7 мин) 3.2.Химические свойства солей угольной кислоты (9 мин) 3.3.Физминутка (2 мин) 3.4.Превращения карбонатов и гидрокарбонатов (5 мин) 3.5.Применение солей угольной кислоты (4 мин) | Рассказывает про строение и свойства угольной кислоты Записывает химические свойства Предлагает сделать зарядку для рук и глаз Записывает уравнения химических реакций Предлагает работу в группах | Слушают учителя, записывают в тетради Слушают, записывают Выполняет зарядку для глаз и рук Слушают, записывают Работают в группах, слушают выступление других учащихся |
4. | Предлагает ответить на тест, составить уравнения химических реакций | Работают в тетрадях, отвечают на вопросы, составляют уравнения |
5.Домашнее задание (1 мин) | Объясняет выполнение домашнего задания | Записывают домашнее задание в дневники |
6.Рефлексия (2 мин) | Организует рефлексию деятельности | Оценивают свою работу на уроке |
План-конспект
1.Организационный момент (1 мин)
Приветствие, перед началом учебного занятия я пожелаю вам хорошего настроения и творческих успехов, надеюсь, что наше занятие пройдёт плодотворно.
2. Актуализация знаний (4 мин)
Актуализация знаний (4 мин)
2.1. Проверка домашнего задания (3 мин)
«Фронтальный опрос класса»:
1) Перечислите элементы IVА – группы?
2) Чему равна max и min степени окисления неметаллов IVА – группы?
3) Углерод в виде каких простых веществ может существовать?
4) Какие оксиды образует углерод?
2.2.Мотивация (1 мин)
Мы сегодня с вами познакомимся с кислотой, которую образует углекислый газ. Как вы думаете, что это за кислота?
Угольная кислота – это тот редкий случай вещества, формулу которого принято считать условной, т. е. такой молекулы не существует, однако возможно рассматривать не только свойства её соединений, но и собственные свойства этой кислоты.
3.Формирование новых знаний (27 мин)
3.1.Состав и свойства угольной кислоты (7 мин)
Химическая формула – H2CO3.
Структурная формула – все связи ковалентные полярные:
Кислота слабая, существует только в водном растворе, очень не прочная, разлагается на углекислый газ и воду:
H2CO3↔ CO2↑ + H2O
Получение угольной кислоты:
– действием соляной кислоты на мрамор — карбонат кальция.
Просмотр видеоролика «Получение угольной кислоты»
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O.
Угольная кислота – двухосновная кислота, диссоциирует слабо в две ступени:
H2CO3 ↔ H+ + HCO3—(гидрокарбонат-ион)
HCO3— ↔ H+ + CO32- (карбонат-ион)
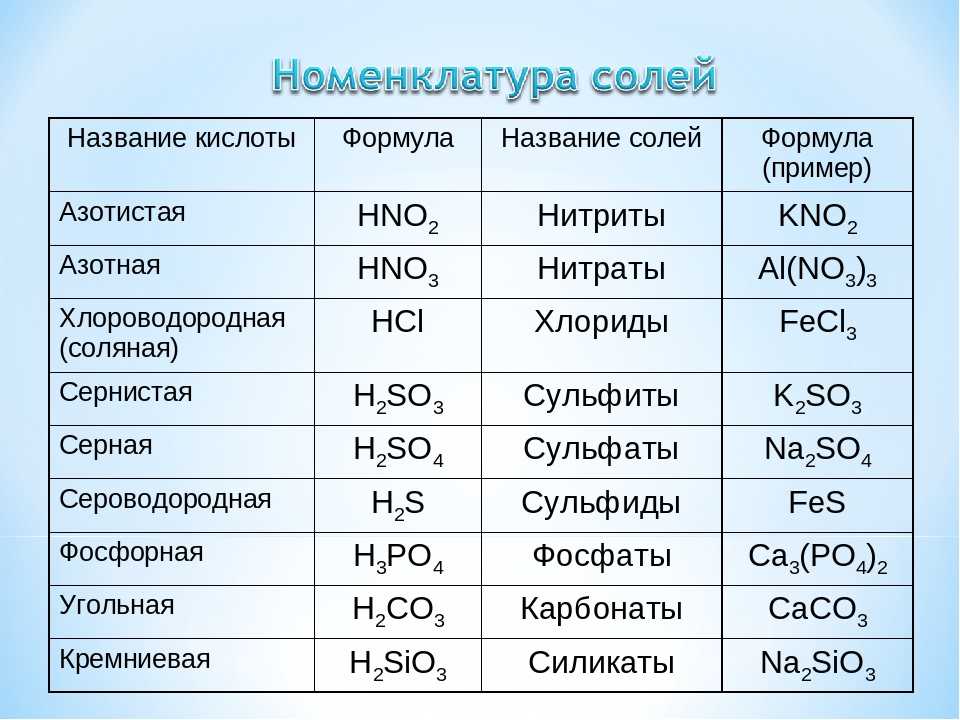
Соли угольной кислоты
средние кислые
карбонат – ион CO32- гидрокарбонат – ион HCO3—
3. 2.Химические свойства солей угольной кислоты (9 мин)
2.Химические свойства солей угольной кислоты (9 мин)
Соли угольной кислоты, кроме карбонатов большинства щелочных металлов, при нагревании разлагаются с выделением углекислого газа:
CaCO3 t˚C → CaO+ CO2↑
2NaHCO3 t˚C → Na2CO3 + H2O + CO2↑
Лабораторный опыт № 2
Обнаружение карбонат-ионов
HCl
CaCO3 Na2CO3
а) CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ – качественная реакция;
CaCO3 + 2H+ + 2Cl— = Ca2+ + 2Cl— + H2O + CO2↑;
СаCO3 + 2H+ = Ca2+ + H2O + CO2↑.
б) Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑;
2Na+ + CO32- + 2H+ + 2Cl— = 2Na+ + 2Cl— + H2O + CO2↑;
CO32- + 2H+ = H2O + CO2↑.
Выводы: соли угольной кислоты взаимодействуют с соляной кислотой с выделением углекислого газа.
3.3.Физминутка (2 мин)
3.4.Превращения карбонатов и гидрокарбонатов (5 мин)
Пропускаем через раствор гидроксида кальция углекислый газ, получается нерастворимый карбонат кальция:
Ca(OH)2 + CO2 = CaCO3 ↓ + H2O
Нерастворимый карбонат превращается в растворимый гидрокарбонат при пропускании через раствор углекислого газа:
CaCO3 + CO2 + H2O ↔ Ca(HCO3)2
При нагревании раствора гидрокарбоната выделяется углекислый газ, и вновь образуется нерастворимый карбонат кальция:
Ca(HCO3)2 = CaCO3↓ + CO2 + H2O
3.5.Применение солей угольной кислоты (4 мин)
Практическое значение природных карбонатов
Формула | Химическое название | Области применения |
Na2CO3 | карбонат натрия | -производство мыла, стекла; -получение неорганических красителей. |
NaHCO3 | гидрокарбонат натрия | -в быту; -пищевой промышленности. |
СаCO3 | карбонат кальция | в строительстве в качестве облицовочных и архитектурно-строительных материалов. |
4.Закрепление новых знаний (10 мин)
Задание 1. Продолжите уравнения химических реакций:
а) ВаСО3 t˚C →
б) Са(ОН)2 + СО2 =
в) BaCO3 + CO2 + H2O =
Задание 2. Тест «Угольная кислота и ее соли»:
1. Угольная кислота изменяет окраску лакмуса в:
а) малиновый;
б) красный;
в) оранжевый;
г) синий.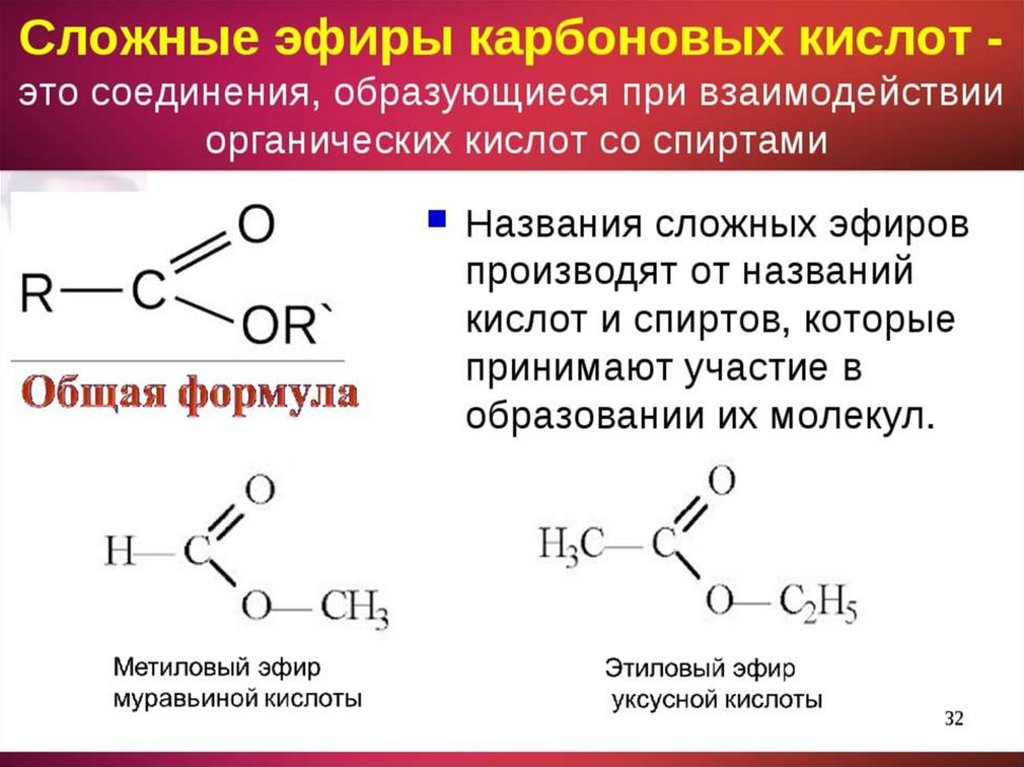
2. Как называются соли угольной кислоты:
а) силикаты;
б) фосфаты;
в) сульфаты;
г) карбонаты.
3. Формула питьевой соды:
а) CaCO3;
б) NaHCO3;
в) Na2CO3 ∙ 10H2O;
г) Na2CO3.
4. Угольная кислота диссоциирует ступенчато в:
а) 1 стадию;
б) 3 стадии;
в) 2 стадии.
5. Какой кислотный оксид соответствует угольной кислоте:
а) CO2;
б) CO.
Ответы к тесту:
1. б
2. г
3. б
4. в
5. a
a
5.Домашнее задание (1 мин)
§17 упр.8,9 стр.72.
6.Рефлексия (2 мин)
Закончите предложения:
На сегодняшнем уроке я понял, я узнал…….
Было интересно……
Я научился……
После урока мне захотелось…..
Было трудно……
Меня удивило……
Углерод: формула, химические свойства, характеристики
Поможем понять и полюбить химию
Начать учиться
В этой статье мы дадим характеристику углерода с точки зрения химии: узнаем, металл это или неметалл, какими свойствами он обладает, с какими веществами реагирует и где находят применение различные модификации углерода.
Углерод — это химический элемент, неметалл, расположенный в таблице Д.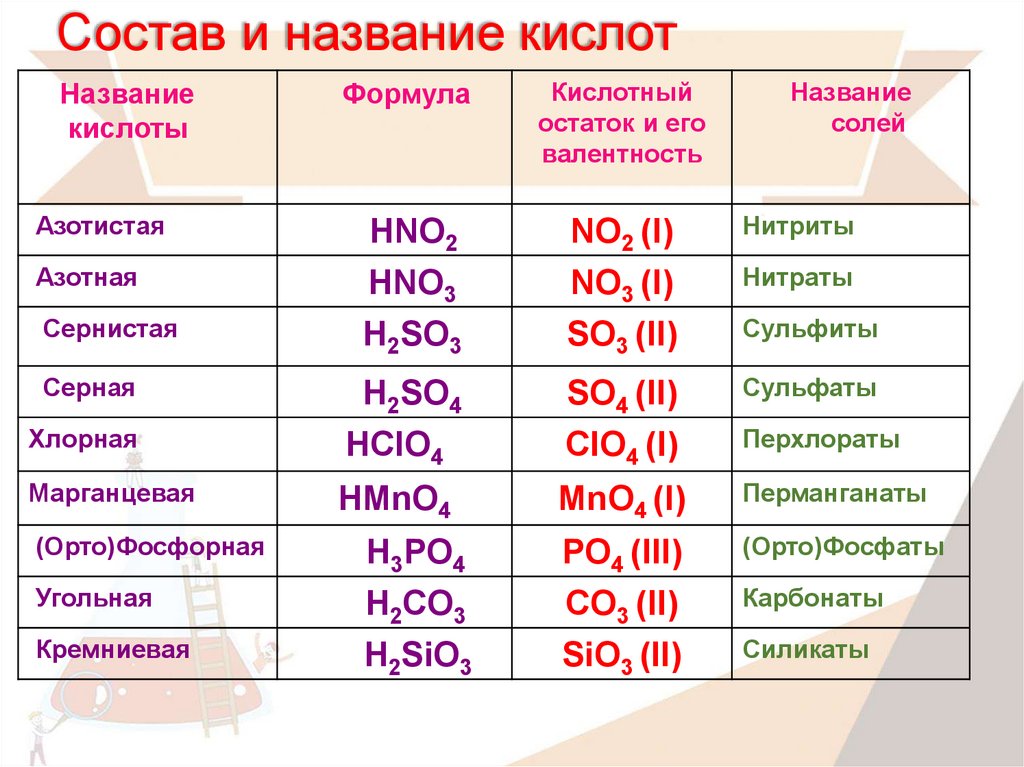 И. Менделеева в главной подгруппе IV группы, во 2-м периоде, имеет порядковый номер 6.
И. Менделеева в главной подгруппе IV группы, во 2-м периоде, имеет порядковый номер 6.
Агрегатное состояние углерода при нормальных условиях — твердое вещество с атомной кристаллической решеткой. Молекула углерода одноатомна. Химическая формула углерода — С.
Строение углерода
Несмотря на наличие двух неспаренных электронов на внешнем уровне, в большинстве химических соединений углерод четырехвалентен. Возможность образовывать четыре связи углерод получает при переходе одного электрона из состояния 2s в 2р — происходит «распаривание», т. е. переход атома углерода из нейтрального состояния в возбужденное. Этому возбужденному состоянию атома углерода соответствует электронная конфигурация 1s 22s12p3.
е. переход атома углерода из нейтрального состояния в возбужденное. Этому возбужденному состоянию атома углерода соответствует электронная конфигурация 1s 22s12p3.
Возможные валентности: II, IV.
Возможные степени окисления: −4, 0, +2, +4.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Аллотропия углерода
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Выделяют два вида углерода в зависимости от образования модификаций:
Кристаллический углерод входит в состав твердых веществ (алмаз, графит, графен, фуллерен, карбин).

Рассмотрим подробнее основные аллотропные модификации углерода, их физические свойства и применение.
Алмаз
Алмаз — трехмерный полимер, бесцветное кристаллическое вещество, самый твердый природный минерал, имеет высокую теплопроводность. Его используют в промышленности для обработки различных твердых материалов, для бурения горных пород. Несмотря на то что алмаз твердый, в то же время он хрупкий. Получающийся при измельчении алмаза порошок применяют для шлифовки драгоценных камней. Хорошо отшлифованные прозрачные алмазы называют бриллиантами.
В кристаллической решетке атомы углерода связаны ковалентной связью. Расстояние между всеми атомами одинаковое, поэтому связи прочные по всем направлениям.
Одно из уникальных свойств алмазов — способность преломлять свет (люминесценция).
В промышленных масштабах алмазы получают при высоком давлении (тысячи МПа) и высоких температурах (1 500–3 000 °С). Процесс протекает в присутствии катализатора (например, Ni).
При нагревании алмаза до 1 000 °С и высоком давлении без доступа воздуха получают графит. При температуре 1 750 °С переход из алмаза в графит протекает существенно быстрее. При прокаливании в кислороде алмаз сгорает, образуя диоксид углерода.
Графит
Графит — темно-серое мягкое кристаллическое вещество со слабым металлическим блеском. Хорошо электро- и теплопроводен, стоек при нагревании в вакууме. Имеет слоистую структуру. На поверхности оставляет черные черты.
Графит термодинамически устойчив, поэтому в расчетах термодинамических величин он принимается в качестве стандартного состояния углерода.
На воздухе графит не загорается даже при сильном накаливании, но легко сгорает в чистом кислороде с образованием диоксида углерода.
При температуре 3 000 °С в электрических печах получают искусственный графит из лучших сортов каменного угля.
Графен
Графен представляет собой монослой графита. Впервые графен был получен ручным механическим отщеплением в лабораторных условиях, что не предполагает широкого производства.
В более крупных масштабах графен получают при помощи нагревания кремниевых пластин, верхний слой которых состоит из карбида кремния. Под действием высоких температур происходит отщепление атомов углерода, которые остаются на пластинке в виде графена, а кремний испаряется. Графен представляет собой тонкое и прочное вещество с высокой электропроводностью. В настоящее время он широко используется в микроэлектронике и автомобилестроении.
Графен представляет собой тонкое и прочное вещество с высокой электропроводностью. В настоящее время он широко используется в микроэлектронике и автомобилестроении.
Карбин
Карбин — твердое черное вещество. Состоит из линейных полимерных цепей, которые соединены чередующимися одинарными и тройными связями в линейные цепочки: −С≡С−С≡С−С≡С−.
Впервые карбин был открыт в 60-х годах, но его существование не признавали до тех пор, пока его не обнаружили в природе — в метеоритном веществе.
Карбин — полупроводник, под действием света его проводимость сильно увеличивается. Переход в графит возможен при нагревании до 2 300 °С.
Карбин применяют в медицине для изготовления искусственных кровеносных сосудов.
Уголь
Уголь — мельчайшие кристаллики графита, полученные путем термического разложения углеродсодержащих соединений без доступа воздуха.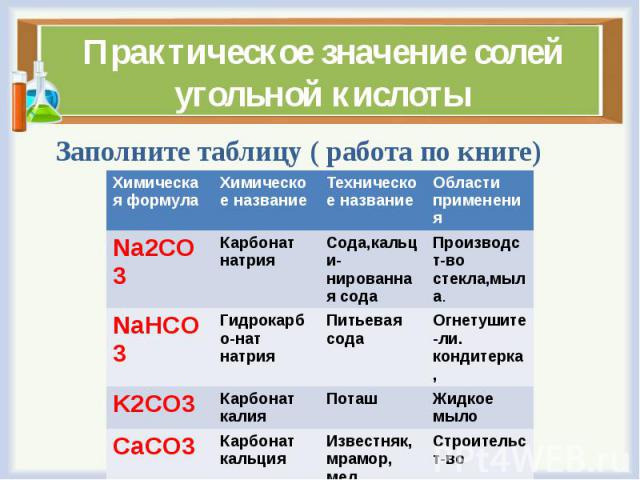
Угли имеют разные свойства в зависимости от веществ, из которых получены. Наиболее важные сорта угля — кокс, древесный уголь, сажа.
Кокс получается при нагревании каменного угля без доступа воздуха. Применяется в металлургии при выплавке металлов из руд.
Древесный уголь
образуется при нагревании дерева без доступа воздуха. Благодаря пористому строению он обладает высокой адсорбционной способностью.Сажа — очень мелкий графитовый кристаллический порошок. Образуется при сжигании углеводородов (природного газа, ацетилена, скипидара и др.) с ограниченным доступом воздуха.
Активные угли — пористые промышленные адсорбенты, получаемые из твердого топлива, дерева и продуктов его переработки. Применяются для поглощения паров летучих жидкостей из воздуха.
Применяются для поглощения паров летучих жидкостей из воздуха.
Сравнение основных аллотропных модификаций углерода
Нахождение углерода в природе
Согласно справочнику Дж. Эмсли «Элементы», углерод занимает 11-е место по распространенности в природе. Содержание углерода составляет 0,1% массы земной коры. Свободный углерод представлен в виде алмаза и графита.
Основная масса углерода существует в виде природных карбонатов кальция CaCO3 (мела, мрамора, известняка) и магния MgCO3, а также горючих ископаемых.
Доля углерода в составе горючих ископаемых
Название | Содержание углерода |
|---|---|
Антрацит | 93% |
Бурые угли | 72% |
Каменные угли | 84% |
Горючие сланцы | 60% |
| Нефть | 80% |
Горючие природные газы | До 99% метана |
Торф | 50% |
В атмосфере находится в виде диоксида углерода СО2 (~0,03%). В воде углерод содержится в составе растворимых гидрокарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2. Углерод входит в состав растений и животных (~20%).
В воде углерод содержится в составе растворимых гидрокарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2. Углерод входит в состав растений и животных (~20%).
Химические свойства углерода
Взаимодействие со фтором
Углерод обладает низкой реакционной способностью и из галогенов реагирует только со фтором:
С + 2F2 = CF4.
Взаимодействие с кислородом
При нагревании взаимодействует с кислородом, образуя оксиды СО и СО2:
2С + О2 = 2СО;
С + О2 = СО2.
Взаимодействие с другими неметаллами
Реагирует с серой:
С + 2S = CS2.
Не взаимодействует с азотом и фосфором.
Углерод взаимодействует с водородом и кремнием в присутствии никелевого катализатора:
C + Si = SiC;
C + 2H2 = CH4.
Взаимодействие с металлами
Способен взаимодействовать с металлами, образуя карбиды:
Ca + 2C = CaC2.
Взаимодействие с водой
При пропускании водяных паров через раскаленный уголь образуется оксид углерода (II) и водород:
C + H2O = CO + H2.
Восстановительные свойства
Углерод способен восстанавливать многие металлы из их оксидов (карботермия):
2ZnO + C = 2Zn + CO2.
Концентрированные серная и азотная кислоты при нагревании окисляют углерод до оксида углерода (IV):
C + 2H2SO4 = CO2 + 2SO2 + 2H2O;
C + 4HNO3 = CO2 + 4NO2 + 2H2O.
Вопросы для самопроверки
Что такое углерод? Дайте характеристику его положения в Периодической системе химических элементов Д.
 И. Менделеева.
И. Менделеева.Как распределяются электроны по энергетическим уровням в атоме углерода? Напишите электронную конфигурацию углерода.
Углерод является окислителем в реакции с:
Кислородом
Хлором
Водородом
Серой
Возможно ли взаимопревращение алмаза и графита? Объясните почему.
В виде каких соединений углерод находится в природе?
Для какого аллотропного видоизменения углерода характерна совместимость с тканями человеческого организма?
Опишите физические свойства графена и карбина.
Для чего используют карботермию?
Чем обусловлено наличие аллотропных видоизменений углерода?
В чем заключается различие между нейтральным состоянием атома углерода и возбужденным? Какие возможны степени окисления?
Красота химии — в том, что она изучает окружающий нас мир.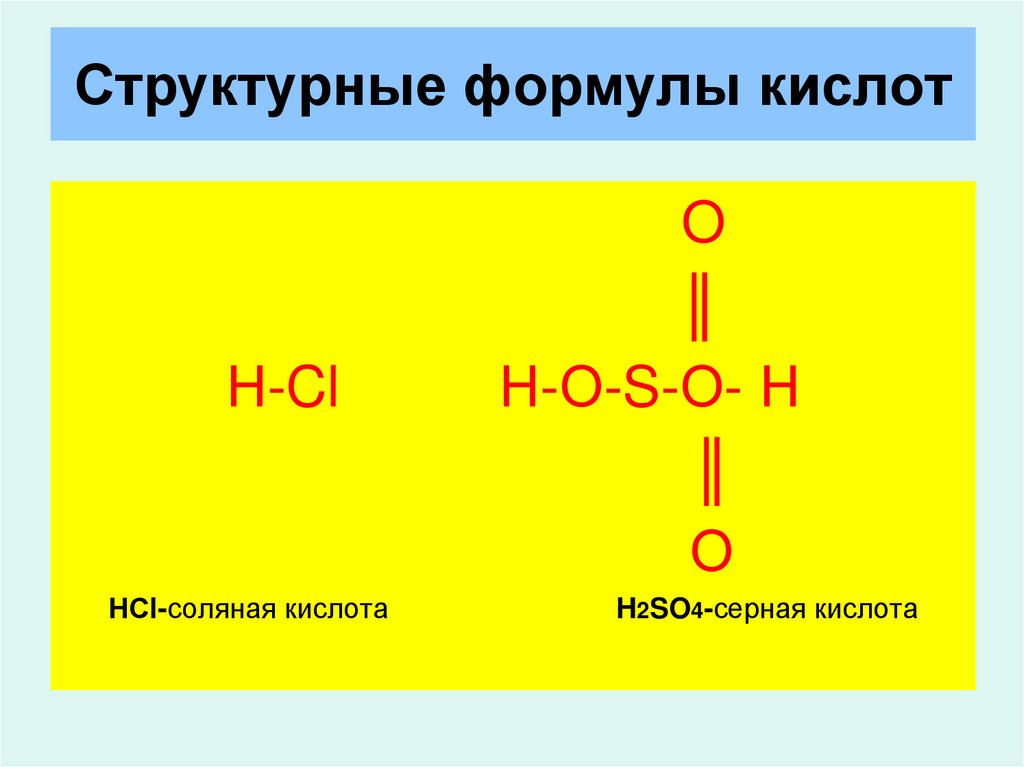 Но это не всегда получается увидеть на школьных занятиях. Онлайн-уроки химии в Skysmart помогут не только подтянуть оценки и подготовиться к экзаменам, но и полюбить этот предмет, тесно связанный с окружающим нас миром.
Но это не всегда получается увидеть на школьных занятиях. Онлайн-уроки химии в Skysmart помогут не только подтянуть оценки и подготовиться к экзаменам, но и полюбить этот предмет, тесно связанный с окружающим нас миром.
Татьяна Сосновцева
К предыдущей статье
Химия сероводорода
К следующей статье
Простые и сложные вещества
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Формула надугольной кислоты – структура, свойства, применение и часто задаваемые вопросы
Надугольная кислота, или карбоновая кислота, является производным перекиси водорода и других подобных веществ. Его молекулярная формула CH 2 O 4 . Это нестабильное соединение, которое разлагается на углекислый газ и воду. Его можно определить путем разложения его соли разбавленной серной кислотой и последующего титрования выделившегося H 2 O 2 растворами перманганата. Его количество доноров водородных связей равно 2, а количество акцепторов водородных связей равно 4. Он действует как реагент в реакции «нуклеофильного ацилирования».
Его молекулярная формула CH 2 O 4 . Это нестабильное соединение, которое разлагается на углекислый газ и воду. Его можно определить путем разложения его соли разбавленной серной кислотой и последующего титрования выделившегося H 2 O 2 растворами перманганата. Его количество доноров водородных связей равно 2, а количество акцепторов водородных связей равно 4. Он действует как реагент в реакции «нуклеофильного ацилирования».
Структура надугольной кислоты
Химическая формула надугольной кислоты: H 2 CO 4 . Центральный углерод связан с четырьмя молекулами кислорода, а два атома водорода связаны с двумя из четырех атомов кислорода.
Структура надугольной кислоты
Получение надугольной кислоты
- Надугольная кислота может быть получена путем нуклеофильного ацилирования хлоругольной кислоты и перекиси водорода.
CHClO 2 + H 2 O 2 → CH 2 O 4 + HCL
Препарат перкарбоновой кислоты
- Это также может синтезироваться с помощью я нуклеофильной ацилации.

CHBRO 2 + H 2 O 2 → CH 2 O 4 + HBR
Приготовление перкарбоновой кислоты
Propertes of Percarbonic Acid Acid Acid Acid Acid Acid Aictaines of Percarbonies Acid Acid Acid Acid Acid Acid Acid Acid Acid Acid Acid Acid Acid Acid Acid Acid Acid Acid Acid Acid Acid Acid Acid Acid Acid Acid Acid Acid Acid Acid.0013
| Молекулярная формула | CH 2 O 4 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Смалы | C (o) (O) OO | ||||||||||||||||||||||||
| IUPAC ACAC ACKACAC ACLAC. | . | . | . | . | . | . | . | . | . | . | . | . | . названия | Карбопероксоевая кислота Диоксикарбоновая кислота Пероксикарбоновая кислота | |||||||||||
| Молекулярная масса | 79075 79 080 90 90 1 моль0073 Сложность38,9 |
Химические свойства надугольной кислоты
- Надугольная кислота реагирует с гидроксиламином (NH 2 OH) с образованием гидроксикарбампероксоевой кислоты.

CH 2 O 4 + NH 2 OH → CH 3 NO 4 + H 2 O
- Percarbonic Acid Reactcts с Prop-2-19005
- PERCARBONIC AID REACTS с Prop-2 -EN-IN-IN-IN-IN-IN-IN-IN-IN-10045
- . -ол (C 3 H 6 O) с образованием аллилгидроксикарбоната (C 4 H 6 O 3 ).
CH 2 O 4 + C 3 H 6 O → C 4 H 6 O 3 + H 2 O 2 9001 + H 2 O 2
9004 + 2 O 2 1111119 + H 2 O 2 111119 + H 2 . по формуле надугольной кислотыВопрос 1: Рассчитайте молярную массу надугольной кислоты.
Ответ:
Мы знаем, что химическая формула надугольной кислоты Н 2 СО 4 .

Атомная масса атома водорода = 1,00794
Атомная масса атома углерода = 12,0107
Атомная масса атома кислорода = 15,9994
Теперь молярная доля надугольной кислоты = 2 × 7 + 1,007940 + 1,007940 + 1,007940 × 15,9994
= 2,01588 + 12,0107 + 63,9976 = 78,02418 г/моль
Итак, молярная масса надугольной кислоты равна 78,02418 г/моль.
Вопрос 2: Какова химическая формула надугольной кислоты?
Ответ:
Химическая формула надугольной кислоты H 2 CO 4 . Центральный углерод связан с четырьмя молекулами кислорода, а два атома водорода связаны с двумя из четырех атомов кислорода.
Вопрос 3: Как получают надугольную кислоту?
Ответ:
- Надугольную кислоту можно получить нуклеофильным ацилированием хлоругольной кислоты и пероксида водорода.
CHCLO 2 + H 2 O 2 → CH 2 O 4 + HCL
- Это также может быть синтезировано в ядлефильной ацилировании бромкарборонического акизита.

CHBRO 2 + H 2 O 2 → CH 2 O 4 + HBR
ВОПРОС 4: Упомяните некоторые свойства перкарбоновой кислоты.
Ответ:
Химическая формула надугольной кислоты: H 2 CO 4 . Его молярная масса составляет 78,02 г/моль, а сложность 38,9. Количество доноров водородной связи равно 2, а количество акцепторов водородной связи равно 4.
Вопрос 5: Назовите некоторые химические свойства надугольной кислоты.
Ответ:
- Надугольная кислота реагирует с гидроксиламином (NH 2 OH) с образованием гидроксикарбампероксоевой кислоты.
CH 2 O 4 + NH 2 OH → CH 3 NO 4 + H 2 O
- Percarbonic Acid Reacts с ProP-2-en-1-ol.
 (C 3 H 6 O) с образованием аллилгидроксикарбоната (C 4 H 6 O 3 ).
(C 3 H 6 O) с образованием аллилгидроксикарбоната (C 4 H 6 O 3 ).
CH 2 O 4 + C 3 H 6 O → C 4 H 6 O 3 + H 2 O 2 O 3 + H 2 O 2 .0004
3dstruktur Von Kohlensäure Einer Chemischen Verbindung Mit Der Chemischen Formel h3co3 Es Spielt Eine Wichtige Rolle Im Bicarbonatpuffersystem Zur Aufrechterhaltung Der Säurebasenhomöostase Stockfoto und mehr Bilder von Säure
Bilder
- Bilder
- Fotos
- Grafiken
- Vektoren
- Видео
 Он играет важную роль в бикарбонатной буферной системе для поддержания кислотно-щелочного гомеостаза.
Он играет важную роль в бикарбонатной буферной системе для поддержания кислотно-щелочного гомеостаза.Beschreibung
3D-Struktur von Kohlensaure, einer chemischen Verbindung mit der chemischen Formel h3CO3. Es spielt eine wichtige Rolle im Bicarbonat-Puffersystem zur Aufrechterhaltung der Säure-Basen-Homöostase
Essentials Kollektion
9,00 € für dieses Bild
Günstige und flexible Optionen für jedes Budget
Umfasst unsere Standardlizenz.
Erweiterte Lizenz hinzufügen.
Bildnachweis:ibreakstock
Maximale Größe:6000 x 4000 Pixel (50,80 x 33,87 cm) — 300 dpi — RGB
Stock-Fotografie-ID:1224068269
Hochgeladen am:
Категория:Фотографии | Säure
Suchbegriffe
- Säure Fotos,
- Homöostase Fotos,
- Lösung Fotos,
- Atom Fotos,
- Biochemie Fotos,
- Biologie Fotos,
- Chemie Fotos,
- Chemikalie Fotos,
- Dreidimensional Fotos,
- Forschung Fotos,
- Fotografie Fotos,
- Freisteller – Neutraler Hintergrund Fotos,
- Gas Fotos,
- Geologie Fotos,
- Horizontal Fotos,
- Kroatien Fotos,
- Molekül Fotos,
- Molekülstruktur Fotos,
Alle anzeigen
Kategorien
- Wissenschaft
Häufig gestellte Fragen
- Was ist eine lizenzfreie Lizenz?
- Bei lizenzfreien Lizenzen bezahlen Sie einmalig und können urheberrechtlich geschützte Bilder und Videoclips fortlaufend in privaten und kommerziellen Projekten nutzen, ohne bei jeder Verwendung zusätzlich bezahlen zu müssen.

- PERCARBONIC AID REACTS с Prop-2 -EN-IN-IN-IN-IN-IN-IN-IN-IN-10045

 1.Проверка домашнего задания
1.Проверка домашнего задания Закрепление новых знаний (10 мин)
Закрепление новых знаний (10 мин)

 И. Менделеева.
И. Менделеева.


 (C 3 H 6 O) с образованием аллилгидроксикарбоната (C 4 H 6 O 3 ).
(C 3 H 6 O) с образованием аллилгидроксикарбоната (C 4 H 6 O 3 ). Он играет важную роль в бикарбонатной буферной системе для поддержания кислотно-щелочного гомеостаза.
Он играет важную роль в бикарбонатной буферной системе для поддержания кислотно-щелочного гомеостаза.