Угольная кислота | это… Что такое Угольная кислота?
У́гольная кислота́ — слабая двухосновная кислота с химической формулой . В чистом виде неустойчива[2]. Образуется в малых количествах при растворении углекислого газа в воде[1], в том числе и углекислого газа из воздуха. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Содержание
|
Физические свойства
Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp²-гибридизацию. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи. Длина связи C—O в карбонат-ионе составляет 129 пм.
Длина связи C—O в карбонат-ионе составляет 129 пм.
Химические свойства
Равновесие в водных растворах и кислотность
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода:
- , константа равновесия при 25 °C
Скорость прямой реакции 0,039 с
В свою очередь растворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода:
Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево (подробнее см. Абсорбция газов).
Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду:
- , константа кислотности при 25 °C
Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода:
Гидрокарбонат-ион подвергается дальнейшему гидролизу по реакции
- , константа кислотности при 25 °C
Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система, которую можно изобразить в общем виде следующим образом:
Значение pH в такой системе, соответствующей насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт.
- , где L = 0,034 моль/л — растворимость CO2 в воде при указанных условиях.
Разложение
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие в системе смещается влево, что приводит к разложению части угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
Взаимодействие с основаниями и солями
Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли — карбонаты и гидрокарбонаты соответственно:
- (конц.)
- (разб.)
При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты:
Получение
Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа.
Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода:
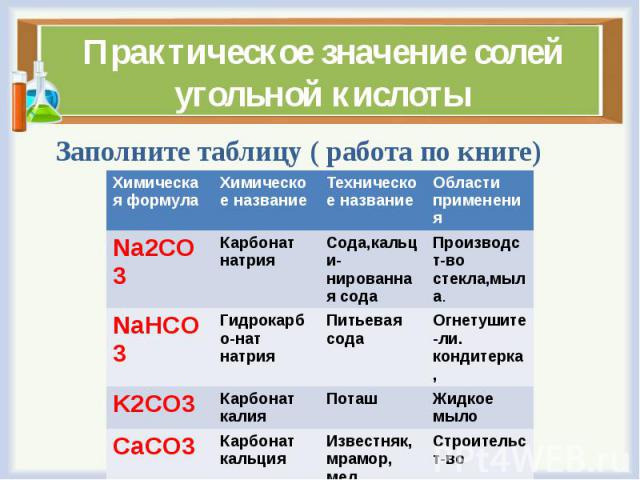
Применение
Угольная кислота всегда присутствует в водных растворах углекислого газа (см. Газированная вода).
В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора.
Органические производные
Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот[3].
Некоторые представители подобных соединений перечислены в таблице.
| Класс соединений | Пример соединения |
|---|---|
| Сложные эфиры | поликарбонаты |
| Хлорангидриды | фосген |
| Амиды | мочевина |
| Нитрилы | циановая кислота |
| Ангидриды | пироугольная кислота |
См. также
- Оксид углерода(IV)
- Карбонаты
- Гидрокарбонаты
- Карбоновые кислоты
- Газированная вода
Примечания
- ↑ 1 2 3 В водном растворе бо́льшая часть угольной кислоты обратимо переходит в гидрат диоксида углерода по реакции H2CO3 ⇄ CO2·H2O
- ↑ Угольная кислота теперь обнаружена и в газовой фазе — пора снова переписывать учебники
- ↑ Нейланд О. Я. Органическая химия. — М.: Высшая школа, 1990. — С. 640—652. — 751 с. — ISBN 5-06-001471-1
Литература
- Лидин Р.
 А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2
А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2 - Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5
Растворимость кислот, оснований и солей в воде
| H+ | Li+ | K+ | Na+ | NH4+ | Ba2+ | Ca2+ | Mg2+ | Sr2+ | Al3+ | Cr3+ | Fe2+ | Fe3+ | Ni2+ | Co2+ | Mn2+ | Zn2+ | Ag+ | Hg2+ | Hg22+ | Pb2+ | Sn2+ | Cu+ | Cu2+ | |
| OH− | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F− | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р | |
| Br− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I− | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | — | Н | Н | Н | Н |
| SO32− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO42− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | Р | |
| NO2− | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO43− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO32− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | — | Н | — | Н | — | — | ? | — |
| CH3COO− | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN− | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO32− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Угольная кислота | это.
 .. Что такое Угольная кислота?
.. Что такое Угольная кислота?У́гольная кислота́ — слабая двухосновная кислота с химической формулой . В чистом виде неустойчива
Содержание
|
Физические свойства
Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp²-гибридизацию. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи. Длина связи C—O в карбонат-ионе составляет 129 пм.
Длина связи C—O в карбонат-ионе составляет 129 пм.
Химические свойства
Равновесие в водных растворах и кислотность
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода:
- , константа равновесия при 25 °C
Скорость прямой реакции 0,039 с−1, обратной — 23 с−1.
В свою очередь растворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода:
Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево (подробнее см. Абсорбция газов).
Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду:
- , константа кислотности при 25 °C
Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода:
Гидрокарбонат-ион подвергается дальнейшему гидролизу по реакции
- , константа кислотности при 25 °C
Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система, которую можно изобразить в общем виде следующим образом:
Значение pH в такой системе, соответствующей насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., можно рассчитать по формуле:
ст., можно рассчитать по формуле:
- , где L = 0,034 моль/л — растворимость CO2 в воде при указанных условиях.
Разложение
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие в системе смещается влево, что приводит к разложению части угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
Взаимодействие с основаниями и солями
Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли — карбонаты и гидрокарбонаты соответственно:
- (конц.)
- (разб.)
При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты:
Получение
Угольная кислота образуется при растворении в воде диоксида углерода:
Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа.
Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода:
Применение
Угольная кислота всегда присутствует в водных растворах углекислого газа (см. Газированная вода).
В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора.
Органические производные
Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот[3].
Некоторые представители подобных соединений перечислены в таблице.
| Класс соединений | Пример соединения |
|---|---|
| Сложные эфиры | поликарбонаты |
| Хлорангидриды | фосген |
| Амиды | мочевина |
| Нитрилы | циановая кислота |
| Ангидриды | пироугольная кислота |
См. также
- Оксид углерода(IV)
- Карбонаты
- Гидрокарбонаты
- Карбоновые кислоты
- Газированная вода
Примечания
- ↑ 1 2 3 В водном растворе бо́льшая часть угольной кислоты обратимо переходит в гидрат диоксида углерода по реакции H2CO3 ⇄ CO2·H2O
- ↑ Угольная кислота теперь обнаружена и в газовой фазе — пора снова переписывать учебники
- ↑ Нейланд О. Я. Органическая химия. — М.: Высшая школа, 1990. — С. 640—652. — 751 с. — ISBN 5-06-001471-1
Литература
- Лидин Р.
 А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2
А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2 - Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5
Растворимость кислот, оснований и солей в воде
| H+ | Li+ | K+ | Na+ | NH4+ | Ba2+ | Ca2+ | Mg2+ | Sr2+ | Al3+ | Cr3+ | Fe2+ | Fe3+ | Ni2+ | Co2+ | Mn2+ | Zn2+ | Ag+ | Hg2+ | Hg22+ | Pb2+ | Sn2+ | Cu+ | Cu2+ | |
| OH− | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F− | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I− | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | — | Н | Н | Н | Н |
| SO32− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO42− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2− | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO43− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO32− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | — | Н | — | Н | — | — | ? | — |
| CH3COO− | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN− | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO32− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Углекислота Определение и значение
- Основные определения
- Викторина
- Связанный контент
- Примеры
- Британский
- Научный
Показывает уровень сложности слова на основе уровня сложности.
Сохрани это слово!
См. синонимы для углекислоты на сайте Thesaurus.com
Показывает уровень оценки в зависимости от сложности слова.
сущ.
кислота, h3CO3, образующаяся при растворении углекислого газа в воде, известная в виде ее солей и эфиров, карбонатов.
ВИКТОРИНА
ВЫ ПРОЙДЕТЕ ЭТИ ВОПРОСЫ ПО ГРАММАТИКЕ ИЛИ НАТЯНУТСЯ?
Плавно переходите к этим распространенным грамматическим ошибкам, которые ставят многих людей в тупик. Удачи!
Вопрос 1 из 7
Заполните пропуск: Я не могу понять, что _____ подарил мне этот подарок.
Происхождение угольной кислоты
Впервые записано в 1785–1795 гг.
Слова рядом с угольной кислотой
углеродное волокно, углеродное волокно, фиксация углерода, углеродный след, углерод, угольная кислота, углекислый газ, угольная ангидраза, каменноугольный период, карбоний ион, карбонизация
Dictionary.com Полный текст
На основе Random House Unabridged Dictionary, © Random House, Inc. 2023
2023
Слова, связанные с углекислотой
углекислый газ
Как использовать углекислоту в предложении
Я пишу тексты песен и работаю с Мервом Дугласом из Lords of Acid.
Порнозвезд года в порно: Drone Erotica, Belle Knox и Wild Sex|Aurora Snow|27 декабря 2014|DAILY BEAST
В разгар разочарования он посетил свой родной город, где старый ему немного жидкой кислоты.
DJ Spooky хочет, чтобы вы поставили под сомнение все, что вы знаете о музыке, технологиях и философии|Оливер Джонс|27 декабря 2014 г.|DAILY BEAST
Яйца, по его словам, являются хорошим источником цистеина, аминокислоты, которая помогает печень быстрее расщепляет алкоголь.
5 средств от похмелья, которые спасут вас после нескольких переизбытков|DailyBurn|19 декабря 2014 г.|DAILY BEAST
Этот домашний набор для анализа крови дает полное определение содержания антиоксидантов, жирных кислот или витаминов.
Ничто не говорит, что я люблю тебя, как данные|The Daily Beast|8 декабря 2014|DAILY BEAST
Недавняя волна кислотных нападений на женщин — лишь последнее проявление этой опасной тенденции.

Ядерная сделка, которой иранский режим боится больше всего|Джавад Хадем|22 ноября 2014 г.|DAILY BEAST
Существует ряд бацилл, называемых кислотоустойчивыми бациллами, которые окрашиваются так же, как туберкулезная палочка.
Руководство по клинической диагностике|Джеймс Кэмпбелл Тодд
Общее количество других пуриновых телец составляет примерно одну десятую от количества мочевой кислоты.
Руководство по клинической диагностике|James Campbell Todd
Мочевая кислота снижена перед приступом подагры и повышена после нее, но ее этиологическая связь остается неопределенной.
Руководство по клинической диагностике|James Campbell Todd
Также отмечается усиление мочекислого диатеза и заболеваний, сопровождающихся дыхательной недостаточностью.
Руководство по клинической диагностике|Джеймс Кэмпбелл Тодд
Индол всасывается и окисляется в индоксил, который соединяется с калием и серной кислотой и таким образом выводится из организма.

A Manual of Clinical Diagnosis|James Campbell Todd
Определения углекислоты из Британского словаря
углекислота
сущ. чистое состояние. Формула: Н 2 СО 3
Английский словарь Коллинза — полное и полное цифровое издание 2012 г. © William Collins Sons & Co. Ltd., 1979, 1986 © HarperCollins Publishers 1998, 2000, 2003, 2005, 2006, 2007, 2009, 2012
Научные определения угольной кислоты
угольная кислота
[ kär-bŏn′ĭk ]
6 A 900 неустойчивая двуокись углерода присутствует в слабых растворах двуокиси углерода в воде. Он придает газированным напиткам их острый вкус. Химическая формула: h3CO3.Научный словарь American Heritage® Авторские права © 2011. Опубликовано издательством Houghton Mifflin Harcourt Publishing Company. Все права защищены.
Углекислота стабилизируется под действием высокого давления и высокой температуры
Исследователи MPIC «приручили» реактивную молекулу под высоким давлением – значение для системы Земли могло быть недооценено
До настоящего времени кислоте уделялось мало научного внимания H 2 CO 3 , широко известный как угольная кислота.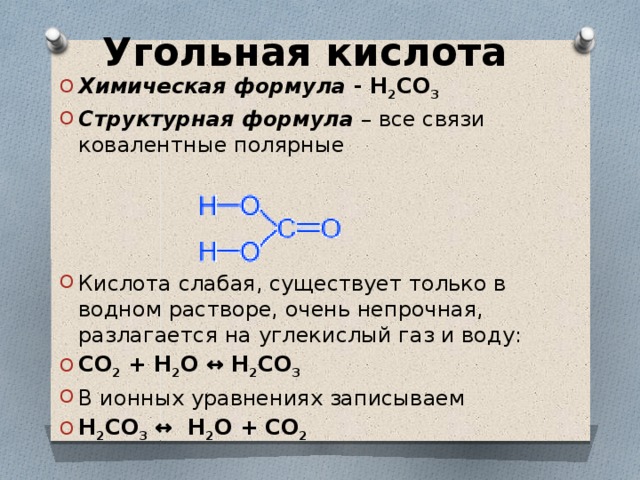 Хотя известно, что углекислый газ образуется при растворении в воде, угольная кислота вступает в реакцию за доли секунды с образованием более стабильного иона бикарбоната (HCO 3 -), поэтому концентрация кислоты настолько мала в условиях окружающей среды, что ее обычно не принимают во внимание в геологическом контексте. Однако недавно исследователи из Химического института им. Макса Планка в Майнце разработали новый метод исследования угольной кислоты и обнаружили, что она стабилизируется под действием высокого давления и высокой температуры. Это означает, что угольная кислота становится важным веществом, которое следует учитывать примерно на 80 км ниже поверхности Земли. Их исследование было недавно опубликовано в журнале с открытым доступом «Научные отчеты» издательства Nature Publishing Group.
Хотя известно, что углекислый газ образуется при растворении в воде, угольная кислота вступает в реакцию за доли секунды с образованием более стабильного иона бикарбоната (HCO 3 -), поэтому концентрация кислоты настолько мала в условиях окружающей среды, что ее обычно не принимают во внимание в геологическом контексте. Однако недавно исследователи из Химического института им. Макса Планка в Майнце разработали новый метод исследования угольной кислоты и обнаружили, что она стабилизируется под действием высокого давления и высокой температуры. Это означает, что угольная кислота становится важным веществом, которое следует учитывать примерно на 80 км ниже поверхности Земли. Их исследование было недавно опубликовано в журнале с открытым доступом «Научные отчеты» издательства Nature Publishing Group.
С помощью ячейки с алмазной наковальней и CO 2 лазера исследователи из Майнца смоделировали условия, обнаруженные на глубине до 300 км внутри Земли. При давлении до 9,1 гигапаскаля (ГПа) и температуре до 1200 °C (горячее, чем поверхность вулкана) они исследовали поведение CO 2 и H 2 O. Группа, состоящая из исследователей отдела кафедры химии атмосферы и из группы исследований высоких давлений под руководством Михаила Еремца обнаружили нечто совершенно удивительное: начиная с давления 2,4 ГПа и температуры выше 9Водная угольная кислота при 7 °C становится стабильной.
Группа, состоящая из исследователей отдела кафедры химии атмосферы и из группы исследований высоких давлений под руководством Михаила Еремца обнаружили нечто совершенно удивительное: начиная с давления 2,4 ГПа и температуры выше 9Водная угольная кислота при 7 °C становится стабильной.
«Изначально мы подготовили исследование реакционной способности углеродсодержащих жидкостей с различным соотношением водорода и кислорода внутри Земли, то есть при очень высоком давлении», — объясняет начало исследования Янек Цойшнер, аспирант Центра повышения квалификации Макса Планка. Для проверки экспериментальной установки с родственной системой они выбрали одну из самых известных: CO 2 и H 2 O.
При температуре окружающей среды вода и углекислый газ находятся в твердом состоянии при исследованных давлениях. Чтобы ускорить химическую реакцию и создать более реалистичные геологические условия, при которых температура увеличивается с глубиной, исследователи нагрели образец с помощью углекислого газа. 0146 2 лазер. К своему удивлению, они обнаружили, что кристаллы образуются при давлении выше 2,4 ГПа в ячейке алмазной наковальни. Янек Цойшнер был первым, кто осознал потенциальное значение рамановских и инфракрасных спектров, записанных для этих образцов, а именно образование твердой угольной кислоты. «Ни одно из предыдущих исследований не давало никаких указаний на то, что CO 2 и H 2 O могут образовывать значительные количества углекислоты при высоком давлении», — объясняет Янек. Хотя дальнейшие эксперименты показали, что первоначально образовавшиеся кристаллы растворялись при более низких температурах в жидкой воде, стабильные молекулы угольной кислоты оставались в растворе и были тем обильнее, чем выше нагревался раствор.
0146 2 лазер. К своему удивлению, они обнаружили, что кристаллы образуются при давлении выше 2,4 ГПа в ячейке алмазной наковальни. Янек Цойшнер был первым, кто осознал потенциальное значение рамановских и инфракрасных спектров, записанных для этих образцов, а именно образование твердой угольной кислоты. «Ни одно из предыдущих исследований не давало никаких указаний на то, что CO 2 и H 2 O могут образовывать значительные количества углекислоты при высоком давлении», — объясняет Янек. Хотя дальнейшие эксперименты показали, что первоначально образовавшиеся кристаллы растворялись при более низких температурах в жидкой воде, стабильные молекулы угольной кислоты оставались в растворе и были тем обильнее, чем выше нагревался раствор.
«В этот момент мы поняли, что, вопреки общепринятому пониманию, углекислота на самом деле может быть довольно важной молекулой на глубинах более 80 км в Земле. Действительно, внутри Земли мы находим именно те условия нашего эксперимента: экстремально высокое давление и высокие температуры», — объясняет результаты исследования Хунбо Ван из Исследовательской группы высокого давления.
Исследователи пошли еще дальше. При нагреве образца лазером матрица образца быстро затвердевает на заднем конце движущегося лазерного пятна и тем самым «замораживает» состояние, в котором находился раствор при высокой температуре. В этом состоянии в растворе находится гораздо больше угольной кислоты, чем она растворялась бы в воде при более низких температурах (т. е. близких к температуре плавления воды при давлении опыта). Поскольку избыток угольной кислоты в растворе более нестабилен, молекулы выпадают в осадок в твердой форме. Процесс быстрого охлаждения на заднем конце лазерного пятна заставляет воду замерзать (из-за высокого давления), прежде чем она сможет вступить в реакцию с осажденной углекислотой. «Теперь мы можем исследовать твердую углекислоту при температуре окружающей среды и даже до точки плавления воды при приложенном давлении после лазерного нагрева наших образцов», — заметил химик Янек Цойшнер.
Открытие может изменить нынешнее понимание физических свойств глубинных флюидов (например, электропроводности), которые переносят молекулярную углекислоту.

 А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2
А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2 А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2
А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2
