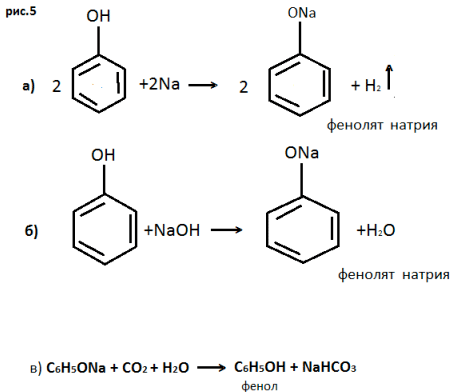
1. Взаимодействие избытка раствора гидроксида натрия с углекислым газом отражает следующее
Органічна речовина масою 7,2 г повністю згоріла в атмосфері кисню. Утворився карбон (ІV) оксид об’ємом 8,96 л (н. у.) і вода масою 7,2 г. Густина пари … речовини за етеном становить 2,57. Обчисліть і виведіть молекулярну формулу речовини.
Тест с Хімії 1. Оберіть вірне твердження1. Відкрита термодинамічна система — це та, в якій відбувається взаємодія між об′єктами в системі не відбуваєт
…
ься теплообмін та масообмін з зовнішнім середовищем.2. Відкрита термодинамічна система — це та, в якій відбувається взаємодія між об′єктами в системі, відбувається теплообмін та не відбувається масообмін з зовнішнім середовищем3.Відкрита термодинамічна система- це та, в якій відбувається взаємодія між об′єктами в системі та теплообмін та масообмін з зовнішнім середовищем. 2. Оберіть вірне твердження 1.Термодинамічні параметри стану системи, це ті, що значення яких залежать від шляху протікання процесу, кількості стадій, і не залежать від початкового та кінцевого стану системи 2.
 Стандартна ентальпія утворення складної речовини це та кількість енергії, що виділяється, або поглинається при утворенні 1 моль складної речовини із простих речовин, що знаходяться в стабільних модифікаціях та виміряна за стандартних умов, 3.Стандартна ентальпія утворення складної речовини це та кількість енергії, що виділяється, або поглинається при утворенні 1 моль складної речовини із складних речовин та виміряна за стандартних умов, 6. Яке рівнянні відповідає поняттю стандартна ентальпія утворення речовини: 1)h3O + SO3 = h3SO4;2) h3 + 2O2 + S = h3SO4;3) h3 + SO2 + O2 = h3SO4;4) 2H + S + 4O = h3SO4 7. Екзотермічні –це ті реакції , що відбуваються з 1)Виділенням енергії 2)Поглининням енергії3) Без зміни енергетичного стану 8. Ендотермічні –це ті реакції , що відбуваються з 1.Виділенням енергії2. Поглинанням енергії 3.Без зміни енергетичного стану 9. Для реакції сС + аА = dD виберіть правильний розрахунок теплового ефекту 1)ΔНх.р.0 = сΔНf0 (C) + dΔНf0(D) – aΔНf0(A), 2)ΔНх.р.0 = dΔНf0(D) — сΔНf0 (C) – aΔНf0(A), 3)ΔНх.
Стандартна ентальпія утворення складної речовини це та кількість енергії, що виділяється, або поглинається при утворенні 1 моль складної речовини із простих речовин, що знаходяться в стабільних модифікаціях та виміряна за стандартних умов, 3.Стандартна ентальпія утворення складної речовини це та кількість енергії, що виділяється, або поглинається при утворенні 1 моль складної речовини із складних речовин та виміряна за стандартних умов, 6. Яке рівнянні відповідає поняттю стандартна ентальпія утворення речовини: 1)h3O + SO3 = h3SO4;2) h3 + 2O2 + S = h3SO4;3) h3 + SO2 + O2 = h3SO4;4) 2H + S + 4O = h3SO4 7. Екзотермічні –це ті реакції , що відбуваються з 1)Виділенням енергії 2)Поглининням енергії3) Без зміни енергетичного стану 8. Ендотермічні –це ті реакції , що відбуваються з 1.Виділенням енергії2. Поглинанням енергії 3.Без зміни енергетичного стану 9. Для реакції сС + аА = dD виберіть правильний розрахунок теплового ефекту 1)ΔНх.р.0 = сΔНf0 (C) + dΔНf0(D) – aΔНf0(A), 2)ΔНх.р.0 = dΔНf0(D) — сΔНf0 (C) – aΔНf0(A), 3)ΔНх.
9. Складіть рівняння процесів, що відбуваються на вугільних електродах під час електролізу водних розчинів наведених нижче солей. В якому випадку на о … дному з електродів (аноді чи катодi) виділяється кисень ? Розрахуйте його об’єм, якщо кількість електрики становить 72375 А.с. 9.4 а) NiSO4; б) BaCl, O 150
7. Розставте ступені окиснення елементів в наведених рівняннях окисно- відновних реакцій.Визначте атом-окисник та атом-відновник, вкажіть ТИП окисно-в
…
ідновної реакції. Підберіть коефіцієнти, користуючись методом електронного балансу. 7.4. a) Ag2CO3 = Ag + CO2 + O2 б) h3SO4 + KI= h3S + I2 + K2SO4 + h3O
7.4. a) Ag2CO3 = Ag + CO2 + O2 б) h3SO4 + KI= h3S + I2 + K2SO4 + h3O
2. Виходячи із ступеню окиснення елементів, що підкреслені, та їх розташування в періодичній системі, визначте, чи можливі відновні реакції між між на … веденими B в умові речовинами. Вкажіть у взаємодіючих речовинах атом-окисник та атом-відновник: 2.4. h3SO3 та HClO4, h3SO4 та НСЮ4, h3SO3 та h3S
9.2. РАСТВОРЫ ЩЕЛОЧЕЙ \ КонсультантПлюс
9.2. РАСТВОРЫ ЩЕЛОЧЕЙ
9.2.1. Гидроксиды натрия или калия. Исходными реактивами являются гидроксид натрия (едкий натр), NaOH, х.ч. или ч.д.а., по ГОСТ 4328-77 или гидроксид калия (едкое кали), KOH, х.ч. или ч.д.а., по действующей нормативно-технической документации.
2,5 моль/куб. дм (2,5 н) раствор. Вначале готовят концентрированный раствор с массовой долей примерно 45%. Для этого в фарфоровой посуде взвешивают на технических весах 500 — 520 г NaOH или KOH, смывают водой верхний слой карбоната. Обмытые гранулы растворяют в 500 куб. см воды, добавляя ее постепенно, при непрерывном помешивании. Остывший концентрированный раствор осторожно сливают в бутыль, которую закрывают пробкой с хлоркальциевой трубкой, наполненной натронной известью <1>. Раствор оставляют для отстаивания на срок не менее двух дней, затем сливают с осадка и замеряют плотность ареометром.
Остывший концентрированный раствор осторожно сливают в бутыль, которую закрывают пробкой с хлоркальциевой трубкой, наполненной натронной известью <1>. Раствор оставляют для отстаивания на срок не менее двух дней, затем сливают с осадка и замеряют плотность ареометром.
———————————
<1> Все растворы гидроксида натрия или калия хранят, защищая их от углекислого газа воздуха при помощи вставленных в пробки хлоркальциевых трубок, заполненных натронной известью. Натронную известь получают при взаимодействии концентрированного раствора NaOH со свежепрокаленной CaO (на 2 весовые части CaO одна весовая часть NaOH) с последующим выпариванием (осторожно) и слабым прокаливанием. После измельчения и просеивания ею заполняют хлоркальциевую трубку.
Из концентрированного раствора путем разбавления водой
(свободной от CO ) готовят приблизительно 2,5 моль/куб. дм
2
раствор с массовой долей 10%, плотностью 1,109 г/куб. см. Для
см. Для
удаления углекислого газа дистиллированную воду кипятят и
охлаждают в колбе с закрытой пробкой, в которую вставлена
хлоркальциевая трубка, заполненная натронной известью.
Точность 2,5 моль/куб. дм раствора проверяют титрованием соляной или серной кислотой в присутствии фенолфталеина.
На 10 куб. см точно 2,5 моль/куб. дм (2,5 н) раствора гидроксида натрия или гидроксида калия должно пойти 25 куб. см точно 1 моль/куб. дм (1 н) раствора соляной или 0,5 моль/куб. дм (1 н) раствора серной кислоты. Если кислоты идет на титрование больше или меньше, то концентрацию раствора гидроокиси натрия соответственно уменьшают, разбавляя водой, или увеличивают, добавляя раствор гидроксида натрия с массовой долей 45%.
1 моль/куб. дм (1 н) раствор. Из концентрированного раствора
путем разбавления водой, освобожденной от CO , готовят раствор с
2
массовой долей 4% (приблизительно), плотностью 1,043 г/куб. см.
см.
Коэффициент поправки 1 моль/куб. дм растворов NaOH и KOH устанавливают по 1 моль/куб. дм (1 н) раствору соляной или 0,5 моль/куб. дм (1 н) серной кислоты, приготовленному из фиксанала (К = 1), или с установленным коэффициентом поправки. В этом случае в 3 — 4 конические колбы отмеривают пипеткой 10 — 20 куб. см растворов NaOH или KOH добавляют по 3 — 4 капли раствора фенолфталеина с массовой долей 1% и титруют соответствующим раствором соляной или серной кислоты до исчезновения розовой окраски.
Коэффициент поправки вычисляют по формуле:
V x К
1 1
К = ——-, (112)
V
2
где:
К — коэффициент поправки;
V — объем раствора кислоты, израсходованной на титрование,
1
куб. см;
К — коэффициент поправки использованного раствора кислоты;
1
V — объем раствора NaOH или KOH, взятый для титрования, куб.
2
см.
Коэффициент поправки растворов NaOH и KOH проверяют не реже 1
раза в 3 месяца, а при наличии резких колебаний температуры
окружающего воздуха — чаще.
1 моль/куб. дм (1 н) раствор, используемый для осаждения
мешающих несахаров в комплексе с 0,5 моль/куб. дм (1 н) раствором
сульфата цинка, может содержать некоторое количество карбонатов и
при этом хорошо выполнять свою функцию. Его можно приготовить
непосредственно из сухого реактива: взвешивают 40 — 45 г NaOH или
56 — 60 г KOH в фарфоровой чашке, смывают небольшим количеством
воды без CO верхний слой карбоната, обмытые кристаллы растворяют
2
в 100 — 150 куб. см воды и, после охлаждения, разбавляют до объема
1000 куб. см. Затем устанавливают эквивалентное соотношение этих
растворов, как указано ниже.
0,1 моль/куб. дм (0,1 н) раствор. Приготовленный 1 моль/куб.
дм (1 н) раствор NaOH разбавляют в 10 раз дистиллированной водой,
освобожденной от CO . Один объем 1 моль/куб. дм (1 н) раствора
Один объем 1 моль/куб. дм (1 н) раствора
2
NaOH и 9 объемов дистиллированной воды смешивают непосредственно в
сосуде для хранения раствора, а затем устанавливают коэффициент
поправки.
Растворы с массовой долей 15% и 2% (приблизительно).
Взвешивают на технических весах соответственно 150 и 20 г
твердого NaOH, осторожно растворяют в небольшом количестве
дистиллированной воды, освобожденной от CO , и разбавляют такой же
2
водой до 1000 куб. см.
Если приготовлен предварительно концентрированный раствор
NaOH, то его разбавляют дистиллированной водой без CO до
2
плотности соответственно 1,164 и 1,021 г/куб. см.
9.2.2. Гидроксид бария, насыщенный раствор. Исходным реактивом
является гидроксид бария (Ba(OH) x 8H O), х. ч. или ч.д.а., по
ч. или ч.д.а., по
2 2
ГОСТ 4107-78. Растворяют в воде Ba(OH) при нагревании (70 — 80
2
°C) до насыщения. При охлаждении из раствора выпадает
кристаллический гидроксид бария с большим содержанием в нем
карбоната бария; прозрачную жидкость осторожно сливают с помощью
сифона в склянку, из которой предварительно удаляют углекислоту,
пропуская через нее поток воздуха, лишенного углекислоты (в
течение нескольких часов), для чего воздух пропускают через
промывные склянки с концентрированным раствором едкого кали или
едкого натра или V-образные трубки с натронной известью.
С этой целью склянку, из которой удаляют углекислоту, соединяют с промывными склянками с помощью стеклянной трубки, вставленной в пробку, промывные склянки также соединяют между собой с помощью стеклянных трубок, вставленных в пробки (рис. 8 — не приводится). Вторую стеклянную трубку склянки присоединяют к водоструйному насосу посредством резиновой трубки с зажимом. По окончании продувания резиновую трубку перекрывают зажимом.
8 — не приводится). Вторую стеклянную трубку склянки присоединяют к водоструйному насосу посредством резиновой трубки с зажимом. По окончании продувания резиновую трубку перекрывают зажимом.
9.2.3. Гидроксид аммония (водный раствор аммиака с массовой долей 25%), х.ч. или ч.д.а., по ГОСТ 3760-79, растворы с массовой долей 15% и 10%. Готовят разбавлением соответственно 622 и 423 куб. см водного раствора с массовой долей 25% аммиака дистиллированной водой до 1000 куб. см.
Реакция углекислого газа с водой | Эксперимент
В этом эксперименте учащиеся используют собственный выдыхаемый воздух для исследования реакции между углекислым газом и водой. Они наблюдают образование слабой кислоты по изменению цвета кислотно-щелочного индикатора
Это относительно краткое и прямое исследование реакции углекислого газа и воды на простом уровне, которое должно занять не более 15 минут.
При реакции углекислого газа с водой образуется слабая кислота. Углекислый газ, присутствующий в выдыхаемом воздухе, вдувают в колбу, содержащую индикатор, чувствительный к небольшим изменениям рН в соответствующем диапазоне шкалы рН, и последующее изменение цвета наблюдают и регистрируют. Для соответствующих учащихся можно представить уравнение реакции между углекислым газом и водой.
Для соответствующих учащихся можно представить уравнение реакции между углекислым газом и водой.
Если учащиеся еще не знакомы с составом вдыхаемого и выдыхаемого воздуха, этот эксперимент может служить частью последовательности изучения темы дыхания и дыхания во вводном курсе естественных наук с использованием соответствующего элементарного подхода к соответствующей химии.
Для учащихся, которые уже рассмотрели тему дыхания и дыхания и знают, что двуокись углерода является важным компонентом выдыхаемого воздуха, основное внимание в этом эксперименте можно перенести на характер химической реакции (другими связанными темами могут быть кислотные дождь, газожидкостные реакции или индикаторы).
Уравнение реакции между углекислым газом и водой может быть введено для соответствующих учащихся.
Оборудование
Аппарат
- Защита глаз
- Коническая колба, 250 см 3 , 2 шт.
- Индикаторные флаконы с пипетками, 3 шт.

Химикаты
- Этанол (IDA – Промышленный денатурированный спирт) (ЛЕГКО ВОСПЛАМЕНЯЕМЫЙ, ВРЕДНЫЙ)
- Индикаторный раствор тимолфталеина (ЛЕГКО ОГНЕОПАСНЫЙ), доступ к маленькому флакону с пипеткой
- Индикаторный раствор фенолового красного (ЛЕГКО ОГНЕОПАСНЫЙ), доступ к маленькому флакону с пипеткой
- Раствор гидроксида натрия, 0,4 М (РАЗДРАЖАЮЩЕЕ СРЕДСТВО), маленький флакон с пипеткой
- Дистиллированная (или деионизированная) вода, 125 см 3 , 2 шт.
Примечания по охране труда и технике безопасности
- Прочтите наше стандартное руководство по охране труда и технике безопасности.
- Всегда используйте защитные очки.
- Красный индикатор фенола – см. CLEAPSS Hazcard HC032. Индикатор можно приобрести в виде твердого реагента или в виде готового раствора в этаноле. Раствор можно приготовить из твердых реагентов, приготовив 5% вес./об. раствор в этаноле (IDA).
 Если 30 см 3 или 60 см 3 доступны флаконы-капельницы со встроенными пипетками, которые идеально подходят для дозирования растворов индикатора. Хотя сам по себе феноловый красный не воспламеняется, его раствор в этаноле легко воспламеняется.
Если 30 см 3 или 60 см 3 доступны флаконы-капельницы со встроенными пипетками, которые идеально подходят для дозирования растворов индикатора. Хотя сам по себе феноловый красный не воспламеняется, его раствор в этаноле легко воспламеняется. - Тимолфталеиновый индикатор – см. карточку опасности CLEAPSS HC032. Индикатор можно приобрести в виде твердого реагента или в виде готового раствора в этаноле. Раствор можно приготовить из твердых реагентов, приготовив 5% вес./об. раствор в этаноле (IDA). Если 30 см 3 или 60 см 3 доступны флаконы-капельницы со встроенными пипетками, которые идеально подходят для дозирования растворов индикатора. Хотя сам тимолфталеин не воспламеняется, его раствор в этаноле легко воспламеняется.
- Этанол (IDA – Промышленный денатурированный спирт), CH 3 CH 2 OH(l), (ЛЕГКО ВОСПЛАМЕНЯЕМЫЙ, ВРЕДНЫЙ) – см. CLEAPSS Hazcard HC040A.
- Раствор гидроксида натрия, NaOH (водн.
 ), (РАЗДРАЖАЮЩЕЕ при используемой концентрации) – см. CLEAPSS Hazcard HC091a и книгу рецептов CLEAPSS RB085.
), (РАЗДРАЖАЮЩЕЕ при используемой концентрации) – см. CLEAPSS Hazcard HC091a и книгу рецептов CLEAPSS RB085.
Процедура
Источник: Королевское общество химии
Активность 1- Место около 125 см 3 воды в 250 CM 3 Conical Clask.
- Добавьте в воду пять или шесть капель индикатора тимолфталеина.
- Добавьте ровно столько раствора гидроксида натрия (около двух или трех капель), чтобы получился синий цвет.
- Аккуратно поговорите или подуйте в колбу, т.е. добавьте углекислый газ.
- Продолжайте добавлять углекислый газ, пока не заметите изменение цвета.
- Поместите примерно 125 см 3 воды в 250 см 3 коническую колбу.
- Добавьте в воду одну или две капли фенолового красного.
- Добавьте две капли раствора гидроксида натрия, чтобы получить красный раствор.

- Говорите или осторожно дуйте в колбу – т.е. добавить углекислый газ.
- Продолжайте добавлять углекислый газ, пока не заметите изменение цвета.
Вопросы к классу
- Почему изменение цвета не происходит мгновенно?
- По какой причине перед каждым экспериментом добавляют несколько капель раствора гидроксида натрия (NaOH)?
Ответы на вопросы
- Количество углекислого газа в каждом вдохе невелико, поэтому для реакции со щелочью требуется много вдохов.
- Для обеспечения слабой щелочности раствора в начале и для нейтрализации любого CO
Учебные заметки
Соломинки не нужны для вдувания выдыхаемого воздуха в колбу; достаточно просто дышать или говорить в колбу, чтобы индикатор изменил цвет.
Индикатор феноловый красный меняет цвет с желтого на красный в диапазоне рН 6,8–8,4. Тимолфталеин (также можно использовать альтернативный бромтимоловый синий) меняет цвет с синего (щелочной) на бесцветный (кислотный) в диапазоне рН 9. .3–10,5. См. Книгу рецептов CLAPSS RB000, в которой также рассматривается раствор бикарбонатного индикатора.
.3–10,5. См. Книгу рецептов CLAPSS RB000, в которой также рассматривается раствор бикарбонатного индикатора.
Со временем достаточное количество углекислого газа из дыхания учащихся растворяется и образует в растворе достаточно кислоты, чтобы изменить цвет индикатора:
CO 2 (водн.) + H 2 O(л) ⇌ H + (водн.) + HCO 3 – (водн.)
CO 2 также реагирует с NaOH. Эта реакция дает менее щелочной Na 2 CO 3 :
2NaOH(водн.) + CO 2 (г) → Na 2 CO 3 (водн.) + H 2 O(ж)
Равновесие между углекислым газом и водой можно обратить нагревание слабокислого раствора чуть ниже температуры кипения. С повышением температуры растворимость углекислого газа в воде уменьшается, и он уносится в атмосферу. Поэтому концентрация растворенного диоксида углерода падает, что приводит к смещению равновесия влево и изменению цвета индикатора обратно на красный. При охлаждении раствора и повторном вдувании выдыхаемого воздуха в колбу последовательность действий можно повторить.
При охлаждении раствора и повторном вдувании выдыхаемого воздуха в колбу последовательность действий можно повторить.
Дополнительная информация
Это ресурс проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом. Эта коллекция из более чем 200 практических заданий демонстрирует широкий спектр химических концепций и процессов. Каждое задание содержит исчерпывающую информацию для учителей и техников, включая полные технические примечания и пошаговые инструкции. Практические занятия по химии сопровождают практические занятия по физике и практической биологии.
© Фонд Наффилда и Королевское химическое общество
Проверено на здоровье и безопасность, 2016 г.
Абсорбенты сильно различаются по своей способности производить соединение А и монооксид углерода
. 2000 г., июнь; 90(6):1428-35.
doi: 10. 1097/00000539-200006000-00033.
1097/00000539-200006000-00033.
CR Stabernack 1 , Р. Браун, М. Дж. Ластер, Р. Дудзяк, Э. И. Эгер, 2
Принадлежности
принадлежность
- 1 Кафедра анестезии Калифорнийского университета, Сан-Франциско, Калифорния 94143-0464, США.
- PMID: 10825335
- DOI: 10.1097/00000539-200006000-00033
CR Stabernack et al. Анест Анальг. 2000 июнь
. 2000 г., июнь; 90(6):1428-35.
doi: 10. 1097/00000539-200006000-00033.
1097/00000539-200006000-00033.
Авторы
C R Stabernack 1 , Р. Браун, М. Дж. Ластер, Р. Дудзяк, Э. И. Эгер, 2-й
принадлежность
- 1 Кафедра анестезии Калифорнийского университета, Сан-Франциско, Калифорния 94143-0464, США.
- PMID:
- DOI: 10.1097/00000539-200006000-00033
Абстрактный
Сохраняется озабоченность по поводу образования монооксида углерода (СО) и соединения А в результате действия абсорбентов диоксида углерода (СО(2)) на десфлюран и севофлуран соответственно. Мы проверили способность восьми различных абсорбентов с различным базовым составом производить CO и соединение A. Мы вводили десфлуран через высушенные абсорбенты, а севофлуран — через высушенные и влажные абсорбенты, затем измерили результирующие концентрации CO из первого и соединения A из второго. . Мы также проверили способность каждого абсорбента поглощать CO(2) с использованием модельной системы анестезии. Мы обнаружили, что присутствие гидроксида калия (КОН) и гидроксида натрия (NaOH) увеличивало образование СО из гидроксида кальция (Са[ОН](2)), но не всегда влияло на производство соединения А. Однако эффект КОН по сравнению с NaOH не было последовательным в его влиянии на производство CO. Кроме того, эффект KOH по сравнению с NaOH по сравнению с Ca(OH)(2) был непостоянным в его влиянии на образование соединения A. Два абсорбента (Amsorb) [Armstrong Medica, Ltd, Колрейн, Северная Ирландия], состоящие из Ca(OH)(2) плюс 0,7% поливинилпирролидина, хлорида кальция и сульфата кальция; и гидроксид лития) давали значительно более низкие концентрации как СО, так и соединения А.
Мы проверили способность восьми различных абсорбентов с различным базовым составом производить CO и соединение A. Мы вводили десфлуран через высушенные абсорбенты, а севофлуран — через высушенные и влажные абсорбенты, затем измерили результирующие концентрации CO из первого и соединения A из второго. . Мы также проверили способность каждого абсорбента поглощать CO(2) с использованием модельной системы анестезии. Мы обнаружили, что присутствие гидроксида калия (КОН) и гидроксида натрия (NaOH) увеличивало образование СО из гидроксида кальция (Са[ОН](2)), но не всегда влияло на производство соединения А. Однако эффект КОН по сравнению с NaOH не было последовательным в его влиянии на производство CO. Кроме того, эффект KOH по сравнению с NaOH по сравнению с Ca(OH)(2) был непостоянным в его влиянии на образование соединения A. Два абсорбента (Amsorb) [Armstrong Medica, Ltd, Колрейн, Северная Ирландия], состоящие из Ca(OH)(2) плюс 0,7% поливинилпирролидина, хлорида кальция и сульфата кальция; и гидроксид лития) давали значительно более низкие концентрации как СО, так и соединения А. Оба продуцировали минимальное количество СО или вообще не давали СО и только небольшие концентрации соединения А. Присутствие поливинилпирролидина, хлорида кальция и сульфата кальция в Амсорбе, по-видимому, подавляло образование токсичных продукты. Все абсорбенты имели достаточную поглощающую способность по СО(2), наибольшую у гидроксида лития.
Оба продуцировали минимальное количество СО или вообще не давали СО и только небольшие концентрации соединения А. Присутствие поливинилпирролидина, хлорида кальция и сульфата кальция в Амсорбе, по-видимому, подавляло образование токсичных продукты. Все абсорбенты имели достаточную поглощающую способность по СО(2), наибольшую у гидроксида лития.
Подразумеваемое: Производство токсичных веществ, окиси углерода и соединения А, в результате разложения анестетика абсорбентами двуокиси углерода может быть сведено к минимуму за счет использования одного из двух конкретных абсорбентов, Amsorb (Armstrong Medica, Ltd., Колрейн, Северная Ирландия) (гидроксид кальция, который также включает 0,7% поливинилпирролидина, хлорид кальция и сульфат кальция) или гидроксид лития.
Похожие статьи
Удаление гидроксидов натрия и калия из обезвоженной натронной извести уменьшает разложение десфлюрана до монооксида углерода и севофлюрана до соединения А, но не ухудшает абсорбцию диоксида углерода.

Нойманн М.А., Ластер М.Дж., Вайскопф Р.Б., Гонг Д.Х., Дудзяк Р., Фёрстер Х., Эгер Э.И. 2-й. Нейман М.А. и соавт. Анест Анальг. 1999 г., сентябрь 89(3):768-73. дои: 10.1097/00000539-199909000-00046. Анест Анальг. 1999. PMID: 10475323
Сравнение разложения амсорба, содалима и баралима летучих анестетиков и образования окиси углерода и соединения а у свиней in vivo.
Харащ Э.Д., Пауэрс К.М., Артру А.А. Хараш Э.Д. и соавт. Анестезиология. 2002 г., январь; 96 (1): 173–82. doi: 10.1097/00000542-200201000-00031. Анестезиология. 2002. PMID: 11753018
Производство соединения А и монооксида углерода в замкнутых системах: сравнение in vitro двух поглотителей диоксида углерода.

Струйс М.М., Буш М.П., Ролли Г., Вандевивер Ю.Д., Дайзерс Д., Гётейн В., Версихелен Л.Ф., Ван Бокслаер Д.Ф., Мортье Э.П. Стройс М.М. и соавт. Анестезия. 2004 г., июнь; 59 (6): 584-9. doi: 10.1111/j.1365-2044.2004.03704.x. Анестезия. 2004. PMID: 15144299
Абсорбция углекислого газа при ингаляционной анестезии: современная практика.
Фельдман Дж.М., Хендриккс Дж., Кеннеди Р.Р. Фельдман Дж. М. и соавт. Анест Анальг. 2021 1 апреля; 132 (4): 993-1002. doi: 10.1213/ANE.0000000000005137. Анест Анальг. 2021. PMID: 32947290 Обзор.
Механизмы образования оксида углерода ингаляционными агентами.
Coppens MJ, Versichelen LF, Rolly G, Mortier EP, Struys MM.
 Коппенс М.Дж. и соавт.
Анестезия. 2006 май; 61 (5): 462-8. doi: 10.1111/j.1365-2044.2006.04536.x.
Анестезия. 2006.
PMID: 16674622
Обзор.
Коппенс М.Дж. и соавт.
Анестезия. 2006 май; 61 (5): 462-8. doi: 10.1111/j.1365-2044.2006.04536.x.
Анестезия. 2006.
PMID: 16674622
Обзор.
Посмотреть все похожие статьи
Цитируется
Севофлуран.
Де Херт С., Мурман А. Де Херт С. и соавт. F1000рез. 2015 г., 25 августа; 4 (F1000, версия факультета): 626. doi: 10.12688/f1000research.6288.1. Электронная коллекция 2015. F1000рез. 2015. PMID: 26380072 Бесплатная статья ЧВК. Обзор.
Сравнение почечной безопасности продуктов, абсорбирующих углекислый газ, под анестезией севофлураном: пилотное исследование.
Lee HC, Kim D, Ahn W, Sim J, Chung Y.
 Ли Х.К. и др.
Корейский J Anesthesiol. 2012 июль; 63 (1): 11-7. doi: 10.4097/kjae.2012.63.1.11. Epub 2012 24 июля.
Корейский J Anesthesiol. 2012.
PMID: 22870359
Бесплатная статья ЧВК.
Ли Х.К. и др.
Корейский J Anesthesiol. 2012 июль; 63 (1): 11-7. doi: 10.4097/kjae.2012.63.1.11. Epub 2012 24 июля.
Корейский J Anesthesiol. 2012.
PMID: 22870359
Бесплатная статья ЧВК.Обнаружение образования угарного газа в результате взаимодействия пяти летучих анестетиков и высушенного натриевого извести с электрохимическим датчиком угарного газа в наркозном контуре по сравнению с газовой хроматографией.
Кейзер С., Перес Р.С., де Ланге Дж.Дж. Кейзер С. и др. J Clin Monit Comput. 2007 авг; 21 (4): 257-64. doi: 10.1007/s10877-007-9083-y. Epub 2007 28 июня. J Clin Monit Comput. 2007. PMID: 17597416
Производство угарного газа из пяти летучих анестетиков в сухом содалиме на модели пациента: галотан и севофлуран действительно производят угарный газ; температура является плохим предиктором образования угарного газа.



 Если 30 см 3 или 60 см 3 доступны флаконы-капельницы со встроенными пипетками, которые идеально подходят для дозирования растворов индикатора. Хотя сам по себе феноловый красный не воспламеняется, его раствор в этаноле легко воспламеняется.
Если 30 см 3 или 60 см 3 доступны флаконы-капельницы со встроенными пипетками, которые идеально подходят для дозирования растворов индикатора. Хотя сам по себе феноловый красный не воспламеняется, его раствор в этаноле легко воспламеняется. ), (РАЗДРАЖАЮЩЕЕ при используемой концентрации) – см. CLEAPSS Hazcard HC091a и книгу рецептов CLEAPSS RB085.
), (РАЗДРАЖАЮЩЕЕ при используемой концентрации) – см. CLEAPSS Hazcard HC091a и книгу рецептов CLEAPSS RB085.

 Коппенс М.Дж. и соавт.
Анестезия. 2006 май; 61 (5): 462-8. doi: 10.1111/j.1365-2044.2006.04536.x.
Анестезия. 2006.
PMID: 16674622
Обзор.
Коппенс М.Дж. и соавт.
Анестезия. 2006 май; 61 (5): 462-8. doi: 10.1111/j.1365-2044.2006.04536.x.
Анестезия. 2006.
PMID: 16674622
Обзор. Ли Х.К. и др.
Корейский J Anesthesiol. 2012 июль; 63 (1): 11-7. doi: 10.4097/kjae.2012.63.1.11. Epub 2012 24 июля.
Корейский J Anesthesiol. 2012.
PMID: 22870359
Бесплатная статья ЧВК.
Ли Х.К. и др.
Корейский J Anesthesiol. 2012 июль; 63 (1): 11-7. doi: 10.4097/kjae.2012.63.1.11. Epub 2012 24 июля.
Корейский J Anesthesiol. 2012.
PMID: 22870359
Бесплатная статья ЧВК.