Карбонат натрия — это… Что такое Карбонат натрия?
Карбона́т на́трия Na2CO3 — химическое соединение, натриевая соль угольной кислоты.
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — питьевая сода, натрий двууглекислый, бикарбонат натрия
Название «сода» происходит от растения Salsola Soda, из золы которого её добывали. Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать (то есть нагревать до высокой температуры).
Каустической содой называют гидроксид натрия (NaOH).
Оксиды и гидроксиды
| Для Na | Для С | |
|---|---|---|
| Гидроксид | NaOH | H2CO3 |
| Оксид | Na2O | CO2 |
Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде следующих минералов:
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
Получение
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей и прибрежных растений.
Способ Леблана
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
- Na2SO4 + 2C → Na2S + 2CO2↑.
Сульфид натрия реагирует с карбонатом кальция:
- Na2S + СаСО3 → Na2CO3 + CaS.
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
- 2NaCl + H2SO4 → Na2SO4 + 2HCl↑.
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
 Карбонат натрия
Карбонат натрияВ 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH 4HCO3:
- NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl.
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
- 2NaHCO3 →(t) Na2CO3 + CO2↑ + H2O.
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
- 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O,
и полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция, не имеющий широкого промышленного применения, кроме использования в качестве противообледеняющего реагента для посыпания улиц.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказал фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).[источник не указан 293 дня]
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год)[2].
Свойства
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O.
Безводный карбонат натрия представляет собой бесцветный кристаллический порошок.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 852 °C (по другим источникам, 853 °C) | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, мало растворим в этаноле хорошо растворим в глицерине, и воде (см. таблицу ниже) | растворим в воде, не растворим в этаноле |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
CO32− + H2O ↔ HCO3− + OH−
Первая константа диссоциации угольной кислоты равна 4,5·10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
Применение
Карбонат натрия используют в стекольном производстве, мыловарении и производстве стиральных и чистящих порошков, эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще устранения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Карбонат натрия (кальцинированная сода) Название и функция вещества:
Карбонат натрия (кальцинированная сода) — регулятор кислотности; окислитель. Имеется в составе жидкости для мытья посуды, сигарет, пестицидов.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E500, регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию.
Примечания
Натрий углекислый
Натрий углекислый ГОСТ 83-79
Na2CO3
Карбонат натрия Na2CO3 — химическое соединение, натриевая соль угольной кислоты.
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O. В интервале 100-120 °C моногидрат теряет воду. Плавится при 852 °C, при дальнейшем нагревании разлагается (выше 1000 °C).
Безводный карбонат натрия представляет собой бесцветный порошок.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 852 °C (по другим источникам, 853 °C) | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, малорастворим в этаноле, хорошо растворим в глицерине и воде | |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образованияΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
Первая константа диссоциации угольной кислоты равна 4,5·10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
Применение
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii.Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах.
Одна из новейших технологий повышения нефтеотдачи пластов — АСП заводнение, в котором применяется сода в сочетании с ПАВ для снижения межфазного натяжения между водой и нефтью
Также используется для приготовления фотографических проявителей как ускоряющее средство.
Натрий углекислый безводный (натрий карбонат)
Химическая формула: Na2CO3
Синоним: Натрий карбонат
Международное название: Sodium carbonate anhydrous
CAS No: CAS 497-19-8
Квалификация: «хч»
Внешний вид: белый порошок без запаха
Фасовка: мешки, 35 кг
Условия хранения: в сухом, хорошо проветриваемом помещении
Молекулярная масса | 105,99 |
Насыпная плотность | 1100 кг/м3 |
Температура плавления | 854°C |
Температура кипения | 1600°C |
Плотность | 2,53 г/см3 (20°C) |
Основное вещество, не менее | 99,8% |
Потери при прокаливании, не более | 0,25% (по факт. 0,1%) |
Нераств. в воде веществ, не более | 0,004 % |
Общий азот (N), не более | 0,001 % |
Содержание кремнекислоты (SiO2), не более | 0,003 % |
Содержание серы в пересчете на(SO4), не более | 0,002 % |
Содержание фосфатов (PO4), не более | 0,001% |
Содержание хлоридов (Сl), не более | 0,001% |
Содержание алюминия (Al), не более | 0,0003% |
Содержание железа (Fe), не более | 0,0003% |
Содержание калия (К), не более | 0,005% (по факт. 0,002%) |
Ca и Mg в пересчете на (Mg), не более | 0,005 % (по факт. 0,001%) |
Содержание мышьяка (As), не более | 0,00002 % |
Содержание тяжелых металлов, не более | 0,0005% |
(383) 289- 98- 09, (383) 289- 98- 08
(383) 279-97-52
(383) 279-98-76
Натрий углекислый безводный (Натрий карбонат) представляет собой белый порошок без запаха. Растворимость: 12 г в 100 мл воды при 10°С. Раствор имеет щелочную реакцию. 1 часть безводной соды может быть заменена 2,7 части кристаллической.
Применение
Карбонат натрия используют в стекольном производстве, мыловарении, производстве стиральных и чистящих порошков, эмалей, для получения ультрамарина.
Натрий карбонат применяется для смягчения воды паровых котлов и устранения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна.
Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4.
В пищевой промышленности Натрий углекислый безводный используется в качестве регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию.
Натрий углекислый кислый — ООО ХПК-ГРУПП г. Пенза
Химическая формула:NaHCO3
Международное название:SODIUM BICARBONATE
CAS No:144-55-8
Синонимы: Натрий бикарбонат, Питьевая сода, Пищевая сода, бикарбонат натрия, натрий двууглекислый, гидрокарбонат натрия, Натрий гидрокарбонат
Внешний вид:порошок белого цвета
Фасовка:мешки, 25 кг
Условия хранения:в сухом, хорошо проветриваемом помещении
Товар в наличии на складе 
| Спецификация | |
|---|---|
| Молекулярный вес | 84.01 |
| PH, не более | 8,6 |
| Массовая доля NaHCO3, не менее | 99 % |
| Потери при высушивании, не более | 0,2 % |
| Тяжелых металлов (как Pb), не более | 0,0005% |
| Содержание As, не более | 0,0001% |
Натрий углекислый кислый или другие названия бикарбонат натрия, натрий двууглекислый, натрий гидрокарбонат NaHCO3, а также в обиходе его часто называют питьевая сода или пищевая сода — это химическое соединение, кислая натриевая соль угольной кислоты. Натрий углекислый кислый представляет собой порошок тонкого помола белого цвета.
Бикарбонат натрия реагирует с кислотами, с образованием соли и угольной кислоты, которая тут же распадается на углекислый газ и воду:
NaHCO3 + HCl → NaCl + h3CO3
h3CO3 → h3O + CO2↑
В кулинарии чаще встречается такая реакция с уксусной кислотой, с образованием ацетата натрия:
NaHCO3 + Ch4COOH → Ch4COONa + h3O + CO2↑
Применение натрия двууглекислого
Натрий углекислый кислый, или натрий бикарбонат применяется
• в химической промышленности, для производства красителей, пенопластов и других органических продуктов, фтористых реактивов, товаров бытовой химии, наполнителей в огнетушителях, для отделения двуокиси углерода, сероводорода из газовых смесей,
• в цветной металлургии,
• в легкой промышленности, в производстве подошвенных резин и искусственных кож, кожевенном производстве (дубление и нейтрализация кож), текстильной промышленности (отделка шелковых и хлопчатобумажных тканей),
• в медицинской и фармацевтической промышленности,
• в пищевой промышленности натрий двууглекислый применяется очень широко — зарегистрирован в качестве пищевой добавки E500. Натрий бикарбонат используется в хлебопечении, в производстве кондитерских изделий, приготовлении напитков и т.д.
углекислый натрий — это… Что такое углекислый натрий?
- углекислый натрий
карбонат натрия
Cловарь химических синонимов I . Под редакцией С. Собецкой, В. Хоинского и П. Майорек. 2013.
- углекислый марганец(II)
- углекислый никель(II)
Смотреть что такое «углекислый натрий» в других словарях:
УГЛЕКИСЛЫЙ НАТРИЙ — (сода), термин используется для обозначения соединений натрия, чаще для определения КАРБОНАТА НАТРИЯ и ГИДРОКАРБОНАТА НАТРИЯ … Научно-технический энциклопедический словарь
углекислый натрий — i Регулятор кислотности пищевого продукта, получаемый термической обработкой гидрокарбоната натрия, находящегося в природных залежах, содержащий основного вещества Na2CO3 не менее 99,0 % по безводной соли, свинца не более 5,0 мг/кг,… … Справочник технического переводчика
кислый углекислый натрий — ii Регулятор кислотности пищевого продукта, получаемый термической обработкой гидрокарбоната натрия, находящегося в природных залежах, содержащий основного вещества Na2HCO3 не менее 99,0 % по безводной соли, свинца не более 5,0 мг/кг, имеющий… … Справочник технического переводчика
кислый углекислый натрий — бикарбонат натрия … Cловарь химических синонимов I
НАТРИЙ — (греч. nitron, лат. natrum). Металл белого цвета, составляющий часть поваренной соли, соды, селитры и др. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. НАТРИЙ белый блестящий мягкий металл, быстро окисляющийся в… … Словарь иностранных слов русского языка
Натрий двууглекислый — Гидрокарбонат натрия NaHCO3 (другие названия: питьевая сода, пищевая сода, бикарбонат натрия, натрий двууглекислый) кристаллическая соль, однако чаще всего она встречается в виде порошка тонкого помола белого цвета. Химическая формула Содержание… … Википедия
Натрий* — (хим.; нем. Natrium, франц. и англ. Sodium). Сведения о соединениях этого металла ведут свое начало от очень старых времен. Еврейское слово neter (греч. νίτρον, лат. nitrum) встречается в Библии как название вещества, которое, по Соломону,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Натрий — (хим.; нем. Natrium, франц. и англ. Sodium). Сведения о соединениях этого металла ведут свое начало от очень старых времен. Еврейское слово neter (греч. νίτρον, лат. nitrum) встречается в Библии как название вещества, которое, по Соломону,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
натрий углекислый — natrio hidrokarbonatas statusas T sritis chemija formulė NaHCO₃ atitikmenys: angl. backing soda; sodium bicarbonate; sodium hydrocarbonate; sodium hydrogen carbonate rus. натрий углекислый; натрия бикарбонат; натрия гидрокарбонат; пищевая сода… … Chemijos terminų aiškinamasis žodynas
натрий углекислый — natrio karbonatas statusas T sritis chemija formulė Na₂CO₃ atitikmenys: angl. calcined soda; soda ash; sodium carbonate rus. кальцинированная сода; натрий углекислый; натрия карбонат ryšiai: sinonimas – dinatrio trioksokarbonatas sinonimas –… … Chemijos terminų aiškinamasis žodynas
УГЛЕКИСЛЫЙ НАТРИЙ — это… Что такое УГЛЕКИСЛЫЙ НАТРИЙ?
- УГЛЕКИСЛЫЙ НАТРИЙ
УГЛЕКИСЛЫЙ НАТРИЙ (сода), термин используется для обозначения соединений натрия, чаще — для определения КАРБОНАТА НАТРИЯ и ГИДРОКАРБОНАТА НАТРИЯ.
Научно-технический энциклопедический словарь.
- УГЛЕКИСЛЫЙ КАЛИЙ
- УГЛЕРОД
Смотреть что такое «УГЛЕКИСЛЫЙ НАТРИЙ» в других словарях:
углекислый натрий — i Регулятор кислотности пищевого продукта, получаемый термической обработкой гидрокарбоната натрия, находящегося в природных залежах, содержащий основного вещества Na2CO3 не менее 99,0 % по безводной соли, свинца не более 5,0 мг/кг,… … Справочник технического переводчика
углекислый натрий — карбонат натрия … Cловарь химических синонимов I
кислый углекислый натрий — ii Регулятор кислотности пищевого продукта, получаемый термической обработкой гидрокарбоната натрия, находящегося в природных залежах, содержащий основного вещества Na2HCO3 не менее 99,0 % по безводной соли, свинца не более 5,0 мг/кг, имеющий… … Справочник технического переводчика
кислый углекислый натрий — бикарбонат натрия … Cловарь химических синонимов I
НАТРИЙ — (греч. nitron, лат. natrum). Металл белого цвета, составляющий часть поваренной соли, соды, селитры и др. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. НАТРИЙ белый блестящий мягкий металл, быстро окисляющийся в… … Словарь иностранных слов русского языка
Натрий двууглекислый — Гидрокарбонат натрия NaHCO3 (другие названия: питьевая сода, пищевая сода, бикарбонат натрия, натрий двууглекислый) кристаллическая соль, однако чаще всего она встречается в виде порошка тонкого помола белого цвета. Химическая формула Содержание… … Википедия
Натрий* — (хим.; нем. Natrium, франц. и англ. Sodium). Сведения о соединениях этого металла ведут свое начало от очень старых времен. Еврейское слово neter (греч. νίτρον, лат. nitrum) встречается в Библии как название вещества, которое, по Соломону,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Натрий — (хим.; нем. Natrium, франц. и англ. Sodium). Сведения о соединениях этого металла ведут свое начало от очень старых времен. Еврейское слово neter (греч. νίτρον, лат. nitrum) встречается в Библии как название вещества, которое, по Соломону,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
натрий углекислый — natrio hidrokarbonatas statusas T sritis chemija formulė NaHCO₃ atitikmenys: angl. backing soda; sodium bicarbonate; sodium hydrocarbonate; sodium hydrogen carbonate rus. натрий углекислый; натрия бикарбонат; натрия гидрокарбонат; пищевая сода… … Chemijos terminų aiškinamasis žodynas
натрий углекислый — natrio karbonatas statusas T sritis chemija formulė Na₂CO₃ atitikmenys: angl. calcined soda; soda ash; sodium carbonate rus. кальцинированная сода; натрий углекислый; натрия карбонат ryšiai: sinonimas – dinatrio trioksokarbonatas sinonimas –… … Chemijos terminų aiškinamasis žodynas
формула и использование в химической промышленности
Кальцинированная сода, формула которой известна с давних времен, уже давно применяется во многих сферах. Многие хозяйки используют ее в быту. Ведь кальцинированная сода — это моющее средство, натуральное и безопасное.
формула и состав
Примерно лет 20 назад в каждом доме имелась упаковка этого удивительного средства. Что же собой представляет кальцинированная сода? Формула данного вещества — Na2CO3. По сути, это натриевая Это вещество представляет собой смесь мелких и крупных кристаллов белого цвета.
Стоит отметить, что порошок из окружающей среды поглощает влагу. В результате этого кальцинированная сода быстро слеживается. Поэтому рекомендуют хранить это вещество в закрытой емкости, а также в тех помещениях, где не очень высокий уровень влажности.
В промышленности для этого вещества существует ГОСТ. Сода кальцинированная выпускается согласно документу 5100 85, который был принят еще в советское время. Однако ГОСТ действует до сих пор. Согласно данной технологии, вещество делят на несколько марок: А и Б. По массовому содержанию определенных химических элементов эти составы отличаются. Это позволяет использовать каждую марку в отдельной отрасли промышленности.
Как получают это средство?
Производство соды кальцинированной — это сложные химические процессы. Стоит отметить, что в природе в чистом виде это вещество существует, и это открытие было сделано в начале 19 века. Изначально его получали из золы, полученной в результате сожжения прибрежных растений, а также из некоторых водорослей. Конечно, человечество эволюционировало, и вместе с ним развились новые технологии. К тому же было обнаружено крупное место залегания этого вещества.
На данный момент кальцинированная сода, формула которой указана выше, изготавливается несколькими способами, такими как:
- Получение из природного вещества.
- Аммиачный метод.
- Получение из нефелинового сырья.
- Карбонизация
Получение из природного сырья
Этот способ изготовления кальцинированной соды представляет собой новую промышленную отрасль. Она появилась относительно недавно, но стала основным конкурентом для тех, кто добывает это вещество аммиачным способом.
Стоит отметить, что метод был известен уже давно. Однако только в начале 20 века его смогли применить на практике. Началом для бурного развития данного направления стало открытие богатейших залежей соды (троны) в США.
Основан метод получения кальцинированной соды из природного сырья на переработке щелоков и рапы, которые образуются при растворении отложений соды. Стоит отметить, что помимо углекислого натрия в большинстве случаев удается выделить и другие компоненты, которые входят в состав исходных веществ.
Способ Леблана
Это еще один не менее популярный способ, позволяющий получить такое вещество, как сода кальцинированная. Состав данного вещества достаточно прост, и его легко выделить из других веществ. Этот способ основан на сплавлении смеси угля и во вращающихся печах. Температура в них может достигать 1000°С. В результате этого процесса образуется содовый сплав — это сырая сода. После этого вещество подвергается выщелачиванию водой. Это требуется для извлечения из содового раствора соды.
Полученный раствор должен хорошо отстояться. Затем щелок очищают, выпаривают из него влагу, кальцинируют — прокаливают, а после измельчают в порошок. Как правило, для изготовления соды используют известняк, мел и соль.
Полезные свойства
Гост «Сода кальцинированная» 5100 85 не менялся на протяжении многих десятилетий. Благодаря разработанной технологии производства данное вещество обладает уникальными свойствами. Кальцинированная сода применяется не только в промышленности, но и в быту. Среди всех полезных качеств этого состава стоит выделить:
- Способность хорошо удалять старую грязь, краску, жирные пятна.
- Хорошо очищает раковины, кафель, фарфор, эмаль и керамику.
- Справляется практически с любыми засорами в трубах.
- Смягчает воду.
- Отстирывает даже застаревшие пятна с одежды.
- Позволяет побороть садовых вредителей.
- Хорошо дезинфицирует.
Вред соды
Сода кальцинированная, техническая обладает не только достоинствами. Это вещество имеет и некоторые недостатки. Конечно, нельзя сказать, что состав способен вызвать какой-либо вред. Это будет неправильно. Скорее неправильное применение кальцинированной соды может привести к возникновению каких-либо побочных эффектов. В результате появляются негативные отзывы о средстве.
Чаще всего отмечается несоблюдение мер предосторожности, а также дозировок. Раствор кальцинированной соды — это агрессивное вещество. Ошибки в дозировках, а также нарушения процесса использования могут нанести здоровью человека вред. Поэтому при работе с веществом следует помнить о правилах безопасности. К тому же не стоит забывать о том, что кальцинированная сода подходит далеко не для всех материалов.
Меры предосторожности
Какими свойствами обладает сода кальцинированная? Состав вещества указывает на его безопасность. Поэтому кальцинированную соду часто используют в быту. Это вещество отличается белым цветом и кристаллической структурой. Раствор соды обладает сильно выраженным щелочным эффектом. Однако само по себе вещество считается взрыво- и пожаробезопасным. Но из-за деятельности человека его относят к третьему классу.
Сода кальцинированная, техническая — это химически активный состав. При работе с этим веществом следует соблюдать правила безопасности. Если сода попала на слизистую, то это может вызвать сильнейшее раздражение тканей. В некоторых случаях возникают даже ожоги. Если вещество попало на кожу или же в глаза, то рекомендуется промыть хорошо чистой водой пораженный участок.
Не стоит забывать, что кальцинированная сода поглощает влагу. В результате ее соединения с водой образуется агрессивный раствор. Поэтому не рекомендуется использовать кальцинированную соду в помещениях, где отмечен высокий показатель влажности воздуха.
Применение в промышленности
В промышленности часто используется сода кальцинированная. Характеристика и свойства этого вещества позволяют применять его во многих отраслях. Некоторые производственные процессы очень сложно представить без участия данного компонента. К основным областям применения кальцинированной соды в промышленности стоит отнести:
Это вещество просто незаменимо. Кальцинированная сода применяется даже при производстве медикаментов. Его используют здесь в качестве средства для очистки, элемента для синтеза прочих химических компоне
Карбонат натрия — синтез (процесс Solvey), использование, структура, формула и свойства
- Классы
- Класс 1-3
- Класс 4-5
- Класс 6-10
- Класс 11-12
- КОНКУРЕНТНЫЙ ЭКЗАМЕН
- BNAT 000 NC
- BNAT 000 Книги
- Книги NCERT для класса 5
- Книги NCERT для класса 6
- Книги NCERT для класса 7
- Книги NCERT для класса 8
- Книги NCERT для класса 9
- Книги NCERT для класса 10
- Книги NCERT для класса 11
- Книги NCERT для класса 12
- NCERT Exemplar
- NCERT Exemplar Class 8
- NCERT Exemplar Class 9
- NCERT Exemplar Class 10
- NCERT Exemplar Class 11
- NCERT Exemplar Class 11
- NCERT 9000 9000
- NCERT
- Решения RS Aggarwal, класс 12
- Решения RS Aggarwal, класс 11
- Решения RS Aggarwal, класс 10 90 003 Решения RS Aggarwal класса 9
- Решения RS Aggarwal класса 8
- Решения RS Aggarwal класса 7
- Решения RS Aggarwal класса 6
- Решения RD Sharma
- RD Sharma Class 6 Решения
- Решения RD Sharma Решения RD Sharma класса 8
- Решения RD Sharma класса 9
- Решения RD Sharma класса 10
- Решения RD Sharma класса 11
- Решения RD Sharma класса 12
- BNAT 000 Книги
- PHYSICS
- Механика
- Оптика
- Термодинамика Электромагнетизм
- ХИМИЯ
- Органическая химия
- Неорганическая химия
- Периодическая таблица
- MATHS
- Теорема Пифагора
- 000
- 00030003000300030004
- Простые числа
- Взаимосвязи и функции
- Последовательности и серии
- Таблицы умножения
- Детерминанты и матрицы
- Прибыль и убыток
- Полиномиальные уравнения
- Деление фракций
- 000
- 000
- 000
- 000
- 000 BIOG3000
- Математические формулы
- Алгебраные формулы
- Тригонометрические формулы
- Геометрические формулы
- FORMULAS
- КАЛЬКУЛЯТОРЫ
- Математические калькуляторы
- 000 PBS4000
- 000
- 000 Физические калькуляторы
- 000
- 000
- 000 PBS4000
- 000
- 000 Калькуляторы для химии Класс 6
- Образцы бумаги CBSE для класса 7
- Образцы бумаги CBSE для класса 8
- Образцы бумаги CBSE для класса 9
- Образцы бумаги CBSE для класса 10
- Образцы бумаги CBSE для класса 11
- Образцы бумаги CBSE чел. для класса 12
- BNAT 000 NC
- CBSE, вопросник за предыдущий год
- CBSE, вопросник за предыдущий год, класс 10
- CBSE, вопросник за предыдущий год, класс 12
- HC Verma Solutions
- HC Verma Solutions, класс 11, физика
- Решения HC Verma, класс 12, физика
- Решения Лахмира Сингха
- Решения Лакмира Сингха, класс 9
- Решения Лакмира Сингха, класс 10
- Решения Лакмира Сингха, класс 8
- Заметки CBSE
- , класс
- CBSE Notes
- Примечания CBSE класса 7
- Примечания CBSE класса 8
- Примечания CBSE класса 9
- Примечания CBSE класса 10
- Примечания CBSE класса 11
- Примечания CBSE класса 12
- Классы
- Примечания к редакции CBSE
- Примечания к редакции
- CBSE Class
- Примечания к редакции класса 10 CBSE
- Примечания к редакции класса 11 CBSE 9000 4
- Примечания к редакции класса 12 CBSE
- Дополнительные вопросы CBSE
- Дополнительные вопросы по математике класса 8 CBSE
- Дополнительные вопросы по науке 8 класса CBSE
- Дополнительные вопросы по математике класса 9 CBSE
- Дополнительные вопросы по науке класса 9 CBSE
Дополнительные вопросы по математике для класса 10
- CBSE Class
- Дополнительные вопросы по науке, класс 10 по CBSE
- Примечания к редакции
- CBSE, класс
- , класс 3
- , класс 4
- , класс 5
- , класс 6
- , класс 7
- , класс 8
- , класс 9 Класс 10
- Класс 11
- Класс 12
- Учебные решения
- Решения NCERT для класса 11
- Решения NCERT для класса 11 по физике
- Решения NCERT для класса 11 Химия Решения для биологии класса 11
- Решения NCERT для математики класса 11 9 0003 NCERT Solutions Class 11 Accountancy
- NCERT Solutions For Класс 12 по физике
- Решения NCERT для химии класса 12
- Решения NCERT для класса 12 по биологии
- Решения NCERT для класса 12 по математике
- Решения NCERT Бухгалтерский учет 12 класса
- Решения NCERT Класс 12 Бизнес-исследования
- Решения NCERT, класс 12 Экономика
- NCERT Solutions Class 12 Accountancy Part 1
- NCERT Solutions Class 12 Accountancy Part 2
- NCERT Solutions Class 12 Micro-Economics
- NCERT Solutions Class 12 Commerce
- NCERT Solutions Class 12 Macro-Economics
- Решения NCERT для математики класса 4
- Решения NCERT для класса 4 EVS
- Решения NCERT для математики класса 5
- Решения NCERT для класса 5 EVS
- Решения NCERT для математики 6 класса
- Решения NCERT для науки 6 класса
- Решения NCERT для 6 класса социальных наук
- Решения NCERT для 6 класса Английский
- Решения NCERT для класса 7 Математика
- Решения NCERT для класса 7 Наука
- Решения NCERT для класса 7 по социальным наукам
- Решения NCERT для класса 7 Английский
- Решения NCERT для класса 8 Математика
- Решения NCERT для класса 8 Наука
- Решения NCERT для социальных наук 8 класса
- Решение NCERT ns для класса 8 Английский
- Решения NCERT для социальных наук класса 9
- Решения NCERT для математики класса 9 Глава 1
- Решения NCERT для Математика класса 9 Глава 2
- Решения NCERT для математики класса 9 Глава 3
- Решения NCERT для математики класса 9 Глава 4
- Решения NCERT для математики класса 9 Глава 5
- Решения NCERT для математики класса 9 Глава 6
- Решения NCERT для Математика класса 9 Глава 7
- Решения NCERT для математики класса 9 Глава 8
- Решения NCERT для математики класса 9 Глава 9 Решения NCERT
- для математики класса 9 Глава 10
- Решения NCERT для математики класса 9 Глава 11
- Решения NCERT для Математика класса 9 Глава 12
- Решения NCERT для математики класса 9 Глава 13 Решения
- NCERT для математики класса 9 Глава 14
- Решения NCERT для математики класса 9 Глава 15
- Решения NCERT для науки класса 9 Глава 1
- Решения NCERT для науки класса 9 Глава 2
- Решения NCERT для класса 9 Наука, глава 3
- Решения NCERT для класса 9, наука, глава 4
- Решения NCERT для науки класса 9, глава 5
- Решения NCERT для класса 9, глава 6
- Решения NCERT для науки класса 9, глава 7
- Решения NCERT для класса 9 Наука Глава 8
- Решения NCERT для Науки Класса 9 Глава 9
- Решения NCERT для Науки Класса 9 Глава 10
- Решения NCERT для Науки Класса 9 Глава 12
- Решения NCERT для Науки Класса 9 Глава 11
- Решения NCERT для Класса 9 Наука Глава 13
- Решения NCERT для класса 9 Наука Глава 14
- Решения NCERT для класса 9 по науке Глава 15
- Решения NCERT для класса 10 по социальным наукам
- Решения NCERT для математики класса 10 Глава 1
- Решения NCERT для математики класса 10 Глава 2
- Решения NCERT для математики класса 10 Глава 3
- Решения NCERT для математики класса 10 Глава 4
- Решения NCERT для математики класса 10 Глава 5
- Решения NCERT для математики класса 10 Глава 6
- Решения NCERT для математики класса 10 Глава 7
- Решения NCERT для математики класса 10 Глава 8
- Решения NCERT для математики класса 10 Глава 9
- Решения NCERT для математики класса 10 Глава 10
- Решения NCERT для математики класса 10 Глава 11
- Решения NCERT по математике класса 10 Глава 12
- Решения NCERT по математике класса 10 Глава 13
- NCERT Sol
- Решения NCERT для математики класса 10 Глава 15
- Решения NCERT для науки 10 класса Глава 1
- Решения NCERT для науки 10 класса Глава 2
- Решения NCERT для науки класса 10, глава 3
- Решения NCERT для науки класса 10, глава 4
- Решения NCERT для науки класса 10, глава 5
- Решения NCERT для науки класса 10, глава 6
- Решения NCERT для науки класса 10, глава 7
- Решения NCERT для науки класса 10, глава 8
- Решения NCERT для науки класса 10, глава 9
- Решения NCERT для науки класса 10, глава 10
- Решения NCERT для науки класса 10, глава 11
- Решения NCERT для науки класса 10, глава 12
- Решения NCERT для науки 10 класса Глава 13
- Решения NCERT для науки 10 класса Глава 14
- Решения NCERT для науки класса 10 Глава 15 Решения NCERT
- для науки класса 10 Глава 16
- Class 11 Commerce Syllabus 110002ancy Account
- Программа обучения бизнесу 11 класса
- Программа курса экономики 11 класса
Формула гидрокарбоната натрия — гидрокарбонат натрия Использование, свойства, структура и формула
Формула и структура: Химическая формула гидрокарбоната натрия — NaHCO 3 , а его молярная масса составляет 84,007 г / моль. Его химическая структура показана ниже. Это ионное соединение, состоящее из катионов натрия (Na + ) и бикарбонат-анионов (HCO 3 — ).

Происхождение: Гидрокарбонат натрия встречается в природе в виде минерала нахколита, который содержится во многих минеральных источниках.Это основной источник этого материала.
Приготовление: Гидрокарбонат натрия также получают в больших масштабах с помощью процесса Сольвея, в котором хлорид натрия реагирует с аммиаком, диоксидом углерода и водой с образованием NaHCO 3 вместе с солью хлорида аммония (NH 4 Cl).
NaCl + NH 3 + CO 2 + H 2 O → NaHCO 3 + NH 4 Cl
Другой основной метод приготовления включает растворение кальцинированной соды (минерал карбонат натрия) в воде и пропускание через раствор диоксида углерода.
Na 2 CO 3 + CO 2 + H 2 O → 2 NaHCO 3
Физические свойства: Гидрокарбонат натрия представляет собой белое кристаллическое твердое вещество без запаха с плотностью 2,2 г / мл. Он также обычно доступен в виде мелкого белого порошка с плотностью 1,2 г / мл. Его температура плавления составляет 50 ° C, и он хорошо растворяется в воде.
Химические свойства: NaHCO 3 растворяется в воде с образованием слабокислой угольной кислоты (H 2 CO 3 ) и основных гидроксид-ионов, что в целом делает его слабым основанием.Гидрокарбонат натрия реагирует с кислотами с образованием солей и угольной кислоты, которая затем разлагается на углекислый газ и воду:
NaHCO 3 + HCl → NaCl + H 2 CO 3 → H 2 O + CO 2
При нагревании разлагается на карбонат натрия, воду и диоксид углерода:
2 NaHCO 3 → Na 2 CO 3 + H 2 O + CO 2
Он также реагирует с основаниями, такими как гидроксид натрия, с образованием карбоната натрия:
NaHCO 3 + NaOH → Na 2 CO 3 + H 2 O
Применение: Гидрокарбонат натрия обычно используется в качестве антацида, в разрыхлителе, в качестве поглотителя запаха, осушающего агента и в зубных пастах.Он также используется в качестве антипирена, в фейерверках, для мягкой дезинфекции, борьбы с вредителями, балансировки pH, удаления краски и очистки металлов.
Воздействие на здоровье / опасность для здоровья: Не считается токсичным или опасным. Однако попадание в глаза или на кожу концентрированных растворов NaHCO 3 может вызвать сильное раздражение глаз и кожи.
.Молекулярная масса карбоната натрия
Молярная масса of Na2CO3 = 105,98844 г / моль
Перевести граммы карбоната натрия в моль или моль карбоната натрия в граммы
Расчет молекулярной массы:
22.989770 * 2 + 12.0107 + 15.9994 * 3
| Элемент | Условное обозначение | Атомная масса | Количество атомов | Массовый процент |
| Натрий | Na | 22.989770 | 2 | 43,382% |
| Углерод | С | 12.0107 | 1 | 11,332% |
| Кислород | O | 15.9994 | 3 | 45,286% |
Обратите внимание, что все формулы чувствительны к регистру.
Вы хотели найти молекулярную массу одной из этих похожих формул?
Na2CO3
Na2Co3
В химии вес формулы — это величина, вычисляемая путем умножения атомного веса (в единицах атомной массы) каждого элемента в химической формуле на количество атомов этого элемента, присутствующего в формуле, с последующим сложением всех этих продуктов вместе.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные веса и вычислить молекулярную массу вещества.
Часто на этом сайте просят перевести граммы в моль. Чтобы выполнить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать. Причина в том, что на конверсию влияет молярная масса вещества. Этот сайт объясняет, как найти молярную массу.
Определение молярной массы начинается с единиц граммов на моль (г / моль).При расчете молекулярной массы химического соединения он говорит нам, сколько граммов содержится в одном моль этого вещества. Вес формулы — это просто вес в атомных единицах массы всех атомов в данной формуле.
Формула веса особенно полезна при определении относительного веса реагентов и продуктов в химической реакции. Эти относительные веса, вычисленные по химическому уравнению, иногда называют весами по уравнениям.
Атомные веса, используемые на этом сайте, получены от Национального института стандартов и технологий NIST.Мы используем самые распространенные изотопы. Вот как рассчитать молярную массу (средний молекулярный вес), которая основана на изотропно взвешенных средних. Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов. Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
Если формула, используемая для вычисления молярной массы, является молекулярной формулой, вычисленная формула веса является молекулярной массой.Весовой процент любого атома или группы атомов в соединении можно вычислить, разделив общий вес атома (или группы атомов) в формуле на вес формулы и умножив на 100.
,Бикарбонат натрия Формула
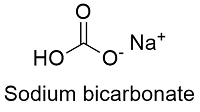
Формула и структура: Химическая формула бикарбоната натрия — NaHCO 3 , а его молярная масса составляет 84,006 г / моль -1 . Молекула образована катионом натрия Na + и бикарбонат-анионом HCO 3 — . Структура решетки бикарбоната натрия моноклинная. Его химическая структура может быть записана, как показано ниже, в общих представлениях, используемых для органических молекул.
Происхождение: Бикарбонат натрия обнаружен в месторождениях по всему миру.Месторождения этой соли называют нахколитом.
Получение: Хотя бикарбонат натрия встречается в природе, его получают в основном синтетическими методами. Наиболее часто используется процесс Solvay, в котором хлорид натрия, аммиак и диоксид углерода реагируют с образованием карбоната натрия, который реагирует с диоксидом углерода и водой с образованием бикарбоната натрия.
NaCl + NH 3 + CO 2 + H 2 O → Na 2 CO 3 + NH 4 Cl
Na 2 CO 3 + CO 2 + H 2 O → 2 NaHCO 3
Физические свойства: Бикарбонат натрия представляет собой белое кристаллическое твердое вещество или мелкий порошок без запаха.Имеет слегка щелочной вкус. Его плотность составляет 2,20 г / мл -1 , и он разлагается при температуре выше 50 ºC. При разложении образуется карбонат натрия. Он хорошо растворяется в воде и плохо растворяется в ацетоне и метаноле. Не растворяется в этаноле.
Химические свойства: Бикарбонат натрия является амфотерным соединением, это означает, что соединение имеет одновременно кислотный и основной характер. Он хорошо растворяется в воде, что приводит к образованию слабощелочного раствора, который очень часто используется для приготовления растворов акалиса:
HCO 3 — + H 2 O → H 2 CO 3 + OH —
Реакции в растворах кислот приводят к образованию натриевой соли и угольной кислоты (реакция I), в то время как в основных растворах образуются карбонаты и вода (реакция II):
NaHCO 3 + HCl → NaCl + H 2 CO 3 (I)
H 2 CO 3 → H 2 O + CO 2 (г)
NaHCO 3 + NaOH → Na 2 CO 3 + H 2 O (II)
Другой важной реакцией бикарбоната натрия является разложение при температуре выше 50 ºC с образованием карбоната натрия, воды и диоксида углерода.
2 NaHCO 3 → Na 2 CO 3 + H 2 O + CO 2
Применение: Бикарбонат натрия широко используется в пищевой промышленности; он особенно продается как основной компонент разрыхлителя. Это также добавка в муку и другие продукты питания и напитки. Бикарбонаты натрия используются для приготовления щелочного раствора (pH выше 8). Кроме того, он используется в фармацевтике, для производства антацидов, а также в мыле и детергентах, дезодорантах, зубных пастах и других отраслях промышленности.Также применяется в огнетушителях.
Воздействие на здоровье / опасность для здоровья: Бикарбонат натрия может вызвать серьезные повреждения глаз. Он не горюч, но при контакте с кислотой может выделять нетоксичные пары двуокиси углерода.
.