Формула Угольной кислоты структурная химическая
Структурная формула
 |
 |
Истинная, эмпирическая, или брутто-формула: CH2O3
Химический состав Угольной кислоты
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод | 12.011 | 1 | 19,4% |
| H | Водород | 1.008 | 2 | 3,3% |
| O | Кислород | 15.999 | 3 | 77,4% |
Молекулярная масса: 62,024
У́гольная кислота́ — слабая двухосновная кислота с химической формулой H
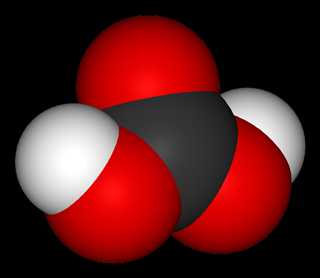
Угольная кислота существует в водных растворах в равновесии с диоксидом углерода, причём равновесие сильно сдвинуто в сторону разложения кислоты. Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp²-гибридизацию. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи. Длина связи C—O в карбонат-ионе составляет 129 пм. Безводная угольная кислота представляет собой бесцветные кристаллы, устойчивые при низких температурах, сублимирующиеся при температуре -30 градусов Цельсия, а при дальнейшем нагревании полностью разлагающиеся. Поведение чистой угольной кислоты в газовой фазе исследовано в 2011 году австрийскими химиками.
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода. В свою очередь растворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода. Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево (подробнее см. Абсорбция газов). Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду. Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода. Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система. Значение pH в такой системе, соответствующей насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., равен pH=3,9.
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие смещается в сторону разложения угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью. Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли — карбонаты и гидрокарбонаты соответственно. При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты.
Угольная кислота образуется при растворении в воде диоксида углерода. Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа. Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода
Угольная кислота всегда присутствует в водных растворах углекислого газа (см. Газированная вода). В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора.
Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот. Некоторые представители подобных соединений перечислены в таблице:
| Класс соединений | Пример соединения |
|---|---|
| Сложные эфиры | поликарбонаты |
| Хлорангидриды | фосген |
| Амиды | мочевина |
| Нитрилы | циановая кислота |
| Ангидриды | пироугольная кислота |
Угольная кислота
Угольная кислота — слабая двухосновная кислота с химической формулой . В чистом виде неустойчива [1]. Образуется в малых количествах при растворении углекислого газа в воде [2], в том числе и углекислого газа с воздуха. Образует ряд устойчивых неорганических и органических производных: соли (химия) ( карбонаты и гидрокарбонаты), эфиры, амиды и др.
1. Физические свойства
Молекула угольной кислоты имеет плоскую структуру. Центральный углеродный атом имеет sp ? — гибридизацию. В гидрокарбонат — карбонат -анионов происходит делокализация π-связи. Длина связи C — O в карбонат-ионе составляет 129 пм.
2. Химические свойства
2.1. Равновесие в водных растворах и кислотность
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода :
- , константа равновесия при 25 ? C
Скорость прямой реакции 0,039 с -1, обратной — 23 из -1.
В свою очередь растворенный гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода:
- ]
Данная равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево (подробнее см.. Абсорбция газов).
Угольная кислота подвергается Оборна гидролиза, создавая при этом кислая среда:
- , константа кислотной диссоциации при 25 ? C
Однако для практических расчетов чаще используют кажущуюся константу кислотности, учитывающий равновесие угольной кислоты с гидратом диоксида углерода:
гидрокарбонат -ион подвергается дальнейшему гидролизу по реакции
- , Константа кислотности при 25 ? C
Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система, которую можно представить в общем виде следующим образом:
Значение pH в такой системе, которое соответствует насыщенному раствору диоксида углерода в воде при 25 ? C и давлении 760 мм рт. ст., можно рассчитать по формуле:
- , Где L = 0,034 моль / л — растворимость CO 2 в воде при указанных условиях.
2.2. Разложение
При повышении температуры раствора и / или понижении парциального давления диоксида углерода равновесие в системе смещается влево, что приводит к разложению части угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
2.3. Взаимодействие с основаниями и солями
Угольная кислота вступает в реакции нейтрализации с растворами основ, образуя средние и кислые соли (химия) — карбонаты и гидрокарбонаты соответственно:
- (Конц.) ]
- (Разб.) ]
- ]
- ]
При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты:
3. Получение
Угольная кислота образуется при растворении в воде диоксида углерода :
Содержание угольной кислоты в растворе увеличивается при снижении температуры раствора и увеличении давления углекислого газа.
Также угольная кислота образуется при взаимодействии ее солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом большая часть образовалась угольной кислоты, как правило, разлагается на воду и диоксид углерода:
4. Применение
Угольная кислота всегда присутствует в водных растворах углекислого газа (см. Газировка).
В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора.
5. Производные
Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот [3].
Некоторые представители подобных соединений перечислены в табл.
См.. также
Примечания
Литература
- Лидин Р.А., Молочко В.А., Андреева Л.Л. Реакции неорганических соединений: справочник / Под ред. Г. А. Лидин. — 2-е изд., Перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2
- Лидин Р.А., Андреева Л.Л., Молочко В.А. Константы неорганических соединений: справочник / Под ред. Г. А. Лидин. — 2-е изд., Перераб. и доп. — М.: Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5
nado.znate.ru
Реферат Угольная кислота
скачатьРеферат на тему:
План:
- Введение
- 1 Физические свойства
- 2 Химические свойства
- 2.1 Равновесие в водных растворах и кислотность
- 2.2 Разложение
- 2.3 Взаимодействие с основаниями и солями
- 3 Получение
- 4 Применение
- 5 Органические производные Примечания
Литература
Введение
У́гольная кислота́ — слабая двухосновная кислота с химической формулой H2CO3. В чистом виде неустойчива[2]. Образуется в малых количествах при растворении углекислого газа в воде[1], в том числе и углекислого газа из воздуха. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
1. Физические свойства
Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp²-гибридизацию. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи. Длина связи C—O в карбонат-ионе составляет 129 пм.
2. Химические свойства
2.1. Равновесие в водных растворах и кислотность
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода:
- , константа равновесия при 25 °C
Скорость прямой реакции 0,039 с−1, обратной — 23 с−1.
В свою очередь растворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода:
Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево (подробнее см. Абсорбция газов).
Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду:
- , константа кислотности при 25 °C
Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода:
- , константа кислотности при 25 °C
Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система, которую можно изобразить в общем виде следующим образом:
Значение pH в такой системе, соответствующей насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., можно рассчитать по формуле:
- , где L = 0,034 моль/л — растворимость CO2 в воде при указанных условиях.
2.2. Разложение
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие в системе смещается влево, что приводит к разложению части угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
2.3. Взаимодействие с основаниями и солями
Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли — карбонаты и гидрокарбонаты соответственно:
- (конц.)
- (разб.)
При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты:
3. Получение
Угольная кислота образуется при растворении в воде диоксида углерода:
Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа.
Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода:
4. Применение
Угольная кислота всегда присутствует в водных растворах углекислого газа (см. Газированная вода).
В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора.
5. Органические производные
Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот[3].
Некоторые представители подобных соединений перечислены в таблице.
| Класс соединений | Пример соединения |
|---|---|
| Сложные эфиры | поликарбонаты |
| Хлорангидриды | фосген |
| Амиды | мочевина |
| Нитрилы | циановая кислота |
| Ангидриды | пироугольная кислота |
Примечания
- ↑ 123 В водном растворе бо́льшая часть угольной кислоты обратимо переходит в гидрат диоксида углерода по реакции H2CO3 ⇄ CO2·H2O
- Угольная кислота теперь обнаружена и в газовой фазе — пора снова переписывать учебники — inchem.ru/node/214
- Нейланд О. Я. Органическая химия. — М.: Высшая школа, 1990. — С. 640—652. — 751 с. — ISBN 5-06-001471-1
Литература
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2
- Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5
Угольная кислота и её соли — урок. Химия, 8–9 класс.
Угольная кислота
Угольная кислота h3CO3 — раствор углекислого газа в воде. Это слабая двухосновная кислота. Она образуется при растворении в воде оксида углерода(\(IV\)) и в свободном виде из раствора не выделяется. При попытке выделения кислота легко разлагается на углекислый газ и воду:
h3CO3⇄CO2↑+h3O.
Угольная кислота диссоциирует ступенчато. На первой ступени образуется гидрокарбонат-ион и ион водорода:
h3CO3⇄HCO3−+H+.
Гидрокарбонат-ион частично распадается на карбонат-ион и ещё один ион водорода:
HCO3−⇄CO32−+H+.
Диссоциация протекает слабо, ионов водорода в растворе содержится немного. Поэтому раствор углекислого газа (угольная кислота) имеет слегка кисловатый вкус и меняет окраску лакмуса на розовую (не красную).
Соли угольной кислоты
Как двухосновная угольная кислота образует два ряда солей: средние — карбонаты (K2CO3, CaCO3) и кислые — гидрокарбонаты (NaHCO3, Ca(HCO3)2).
Из карбонатов растворяются в воде соли натрия, калия и аммония. Гидрокарбонаты растворяются лучше.
Обрати внимание!
Все соли угольной кислоты реагируют с более сильными кислотами.
В результате выделяется углекислый газ, что позволяет использовать эту реакцию как качественную на карбонаты и гидрокарбонаты:
CaCO3+2HCl=CaCl2+h3O+CO2↑,
NaHCO3+HNO3=NaNO3+h3O+CO2↑.
Реакция карбоната с кислотой
Обрати внимание!
Карбонаты и гидрокарбонаты взаимопревращаемы.
Карбонаты превращаются в гидрокарбонаты при пропускании через их раствор или взвесь углекислого газа:
CaCO3+h3O+CO2=Ca(HCO3)2.
Обратное превращение происходит при нагревании:
Ca(HCO3)2=tCaCO3↓+h3O+CO2↑.
С присутствием в воде гидрокарбонатов кальция и магния связана временная жёсткость воды. Временная — потому что при нагревании растворимые кислые соли разлагаются, и ионы металлов связываются в нерастворимые карбонаты.
Применение солей угольной кислоты
Na2CO3 — карбонат натрия, или сода. Применяется в производстве стекла, мыла, бумаги.
NaHCO3 — гидрокарбонат натрия, или питьевая сода. Используется в быту и пищевой промышленности как разрыхлитель теста. Находит применение в медицине.
K2CO3 — карбонат калия, или поташ. Применяется в производстве жидкого мыла, стекла, в качестве удобрения.
CaCO3 — карбонат кальция. В природе встречается в виде мела, мрамора, известняка. Применяются как строительные и отделочные материалы, а также в производстве негашёной извести, цемента, стекла.

www.yaklass.ru
Угольная кислота Химическая формула H 2 CO
 Угольная кислота
Угольная кислота
 Химическая формула H 2 CO 3
Химическая формула H 2 CO 3
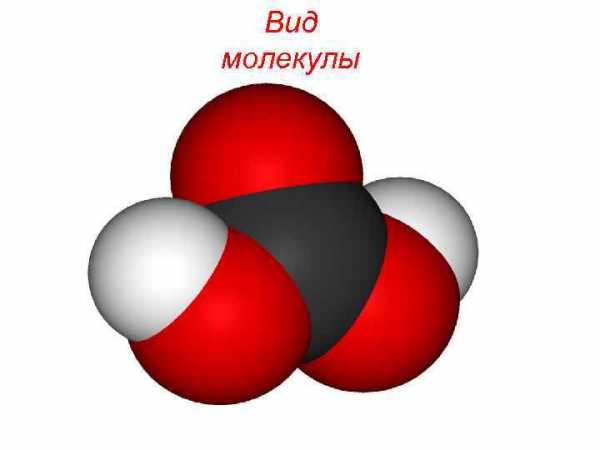 Вид молекулы
Вид молекулы
 Общие сведения Угольная кислота — слабая двухосновная кислота. В чистом виде не выделена. Образуется в малых количествах при растворении углекислого газа в воде, в том числе и углекислого газа из воздуха. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Общие сведения Угольная кислота — слабая двухосновная кислота. В чистом виде не выделена. Образуется в малых количествах при растворении углекислого газа в воде, в том числе и углекислого газа из воздуха. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
 Химические свойства
Химические свойства
 Разложение При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие в системе смещается влево, что приводит к разложению части угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
Разложение При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие в системе смещается влево, что приводит к разложению части угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
 Получение Угольная кислота образуется при растворении в воде диоксида углерода. Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа. Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода
Получение Угольная кислота образуется при растворении в воде диоксида углерода. Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа. Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода
 Применение Угольная кислота всегда присутствует в водных растворах углекислого газа (газированная вода). В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением p. H раствора
Применение Угольная кислота всегда присутствует в водных растворах углекислого газа (газированная вода). В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением p. H раствора
 Спасибо за внимание
Спасибо за внимание
present5.com
Формула углекислого газа в химии
Химическая, структурная и электронная формулы углекислого газа
Химическая формула: СО2.
Структурная формула: O = C = O
Электронная формула:
Молярная масса: 44,01 г/моль.
Физические свойства углекислого газа
При стандартных условиях – газ без цвета и запаха, с кисловатым вкусом. При атмосферном давлении не существует в жидком состоянии, при сильном охлаждении кристаллизуется в виде «сухого льда» – белой снегообразной массы. Температура сублимации равна –78 °С. При нормальных условиях в одном объеме воды растворяется 0,9 объемов углекислого газа.
Химические свойства углекислого газа
Является кислотным оксидом.
Качественная реакция – помутнение известковой воды (Ca(OH)2) за счет образования белого осадка карбоната кальция:
Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений.
В промышленности углекислый газ получают термическим разложением карбонатов:
В лаборатории – действием сильных кислот на карбонаты или гидрокарбонаты:
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Угольная кислота Википедия
| Угольная кислота | |
|---|---|
| | |
| Систематическое название | Угольная кислота |
| Химическая формула | H2CO3 |
| Внешний вид | бесцветный раствор |
| Свойства | |
| Молярная масса | 62,03 г/моль |
| Температура плавления | ? |
| Температура кипения | ? |
| Температура возгонки | ? |
| Температура разложения | ? |
| Температура стеклования | ? |
| Плотность | 1,668 г/см³ |
| Константа диссоциации pKa | реальные: 1) 3,60; 2) 10,33 кажущаяся[1]: 6,37 |
| Растворимость в воде | 0,21[1] г/100 мл |
| Термодинамические свойства | |
| Стандартная энтальпия образования | −700 кДж/моль |
| Стандартная молярная энтропия | +187 Дж/(К·моль) |
| Стандартная энергия образования Гиббса | −623 кДж/моль |
| Классификация | |
| Регистрационный номер CAS | 463-79-6 |
| Код SMILES | C(=O)(O)O |
| Безопасность | |
| NFPA 704 | 00 1 |
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). | |
У́гольная кислота́ — слабая двухосновная кислота с химической формулой H2CO3, образуется в малых количествах при растворении углекислого газа в воде[1], в том числе и углекислого газа из воздуха. В водных растворах неустойчива. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 2.1 Равновесие в водных растворах и кислотность
- 2.2 Разложение
- 2.3 Взаимодействие с основаниями и солями
- 3 Получение
- 4 Применение
- 5 Органические производные
- 6 Примечания
- 7 Литература
Физические свойства[
ru-wiki.ru
