Угольная кислота — свойства, получение и применение
Угольная кислота — слабая двухосновная кислота с химической формулой H2CO3, образуется в малых количествах при растворении углекислого газа в воде, в том числе и углекислого газа из воздуха. В водных растворах неустойчива. Образует ряд устойчивых неорганических и органических производных: соли, сложные эфиры, амиды и др.
| Угольная кислота | |
|---|---|
| Систематическое название | Угольная кислота |
| Химическая формула | H2CO3 |
| Внешний вид | бесцветный раствор |
| Молярная масса | 62,025 г/моль |
| Температура плавления | ? |
| Температура кипения | ? |
| Температура возгонки | ? |
| Температура разложения | ? |
| Температура стеклования | ? |
| Плотность | 1,668 г/см³ |
| Константа диссоциации pKa | реальные: 1) 3,60; 2) 10,33 кажущаяся: 6,37 |
| Растворимость в воде | 0,21 г/100 мл |
| Стандартная энтальпия образования | −700 кДж/моль |
| Стандартная молярная энтропия | +187 Дж/(К·моль) |
| Стандартная энергия образования Гиббса | −623 кДж/моль |
| Регистрационный номер CAS | 463-79-6 |
| PubChem | 463-79-6 |
| Код SMILES | C(=O)(O)O |
| Пиктограммы опасности СГС | |
| NFPA 704 | |
Физические свойства
Угольная кислота существует в водных растворах в равновесии с диоксидом углерода, причём равновесие сильно сдвинуто в сторону разложения кислоты.
Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp²-гибридизацию. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи. Длина связи C—O в карбонат-ионе составляет 130 пм.
Безводная угольная кислота представляет собой бесцветные кристаллы, устойчивые при низких температурах, сублимирующиеся при температуре –30 °C, а при дальнейшем нагревании полностью разлагающиеся. Поведение чистой угольной кислоты в газовой фазе исследовано в 2011 г. австрийскими химиками.
Химические свойства
Равновесие в водных растворах и кислотность
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода:
- , константа равновесия при 25 °C
Скорость прямой реакции 0,039 с−1, обратной — 23 с−1.
В свою очередь растворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода:
Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево (подробнее см.
Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду:
- , константа кислотности при 25 °C
Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода:
Гидрокарбонат-ион подвергается дальнейшему гидролизу по реакции
- , константа кислотности при 25 °C
Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система, которую можно изобразить в общем виде следующим образом:
Получение
Угольная кислота образуется при растворении в воде диоксида углерода:
Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа.
Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом большая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода:
При этом большая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода:
Применение
Угольная кислота всегда присутствует в водных растворах углекислого газа .
В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора. Также применяется для производства хладагента, солнечных генераторов и морозильников.
Органические производные
Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот.
Некоторые представители подобных соединений перечислены в таблице.
| Класс соединений | Пример соединения |
|---|---|
| Сложные эфиры | поликарбонаты |
| Хлорангидриды | фосген |
| Амиды | мочевина |
| Нитрилы | циановая кислота |
| Ангидриды | пироугольная кислота |
Кислота угольная — Справочник химика 21
Угольные ткани применяют для армированных покрытий и конструкционных углепластиков в тех случаях, когда определяющим является стойкость в плавиковой или кремнефтористоводородной кислотах. Угольные ткани получают карбонизацией без доступа воздуха при высоких температурах вискозного или полиакрилонитрильного волокна. Наибольшее применение в противокоррозионной технике нашла ткань угольная УТМ-8 (ТУ 48-20-17—77) с разрывной нагрузкой по основе не менее 500 Н, а по утку 200 Н. [c.88]
Угольные ткани получают карбонизацией без доступа воздуха при высоких температурах вискозного или полиакрилонитрильного волокна. Наибольшее применение в противокоррозионной технике нашла ткань угольная УТМ-8 (ТУ 48-20-17—77) с разрывной нагрузкой по основе не менее 500 Н, а по утку 200 Н. [c.88]
Как двухосновная кислота, угольная кислота образует два ряда солей — средние и кислые средние соли называются карбона т а м и, кислые — гидрокарбонатами. [c.439]
В каждой группе расположите соединения в порядке уменьшения кислотности а) серная кислота, угольная кислота, фенол, вода б) фенол, бензиловый спирт, бензойная кислота [c.165]
Этиленхлоргидрин (монохлоргидрин или 2-хлорэтанол) впервые был получен Вюрцем в 1859 г. нагреванием в запаянной трубке этиленгликоля, насыщенного хлористым водородом. В поисках промышленных методов получения этиленхлоргидрина длительное время придерживались принципа получения его из этилена и хлорноватистой кислоты, считая последнюю необходимым компонентом реакции.
Кислые соли образуются при гидролизе солей слабых многоосновных кислот — угольной, ортофосфорной и т. д. [c.206]
Кислота угольная Н СОз Карбонат ион [c.416]
Угольная кислота. Угольная кислота существует только в растворе. При нагревании она разлагается на окснд углерода (IV) и воду. В молекуле угольной кислоты атомы водорода связаны с атомами кислорода [c.211]
К слабым электролитам относятся почти все органические кислоты (муравьиная, уксусная, бензойная), цианистоводородная кислота, борная кислота, угольная кислота, сероводородная кислота, гидроксид аммония, вода, а также некоторые соли (Hg l2, СёСЬ).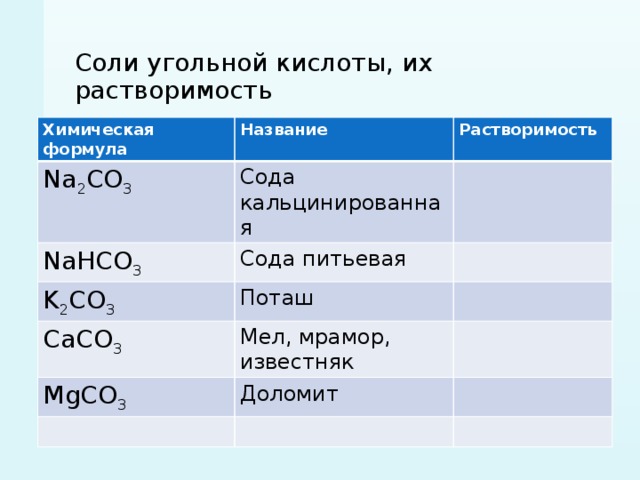
Муравьиная кислота Уксусная кислота Пропионовая кислота Масляная кислота Угольная кислота К К-2 [c.199]
Можно ли объяснить смещение равновесия в направлении образования кремниевой кислоты только исходя из различия в силе кислот — угольной и кремниевой, на основе сопоставления их констант диссоциации Какие свойства кремниевой кислоты особенно следует учитывать при этом [c.208]
Аминолиз проводится в органических или водных средах, а также в смешанных растворителях (при контролируемом pH) [62]. Аминолиз ангидрида можно проводить с высокой селективностью с преимущественным образованием а-изомера. С этой целью необходимо вести процесс при низкой температуре в избытке аминокислоты и в присутствии следующих добавок [53] 1) уксусная кислота [53], ортофосфорная кислота, угольная кислота [53—55] 2 смеси слабых кислот и низших алифатических спиртов [53] 3) смеси сильных кислот и спиртов [61—65].
Если к раствору карбоната натрия прилить раствор серной кислоты, то происходит образование новой соли и новой кислоты— угольной, распадающейся на воду и углекислый газ. [c.17]
Соли щелочных металлов и слабых кислот (угольной, сероводородной и др.) гидролизуются, водные растворы их имеют щелочную реакцию (рН>7). [c.288]
Хлорангидриды угольной кислоты. Угольной кислоте,, как двухосновной кислоте, соответствуют два хлорангидрида полный хлорангидрид—фосген и неполный хлорангидрид— хлоругольная кислота, называемая также хлормуравьиной кислотой [c.411]
Вы не приняли во внимание основность угольной кислоты. Угольная кислота Н2СО3 является двухосновной кислотой, т.е. ее основность равна двум. [c.238]
Кислотностью называется общее содержание в воде веществ, реагирующих с сильными основаниями. К этим соединениям относятся сильные кислоты (соЛяная, серная и др.), слабые кислоты (угольная, свободный сероводород и др.) и соли слабых оснований (аммиачные, соли железа.и алюминия). Определение кислотности производят только в водах, имеющих кислую реакцию (рН[c.72]
К этим соединениям относятся сильные кислоты (соЛяная, серная и др.), слабые кислоты (угольная, свободный сероводород и др.) и соли слабых оснований (аммиачные, соли железа.и алюминия). Определение кислотности производят только в водах, имеющих кислую реакцию (рН[c.72]
Коррозийный износ. Основной причиной износа двигателя является коррозия в результате химического воздействия влаги и кислот, образующихся при сгорании топлива. На каждый литр сгоревшего в двигателе топлива в камере сгорания образуется приблизительно 1 л воды. При сгорании топлива образуются также двуокись углерода и небольшое количество окислов серы из органических сернистых соединений, входящцх в состав топлива, следы окиси азота в результате окисления азота при высокой температуре сгорания и небольшое количество соединений брома или хлора, выделяемых из тетраэтилсвинца, содержавшегося в топливе. Все эти продукты сгорания путем конденсации или химического взаимодействия с водой образуют кислоты (угольную, серную, сернистую, азотную и азотистую, бромистоводородную, хлористоводородную) и другие продукты, способные вызвать коррозию. В двигателях, работающих при достаточно жестких температурных режимах, эти продукты сгорания в основном выносятся с выхлопными газами, что ограничивает возможность появления коррозии двигателя. Однако нри работе двигателя с пониженной температурой стенок цилиндра влага и продукты окисления могут легко конденсироваться и скопляться, что способствует коррозийному разрушению поверхности стенок и поршневых колец и попаданию при работе продуктов окисления и коррозии внутрь двигателя и в картерное масло. Высокие окисляющие и корродирующие свойства этих продуктов описаны в главе XII. [c.386]
В двигателях, работающих при достаточно жестких температурных режимах, эти продукты сгорания в основном выносятся с выхлопными газами, что ограничивает возможность появления коррозии двигателя. Однако нри работе двигателя с пониженной температурой стенок цилиндра влага и продукты окисления могут легко конденсироваться и скопляться, что способствует коррозийному разрушению поверхности стенок и поршневых колец и попаданию при работе продуктов окисления и коррозии внутрь двигателя и в картерное масло. Высокие окисляющие и корродирующие свойства этих продуктов описаны в главе XII. [c.386]
При окислении азотной кислотой горчичные масла дают серную кислоту, угольный ангидрид и амин [c.93]
Сам анилин не образует солей со слабыми кислотами-угольной, циановодородной, сернистой, сероводородной итд [c.234]
Появляется железо в природных водах в результате перехода его из раз-.личных горных пород под действием окислителей (кислорода) или кислот (угольной, органических).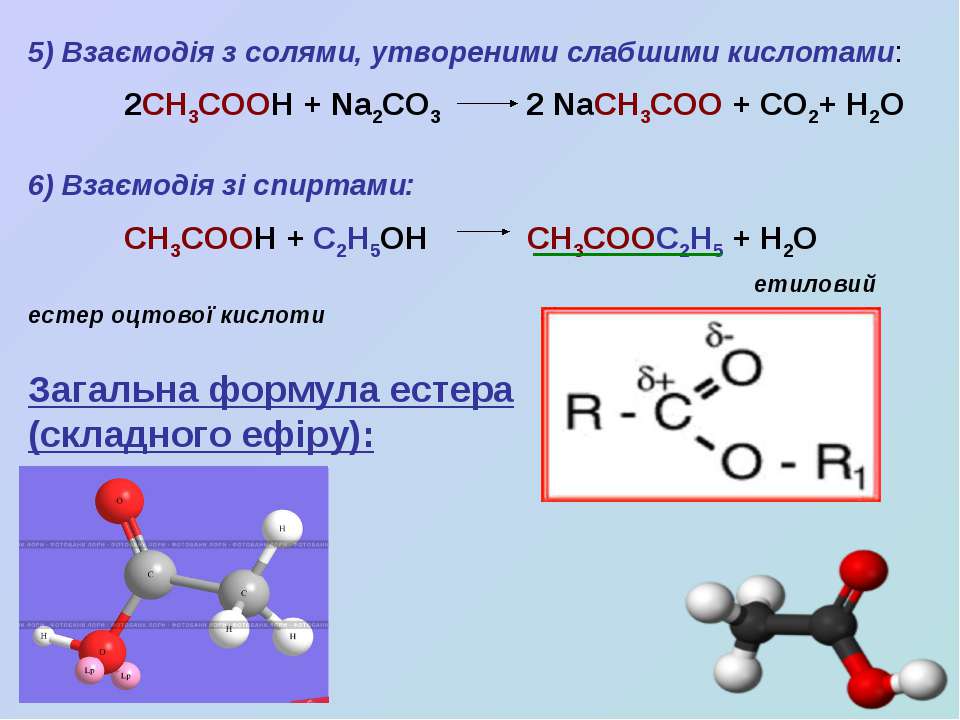 [c.180]
[c.180]
В соединениях с кислородом углерод и кремний образуют соединения, в которых их окислительное число +2 и +4 СО, 510, СО и Более устойчивы из них СО2 и 5102. Оксиды СО и 510 относятся к несолеобразующим, СО и 5Юз обладают кислотными свойствами. Им соответствуют кислоты угольная Н2СО3 и кремниевая Н2510з, причем кислотные свойства кремниевой кислоты выражены слабее, чем угольной. [c.204]
Ортоформа угольной кислоты Н4СО4 или С(0Н)4 и её соли неизвестны, хотя органические её производные, например,эфиры, известны. В угольной кислоте (как и в карбонатах) анион угольной кислоты СОз по существу представляет собой ацидокодшлекс, в котором центральный атом углерода подвержен зр -гибридизации. Остающиеся у всех атомов по одному р — электрону образуют делокализованные л — связи, сильно увеличивающие прочность комплекса. При этом атом углерода находится в центре равностороннего треугольника, а атомы кислорода — по его вершинам. Как двухосновная кислота угольная кислота образует два ряда солей — средние и кислые средние соли называются карбонатами, кислые — гидрокарбонатами. [c.16]
[c.16]
Формамид Синильная кислота Марганцевые соли кислот угольной, щавелевой, муравьиной, фосфорной — силикагель проток, 450° С. Выход на МпСО, 88% [24] Мп или сплав Си—Мп 450—600° С. Наилучший выход при 550° С на Си—Мп [25 Мп02 (20 г) — ТЬОг (5 г) — AI2O3 (1000 г) поток формамида 0,8 г мин, водорода — 500 мл1мин. Выход 96% [26] [c.693]
В природных водах буферная система включает в себя слабую кислоту — угольную кислоту (Н3СО3) — и связанные с ней анионы — бикарбонаты (НСО3) и карбонаты ( O3 ). При pH 4-9 НСОз является преобладающим анионом. В следующем примере мы принебрежем СОз (и опять допустим, что активности и концентрации равны). [c.263]
Свойства угольной кислоты. Угольная кислота Н2СО3 — очень слабая и непрочная кислота, существующая только в водном растворе (/С] =4,3-10 и /Сг = = 5,6-107 ). [c.178]
Угольная кислота. Угольная кислота Н2СО3 образуется при растворении в воде диоксида углерода. Эта кислота существует только в водном растворе. Угольная кислота относится к слабым кислотам, диссоциация ее на ионы, особенно по второй ступени, происходит в незначительной степени [c.174]
Эта кислота существует только в водном растворе. Угольная кислота относится к слабым кислотам, диссоциация ее на ионы, особенно по второй ступени, происходит в незначительной степени [c.174]
При перегонке родаиистоводородной кислоты с минеральными кис ютами образуются сероокись углерода, аммиак, дитиокарбаминовая кислота, угольный ангидрид, муравьиная кислота, а также азот и сйрнистыс соединения з . [c.89]
Фтористоводородная кислота в разбавленных водных растворах я вляет-ся слабой одноосновной кислотой она, как и другие слабые кислоты (угольная, уксусная и т. д.), окрашивает синий лакмус в красный цвет. Ее к нстанта диссоциации 7,2-1СГ и в 0,Ш растворе она ионизирована примерно на 10%. В концентрированных растворах она обладает склонностью К образованию гидрофторид-ионов [c.471]
Индикаторы первой гpyJШЫ чувствительны даже к угольной кислоте. Поэтому при титровании с этими индикаторами слабых кислот угольная кислота и карбонаты, разлагающиеся при действии кислот с образованием угольной кислоты, должны отсутствовать. Если все же приходится титровать в присутствии угольной кислоты, то применяют специальные способы (например, нагревание титруемого раствора до кипения). [c.109]
Если все же приходится титровать в присутствии угольной кислоты, то применяют специальные способы (например, нагревание титруемого раствора до кипения). [c.109]
Неорганическая химия (1989) — [ c.194 ]
Аналитическая химия. Т.1 (2001) — [ c.433 ]
Аналитическая химия (1973) — [ c.37 , c.250 , c.370 ]
Химия (1978) — [ c.234 , c.349 ]
Химические свойства неорганических веществ Изд.3 (2000) — [ c.205 ]
Справочник азотчика Том 1 (1967) — [ c.228 ]
Введение в химию окружающей среды (1999) — [
c. 64
]
64
]
Методы органической химии Том 3 Выпуск 2 (1935) — [ c.314 , c.349 ]
Химия (2001) — [ c.310 ]
Органическая химия 1965г (1965) — [ c.243 ]
Органическая химия 1969г (1969) — [ c.272 ]
Органическая химия 1973г (1973) — [ c.258 ]
Качественные микрохимические реакции по органической химии (1957) — [ c.44 ]
Качественные микрохимические реакции по органической химии Издание 2 (1965) — [ c.33 ]
Органическая химия Издание 4 (1981) — [ c.252 ]
Аналитическая химия (1965) — [
c. 276
,
c.277
,
c.475
,
c.630
]
276
,
c.277
,
c.475
,
c.630
]
Фотосинтез 1951 (1951) — [ c.31 , c.191 ]
Очерк общей истории химии (1979) — [ c.151 , c.152 , c.160 , c.163 , c.164 , c.194 , c.196 , c.205 , c.327 ]
Основы номенклатуры неорганических веществ (1983) — [ c.44 ]
Справочник по общей и неорганической химии (1997) — [
c. 75
,
c.91
,
c.96
,
c.180
,
c.183
]
75
,
c.91
,
c.96
,
c.180
,
c.183
]
Теоретические основы общей химии (1978) — [ c.225 ]
Технология минеральных солей Ч 2 (0) — [ c.603 , c.765 ]
Материалы для изготовления химической аппаратуры (1932) — [ c.0 ]
Неорганическая химия Изд2 (2004) — [ c.86 , c.351 ]
Технология минеральных солей Издание 2 (0) — [ c.411 , c.414 , c.523 ]
Справочник азотчика Т 1 (1967) — [
c. 228
]
228
]
Инженерная лимнология (1987) — [ c.176 ]
Угольная кислота Химическая формула H 2 CO
Угольная кислота
Химическая формула H 2 CO 3
Вид молекулы
Общие сведения Угольная кислота — слабая двухосновная кислота. В чистом виде не выделена. Образуется в малых количествах при растворении углекислого газа в воде, в том числе и углекислого газа из воздуха. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Химические свойства
Разложение При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие в системе смещается влево, что приводит к разложению части угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
При кипении раствора угольная кислота разлагается полностью:
Получение Угольная кислота образуется при растворении в воде диоксида углерода. Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа. Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода
Применение Угольная кислота всегда присутствует в водных растворах углекислого газа (газированная вода). В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением p. H раствора
Спасибо за внимание
Угольная кислота
Угольная кислота — слабая двухосновная кислота с химической формулой H 2 CO 3, образуется в малых количествах при растворении углекислого газа в воде, в том числе и углекислого газа из воздуха. В водных растворах неустойчива. Образует ряд устойчивых неорганических и органических производных: соли, сложные эфиры, амиды и др.
В водных растворах неустойчива. Образует ряд устойчивых неорганических и органических производных: соли, сложные эфиры, амиды и др.
1. Физические свойства
Угольная кислота существует в водных растворах в равновесии с диоксидом углерода, причём равновесие сильно сдвинуто в сторону разложения кислоты.
Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp²-гибридизацию. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи. Длина связи C — O в карбонат-ионе составляет 130 пм.
Безводная угольная кислота представляет собой бесцветные кристаллы, устойчивые при низких температурах, сублимирующиеся при температуре –30 °C, а при дальнейшем нагревании полностью разлагающиеся. {2-}*}}}
{2-}*}}}
Значение водородного показателя pH в такой системе, соответствующего насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., можно рассчитать по формуле:
p H ≈ − 1 2 lg K a ′ ⋅ L = 3, 9 {\displaystyle {\mathsf {pH}}\approx -{\frac {1}{2}}\lgK_{a}\cdot L=3.9}, где L = 0.034 моль/л — растворимость CO 2 в воде при указанных условиях.
2.2. Химические свойства Разложение
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие смещается в сторону разложения угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
H 2 C O 3 ⟶ H 2 O + C O 2 ↑ {\displaystyle {\mathsf {H_{2}CO_{3}\longrightarrow H_{2}O+CO_{2}\uparrow }}}
2.3. Химические свойства Взаимодействие с основаниями и солями
Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли — карбонаты и гидрокарбонаты соответственно:
H 2 C O 3 + 2 N a O H {\displaystyle {\mathsf {H_{2}CO_{3}+2NaOH}}} конц. ⟶ N a 2 C O 3 + 2 H 2 O {\displaystyle {\mathsf {\longrightarrow Na_{2}CO_{3}+2H_{2}O}}} H 2 C O 3 + N a O H {\displaystyle {\mathsf {H_{2}CO_{3}+NaOH}}} разб. ⟶ N a H C O 3 + H 2 O {\displaystyle {\mathsf {\longrightarrow NaHCO_{3}+H_{2}O}}} H 2 C O 3 + C a O H 2 ⟶ C a C O 3 ↓ + 2 H 2 O {\displaystyle {\mathsf {H_{2}CO_{3}+\ CaOH_{2}\longrightarrow CaCO_{3}\downarrow +\ 2H_{2}O}}} H 2 C O 3 + N H 3 ⋅ H 2 O ⟶ N H 4 H C O 3 + H 2 O {\displaystyle {\mathsf {H_{2}CO_{3}+\ NH_{3}\cdot H_{2}O\longrightarrow NH_{4}HCO_{3}+H_{2}O}}}
При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты:
H 2 C O 3 + N a 2 C O 3 ⟶ 2 N a H C O 3 {\displaystyle {\mathsf {H_{2}CO_{3}+Na_{2}CO_{3}\longrightarrow 2NaHCO_{3}}}} H 2 C O 3 + C a C O 3 ⟶ C a H C O 3 2 {\displaystyle {\mathsf {H_{2}CO_{3}+\ CaCO_{3}\longrightarrow CaHCO_{3}_{2}}}}
3. Получение
Угольная кислота образуется при растворении в воде диоксида углерода:
C O 2 + H 2 O ⇄ C O 2 ⋅ H 2 O ⇄ H 2 C O 3 {\displaystyle {\mathsf {CO_{2}+H_{2}O\rightleftarrows CO_{2}\cdot H_{2}O\rightleftarrows H_{2}CO_{3}}}}
Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа.
Также угольная кислота образуется при взаимодействии её солей карбонатов и гидрокарбонатов с более сильной кислотой. При этом большая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода:
N a 2 C O 3 + 2 H C l ⟶ 2 N a C l + H 2 C O 3 {\displaystyle {\mathsf {Na_{2}CO_{3}+2HCl\longrightarrow 2NaCl+H_{2}CO_{3}}}} H 2 C O 3 → H 2 O + C O 2 ↑ {\displaystyle {\mathsf {H_{2}CO_{3}\rightarrow H_{2}O+CO_{2}\uparrow }}}
4. Применение
Угольная кислота всегда присутствует в водных растворах углекислого газа см. Газированная вода.
В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония кислотности при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора. Также применяется для производства хладагента, солнечных генераторов и морозильников.
5. Органические производные
Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот.
Некоторые представители подобных соединений перечислены в таблице.
Дата публикации:
05-16-2020
Дата последнего обновления:
05-16-2020Угольная кислота, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Оксид углерода (IV), Угольная кислота и ее соли — Кислородные соединения — Подгруппа углерода и кремния — Неорганическая химия
10 января 2007
Оксид углерода (IV) (диоксид углерода, углекислый газ) – газ без цвета и запаха, не поддерживающий дыхания и горения, тяжелее воздуха. Он растворим в воде (88 объемов СО2 в 100 объемах Н2О при 20°С). При обычных давлениях твердый диоксид углерода переходит в газообразное состояние (сублимируется), минуя жидкое состояние. При обычной температуре под давлением 60 атм переходит в жидкость.
При большой концентрации оксида углерода (IV) люди и животные задыхаются. При его концентрации в воздухе до 3% у человека наблюдается учащенное дыхание, более 10% – потеря сознания и даже смерть.
Оксид углерода (IV) является ангидридом угольной кислоты Н2СО3 и обладает всеми свойствами кислотных оксидов.
При растворении СО2 в воде частично образуется угольная кислота, при этом в растворе существует следующее равновесие:
Существование равновесия объясняется тем, что угольная кислота является очень слабой кислотой (K1 = 4∙10-7, К2 = 5∙10-11 при 25 °С). Даже такая слабая кислота, как уксусная, намного сильнее угольной. В свободном виде угольная кислота неизвестна, так как она неустойчива и легко разлагается. Как двухосновная кислота она образует средние соли – карбонаты и кислые – гидрокарбонаты. Качественная реакция на эти соли – действие на них сильных кислот, при котором кислота вытесняется и разлагается с выделением СО2:
СО32-+ 2Н+ Н2СО3 Н2О + СО2↑,
НСО3– + Н+Н2СО3 Н2О + СО2↑.
При пропускании выделяющегося СО2 в известковую воду выпадает белый нерастворимый осадок; этой реакцией пользуются также для обнаружения оксида углерода (IV):
Са(ОН)2 + СО2 = СаСО3↓ + Н2О.
Из всех карбонатов в воде растворимы карбонаты только щелочных металлов и аммония. Гидрокарбонаты большинства металлов хорошо растворимы в воде.
Под действием избытка оксида углерода (IV) нерастворимые в воде карбонаты превращаются в растворимые гидрокарбонаты:
СаСО3 | + | H2O | + | CO2 | = | Са(НСО3)2 |
| взвесь в воде | избыток | |||||
Гидрокарбонаты при нагревании распадаются на карбонаты, углекислый газ и воду:
2NаНСО3 = Nа2СО3 + Н2О + СО2↑.
Все карбонаты, кроме карбонатов щелочных металлов, при нагревании разлагаются на оксид металла и диоксид углерода:
МgСО3 = МgО + СО2↑.
Из солей угольной кислоты наибольшее практическое значение имеет сода; известны различные кристаллогидраты соды Nа2СО3∙10Н2О, Nа2СО3.7Н2О или Na2СО3.Н2О; наиболее устойчивым кристаллогидратом является Nа2СО3.10Н2О, который обычно называют кристаллической содой. При прокаливании получают безводную, или кальцинированную соду Nа2СО3. Широко используется также питьевая сода NаНСО3. Из других солей важное значение имеют К2СО3 и СаСО3.
Основные количества соды получают получают по аммиачному способу, часто его называют также методом Сольвэ.
Суть метода заключается в насыщении концентрированного раствора поваренной соли (точнее, насыщенного раствора NаСl) аммиаком при охлаждении и последующем пропускании через этот раствор СО2 под давлением. При этом идут следующие реакции:
NН3 + СО2 + Н2О = NН4НСО3,
NН4НСО3 + NаСl = NаНСО3↓ + NН4Сl.
Питьевая сода NaНСО3 – нерастворима в холодном насыщенном растворе и ее отделяют фильтрованием. При прокаливании NаНСО3 получают кальцинированную соду; выделяющийся при этом СО2 вновь используют в производстве:
2NаНСО3 = Na2СО3 + СО3 + Н2О.
Нагревая раствор, содержащий хлорид аммония с известью, выделяют обратно аммиак:
2NН4Сl + Са(ОН)2 = 2NН3 + СаСl2 + 2Н2О.
Таким образом, при аммиачном способе получения соды единственным «отходом» является хлорид кальция, остающийся в растворе и имеющий ограниченное применение.
Поташ К2СО3 нельзя получить по методу Сольвэ, так как он основан на малой растворимости кислой соли NаНСO3 в насыщенном растворе, тогда как КНСО3 (в отличие от NаНСО3) хорошо растворим в таких растворах. Реакция
КСl + NН4НСО3 КНСО3 + NН4Сl
будет полностью обратимой (ни один из продуктов не удается выделить из сферы реакции в индивидуальном виде). Поэтому карбонат калия получают действием СО2 на раствор едкого калия:
КОН + СО2 = КНСО3,
КНСО3 + КОН = К2СО3 + Н2О.
Производство соды является одним из крупнейших среди производств неорганических веществ; в настоящее время ее мировое производство составляет десятки млн. тонн.
gaz.wiki — gaz.wiki
- Main page
Languages
- Deutsch
- Français
- Nederlands
- Русский
- Italiano
- Español
- Polski
- Português
- Norsk
- Suomen kieli
- Magyar
- Čeština
- Türkçe
- Dansk
- Română
- Svenska
Формула угольной кислоты — использование, свойства, структура и формула угольной кислоты
Угольная кислота — это слабая неорганическая кислота, которая также считается раствором углекислого газа в воде. Он существует только в виде раствора, и его также называют кислотой воздуха, воздушной кислотой, раствором углекислого газа или дигидрокарбонатом. Он наиболее известен как компонент большинства газированных напитков, таких как газированные и безалкогольные напитки.
Формула и структура: Химическая формула угольной кислоты: H 2 CO 3 .Его молекулярная формула CH 2 O 3 , а его молярная масса составляет 62,03 г / моль. Химическая структура угольной кислоты показана ниже, и она состоит из карбоксильной группы и двух гидроксильных групп. Это дипротонная кислота, которая может высвобождать два протона, но имеет слабую кислотность из-за сильных связей O-H.
Происхождение: В организме человека CO 2 , присутствующий в крови, соединяется с водой с образованием угольной кислоты, которая затем выдыхается легкими в виде газа.Он также встречается в скалах и пещерах, где может растворять известняки. H 2 CO 3 также может быть обнаружен в угле, метеоритах, вулканах, кислотных дождях, грунтовых водах, океанах и растениях.
Приготовление: Углекислота образуется при растворении диоксида углерода в воде и может существовать только в растворе. Эта реакция обычно находится в равновесии, что означает, что угольная кислота частично и обратимо образует диоксид углерода и воду.
CO 2 + H 2 O ⇌ H 2 CO 3
В промышленности углекислота получается как побочный продукт других процессов, таких как ферментация, сжигание ископаемого топлива и т. Д.
Физические свойства: Угольная кислота существует только в виде раствора с плотностью 1,668 г / моль. Не растворяется в воде.
Химические свойства: Углекислота — слабая и нестабильная кислота, которая частично диссоциирует в воде на ионы водорода (H + ) и ионы бикарбоната (HCO 3 — ). Будучи дипротоновой кислотой, она может образовывать два вида солей: карбонаты и бикарбонаты. Добавление основания к избытку угольной кислоты дает бикарбонатные соли, а добавление избытка основания к угольной кислоте дает карбонатные соли.
Применение: Углекислота широко используется в приготовлении газированных напитков, таких как газированные напитки, безалкогольные напитки, игристые вина и другие газированные напитки. Углекислота также используется во многих других областях, таких как фармацевтика, косметика, удобрения, пищевая промышленность, анестетики и т. Д.
Опасность для здоровья / воздействие на здоровье: Углекислота не считается токсичной или опасной и присутствует в организме человека. Однако его воздействие в высоких концентрациях может вызвать раздражение глаз и дыхательных путей.
Как сделать угольную кислоту, свойства и применение
Угольная кислотаУгольная кислота — это химическое соединение с химической формулой H 2 CO 3 и молекулярной формулой CH 2 O 3 . Это неорганическая слабая кислота, которая существует только в виде раствора. Угольная кислота также известна как кислота воздуха, воздушная кислота или дигидрокарбонат.Он образует два вида солей: карбонаты и бикарбонаты. Ph угольной кислоты составляет 4,68 в 1 мМ.
Угольная кислота — это, в частности, дипротонная кислота, что означает, что она имеет два протона, которые могут отделиться от исходной молекулы. Таким образом, имеют две константы диссоциации: первая для диссоциации бикарбонат-иона, а вторая — для диссоциации бикарбонат-иона на карбонат-ион.
Прохождение:Угольная кислота присутствует в крови человеческого тела.Он образуется в организме человека при растворении воды с углекислым газом. Он также присутствует в дождевой воде, кальците, ферментации, угле, грунтовых водах, метеорах, вулканах, аминокислотах, белках, океанах, растениях, эритроцитах, отложениях серы, солях и пещерах.
Свойства угольной кислоты:Физические свойства:
Внешний вид: Серовато-белое твердое вещество.
Точка плавления: 210 градусов Цельсия, точка кипения: -78 градусов Цельсия.
Молекулярный вес: 62,024 г / моль.
Растворимость: не растворим.
Угольная кислота имеет значение pH менее 7.
Угольная кислота не имеет запаха и имеет щелочной вкус.
Химическая промышленность Свойства :
Угольная кислота — слабая и нестабильная двухосновная кислота.
Имеет кислотность 6.3 пк.
Реактивы
Карбонат кальция
Раствор соляной кислоты
Лакмус
Вода
Носите лабораторные очки и старайтесь избегать контакта кожи с соляной кислотой. Соблюдайте общие рекомендации по безопасности.
Включенные шаги:
- Налейте в стакан немного воды.
- Добавьте в стакан 5-6 капель лакмуса.
- Поместите кусок карбоната кальция в пробирку или в какой-нибудь стакан.
- Налейте немного соляной кислоты в пробирку / стакан и закройте ее отверстие пробкой с выпускной трубкой.
- Опустите конец выпускной трубки в лакмусовый раствор. Образующийся газ начнет пузыриться через раствор, и цвет раствора изменится.
- Проверьте pH воды. Воды больше нет, углекислота образовалась.Значение pH будет считаться слабым кислотным.
Реакция взаимодействия в форме уравнения:
CaCO 3 + HCl → CaCl 2 + CO 2 ↑ + H 2 O
CO 2 + H 2 O → H 2 CO 3
Использование угольной кислоты:Угольная кислота чаще всего используется в форме солей.
- В крови: Бикарбонат, форма соли угольной кислоты, действует как промежуточное звено для транспортировки CO 2 из организма через дыхательный газообмен.Он также играет жизненно важную роль в протонировании большого количества азотистых оснований в сыворотке крови. Углекислота является основным буферным элементом в организме человека и расщепляется на углекислый газ с помощью фермента, называемого карбоангидразой.
В напитках: Углекислота широко используется для приготовления газированных напитков.
Для лечения дерматитов: обычно используется для лечения дерматитов, таких как стригущий лишай.
Он также используется в качестве жидкости для полоскания рта или для вагинального душа.
При отравлении или передозировке лекарственным средством углекислота назначается перорально для того, чтобы вызвать рвоту.
Для очистки контактных линз очень эффективна углекислота, ее также используют в качестве газа для сварки, пищевой промышленности и косметики.
Для гидролиза крахмала также используется угольная кислота.
Угольная кислота — Энциклопедия Нового Света
Угольная кислота (древнее название кислота воздуха или кислота воздуха ) — слабая кислота с формулой H 2 CO 3 .Он образуется в небольших количествах при растворении углекислого газа в воде и обычно находится только в растворе. Соли карбоновых кислот называются бикарбонатами (или гидрокарбонатами, когда анион HCO 3 —) и карбонатами (когда анион CO 3 2-).
Присутствие угольной кислоты в крови и других жидкостях организма помогает контролировать уровень pH (кислотность) этих жидкостей.
Раствор в воде
Диоксид углерода, растворенный в воде, находится в равновесии с угольной кислотой:
- CO 2 + H 2 O ⇌ H 2 CO 3
Константа равновесия при 25 ° C равна K h = 1.70 × 10 −3 , что указывает на то, что большая часть диоксида углерода не превращается в угольную кислоту и остается в виде молекул CO 2 . В отсутствие катализатора равновесие достигается довольно медленно.
Константы скорости составляют 0,039 с −1 для прямой реакции (CO 2 + H 2 O → H 2 CO 3 ) и 23 с −1 для обратной реакции (H 2 CO 3 → CO 2 + H 2 O).
Кислотность угольной кислоты
Угольная кислота имеет два кислых водорода и, следовательно, две константы диссоциации:
- H 2 CO 3 ⇌ HCO 3 — + H +
- K a1 = 2,5 × 10 −4 моль / л; p K a1 = 3,60 при 25 ° C.
- H 2 CO 3 ⇌ HCO 3 — + H +
- HCO 3 — ⇌ CO 3 2− + H +
- K a2 = 5.61 × 10 −11 моль / л; p K a2 = 10,25 при 25 ° C.
- HCO 3 — ⇌ CO 3 2− + H +
Следует соблюдать осторожность при цитировании и использовании первой константы диссоциации угольной кислоты. Приведенное выше значение является правильным для молекулы H 2 CO 3 и показывает, что это более сильная кислота, чем уксусная кислота или муравьиная кислота: этого можно ожидать из-за влияния электроотрицательного кислородного заместителя. Тем не мение, угольная кислота существует только в растворе в равновесии с диоксидом углерода, поэтому концентрация H 2 CO 3 намного ниже, чем концентрация CO 2 , снижая измеренную кислотность.Уравнение можно переписать следующим образом ( ср. серная кислота):
- CO 2 + H 2 O ⇌ HCO 3 — + H +
- K a = 4.30 × 10 −7 моль / л; p K a = 6,36.
- CO 2 + H 2 O ⇌ HCO 3 — + H +
Эта цифра указана как константа диссоциации угольной кислоты, хотя она неоднозначна: ее лучше назвать константой кислотности диоксида углерода, поскольку она особенно полезна для расчета pH CO . 2 решений.
Роль угольной кислоты в крови
Угольная кислота играет очень важную роль в крови млекопитающих. Это промежуточный продукт при переносе углекислого газа из легких в кровь и наоборот. Превращение углекислого газа в угольную кислоту катализируется ферментом (карбоангидраза), который увеличивает скорость реакции почти в миллиард раз. Угольная кислота диссоциирует в крови (как и в других растворах) с образованием в основном ионов H + и HCO 3 — (бикарбонат).Эта диссоциация является равновесной реакцией и помогает контролировать уровень pH крови.
Получение чистой угольной кислоты
В течение долгого времени исследователи не могли получить чистый бикарбонат водорода (H 2 CO 3 ) при комнатной температуре (около 20 ° C или около 70 ° F). Однако в 1991 году ученым из Центра космических полетов имени Годдарда (США) НАСА удалось получить первые образцы чистого H 2 CO 3 . Они сделали это, подвергая замороженную смесь воды и углекислого газа воздействию высокоэнергетического излучения, а затем нагревая, чтобы удалить лишнюю воду.Оставшуюся угольную кислоту охарактеризовали с помощью инфракрасной спектроскопии.
Способность производить углекислоту путем облучения твердой смеси H 2 O и CO 2 привела к предположению, что H 2 CO 3 может быть обнаружен в космическом пространстве, где замороженные льды H 2 O и CO 2 являются обычными, как космические лучи и ультрафиолетовый свет, которые помогают им реагировать.
Тот же самый полиморф угольной кислоты (обозначаемый бета-угольной кислотой) был получен с помощью криотехники в Университете Инсбрука: чередующиеся слои стекловидных водных растворов бикарбоната и кислоты нагревали в вакууме, что вызывает протонирование бикарбоната, и растворитель подвергался нагреванию. впоследствии удален.Второй полиморф (обозначенный альфа-угольной кислотой) был получен по той же методике в Университете Инсбрука с использованием метанола, а не воды в качестве растворителя.
Исследователи из Инсбрука сообщили, что чистая безводная углекислота очень стабильна в газовой фазе с расчетным периодом полураспада 180 000 лет. Тем не менее, согласно их расчетам, присутствие одной молекулы воды заставляет молекулу угольной кислоты быстро разлагаться на диоксид углерода и воду.
pH и состав раствора угольной кислоты
При данной температуре состав чистого раствора угольной кислоты (или чистого раствора CO 2 ) полностью определяется парциальным давлением pCO2 {\ displaystyle \ scriptstyle p_ {CO_ {2}}} диоксида углерода, указанным выше решение.Для расчета этого состава необходимо принять во внимание вышеуказанное равновесие между тремя различными карбонатными формами (H 2 CO 3 , HCO 3 — и CO 3 2-), а также равновесие между растворенным CO 2 и H 2 CO 3 с постоянной Kh = [h3CO3] [CO2] {\ displaystyle \ scriptstyle K_ {h} = {\ frac {[H_ {2} CO_ {3} ]} {[CO_ {2}]}}} (см. Выше) и следующего равновесия между растворенным CO 2 и газообразным CO 2 над раствором:
- CO 2 (газ) ↔ CO 2 (растворенный) с [CO2] pCO2 = 1kH {\ displaystyle \ scriptstyle {\ frac {[CO_ {2}]} {p_ {CO_ {2}}}} = {\ frac {1} {k _ {\ mathrm {H}}}}}, где k H = 29.{2-}]} приводят к шести уравнениям для шести неизвестных [CO 2 ], [H 2 CO 3 ], [H + ], [OH — ], [HCO 3 –] и [CO 3 2–], показывая, что состав раствора полностью определяется pCO2 {\ displaystyle \ scriptstyle p_ {CO_ {2}}}. Уравнение, полученное для [H + ], является кубическим, численное решение которого дает следующие значения для pH и различных концентраций частиц:
PCO2 {\ displaystyle \ scriptstyle P_ {CO_ {2}}} (атм) pH [CO 2 ] (моль / л) [H 2 CO 3 ] (моль / л) [HCO 3 — ] (моль / л) [CO 3 2−] (моль / л) 10 −8 7.00 3,36 × 10 -10 5,71 × 10 −13 1,42 × 10 −9 7,90 × 10 −13 10 −6 6,81 3,36 × 10 −8 5,71 × 10 −11 9,16 × 10 −8 3,30 × 10 −11 10 −4 5,92 3,36 × 10 −6 5.71 × 10 −9 1,19 × 10 −6 5,57 × 10 −11 3,5 × 10 −4 5,65 1,18 × 10 −5 2,00 × 10 −8 2,23 × 10 −6 5.60 × 10 −11 10 −3 5,42 3.36 × 10 −5 5,71 × 10 −8 3,78 × 10 −6 5,61 × 10 −11 10 −2 4,92 3,36 × 10 −4 5,71 × 10 −7 1,19 × 10 −5 5,61 × 10 −11 10 −1 4,42 3,36 × 10 −3 5,71 × 10 −6 3.78 × 10 −5 5,61 × 10 −11 1 3,92 3,36 × 10 −2 5,71 × 10 −5 1,20 × 10 −4 5,61 × 10 −11 2,5 3,72 8,40 × 10 -2 1,43 × 10 −4 1,89 × 10 −4 5.61 × 10 −11 10 3,42 0,336 5,71 × 10 −4 3,78 × 10 −4 5,61 × 10 −11 - Мы видим, что во всем диапазоне давлений pH всегда значительно ниже, чем pKa 2 , так что концентрация CO 3 2− всегда пренебрежимо мала. по концентрации HCO 3 — .{-4}} атм.), Мы получаем слабокислый раствор (p H = 5,7), а растворенный углерод теперь по существу находится в форме CO 2 . После этого давления [OH — ] также становится незначительным, так что ионизированная часть раствора теперь представляет собой эквимолярную смесь H + и HCO 3 — .
- Для давления CO 2 , типичного для давления в бутылках с газированными напитками (PCO2 {\ displaystyle \ scriptstyle P_ {CO_ {2}}} ~ 2,5 атм), мы получаем относительно кислую среду (p H = 3. {1/2}}
См. также
Список литературы
- Hage, W., К. Р. Лидл, А. Халльбрукер и Э. Майер. 1998. «Углекислота в газовой фазе и ее астрофизическое значение». Наука , 279: 1332-1335.
- Hage, W., A. Hallbrucker и E. Mayer. 1993. «Угольная кислота: синтез протонированием бикарбоната и ИК-Фурье спектроскопия с помощью новой криогенной техники». J. Am. Chem. Soc. 115: 8427-8431.
- Hage, W., A. Hallbrucker и E. Mayer. 1995. Полиморф угольной кислоты и его возможное астрофизическое значение. J. Chem. Soc. Фарад. Пер. 91: 2823-2826.
- Джолли, W. L. 1991. Современная неорганическая химия , 2-е изд. Нью-Йорк: MgGraw-Hill. ISBN 0-07-112651-1
- Loerting, T., C. Tautermann, R.T. Kroemer, I. Kohl, E. Mayer, A. Hallbrucker и K. R. Liedl. 2001. «Об удивительной кинетической стабильности угольной кислоты». Angew. Chem. Int. Эд. 39: 891-895.
- Мур, М. Х. и Р. Ханна. 1991. «Инфракрасные и масс-спектральные исследования льда h3O + CO2, облученного протонами: доказательства наличия угольной кислоты.” Spectrochimica Acta , 47A: 255-262.
- Welch, M. J., J. F. Lipton и J. A. Seck. 1969. J. Phys. Chem. 73: 3351.
Внешние ссылки
Все ссылки получены 10 января 2017 г.
Кредиты
Энциклопедия Нового Света Писатели и редакторы переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 Лицензия (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, участников, так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в Энциклопедия Нового Света :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Угольная кислота — структура, свойства, применение и значение в крови
Что такое углекислота?
Угольная кислота может быть определена как углеродсодержащее соединение, имеющее химическую формулу h3CO3. Растворы диоксида углерода в воде содержат небольшие количества этого соединения. Химическая формула угольной кислоты также может быть записана как OC (OH) 2, потому что в этом соединении есть одна двойная связь углерод-кислород.
Угольную кислоту часто называют респираторной кислотой, потому что это единственная кислота, выдыхаемая легкими человека в газообразном состоянии.Он образует бикарбонатные и карбонатные соли и является слабой кислотой.
Примечание: h3CO3 способен растворять известняк, что приводит к образованию бикарбоната кальция (Ca (HCO3) 2). Это основная причина различных свойств известняка, включая сталактиты и сталагмиты.
Структура h3CO3
Углекислота или структура h3CO3 может быть проиллюстрирована ниже:
[Изображение будет загружено в ближайшее время]
Из иллюстрации выше мы можем понять, что структура угольной кислоты состоит из одной двойной связи углерод-кислород и двух одинарных связей углерод-кислород.Атомы кислорода, которые участвуют в одинарной связи с углеродом, содержат каждый присоединенный к ним атом водорода.
Угольная кислота, образующаяся при гидролизе и растворении CO2 в воде, является основным естественным выщелачивающим агентом в различных экосистемах умеренного пояса. Угольная кислота нестабильна, слабая и быстро диссоциирует на ионы бикарбоната (HCO3–) и ионы водорода (H +).
Когда CO2 растворяется в воде, он участвует в химическом равновесии, как показано ниже.
CO2 + h3O ⇌ h3CO3
Однако в описанном выше химическом равновесии только небольшое количество диоксида углерода превращается в угольную кислоту.
Свойства h3CO3
В этом подразделе перечислены несколько основных физических и химических свойств угольной кислоты:
Физические свойства
Молярная масса угольной кислоты может быть выражена как 62,024 грамма на моль.
Соединение h3CO3 имеет значение pKa 3,6.
В стандартном состоянии имеет плотность 1,668 грамма на кубический сантиметр.
Обычно это соединение существует в виде раствора.Но есть сообщения, что ученые НАСА подготовили твердые образцы h3CO3.
Основание конъюгата, соответствующее угольной кислоте, представляет собой бикарбонат.
Химические свойства
h3CO3 нестабилен по природе и является слабой кислотой.
В присутствии воды он подвергается частичной диссоциации с образованием ионов HCO3– (бикарбонат) и H +.
Угольная кислота является дипротоновой кислотой и, следовательно, может образовывать два типа солей: карбонаты и бикарбонаты.
Добавление небольшого количества основания к h3CO3 дает бикарбонатные соли, тогда как добавление избыточного количества основания дает карбонатные соли.
Следует также отметить, что угольная кислота может быть получена при сжигании ископаемого топлива в промышленных масштабах или как побочный продукт промышленных процессов ферментации.
Углекислота
h3CO3 — важное соединение с широким спектром применения. Некоторые виды использования угольной кислоты перечислены ниже:
При приготовлении игристого вина, газированной воды и других газированных напитков используется углекислота.
h3CO3 можно использовать для осаждения различных солей аммония, таких как персульфат аммония.
Помогает выводить углекислый газ из организма.
h3CO3 протонирует многие основания, содержащие азот в сыворотке крови.
Стригущий лишай и другие дерматиты лечат путем нанесения угольной кислоты на пораженный участок.
Растворы, содержащие это соединение, очень эффективны при очистке контактных линз.
Его можно принимать перорально, чтобы вызвать рвоту, когда это необходимо (например, в случае передозировки наркотиками).
Значение углекислоты в крови
Ион или молекула бикарбоната являются промежуточным звеном для транспортировки углекислого газа из человеческого тела в процессе газообмена дыхательных путей. Реакции гидратации диоксида углерода протекают очень медленно, особенно в отсутствие подходящего катализатора. Присутствие в эритроцитах семейства ферментов, называемых углеангидразами, приводит к увеличению скорости реакции.
Ферменты ферментов карбоангидразы катализируют превращение воды и диоксида углерода в диссоциированные ионы угольной кислоты. При этом образуются анионы бикарбоната, которые растворяются в плазме крови. Эта катализируемая реакция обратится в легких, что приведет к образованию CO2, а затем будет выдох.
Комментарий к кислотности угольной кислоты
Угольная кислота описывается как карбоновая кислота, которая содержит замещенную гидроксильную группу. Ее еще называют полипротонной кислотой.На самом деле это соединение дипротично и, следовательно, оно имеет два протона, которые диссоциируют от первичной родительской молекулы. Таким образом, существуют две константы диссоциации, первая из которых предназначена для диссоциации на бикарбонат-ион.
Угольная кислота — обзор
CO
2 FLOODДобавление угольной кислоты к воде для закачки в пласт или ее применение в качестве оторочки перед закачкой воды является эффективным методом увеличения нефтеотдачи.
Когда масло контактирует с газированной водой, диоксид углерода, который более растворим в углеводородных жидкостях, чем в воде, переходит из воды в масло.В результате вязкость масла снижается, а объем масла увеличивается. Вода, насыщенная углекислым газом, становится более вязкой, снижается pH и поверхностное натяжение на границе нефть-вода, улучшается смачивание породы водой, происходит отделение и смыв нефтяной пленки. Это приводит к увеличению скорости смачивания насыщенной породы водой. В процессе фильтрации проницаемость пористой среды увеличивается за счет уменьшения набухания глины и раствора карбонатов кальция.
Добавление 4–5% угольной кислоты к воде, закачиваемой в пласт, или создание оторочки угольной кислоты позволяет увеличить нефтеотдачу примерно на 10–15% по сравнению с обычным заводнением.
Промышленные испытания проводились в пласте, состоящем из обломочных пород нижнего карбона, образовавшихся в результате заводнения. Углекислота закачивалась на участке, где были доступны одна нагнетательная скважина и четыре добывающие скважины. Закачка газированной воды привела к увеличению нефтеотдачи на 6 процентов по сравнению с заводнением. На тонну добавленной угольной кислоты было получено от 10 до 15 тонн дополнительной нефти.
В связи с высокой эффективностью угольной кислоты для повышения нефтеотдачи, потребность в этой кислоте резко возросла.Высококачественное производство углекислоты может быть достигнуто за счет утилизации газообразных отходов спиртовых заводов, нефтеперерабатывающих заводов, нефтехимических, химических и других энергетических предприятий. Одновременно требуют решения проблемы защиты окружающей среды.
Самый дешевый источник CO 2 для применения в нефтяной промышленности — это естественные месторождения, связанные с нефтяными месторождениями. Другие возможные источники угольной кислоты приведены в Таблице 27-1.
ТАБЛИЦА 27-1. Источники углекислоты
| Источник | Годовой объем производства (10 3 тонны) | Ориентировочная стоимость за тонну (рубли) | Цена за тонну (рубли) | |||
|---|---|---|---|---|---|---|
| Рассчитано до | Требуется наладить производство | |||||
| Нефтехимический завод | 300 | 4.7 | 6,2 | 8 | ||
| Нефтеперерабатывающий завод | 240 | 6,4 | 8,9 | 10 | ||
| Содно-цементный завод | 380 | 40,2 44,14548 905 905 Тепло и электростанция | 1,530 | 40,9 | 44,9 | 50 |
| ГЭС | 1,530 | 40,9 | 44,9 | Таким образом50 | ||
Угольная кислота — обзор
6.16.1.1.4. (Iv) Реакции аминов с карбаматами и тиокарбаматами
Карбаматы представляют собой производные угольной кислоты, наиболее широко используемые в синтезе мочевины и обычно получаемые частичным аминолизом хлорформиатов ( см. схему 8). O -фенил и O — t -бутилкарбаматы являются наиболее популярными, последние легко доступны из аминов и (BOC) 2 O. Аминолиз карбаматов (уравнение (11)) обычно требует присутствия основания (триэтиламин, ДБУ, NaHCO 3 и др.) и, при необходимости, можно стимулировать добавлением хлорсиланов <1998JOC8515, 2000JOC3239> или нагреванием над γ-Al 2 O 3 <2000TL6347>.
(11)Реакция толерантна к широкому спектру функциональных групп как карбаматных, так и аминных реагентов, что позволяет получать мультифункциональные мочевины, в том числе: акрилоилмочевины <1993EUP556841>, гидроксизамещенные мочевины <1997S1189, 2001TL1445 >, полифторированные мочевины <2000JOC1549>, арилсульфонил <2001WOP05354> и гетероарилсульфонилмочевины <1995WOP00509, 2001MI404>, карбамоилдиаминокислоты <1994EUP629612>, N — карбамоилгликозиды <1994EUP629612>, N — карбамоилгликозиды 14HLGL209L1209LGликозиды 14A120119LGликозиды 114A91 карбамоилпиперидины <1997S1189, 2000JOC1549>, пиперазины <1996SL507>, индолины <2001JHC451, 2002TL6649>, дигидрохинолины <2000TL6387> и дигидрофталазины <2002JHC989>.Группы, чувствительные к трансформации, включают некоторые аминозащитные группы, такие как N -бензоат <2000MI405> и N -феноксикарбоксилат <1992JOC5020>.
Карбаматаминолиз также применялся для твердофазного получения N -карбамоилдигидрохинолинонов <2000SL45>, N -карбамоилгуанидинов <1999JCO361>, олигубамочевин <2000TL1553- и трис-мочевин <2000TL1553->, а также библиотек 1998JOC4802, 2002MI81>.
При обработке аминами циклические карбаматы, такие как 2-оксазолидиноны <1996TL1217> или 1 H -тиено [2,3-d] [1,3] оксазин-2,4-дионы <1998T10789>, подвергаются аминативному раскрытие кольца с получением мочевины с гидрокси- или карбоксигруппами соответственно.
Когда реактивная амино- или иминофункция уже присутствует в карбамате или активирована in situ путем снятия защиты, может происходить внутримолекулярное карбамоилирование, открывая доступ к различным замещенным гидантоинам <1997TL2065, 1998CC2703, 2000T3697>, оптически активным полициклическим мочевинам <1996T8581 >, триазиндионы <2002HCO123> и конденсированные тетразиноны <2002JCS (P1) 1877>.
Циклические мочевины также могут быть получены межмолекулярным карбамоилированием, если карбаматный и / или аминный компонент имеет дополнительные реакционноспособные функциональные группы. Таким образом, гидантоины 29 (уравнение (12)) и их дегидропроизводные были получены конденсацией N -BOC аминов 28 , имеющих активированное α-положение, с иминами <1996JOC428, 2001JOC2858, 2002EJO301> и нитрилами <1994JHC1689> , соответственно. Циклоконденсация α, β-ненасыщенных β-аминокислот или их сложных эфиров с карбаматами дала производные урацила <1995JAP (K) 0761975, 1998USP5817814>, тогда как реакция дигидробензодиазепинтиона с этилкарбазатом давала конденсированные триазолобензодиазепиноны с умеренными выходами <3758200>.Пиразоло [1,5-d] [1,2,4] триазиноны получали аналогичной циклоконденсацией 5-ацилпиразолил-1-карбоксилатов с фенилгидразином <2002JOU602>.
(12)Аминолиз S -метилалкилтиокарбаматов с первичными или вторичными алкилами и циклоалкиламинами в ацетонитриле <1998TL3609> или с первичными сульфонамидами в толуоле в присутствии DBU <2000SC3081> дал соответствующие мочевины и 60 сульфонилмочевины. –89% выход без рацемизации. Хотя бензамид и тиобензамид не реагировали в этих условиях, арилзамещенные мочевины были получены с выходами 81–100% обработкой тиокарбаматов образовавшимися in situ карбанионами анилина <2000SC1675>.
Аминолиз S -аллил N -ацилтиокарбаматов с различными аминами в двухфазной системе бензол-вода <1993CCC575> или с фенилгидразином в бензоле <1993MI64> давал соответствующие ацилмочевины и ацилсемикарбазиды соответственно.
Термолиз N -арилкарбаматов при 230–240 ° C дает соответствующие симметричные 1,3-диарилмочевины с выходами 42–97% <1994RRC397>.
Углекислота в напитках | Жить сильным.com
Углекислота не разрушает зубы.
Изображение предоставлено: shironosov / iStock / Getty Images
Газированные напитки содержат кислотную молекулу, называемую угольной кислотой, которая разлагается, когда вы открываете бутылку или банку газированного напитка. При разложении угольной кислоты образуется характерное газированное шипение. Несмотря на ее кислотные свойства, нет никаких доказательств того, что углекислота в напитках причиняет вам вред.
Угольная кислота
Угольная кислота имеет химическую формулу h3CO3.Он образуется в результате химической реакции углекислого газа и воды, и когда он разлагается, он производит их в виде продуктов. Разложение — не единственная химическая реакция, через которую может пройти угольная кислота; он также может действовать как кислота и распадаться на положительно заряженную частицу водорода и отрицательно заряженную частицу HCO3 или бикарбоната, объясняет доктор. Реджинальд Гаррет и Чарльз Гришем в своей книге «Биохимия». Обстоятельства помогают определить реакцию угольной кислоты.
В напитках
Углекислота растворяется в воде, поэтому ее можно добавлять в напитки.В запечатанном контейнере угольная кислота имеет тенденцию действовать как кислота, распадаясь на водород и бикарбонат. Однако как только вы открываете контейнер с напитком, водород и бикарбонат в напитке быстро рекомбинируют с образованием угольной кислоты, которая затем разлагается на воду и диоксид углерода. Углекислый газ пузырится из напитка, выделяя газ в воздух.
Зубы
Купание зубов кислотой вредно для зубной эмали и может привести к образованию кариеса.Однако угольная кислота не является особенно кислой по сравнению со многими другими кислотами, которые вы найдете в газированных напитках — например, фосфорной кислотой — и не участвует в повреждении зубов, — объясняет доктор П. Мойнихан в 2002 году. статья в «Британском стоматологическом журнале». Отчасти это связано с тем, что угольная кислота относительно слаба, а отчасти потому, что она так быстро разлагается.
Другие проблемы
Нет серьезных последствий для здоровья, связанных с употреблением угольной кислоты, как потому, что это относительно слабая кислота, так и потому, что она очень быстро разлагается.Однако углекислота, содержащаяся в газированных напитках и других газированных напитках, при расщеплении может привести к скоплению воздуха в желудке. Это может вызвать неприятное ощущение вздутия живота и может привести к отрыжке.
