6 преимуществ украшений из титана — Jewellery Mag

Серьги Moon Jewellery из титана с элементами из серебра и позолоченной латуни. Фото: E. Fedko
За последние несколько лет ювелирные изделия из титана стали особенно популярными. И мужчины и женщины ценят практичность этого прочного металла.
Ювелирные изделия из титана в основном производятся сложными машинами, которые тщательно вырезают и отделяют идеально сформированные куски. Украшения из титана могут включать бриллианты и другие драгоценные камни, однако в целом твердость титана ограничивает выбор вставок, которые может удерживать металл.
О ювелирных изделиях из титана
Когда титан был впервые обнаружен в конце XVIII века, он был назван в честь великих мифологических титанов — вряд ли нашлось бы более подходящее имя такого крепкого и выносливого металла. В то время работа с таким прочным материалом была невозможна, поэтому ювелирные дизайнеры не работали с титаном до конца 1990-х годов.
Кольца были первыми украшениями, которые были изготовлены из титана, а новые технологии были протестированы для гравировки по металлу и инкрустирования драгоценных камней. Благодаря успеху титановых колец появилась возможность для ювелирных дизайнеров экспериментировать ожерельями, браслетами и другими изделиями.
Преимущества покупки ювелирных изделий из титана

Кольцо «Руны» из титана и 24-каратного золота. Фото: E. Fedko
К сожалению, по сей день большинство потребителей не знает о многих преимуществах, которые может предложить этот металл. Далее мы рассмотрим 6 главных плюсов титановых ювелирных изделий.
1. Прочность и долговечность
Одним из наиболее известных преимуществ титана является его долговечность. В то время как ювелирные изделия из золота и серебра легко царапаются от ежедневного ношения, титан является одним из самых прочных ювелирных металлов. Изделия из титана могут выдерживать практически любые неблагоприятные условия. Этот металл не вдавливается, практически не царапается и не теряет блеска. Титан не подвержен коррозии и не меняет цвет от времени.
Многие кольца из золота и серебра со временем теряют свою круглую форму, когда мы задеваем пальцами различные объекты и поверхности или даже просто сжимаем ладони. Из-за своей твердости титановые кольца не теряют форму.
Несмотря на то, что металл этот очень прочный, титановые украшения можно выполнять в самых разных стилях, с инкрустацией камнями и даже другими металлами. Титан также легче, чем многие другие металлы. Это качество делает украшения из титана (даже по-настоящему массивные) более удобными для ношения.
2. Необыкновенная палитра цветов

Кольцо «Бабочка»: титан, белое золото, бриллианты. Фото: E. Fedko

Браслет из титана и серебра от Jean-Yves Nantel. Фото: E. Fedko
При нагревании титана или воздействии на него электрическим током, металл высвобождает оксиды и меняет свой цвет. В зависимости от температуры и длительности времени нагрева титана цвета варьируются от желтого и розового до красного, фиолетового и даже черного. Благодаря этому мы можем любоваться украшениями самых разных фантастических оттенков, возникших не благодаря окрашиванию, а порожденных свойствами самого металла.
3. Биосовместимость
Даже в своей природной форме титан является биосовместимым практически со всеми типами кожи человека. Это означает, что практически каждый может носить титановые украшения, не опасаясь высыпаний и других аллергических реакций организма. Зачастую даже те люди, которые столкнулись с непереносимостью изделий из золота или серебра, могут без проблем носить титан.
Главная причина состоит в том, что, в отличие от прочих драгоценных металлов, титан не смешивается с иными сплавами и металлами, способными вызвать аллергию. Свои лучшие качества титан проявляет именно в «чистом виде», поэтому он подходит практически каждому человеку.
4. Востребованность у мужчин
По мере роста популярности титана в ювелирных изделиях, спрос на него рос в том числе среди представителей мужского пола. Многие мужчины считают, что титан выглядит более мужественным из-за его гладкого, блестящего, почти космического внешнего вида. Даже те, кто редко носит ювелирные изделия, ценят легкость, прочность и износостойкость титановых часов или колец.
5. Доступность покупки

Серьги «Крылья»: титан, белое золото, бриллианты. Фото: E. Fedko
Когда дизайнеры ювелирных изделий начали экспериментировать с титаном в конце 1990-х годов, было почти невозможно найти этот металл в ювелирных изделиях. Сегодня же титановые украшения достаточно популярны и доступны во многих ювелирных магазинах. Информация о преимуществах этого металла активно распространялась, и сегодня многие смелые покупатели выбирают титановые украшения.
6. Демократичная стоимость
Титановые изделия по сравнению с другими популярными ювелирными металлами несут на себе меньшую наценку и, как следствие, более демократичную стоимость. Золото, например, оценивается в соответствии с его каратами (фактически – чистотой) и сложным процессом подготовки сплавов еще до превращения в ювелирные изделия.
Напротив, титан — изначально готов к обработке без каких-либо добавок или трудоемких процессов подготовки. Этот металл нужно только формовать и стилизовать, чтобы он стал украшением. Это позволяет снизить стоимость изделий из титана по сравнению с другими металлами. Даже дополнительные элементы дизайна, такие как резьбовые пазы или вставки драгоценных камней, создают меньшее увеличение цены, чем в золотых или серебряных ювелирных изделиях.
Титан отлично подходит для любого украшения. Доступность и износостойкость этого металла делает его разумным выбором для большинства поклонников драгоценностей. По мере того, как титан приобретает все большую популярность, ювелиры будут все смелее экспериментировать с формами и стилями титановых изделий.
jewellerymag.ru
описание элемента с фото, его влияние на организм, потребность в нем
Описание
Титан – один из загадочных, малоизученных макроэлементов в науке и жизни человека. Хотя его не зря называют «космическим» элементом, т.к. он активно применяется в передовых отраслях науки, техники, медицины и во многом другом – это элемент будущего.
Этот металл серебристо-серого цвета (см. фото), не растворим в воде. Он у него небольшая химическая плотность, поэтому ему характерна легкость. В то же время он очень прочен и легко поддается обработке из-за своей плавкости и пластичности. Элемент химически инертен благодаря наличию на поверхности защитной пленки. Титан не горюч, но его пыль взрывоопасна.
Открытие этого химического элемента принадлежит большому любителю минералов англичанину Уильяму Мак-Грегору. Но своим названием титан обязан все же химику – Мартину Генриху Клапроту, который обнаружил его независимо от Мак-Грегора.
Предположения о причинах, по которым этот металл назвали «титаном» романтичны. По одной версии, название связано с древнегреческими богами Титанами, родителями которых являлись бог Уран и богиня Гея, а вот согласно второй, оно происходит от имени королевы фей – Титании.
Как бы там ни было, этот макроэлемент девятый по нахождению в природе. Он входит в состав тканей представителей флоры и фауны. Много его в морской воде (до 7%), а вот в почве его содержится всего 0,57%. Наиболее богат запасами титана Китай, за ним идет Россия.
Действие титана
Действие макроэлемента на организм обусловлено его физико-химическими свойствами. Его частицы очень малы, они могут проникать в клеточную структуру и влиять на ее работу. Считается, что из-за своей инертности макроэлемент не взаимодействует химически с раздражителями, и поэтому не токсичен. Однако он вступает в связь с клетками тканей, органов, крови, лимфы посредством физического действия, что приводит к их механическому повреждению. Так, элемент может своим действием привести к повреждению одно- и двухцепочной ДНК, повредить хромосомы, что может привести к риску развития рака и сбоя в генетическом коде.
Выяснилось, что частицы макроэлемента не способны пройти через кожу. Поэтому попадают они внутрь человека только с едой, водой и воздухом.
Титан лучше усваивается через желудочно-кишечный тракт (1-3%), а вот через дыхательные пути всасывается только около 1%, однако содержание его в организме сконцентрировано как в легких (30%). С чем это связано? Проанализировав все вышеуказанные цифры, можно прийти к нескольким выводам. Во-первых, титан вообще плохо усваивается организмом. Во-вторых, через ЖКТ идет выведение титана через кал (0,52 мг) и мочу (0,33 мг), а вот в легких такой механизм слабый или вовсе отсутствует, так как с возрастом у человека концентрация титана в этом органе возрастает практически в 100 раз. Чем же обусловлена такая большая концентрация при таком слабом всасывании? Скорее всего, это связано с постоянной атакой на наш организм пыли, в которой всегда присутствует титановая составляющая. Кроме того в данном лучае нужно учитывать нашу экологию и наличие промышленных мощностей вблизи населенных пунктов.
По сравнению с легкими, в остальных органах, таких как селезенка, надпочечники, щитовидная железа, содержание макроэлемента на протяжении всей жизни остается неизменным. Также присутствие элемента наблюдается в лимфе, плаценте, головном мозге, женском грудном молоке, костях, ногтях, волосах, хрусталике глаза, тканях эпителия.
Находясь в костях, титан участвует в их срастании после переломов. Также положительное действие наблюдается в восстановительных процессах, происходящих в поврежденных подвижных соединениях костей при артритах и артрозах. Этот металл является сильным антиоксидантом. Ослабляя действие свободных радикалов на клетки кожи и крови, он защищает весь организм от преждевременного старения и изнашивания.
Концентрируясь в отделах мозга, отвечающих за зрение и слух, положительно влияет на их функционирование. Нахождение металла в надпочечниках и щитовидной железе подразумевает его участие в вырабатывании гормонов, участвующих в обмене веществ. Он также задействован в выработке гемоглобина, выработке эритроцитов. Снижая в крови содержание холестерина и мочевины, следит за ее нормальным составом.
Негативное действие титана на организм связано с тем, что он является тяжелым металлом. Попадая в организм, он не расщепляется и не разлагается, а оседает в органах и тканях человека, отравляя его и вмешиваясь в процессы жизнедеятельности. Он не подвержен коррозии и устойчив к действию щелочей и кислот, поэтому желудочный сок не способен на него воздействовать.
Соединения титана имеют способность не пропускать коротковолновое ультрафиолетовое излучение и не всасываются через кожу, поэтому их можно использовать для защиты кожи от ультрафиолета.
Доказано, что курение увеличивает поступление металла в легкие из воздуха во много раз. Это ли не повод бросить эту вредную привычку!
Суточная норма — какова потребность в химическом элементе?
Суточная норма макроэлемента обусловлена тем, что в теле человека содержится примерно 20 мг титана, из них 2,4 мг – в легких. Каждый день с пищей организм приобретает 0,85 мг вещества, с водой – 0,002 мг, а с воздухом – 0,0007 мг. Суточная норма для титана очень условна, так как последствия его влияния на органы до конца не изучено. Приблизительно она равняется около 300-600 мкг в сутки. Нет никаких клинических данных о последствиях превышения этой нормы – все на стадии опытных исследований.
Недостаток титана
Состояния, при которых бы наблюдался недостаток металла, не выявлены, поэтому ученые пришли к выводу, что их в природе не существует. Но его дефицит наблюдается при большинстве тяжелых заболеваний, что может ухудшить состояние больного. Этот недостаток можно убрать титаносодержащими препаратами.
Влияние избытка титана на организм
Избыток макроэлемента единоразового поступления титана в организм не выявлен. Если, предположим, человек проглотил титановый штифт, то, по всей видимости, об отравлении говорить не приходится. Скорее всего, из-за своей инертности элемент не вступит в контакт, а выведется естественным путем.
Большую опасность вызывает систематическое увеличение концентрации макроэлемента в органах дыхания. Это приводит к повреждению дыхательной и лимфатической систем. Также есть непосредственная связь между степенью протекания силикоза и содержанием элемента в органах дыхания. Чем больше его содержание, тем тяжелее протекает болезнь.
Избыток тяжелого металла наблюдается у людей, работающих на химических и металлургических предприятиях. Наиболее опасен хлорид титана – за 3 рабочих года начинается проявление тяжелых хронических заболеваний.
Такие заболевания лечат специальными препаратами и витаминами.
Каковы источники?

Элемент попадает в организм человека в основном с пищей и водой. Больше всего его в бобовых (горох, фасоль, чечевица, бобы) и в злаковых (рожь, ячмень, гречка, овес). Выявлено его присутствие в молочных и мясных блюдах, а также в яйцах. В растениях сконцентрировано больше этого элемента, чем в животных. Особенно высоко его содержание в водоросли – кустистой кладофоре.
Во всех продуктах питания, где присутствует пищевой краситель Е171, содержится диоксид этого металла. Его применяют в изготовлении соусов и приправ. Вред этой добавки находится под вопросом, так как оксид титана практически не растворим в воде и желудочном соке.
Показания к применению
Показания к применению элемента, несмотря на то, что этот космический элемент еще мало изучен, есть, он активно применяется во всех сферах медицины. Из-за своей прочности, коррозионной стойкости и биологической инертности, он широко применяется в сферах протезирования для изготовления имплантантов. Его применяют в стоматологии, нейрохирургии, ортопедии. Благодаря долговечности из него изготавливают хирургические инструменты.
Диоксид этого вещества используют в лечении болезней кожи, таких как хейлит, герпес, угревая сыпь, воспаление слизистой рта. Им удаляют гемангиому лица.
Никелид металла задействован в устранении местно-распространенного рака гортани. Его используют для эндопротезирования гортани и трахеи. Также он применяется для лечения инфицированных ран в сочетании с растворами антибиотиков.
Аквакомплекс глицеросольвата макроэлемента способствует заживлению язвенных ран.
Для ученых по всему миру открыто много возможностей для изучения элемента будущего, так как его физико-химические свойства высоки и могут принести безграничную пользу для человечества.
xcook.info
Титан — металл сильных и уверенных в себе — Jewellery Mag
Сегодня мы расскажем о главных особенностях этого необычного металла, причинах столь его высокой популярности и о том, как правильно за ним ухаживать.
История развития титана

Слиток титана
Этот тугоплавкий металл открыли приблизительно в 1790 году, но тогда учёные умы совершенно не представляли, чем он может быть полезен. В то время с ним не умели работать, а за сложность обработки прозвали «Titan», как некогда древние греки называли богов, обладающих огромной силой и мужеством.
Спустя 120 лет, только в 1910 году, англичане начали процесс извлечения титана из руды. Этот процесс постоянно улучшался, и уже к середине 1940-х годов американцы решили использовать его в военной авиации. Основными критериями в таком выборе послужили: соотношение прочности к весу, устойчивость к перепадам температур, доступная цена, а также антикоррозийные свойства металла.
Использование титана

Памятник Гагарину в Москве, изготовленный из титана
Начиная с 40-х годов прошлого века титан активно используют в кораблестроении, изготовлении самолётов и ракет. Из него также делают велосипедные рамы, насосы, реакторы, протезы, арматуру, бронежилеты и ещё множество полезных для человека вещей. Не последнее место титан занял в часовом и ювелирном производствах.
В 1980 году в Москве установили 42-х метровый памятник Гагарину. Он стал первым в мире габаритным постаментом, изготовленным из этого металла. Сделать это было не так-то просто, памятник собирали из 238 литых сегментов, а вес всей установки составил 12 тонн.
Титан в часовом производстве

Титановые часы от Porsche Design и IWC (Ocean 2000)
Часовщики и ювелиры обратили своё внимание на титан не так давно. Впервые его применили для изготовления часов в 1980 году. Первопроходцами стали специалисты из Porsche Design и IWC. Объединив свои силы, компании выпустили титановые часы, которые произвели настоящий фурор. Вскоре после этого появились еще две модели — Ocean 2000 и Ocean 500 — работающие под водой на глубине до 2000 и до 500 метров соответственно.
Главное преимущества титановых часов в том, что они очень лёгкие, имеют приятный металлический блеск и чем-то схожи по внешним признакам с платиной. Правда, по деформации и подверженности царапинам такие часы уступают изделиям из стали.
Титан в ювелирном искусстве

Брошь Wallace Chan из титана с рубинами, белыми и желтыми бриллиантами, розовыми сапфирами и цаворит гранатов
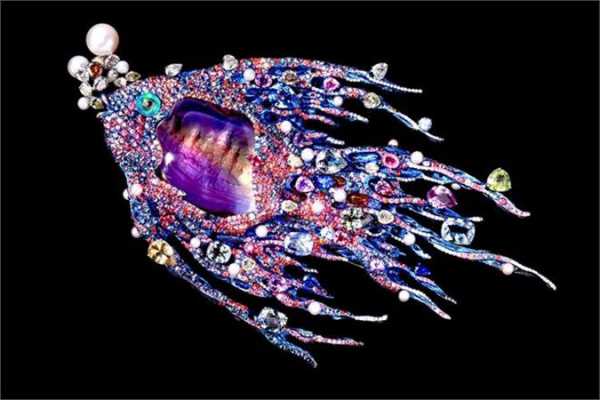
В ювелирном деле титан изначально стали использовать для изготовления обручальных колец, украшений для пирсинга и мужских аксессуаров. Его обработка является довольно сложной и затратной, требует определённых знаний и навыков у мастера, поэтому созданием украшений из титана занимается далеко не каждый ювелир. Но есть и те, кто достиг высшего мастерства в обработке этого металла. Например, китайский ювелир Уоллес Чан изготавливает из титана настоящие произведения искусства в виде драгоценных цветов, насекомых или рыб.
У титана есть одно интересное свойство: при определённом окислении, нагреве или смешивании с другими металлами он может менять свой цвет. В чистом виде это серый металл, но после обработки он может приобрести зелёный, синий, лиловый и даже красный оттенок. Ювелирные дома пользуются той особенностью в создании своих коллекций. Среди именитых брендов-поклонников титана значатся Chopard, Suzanne Syz, Glenn Spiro, Faberge, de Grisogono и другие.
Как ухаживать за титановыми украшениями

Титан, сапфиры, бриллианты. Glenn Spiro
Как и любые другие украшения, изделия из титана нуждаются в правильном уходе. Существует заблуждение, что этот металл не царапается. На самом деле он может потерять привлекательный внешний вид из-за агрессивного контакта с алмазом, другим металлом или наждачной бумагой. В то же время, титан не боится морской воды, пота и абразивных моющих средств.
Уход за титановыми украшениями довольно прост. Их нужно хранить отдельно от других украшений, желательно в бархатном мешочке или шкатулке. Во время работы с другими металлами или наждачной бумагой, следует снимать титановое кольцо.
Для профилактики царапин и мелких деформаций, раз в полгода ювелирные изделия из титана необходимо относить на полировку и чистку. Соблюдая эти несложные правила, вы сможете уберечь свои украшения от повреждений. Они будут всегда выглядеть достойно и эффектно.
Если вам не безразлична судьба ваших любимых драгоценностей и вы хотите правильно о них заботиться, предлагаем ознакомиться и с другими нашими статьями на эту тему:
jewellerymag.ru
Титан (элемент) — WiKi
У этого термина существуют и другие значения, см. Титан.Тита́н — химический элемент с атомным номером 22[4]. Принадлежит к 4-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к побочной подгруппе IV группы, или к группе IVB), находится в четвёртом периоде таблицы. Атомная масса элемента 47,867(1) а. е. м.[1]. Обозначается символом Ti. Простое вещество титан — лёгкий прочный металл серебристо-белого цвета. Обладает высокой коррозионной стойкостью.
| Внешний вид простого вещества | |
|---|---|
| Стержень, состоящий из титановых кристаллов высокой чистоты | |
| Свойства атома | |
| Название, символ, номер | Тита́н / Titanium (Ti), 22 |
| Атомная масса (молярная масса) | 47,867(1)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d2 4s2 |
| Радиус атома | 147 пм |
| Химические свойства | |
| Ковалентный радиус | 132 пм |
| Радиус иона | (+4e)68 (+2e)94 пм |
| Электроотрицательность | 1,54 (шкала Полинга) |
| Электродный потенциал | −1,63 |
| Степени окисления | 2, 3, 4 |
| Энергия ионизации (первый электрон) | 657,8 (6,8281[2]) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 4,54 г/см³ |
| Температура плавления | 1670 °C 1943 K |
| Температура кипения | 3560 K |
| Уд. теплота плавления | 18,8 кДж/моль |
| Уд. теплота испарения | 422,6 кДж/моль |
| Молярная теплоёмкость | 25,1[3] Дж/(K·моль) |
| Молярный объём | 10,6 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная плотноупакованная (α-Ti) |
| Параметры решётки | a=2,951 с=4,697 (α-Ti) |
| Отношение c/a | 1,587 |
| Температура Дебая | 380 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 21,9 Вт/(м·К) |
| Номер CAS | 7440-32-6 |
История
Открытие TiO2 (диоксида титана) сделали практически одновременно и независимо друг от друга англичанин У. Грегор и немецкий химик М. Г. Клапрот. У. Грегор, исследуя состав магнитного железистого песка (Крид, Корнуолл, Англия, 1791), выделил новую «землю» (оксид) неизвестного металла, которую назвал менакеновой. В 1795 г. немецкий химик Клапрот открыл в минерале рутиле новый элемент и назвал его титаном. Спустя два года Клапрот установил, что рутил и менакеновая земля — оксиды одного и того же элемента, за которым и осталось название «титан», предложенное Клапротом. Через 10 лет открытие титана состоялось в третий раз. Французский учёный Л. Воклен обнаружил титан в анатазе и доказал, что рутил и анатаз — идентичные оксиды титана.
Первый образец металлического титана получил в 1825 году Й. Я. Берцелиус. Из-за высокой химической активности титана и сложности его очистки чистый образец Ti получили голландцы А. ван Аркел и И. де Бур в 1925 году термическим разложением паров иодида титана TiI4.
Титан не находил промышленного применения, пока Г. Кролл (англ.)русск. в 1940 году не запатентовал простой магниетермический метод восстановления металлического титана из тетрахлорида; этот метод (процесс Кролла (англ.)русск.) до настоящего времени остаётся одним из основных в промышленном получении титана.
Происхождение названия
Металл получил своё название в честь титанов, персонажей древнегреческой мифологии, детей Геи. Название элементу дал Мартин Клапрот в соответствии со своими взглядами на химическую номенклатуру в противовес французской химической школе, где элемент старались называть по его химическим свойствам. Поскольку немецкий исследователь сам отметил невозможность определения свойств нового элемента только по его оксиду, он подобрал для него имя из мифологии, по аналогии с открытым им ранее ураном.
Нахождение в природе
Титан находится на 10-м месте по распространённости в природе. Содержание в земной коре — 0,57 % по массе, в морской воде — 0,001 мг/л[5]. В ультраосновных породах 300 г/т, в основных — 9 кг/т, в кислых 2,3 кг/т, в глинах и сланцах 4,5 кг/т. В земной коре титан почти всегда четырёхвалентен и присутствует только в кислородных соединениях. В свободном виде не встречается. Титан в условиях выветривания и осаждения имеет геохимическое сродство с Al2O3. Он концентрируется в бокситах коры выветривания и в морских глинистых осадках. Перенос титана осуществляется в виде механических обломков минералов и в виде коллоидов. До 30 % TiO2 по весу накапливается в некоторых глинах. Минералы титана устойчивы к выветриванию и образуют крупные концентрации в россыпях. Известно более 100 минералов, содержащих титан. Важнейшие из них: рутил TiO2, ильменит FeTiO3, титаномагнетит FeTiO3 + Fe3O4, перовскит CaTiO3, титанит (сфен) CaTiSiO5. Различают коренные руды титана — ильменит-титаномагнетитовые и россыпные — рутил-ильменит-цирконовые[3].
Месторождения
Крупные коренные месторождения титана находятся на территории ЮАР, России, Украины, Канады, США, Китая, Норвегии, Швеции, Египта, Австралии, Индии, Южной Кореи, Казахстана; россыпные месторождения имеются в Бразилии, Индии, США, Сьерра-Леоне, Австралии[6][3]. В странах СНГ ведущее место по разведанным запасам титановых руд занимает РФ (58,5 %) и Украина (40,2 %)[7]. Крупнейшее месторождение в России — Ярегское.
Запасы и добыча
Основные руды: ильменит (FeTiO3), рутил (TiO2), титанит (CaTiSiO5).
По данным на 2002 год, 90 % добываемого титана использовалось на производство диоксида титана TiO2. Мировое производство диоксида титана составляло 4,5 млн т. в год. Подтверждённые запасы диоксида титана (без России) составляют около 800 млн т. На 2006 год, по оценке Геологической службы США, в пересчёте на диоксид титана и без учёта России, запасы ильменитовых руд составляют 603—673 млн т., а рутиловых — 49,7—52,7 млн т[8]. Таким образом, при нынешних темпах добычи мировых разведанных запасов титана (без учёта России) хватит более чем на 150 лет.
Россия обладает вторыми в мире, после Китая, запасами титана. Минерально-сырьевую базу титана России составляют 20 месторождений (из них 11 коренных и 9 россыпных), достаточно равномерно рассредоточенных по территории страны. Самое крупное из разведанных месторождений (Ярегское) находится в 25 км от города Ухта (Республика Коми). Запасы месторождения оцениваются в 2 миллиарда тонн руды со средним содержанием диоксида титана около 10 %[9].
Крупнейший в мире производитель титана — российская компания «ВСМПО-АВИСМА»[10].
Получение
Как правило, исходным материалом для производства титана и его соединений служит диоксид титана со сравнительно небольшим количеством примесей. В частности, это может быть рутиловый концентрат, получаемый при обогащении титановых руд. Однако запасы рутила в мире весьма ограничены, и чаще применяют так называемый синтетический рутил или титановый шлак, получаемые при переработке ильменитовых концентратов. Для получения титанового шлака ильменитовый концентрат восстанавливают в электродуговой печи, при этом железо отделяется в металлическую фазу (чугун), а невосстановленные оксиды титана и примесей образуют шлаковую фазу. Богатый шлак перерабатывают хлоридным или сернокислотным способом.
Концентрат титановых руд подвергают сернокислотной или пирометаллургической переработке. Продукт сернокислотной обработки — порошок диоксида титана TiO2. Пирометаллургическим методом руду спекают с коксом и обрабатывают хлором, получая пары тетрахлорида титана TiCl4:
- TiO2+2C+2Cl2→TiCl4+2CO{\displaystyle {\mathsf {TiO_{2}+2C+2Cl_{2}\rightarrow TiCl_{4}+2CO}}}
Образующиеся пары TiCl4 при 850 °C восстанавливают магнием:
- TiCl4+2Mg→2MgCl2+Ti{\displaystyle {\mathsf {TiCl_{4}+2Mg\rightarrow 2MgCl_{2}+Ti}}}
Кроме этого, в настоящее время начинает получать популярность так называемый процесс FFC Cambridge, названный по именам его разработчиков Дерека Фрэя, Тома Фартинга и Джорджа Чена и Кембриджского университета, где он был создан. Этот электрохимический процесс позволяет осуществлять прямое непрерывное восстановление титана из оксида в расплаве смеси хлорида кальция и негашёной извести (оксида кальция). В этом процессе используется электролитическая ванна, наполненная смесью хлорида кальция и извести, с графитовым расходуемым (либо нейтральным) анодом и катодом, изготовленным из подлежащего восстановлению оксида. При пропускании через ванну тока температура быстро достигает ~1000—1100 °C, и расплав оксида кальция разлагается на аноде на кислород и металлический кальций:
- 2CaO→2Ca+O2{\displaystyle {\mathsf {2CaO\rightarrow 2Ca+O_{2}}}}
Полученный кислород окисляет анод (в случае использования графита), а кальций мигрирует в расплаве к катоду, где и восстанавливает из оксида титан:
- O2+C→CO2{\displaystyle {\mathsf {O_{2}+C\rightarrow CO_{2}}}}
- TiO2+2Ca→Ti+2CaO{\displaystyle {\mathsf {TiO_{2}+2Ca\rightarrow Ti+2CaO}}}
Образующийся оксид кальция вновь диссоциирует на кислород и металлический кальций, и процесс повторяется вплоть до полного преобразования катода в титановую губку либо исчерпания оксида кальция. Хлорид кальция в данном процессе используется как электролит для придания электропроводности расплаву и подвижности активным ионам кальция и кислорода. При использовании инертного анода (например, диоксида олова), вместо углекислого газа на аноде выделяется молекулярный кислород, что меньше загрязняет окружающую среду, однако процесс в таком случае становится менее стабильным, и, кроме того, в некоторых условиях более энергетически выгодным становится разложение хлорида, а не оксида кальция, что приводит к высвобождению молекулярного хлора.
Полученную титановую «губку» переплавляют и очищают. Рафинируют титан иодидным способом или электролизом, выделяя Ti из TiCl4. Для получения титановых слитков применяют дуговую, электронно-лучевую или плазменную переработку.
Физические свойства
Титан — лёгкий серебристо-белый металл. При нормальном давлении существует в двух кристаллических модификациях: низкотемпературный α-Ti с гексагональной плотноупакованной решёткой (гексагональная сингония, пространственная группа C6mmc, параметры ячейки a = 0,2953 нм, c = 0,4729 нм, Z = 2) и высокотемпературный β-Ti с кубической объёмно-центрированной упаковкой (кубическая сингония, пространственная группа Im3m, параметры ячейки a = 0,3269 нм, Z = 2), температура перехода α↔β 883 °C, теплота перехода ΔH=3,8 кДж/моль[3] (87,4 кДж/кг[11]). Большинство металлов при растворении в титане стабилизируют β-фазу и снижают температуру перехода α↔β[3]. При давлении выше 9 ГПа и температуре выше 900 °C титан переходит в гексагональную фазу (ω-Ti)[11]. Плотность α-Ti и β-Ti соответственно равна 4,505 г/см³ (при 20 °C) и 4,32 г/см³ (при 900 °C)[3]. Атомная плотность α-титана 5,67·1022 ат/см³[12][13].
Температура плавления титана при нормальном давлении равна 1670 ± 2 °C, или 1943 ± 2 К (принята в качестве одной из вторичных калибровочных точек температурной шкалы ITS-90 (англ.)русск.)[2]. Температура кипения 3287 °C[2]. При достаточно низкой температуре (-80°C)[2] , титан становится довольно хрупким. Молярная теплоёмкость при нормальных условиях Cp = 25,060 кДж/(моль·K), что соответствует удельной теплоёмкости 0,523 кДж/(кг·K)[2]. Теплота плавления 15 кДж/моль[11], теплота испарения 410 кДж/моль[11]. Характеристическая дебаевская температура 430 К[11]. Теплопроводность 21,9 Вт/(м·К) при 20 °C[11]. Температурный коэффициент линейного расширения 9,2·10−6 К−1 в интервале от −120 до +860 °C[11]. Молярная энтропия α-титана S0 = 30,7 кДж/(моль·К)[2]. Для титана в газовой фазе энтальпия формирования ΔH0
f = 473,0 кДж/моль, энергия Гиббса ΔG0
f = 428,4 кДж/моль, молярная энтропия S0 = 180,3 кДж/(моль·К), теплоёмкость при постоянном давлении Cp = 24,4 кДж/(моль·K)[2]
Удельное электрическое сопротивление при 20 °C составляет 0,58 мкОм·м[11] (по другим данным 0,42 мкОм·м[3]), при 800 °C 1,80 мкОм·м[3]. Температурный коэффициент сопротивления 0,003 К−1 в диапазоне 0…20 °C[11].
Пластичен, сваривается в инертной атмосфере. Прочностные характеристики мало зависят от температуры, однако сильно зависят от чистоты и предварительной обработки[3]. Для технического титана твёрдость по Виккерсу составляет 790—800 МПа, модуль нормальной упругости 103 ГПа, модуль сдвига 39,2 ГПа[11]. У высокочистого предварительно отожжённого в вакууме титана предел текучести 140—170 МПа, относительное удлинение 55—70%, твёрдость по Бринеллю 716 МПа[3].
Имеет высокую вязкость, при механической обработке склонен к налипанию на режущий инструмент, и поэтому требуется нанесение специальных покрытий на инструмент, различных смазок.
При обычной температуре покрывается защитной пассивирующей плёнкой оксида TiO2, благодаря этому коррозионностоек в большинстве сред (кроме щелочной).
Температура перехода в сверхпроводящее состояние 0,387 К. При температурах выше 73 кельвин титан парамагнитен. Магнитная восприимчивость при 20 °C составляет 3,2·10−6[3]. Постоянная Холла α-титана равна +1,82·10−13[3].
Химические свойства
Устойчив к коррозии благодаря оксидной плёнке, но при измельчении в порошок, а также в тонкой стружке или проволоке титан пирофорен[3]. Титановая пыль имеет свойство взрываться. Температура вспышки — 400 °C. Титановая стружка пожароопасна.
Титан устойчив к разбавленным растворам многих кислот и щелочей (кроме HF, H3PO4 и концентрированной H2SO4). Титан устойчив к влажному хлору и водным растворам хлора[2].
Легко реагирует даже со слабыми кислотами в присутствии комплексообразователей, например, с плавиковой кислотой HF он взаимодействует благодаря образованию комплексного аниона [TiF6]2−. Титан наиболее подвержен коррозии в органических средах, так как в присутствии воды на поверхности титанового изделия образуется плотная пассивная пленка из оксидов и гидрида титана. Наиболее заметное повышение коррозионной стойкости титана заметно при повышении содержания воды в агрессивной среде с 0,5 до 8,0 %, что подтверждается электрохимическими исследованиями электродных потенциалов титана в растворах кислот и щелочей в смешанных водно-органических средах[14].
При нагревании на воздухе до 1200 °C Ti загорается ярким белым пламенем с образованием оксидных фаз переменного состава TiOx. Из растворов солей титана осаждается гидроксид TiO(OH)2·xH2O, осторожным прокаливанием которого получают оксид TiO2. Гидроксид TiO(OH)2·xH2O и диоксид TiO2амфотерны.
TiO2 взаимодействует с серной кислотой при длительном кипячении. При сплавлении с содой Na2CO3 или поташом K2CO3 оксид TiO2 образует титанаты:
- TiO2+K2CO3→K2TiO3+CO2{\displaystyle {\mathsf {TiO_{2}+K_{2}CO_{3}\rightarrow K_{2}TiO_{3}+CO_{2}}}}
При нагревании Ti взаимодействует с галогенами (например, с хлором — при 550 °C[2]). Тетрахлорид титана TiCl4 при обычных условиях — бесцветная жидкость, сильно дымящая на воздухе, что объясняется гидролизом TiCl4, содержащимися в воздухе парами воды и образованием мельчайших капелек HCl и взвеси гидроксида титана.
Восстановлением TiCl4водородом, алюминием, кремнием, другими сильными восстановителями, получен трихлорид и дихлорид титана TiCl3 и TiCl2 — твёрдые вещества, обладающие сильными восстановительными свойствами. Ti взаимодействует с Br2 и I2.
С азотом N2 выше 400 °C титан образует нитрид TixNx = (Ti25N13 — TiN). Титан — единственный элемент, который горит в атмосфере азота[2].
При взаимодействии титана с углеродом образуется карбид титана TixCx(x = Ti20C9 — TiC.
При нагревании Ti поглощает H2 с образованием соединения переменного состава TixHx(x = Ti10H13 — TiH2. При нагревании эти гидриды разлагаются с выделением H2.
Титан образует сплавы и интерметаллические соединения со многими металлами.
Применение
В чистом виде и в виде сплавов
Часы из титанового сплава Заготовка титанового шпангоута истребителя F-15 до и после прессования на штамповочном прессе компании Alcoa усилием 45 тыс. тонн, май 1985Использование металлического титана во многих отраслях промышленности обусловлено тем, что его прочность примерно равна прочности стали при том, что он на 45 % легче. Титан на 60 % тяжелее алюминия, но прочнее его примерно вдвое[2].
- Титан в виде сплавов является важнейшим конструкционным материалом в авиа- и ракетостроении, в кораблестроении.
- Металл применяется в химической промышленности (реакторы, трубопроводы, насосы, трубопроводная арматура), военной промышленности (бронежилеты, броня и противопожарные перегородки в авиации, корпуса подводных лодок), промышленных процессах (опреснительных установках, процессах целлюлозы и бумаги), автомобильной промышленности, сельскохозяйственной промышленности, пищевой промышленности, спортивных товарах, ювелирных изделиях, мобильных телефонах, лёгких сплавах и т. д.
- Титан является физиологически инертным[2], благодаря чему применяется в медицине (протезы, остеопротезы, зубные имплантаты), в стоматологических и эндодонтических инструментах, украшениях для пирсинга.
- Титановое литьё выполняют в вакуумных печах в графитовые формы. Также используется вакуумное литьё по выплавляемым моделям. Из-за технологических трудностей в художественном литье используется ограниченно. Первой в мировой практике монументальной литой скульптурой из титана является памятник Юрию Гагарину на площади его имени в Москве[15].
- Титан является легирующей добавкой во многих легированных сталях и большинстве спецсплавов[каких?].
- Нитинол (никель-титан) — сплав, обладающий памятью формы, применяемый в медицине и технике.
- Алюминиды титана являются очень стойкими к окислению и жаропрочными, что, в свою очередь, определило их использование в авиации и автомобилестроении в качестве конструкционных материалов.
- Титан является одним из наиболее распространённых геттерных материалов, используемых в высоковакуумных насосах.
Существует множество титановых сплавов с различными металлами. Легирующие элементы разделяют на три группы, в зависимости от их влияния на температуру полиморфного превращения: на бета-стабилизаторы, альфа-стабилизаторы и нейтральные упрочнители. Первые понижают температуру превращения, вторые повышают, третьи не влияют на неё, но приводят к растворному упрочнению матрицы. Примеры альфа-стабилизаторов: алюминий, кислород, углерод, азот. Бета-стабилизаторы: молибден, ванадий, железо, хром, никель. Нейтральные упрочнители: цирконий, олово, кремний. Бета-стабилизаторы, в свою очередь, делятся на бета-изоморфные и бета-эвтектоидообразующие.
Самым распространённым титановым сплавом является сплав Ti-6Al-4V (англ.)русск. (в российской классификации — ВТ6), содержащий около 6% алюминия и около 4% ванадия. По соотношению кристаллических фаз он классифицируется как (α+β)-сплав. На его производство идёт до 50% добываемого титана[3].
Ферротитан (сплав титана с железом, содержащий 18—25% титана) используют в чёрной металлургии для раскисления стали и удаления растворённых в ней нежелательных примесей (сера, азот, кислород)[3].
В 1980-х годах около 60-65 % добываемого в мире титана использовалось в строительстве летательных аппаратов и ракет, 15% — в химическом машиностроении, 10% — в энергетике, 8% — в строительстве судов и для опреснителей воды[3].
В виде соединений
- Белый диоксид титана (TiO2) используется в красках (например, титановые белила), а также при производстве бумаги и пластика. Пищевая добавка E171.
- Титанорганические соединения (например, тетрабутоксититан) применяются в качестве катализатора и отвердителя в химической и лакокрасочной промышленности.
- Неорганические соединения титана применяются в химической электронной, стекловолоконной промышленности в качестве добавки или покрытий.
- Карбид титана, диборид титана, карбонитрид титана — важные компоненты сверхтвёрдых материалов для обработки металлов.
- Нитрид титана применяется для покрытия инструментов, куполов церквей и при производстве бижутерии, так как имеет цвет, похожий на золото.
- Титанат бария BaTiO3, титанат свинца PbTiO3 и ряд других титанатов — сегнетоэлектрики.
- Тетрахлорид титана используется для иридизации стекла и для создания дымовых завес[2].
Анализ рынков потребления
В 2005 компания Titanium Corporation опубликовала следующую оценку потребления титана в мире:
- 60 % — краска;
- 20 % — пластик;
- 13 % — бумага;
- 7 % — машиностроение.
Цены
Цена титана составляет $5,9-6,0 за килограмм, в зависимости от чистоты[16].
Чистота и марка чернового титана (титановой губки) обычно определяется по его твёрдости, которая зависит от содержания примесей.
Физиологическое действие
Титан считается физиологически инертным, благодаря чему применяется в протезировании как металл, непосредственно контактирующий с тканями организма. Однако титановая пыль может быть канцерогенной[2]. Как было сказано выше, титан применяется также в стоматологии. Отличительная черта применения титана заключается не только в прочности, но и способности самого металла сращиваться с костью, что даёт возможность обеспечить квазимонолитность основы зуба.
Изотопы
Природный титан состоит из смеси пяти стабильных изотопов: 46Ti (7,95 %), 47Ti (7,75 %), 48Ti (73,45 %), 49Ti (5,51 %), 50Ti (5,34 %).
Известны искусственные радиоактивные изотопы 45Ti (T½ = 3,09 ч), 51Ti (Т½ = 5,79 мин) и другие.
Примечания
- ↑ 1 2 Meija J. et al. Atomic weights of the elements 2013 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2016. — Vol. 88, no. 3. — P. 265—291. — DOI:10.1515/pac-2015-0305.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 CRC Handbook of Chemistry and Physics / D. R. Lide (Ed.). — 90th edition. — CRC Press; Taylor and Francis, 2009. — 2828 p. — ISBN 1420090844.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Раков И. Э. Титан // Химическая энциклопедия: в 5 т / Зефиров Н. С. (гл. ред.). — М.: Большая Российская энциклопедия, 1995. — Т. 4: Пол—Три. — С. 590—592. — 639 с. — 40 000 экз. — ISBN 5-85270-039-8.
- ↑ Таблица Менделеева на сайте ИЮПАК
- ↑ Riley J.P., Skirrow G. Chemical Oceanography V. 1, 1965.
- ↑ Месторождение титана.
- ↑ Месторождение титана.
- ↑ Ильменит, рутил, титаномагнетит — 2006 г.
- ↑ Титан. Информационно-аналитический центр «Минерал». Проверено 19 ноября 2010. Архивировано 21 августа 2011 года.
- ↑ Корпорация ВСМПО-АВИСМА
- ↑ 1 2 3 4 5 6 7 8 9 10 Бердоносов С. С. Титан // Физическая энциклопедия : [в 5 т.] / Гл. ред. А. М. Прохоров. — М.: Большая российская энциклопедия, 1994. — Т. 4: Пойнтинга — Робертсона — Стримеры. — С. 116. — 704 с. — 40 000 экз. — ISBN 5-85270-087-8.
- ↑ Стрельченко С. С., Лебедев В. В. Соединения A3B5: Справочник. М.: Металлургия, 1984. 144 с.
- ↑ Свойства элементов: В 2 ч. Ч. 1. Физические свойства: Справочник/ Под ред. Г. В. Самсонова. М.: Металлургия, 1976. 600 с.
- ↑ Влияние воды на процесс пассивации титана — 26 Февраля 2015 — Химия и химическая технология в жизни. www.chemfive.ru. Проверено 21 октября 2015.
- ↑ Искусство литья в XX веке
- ↑ На мировом рынке титана за последние два месяца цены стабилизировались (обзор)
Ссылки
ru-wiki.org
Титан — материал украшений будущего – Ярмарка Мастеров
Уже пару лет наш мастер работает с таким интересным и необычным для нашего рынка материалом, как титан. Вдохновил его на этот журнал про ювелирное искусство, который он нашел как-то на работе — оказалось, ювелиры Запада уже давно освоили этот металл и активно используют его в своих украшениях. Было много попыток, но в итоге все желаемое было достигнуто, мастерство освоено и теперь мы можем с уверенностью сказать, что титан нам под силу 🙂
Пока еще титановые украшения только набирают свою популярность — для большинства это занятная диковинка, которая вызывает противоречивые впечатления. Тем более, сейчас на рынке появилось очень много подделок под титан — украшения делаются из сплавов и выдаются за титановые. Если вы видите цену меньше 100 долларов — будете уверены: перед вами подделка, так как титан обрабатывается вручную, это очень кропотливый и трудоемкий процесс, поэтому цена на украшение не может быть низкой.
Нам очень интересен этот металл тем, что он, кроме своей прочности, еще и позволяет сделать очень интересную палитру цветов с помощью окисидирования, вставить в украшения золото или просто придать им более интеренсный вид с помощью разнообразных камней. Надеюсь, мы вас заинтересовали и вы с удовольствием ознакомитесь с этим интересным металлом 🙂

Сегодня мы расскажем о главных особенностях этого необычного металла, причинах столь его высокой популярности и о том, как правильно за ним ухаживать.
Титан — это один из металлов в таблице Менделеева, то есть он является естественным природным элементом (не сплав). Это один из самых легких металлов в мире и к тому же очень прочный — прочнее золота, серебра, стали. Естественный цвет титана — серебристый белый. Добавление примесей делает титан еще более прочным. Этот металл не относится к драгоценным, поэтому пробу на нем не ставят
Этот тугоплавкий металл открыли приблизительно в 1790 году, но тогда учёные умы совершенно не представляли, чем он может быть полезен. В то время с ним не умели работать, а за сложность обработки прозвали «Titan», как некогда древние греки называли богов, обладающих огромной силой и мужеством.

Спустя 120 лет, только в 1910 году, англичане начали процесс извлечения титана из руды. Этот процесс постоянно улучшался, и уже к середине 1940-х годов американцы решили использовать его в военной авиации. Основными критериями в таком выборе послужили: соотношение прочности к весу, устойчивость к перепадам температур, доступная цена, а также антикоррозийные свойства металла.
Начиная с 40-х годов прошлого века титан активно используют в кораблестроении, изготовлении самолётов и ракет. Из него также делают велосипедные рамы, насосы, реакторы, протезы, арматуру, бронежилеты и ещё множество полезных для человека вещей. Не последнее место титан занял в часовом и ювелирном производствах.
Титан — материал будущего. Он является одним из пяти биологически совместимых элементов и не вызывает аллергических реакций даже на самой чувствительной коже. Титан необычайно легкий, но очень прочный материал. Благодаря этим уникальным свойствам 85% конструкционных материалов в космической технике — титан и его сплавы. Наши украшения производятся именно из авиационного титана.

Часовщики и ювелиры обратили своё внимание на титан не так давно. Впервые его применили для изготовления часов в 1980 году. Первопроходцами стали специалисты из Porsche Design и IWC. Объединив свои силы, компании выпустили титановые часы, которые произвели настоящий фурор. Вскоре после этого появились еще две модели — Ocean 2000 и Ocean 500 — работающие под водой на глубине до 2000 и до 500 метров соответственно.
Главное преимущества титановых часов в том, что они очень лёгкие, имеют приятный металлический блеск и чем-то схожи по внешним признакам с платиной. Правда, по деформации и подверженности царапинам такие часы уступают изделиям из стали.
В ювелирном деле титан изначально стали использовать для изготовления обручальных колец, украшений для пирсинга и мужских аксессуаров. Его обработка является довольно сложной и затратной, требует определённых знаний и навыков у мастера, поэтому созданием украшений из титана занимается далеко не каждый ювелир. Но есть и те, кто достиг высшего мастерства в обработке этого металла. Например, китайский ювелир Уоллес Чан изготавливает из титана настоящие произведения искусства в виде драгоценных цветов, насекомых или рыб.

У титана есть одно интересное свойство: при определённом окислении, нагреве или смешивании с другими металлами он может менять свой цвет. В чистом виде это серый металл, но после обработки он может приобрести зелёный, синий, лиловый и даже красный оттенок. Ювелирные дома пользуются той особенностью в создании своих коллекций. Среди именитых брендов-поклонников титана значатся Chopard, Suzanne Syz, Glenn Spiro, Faberge, de Grisogono и другие.

Как и любые другие украшения, изделия из титана нуждаются в правильном уходе. Существует заблуждение, что этот металл не царапается. На самом деле он может потерять привлекательный внешний вид из-за агрессивного контакта с алмазом, другим металлом или наждачной бумагой. В то же время, титан не боится морской воды, пота и абразивных моющих средств.
Уход за титановыми украшениями довольно прост. Их нужно хранить отдельно от других украшений, желательно в бархатном мешочке или шкатулке. Во время работы с другими металлами или наждачной бумагой, следует снимать титановое кольцо.
Для профилактики царапин и мелких деформаций, раз в полгода ювелирные изделия из титана необходимо относить на полировку и чистку. Соблюдая эти несложные правила, вы сможете уберечь свои украшения от повреждений. Они будут всегда выглядеть достойно и эффектно.

Любители титановых украшений ценят этот металл за его несколько особых качеств.
Красивый внешний вид. Кольца из титана не менее красивы, чем из серебра и золота. Их делают и простые — только из металла, и с декором — с различными камнями (в том числе с бриллиантами), вставками, напылениями и так далее. Они могут быть глянцевыми и матовыми, а также различного цвета — синие, черные, фиолетовые и другие.
Относительно низкая цена. Кольца из титана дешевле, чем из золота. Сам металл стоит недорого, но для его обработки нужно иметь дорогое оборудование. Это образует большую часть цены изделий.
Прочность. Обручальные кольца из титана более устойчивы к физическим и химическим (например, от бытовой химии) воздействиям, чем золотые или серебряные. Фактор прочности здесь важен, ведь эти кольца люди обычно носят практически не снимая.

Гипоаллергенность. Титан не окисляется, не ржавеет, не вступает в реакцию ни с какими веществами, находясь на человеческом теле. Люди, у которых есть аллергия на серебро, золото и сплавы, могут позволить себе носить титановые украшения.
Легкость. Так как титан очень легкий металл, то даже крупные украшения из него обладают относительно маленьким весом.
Недостатки у титановых украшений тоже есть. Из-за прочности материала их очень сложно как-то изменить, в отличие от золотых ювелирных изделий, которые легко переплавить в новые. Если возникнет внештатная ситуация, когда украшение из титана нужно будет распилить, чтобы снять (обычным способом кольцо не снимается, например, потому что палец опух из-за травмы), то сделать это будет очень и очень нелегко.
Титановые кольца — вечные.
Приобретая такой атрибут, можно быть уверенным в том, что кольца переживут не только своих владельцев, но и много поколений их потомков. Инертные свойства металла и его поразительная твердость послужили причиной его использования при производстве протезов и вооружения — именно эти свойства будут гарантировать долгую службу колец из титана.

Титановые кольца не потускнеют, не заржавеют и не окрасят ваш палец в зеленый цвет.
Драгоценные металлы склонны меняться в цвете с течением времени. А порой оставляют непривлекательные следы на коже. Титан же, оправдывая звание инертного металла, не вступает в химические реакции и сохраняет первозданный вид столетиями.
Титановые кольца не «похудеют» от трения и не погнутся.
И вновь виной уникальные свойства металла — а точнее, его поразительная твердость. Этому веществу не страшно ничего – оно чувствует себя комфортно и на пальце невесты, и в двигателе самолета A380 (с той лишь разницей, что на кольцо уходит несколько граммов, а на двигатель самолета — около 11 тонн титана).
Титановые кольца абсолютно не вызывают аллергию.
Логично, не правда ли, что ни с чем не взаимодействующий металл и с нашим организмом взаимодействовать отказывается? Этот фактор может стать решающим для тех, кто страдает болезненной реакцией на золото или серебро.

Давайте посмотрим, кто же работает с таким интересным материалом, как титан?
Во-первых, это живой классик ювелирной миниатюры — китаец Уоллес Чан. Его бренд Wallace Chan сегодня является одним из самых дорогих на планете. Свои вещи Чан создаёт из титана с добавлением золотых элементов. Титан, несмотря на свою привлекательность — лёгкость, пластичность, способность менять при нагревании цвет, — металл крайне коварный. Умением работать с ним может похвастаться далеко не каждый ювелир. Уоллес Чан — может. В своих ювелирных изделиях Уоллес Чан использует титан с добавлением золота. В 2007 году мастер разработал и запатентовал особую технику окраски титана и назвал ее Titanium Jewelry.

Украшения Wallace Chan — это тщательно проработанные объекты растительного и животного мира Китая. Вся палитра драгоценных камней использована мастером сполна. Особое пристрастие Чан питает к сплавам титана, которые позволяют добиться необходимой фактуры поверхности (крыльев бабочки-брошки, например), а также к опалам всевозможных оттенков. Свои работы Чан называет «носибельной скульптурой».
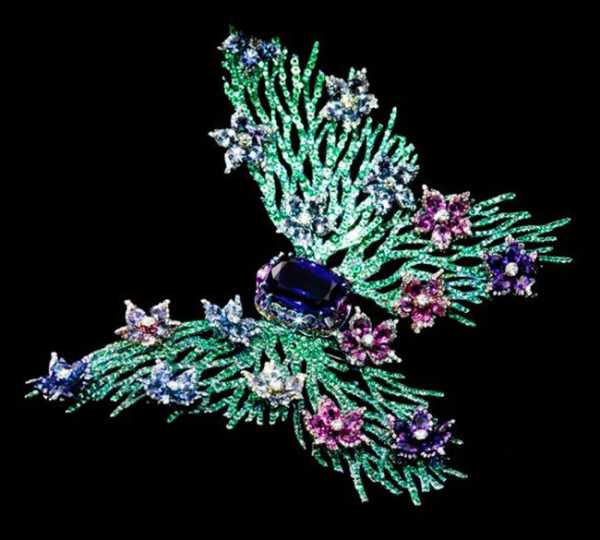
«Через каждую мою драгоценность, я рассказываю неповторимую историю, о красоте восточного «дзен» и традициях ювелирного дела. Как представитель китайского искусства, я надеюсь привнести в этот мир сущность восточной философии и китайской культуры. Мои ювелирные изделия предназначены инициировать плодотворный диалог между культурами», говорит дизайнер.


Также известный швейцарский бренд Chopard активно использует этот металл своих украшениях. В одной из последних коллекций Fleurs d’Opales тонкие изогнутые лепестки одного из колец сделаны из титана, а в центре находится крупный австралийский черный опал, окруженный крошечными бриллиантами. В другом кольце-цветке лепестки покрыты аметистами и сиреневыми сапфирами, а титан, используемый как основа, окислен до получения такого фиолетового оттенка, чтобы быть практически незаметным на фоне камней.



Умение сочетать традиционный подход и новые технологии бренд демонстрирует в своей последней коллекции Haut Joallerie. Её основу составляют три браслета-манжеты. Они выполнены из титана и инкрустированы разноцветными драгоценными камнями. титан — это уникальный материал, он не только обладает необыкновенной легкостью, но и способен принимать все цвета радуги. Именно благодаря этому браслеты Chopard переливаются как драгоценные перья сказочной жар-птицы.





Швейцарский ювелир Сьюзан Сиз (Suzanne Syz) очень любит использовать титан в своих изделиях, хотя твердость металла и затрудняет работу с ним. Она использует его и в «исходном» цвете и в обработанном, добиваясь сиреневых, синих и зеленых оттенков, зачастую делая титан основной изюминкой украшения.


По мнению британского ювелирного дизайнера Гленна Спайро (Glenn Spiro), титан не только улучшает вид крупных украшений, делая их менее громоздкими, но прекрасно подходит и для небольших ювелирных изделий, таких, как обручальные кольца. Не так давно он работал с этим металлом в своей свадебной коллекции I Do эксклюзивно для Harrods. Дизайн бриллиантовых обручальных колец остался классическим, за исключением нетрадиционного металла, придающего украшению долговечность, прочность, а также действительно обширную палитру ярко-синих, розовых оттенков и цвета коньяка.»Этот металл совершенно — говорит известный мастер — не похож на золото. С ним мы можем делать ювелирные изделия более тонкими, а расположение камней на них более сложным. «
Формально титан не считается драгоценным металлом, однако цены на украшения из этого металла от Glenn Spiro довольно высоки. На вопрос, является ли это проблемой для его клиентов, дизайнер отвечает, что на самом деле стоимость металла в украшении по сравнению со стоимостью по-настоящему хорошего драгоценного камня является несущественной.

Титановые серьги Nisan Ongwuthitham с сапфирами
Титан действительно обладает рядом существенных и заманчивых достоинств. Однако для того, чтобы взяться за работу с ним и начать использовать его в своих украшения, мастеру придется проявить смелость и упорство. Хотя сегодня нарушение ювелирных традиций стало, пожалуй, настоящим трендом.

Колье из титана и белого золота от Nisan Ongwuthitham
А вот оригинальные и простые идеи колец из титана, которые вполне под силу мастерам-ювелирам 🙂





И ни одна статья не обходится без желтой уточки 🙂

www.livemaster.ru
Титан (элемент) — это… Что такое Титан (элемент)?
У этого термина существуют и другие значения, см. Титан.| Внешний вид простого вещества | |
|---|---|
| Металл серебристого оттенка | |
| Свойства атома | |
| Имя, символ, номер | Тита́н / Titanium (Ti), 22 |
| Атомная масса (молярная масса) | 47,88 а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d2 4s2 |
| Радиус атома | 147 пм |
| Химические свойства | |
| Ковалентный радиус | 132 пм |
| Радиус иона | (+4e)68 (+2e)94 пм |
| Электроотрицательность | 1,54 (шкала Полинга) |
| Электродный потенциал | −1,63 |
| Степени окисления | 2, 3, 4 |
| Энергия ионизации (первый электрон) | 657,8(6,82) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 4,54 г/см³ |
| Температура плавления | 1933±20 K |
| Температура кипения | 3560 K |
| Теплота плавления | 18,8 кДж/моль |
| Теплота испарения | 422,6 кДж/моль |
| Молярная теплоёмкость | 25,1[1] Дж/(K·моль) |
| Молярный объём | 10,6 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=2,951 с=4,697 (α-Ti) Å |
| Отношение c/a | 1,587 |
| Температура Дебая | 380 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 21,9 Вт/(м·К) |
Тита́н (лат. Titanium; обозначается символом Ti) — элемент побочной подгруппы четвёртой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 22. Простое вещество титан (CAS-номер: 7440-32-6) — лёгкий металл серебристо-белого цвета. Существует в двух кристаллических модификациях: α-Ti с гексагональной плотноупакованной решёткой, β-Ti с кубической объёмно-центрированной упаковкой, температура полиморфного превращения α↔β 883 °C[1]. Температура плавления 1660±20 °C[2].
История
Открытие TiO2 сделали практически одновременно и независимо друг от друга англичанин У. Грегор и немецкий химик М. Г. Клапрот. У. Грегор, исследуя состав магнитного железистого песка (Крид, Корнуолл, Англия, 1791), выделил новую «землю» (оксид) неизвестного металла, которую назвал менакеновой. В 1795 г. немецкий химик Клапрот открыл в минерале рутиле новый элемент и назвал его титаном. Спустя два года Клапрот установил, что рутил и менакеновая земля — оксиды одного и того же элемента, за которым и осталось название «титан», предложенное Клапротом. Через 10 лет открытие титана состоялось в третий раз. Французский учёный Л. Воклен обнаружил титан в анатазе и доказал, что рутил и анатаз — идентичные оксиды титана.
Первый образец металлического титана получил в 1825 году Й. Я. Берцелиус. Из-за высокой химической активности титана и сложности его очистки чистый образец Ti получили голландцы А. ван Аркел и И. де Бур в 1925 году термическим разложением паров иодида титана TiI4.
Происхождение названия
Металл получил своё название в честь титанов, персонажей древнегреческой мифологии, детей Геи. Название элементу дал Мартин Клапрот в соответствии со своими взглядами на химическую номенклатуру в противовес французской химической школе, где элемент старались называть по его химическим свойствам. Поскольку немецкий исследователь сам отметил невозможность определения свойств нового элемента только по его оксиду, он подобрал для него имя из мифологии, по аналогии с открытым им ранее ураном.
Однако согласно другой версии, публиковавшейся[источник не указан 312 дней] в журнале «Техника-Молодежи» в конце 1980-х, новооткрытый металл обязан своим именем не могучим титанам из древнегреческих мифов, а Титании — королеве фей в германской мифологии (жена Оберона в шекспировском «Сне в летнюю ночь»). Такое название связано с необычайной «лёгкостью» (малой плотностью) металла.
Нахождение в природе
Титан находится на 10-м месте по распространённости в природе. Содержание в земной коре 0,57 % по массе, в морской воде 0,001 мг/л[3]. В ультраосновных породах 300 г/т, в основных — 9 кг/т, в кислых 2,3 кг/т, в глинах и сланцах 4,5 кг/т. В земной коре титан почти всегда четырёхвалентен и присутствует только в кислородных соединениях. В свободном виде не встречается. Титан в условиях выветривания и осаждения имеет геохимическое сродство с Al2O3. Он концентрируется в бокситах коры выветривания и в морских глинистых осадках. Перенос титана осуществляется в виде механических обломков минералов и в виде коллоидов. До 30 % TiO2 по весу накапливается в некоторых глинах. Минералы титана устойчивы к выветриванию и образуют крупные концентрации в россыпях. Известно более 100 минералов, содержащих титан. Важнейшие из них: рутил TiO2, ильменит FeTiO3, титаномагнетит FeTiO3 + Fe3O4, перовскит CaTiO3, титанит CaTiSiO5. Различают коренные руды титана — ильменит-титаномагнетитовые и россыпные — рутил-ильменит-цирконовые.
Месторождения
Месторождения титана находятся на территории ЮАР, России, Украины, Китая, Японии, Австралии, Индии, Цейлона, Бразилии, Южной Кореи, Казахстана[4].
Запасы и добыча
Основные руды: ильменит (FeTiO3), рутил (TiO2), титанит (CaTiSiO5).
На 2002 год, 90 % добываемого титана использовалось на производство диоксида титана TiO2. Мировое производство диоксида титана составляло 4,5 млн т. в год. Подтверждённые запасы диоксида титана (без России) составляют около 800 млн т. На 2006 год, по оценке Геологической службы США, в пересчёте на диоксид титана и без учёта России, запасы ильменитовых руд составляют 603—673 млн т., а рутиловых — 49.7—52.7 млн т[5]. Таким образом, при нынешних темпах добычи мировых разведанных запасов титана (без учёта России) хватит более, чем на 150 лет.
Россия обладает вторыми в мире, после Китая, запасами титана. Минерально-сырьевую базу титана России составляют 20 месторождений (из них 11 коренных и 9 россыпных), достаточно равномерно рассредоточенных по территории страны. Самое крупное из разведанных месторождений (Ярегское) находится в 25 км от города Ухта (Республика Коми). Запасы месторождения оцениваются в 2 миллиарда тонн руды со средним содержанием диоксида титана около 10 %[6].
Крупнейший в мире производитель титана — российская компания «ВСМПО-АВИСМА»[7].
Получение
Как правило, исходным материалом для производства титана и его соединений служит диоксид титана со сравнительно небольшим количеством примесей. В частности, это может быть рутиловый концентрат, получаемый при обогащении титановых руд. Однако запасы рутила в мире весьма ограничены, и чаще применяют так называемый синтетический рутил или титановый шлак, получаемые при переработке ильменитовых концентратов. Для получения титанового шлака ильменитовый концентрат восстанавливают в электродуговой печи, при этом железо отделяется в металлическую фазу (чугун), а не восстановленные оксиды титана и примесей образуют шлаковую фазу. Богатый шлак перерабатывают хлоридным или сернокислотным способом.
Концентрат титановых руд подвергают сернокислотной или пирометаллургической переработке. Продукт сернокислотной обработки — порошок диоксида титана TiO2. Пирометаллургическим методом руду спекают с коксом и обрабатывают хлором, получая пары тетрахлорида титана TiCl4:
Образующиеся пары TiCl4 при 850 °C восстанавливают магнием:
Полученную титановую «губку» переплавляют и очищают. Рафинируют титан иодидным способом или электролизом, выделяя Ti из TiCl4. Для получения титановых слитков применяют дуговую, электроннолучевую или плазменную переработку.
Физические свойства
Титан — легкий серебристо-белый металл. Существует в двух кристаллических модификациях: α-Ti с гексагональной плотноупакованной решёткой (a=2,951 Å; с=4,679 Å[8]; z=2; пространственная группа C6mmc), β-Ti с кубической объёмноцентрированной упаковкой (a=3,269 Å; z=2; пространственная группа Im3m), температура перехода α↔β 883 °C, ΔH перехода 3,8 кДж/моль. Точка плавления 1660±20 °C, точка кипения 3260 °C, плотность α-Ti и β-Ti соответственно равна 4,505 (20 °C) и 4,32 (900 °C) г/см³[1], атомная плотность 5,71·1022 ат/см³[источник не указан 1191 день]. Пластичен, сваривается в инертной атмосфере. Удельное сопротивление 0,42 мкОм·м при 20 °C
Имеет высокую вязкость, при механической обработке склонен к налипанию на режущий инструмент, и поэтому требуется нанесение специальных покрытий на инструмент, различных смазок.
При обычной температуре покрывается защитной пассивирующей плёнкой оксида TiO2, благодаря этому коррозионностоек в большинстве сред (кроме щелочной).
Титановая пыль имеет свойство взрываться. Температура вспышки 400 °C. Титановая стружка пожароопасна.
Химические свойства
Устойчив к коррозии благодаря оксидной плёнке, но при измельчении в порошок, а также в тонкой стружке или проволоке титан пирофорен[9].
Титан устойчив к разбавленным растворам многих кислот и щелочей (кроме HF, H3PO4 и концентрированной H2SO4).
Легко реагирует даже со слабыми кислотами в присутствии комплексообразователей, например, с плавиковой кислотой HF он взаимодействует благодаря образованию комплексного аниона [TiF6]2−.
При нагревании на воздухе до 1200 °C Ti загорается с образованием оксидных фаз переменного состава TiOx. Из растворов солей титана осаждается гидроксид TiO(OH)2·xH2O, осторожным прокаливанием которого получают оксид TiO2. Гидроксид TiO(OH)2·xH2O и диоксид TiO2амфотерны.
TiO2 взаимодействует с серной кислотой при длительном кипячении. При сплавлении с содой Na2CO3 или поташом K2CO3 оксид TiO2 образует титанаты:
При нагревании Ti взаимодействует с галогенами. Тетрахлорид титана TiCl4 при обычных условиях — бесцветная жидкость, сильно дымящая на воздухе, что объясняется гидролизом TiCl4 содержащимися в воздухе парами воды и образованием мельчайших капелек HCl и взвеси гидроксида титана.
Восстановлением TiCl4водородом, алюминием, кремнием, другими сильными восстановителями, получен трихлорид и дихлорид титана TiCl3 и TiCl2 — твёрдые вещества, обладающие сильными восстановительными свойствами. Ti взаимодействует с Br2 и I2.
С азотом N2 выше 400 °C титан образует нитрид TiNx(x=0,58-1,00). При взаимодействии титана с углеродом образуется карбид титана TiCx (x=0,49-1,00).
При нагревании Ti поглощает H2 с образованием соединения переменного состава TiHх (x=1,3 — 2). При нагревании эти гидриды разлагаются с выделением H2. Титан образует сплавы со многими металлами.
Применение
| В этом разделе не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 7 декабря 2012. |
В чистом виде и в виде сплавов
Титановый памятник Гагарину на Ленинском проспекте в Москве- Металл применяется в: химической промышленности (реакторы, трубопроводы, насосы, трубопроводная арматура), военной промышленности (бронежилеты, броня и противопожарные перегородки в авиации, корпуса подводных лодок), промышленных процессах (опреснительных установках, процессах целлюлозы и бумаги), автомобильной промышленности, сельскохозяйственной промышленности, пищевой промышленности, украшениях для пирсинга, медицинской промышленности (протезы, остеопротезы), стоматологических и эндодонтических инструментах, зубных имплантатах, спортивных товарах, ювелирных изделиях (Александр Хомов), мобильных телефонах, лёгких сплавах и т. д. Является важнейшим конструкционным материалом в авиа-, ракето-, кораблестроении.
- Титановое литье выполняют в вакуумных печах в графитовые формы. Также используется вакуумное литье по выплавляемым моделям. Из-за технологических трудностей, в художественном литье используется ограниченно. Первой в мировой практике монументальной литой скульптурой из титана является памятник Юрию Гагарину на площади его имени в Москве[10].
- Титан является легирующей добавкой во многих легированных сталях и большинстве спецсплавов.
- Нитинол (никель-титан) — сплав, обладающий памятью формы, применяемый в медицине и технике.
- Алюминиды титана являются очень стойкими к окислению и жаропрочными, что в свою очередь определило их использование в авиации и автомобилестроении в качестве конструкционных материалов.
В виде соединений
- Белый диоксид титана (TiO2) используется в красках (например, титановые белила), а также при производстве бумаги и пластика. Пищевая добавка E171.
- Титанорганические соединения (напр. тетрабутоксититан) применяются в качестве катализатора и отвердителя в химической и лакокрасочной промышленности.
- Неорганические соединения титана применяются в химической электронной, стекловолоконной промышленности в качестве добавки или покрытий.
- Карбид титана, диборид титана, карбонитрид титана — важные компоненты сверхтвёрдых материалов для обработки металлов.
- Нитрид титана применяется для покрытия инструментов, куполов церквей и при производстве бижутерии, т.к. имеет цвет, похожий на золото.
- Титанат бария BaTiO3, титанат свинца PbTiO3 и ряд других титанатов —- сегнетоэлектрики.
Существует множество титановых сплавов с различными металлами. Легирующие элементы разделяют на три группы, в зависимости от их влияния на температуру полиморфного превращения: на бета-стабилизаторы, альфа-стабилизаторы и нейтральные упрочнители. Первые понижают температуру превращения, вторые повышают, третьи не влияют на неё, но приводят к растворному упрочнению матрицы. Примеры альфа-стабилизаторов: алюминий, кислород, углерод, азот. Бета-стабилизаторы: молибден, ванадий, железо, хром, никель. Нейтральные упрочнители: цирконий, олово, кремний. Бета-стабилизаторы, в свою очередь, делятся на бета-изоморфные и бета-эвтектоидообразующие. Самым распространённым титановым сплавом является сплав Ti-6Al-4V (в российской классификации — ВТ6).
Анализ рынков потребления
В 2005 компания Titanium Corporation опубликовала следующую оценку потребления титана в мире:
- 60 % — краска;
- 20 % — пластик;
- 13 % — бумага;
- 7 % — машиностроение.
Цены
| В этом разделе не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 12 мая 2011. |
15-25 $ за килограмм, в зависимости от чистоты.
Чистота и марка чернового титана (титановой губки) обычно определяется по её твёрдости, которая зависит от содержания примесей. Наиболее распространены марки ТГ100 и ТГ110.
Цена ферротитана (минимум 70 % титана) на 22.12.2010 $6,82 за килограмм. На 01.01.2010 цена была на уровне $5,00 за килограмм.
В России цены на титан на начало 2012 года составляли 1200-1500 руб/кг.
Физиологическое действие
Примечания
Ссылки
| Электрохимический ряд активности металлов | |
|---|---|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au |
dic.academic.ru
Прием лома цветных и черных металлов в Москве и области
 Компания «ПерфектМеталл» закупает, наряду с другими металлами, лом титана. Любые пункты приема металлолома компании примут у вас титан, изделия из сплавов титана, титановую стружку и т.п. Откуда титан попадает в пункты сдачи металлолома? Все очень просто, этот металл нашел очень широкое применение как в промышленных целях, так и в быту человека. Сегодня этот металл используется при строительстве космических и военных ракет, много его используется и в самолетостроении. Из титана строят прочные и легкие морские суда. Химическая промышленность, ювелирное дело, не говоря уже об очень широком применении титана в медицинской промышленности. И все это из за того, что титан и его сплавы обладают рядом уникальных свойств.
Компания «ПерфектМеталл» закупает, наряду с другими металлами, лом титана. Любые пункты приема металлолома компании примут у вас титан, изделия из сплавов титана, титановую стружку и т.п. Откуда титан попадает в пункты сдачи металлолома? Все очень просто, этот металл нашел очень широкое применение как в промышленных целях, так и в быту человека. Сегодня этот металл используется при строительстве космических и военных ракет, много его используется и в самолетостроении. Из титана строят прочные и легкие морские суда. Химическая промышленность, ювелирное дело, не говоря уже об очень широком применении титана в медицинской промышленности. И все это из за того, что титан и его сплавы обладают рядом уникальных свойств.
Титан – описание и свойства
Земная кора, как известно, насыщенна многочисленным рядом химических элементов. Среди часто встречающихся среди них — титан. Можно сказать, что он находится на 10-м месте ТОПа самых распространенных хим элементов Земли. Титан — металл серебристо-белого цвета, стоек ко многим агрессивным средам, не подвержен окислению в ряде мощнейших кислот, исключениями являются лишь плавиковая, ортофосфорная серная кислота в высокой концентрации. Титан в чистом виде относительно молод, его получили лишь в 1925 году.

Пленка оксида, которая покрывает титан в чистом виде, служит весьма надежной защитой этого металла от коррозии. Ценится титан и за его низкую теплопроводность, для сравнения — титан в 13 раз хуже проводит тепло чем алюминий, а вот с проводимостью электричества обратная картина — титан обладает гораздо большим сопротивлением. Все же самой главная отличительная черта титана — его колоссальная прочность. Опять же если сравнить ее теперь с чистым железом, то титан в два раза превышает его прочность!
Сплавы титана
Сплавы из титана обладают так же выдающимися свойствами, среди которых на первом месте, как вы уже могли догадаться — прочность. Как конструкционный материал, титан уступает в прочности лишь бериллиевым сплавам. Однако неоспоримым преимуществом сплавов титана является их высокая стойкость к истиранию, износу и в то же время достаточная пластичность.

Титановые сплавы устойчивы к воздействию целого ряда активных кислот, солей, гидроксидов. Эти сплавы не боятся и высокотемпературных воздействий, именно поэтому из титана и его сплавов изготавливают турбины реактивных двигателей, да и вообще широко используются в ракетостроении и авиационной промышленности.
Где используется титан
Титан используется там, где необходим очень прочный материал, обладающий максимальной стойкостью к различным видам негативного воздействия. Например, в химической промышленности титановые сплавы применяются для производства насосов, емкостей и трубопроводов для транспортировки агрессивных жидкостей. В медицине титан служит для протезирования и обладает отличной биологической совместимостью с организмом человека. Кроме того, сплав титана и никеля – нитинол – обладает “памятью”, что позволяет использовать его в ортопедической хирургии. В металлургии титан служит легирующим элементом, который вводят в состав некоторых видов стали.
Благодаря сохранению пластичности и прочности под воздействием низких температур, металл используют в криогенной технике. В авиа- и ракетостроении титан ценится за свою жаропрочность, а наиболее широкое распространение здесь получил его сплав с алюминием и ванадием: именно из него изготавливают детали для корпусов летательных аппаратов и реактивных двигателей.

В свою очередь, в судостроении титановые сплавы применяют для изготовления металлических изделий с повышенной коррозийной устойчивостью. Но, помимо промышленного использования, титан служит сырьем для создания украшений и аксессуаров, так как он хорошо поддается таким методам обработки, как полировка или анодирование. В частности, из него отливают корпуса наручных часов и ювелирные украшения.

Титан получил широкое применение в составе различных соединений. Например, диоксид титана входит в состав красок, используется в процессе производства бумаги и пластика, а нитрид титана выступает в роли защитного покрытия инструментов. Несмотря на то, что титан называют металлом будущего, на данном этапе сфера его применения серьезно ограничена высокой стоимостью получения.
Таблица 1
| Химический состав промышленных титановых сплавов. | ||||||||
| Тип сплава | Марка сплава | Химический состав, % (остальное Ti) | ||||||
| Аl | V | Mo | Mn | Cr | Si | Другие элементы | ||
| a | ВТ5 ВТ5-1 | 4,3—6,2 4,5—6,0 | — — | — — | — — | — — | — — | — 2—3Sn |
| Псевдо-a | ОТ4-0 ОТ4-1 ОТ4 ВТ20 ВТ18 | 0,2—1,4 1,0—2,5 3,5—5,0 6,0—7,5 7,2—8,2 | — — — 0,8—1,8 — | — — — 0,5—2,0 0,2—1,0 | 0,2—1,3 0,7—2,0 0,8—2,0 — — | — — — — — | — — — — 0,18—0,5 | — — — 1,5—2,5Zr 0,5—1,5Nb 10—12Zr |
| a + b | ВТ6С ВТ6 ВТ8 ВТ9 ВТ3-1 ВТ14 ВТ16 ВТ22 | 5,0—6,5 5,5—7,0 6,0—7,3 5,8—7,0 5,5—7,0 4,5—6,3 1,6—3,0 4,0—5,7 | 3,5—4,5 4,2—6,0 — — — 0,9—1,9 4,0—5,0 4,0—5,5 | — — 2,8—3,8 2,8—3,8 2,0—3,0 2,5—3,8 4,5—5,5 4,5—5,0 | — — — — — — — — | — — — — 1,0—2,5 — — 0,5—2,0 | — — 0,20—0,40 0,20—0,36 0,15—0,40 — — — | — — — 0,8—2,5Zr 0,2—0,7Fe — — 0,5—1,5Fe |
| b | ВТ15 | 2,3—3,6 | — | 6,8—8,0 | — | 9,5—11,0 | — | 1,0Zr |
Таблица 2. Механические свойства титановых сплавов (типичные).
sdatlom.ru
