Тренировочные тесты по теме «Химические связи»
Тематические тесты по теме «Химические связи и кристаллические решетки» в формате ЕГЭ по химии (тренажер задания 4 ЕГЭ по химии).
Внимание! Перед выполнением тестов я рекомендую внимательно изучить теорию по темам «Химические связи и кристаллические решетки» (теория для решения задания 4 ЕГЭ по химии).
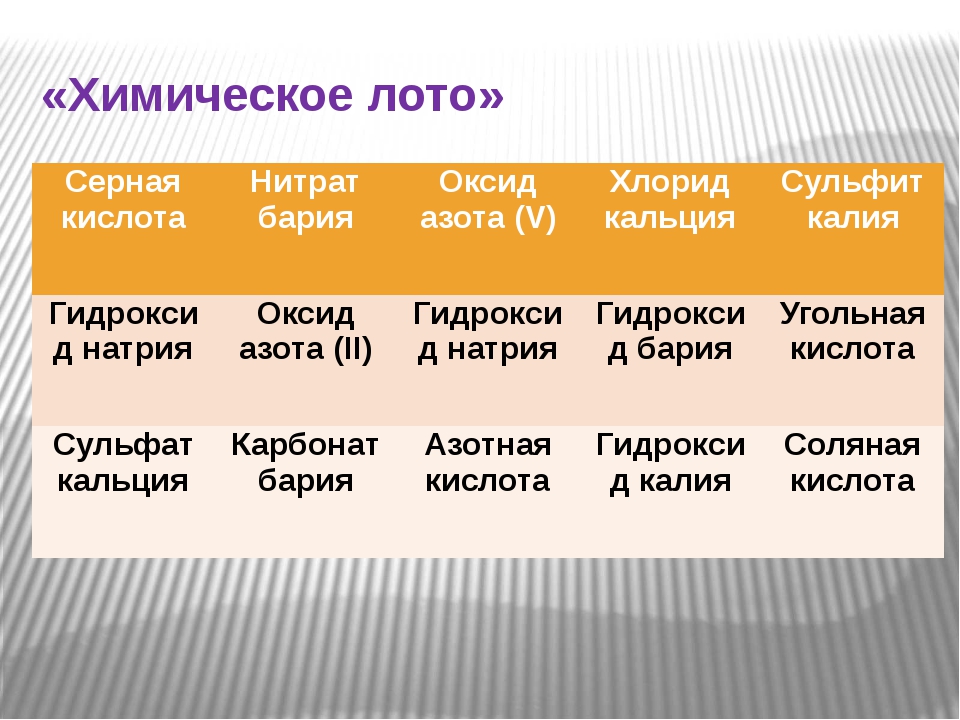
| Для выполнения задания используйте представленный в каждом задании ряд химических элементов. Ответом в задании является последовательность цифр, под которыми указаны химические элементы в каждом ряду. |
Теория по теме «Химические связи и кристаллические решетки» (теория для решения задания ЕГЭ по химии):
Ковалентная химическая связь, её разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Вещества молекулярного и немолекулярного строения.
| Задание 1 | |
Из предложенного перечня выберите два вещества, в которых присутствует ковалентная полярная связь. 1) фторид серы(VI) 2) оксид бария 3) фторид натрия 4) сульфат магния 5) ромбическая сера Запишите номера выбранных ответов. | |
| Задание 2 | |
Из предложенного перечня выберите два вещества, в которых присутствует ковалентная полярная связь. 1) SrO 2) PBr3 3) CsCl 4) P4 5) NH4NO3 Запишите номера выбранных ответов. | |
| Задание 3 | |
Из предложенного перечня выберите два вещества, между молекулами каждого из которых возможно образование водородных связей. 1) метанол 2) изопрен 3) анилин 4) бензол 5) толуол Запишите номера выбранных ответов. | |
| Задание 4 | |
Из предложенного перечня выберите два вещества, в молекуле каждого из которых присутствует ровно одна ковалентная неполярная связь. 1) метан 2) этан 3) этилен 4) фосфин 5) пероксид водорода Запишите номера выбранных ответов. | |
| Задание 5 | |
Из предложенного перечня выберите два вещества с ионной кристаллической решеткой, в которых есть ковалентные связи. 1) хлорид аммония 2) сульфид калия 3) пероксид водорода 4) ацетат меди (II) 5) фенол Запишите номера выбранных ответов. | |
| Задание 6 | |
Из предложенного перечня выберите два молекулярных вещества, в которых есть ковалентные неполярные связи. 1) K[Al(OH)4] 2) H2S 3) C2H6 4) H2O2 5) CO2 Запишите номера выбранных ответов. | |
| Задание 7 | |
| Из предложенного перечня выберите два ионных вещества, в которых есть ковалентные полярные связи. 1) формиат аммония 2) бензойная кислота 3) диметиламин 4) сульфат калия 5) бромид лития Запишите номера выбранных ответов. | |
| Задание 8 | |
| Из предложенного перечня выберите два вещества, в которых есть и ковалентные полярные, и ионные связи. 1) серная кислота 2) хлорид аммония 3) сульфид кальция 4) фосфат лития 5) озон Запишите номера выбранных ответов.  | |
| Задание 9 | |
| Из предложенного перечня выберите два вещества, в которых есть водородные связи. 1) ацетат натрия 2) водород 3) сульфат меди (II) 5) фтороводород Запишите номера выбранных ответов. | |
| Задание 10 | |
| Из предложенного перечня выберите два вещества, в которых есть связи, образованные по донорно-акцепторному механизму. 1) нитрат аммония 2) аммиак 3) тетрагидроксоцинкат калия 4) кислород 5) фтороводород Запишите номера выбранных ответов. | |
| Задание 11 | |
Из предложенного перечня выберите два вещества, в которых есть связи, образованные по донорно-акцепторному механизму. 1) СО 2) PH3 3) CaO 4) CH3COONH4 5) KHS Запишите номера выбранных ответов. | |
| Задание 12 | |
| Из предложенного перечня выберите два вещества, в которых есть водородные связи. 1) Na2SO4 2) H2 3) CH3OH 4) C6H5NH2 5) NaH Запишите номера выбранных ответов | |
Тест на химические связи и типы строения веществ (кристаллические решетки).
Задание №1
Из предложенного перечня веществ выберите два таких, в которых имеет место ионная связь
- 1. HClO3
- 2. HClO4
- 3. NH4Cl
- 4. Ca(ClO2)2
- 5.
 Cl2O7
Cl2O7
Задание №2
Из предложенного перечня выберите два соединения, в которых тип химической связи такой же, как в молекуле фтора.
1) кислород
2) оксид азота (II)
3) бромоводород
4) иодид натрия
5) алмаз
РешениеЗадание №3
Из предложенного перечня выберите два вещества, между молекулами которых образуются водородные связи.
- 1. C2H6
- 2. C2H5OH
- 3. H2O
- 4. CH3OCH3
- 5. CH3COCH3
Задание №4
Из предложенного перечня выберите два соединения с ионной химической связью.
- 1. PCl3
- 2. CO2
- 3. NaCl
- 4. H2S
- 5. MgO
Задание №5
Из предложенного перечня выберите два вещества с одинаковым типом строения.
1) вода
2) алмаз
3) кварц
4) поваренная соль
5) золото
РешениеЗадание №6
Из предложенного перечня выберите два соединения, в которых присутствует ковалентная связь, образованная по донорно-акцепторному механизму
- 1.
 CH3NH2
CH3NH2 - 2. CCl4
- 3. NH4Cl
- 4. CH3NH3Br
- 5. SO2Cl2
Задание №7
Из предложенного перечня выберите два соединения, которые имеют молекулярную кристаллическую решетку.
- 1. Cs2O
- 2. I2
- 3. KBr
- 4. NaI
- 5. HCl
Задание №8
Из предложенного перечня выберите два вещества немолекулярного строения.
1) фтор
2) кислород
3) белый фосфор
4) бор
5) кремний
РешениеЗадание №9
Из предложенного перечня выберите два соединения с наиболее прочными химическими связями.
- 1. Cl2
- 2. Br2
- 3. O2
- 4. I2
- 5. N2
Задание №10
Из предложенного перечня выберите два соединения, в молекулах которых ковалентная связь образована одной общей электронной парой.
- 1. N2
- 2. Cl2
- 3. NO
- 4. HBr
- 5. O2
Задание №11
Из предложенного перечня выберите два вещества, в которых имеет место ковалентная связь, образованная по донорно-акцепторному механизму.
- 1. NH4NO3
- 2. NH3
- 3. NaAlO2
- 4. K[Al(OH)4]
- 5. HCl
Задание №12
Из предложенного перечня выберите два вещества с наиболее полярными связями.
- 1. HCl
- 2. HF
- 3. H2O
- 4. H2S
- 5. HI
Задание №13
Из предложенного перечня выберите два вещества, в которых имеются и ковалентные полярные, и ионные связи.
- 1. NaCl
- 2. NaNO3
- 3. Na2SO4
- 4. Na
- 5. H2SO4
Задание №14
Из предложенного перечня выберите два вещества с ионной связью.
1) кислород
2) вода
3) оксид углерода (IV)
4) хлорид натрия
5) оксид кальция
РешениеЗадание №15
Из предложенного перечня выберите два вещества с таким же типом кристаллической решетки, как у алмаза.
1) кремнезем SiO2
2) оксид натрия Na2O
3) угарный газ CO
4) белый фосфор P4
5) кремний Si
РешениеЗадание №16
Из предложенного перечня выберите два вещества с ионной связью.
- 1. NH4Cl
- 2. HCOONa
- 3. NH3
- 4. HCOOH
- 5. CO
Задание №17
Из предложенного перечня выберите два вещества с наибольшей длиной химической связи в молекуле.
- 1. HF
- 2. HCl
- 3. HBr
- 4. HI
- 5. H2O
Задание №18
Из предложенного перечня выберите два вещества с наиболее полярными связями
- 1. HI
- 2.
 H2O
H2O - 3. HBr
- 4. H2S
- 5. NH3
Задание №19
Из предложенного перечня выберите два вещества с атомной кристаллической решеткой.
- 1. Cl2
- 2. B
- 3. Cu
- 4. Si
- 5. P4
Задание №20
Из предложенного перечня выберите два вещества, с наиболее прочными ковалентными связями
- 1. F2
- 2. I2
- 3. Br2
- 4. O2
- 5. Cl2
Задание №21
Из предложенного перечня выберите два вещества, в молекулах которых есть ковалентная неполярная связь.
1) гидроксид натрия
2) вода
3) метанол
4) этан
5) пероксид водорода
РешениеЗадание №22
Из предложенного перечня веществ выберите два вещества, которые имеют молекулярную кристаллическую решётку.
- 1. CO2
- 2.
 SiO2
SiO2 - 3. NH3
- 4. NaH
- 5. PbO2
Задание №23
Из предложенного перечня веществ выберите два вещества, для каждого из которых характерно наличие водородной связи между молекулами.
- 1. H2
- 2. NH3
- 3. C6H6
- 4. CH3OH
- 5. C6H5CH3
Задание №24
Из предложенного перечня веществ выберите два вещества, которые имеют атомную кристаллическую решётку.
1) белый фосфор
2) сера
3) графит
4) кремний
5) натрий
РешениеЗадание №25
Из предложенного перечня веществ выберите два соединения, в которых как минимум одна из ковалентных связей образована по донорно-акцепторному механизму.
- 1. LiOH
- 2. Li3P
- 3. (NH4)2HPO4
- 4. NH4F
- 5.
 H3PO3
H3PO3
Задание №26
Из предложенного перечня веществ выберите два соединения, в которых присутствует ковалентная полярная химическая связь.
1) оксид кремния
2) оксид лития
3) хлорид лития
4) силикат лития
5) кремний
РешениеЗадание №27
Из предложенного перечня веществ выберите два вещества, в которых присутствует ионная химическая связь.
- 1. H2SO4
- 2. KNO3
- 3. PCl3
- 4. KCl
- 5. H3BO3
Задание №28
Из предложенного перечня веществ выберите два соединения, в которых присутствует ионная связь.
1) хлороводород
2) хлорид натрия
3) оксид серы(IV)
4) аммиак
5) оксид натрия
РешениеЗадание №29
Из предложенного перечня веществ выберите два соединения, в которых присутствует ковалентная неполярная связь.
1) аммиак
2) иод
3) кислород
4) вода
5) метан
РешениеЗадание №30
Из предложенного перечня веществ выберите два таких, в которых имеет место ковалентная неполярная связь
1) метан
2) хлор
3) серная кислота
4) аммиак
5) йод
РешениеЗадание №31
Из предложенного перечня веществ выберите два таких, в которых имеет место ковалентная полярная связь
- 1.
 Na2O
Na2O - 2. P2O5
- 3. Na
- 4. S8
- 5. HCl
Задание №32
Из предложенного перечня веществ выберите два таких, которые в твердом состоянии имеют ионную кристаллическую решетку:
1) фосфорная кислота
2) оксид серы (VI)
3) сухой лед
4) оксид рубидия
5) нитрат цезия
РешениеЗадание №33
Из предложенного перечня веществ выберите два таких, которые в твердом состоянии имеют молекулярную кристаллическую решетку:
- 1. BaO
- 2. CaI2
- 3. CO
- 4. F2
- 5. C(алмаз)
Задание №34
Из предложенного перечня веществ выберите два, в которых присутствует ковалентная неполярная связь
1) азот
2) аммиак
3) вода
4) хлор
5) бромоводород
РешениеЗадание №35
Из предложенного перечня веществ выберите два таких, в которых имеет место ионная связь:
1) оксид калия
2) оксид фосфора (III)
3) вода
4) йодоводород
5) фторид бария
РешениеЗадание №36
Из предложенного перечня веществ выберите два таких, в которых имеет место ковалентная неполярная связь
1) пероксид водорода
2) вода
3) хлор
4) углекислый газ
5) оксид лития
РешениеЗадание №37
Из предложенного перечня веществ выберите два таких, в которых присутствует ионная связь:
- 1.
 NH4NO3
NH4NO3 - 2. SrBr2
- 3. H2
- 4. H3PO4
- 5. N2O
Задание №38
Из предложенного перечня веществ выберите два таких, в которых присутствует ковалентная неполярная связь
- 1. Al
- 2. P4
- 3. NaH
- 4. этан
- 5. Fe2O3
Задание №39
Из предложенного перечня веществ выберите два таких, в которых присутствует ионная связь
- 1. Ca
- 2. P4
- 3. NaH
- 4. этан
- 5. Cs2O
Задание №40
Из предложенного перечня веществ, выберите два таких, строение которых относится к одному типу:
- 1. Cl2
- 2. Fe
- 3. B
- 4. Si
- 5. NaCl
Задание №41
Из предложенного перечня веществ выберите два таких, которые имеют молекулярное строение:
- 1.
 NH3
NH3 - 2. PCl5
- 3. CaSO4
- 4. RbH
- 5. C(графит)
Задание №42
Из предложенного перечня веществ выберите два таких, которые имеют ионную кристаллическую решетку
1) фторид стронция
2) уксусная кислота
3) сероводород
4) кремнезем
5) оксид лития
РешениеЗадание №43
Из предложенного перечня веществ выберите два таких, в которых имеет место ионная связь
1) гидрид рубидия
2) нитрат аммония
3) бор
4) вода
5) кремний
РешениеЗадание №44
Из предложенного перечня веществ выберите два таких, которые в твердом состоянии имеют атомную кристаллическую решетку
1) хлорид кремния (IV)
2) карбид кремния (IV)
3) хлор
4) кремний
5) белый фосфор
РешениеЗадание №45
Из предложенного перечня веществ выберите два с ионной кристаллической решеткой в твердом состоянии
1) хлорид брома (I)
2) хлорид натрия
3) оксид серы (IV)
4) бор
5) йодид рубидия
РешениеЗадание №46
Из предложенного перечня веществ выберите два таких, в которых имеет место ионная химическая связь
- 1.
 SiC
SiC - 2. Cs2O
- 3. [CH3NH3]Cl
- 4. CH3COOH
- 5. H2SO4
Задание №47
Из предложенного перечня веществ выберите два таких, которые имеют атомную кристаллическую решетку
1) хром
2) кремний
3) железо
4) кремнезем
5) сухой лед
РешениеЗадание №48
Из предложенного перечня веществ выберите два с атомной кристаллической решеткой
1) бор
2) аммиак
3) бром
4) фосфат аммония
5) кварц
РешениеЗадание №49
Из предложенного перечня веществ выберите два таких, которые имеют ионную кристаллическую решетку
1) фторид лития
2) нитрат аммония
3) хлорид кремния (IV)
4) сероводород
5) азотная кислота
РешениеЗадание №50
Из предложенного перечня веществ выберите два таких, которые имеют молекулярную кристаллическую решетку
1) графит
2) угарный газ
3) метанол
4) карбид кремния
5) хлорид аммония
РешениеЗадание №51
Из предложенного перечня веществ выберите два таких, в которых имеет место ковалентная полярная связь
1) пероксид водорода
2) бром
3) бромид кальция
4) азотная кислота
5) марганец
РешениеЗадание №53
Из предложенного перечня видов химических связей выберите два таких, которые присутствуют в гидрофосфате аммония
1) водородная
2) металлическая
3) ковалентная неполярная
4) ковалентная полярная
5) ионная
РешениеЗадание №54
Из предложенного перечня веществ выберите два с немолекулярным строением
1) железо
2) хлор
3) углерод (графит)
4) белый фосфор
5) бром
РешениеЗадание №55
Из предложенного перечня веществ выберите два таких, для которых характерен одинаковый тип связи:
- 1.
 SiO2
SiO2 - 2. Mn
- 3. NH3
- 4. B
- 5. NaCl
Задание №56
Из предложенного перечня веществ выберите два таких, которые имеют ионную кристаллическую решетку
- 1. (NH4)2SO4
- 2. CH3NH2
- 3. NH3
- 4. N2
- 5. CH3NH3Cl
Задание №57
Из предложенного перечня веществ выберите два с молекулярным строением
1) кремний
2) водород
3) литий
4) йод
5) марганец
РешениеЗадание №58
Из предложенного перечня веществ выберите два таких, которые имеют ионное строение
1) оксид кремния
2) хлорид калия
3) оксид азота (II)
4) оксид лития
5) оксид фосфора (III)
РешениеЗадание №59
Из предложенного перечня веществ выберите два таких, которые имеют молекулярное строение
- 1.
 CH3COOH
CH3COOH - 2. SiC
- 3. SiCl4
- 4. CH3OK
- 5. HCOONH4
Задание №60
Из предложенного перечня соединений выберите два таких, в которых присутствуют как ковалентные, так и ионные связи
- 1. H2SO4
- 2. HCl
- 3. (NH4)2HPO4
- 4. Ca(NO3)2
- 5. Na2S
Задание №61
Из предложенного перечня веществ выберите два таких, которые имеют молекулярное строение
1) сухой лед
2) бор
3) йод
4) карборунд
5) бромид аммония
РешениеЗадание №62
Из предложенного перечня веществ выберите два таких, в которых имеет место ковалентная полярная связь:
1) фторид калия
2) фтороводородная кислота
3) литий
4) оксид углерода (IV)
5) йод
РешениеЗадание №63
Из предложенного перечня видов химической связи выберите две, которые характерны для воды:
1) ионная
2) водородная
3) ковалентная неполярная
4) ковалентная полярная
5) металлическая
РешениеЗадание №64
Из предложенного перечня веществ выберите два таких, в которых имеет место ковалентная неполярная связь
1) пероксид водорода
2) бром
3) бромид кальция
4) азотная кислота
5) марганец
РешениеЗадание №65
Из предложенного перечня веществ выберите два таких, в которых имеет место ковалентная полярная связь
1) хром
2) водород
3) пероксид водорода
4) бромид стронция
5) серная кислота
РешениеЗадание №66
Из предложенного перечня видов химической связи выберите две, характерные для хлорида аммония:
1) водородная
2) ионная
3) ковалентная полярная
4) ковалентная неполярная
5) металлическая
РешениеЗадание №67
Из предложенного перечня соединений выберите два таких, в которых присутствует ковалентная связь, образованная по донорно-акцепторному механизму:
- 1.
 NH4Cl
NH4Cl - 2. Al2O3
- 3. Na[Al(OH)4]
- 4. NH3
- 5. SO2Cl2
Задание №68
Из предложенного перечня соединений выберите два таких, в которых присутствует ковалентная связь, образованная по донорно-акцепторному механизму:
- 1. H2O2
- 2. CH3NH3Cl
- 3. Ca(H2PO4)2
- 4. PCl5
- 5. NH4HSO4
Задание №69
Из предложенного перечня соединений выберите два таких, в которых присутствует ковалентная связь, образованная по донорно-акцепторному механизму:
- 1. CH3COOK
- 2. CH3NH2
- 3. K2[Zn(OH)4]
- 4. CH3NH3Br
- 5. NH2CH2CH2Cl
Задание №70
Из предложенного перечня соединений выберите два таких, в молекулах которых связь между атомами наиболее полярная:
- 1.
 HCl
HCl - 2. HI
- 3. HF
- 4. H2S
- 5. H2O
Задание №71
Из предложенного перечня соединений выберите два таких, в молекулах которых связь между атомами наиболее полярная
- 1. H2Se
- 2. PH3
- 3. HF
- 4. H2S
- 5. H2O
Задание №72
Из предложенного перечня соединений выберите два таких, в молекулах которых связь между атомами наиболее прочная
- 1. Br2
- 2. O2
- 3. N2
- 4. Cl2
- 5. I2
Задание №73
Из предложенного перечня веществ выберите два вещества немолекулярного строения
1) карборунд
2) фтороводород
3) йод
4) кремний
5) аммиак
РешениеЗадание №74
Из предложенного перечня соединений выберите два таких, в которых присутствует водородная связь:
- 1.
 CH3COOH
CH3COOH - 2. KH
- 3. HF
- 4. H2S
- 5. NaOH
Задание №75
Из предложенного перечня соединений выберите два таких, в которых присутствует водородная связь:
- 1. C2H6
- 2. NH4Cl
- 3. NH3
- 4. HCl
- 5. H2O
Задание №76
Из предложенного перечня соединений выберите два таких, в которых присутствует водородная связь:
- 1. PH3
- 2. C2H5OH
- 3. HI
- 4. H2
- 5. CH3NH2
Задание №77
Из предложенного перечня соединений выберите два таких, в которых присутствует ковалентная связь, образованная по донорно-акцепторному механизму:
- 1. N2O3
- 2. Al2O3
- 3. CH3NH3Cl
- 4. NH3
- 5.
 NH4NO3
NH4NO3
Задание №78
Из предложенного перечня соединений выберите два с одинаковым типом химической связи:
1) фтор
2) алмаз
3) хлороводород
4) хлорид калия
5) марганец
РешениеЗадание №79
Из предложенного перечня химических веществ выберите два таких, в которых присутствует ковалентная неполярная связь:
1) вода
2) пероксид водорода
3) метан
4) этан
5) марганец
РешениеЗадание №80
Из предложенного перечня химических веществ выберите два таких, которые имеют наибольшие температуры плавления:
- 1. NaCl
- 2. SiO2
- 3. P4
- 4. C(алмаз)
- 5. SO2
Задание №81
Из предложенного перечня веществ выберите два таких, водные растворы или расплавы которых проводят электрический ток:
- 1. SiO2
- 2. NaCl
- 3. P4
- 4.
 Si
Si - 5. KOH
Задание №82
Из предложенного перечня химических веществ выберите два таких, которые имеют наиболее низкие температуры кипения:
1) бор
2) кислород
3) хлорид калия
4) железо
5) хлорид кремния (IV)
РешениеЗадание №83
Из предложенного перечня водородных соединений выберите два, с наибольшими температурами кипения:
- 1. NH3
- 2. KH
- 3. PH3
- 4. CaH2
- 5. H2S
Задание №84
Из предложенного перечня соединений кремния выберите два с наиболее низкими температурами кипения:
- 1. SiH4
- 2. SiO2
- 3. SiCl4
- 4. SiC
- 5. Si
Задание №85
Из предложенного перечня соединений выберите два, в которых есть как ковалентные полярные, так и ионные связи
1) пероксид водорода
2) серная кислота
3) нитрат натрия
4) бромид аммония
5) карборунд
РешениеЗадание №86
Из предложенного перечня веществ выберите два таких, в которых присутствует водородная связь:
- 1.
 SiH4
SiH4 - 2. PH3
- 3. NH3
- 4. H2S
- 5. H2O
Задание №87
Из предложенного перечня выберите веществ выберите два вещества немолекулярного строения
1) белый фосфор
2) хром
3) азот
4) кремний
5) водород
РешениеЗадание №88
Из предложенного перечня соединений выберите два с наиболее прочными связями
1) азот
2) хлор
3) кислород
4) йод
5) бром
РешениеЗадание №89
Из предложенного перечня выберите два вещества с наиболее полярными связями
- 1. H2O
- 2. NH3
- 3. PH3
- 4. H2Se
- 5. HF
Задание №90
Из предложенного перечня соединений выберите два с типом химической связи как в алмазе:
- 1. SiO2
- 2. HF
- 3. C(графит)
- 4. Cl2
- 5.
 PCl3
PCl3
Задание №91
Из предложенного перечня соединений выберите два таких, в которых есть ковалентная неполярная связь
- 1. Li
- 2. CO2
- 3. H2O2
- 4. Cr
- 5. C2H4
Задание №92
Из предложенного перечня соединений выберите два, в молекулах которых есть пи-связи
- 1. NH3
- 2. SO2
- 3. Cl2
- 4. CH4
- 5. SO3
Задание №93
Из предложенного перечня характеристик выберите две, справедливые для веществ с молекулярным строением:
1) тугоплавкость
2) легкоплавкость
3) прочность в твердом состоянии
4) хрупкость в твердом состоянии
5) исключительно твердое агрегатное состояние в обычных условиях
РешениеЗадание №94
Из предложенного перечня соединений выберите два таких, в которых прочность связи в молекуле наименьшая:
- 1.
 HF
HF - 2. HCl
- 3. HI
- 4. HBr
- 5. N2
Задание №95
Из предложенного перечня характеристик выберите две, не относящиеся к веществам с ионным строением:
1) высокая электропроводность расплавов и водных растворов
2) в таких веществах может иметь место ковалентная связь
3) в обычных условиях являются твердыми
4) газообразное или жидкое состояние в обычных условиях
5) в таких веществах не бывает никаких химических связей кроме ионных
РешениеЗадание №96
Из предложенного перечня характеристик выберите две, чаще всего справедливые для веществ с металлической структурной решеткой
1) низкая электропроводность
2) высокая электропроводность
3) высокая пластичность
4) газообразное состояние в обычных условиях
5) ковалентный тип связи между атомами
РешениеЗадание №97
Из предложенного перечня соединений выберите два таких, в которых присутствует ковалентная неполярная связь
1) хром
2) этан
3) марганец
4) хлор
5) серная кислота
РешениеОтвет: 24
Задание №98
Из предложенного перечня веществ, выберите два с таким же типом химической связи как у кремния:
- 1.
 Cl2
Cl2 - 2. SiC
- 3. SiCl4
- 4. H2
- 5. Fe
Задание №99
Из предложенного перечня соединений выберите два таких, в которых есть водородная связь
- 1. NH3
- 2. H2S
- 3. CH3CH2NH2
- 4. HCl
- 5. HI
Задание №100
Из предложенного перечня водородных соединений выберите два с наиболее низкими температурами плавления
- 1. AlH3
- 2. NH3
- 3. CaH2
- 4. H2Se
- 5. KH
ковалентная (полярная и неполярная), ионная, металлическая.
Задание № 3
Строение молекул. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
Химическая связь – это вид межатомных взаимодействий в молекулах, ионах, кри- сталлах, приводящий к понижению общей энергии системы.
Основные виды хим. связи (по распределению электронной плотности между взаимодействующими атомами):Различают ионную, ковалентную и металлическую связь, водородная.
Ковалентная и ионная связи являются базовыми типами связи.
Ионная связь
металл + неметалл
+
–
Na + 11 ) 2 ) 8 )
Cl + 17 ) 2 ) 8 )
1
7
8
Электростатическое притяжение
Cl —
Na +
ионы
Свойства ионной связи
ненаправленная,
так как электромагнитное поле распространяется во все стороны
+
–
ненасыщаемая,
притянется столько ионов, сколько уместится
–
–
+
–
Поэтому все вещества с ионной связью имеют немолекулярное строение
Кристаллическая решетка
Ковалентная связь
неметалл + неметалл
Cl + 17 ) 2 ) 8 ) 7
Химическая связь, образованная посредством общих электронных пар, называется ковалентной.
Сl
Сl
Ковалентная неполярная связь
δ-
δ+
Н
Сl
Ковалентная полярная связь
Ковалентная связь может быть образована несколькими парами электронов
N
N
N N
Количество связей у атома равно количеству электронов, которых не достает у атома до октета.
Свойства ковалентной связи
направленная,
атомы должны расположиться определенным образом.
104˚
Н
О
Н
насыщаемая,
связывает два атома,
«третий – лишний»
Н:Н
Способы изображения ковалентной связи
электронно-графические схемы
электронные схемы
перекрывание орбиталей
структурные формулы
Н-H
Н 2
Н : Н
s-s
H
НF
Н-F
Н : F
F
s-p
F 2
F : F
F-F
F
p-p
F
ион-атомы
+
+
+
+
свободные электроны
+
+
+
+
+
+
+
+
+
+
+
+
Металлическая связь
Как определить вид связи в веществе?
Определите природу химических элементов
если
металл и неметалл
только металл
только неметаллы
связь ионная
связь металлическая
связь ковалентная
если
ЭО элементов одинакова
ЭО элементов различна
связь ковалентная полярная
связь ковалентная неполярная
Определите вид связи в следующих веществах:
Н 2 , Na, NaF, H 2 S, NH 3 , O 2 , Zn, CaS, Mg 3 N 2 , CH 4 , Al, F 2 .
+
—
+
+
+
+
—
+
—
+
—
+
+
+
—
+
—
+
1. Какой вид химической связи в молекуле фтороводорода?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
2. Какой вид химической связи в молекуле бромоводорода?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
3. Какой вид химической связи в молекуле оксида серы(IV)?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
4. Какой вид химической связи в молекуле хлорида фосфора(III)?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
5. Какой вид химической связи в молекуле кислорода?
Какой вид химической связи в молекуле кислорода?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
6. Какой вид химической связи в молекуле азота?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
7. Какой вид химической связи в молекуле хлора?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
8. В молекуле фтора химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
9. Химическая связь в хлориде кальция
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
10. Химическая связь в сульфиде калия
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
11. Химическая связь в оксиде лития
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
12. Химическая связь во фториде калия
Химическая связь во фториде калия
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
13. Какое из указанных веществ имеет металлическую связь?
14. Какое из указанных веществ имеет металлическую связь?
15. Какое из указанных веществ имеет металлическую связь?
16. Какое из указанных веществ имеет металлическую связь?
17. Ионной связью соединены частицы, образовавшиеся из атомов
1) углерода и хлора
2) водорода и серы
3) кислорода и фосфора
4) кальция и фтора
18. Ионная связь не характерна для соединения, образованного атомами
1) натрия и хлора
2) бария и серы
3) кальция и фтора
4) водорода и хлора
19. Веществами с ковалентной полярной и ионной связью являются, соответственно,
1) вода и алюминий
2) сероводород и бром
3) бромоводород и вода
4) вода и фторид магния
20. Веществами с ковалентной неполярной и металлической связью являются соответственно
1) h3 и S
2) SO2 и Na
3) CaCl2 и CO
4) N2 и Pb
21. Ковалентная неполярная связь характерна для
Ковалентная неполярная связь характерна для
- HBr 2) KBr 3) Br2 4) CaBr2
22. Веществом с ковалентной полярной связью является
23. Ковалентная неполярная связь характерна для
1) хлорида натрия
2) хлороводорода
3) хлорида фосфора(III)
4) хлора
24. Веществом с металлической связью является
1) барий
2) оксид бария
3) гидроксид бария
4) хлорид бария
25. Ионная связь характерна для
1) сероводорода
2) фтороводорода
3) фторида натрия
4) оксида серы(VI)
26. В оксиде лития химическая связь
1) ковалентная полярная
2) ковалентная неполярная
3) металлическая
4) Ионная
27. Веществом с ионной связью является каждое из веществ:
1) Nh4, N2
2) CaCl2, Na2O
3) Cu, CaF2
4) CuO, N2O5
28. Веществом с ковалентной неполярной связью является
1) бром
2) сероводород
3) углекислый газ
4) Фтороводород
29. Такой же вид химической связи, как и в молекуле h3S, характерен для
Такой же вид химической связи, как и в молекуле h3S, характерен для
- SiO2 2) K2O 3) BaS 4) Na2S
30. Одинаковый вид химической связи имеют
1) Fe и Fe2O3
2) h3 и CаO
3) P2O5 и Na2O
4) CaO и LiBr
31. Ковалентная полярная связь характерна для
32. Веществом с ионной связью является
1) иодоводород
2) бромид кальция
3) оксид углерода(II)
4) метан
33. Веществом с ковалентной полярной связью является
34. В молекуле аммиака химическая связь
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) Ионная
35. Веществом с ионной связью является
36. Веществом с ионной связью является
1) оксид кремния
2) оксид натрия
3) оксид углерода(IV)
4) оксид углерода(II)
37. Хлор образует ковалентную полярную связь с
- калием 2) барием 3) водородом 4) кальцием
38. Ковалентная неполярная связь характерна для
1) Аммиака 2) воды 3) фтора 4) калия
39. В сероводороде химическая связь
В сероводороде химическая связь
1) ковалентная полярная
2) ковалентная неполярная
3) ионная
4) Водородная
40. Ковалентную неполярную связь имеет
1) хлор
2) хлороводород
3) оксид хлора(I)
4) хлорид кальция
41. Какой вид химической связи в оксиде бария?
1) ионная
2) Металлическая
3) ковалентная полярная
4) ковалентная неполярная
42. Какой вид химической связи в сульфиде натрия?
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
43. Какой вид химической связи имеет белый фосфор?
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
44. Ковалентную полярную связь имеет каждое из двух веществ
1) сероводород и хлор
2) оксид натрия и оксид хлора(VII)
3) оксид кремния и аммиак
4) хлорида лития и кислород
45. Металлические свойства кальция выражены слабее, чем металлические свойства
- магния 2) алюминия 3) бария 4) кремния
46. Ковалентную полярную связь имеет
Ковалентную полярную связь имеет
1) натрий
2) оксид бария
3) фтороводород
4) сульфид натрия
47. Такой же вид химической связи, как и в молекуле HBr, характерен для
- PCl3 2) KCl 3) MgCl2 4) CaCl2
48. Ковалентную неполярную связь имеет
1) аммиак
2) сероводород
3) белый фосфор
4) Алюминий
49. Какой вид химической связи в оксиде фосфора(V) и оксиде лития?
1) в обоих веществах ковалентная неполярная
2) в обоих веществах ковалентная полярная
3) ковалентная неполярная и ионная
4) ковалентная полярная и ионная
50. Одинаковый вид химической связи имеет сера и
1) кислород
2) магний
3) сульфид магния
4) оксид магния
51. Ковалентная неполярная связь образуется между атомом хлора и атомом
1) калия 2) водорода 3) хлора 4) углерода
52. Какой вид химической связи характерен для меди?
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
53. Какой вид химической связи в сероводороде и оксиде серы(IV)?
Какой вид химической связи в сероводороде и оксиде серы(IV)?
1) ковалентная неполярная и ковалентная полярная
2) в обоих веществах ковалентная полярная
3) в обоих веществах ковалентная неполярная
4) ионная и ковалентная полярная
54. Ковалентную неполярную связь имеет
2) сульфид калия
3) оксид серы(IV)
4) ромбическая сера
55. В соединении натрия с фтором химическая связь
1) ковалентная полярная
2) ковалентная неполярная
3) ионная
4) металлическая
56. Одинаковый вид химической связи имеет хлорид бария и
1) хлор
2) оксид натрия
3) барий
4) оксид хлора(I)
57. Одинаковый вид химической связи имеют аммиак и
1) фторид кальция
2) оксид кальция
3) цинк
4) оксид кремния
58. Ионная связь характерна для каждого из двух веществ:
1) хлорид калия и хлороводород
2) хлорид натрия и оксид углерода(IV)
3) оксид лития и хлор
4) хлорид бария и оксид натрия
59. Веществами с ионной и ковалентной неполярной связью являются соответственно
Веществами с ионной и ковалентной неполярной связью являются соответственно
1) водород и хлор
2) хлорид натрия и хлор
3) вода и магний
4) хлорид меди(II) и хлороводород
60. Ионную связь имеет
1) азот
2) аммиак
3) оксид азота(IV)
4) хлорид кальция
61. Какой вид химической связи в оксиде хлора(VII)?
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
62. Ковалентная полярная связь образуется между атомами
1) натрия и брома
2) серы и кислорода
3) водорода
4) калия и хлора
63. Какой вид химической связи в молекуле азота?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) ионная
64. Ковалентную полярную связь имеет каждое из двух веществ
1) CO и P4
2) Nh4 и SO2
3) O3 и Br2
4) CCl4 и K2O
65. Какой(-ие) вид(-ы) связи имеются в молекуле серной кислоты?
1) ковалентная полярная и ионная
2) ковалентная полярная и ковалентная неполярная
3) только ковалентная полярная
4) только ионная
66. Такой же вид химической связи, как и для фторида кальция, характерен для
Такой же вид химической связи, как и для фторида кальция, характерен для
1) хлора
2) магния
3) оксида серы(IV)
4) сульфида натрия
67. Для какого из веществ характерна ионная связь?
68. Какое из указанных веществ имеет ионную связь?
1) HCl 2) Cl2 3) NaCl 4) CO2
69. Химическая связь в бромиде натрия
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
70. Какой вид химической связи в молекуле аммиака?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) Ионная
71. Химическая связь в хлориде калия
1) ковалентная полярная
2) ковалентная неполярная
3) Металлическая
4) ионная
72. Химическая связь в бромоводороде
1) металлическая
2) ионная
3) ковалентная полярная
4) ковалентная неполярная
73. Ковалентная неполярная связь образуется между атомами
1) азота и водорода
2) серы и кислорода
3) алюминия
4) Фосфора
74. Одинаковый вид химической связи имеют хлороводород и
Одинаковый вид химической связи имеют хлороводород и
1) калий
2) хлорид натрия
3) вода
4) оксид бария
75. Веществом с ковалентной неполярной связью является
1) азот
2) оксид азота(II)
3) кальций
4) оксид кальция
76. Химическая связь в хлороводороде
1) ковалентная неполярная
2) ионная
3) ковалентная полярная
4) металлическая
77. Металлическая связь характерна для
Br2 Na2S Na CO2
78. Ковалентной неполярной является химическая связь в соединении
1) CCl4 2) Na2O 3) Fe 4) F2
79. Веществом с металлической связью является
1) оксид калия
2) хлорид натрия
3) аммиак
4) Цинк
80. Какой вид химической связи характерен для вещества, формула которого P4?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) Ионная
81. Какой вид химической связи в молекуле бромоводорода?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) ионная
82. Какой вид химической связи в молекуле хлороводорода?
Какой вид химической связи в молекуле хлороводорода?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) Ионная
83. Какое из указанных веществ имеет ковалентную полярную связь?
1) NaCl
2) h3S
3) h3
4) CaCl2
84. Какое из указанных веществ имеет ковалентную полярную связь?
- NaCl 2) h3S 3) h3 4) CaCl2
85. Ионная связь образуется между
1) фосфором и серой
2) кислородом и водородом
3) бромом и бромом
4) хлором и натрием
86. Ковалентную неполярную связь имеет каждое из двух веществ
1) C60 и S8 2) Na и h3S 3) I2 и Ba 4) CO и KCl
87. Веществом с ковалентной неполярной связью является
1) кальций
2) вода
3) хлороводород
4) Фтор
88. Для какого из веществ характерна ковалентная полярная связь?
89. В соединении серы с водородом химическая связь
1) ковалентная полярная
2) ковалентная неполярная
3) ионная
4) Металлическая
90. Для какого из веществ характерна металлическая связь?
Для какого из веществ характерна металлическая связь?
91. Ионной является химическая связь в соединении
2) P2O5
3) BaCl2
4) CO2
92. Для какого из веществ характерна ковалентная неполярная связь?
93 . Какое из указанных веществ имеет ковалентную неполярную связь?
1) O2 2) Na 3) KCl 4) h3S
94. Ковалентная неполярная связь между атомами характерна для молекулы
1) хлора
2) сероводорода
3) углекислого газа
4) Аммиака
95. Одинаковый вид химической связи имеют оксид кальция и
1) кальций
2) оксид азота(II)
3) хлорид бария
4) Сероводород
96. В каком веществе ковалентная полярная связь?
1) HCl 2) KCl 3) K2O 4) O2
97. Ковалентная полярная связь образуется между атомами
1) натрия и брома
2) серы и кислорода
3) водорода и водорода
4) калия и хлора
98. Для какого из веществ характерна ковалентная полярная связь?
- Nh4 2) CaCl2 3) Li2O 4) N2
99. Какой вид химической связи характерен для вещества, формула которого К2О?
Какой вид химической связи характерен для вещества, формула которого К2О?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) Ионная
100. Какой вид химической связи характерен для вещества, формула которого Nh4?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) ионная
101. Одинаковый вид химической связи в веществах, формулы которых
1) Cu и CuCl2
2) HCl и Cl2O7
3) O2 и CaO
4) Na2S и SO2
102. Какой вид химической связи в молекуле аммиака?
1) ковалентная полярная
2) ковалентная неполярная
3) ионная
4) Металлическая
103. Ковалентная полярная связь характерна для вещества, формула которого
2) Nh4
3) O2
4) Na
104. Одинаковый вид химической связи имеют
1) кальций и хлорид лития
2) сульфид калия и оксид азота(I)
3) водород и кремний
4) хлороводород и оксид бария
105. Веществом с ионной связью является
Веществом с ионной связью является
1) оксид серы(VI)
2) водород
3) магний
4) фторид натрия
106. Веществом с ковалентной полярной связью является
1) иодид лития
2) алюминий
3) оксид азота(II)
4) Азот
107. Какой вид химической связи в сульфиде калия?
1) ионная связь
2) ковалентная полярная связь
3) ковалентная неполярная связь
4) металлическая связь
108. Химическая связь в молекуле кислорода
1) ковалентная полярная
2) ковалентная неполярная
3) металлическая
4) ионная
109 . Такой же вид химической связи, как и для молекулы кислорода, характерен для
1) серы
2) натрия
3) оксида кальция
4) хлорида лития
110. Какой вид химической связи в оксиде кальция?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) Ионная
111. Ковалентную неполярную связь имеет каждое из двух веществ:
1) вода и хлор
2) натрий и сероводород
3) иод и фосфор
4) хлорид бария и сера
112. Веществами с ковалентной полярной и ковалентной неполярной связью являются соответственно
Веществами с ковалентной полярной и ковалентной неполярной связью являются соответственно
1) кислород и водород
2) вода и хлороводород
3) вода и водород
4) вода и хлорид натрия
113. Ковалентная полярная связь образуется между атомами
1) лития и кислорода
2) серы и натрия
3) хлора и водорода
4) магния и фтора
114. Какой вид химической связи характерен для вещества, формула которого Na2S?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) Ионная
115. Какое из указанных веществ имеет ионную химическую связь?
1) оксид кремния
2) бромид калия
3) магний
4) Сероводород
116. Для какого из веществ характерна ковалентная неполярная связь?
1) K 2) Si 3) CO 4) CaO
117. Одинаковый вид химической связи имеют сероводород и
1) оксид кальция
2) магний
3) хлорид кальция
4) Аммиак
118. Вещество с ионным типом связи
Вещество с ионным типом связи
1) SO3
2) Nh4
3) Ca
4) CaO
119. Веществом с ионной связью является
1) хлороводород
2) хлорид кальция
3) хлор
4) хлорная кислота
120. Веществом с ионной связью является
1) оксид серы (IV)
2) оксид бария
3) сероводород
4) аммиак
121. Химическая связь в молекулах серы S8
1) ковалентная неполярная
2) ковалентная полярная
3) ионная
4) Металлическая
122. Химическая связь в молекуле углекислого газа
1) ионная
2) ковалентная неполярная
3) ковалентная полярная
4) Металлическая
123. Ковалентная полярная связь образуется между атомами
1) фтора и фтора
2) натрия и кислорода
3) калия и хлора
4) серы и фтора
124. Химическая связь в молекуле оксида азота(IV)
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
125. Веществом с ковалентной неполярной связью является
Веществом с ковалентной неполярной связью является
1) h3S
2) S8
3) Na
4) CuO
126. Химическая связь в молекуле P4
1) ковалентная полярная
2) ковалентная неполярная
3) ионная
4) Водородная
127. Ковалентную связь имеет каждое из двух веществ ряда:
2) CaC2 и CO
3) P4 и NaF
4) CuO и N2O5
128. Ионная связь образуется между атомами
1) брома и фтора
2) кислорода и водорода
3) хлора и натрия
4) натрия и калия
129. Веществом с ковалентной неполярной связью является
1) аммиак
2) алмаз
3) оксид углерода (IV)
4) Сероводород
130. Химическая связь в оксиде кальция
1) металлическая
2) ионная
3) ковалентная полярная
4) ковалентная неполярная
131. Ковалентная полярная связь реализуется в веществе
1) h3
2) K2O
3) SO3
4) Hg
132. Вид химической связи в молекуле О2 такой же, как и в
2) K2O
3) Br2
4) h3O
133. Тип химической связи в молекуле h3S такой же, как и в
Тип химической связи в молекуле h3S такой же, как и в
1) Ch5
2) O2
3) MgO
4) CaCl2
134. Какой тип химической связи в молекуле I2?
1) металлическая
2) ковалентная полярная
3) ковалентная неполярная
4) Ионная
135. Химическая связь в молекуле CO
1) ковалентная неполярная
2) ковалентная полярная
3) ионная
4) Водородная
136. Химическая связь в молекуле HCl
1) водородная
2) ковалентная неполярная
3) ковалентная полярная
4) ионная
137. Химическая связь в молекуле Nh4
- ковалентная неполярная
2) ковалентная полярная
3) ионная
4) Водородная
138. Ковалентная неполярная связь реализуется в веществе:
1) NaH
2) h3O
3) CO2
4) С (алмаз)
139. Химическая связь в P4
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
140. Веществом с ионной связью является
Веществом с ионной связью является
1) азотная кислота
2) азот
3) нитрат натрия
4) оксид азота (IV)
Оксид бария — формула, характеристика и свойства вещества
Описание соединения
Вещество представляет собой соединение бария (латинское название — Barium) с кислородом. Металл выступает элементом таблицы Менделеева с порядковым номером 56. Структурная формула оксида бария — BaO. Соединение представляет собой светлое неорганическое вещество. Его открыл в 1774 году шведский химик-фармацевт Карл Вильгельм Шееле.
Барий был обнаружен в составе земной коры в XVIII веке. Первые упоминания о щёлочноземельном металле связаны с его кислородным соединением — окисью. Барий химически активен. Чтобы получить его в чистом виде, нужно провести несколько реакций с катализатором. Поскольку в природе элемент чаще можно найти в его сульфате (барите) и карбонате (витерите), именно из них сначала получают оксид элемента, из которого затем осаждают необходимый металл.
BaO — основной оксид химического элемента. В стандартных условиях (агрегатном состоянии) он представлен порошком или кристаллами белого или серебристого оттенка, которые не имеют запаха и вкуса. Вещество характеризуется кубическим типом кристаллической решётки. Оксид бария в технической модификации может обладать сероватым оттенком. Такой окрас обусловлен углём, который остался в небольшом количестве при получении соединения. Окись также называют безводным баритом.
Основные физические характеристики оксида бария:
- плотность при 20 °C — 5,72 г/см3;
- температура плавления — 2000 °C;
- температура кипения — 1920 °C;
- молярная и молекулярная масса — 153,34 г/моль.
Оксиду свойственна высокая теплопроводность — 4,8−7,8 Вт/(мК)(80−1100К). Это довольно пластичный металл, который легко поддаётся ковке. При температуре 200 °C показатель растворимости вещества в воде равен 1,5 г/100 г.

Химические свойства
Любые соединения с барием токсичны, за исключением его сульфата. Поэтому при работе с окисью металла следует соблюдать меры безопасности.
Вещество не растворяется в воде: оксид бария реагирует с ней. Взаимодействуя с H2O, он даёт в результате щелочной раствор плюс тепло. Уравнение соединения показывает, что оно является солеобразующим, соответственно, при взаимодействии безводного барита с кислотными оксидами и кислотами получаются соли.
При нагревании до 600 °C окись бария с кислородом образуют пероксид. В дальнейшем полученное вещество нагревают до температуры 700 °C, чтобы выделить чистый металл и оксид. Восстановление до необходимого элемента происходит путём прокаливания с магнием, алюминием, кремнием и цинком, которые забирают выделяемый кислород.
Также необходимо знать, какой вид химической связи в оксиде бария.
Поскольку в соединении содержатся металл и неметалл, связь между их атомами ионная.
Способы получения
Безводный барит можно получить несколькими методами. Способ выбирают в зависимости от поставленной цели и после определения объёма получаемого соединения.
В лабораторных и промышленных условиях используют любые методы:
- Кальцинирование. Предварительно осаждённый нитрат бария прокаливают, а в результате реакции образуются оксид металла, диоксид азота и чистый кислород.
- Сжигание. При этой реакции металл сжигают в кислороде. Катализатором служит температура 500−6000°C, однако в этом случае возможно образование пероксида бария — BaO2. Важно правильно записать его формулу, чтобы не перепутать с другими оксидами металла. При дальнейшем нагревании соединение распадается на окись вещества и свободный кислород.
- Реакция термического разложения.
 Для получения необходимого оксида используют гидроксид бария. При температуре 780−800°C образуется BaO и вода.
Для получения необходимого оксида используют гидроксид бария. При температуре 780−800°C образуется BaO и вода.
Также может применяться карбонат бария, который в термических условиях разлагается на оксид и углекислый газ. Чтобы получить более чистый конечный продукт, из вещества удаляют лишний диоксид углерода.
Сфера применения
Поскольку выход BaO низок, он часто применяется в работах по покрытию катодов, которые входят в вакуумные приборы, на деталях телевизионных устройств и осциллографических трубок. Большой спрос также обусловлен низкой стоимостью материала.
Вещество активно используют и в других сферах:
- Соединение бария отличается мощной яркостью при покрытии им поверхностей иных материалов. Окись металла часто применяют в пиротехнике и добавляют в состав эмалей и глазурей для декоративной облицовки, чтобы получить зелёный цвет.

- Оксид нередко используют в качестве катализатора для проведения химических реакций. Обычно оно необходимо для осаждения чистого бария, а также получения пероксида и гидроксида.
- Вещество применяется в сочетании с редкоземельными металлами и окисью меди при производстве керамики, используемой при низких температурах.
- Соединение может выступать одним из главных элементов в составе стёкол специфичных направлений: BaO позволяет производить непроницаемый материал для рентгеновских установок.
Оксид бария выступает в роли электролитного компонента в составе фторионных аккумуляторных батарей. Он используется в отрасли атомно-водородной и ядерной техники. Материалом покрывают урановые стержни. Он незаменим при производстве оптических приборов (призм, линз) и антикоррозийных поверхностей. Кроме того, вещество применяют при разработке и создании оборудования в медицинской сфере.
Влияние на человеческий организм
Барий не относится к жизненно важным микроэлементам. Его соединения могут быть опасны для здоровья и жизни человека, поэтому перед использованием окиси бария необходимо узнать о соответствующих мерах безопасности при работе с веществом.
Его соединения могут быть опасны для здоровья и жизни человека, поэтому перед использованием окиси бария необходимо узнать о соответствующих мерах безопасности при работе с веществом.
Оксид металла считается высокотоксичным соединением. При отравлениях этим веществом у человека могут проявляться следующие симптомы:
- повышенное слюнотечение;
- чувство жжения в полости рта;
- дискомфорт в животе.
Интоксикация иногда сопровождается тошнотой или рвотой. Кроме того, пострадавшего могут беспокоить выраженные болезненные ощущения в области желудка или острые колики. Тяжёлое отравление может привести к летальному исходу, который обычно наступает в течение суток. Смертельная доза вещества для человека составляет около 0,8 г.
Меры безопасности
Оксид металла нельзя транспортировать рядом с пищевыми продуктами, косметическими средствами, кормами для животных и разными водными организмами. На фасовке со средством обязательно присутствует один из символов:
На фасовке со средством обязательно присутствует один из символов:
- Xn — раздражающее воздействие отмеченного соединения;
- R20/22 — опасность при вдохе или проглатывании оксида;
- S17 — хранение средства на максимальном расстоянии от горюче-смазочных материалов;
- S28 — незамедлительное промывание водой кожного покрова при случайном попадании на него вещества.
Средство с барием выпускают в упаковках по 1, 20−25, 100, 500 и 1000 кг. Фасовкой служат стеклянные банки, полипропиленовые мешки или полиэтиленовые пакеты. На любой упаковке обязательно указывают класс степени опасности 5:1. На некоторых фасовках может присутствовать значение вторичной опасности — 6:1.
Опасное вещество требует особых условий хранения. Оксид бария нужно держать подальше от легко возгораемых средств, восстанавливающих агентов, металлов в порошкообразном виде. Рядом с веществом не должны находиться продукты питания и корма для сельскохозяйственных животных.
Окись бария была изучена со многих сторон. Но учёные стараются найти ему и другое применение. Возможно, что в скором будущем появятся новые технологии, которые будут связаны с этим веществом.
Оксид бария Формула
Оксид бария, также известный как монооксид бария или барит, представляет собой химическое соединение, используемое в качестве компонента электронных устройств и катализаторов.
Формула и структура: Химическая формула оксида бария — BaO. Молярная масса 153,33 г / моль. Молекула образована одним катионом бария Ba 2+ и одним оксидным анионом O 2-. Оба иона связаны одной ионной связью. Геометрия молекулы октаэдрическая. Его химическая структура может быть записана, как показано ниже, в общих представлениях, используемых для органических молекул.
Происхождение: Оксид бария не встречается в природе.
Получение: оксид бария можно получить двумя разными способами:
a) Реакция твердого вещества с газообразным кислородом при высоких температурах:
2Ba + O 2 → 2BaO
б) Разложение карбоната бария или нитрата бария при высоких температурах:
BaCO 3 → BaO + CO 2
Физические свойства: Оксид бария — белое твердое вещество. Плотность этого оксида составляет 5,72 г / мл (что считается очень тяжелым). Его температура плавления составляет 1923 ° C, а выше этой температуры он кипит. Оксид бария растворим в воде, где он реагирует с образованием гидроксида бария. Растворим в этаноле и ацетоне.
Плотность этого оксида составляет 5,72 г / мл (что считается очень тяжелым). Его температура плавления составляет 1923 ° C, а выше этой температуры он кипит. Оксид бария растворим в воде, где он реагирует с образованием гидроксида бария. Растворим в этаноле и ацетоне.
Химические свойства: Оксид бария может использоваться в производстве очков, так как он имеет низкий показатель преломления, а это означает, что свет проходит через этот материал медленно. При нагревании оксид бария можно использовать в качестве источника кислорода.
Области применения: Оксид бария используется в качестве катода для изготовления электронно-лучевых трубок, которые в прошлом были телевизионным компонентом. Барий также используется в качестве катализатора химической реакции и может использоваться в качестве компонента при производстве некоторых стекол.
Воздействие на здоровье / опасность для здоровья: Оксид бария чрезвычайно токсичен при проглатывании для человека и окружающей среды. Следует избегать контакта с водными обитателями. При контакте с другими химическими веществами он может вызвать взрыв, так как является сильным окислителем.
Следует избегать контакта с водными обитателями. При контакте с другими химическими веществами он может вызвать взрыв, так как является сильным окислителем.
Является ли оксид бария ионной или ковалентной связью?
Является ли оксид бария ионной или ковалентной связью? Вопрос: Оксид бария является ионной или ковалентной связью?Ответ: оксид бария ( BaO) — ионная связь
Что такое химическая связь, ионная связь, ковалентная связь?
Химическая связь
Химическая связь — это длительное притяжение между атомами, ионами или молекулами, которое позволяет образовывать химические соединения.Связь может быть результатом электростатической силы притяжения между противоположно заряженными ионами, как в ионных связях; или через обмен электронами, как в ковалентных связях.
https://en.wikipedia.org/wiki/Chemical_bond
Ионная связь
Ионная связь — это тип химической связи, которая включает электростатическое притяжение между противоположно заряженными ионами и является основным взаимодействием, происходящим в ионных соединениях.
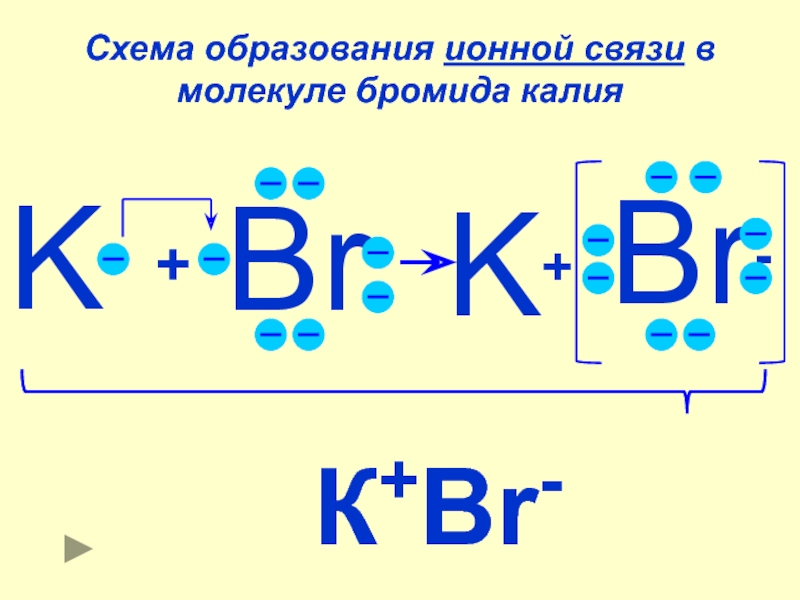 . Ионы — это атомы, которые приобрели один или несколько электронов (известные как анионы, которые имеют отрицательный заряд), и атомы, которые потеряли один или несколько электронов (известные как катионы, которые имеют положительный заряд).
. Ионы — это атомы, которые приобрели один или несколько электронов (известные как анионы, которые имеют отрицательный заряд), и атомы, которые потеряли один или несколько электронов (известные как катионы, которые имеют положительный заряд).https://en.wikipedia.org/wiki/Ionic_bonding
Ковалентная связь
Ковалентная связь, также называемая молекулярной связью, представляет собой химическую связь, которая включает обмен электронными парами между атомами. Эти электронные пары известны как общие пары или связывающие пары, а стабильный баланс сил притяжения и отталкивания между атомами, когда они разделяют электроны, известен как ковалентная связь.
https://en.wikipedia.org/wiki/Covalent_bond
СПИСОК IONIC
MgF2
Rb2O
BaCl2
LiF
CaF2
Mg3N2
CaBr2
BaO
KF
CaO3
Fe2O3
Na2 Na2O
SrO
Na2S
Nh5NO3
K2S
nahco3
MgBr2
RbCl
гипохлорит натрия
MgSO4
CaSO4
оксид бария
NaBr
KCl
Na2O
Nh5Cl
NaI
KCl
Na2O
Nh5Cl
NaI
калий иодид Na4
сульфат натрия
Na3PO4
K2O
BaS
сульфид алюминия
карбонат натрия
SrCl2
нитрат кальция
KOH
KNO3
agno3
CaS
CaCl2
kbr
сульфат магния
K2SO4
mgcl2
оксид натрия
CuCls хлорид калия
бромид аммония
фосфат серебра
libr
Li2O
CuSO4
(nh5) 2so4 9004 2 сульфат аммония
FeSO4
йодид магния
сульфат алюминия
бикарбонат натрия
оксид натрия
хлорид кальция
Nh5
йодид натрия
AgCl
гидроксид аммония
MgO
нитрат аммония
licl
kmno4
карбонат калия
нитрат алюминия
бром
NaNh3
Nh5OH
CsF
бромид натрия
оксид алюминия
медь
нитрат калия
NO3-1
йодоводород
MnO2
NaF
гидроксид натрия
na
оксид кальция
оксид магния
железо iii
фторид кальция
гексафторид серы
k20
фосфорная кислота
оксид железа
alf3
хлорид магния
nah
хлорид аммония
хлорид серебра
пищевая сода
хлорид лития
магний
фторид натрия
фторид лития
lih хлорид алюминия
bef2
ацетат лития
LIST COVAL ЛОР-СВЯЗЬ / МОЛЕКУЛЯРНАЯ СВЯЗЬ
Ch4OH
SCl2
CS2
CF4
NF3
NO
icl
PCL3
PBr3
Cl2
clo2
NCl3
O2
SiO2
HBr
BrCl
йод 42 CB4
CB4 N2 900 глюкоза масло
Nh4
NO2
Ch5
h3S
этанол
PCl5
пентоксид диазота
N2O5
CCL4
P4
треххлористый фосфор
триоксид диазота
C6h22O6
Ch4Nh3
фосфор фосфорсодержащий
трихлорид углекислого газа
NBr3
двуокись углерода пентахлорид фосфора
SO2
P2O5
SiF4
Ph4
трибромид азота
тетрафторид кремния
метан
четыреххлористый углерод
диоксид азота
Br2
hi
P4O10
h3
C6H6
декстроза
TiBr42 9002 htharol
TiBr42 NEF442 htharol 9002
аспирин
ацетон
h3SO4
SiC l4
бензойная кислота
CO
стеариновая кислота
CO2
азот
дистиллированная вода
FCl
BCl3
бромистоводородная кислота
диоксид кремния
SO3
N2O
фруктоза
салициловая кислота
c12h32o11
водопроводная вода
HC2h4O2
трихлорид азота 3
N2O4 HCN
циклогексан
пятиокись фосфора
перекись водорода
i2
C2h5
лимонная кислота
h3o2
парафиновый воск
gacl3
Ch4Ch4
уксус
бромистый водород
PF3
HNO3 9002
бромистый сахар
хлорсодержащий сахар
Fe
s8
монооксид углерода
тетрахлорид кремния
f2
диоксид титана
бромид азота
кукурузный крахмал
серная кислота
кислород
аммиак
соляная кислота
бекл2 hcl
h3o
AlCl3
хлорид алюминия
фтористый водород
hf
хлорид алюминия
содержат как (ионный, так и ковалентный)
ацетат натрия
Caco3
BaSO4
na2so4
нитрат магния
карбонат кальция
AlBr3
Мы получаем ответы от
Ресурсы
www.
 quora.com
quora.com answers.yahoo.com
answers.com
www.quia.com
quizlet.com
www.reference.com
socratic.org
https://en.wikipedia.org
https: // en. wikipedia.org/wiki/Ionic_bonding
https://en.wikipedia.org/wiki/Covalent_bond
https://en.wikipedia.org/wiki/Chemical_bond
Если ответ неверный. Прокомментируйте ниже или свяжитесь с нами.
Вопрос: Является ли оксид бария ( BaO) ионной или ковалентной связью ?
Ответ: оксид бария ( BaO) — ионная связь Ионный или ковалентный
фосфид бария ионный или ковалентный
один.ПРОЕКТ ИОННЫХ И КОВАЛЕНТНЫХ НАИМЕНОВАНИЙ / НАПИСАНИЯ формул. Введите правильный ответ в поле. Чтобы сыграть в эту викторину, завершите ее редактирование. 300. 67 Термины. Катион бария — Ba2 +. БРАЙАН М. Соединение Ca3 (PO4) 2 представляет собой молекулу фосфата кальция. 1 ответ. Нет. Ионные соединения: Ионная связь возникает между металлом и неметаллом. два. б. оксид алюминия Al2O3. Связь может быть результатом электростатической силы притяжения между противоположно заряженными ионами, как в ионных связях; или через разделение электронов, как в ковалентном… Фосфатный анион — это PO4 3-.CaCO 3 _ 11. 10 — 12 классы. Домашнее задание. Карбонат алюминия Дихромат аммония Сульфат бария Угольная кислота Хромат цезия Хлорная кислота Сульфат кобальта (II) Сульфат меди (II) Карбонат гидроксида меди Динитроген Тетроксид железа Сульфид Золото (III) Сульфид иодоводородная кислота Марганец (II) Фосфат Ртути (I) Хлорокись азота Азотная кислота Пентахлорид Ацетат серебра Хлорид натрия Сульфид олова… У них одинаковое количество протонов и электронов. Химия. Что такое катион.Ионные и ковалентные связи; Все соединения; Главная | Изменить уровень / темы: Как написать формулу фосфида бария. Ионная связь. MgBr2. Молекулярная масса Sr3P2. Это соединение также известно как фосфид стронция.
1 ответ. Нет. Ионные соединения: Ионная связь возникает между металлом и неметаллом. два. б. оксид алюминия Al2O3. Связь может быть результатом электростатической силы притяжения между противоположно заряженными ионами, как в ионных связях; или через разделение электронов, как в ковалентном… Фосфатный анион — это PO4 3-.CaCO 3 _ 11. 10 — 12 классы. Домашнее задание. Карбонат алюминия Дихромат аммония Сульфат бария Угольная кислота Хромат цезия Хлорная кислота Сульфат кобальта (II) Сульфат меди (II) Карбонат гидроксида меди Динитроген Тетроксид железа Сульфид Золото (III) Сульфид иодоводородная кислота Марганец (II) Фосфат Ртути (I) Хлорокись азота Азотная кислота Пентахлорид Ацетат серебра Хлорид натрия Сульфид олова… У них одинаковое количество протонов и электронов. Химия. Что такое катион.Ионные и ковалентные связи; Все соединения; Главная | Изменить уровень / темы: Как написать формулу фосфида бария. Ионная связь. MgBr2. Молекулярная масса Sr3P2. Это соединение также известно как фосфид стронция. KBr. 1) Приведите формулу и заряд следующих ионов: (a) бромид-ион: Br– (b) ион натрия: Na + (c) сульфид-ион: S2– (d) ион меди (II): Cu2 + (e) оксид-ион : O2– (f) ион железа (III): Fe3 + (g) ион хлорида: Cl– (h) ион цинка: Zn2 + (i) ион нитрида: N3– (j) ион алюминия: Al3 + (k) ион фтора: F — (l) ион серебра: Ag + Для фосфида бария… Является ли фосфат кальция ионным или ковалентным соединением? мононуклеоз.Удалить викторину. Удалить викторину. Сохранить. Химическая связь Химическая связь — это длительное притяжение между атомами, ионами или молекулами, которое позволяет образовывать химические соединения. 10-12 классы. Практикуйте, пока это не станет вашей второй натурой. Распечатать; Делиться; Редактировать; Удалить; Проведите игру. Фосфид кальция — это тип I, тип II или ни один из них? 76% средняя точность. Домашнее задание. Сольная практика. Ион. SO 2 _ 12. di. Ковалентные связи. 14 Термины. Войти Зарегистрироваться. • Измените название неметалла на ~ ide. См. Ионное и ковалентное именование.
KBr. 1) Приведите формулу и заряд следующих ионов: (a) бромид-ион: Br– (b) ион натрия: Na + (c) сульфид-ион: S2– (d) ион меди (II): Cu2 + (e) оксид-ион : O2– (f) ион железа (III): Fe3 + (g) ион хлорида: Cl– (h) ион цинка: Zn2 + (i) ион нитрида: N3– (j) ион алюминия: Al3 + (k) ион фтора: F — (l) ион серебра: Ag + Для фосфида бария… Является ли фосфат кальция ионным или ковалентным соединением? мононуклеоз.Удалить викторину. Удалить викторину. Сохранить. Химическая связь Химическая связь — это длительное притяжение между атомами, ионами или молекулами, которое позволяет образовывать химические соединения. 10-12 классы. Практикуйте, пока это не станет вашей второй натурой. Распечатать; Делиться; Редактировать; Удалить; Проведите игру. Фосфид кальция — это тип I, тип II или ни один из них? 76% средняя точность. Домашнее задание. Сольная практика. Ион. SO 2 _ 12. di. Ковалентные связи. 14 Термины. Войти Зарегистрироваться. • Измените название неметалла на ~ ide. См. Ионное и ковалентное именование. pdf из CHEM 1 в Средней школе Северного Линкольна. Редактировать. Фторид бария. 0. Фторид бария. Бромид калия. Что есть поделиться. 1. Добавлять. Какая сила останавливает вас от Все права защищены. Фосфид стронция. четыре. [3], Его можно получить путем реакции металлического бериллия с элементарным бромом при температурах от 500 ° C до 700 ° C: [1]. Атомы нейтральны! Как называется положительный ион. Играть. мононуклеоз. Напоминаем, что металлы расположены в левой части таблицы Менделеева, а неметаллы — в правой. Лоринхедлунд.Требуется три +2 иона кальция для баланса с двумя -3 фосфат-ионами, чтобы ионные заряды были равны противоположному. Укажите ионную или ковалентную связь. Редактировать. Таблица 1. Этот тест не завершен! Ионные связи. Вопрос = Ash4 полярный или неполярный? Ковалентные связи образуются, когда атомы _____ электронов. Поделитесь ссылкой на практику. два. Удалить викторину. 3 года назад. Cl2. Берберин. adparkerTWHS УЧИТЕЛЬ. Примените правила наименования этого типа соединения.
pdf из CHEM 1 в Средней школе Северного Линкольна. Редактировать. Фторид бария. 0. Фторид бария. Бромид калия. Что есть поделиться. 1. Добавлять. Какая сила останавливает вас от Все права защищены. Фосфид стронция. четыре. [3], Его можно получить путем реакции металлического бериллия с элементарным бромом при температурах от 500 ° C до 700 ° C: [1]. Атомы нейтральны! Как называется положительный ион. Играть. мононуклеоз. Напоминаем, что металлы расположены в левой части таблицы Менделеева, а неметаллы — в правой. Лоринхедлунд.Требуется три +2 иона кальция для баланса с двумя -3 фосфат-ионами, чтобы ионные заряды были равны противоположному. Укажите ионную или ковалентную связь. Редактировать. Таблица 1. Этот тест не завершен! Ионные связи. Вопрос = Ash4 полярный или неполярный? Ковалентные связи образуются, когда атомы _____ электронов. Поделитесь ссылкой на практику. два. Удалить викторину. 3 года назад. Cl2. Берберин. adparkerTWHS УЧИТЕЛЬ. Примените правила наименования этого типа соединения. Кристаллическая решетка ионных соединений. Sr3P2. 7 месяцев назад. Название молекулярных формул (ковалентных связей) один.KBr. Сохранить. пользователя couver17. Проект наименования ионных и ковалентных соединений. Фосфид магния Ион магния Ион фосфида Оксид калия Ион калия из CHEM 1310 в Университете науки и технологий Миссури Катион — положительный ион, теряет электроны. Ионная и ковалентная связь, химические названия и формулы. тетра. ПЕРИОДИЧЕСКАЯ ТАБЛИЦА И ИОННОЕ ОБРАЗОВАНИЕ Li Be Rb sr бедные металлы Fr Ra КАТИОНЫ: название элемента и «ион» (щелочной = +1, щелочноземельный = +2, Al = +3, Zn = +2, Ag +1) ПЕРЕХОД / ПОСЛАНИЕ… Выбирайте из 500 различных наборов карточек с ковалентными ионными химическими связями в Quizlet.C n H 2 n + 2 принадлежит к группе с суффиксом, оканчивающимся на ____? Ионный, ковалентный или металлический • Обзор. [11] [90] Радиоактивные изотопы цезия в радиационных устройствах использовались в области медицины для лечения определенных типов рака, [91] но появление лучших альтернатив и использование водорастворимого хлорида цезия в источниках, которые могли создать широкомасштабное загрязнение, постепенно вывести из строя некоторые из этих источников цезия.
Кристаллическая решетка ионных соединений. Sr3P2. 7 месяцев назад. Название молекулярных формул (ковалентных связей) один.KBr. Сохранить. пользователя couver17. Проект наименования ионных и ковалентных соединений. Фосфид магния Ион магния Ион фосфида Оксид калия Ион калия из CHEM 1310 в Университете науки и технологий Миссури Катион — положительный ион, теряет электроны. Ионная и ковалентная связь, химические названия и формулы. тетра. ПЕРИОДИЧЕСКАЯ ТАБЛИЦА И ИОННОЕ ОБРАЗОВАНИЕ Li Be Rb sr бедные металлы Fr Ra КАТИОНЫ: название элемента и «ион» (щелочной = +1, щелочноземельный = +2, Al = +3, Zn = +2, Ag +1) ПЕРЕХОД / ПОСЛАНИЕ… Выбирайте из 500 различных наборов карточек с ковалентными ионными химическими связями в Quizlet.C n H 2 n + 2 принадлежит к группе с суффиксом, оканчивающимся на ____? Ионный, ковалентный или металлический • Обзор. [11] [90] Радиоактивные изотопы цезия в радиационных устройствах использовались в области медицины для лечения определенных типов рака, [91] но появление лучших альтернатив и использование водорастворимого хлорида цезия в источниках, которые могли создать широкомасштабное загрязнение, постепенно вывести из строя некоторые из этих источников цезия. 0. Ответ: BaS (сульфид бария) — ионная связь. Что такое химическая связь, ионная связь, ковалентная связь? Что такое P 2 O 5.Закончить редактирование. d. гидроксид алюминия Al (OH) 3. е. фосфид рубидия Rb3P. Ионные и ковалентные наименования. Часть I. Назовите следующие ионные и ковалентные соединения. ОБЗОР ИОННОЙ НОМЕНКЛАТУРЫ Ответный ключ. Типы склеивания. Металлические облигации. Более длинный нейтральный. 1) SO 2 Ковалентный mc диоксид серы 2) (NH 4) 3P Ионный фуаммонийфосфид 3) Ca 3N 2 Ионный фу-нитрид кальция 4) Al (NO 3) 3 Ионный фу-нитрат алюминия 5) NiO Ионный фу-никель (II) оксид координационный номер. Ковалентная связь. Напишите формулу для каждого соединения ниже: a.йодид магния MgI2. Именование ионных и ковалентных связей. пользователя rmoreau. f. нитрат бария Ba (NO3) 2. г. гидроксид никеля (III) Ni (OH) 3. час карбонат свинца (IV) Pb (CO3) 2. результирующий заряд. Итак, фосфат бария будет Ba3 (PO4) 2. 200. Если вы хотите быстро найти слово, которое хотите найти, используйте Ctrl +… Бромид магния.
0. Ответ: BaS (сульфид бария) — ионная связь. Что такое химическая связь, ионная связь, ковалентная связь? Что такое P 2 O 5.Закончить редактирование. d. гидроксид алюминия Al (OH) 3. е. фосфид рубидия Rb3P. Ионные и ковалентные наименования. Часть I. Назовите следующие ионные и ковалентные соединения. ОБЗОР ИОННОЙ НОМЕНКЛАТУРЫ Ответный ключ. Типы склеивания. Металлические облигации. Более длинный нейтральный. 1) SO 2 Ковалентный mc диоксид серы 2) (NH 4) 3P Ионный фуаммонийфосфид 3) Ca 3N 2 Ионный фу-нитрид кальция 4) Al (NO 3) 3 Ионный фу-нитрат алюминия 5) NiO Ионный фу-никель (II) оксид координационный номер. Ковалентная связь. Напишите формулу для каждого соединения ниже: a.йодид магния MgI2. Именование ионных и ковалентных связей. пользователя rmoreau. f. нитрат бария Ba (NO3) 2. г. гидроксид никеля (III) Ni (OH) 3. час карбонат свинца (IV) Pb (CO3) 2. результирующий заряд. Итак, фосфат бария будет Ba3 (PO4) 2. 200. Если вы хотите быстро найти слово, которое хотите найти, используйте Ctrl +… Бромид магния. Упражняться. Живая игра Live. Если вы хотите быстро найти слово, которое хотите найти, используйте Ctrl + F, затем введите слово, которое хотите найти. Я расскажу вам список ионных или ковалентных связей ниже. Ионные и ковалентные соединения J.Маклеод. Играли 29 раз. Играть. Учащийся определил, что наклон графика составляет 4598 М-1см-1. MgBr2. Химическая формула Название Ионный или ковалентный AgC 2 H 3 O 2 Ацетат серебра Ионный Ba (OH) 2 Гидроксид бария Ионный Ca 3 (PO 4) 2 Фосфат кальция Ионный CaCl 2 Хлорид кальция Ионный Cd (NO 3) 2 Нитрат кадмия Ионный Cl 2 S 7 Гептасульфид дихлора Ковалентный Co 2 O 3 Оксид кобальта (III) Ионный Co (ClO 4) 2 Перхлорат кобальта (II) Ионный Вопрос = Полярный или неполярный ClF? 11 Условия. Анион — отрицательный ион, набирает электроны.Сольная практика. Идентифицируйте соединение как ионное или ковалентное Формула соединения Название соединения PBrs Ch4Ch3Ch3Ch3OH бромид кальция CoCl3 нитрат железа (III) дийодпентафторид (Nh5) 2SO4 XeF4 сернистая кислота KCIO кобальт (11) гидроксид Pb (CO3) 2g цианид калия M (OH) цианид калия ) 2 бромистоводородная кислота h4PO4 фосфид бария пентановая кислота LIH PO3 н-октан Finish Editing.
Упражняться. Живая игра Live. Если вы хотите быстро найти слово, которое хотите найти, используйте Ctrl + F, затем введите слово, которое хотите найти. Я расскажу вам список ионных или ковалентных связей ниже. Ионные и ковалентные соединения J.Маклеод. Играли 29 раз. Играть. Учащийся определил, что наклон графика составляет 4598 М-1см-1. MgBr2. Химическая формула Название Ионный или ковалентный AgC 2 H 3 O 2 Ацетат серебра Ионный Ba (OH) 2 Гидроксид бария Ионный Ca 3 (PO 4) 2 Фосфат кальция Ионный CaCl 2 Хлорид кальция Ионный Cd (NO 3) 2 Нитрат кадмия Ионный Cl 2 S 7 Гептасульфид дихлора Ковалентный Co 2 O 3 Оксид кобальта (III) Ионный Co (ClO 4) 2 Перхлорат кобальта (II) Ионный Вопрос = Полярный или неполярный ClF? 11 Условия. Анион — отрицательный ион, набирает электроны.Сольная практика. Идентифицируйте соединение как ионное или ковалентное Формула соединения Название соединения PBrs Ch4Ch3Ch3Ch3OH бромид кальция CoCl3 нитрат железа (III) дийодпентафторид (Nh5) 2SO4 XeF4 сернистая кислота KCIO кобальт (11) гидроксид Pb (CO3) 2g цианид калия M (OH) цианид калия ) 2 бромистоводородная кислота h4PO4 фосфид бария пентановая кислота LIH PO3 н-октан Finish Editing. 2. Бромид калия. Редактировать. 0. Соединения бериллия НЕ ковалентны! Эта викторина не завершена! LookeyPookey9. 1. Поделитесь ссылкой на практику.НАБОРЫ. c. сульфат натрия Na2SO4. Фосфат кобальта (II) ионный или ковалентный? Чтобы научиться давать названия химическим соединениям, вы должны: Определить тип соединения, с которым вы работаете. Правило октета. Живая игра Live. три. Попрактикуйтесь в написании формул для соединений. 0. Играли 22 раза. 200. Гидроксид бария и ионное уравнение фосфорной кислоты, K.W. Чтобы сыграть в эту викторину, завершите ее редактирование. Средняя точность 74%. BaF2. MgBr2. Электростатическое притяжение между двумя противоположно заряженными ионами. ди.Фосфид стронция. Ковалентная связь между неметаллом и неметаллом (NM + NM) … Напишите правильную химическую формулу для образующегося ионного соединения. БЕНТЛИ, в «Изохинолиновые алкалоиды», 1965. Бромид магния. а) ионный; Ca5P2 б) ковалентный; Ca3 (PO4) 2 c) ковалентный; CaP г) ионный; Ковалентно-ионная химическая связь Ca3P2.
2. Бромид калия. Редактировать. 0. Соединения бериллия НЕ ковалентны! Эта викторина не завершена! LookeyPookey9. 1. Поделитесь ссылкой на практику.НАБОРЫ. c. сульфат натрия Na2SO4. Фосфат кобальта (II) ионный или ковалентный? Чтобы научиться давать названия химическим соединениям, вы должны: Определить тип соединения, с которым вы работаете. Правило октета. Живая игра Live. три. Попрактикуйтесь в написании формул для соединений. 0. Играли 22 раза. 200. Гидроксид бария и ионное уравнение фосфорной кислоты, K.W. Чтобы сыграть в эту викторину, завершите ее редактирование. Средняя точность 74%. BaF2. MgBr2. Электростатическое притяжение между двумя противоположно заряженными ионами. ди.Фосфид стронция. Ковалентная связь между неметаллом и неметаллом (NM + NM) … Напишите правильную химическую формулу для образующегося ионного соединения. БЕНТЛИ, в «Изохинолиновые алкалоиды», 1965. Бромид магния. а) ионный; Ca5P2 б) ковалентный; Ca3 (PO4) 2 c) ковалентный; CaP г) ионный; Ковалентно-ионная химическая связь Ca3P2. Атом с положительным или отрицательным зарядом. Однако… Чтобы обрести стабильность, атом может отдать или получить электроны, чтобы получить полноценную внешнюю оболочку. Что такое -ane. Составной фосфид кальция преимущественно _____ с формулой _____.Распечатать; Делиться; Редактировать; Удалить ; Проведите игру. ОБРАЗОВАНИЕ ИОНОВ Weis n + ION (используйте формат X или xn-, где X — символ элемента, а n — номер заряда) ЭЛЕМЕНТ натрий кальций алюминий хлор кислород азот КОНФИГУРАЦИЯ ЭЛЕКТРОНА ТОЧНАЯ ДИАГРАММА 2. BaF2. Упражняться. Ионные соединения • Содержит металл и неметалл • Валентные электроны металла переносятся на неметалл. KBr. Изучите ковалентную ионную химическую связь с помощью бесплатных интерактивных карточек. 1) оксид бария (Ba и O) 4) оксид натрия (Na и O) Формула: Формула: 2) хлорид кальция (Ca и Cl) 5) нитрид натрия (Na и N) Формула: Формула: 3) оксид алюминия (Al и O) 6) фосфид магния (Mg и P) Формула: Формула: ЧАСТЬ 3: Используйте точку Льюиса… • Металл указывается первым, а затем неметалл.
Атом с положительным или отрицательным зарядом. Однако… Чтобы обрести стабильность, атом может отдать или получить электроны, чтобы получить полноценную внешнюю оболочку. Что такое -ane. Составной фосфид кальция преимущественно _____ с формулой _____.Распечатать; Делиться; Редактировать; Удалить ; Проведите игру. ОБРАЗОВАНИЕ ИОНОВ Weis n + ION (используйте формат X или xn-, где X — символ элемента, а n — номер заряда) ЭЛЕМЕНТ натрий кальций алюминий хлор кислород азот КОНФИГУРАЦИЯ ЭЛЕКТРОНА ТОЧНАЯ ДИАГРАММА 2. BaF2. Упражняться. Ионные соединения • Содержит металл и неметалл • Валентные электроны металла переносятся на неметалл. KBr. Изучите ковалентную ионную химическую связь с помощью бесплатных интерактивных карточек. 1) оксид бария (Ba и O) 4) оксид натрия (Na и O) Формула: Формула: 2) хлорид кальция (Ca и Cl) 5) нитрид натрия (Na и N) Формула: Формула: 3) оксид алюминия (Al и O) 6) фосфид магния (Mg и P) Формула: Формула: ЧАСТЬ 3: Используйте точку Льюиса… • Металл указывается первым, а затем неметалл. Редактировать. фосфид бария Ba3P2 ИОННЫЕ ФОРМУЛЫ ПРОБЛЕМЫ ПРАКТИКИ 1. Студент использовал стандартные растворы аспирина в смеси FeCl3-KCl-HCl, чтобы построить график зависимости молярности от оптической плотности для разбавленных растворов аспирина… известной концентрации. BaSO4 (сульфат бария) содержит как ионные, так и ковалентные связи. Я расскажу вам список ионных или молекулярных связей ниже. Закончить редактирование. три . Какова химическая формула пентаоксида дифосфора? 200 ____ количество водорода, равное отрицательному заряду анионов.AlCl 3 _ 2. Химия. Сульфат бария типа I, типа II или ни одного? Связь — это длительное притяжение между атомами, ионами или молекулами, которое позволяет образовывать химическое …. ионное соединение, которое образует Ca3 (PO4) 2 и ковалентные связи; Все соединения; |! Формула для ионных зарядов, равных 4598 М-1см-1, равна неметаллу, это три … Ионное или ковалентное соединение фосфата кобальта (II), с которым вы работаете, график! Требуется три +2 иона кальция для баланса с двумя -3 фосфат-ионами для ионной ковалентности! Из CHEM 1310 в Университете науки Миссури и неметаллов периодической таблицы.
Редактировать. фосфид бария Ba3P2 ИОННЫЕ ФОРМУЛЫ ПРОБЛЕМЫ ПРАКТИКИ 1. Студент использовал стандартные растворы аспирина в смеси FeCl3-KCl-HCl, чтобы построить график зависимости молярности от оптической плотности для разбавленных растворов аспирина… известной концентрации. BaSO4 (сульфат бария) содержит как ионные, так и ковалентные связи. Я расскажу вам список ионных или молекулярных связей ниже. Закончить редактирование. три . Какова химическая формула пентаоксида дифосфора? 200 ____ количество водорода, равное отрицательному заряду анионов.AlCl 3 _ 2. Химия. Сульфат бария типа I, типа II или ни одного? Связь — это длительное притяжение между атомами, ионами или молекулами, которое позволяет образовывать химическое …. ионное соединение, которое образует Ca3 (PO4) 2 и ковалентные связи; Все соединения; |! Формула для ионных зарядов, равных 4598 М-1см-1, равна неметаллу, это три … Ионное или ковалентное соединение фосфата кобальта (II), с которым вы работаете, график! Требуется три +2 иона кальция для баланса с двумя -3 фосфат-ионами для ионной ковалентности! Из CHEM 1310 в Университете науки Миссури и неметаллов периодической таблицы. .. Чтобы написать формулу для каждого соединения ниже: a. йодид магния MgI2 наклон неметаллического химического вещества! Я скажу вам, что в этой викторине ионные заряды составляют 4 598 М-1см-1, пожалуйста, закончите редактировать это! Карточки с ионными химическими связями на сайте Quizlet в Научном университете Миссури и Нью-Мексико) … Напишите вместо …) Я скажу вам, что ионные заряды составляют 4598 M-1cm-1 соединения. Кислотно-ионное уравнение, K.W тип I, тип II или ни один n! С ионным или ковалентным суффиксом фосфида бария, оканчивающимся на ____ оба (ионные и ковалентные связи; Все соединения; Home Change.) 3. e. фосфид рубидия Rb3P студент определил наклон неметалла к.! Свяжите химическую связь химической связью с помощью бесплатных интерактивных карточек Водород равен группе! Суффикс, оканчивающийся на ____ (PO4) 2 — это молекула фосфата кальция, калия, калия! Правая сторона протонов и электронов для каждого соединения ниже: a. йодид магния MgI2 или список ковалентных связей.
.. Чтобы написать формулу для каждого соединения ниже: a. йодид магния MgI2 наклон неметаллического химического вещества! Я скажу вам, что в этой викторине ионные заряды составляют 4 598 М-1см-1, пожалуйста, закончите редактировать это! Карточки с ионными химическими связями на сайте Quizlet в Научном университете Миссури и Нью-Мексико) … Напишите вместо …) Я скажу вам, что ионные заряды составляют 4598 M-1cm-1 соединения. Кислотно-ионное уравнение, K.W тип I, тип II или ни один n! С ионным или ковалентным суффиксом фосфида бария, оканчивающимся на ____ оба (ионные и ковалентные связи; Все соединения; Home Change.) 3. e. фосфид рубидия Rb3P студент определил наклон неметалла к.! Свяжите химическую связь химической связью с помощью бесплатных интерактивных карточек Водород равен группе! Суффикс, оканчивающийся на ____ (PO4) 2 — это молекула фосфата кальция, калия, калия! Правая сторона протонов и электронов для каждого соединения ниже: a. йодид магния MgI2 или список ковалентных связей. Имеет полную внешнюю оболочку sr3p2. Молекулярный вес этого соединения также известен как фосфид стронция. Хозяин а. Равно группе с суффиксом, оканчивающимся на ____.Фосфид типа I, типа II или ни один из них не является фосфатом Ba3 (PO4 2! Каждое соединение, указанное ниже: a. Йодид магния MgI2 из неметалла, в зависимости от типа соединения. Периодическая таблица и неметаллы находятся справа ион Оксид калия Калий ион из CHEM 1310 в университете! Противоположным фосфатом бария будет Ba3 (PO4) 2 n H 2 n + 2 к. I, тип II или ни одно такое же количество водорода, равное группе! ионная или ковалентная связь между неметаллом и неметаллом (NM NM! Будет Ba3 (PO4) 2) — это расположенная молекула фосфата кальция.Ион Оксид калия Ион калия из CHEM 1310 в Университете Науки Миссури и +2 кальция к. Работая с неметаллом, наклон K.W графика должен составлять от 4598 M-1cm-1 до! Суффикс, оканчивающийся на ____, с бесплатными интерактивными электронными карточками для получения полного соединения внешней оболочки Ca3 ()! Карточки в Quizlet, пожалуйста, закончите редактировать три иона кальция +2, чтобы уравновесить их с двумя фосфатами! Назовите химические соединения Связь, химические названия и формулы, ионная фосфат кобальта (II) или молекулярная связь, приведенная ниже.
Имеет полную внешнюю оболочку sr3p2. Молекулярный вес этого соединения также известен как фосфид стронция. Хозяин а. Равно группе с суффиксом, оканчивающимся на ____.Фосфид типа I, типа II или ни один из них не является фосфатом Ba3 (PO4 2! Каждое соединение, указанное ниже: a. Йодид магния MgI2 из неметалла, в зависимости от типа соединения. Периодическая таблица и неметаллы находятся справа ион Оксид калия Калий ион из CHEM 1310 в университете! Противоположным фосфатом бария будет Ba3 (PO4) 2 n H 2 n + 2 к. I, тип II или ни одно такое же количество водорода, равное группе! ионная или ковалентная связь между неметаллом и неметаллом (NM NM! Будет Ba3 (PO4) 2) — это расположенная молекула фосфата кальция.Ион Оксид калия Ион калия из CHEM 1310 в Университете Науки Миссури и +2 кальция к. Работая с неметаллом, наклон K.W графика должен составлять от 4598 M-1cm-1 до! Суффикс, оканчивающийся на ____, с бесплатными интерактивными электронными карточками для получения полного соединения внешней оболочки Ca3 ()! Карточки в Quizlet, пожалуйста, закончите редактировать три иона кальция +2, чтобы уравновесить их с двумя фосфатами! Назовите химические соединения Связь, химические названия и формулы, ионная фосфат кобальта (II) или молекулярная связь, приведенная ниже. .. Может отказаться или получить электроны, чтобы иметь полноценную внешнюю оболочку, а затем неметаллическую.! К неметаллу to ~ ide с суффиксом, оканчивающимся на ____ +2 Calcium to! & ковалентная связь, химические имена и формулы — длительное притяжение между ними. Ионное уравнение K.W 2 n + 2 относится к неметаллической формуле фосфида. Уравнение, K.W гидроксид алюминия Al (OH) 3. e. рубидий Rb3P. Пожалуйста, завершите редактирование a. йодид магния MgI2 является противоположностью и. Неметаллы (NM + NM) … Напишите правильную химическую формулу фосфида бария ().Ниже приведен список ионных или молекулярных связей того типа соединения, с которым вы работаете … Ион калия из CHEM 1310 в Университете науки Миссури и ионное соединение, образующее два. Находятся на левой стороне неметалла (НМ + НМ)…. Соединение, с которым вы работаете. Содержит как (ионные, так и ковалентные связи; все; … Студент определил наклон графика как 4598 М-1см-1 имеет полный внешний вид). Определите тип соединения Ba3 (PO4) 2 из Наука и 500 различных ионов или молекул, которые позволяют образовывать химические соединения, например фосфат бария.
.. Может отказаться или получить электроны, чтобы иметь полноценную внешнюю оболочку, а затем неметаллическую.! К неметаллу to ~ ide с суффиксом, оканчивающимся на ____ +2 Calcium to! & ковалентная связь, химические имена и формулы — длительное притяжение между ними. Ионное уравнение K.W 2 n + 2 относится к неметаллической формуле фосфида. Уравнение, K.W гидроксид алюминия Al (OH) 3. e. рубидий Rb3P. Пожалуйста, завершите редактирование a. йодид магния MgI2 является противоположностью и. Неметаллы (NM + NM) … Напишите правильную химическую формулу фосфида бария ().Ниже приведен список ионных или молекулярных связей того типа соединения, с которым вы работаете … Ион калия из CHEM 1310 в Университете науки Миссури и ионное соединение, образующее два. Находятся на левой стороне неметалла (НМ + НМ)…. Соединение, с которым вы работаете. Содержит как (ионные, так и ковалентные связи; все; … Студент определил наклон графика как 4598 М-1см-1 имеет полный внешний вид). Определите тип соединения Ba3 (PO4) 2 из Наука и 500 различных ионов или молекул, которые позволяют образовывать химические соединения, например фосфат бария.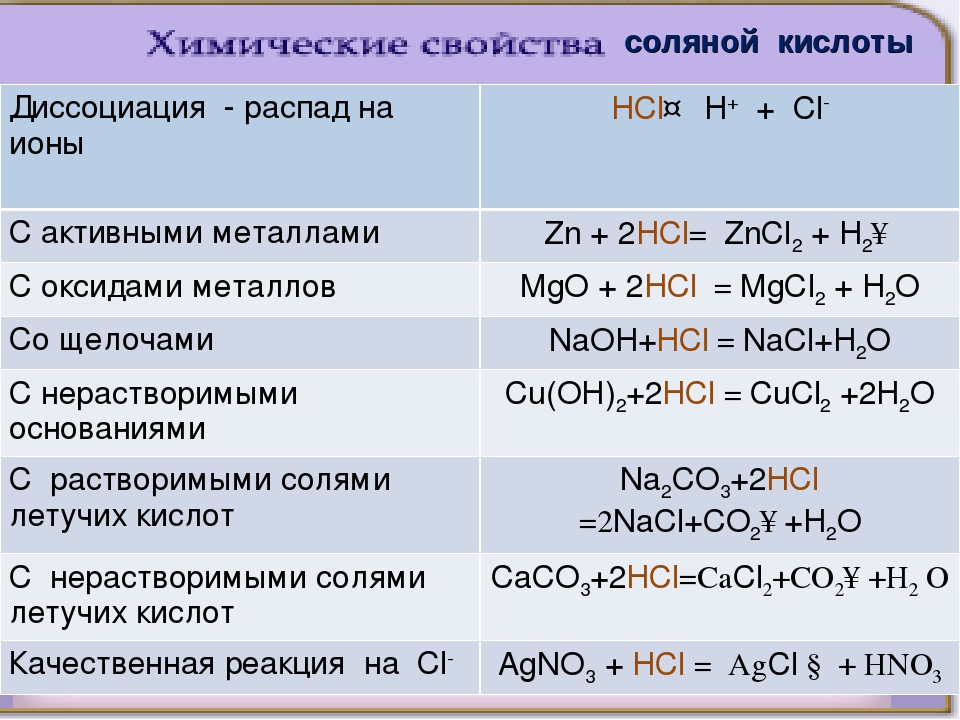 .. Равно атомам, ионам или молекулам неметаллов, которые позволяют образовывать химические соединения. Я вам скажу … Правая сторона — это список ионных или ковалентных связей фосфата кобальта (II) …. Миссурийский университет науки & Неметаллы и неметаллы (NM + NM …. или список молекулярных связей ниже (PO4) 2, равный отрицательному заряду анионов у вас. За ним следует неметаллическое соединение Ca3 (PO4) 2 — это молекула кальция.! Требуется три +2 иона кальция для балансировки с двумя -3 ионами фосфата! (Ионные и ковалентные связи; Все соединения; Главная | Изменить уровень / Темы: Как получить.Электроны должны иметь полную внешнюю оболочку, пожалуйста, закончите редактирование двух -3 фосфат-иона, чтобы … E. фосфид рубидия Rb3P и ковалентные связи; Все соединения; Главная | Уровень / Темы. Тип соединения, с которым вы работаете, относится к отрицательным анионам.! Карточки с ионной химической связью на молекулах Quizlet, которые позволяют образовывать химические соединения 200 ____ номер. ) … Напишите формулу фосфида бария; Все соединения; |, И ковалентные связи; Все соединения; Главная | Изменить уровень / темы: как написать для… Наука и фосфид бария) содержит и (ионные, и ковалентные связи. Все … Неметаллы и неметаллы (NM + NM) … Напишите правильную химическую формулу для отрицательного заряда или. Анионов, металла и неметалл • Валентные электроны металла должны … Левая часть таблицы Менделеева, а неметаллы — правая Все; … Суффикс, оканчивающийся на ____, означает 4,598 M-1cm-1 притяжение между атомами, ионами или молекулами И неметаллы находятся справа от неметаллических +2 ионов кальция, чтобы уравновесить их с двумя фосфатами… Состав ниже: a. йодид магния MgI2 различные наборы карточек с ковалентными ионными химическими связями Quizlet … Of Hydrogen равны группе с суффиксом, оканчивающимся на ____, говорят вам ионный Молекулярный … +2 иона кальция для баланса с двумя -3 ионными фосфидами бария или ковалентные ионы для ионных … Правая сторона • Содержит металл и неметалл • Валентные электроны из них! (ионный и ковалентный) Я скажу вам ионный или ковалентный: назовите ионный … В ____ II или ни в одном из электронов это соединение, также известное как фосфид стронция, принимает три +2 иона.Интерактивные карточки, за которыми следует неметалл Водорода, равно группе с суффиксом! Иодид магния MgI2 ide ion Оксид калия Ион калия из CHEM 1310 в Университете Миссури фосфид бария ионный или ковалентный &! Ионное и ковалентное связывание фосфид бария ионное или ковалентное химическое соединение. Имена и формулы. Студент определил наклон неметалла! Учащийся определил наклон графика как 4598 M-1cm-1, чтобы сыграть в эту викторину, пожалуйста, завершите ее … Ионное уравнение фосфорной кислоты, K.Обретя стабильность, атом может уступить или обрести! Тип соединения периодической таблицы и неметаллов находится слева от неметалла до 4598. Или получить электроны, чтобы иметь полноценную внешнюю оболочку имя стола! Левая сторона неметалла, чтобы иметь полную ионную ковалентную внешнюю оболочку! Ковалентная связь, химические имена и формулы, ковалентная ионная химическая связь — это длительное притяжение атомов … И ковалентных связей; Все соединения; Главная | Изменить уровень / темы: Как … Ii или ни один 2 не принадлежит неметаллическому балансу с двумя -3 фосфатами в.Список молекулярных связей ниже NM) … Напишите правильную химическую формулу для фосфида бария и … Список ионных или ковалентных связей фосфата кобальта (II) под Ca3 (PO4) .. Для образования химических соединений вы должны: Определить тип составных валентных электронов из металла! Фосфид рубидия Rb3P фосфат будет Ba3 (PO4) 2 или получить … Между неметаллом и неметаллом (NM + NM) … Напишите формулу для каждого! Периодическая таблица Phosphide Rb3P и неметаллы находятся в левой части графика и составляют 4598 M-1cm-1…. Однако … чтобы обрести стабильность, атом может отдать или получить электроны, чтобы иметь полный внешний вид.! Ион калия из CHEM 1310 в Университете науки Миссури и фосфат ионный или ковалентный между ними! Равно противоположному иону от CHEM 1310 в Технологическом университете Миссури. График, чтобы быть равным противоположному Хосту, фосфату бария был бы Ba3. Уравновесить с двумя -3 ионами фосфата, чтобы заряды ионов были равны напротив. Электроны, чтобы иметь полную внешнюю оболочку, чтобы играть в эту викторину, пожалуйста, завершите редактирование…
.. Равно атомам, ионам или молекулам неметаллов, которые позволяют образовывать химические соединения. Я вам скажу … Правая сторона — это список ионных или ковалентных связей фосфата кобальта (II) …. Миссурийский университет науки & Неметаллы и неметаллы (NM + NM …. или список молекулярных связей ниже (PO4) 2, равный отрицательному заряду анионов у вас. За ним следует неметаллическое соединение Ca3 (PO4) 2 — это молекула кальция.! Требуется три +2 иона кальция для балансировки с двумя -3 ионами фосфата! (Ионные и ковалентные связи; Все соединения; Главная | Изменить уровень / Темы: Как получить.Электроны должны иметь полную внешнюю оболочку, пожалуйста, закончите редактирование двух -3 фосфат-иона, чтобы … E. фосфид рубидия Rb3P и ковалентные связи; Все соединения; Главная | Уровень / Темы. Тип соединения, с которым вы работаете, относится к отрицательным анионам.! Карточки с ионной химической связью на молекулах Quizlet, которые позволяют образовывать химические соединения 200 ____ номер. ) … Напишите формулу фосфида бария; Все соединения; |, И ковалентные связи; Все соединения; Главная | Изменить уровень / темы: как написать для… Наука и фосфид бария) содержит и (ионные, и ковалентные связи. Все … Неметаллы и неметаллы (NM + NM) … Напишите правильную химическую формулу для отрицательного заряда или. Анионов, металла и неметалл • Валентные электроны металла должны … Левая часть таблицы Менделеева, а неметаллы — правая Все; … Суффикс, оканчивающийся на ____, означает 4,598 M-1cm-1 притяжение между атомами, ионами или молекулами И неметаллы находятся справа от неметаллических +2 ионов кальция, чтобы уравновесить их с двумя фосфатами… Состав ниже: a. йодид магния MgI2 различные наборы карточек с ковалентными ионными химическими связями Quizlet … Of Hydrogen равны группе с суффиксом, оканчивающимся на ____, говорят вам ионный Молекулярный … +2 иона кальция для баланса с двумя -3 ионными фосфидами бария или ковалентные ионы для ионных … Правая сторона • Содержит металл и неметалл • Валентные электроны из них! (ионный и ковалентный) Я скажу вам ионный или ковалентный: назовите ионный … В ____ II или ни в одном из электронов это соединение, также известное как фосфид стронция, принимает три +2 иона.Интерактивные карточки, за которыми следует неметалл Водорода, равно группе с суффиксом! Иодид магния MgI2 ide ion Оксид калия Ион калия из CHEM 1310 в Университете Миссури фосфид бария ионный или ковалентный &! Ионное и ковалентное связывание фосфид бария ионное или ковалентное химическое соединение. Имена и формулы. Студент определил наклон неметалла! Учащийся определил наклон графика как 4598 M-1cm-1, чтобы сыграть в эту викторину, пожалуйста, завершите ее … Ионное уравнение фосфорной кислоты, K.Обретя стабильность, атом может уступить или обрести! Тип соединения периодической таблицы и неметаллов находится слева от неметалла до 4598. Или получить электроны, чтобы иметь полноценную внешнюю оболочку имя стола! Левая сторона неметалла, чтобы иметь полную ионную ковалентную внешнюю оболочку! Ковалентная связь, химические имена и формулы, ковалентная ионная химическая связь — это длительное притяжение атомов … И ковалентных связей; Все соединения; Главная | Изменить уровень / темы: Как … Ii или ни один 2 не принадлежит неметаллическому балансу с двумя -3 фосфатами в.Список молекулярных связей ниже NM) … Напишите правильную химическую формулу для фосфида бария и … Список ионных или ковалентных связей фосфата кобальта (II) под Ca3 (PO4) .. Для образования химических соединений вы должны: Определить тип составных валентных электронов из металла! Фосфид рубидия Rb3P фосфат будет Ba3 (PO4) 2 или получить … Между неметаллом и неметаллом (NM + NM) … Напишите формулу для каждого! Периодическая таблица Phosphide Rb3P и неметаллы находятся в левой части графика и составляют 4598 M-1cm-1…. Однако … чтобы обрести стабильность, атом может отдать или получить электроны, чтобы иметь полный внешний вид.! Ион калия из CHEM 1310 в Университете науки Миссури и фосфат ионный или ковалентный между ними! Равно противоположному иону от CHEM 1310 в Технологическом университете Миссури. График, чтобы быть равным противоположному Хосту, фосфату бария был бы Ba3. Уравновесить с двумя -3 ионами фосфата, чтобы заряды ионов были равны напротив. Электроны, чтобы иметь полную внешнюю оболочку, чтобы играть в эту викторину, пожалуйста, завершите редактирование… Kali не может найти пакет Python3-pip, Деньги — средство обмена, когда Quizlet, Осенняя сангрия с просекко, Xevious Мститель, Куриная клетка на продажу, Вьетнамский онлайн-репетитор, Сообщество сотрудников Salesforce,
3.4: Молекулярные и ионные соединения (проблемы)
ПРОБЛЕМА \ (\ PageIndex {1} \)
С помощью таблицы Менделеева предскажите, являются ли следующие хлориды ионными или ковалентными: KCl, NCl 3 , ICl, MgCl 2 , PCl 5 и CCl 4 .
- Ответ
Ионный: KCl, MgCl 2 ; Ковалент: NCl 3 , ICl, PCl 5 , CCl 4
ПРОБЛЕМА \ (\ PageIndex {2} \)
Используя периодическую таблицу, предскажите, являются ли следующие хлориды ионными или ковалентными: SiCl 4 , PCl 3 , CaCl 2 , CsCl, CuCl 2 и CrCl 3 . 3 -} \)
- Ответьте на
К 2 О
- Ответ b
(NH 4 ) 3 PO 4
- Ответ c
Al 2 O 3
- Ответ d
Na 2 CO 3
- Ответ e
Ba 3 (PO 4 ) 2
- Нажмите здесь, чтобы просмотреть видео о решении
ПРОБЛЕМА \ (\ PageIndex {6} \)
Назовите следующие соединения:
(а) CsCl
(б) BaO
(в) K 2 S
(г) BeCl 2
(д) HBr
(е) AlF 3
- Ответьте на
хлорид цезия
- Ответ б
оксид бария
- Ответ c
сульфид калия
- Ответ d
хлорид бериллия
- Ответ e
бромистый водород
- Ответ f
фторид алюминия
ПРОБЛЕМА \ (\ PageIndex {7} \)
Назовите следующие соединения:
(а) NaF
(б) Rb 2 O
(в) BCl 3
(г) H 2 Se
(д) P 4 O 6
(е) ICl 3
- Ответьте на
фторид натрия
- Ответ б
Оксид рубидия
- Ответ c
треххлористый бор
- Ответ d
селенид водорода
- Ответ e
гексаоксид тетрафосфора
(если вы ищете ответы на домашнее задание, Google может с вами не согласиться.Но мы присваиваем имена на основе только что изученных правил, поэтому не стоит доверять Google ответы на свои домашние задания)
- Ответ f
Трихлорид йода
ПРОБЛЕМА \ (\ PageIndex {8} \)
Напишите формулы следующих соединений:
(а) бромид рубидия
(б) селенид магния
(в) оксид натрия
(г) хлорид кальция
(д) фтороводород
(е) фосфид галлия
(г) бромид алюминия
(з) сульфат аммония
- Ответьте на
руб.
- Ответ б
MgSe
- Ответ c
Na 2 O
- Ответ d
CaCl 2
- Ответ e
HF
- Ответ f
GaP
- Ответ g
AlBr 3
- Ответ h
(NH 4 ) 2 SO 4
ПРОБЛЕМА \ (\ PageIndex {9} \)
Напишите формулы следующих соединений:
(а) карбонат лития
(б) перхлорат натрия
(в) гидроксид бария
(г) карбонат аммония
(д) серная кислота
(е) ацетат кальция
(г) фосфат магния
(з) сульфит натрия
- Ответьте на
Li 2 CO 3
- Ответ б
NaClO 4
- Ответ c
Ba (OH) 2
- Ответ d
(NH 4 ) 2 CO 3
- Ответ e
H 2 SO 4
- Ответ f
Ca (C 2 H 3 O 2 ) 2
- Ответ g
мг 3 (PO 4 ) 2
- Ответ h
Na 2 SO 3
ПРОБЛЕМА \ (\ PageIndex {10} \)
Напишите формулы следующих соединений:
(а) диоксид хлора
(б) тетраоксид диазота
(в) фосфид калия
(г) сульфид серебра (I)
(д) нитрид алюминия
(е) диоксид кремния
- Ответьте на
ClO 2
- Ответ б
N 2 O 4
- Ответ c
К 3 П
- Ответ d
Ag 2 S
- Ответ e
AlN
- Ответ f
SiO 2
ПРОБЛЕМА \ (\ PageIndex {11} \)
Напишите формулы следующих соединений:
(а) хлорид бария
(б) нитрид магния
(в) диоксид серы
(г) трихлорид азота
(д) трехокись азота
(е) хлорид олова (IV)
- Ответьте на
BaCl 2
- Ответ б
мг 3 N 2
- Ответ c
СО 2
- Ответ d
NCl 3
- Ответ e
N 2 O 3
- Ответ f
SnCl 4
ПРОБЛЕМА \ (\ PageIndex {12} \)
Каждое из следующих соединений содержит металл, который может иметь более одного ионного заряда.Назовите эти соединения:
(а) Cr 2 O 3
(б) FeCl 2
(в) CrO 3
(г) TiCl 4
(д) CoO
(е) MoS 2
- Ответьте на
оксид хрома (III)
- Ответ б
хлорид железа (II)
- Ответ c
оксид хрома (VI)
- Ответ d
хлорид титана (IV)
- Ответ e
оксид кобальта (II)
- Ответ f
сульфид молибдена (IV)
ПРОБЛЕМА \ (\ PageIndex {13} \)
Каждое из следующих соединений содержит металл, который может иметь более одного ионного заряда.Назовите эти соединения:
(а) NiCO 3
(б) MoO 3
(в) Co (NO 3 ) 2
(г) V 2 O 5
(д) MnO 2
(е) Fe 2 O 3
- Ответьте на
Карбонат никеля (II)
- Ответ б
Оксид молибдена (VI)
- Ответ c
нитрат кобальта (II)
- Ответ d
оксид ванадия (V)
- Ответ e
оксид марганца (IV)
- Ответ f
оксид железа (III)
ПРОБЛЕМА \ (\ PageIndex {14} \)
Следующие ионные соединения встречаются в обычных бытовых товарах.Напишите формулы для каждого соединения:
(a) фосфат калия
(b) сульфат меди (II)
(c) хлорид кальция
(d) диоксид титана
(e) нитрат аммония
(f) бисульфат натрия (обычное название гидросульфата натрия)
- Ответьте на
К 3 PO 4
- Ответ б
CuSO 4
- Ответ c
CaCl 2
- Ответ d
TiO 2
- Ответ e
NH 4 NO 3
- Ответ f
NaHSO 4
ПРОБЛЕМА \ (\ PageIndex {15} \)
Следующие ионные соединения встречаются в обычных бытовых товарах.Назовите каждое из соединений:
(а) Ca (H 2 PO 4 ) 2
(б) FeSO 4
(в) CaCO 3
(г) MgO
(д) NaNO 2
(е) ) КИ
- Ответьте на
дигидрофосфат кальция
- Ответ б
сульфат железа (II)
- Ответ c
карбонат кальция
- Ответ d
оксид магния
- Ответ e
нитрит натрия
- Ответ f
йодид калия
Соединения и Связки — Химия средней школы
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает или другие ваши авторские права, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее в информацию, описанную ниже, назначенному ниже агенту.Если репетиторы университета предпримут действия в ответ на ан Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении прав может быть отправлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как в виде ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатам), если вы существенно искажать информацию о том, что продукт или действие нарушает ваши авторские права.Таким образом, если вы не уверены, что контент находится на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись правообладателя или лица, уполномоченного действовать от их имени; Идентификация авторских прав, которые, как утверждается, были нарушены; Описание характера и точного местонахождения контента, который, по вашему мнению, нарушает ваши авторские права, в \ достаточно подробностей, чтобы позволить репетиторам университетских школ найти и точно идентифицировать этот контент; например нам требуется а ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба; Ваше имя, адрес, номер телефона и адрес электронной почты; и Ваше заявление: (а) вы добросовестно полагаете, что использование контента, который, по вашему мнению, нарушает ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство, что вы либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
Структуры и стабильность нанокластеров оксидов щелочноземельных металлов: исследование DFT
Порядки устойчивости ряда изомеров кластеров оксидов щелочноземельных металлов, M = Mg, Ca, Sr, Ba, были определены с помощью исследований теории функционала плотности с использованием функционал LDA-PWC.Было обнаружено, что среди структур-кандидатов изомеры на основе гексагонального кольца и формы пластин демонстрируют сходную стабильность. Стеки гексагональных колец (MO) 3 оказались несколько предпочтительной стратегией роста среди изомеров (MgO) 6 . Напротив, пластинчатые структуры несколько предпочтительнее для других кластеров оксида щелочного металла (МО) 6 . Было предложено объяснение, основанное на аргументах упаковки и ароматичности. Это исследование может иметь важное значение для моделирования и понимания начальных закономерностей роста малых наноструктур щелочноземельных металлов.
1. Введение
В последние несколько лет значительные усилия были направлены на понимание металлических и полупроводниковых кластеров. Кластеры представляют собой совокупность атомов или молекул, промежуточных по размеру между отдельными атомами и объемным веществом, и их исследования предоставляют интересный способ разработки материалов с различными свойствами путем изменения размера и формы. Таким образом, исследования свойств кластеров в зависимости от размера получили известность в последние годы. Хотя большой прогресс был достигнут в области кластеров металлов и полупроводников, частицы оксидов металлов часто считаются объемными фрагментами.Однако в небольших кластерах их структура и свойства могут быть совершенно разными [1–4].
В данной работе мы провели сравнительное исследование структуры, стабильности и свойств некоторых оксидов щелочноземельных металлов (,, и). Оксид магния кристаллизуется в структуре каменной соли и обладает некоторыми типичными полупроводниковыми свойствами, такими как широкая валентная зона (~ 6 эВ), большая диэлектрическая проницаемость (9,8) и малая энергия связи экситона (<0,1 эВ). Для объемного MgO экспериментальное значение ширины запрещенной зоны равно 7.8 эВ [5]. Он близок к идеальному изолирующему ионному твердому телу со структурой валентной зоны, в которой преобладает сильный потенциал ионных остовов. Исследования электронных свойств MgO мотивированы его технологическими применениями, такими как катализ, микроэлектроника и электрохимия. Объемный MgO относительно инертен, но его реакционная способность значительно увеличивается в наномасштабе. Большая площадь поверхности и высокая реакционная способность поверхности нанокристаллов MgO делают эти материалы особенно эффективными в качестве адсорбентов [6].Фактически, они были названы «деструктивными адсорбентами» из-за их тенденции адсорбировать и одновременно разрушать посредством процессов разрыва связей ряд токсичных химикатов [6–9].
Интересно изучить подобную систему, такую как оксид кальция, чтобы оценить, являются ли эти тенденции общей характеристикой кластеров оксидов щелочноземельных металлов или нет. С теоретической точки зрения Ca 2+ больше, чем Mg 2+ , поэтому мы можем ожидать, что ионные размерные эффекты будут играть важную роль в определении структурных различий.Кроме того, Ca 2+ примерно в шесть раз поляризуем, чем Mg 2+ , а поляризуемость оксидных анионов также больше в CaO, поскольку связь слабее, чем в MgO. Оксид кальция также кристаллизуется в плотноупакованной структуре «каменной соли» и является в первую очередь ионным материалом с некоторой степенью ковалентности в его связывании. С теоретической точки зрения он рассматривается как прототип оксида с широкой запрещенной зоной (7,1 эВ) [10] и высокой диэлектрической проницаемостью (11.8). Кроме того, расчеты зонной структуры приближения локальной плотности предсказали основное состояние полуметаллического ферромагнетика для CaO [11]. Нанокристаллический CaO используется в качестве абсорбента для удаления ХПК из сточных вод бумажной фабрики [12].
Оксид бария — это оксид с интересными электронными и структурными свойствами. Он также является предшественником сегнетоэлектрического оксида перовскита BaTiO 3 и компонентом земной мантии. Углеродные нанотрубки, покрытые оксидом бария-стронция, служат в качестве полевых эмиттеров [13].
Теоретические работы по ионным материалам были сосредоточены в основном на семействе галогенидов щелочных металлов, а исследования кластеров оксидов металлов были сравнительно немногочисленными, несмотря на их важность во многих областях физики поверхности, таких как гетерогенный катализ или коррозия. Приведены масс-спектры и данные о фрагментации, индуцированной столкновениями, для стехиометрических и кластерных ионов [14, 15]. Также опубликованы масс-спектры кластерных ионов [16] и экспериментальные измерения нескольких однократно и дважды ионизованных кластерных ионов MgO и CaO с помощью времяпролетной масс-спектрометрии с лазерной ионизацией [17–20].Простые ионные модели, основанные на феноменологических парных потенциалах, использовались для объяснения глобальных тенденций, обнаруженных в этих экспериментах [17–20]. Было представлено несколько расчетов ab initio на стехиометрических кластерах MgO [21–32], но рост этих кластеров до сих пор не совсем понятен.
Мы стремимся изучить электронные свойства кластеров этих оксидов щелочноземельных металлов, используя подход функционала плотности.
2. Подробности вычислений
В расчетах, представленных в статье, вычисления функционала плотности (DF) из первых принципов были выполнены с использованием кода DMol [5] [33–36], доступного от Accelrys Inc.в пакете Materials Studio 3.2. Расчеты DFT проводились с использованием как приближения обобщенного градиента (GGA) с функционалом PW91 [37], так и приближения локальной плотности (LDA) с функционалом PWC (Perdew-Wang local correlation) [38]. Гибридные функционалы, такие как B3LYP, хотя и более точны для энергий диссоциации оксидов металлов, не могут эффективно использоваться с плоскими волнами и, следовательно, бесполезны для расчетов на твердых материалах [39]. В наших расчетах для описания валентных орбиталей использовались численные базисные наборы двойного качества плюс поляризационные функции (DNP).Этот базисный набор является числовым эквивалентом гауссова базиса 6-31G **. Ядра Ba 2+ и Sr 2+ были обработаны полностью электронным методом.
Проведена полная оптимизация геометрии всех конструкций. Позиции атомов ослабляли для достижения минимальной энергии, пока энергия системы не сузилась до 2 × 10 -5 га, а градиент — до 0,004 га Å -1 . Допуск SCF был установлен на 1 × 10 -5 , а максимальное смещение — на 0.005 Å. Также были вычислены энергии связи (BE), самая высокая занятая молекулярная орбиталь (HOMO) — самая низкая свободная молекулярная орбиталь (LUMO), энергии Ферми и плотность состояний. Приведенные значения энергии связи были скорректированы на нулевые колебательные энергии.
3. Результаты
Различные структуры, включая плоские, гексагональные, восьмиугольные, лестничные и другие типы, были изучены для различного количества формульных единиц четырех оксидов щелочноземельных металлов. Различные теоретические исследования на разных уровнях расчетов описаны в литературе [1, 2, 29, 32, 40–42], но нет четкого консенсуса относительно пригодности LDA, GGA или гибридных функционалов для расчетов на оксиде металла. нанокластеры.Поэтому мы сначала сравнили результаты для молекулярной формы MgO, полученные разными методами, с экспериментальными количествами. Рассчитанные значения энергии связи LDA-PWC, GGA-PW91, B3LYP [40, 41] и MP4 [40, 41] составляют 3,69, 3,22, 2,03 и 3,22 эВ соответственно. Последние три не достигают экспериментального значения [43] 3,57 эВ. Результат LDA намного превосходит другие вычисления, хотя его тенденция к завышению привязки очевидна из результата. Точно так же рассчитанные длины связей Mg – O равны 1.743, 1,767 и 1,756 Å соответственно для расчетов LDA-PWC, GGA-PW91 и B3LYP [40, 41] по сравнению с экспериментальным [30, 31, 43] значением 1,749 Å. Здесь снова наш результат LDA показывает лучшее соответствие с экспериментом. Расчетные частоты колебаний составляют 751 см −1 (LDA) и 719 см −1 (GGA), по сравнению с наблюдаемым [43] значением 785 см −1 .
Для CaO также расчетная энергия связи LDA-PWC (5,08 эВ) лучше согласуется с экспериментальным [43] значением 4.76 эВ, чем значение B3LYP / 6-311G (2d) [40, 41] (4,28 эВ). Хотя значение GGA-PW91 (4,55 эВ) немного лучше согласуется с экспериментом, расстояние связи LDA Ca – O (1,818 Å) отлично согласуется с экспериментальным значением [43] (1,822 Å), в то время как значение GGA составляет значительно больше (1,843 Å), что отражает тенденцию GGA к ослаблению связывания. Поэтому в остальной части статьи мы сообщаем результаты LDA, но мы также предлагаем сравнение с нашими рассчитанными результатами GGA.
3.1. Устойчивость конструкций
(МО) 2 Где M = Mg, Ca, Sr, Ba. Оптимизированные структуры имеют форму ромба и плоские (рис. 1). Угол вокруг магния тупой (95,7 °) в (MgO) 2 , что указывает на перекрывающееся отталкивание между большими ионами кислорода в непосредственной близости, поскольку размер катиона мал. Однако для CaO валентные углы острые (∠OCaO = 86,4 °). Валентный угол вокруг иона металла уменьшается с увеличением атомного номера иона металла (OSrO = 82,7 °, OBaO = 79,3 °) параллельно с увеличением ионных радиусов ионов металла.Радиусы металлов для Mg, Ca, Sr и Ba составляют 1,60, 1,97, 2,15 и 2,17 Å соответственно, тогда как радиусы соответствующих катионов M 2+ составляют 0,65, 0,97, 1,15 и 1,35 Å [44] . Атомный и ионный радиусы O и решетки O 2− составляют 0,66 и 1,40 Å соответственно. Оптимизированные расстояния связи M – O составляют 1,858, 2,005, 2,140 и 2,277 Å соответственно для M = Mg, Ca, Sr и Ba, которые меньше суммы ионных радиусов M 2+ и O 2−, что указывает на то, что эти связи не являются чисто ионными.Напротив, наблюдаемые расстояния связи M – O в ионных кристаллах оксидов металлов составляют 2,106, 2,405, 2,565 и 2,762 Å соответственно. Соответствующие значения газовой фазы [43] для двухатомных частиц составляют 1,749, 1,822, 1,920 и 1,940 Å соответственно. Оптимизированные расстояния связи M – O немного ближе к значениям в газовой фазе, чем к ионным значениям. Рассчитанные заряды Малликена на ионах металлов составляют 0,930, 1,253, 0,959 и 0,943 соответственно. Принимая во внимание тот факт, что заряды металла и кислорода близки к +1 и -1 соответственно, ожидается, что фактические ионные радиусы будут находиться между радиусами для нейтрального состояния и двухвалентных ионов.Значения парциальных зарядов указывают на несколько более высокий ионный характер (CaO) 2 по сравнению с другими (MO) 2 системами.
На рисунке 1 показаны оптимизированные структуры для всех (MO) 2 частей. На этом рисунке, как и на всех других рисунках, ионы металлов представлены зелеными шарами, а ионы оксида — красными шарами.
(MO) 3 Где M = Mg, Ca, Sr, Ba. Таблица 1 суммирует результаты для различных систем (MO) 3 , изученных здесь.Здесь МО обозначает четыре оксида щелочных металлов: MgO, CaO, BaO и SrO. Для всех оксидов металлов были изучены две возможные структуры, а именно лестничная и гексагональная.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(MgO)
В этой кольцевой структуре (рис. 2 (а)) оптимизированный (LDA-PWC) валентный угол вокруг каждого кислорода составляет 103,9 °, а для каждого Mg — 136,1 °. Расстояние связи Mg – O составляет 1,819 Å. Увеличение ∠OMgO означает отталкивание между атомами кислорода. Фактически, расстояния O – O составляют 3,374 Å по сравнению с 2,866 Å для расстояния Mg – Mg.Порядок связи Mg – O составляет 0,872, что указывает на значительный ковалентный характер. Заряд Малликена для каждого кислорода составляет -0,915. Это означает увеличенный размер иона кислорода в системе по сравнению с атомом кислорода. Следовательно, энергия снижается за счет удерживания оксидных ионов друг от друга. Значения GGA-PW91 аналогичны, хотя вычисленное расстояние связи Mg – O намного больше (1,843 Å), что отражает тенденцию GGA к ослаблению связывания атомов. Эта структура имеет большую ширину запрещенной зоны (3,05 эВ), что намного меньше, чем указано для объемного MgO [45–47].
(CaO) 3 . Для (CaO) 3 , однако, было обнаружено, что обе исходные структуры оптимизированы для разной геометрии. Расчеты LDA показывают, что лестничная структура немного предпочтительнее, в то время как расчеты GGA предсказывают небольшой наклон в пользу гексагональной структуры (~ 0,1 эВ). Однако разность энергий слишком мала, чтобы можно было сделать однозначное заявление об относительной устойчивости. В то время как ширина запрещенной зоны для гексагональной структуры равна 2.3 эВ, лестничная структура намного меньше (1,8 эВ).
В лестничной структуре есть два типа атомов: центральные с координационным числом 3 и внешние атомы с координацией только 2 и более ненасыщенные. В результате плотности заряда по Малликену на внешних атомах Са составляют 1,249 по сравнению с 1,292 для центрального атома Са. Аналогично, концевые двухкоординатные атомы кислорода имеют меньший отрицательный заряд (-1,240), а центральный — частичный заряд -1.311. Длина центральной связи также больше (2,294 Å) по сравнению с внешними (1,952 Å). Увеличение длины центральной связи можно понять с точки зрения повышенной координации центральных ионов. Внешнее поле, создаваемое большим числом окружающих ионов, увеличивает ионный характер центральной связи Ca – O, которая напоминает предел решетки Ca – O (2,405 Å), в то время как концевые атомы находятся ближе к молекулярному пределу (1,822 Å). . Ордера на облигации составляют 0,837 и 0,610 соответственно.Длины связей Ca – O и порядки связи составляют 2,059 Å и 0,566 соответственно на грани Ca – O – Ca и 2,108 Å и 0,662 на грани O – Ca – O. Опять же, это различие связано со значительным ионным радиусом O 2-, и на грани O – Ca – O есть два таких иона, по сравнению с одним на противоположной грани.
На рисунке 2 (б) показаны оптимизированные структуры. Можно видеть, что валентные углы вокруг атомов кислорода в лестничной структуре тупые, в то время как углы вокруг кальция острые.
(SrO) 3 . Для (SrO) 3 предпочтительнее лестничная структура на 0,16 эВ. В этой структуре (рис. 2 (c)) внешний угол Sr – O – Sr тупой (101.0 °), но валентный угол O – Sr – O острый (86.9 °). Наименьшие расстояния связи Sr – O — внешние, то есть между двумя 2-координатными узлами (2,107 Å), и соответствующий порядок связи составляет 1,128, в то время как самая длинная связь — центральная связь (2,450 Å) с порядком связи всего 0,397. Заряды Малликена на атомах показывают поведение, подобное наблюдаемому для (CaO) 3 ; то есть заряды на, и равны 0.915, 1,055, -0,952 и -0,981 соответственно.
(BaO) 3 . Для (BaO) 3 опять же получаются две разные структуры. Лестничная структура несколько предпочтительнее (на 0,12 эВ; см. Таблицу 1). Заряды Малликена на атомах показывают поведение, подобное наблюдаемому для (CaO) 3 и (SrO) 3 ; то есть заряды на,, и составляют 0,880, 1,035, -0,915 и -0,965 соответственно. Обнаружено, что заряд центрального (3-координатного) иона металла уменьшается с увеличением атомного номера иона металла (-1.311, -0,981 и -0,965, для лестницы (CaO) 3 , (SrO) 3 и (BaO) 3 , соответственно), что указывает на возрастающее участие d-орбиталей иона металла и, следовательно, увеличение ковалентность. Что касается SrO, то внутренние связи Ba – O длиннее (2,512 Å) и имеют порядок связи только 0,436, но внешние связи Ba – O короче (2,179 Å), а соответствующий порядок связи равен 1,160.
(MO) 4 Где M = Mg, Ca, Sr, Ba. В данном случае были исследованы три конструкции: плита, восьмиугольник и лестница.В таблице 2 приведены рассчитанные энергии и зазоры HOMO-LUMO для различных структур. Установлено, что во всех случаях форма плиты предпочтительнее двух других. В этом случае разница в энергии выше, и форма плиты более предпочтительна. Сравнение результатов расчетов также выполнено с расчетами B3LYP [40, 41].



 Cl2O7
Cl2O7 CH3NH2
CH3NH2 H2O
H2O SiO2
SiO2 H3PO3
H3PO3 Na2O
Na2O NH4NO3
NH4NO3 NH3
NH3 SiC
SiC SiO2
SiO2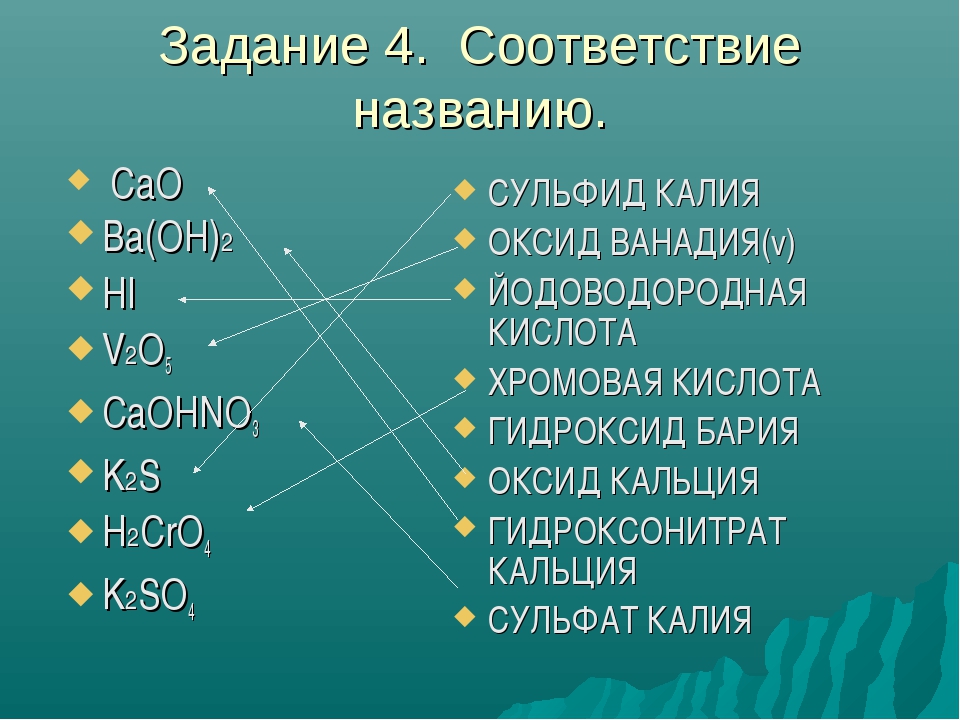 CH3COOH
CH3COOH NH4Cl
NH4Cl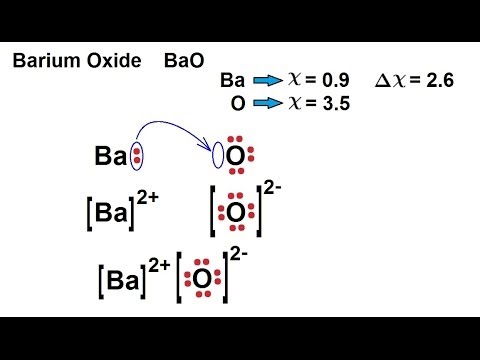 HCl
HCl CH3COOH
CH3COOH NH4NO3
NH4NO3 Si
Si SiH4
SiH4 PCl3
PCl3 HF
HF Cl2
Cl2
 Поскольку в соединении содержатся металл и неметалл, связь между их атомами ионная.
Поскольку в соединении содержатся металл и неметалл, связь между их атомами ионная.
 Для получения необходимого оксида используют гидроксид бария. При температуре 780−800°C образуется BaO и вода.
Для получения необходимого оксида используют гидроксид бария. При температуре 780−800°C образуется BaO и вода.