Химическая связь: определение, типы, свойства

Содержание:
Химическая связь, ее типы, свойства, наряду с химическими реакциями является одним из краеугольных камней интересной науки под названием химия. В этой статье мы разберем все аспекты химических связей, их значение в науке, приведем примеры и многое другое.
Что такое химическая связь
Под химической связью в химии понимается взаимное сцепление атомов в молекуле и кристаллической решетке, в результате действия силы притяжения, существующей между атомами. Именно благодаря химическим связям происходит образование различных химических соединений, в этом заключается природа химической связи.
Типы химических связей
Механизм образования химической связи сильно зависит от ее типа или вида, в целом различаются такие основные виды химической связи:
- Ковалентная химическая связь (которая в свою очередь может быть полярной и неполярной)
- Ионная связь
- Водородная связь
- Химическая связь металлов
подобных людям.
Что касается ковалентной химической связи, то на нашем сайте ей посвящена отдельная статья, и более детально вы можете почитать по ссылке. Далее же мы разберем более детально все другие основные типы химических связей.
Ионная химическая связь
Образование ионной химической связи возникает при взаимном электрическом притяжении двух ионов, имеющих разные заряды. Ионы обычно при таких химических связях простые, состоящие из одного атома вещества.
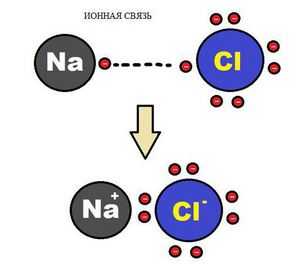
Схема ионной химической связи.
Характерной особенностью ионного типа химичечкой связи является отсутствие у нее насыщенности, и как результат, к иону или даже целой группе ионов может присоединиться самое разное количество противоположно заряженных ионов. Примером ионной химической связи может служить соединение фторида цезия CsF, в котором уровень «ионости» составляет практически 97%.
Водородная химическая связь
Еще задолго до появления современной теории химических связей в ее современном виде учеными химиками было замечено, что соединения водорода с неметаллами обладают различными удивительными свойствами. Скажем, температура кипения воды и вместе со фтороводородом гораздо выше, чем это могло бы быть, вот вам готовый пример водородной химической связи.

На картинке схема образования водородной химической связи.
Природа и свойства водородной химической связи обусловлены способностью атома водорода H образовывать еще одну химическую связь, отсюда собственно и название этой связи. Причиной образования такой связи являются свойства электростатических сил. Например, общее электронное облако в молекуле фтороводорода настолько смещено в сторону фтора, что пространство вокруг атома этого вещества насыщено отрицательным электрическим полем. Вокруг атома водорода, тем более лишенного своего единственного электрона, все с точностью до наоборот, его электронное поле значительно слабее и как следствие имеет положительный заряд. А положительные и отрицательные заряды, как известно, притягиваются, таким нехитрым образом и возникает водородная связь.
Химическая связь металлов
Какая химическая связь характерна для металлов? У этих веществ есть свой собственный тип химической связи – атомы всех металлов расположены не абы как, а определенным образом, порядок их расположения называется кристаллической решеткой. Электроны различных атомов образуют общее электронное облако, при этом они слабо взаимодействуют друг с другом.

В качестве примера металлической химической связи могут выступать любые металлы: натрий, железо, цинк и так далее.
Как определить вид химической связи
В зависимости от веществ, принимающих в ней участие, если метал и неметалл, то связь ионная, если два метала, то металлическая, если два неметалла то ковалентная.
Свойства химических связей
Чтобы провести сравнение разных химических реакций используются разные количественные характеристики, такие как:
- длина,
- энергия,
- полярность,
- порядок связей.
Разберем их подробнее.
Длина связи – равновесное расстояние между ядрами атомов, которые соединены химической связью. Обычно измеряется экспериментально.
Энергия химической связи определяет ее прочность. В данном случае под энергией подразумевается усилие, необходимое, для того, чтобы разорвать химическую связь и разъединить атомы.
Полярность химической связи показывает, насколько электронная плотность смещена к одному из атомов. Способность атомов смещать к себе электронную плотность или говоря простым языком «тянуть одеяло на себя» в химии называют электроотрицательностью.
Порядок химической связи (другими словами кратность химической связи) – это число электронных пар, вступающих в химическую связь. Порядок может быть, как целым, так и дробным, чем он выше, тем большее число электронов осуществляют химическую связь и тем труднее ее разорвать.
Химическая связь, видео
И в завершение познавательное видео об разных видах химической связи.
Эта статья доступна на английском языке — Chemical Bonding: Definition, Types, Properties.
www.poznavayka.org
Урок на тему Типы химической связи
Урок химии в 8 классе
Дата:
Тема урока: Типы химической связи: ковалентная, ионная, металлическая.
Тypes of chemical bonds.
Цели урока:
Образовательные:
познакомить учащихся с различными типами химических связей;
научить школьников определять типы химических связей в различных соединениях.
Развивающие:
формировать умение определять тип химической связи в соединении;
развивать устную речь учащихся, умение применять знания в новой ситуации;
развитие творческого химического мышления.
Воспитательные:
способствовать росту инициативы и самостоятельности;
формирование культуры общения, чувства уважения друг к другу.
Техническое обеспечение урока: компьютер, интерактивная доска, презентация к уроку, технологические карты для учащихся.
ХОД УРОКА
Организационный момент (слайды №1-2)
Любовь дает нам крылья, вдохновение,
С ней радостно каждое мгновение,
Она высот добиться помогает
И лучшие дороги открывает!
Любовь, как воздух, как искусство,
Пусть будет вечно это чувство!
Сообщение темы, постановка целей урока.
2. Актуализация знаний
Разные вещества имеют различное строение: одни существуют в виде свободных атомов, другие состоят из связанных атомных частиц. Между атомными частицами существуют силы, которые обуславливают взаимодействие атомных частиц и называются «химической связью».
3. Изложение нового материала
Образование связи всегда энергетически выгодно и связано с выделением энергии. При этом полная энергия системы понижается (слайд 3). Работа по группам. В соединениях различают 4 типа химических связей (слайд №4):
КОВАЛЕНТНАЯ СВЯЗЬ — это связь, возникающая между атомами за счет образования общих электронных пар (Например, H2, HCl, H2O, O2).
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
1 группа: КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ (КНС) — образуют атомы одного и того же химического элемента — неметалла (Например, H2, O2, О3).
Механизм образования связи.
Каждый атом неметалла отдает в общее пользование другому атому наружные не спаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
Рассмотрим механизм образования молекулы хлора:
Cl2 – кнс.
Электронная схема образования молекулы Cl
Структурная формула молекулы Cl2:
σ
Cl – Cl , σ (p – p) — одинарная связь
2 группа: КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ (КПС) — образуют атомы разных неметаллов, отличающихся по значениям электроотрицательности (Например, HCl, H2O).
3 группа: Связь, которая возникает в результате электростатического взаимодействия между ионами, называется ионной.
Ионная связь возникает между атомами металлов и неметаллов, электороотрицательность которых сильно отличается (более чем на две единицы).
Na0 – 1e —> Na1+, Cl0 + 1e —> Cl1–.
4 группа: Связь, которая образуется между относительно свободными электронами и ионами металлов – называется металлической.(Fe, Cu)
В процессе выступления групп выполняется задание на соответствие(слайд10)
4. Закрепление
Предлагается выполнить задания разного уровня, каждый учащийся выбирает уровень сложности, опираясь на свои знания:
1 уровень на оценку «3»
Задание «Крестики-нолики» «Соедините прямой линией по горизонтали, вертикали или диагонали три клетки, которые содержат формулы веществ с типом химической связи»:
а) ковалентная неполярная
Ответ: Cl2 – I2– O3. б) ионнаяОтвет: MgF2 – Cs2O – NaF.
2 уровень на оценку «4»
Тестовые задания.
1. В аммиаке и хлориде бария химическая связь соответственно
а) ионная и ковалентная полярная
б) ковалентная полярная и ионная
в) ковалентная неполярная и металлическая
г) ковалентная неполярная и ионная
2. Вещества только с ионной связью приведены в ряду:
а) F2,
б) NaBr, Na2O, KI
в) SO2, P4, CaF2
г) H2S, Br2, K2S
3. В каком ряду все вещества имеют ковалентную полярную связь?
а) HCl, NaCl, Cl2
б) O2, H2O, CO2
в) H2O, NH3, CH4
г) NaBr, HBr, CO
4.Веществом с ковалентной неполярной связью является
а) С12 б) NaBr в) H2S г) MgCl2
5. Металлическая связь характерна для
а) С12 б) SO3 в) СО г) Fe
3 уровень на оценку «5»
Определите виды химических связей в молекулах следующих веществ:
H2S, KCl, O2, Na2S, Na2O, N2, NH3, BaF2, LiCl, O3, CO2, SO3, CCl4, F2.
Ребята в парах меняются своими ответами. Осуществляется взаимопроверка.(слайд 11)
5. Домашнее задание: § №27, 28, 29 читать, задание №2,3 решать (после пар. №28). Привести по 5 веществ на каждый тип химической связи
6. Итоги урока
Учитель и учащиеся подводят итоги урока, оценивают работу друг друга, говорят о том, что нового они узнали на уроке (вспомнили понятие химическая связь, выяснили какие типы связей существуют и научились определять тип связи в различных соединениях).
7.Рефлексия
infourok.ru
3.3. Типы химической связи
Метод валентных связей основывается на постулате, согласно которому все атомы стремятся обрести законченную электронную оболочку, но достигают этого разными способами. Атомы металлов обычно отдают электроны, приобретая при этом электронную конфигурацию атома предшествующего инертного газа. Атомы d— и f-элементов, проявляющие переменную валентность, могут иметь и другие устойчивые электронные конфигурации. Атомы неметаллов часто достраивают свой внешний электронный слой. Если в соединении присутствует более электроотрицательный элемент, неметалл может отдавать электроны до обретения устойчивой степени окисления (например, для Cl – это +1, +3, +5, +7). Когда атом металла образует связь с атомом неметалла, первый отдает электроны, а второй принимает. В случае взаимодействия типичного металла с типичным неметаллом между их атомами образуется ионная связь:
2Na + Cl2 = 2NaCl.
При реакции неметалла с неметаллом возникает ковалентная связь. Для атомов одного вида такая связь будет неполярной:
О + О = О2.
Связь между атомами разных неметаллов является ковалентной полярной:
S + O2 = O=S=O.
Атомы металла в простом веществе достигают октета за счет образования валентными электронами единой системы (электронного газа), что называется металлической связью и обусловливает высокую электро- и теплопроводность металла, а также его пластичность. Для образования простой ковалентной связи каждый из атомов предоставляет по одному электрону: А•|•Б. При возникновении донорно-акцепторной связи один атом – донор – предоставляет два электрона, а другой атом – акцептор – выделяет для этого вакантную электронную орбиталь: А : | Б. В случае дативной связи оба атома либо обе частицы одновременно выступают в роли и донора, и акцептора электронов. Например,
в димере Al2Cl6: «акцепторные» атомы хлора отдают свои неподеленные электронные пары, которыми заселяются вакантные d-орбитали «донорных» атомов алюминия. Межмолекулярные связи (взаимодействия) носят как электростатический, так и донорно-акцепторный характер (орбитальное связывание). Среди межмолекулярных взаимодействий можно выделить диполь-дипольное. Очевидно, что два диполя будут ориентироваться относительно друг друга противоположными полюсами (рис. 3.1).
Рис. 3.1. Схема диполь-дипольного взаимодействия |
Наиболее ярким примером диполь-дипольного взаимодействия является водородная связь:
Н2О…Н–О–Н.
Другой тип межмолекулярного взаимодействия – индукционное. Любой диполь, безусловно, оказывает электростатическое воздействие на рядом находящиеся неполярные молекулы, вызывая их поляризацию (рис. 3.2).
Рис. 3.2. Схема индукционного взаимодействия |
Например, неполярная молекула брома, подходя к -облаку молекулы этилена, поляризуется так, что атакующим центром оказывается атом брома с частично положительным зарядом на нем. Об этом свидетельствует образование промежуточного бромониевого катиона:
Возможно межмолекулярное взаимодействие и между совершенно неполярными молекулами. Мы привыкли рассматривать электронную плотность как нечто неизменное во времени. Однако электронная плотность, как и атмосфера Земли, подвержена колебаниям (флуктуациям). Смещение электронной плотности у одного атома (образование мгновенного диполя) вызоветсоответствующее смещение и удругого (рис. 3.3).
Рис. 3.3. Схема дисперсионного взаимодействия |
Следствием подобных сдвигов электронной плотности является взаимное притяжение атомов. Данное взаимодействие называется дисперсионным и позволяет объяснить возможность существования конденсированных фаз (жидкой и твердой) для совершенно неполярных атомов и молекул, например для гелия. Все вышесказанное, касающееся типов химической связи, наглядно можно представить в виде следующей схемы (рис. 3.4).
|
Рис. 3.4. Схема классификации химических связей |
studfiles.net
3. Связь типа «многие-ко-многим»
При установлении связи между таблицами возможна ситуация, когда между ними нельзя установить отношение «главная-подчиненная» из-за того, что любой записи в одной таблице может соответствовать несколько записей из другой таблицы. Примером могут служить таблицы Студенты и Преподаватели, так как каждый студент сдавал экзамены нескольким преподавателям, а каждый преподаватель принимал экзамен у нескольких студентов. Поэтому между этими таблицами нельзя установить ни одну из описанных выше связей. Это пример связи типа «многие-ко-многим». Access непосредственно не поддерживает такой тип связи. Но ее можно реализовать в виде двух связей типа «один-ко-многим» с помощью третьей (связующей) таблицы. В качестве такой связующей таблицы в БД Деканат используется таблица Сессия (см. рис. 3.2). Она связана как с таблицей Студенты по полю Код студента, так и с таблицей Преподаватели по полю Код преподавателя.
После того как эти связи установлены, можно легко определить с помощью соответствующих запросов, у каких студентов принимал экзамены данный преподаватель или кому сдавал экзамены данный студент.
3.3. Создание связей
Для создания связей между таблицами нужно вернуться в окно БД и закрыть все открытые таблицы(иначе на экране вы увидите сообщение: ТАБЛИЦА ЗАБЛОКИРОВАНА ЯДРОМ БАЗЫ ДАННЫХ). Далее нужно щелкнуть по кнопкеСхема данныхпанели инструментов, либо вызвать щелчком правой кнопки мыши контекстное меню и выбрать в нем пунктСхема данных. Если связи в БД определяются впервые, то будет открыто пустое окноСхема данных. В это окно нужно добавить таблицы, между которыми устанавливается связь. Для добавления таблиц следует вызвать щелчком правой кнопки мыши контекстное меню окнаСхема данныхи выбрать в нем пунктДобавить таблицу. Откроется диалоговое окноДобавление таблицы, содержащее список таблиц БД (см. рис. 3.3). Для добавления таблицы нужно щелкнуть по ее имени, а затем — по кнопкеДобавить. После того как все таблицы отобраны, нужно закрыть это окно и вернуться в окноСхема данных.

Рис. 3.3. Окно Добавление таблицы
Диалоговое окно Добавление таблицыдает возможность добавить как таблицы, так и запросы. Иногда нужно определить связи между таблицами и запросами или только между запросами, чтобы Access знал, как правильно объединять эти объекты.
Чтобы определить связь между таблицами, находящимися в окне Схема данных, следует перенести с помощью мыши поле связи главной таблицы и поместить его на поле связи подчиненной таблицы. Откроется диалоговое окноИзменение связей (см. рис. 3.4).

Рис. 3.4.
В левом столбце выводятся имена главной таблицы и ключа, используемого для связи, а в правом столбце — имена подчиненной таблицы и внешнего ключа. Для изменения поля следует открыть список полей справа от его имени. Если связь производится по нескольким полям, то их имена можно добавить, используя пустые строки. Обычно Access сам определяет тип создаваемой связи, проводя анализ полей, для которых определяется связь. Если только одно из полей является ключевым или имеет уникальный индекс, создается связь «один-ко-многим». Связь «один-к-одному» создается в том случае, когда оба связываемых поля являются ключевыми или имеют уникальные индексы.
Создавая связь, нужно настроить режим обеспечения целостности данных.Обеспечение целостности позволяет избежать ситуации, когда в подчиненной таблице имеются записи, не связанные с записями главной таблицы. Если этот режим включен, то Access не разрешит добавить в подчиненную таблицу запись, для которой не найдется связанной с ней записи из главной таблицы. Нельзя будет также удалить из главной таблицы запись, имеющую связанные с ней записи в подчиненной таблице. Например, нельзя будет добавить в таблицу Сессия запись с кодом студента, отсутствующим в таблице Студенты. Соответственно, из таблицы Студенты нельзя удалить запись о студенте, пока в таблице Сессия содержатся сведения о его оценках.
Режим обеспечения целостности данных этой связи можно включить, если выполнены следующие условия:
поле связи главной таблицы является первичным ключом или имеет уникальный индекс;
связанные поля имеют один и тот же тип данных;
обе связанные таблицы принадлежат одной базе данных Access.
Если для связи включен этот режим, то можно дополнительно указать, следует ли автоматически выполнять для связанных записей операции каскадного обновления и каскадного удаления. Если включить режим Каскадное обновление связанных полей, то при изменении значения ключа в главной таблице будут автоматически обновлены соответствующие значения в связанных записях подчиненной таблицы. При включении режимаКаскадное удаление связанных записейпри удалении записи из главной таблицы будут автоматически удалены связанные с ней записи в подчиненной таблице. В том случае, когда эти режимы не включены, а режим обеспечения целостности данных включен, Access не позволит изменить значение в ключевом поле главной таблицы, а также удалить запись в главной таблице, если в подчиненной таблице имеются данные, связанные с этой записью. После завершения операции создания связи нужно нажать кнопкуОК. Связь отображается в виде линии, соединяющей две таблицы. Если включен режим обеспечения целостности данных, то Access изобразит на конце линии, соответствующей главной таблице, цифру1. На другом конце линии, соответствующем подчиненной таблице, будет изображен символ бесконечности∞для связи типа «один-ко-многим» и цифра1для связи типа «один-к-одному».
Если перенести с помощью мыши поле, не являющееся ключевым или не имеющее уникального индекса, на другое поле, которое также не является ключевым или не имеет уникального индекса, будет создана связь неопределенного типа. Режим обеспечения целостности данных в этом случае включить нельзя.
Любую связь можно изменить или удалить. Для изменения связи нужно сделать двойной щелчок по линии связи, и отредактировать ее в открывшемся окне Связи. Чтобы удалить связь, следует щелкнуть по ней и нажать клавишуDelete.
studfiles.net
Базы данных. Связи в ER-модели. Примеры. Мощность связи. Типы связей
ER-модель. Понятие связи. Мощность связи. Типы связей. Примеры
Рекомендуется перед изучением данной темы ознакомиться с следующими темами:
Содержание
1. Что такое связь в ER-модели? Пример
Между двумя сущностями может быть установлена связь. Отношения между сущностями характеризуются глаголом, который можно применить для взаимодействия между ними. Связь – это некое отношение между двумя типами сущностей.
Например. Приведенный пример демонстрирует определение связи между типами сущностей Студент, Дисциплина, Группа.
Студент изучает дисциплину – выделяется глагол «изучает».
Студент учится в группе – выделяется глагол «учится».
⇑
2. Как связи обозначаются в ER-модели?
В ER-модели связи обозначаются в виде ромба. Внутри ромба указывается глагол, который определяет характер взаимодействия между типами сущностей.
⇑
3. Какие типы связей различают в ER-модели?
Между типами сущностей различают следующих 3 типа связей:
- «один-к-одному» или 1:1. Это значит, что одному экземпляру некоторой сущности может соответствовать только один экземпляр другой сущности;
- «один-ко-многим» или 1:M. Это значит, что одному экземпляру сущности может соответствовать любое количество (M) экземпляров другой сущности. Если известно значение максимального количества экземпляров, то это значение указывается вместо символа М;
- «много-к-многим» или M:N. Это означает, что нескольким экземплярам одной сущности может соответствовать несколько экземпляров другой сущности.
⇑
4. Пример связи типа «один ко многим» – 1:М
На рисунке 1 изображен фрагмент ER-модели, которая демонстрирует связь между типами сущностей Студент и Группа.

Рис. 1. Связь между типами сущностей Студент и Группа
На вышеприведенном рисунке изображены два типа сущностей Студент и Группа. Между типами сущностей Студент и Группа есть связь, так как студент учится в группе (ромб с текстом «учиться»).
В группе может быть много студентов. Студент может учиться только в одной группе, в двух и более группах студент учиться не может. Поэтому, на рисунке тип связи обозначен как 1:М, что значит «один ко многим». Обозначение М находится возле типа сущности Студент (много студентов), обозначение 1 находится возле сущности Группа (одна группа).
Тип сущности Студент обозначен как «слабая» сущность. Тип сущности Группа обозначен как сильная сущность. Это значит, что студент находится в подчиненном состоянии к группе, в которой он учится.
⇑
5. Что такое мощность связи? Пример
Мощность связи – это значение максимального количества конкретных экземпляров сущностей, которые могут использоваться для данной связи. Мощность связи 5 говорит о том, что в данной связи может быть использовано не более 5 разных экземпляров сущностей. Или, иными словами, не более 5 отличных между собой значений.
Например. Студент учится в группе. Между типами сущностей Студент и Группа можно установить связь 1:30, как показано на рисунке 2. Число 30 означает, что в группе может учиться не более 30 студентов.
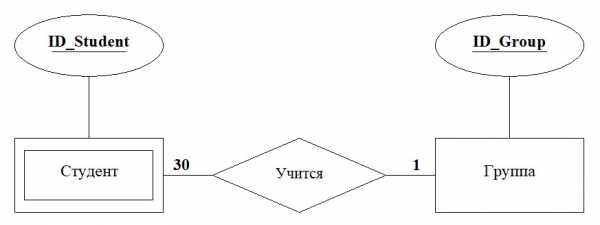
Рисунок 2. Связь между сущностями Студент и Группа
Если количество значений экземпляров сущностей произвольно, то мощность связи наиболее часто представляется символом M или знаком ∝ (бесконечность).
Использование конкретных числовых значений в мощности связи есть удобным при разработке программного обеспечения, поскольку можно более качественно реализовать структуры данных зная их максимальный размер.
⇑
6. Пример связи типа «много ко многим»
Пусть заданы два типа сущностей: Студент и Дисциплина. Если студент (тип сущности Студент) изучает некую дисциплину (тип сущности Дисциплина), то на ER-модели связь может быть отображена так как показано на рисунке 3.
Рисунок 3. Отображение связи типа «много ко многим»
На рисунке 3 символами M и N обозначен тип связи «много ко многим». Этот тип связи выбран, так как один студент может изучать несколько (много) дисциплин, и, наоборот, одну дисциплину может изучать несколько студентов.
⇑
7. Какое характерное отличие типа связи «один к одному» 1:1 в сравнении с другими типами?
Тип связи «один к одному» 1:1 отличается от других типов связи тем, что он может быть заменен атрибутом. При проектировании базы данных, разработчик на собственное усмотрение должен определить, нужно ли использовать тип связи 1:1, или достаточно заменить ее атрибутом. Все это зависит от специфики решаемой задачи.
⇑
8. Какие особенности реализации связи типа «много ко многим» или M:N? Как реализовать связь «много ко многим»? Пример
Связь «много ко многим» сложно реализовать программно, так как реляционные базы данных поддерживают связь «один ко многим». Чтобы решить эту проблему, разработчик базы данных создает искусственный тип сущности, которая выполняет функции коммутатора между двумя основными сущностями.
Пример. Для двух типов сущностей Студент и Дисциплина можно реализовать искусственный тип сущности, как показано на рисунке 4.

Рис. 4. Реализация связи «много ко многим» или M:N
На вышеприведенном рисунке сущность-коммутатор содержит два атрибута, которые есть внешними ключами. Один атрибут связан с подтипом сущности Студент. Второй атрибут связан с подтипом сущности Дисциплина. Также отображена приближенная реализация соответствующих реляционных таблиц. Таблица Subject_Student есть дополнительно созданной таблицей, которая отображает искусственный тип сущности, выполняющей функции коммутатора.
Для обеспечения лучшей наглядности вышеприведенной схемы, часто реализуется упрощенный вариант, который изображен на рисунке 5. В этом случае, искусственный тип сущности изображают в виде ромба, вписанного в прямоугольник.

Рис. 5. Реализация упрощенного варианта искусственного типа сущности на ER-диаграмме
⇑
Связанные темы
⇑
www.bestprog.net
Основные типы химической связи
.Вам известно, что атомы могут соединяться друг с другом с образованием как простых, так и сложных веществ. При этом образуются различного типа химические связи: ионная, ковалентная (неполярная и полярная), металлическая и водородная. Одно из наиболее существенных свойств атомов элементов, определяющих, какая связь образуется между ними – ионная или ковалентная, — это электроотрицательность, т.е. способность атомов в соединении притягивать к себе электроны.
Условную количественную оценку электроотрицательности дает шкала относительных электроотрицательностей.
В периодах наблюдается общая тенденция роста электроотрица-тельности элементов, а в группах – их падения. Элементы по электроот-рицательностям располагают в ряд, на основании которого можно сравнить электроотрицательности элементов, находящихся в разных периодах.
Тип химической связи зависит от того, насколько велика разность значений электроотрицательностей соединяющихся атомов элементов. Чем больше отличаются по электроотрицательности атомы элементов, образующих связь, тем химическая связь полярнее. Провести резкую границу между типами химических связей нельзя. В большинстве соединений тип химической связи оказывается промежуточным; например, сильнополярная ковалентная химическая связь близка к ионной связи. В зависимости от того, к какому из предельных случаев ближе по своему характеру химическая связь, ее относят либо к ионной, либо к ковалентной полярной связи.
Ионная связь.Ионная связь образуется при взаимодействии атомов, которые резко отличаются друг от друга по электроотрицательности. Например, типичные металлы литий(Li), натрий(Na), калий(K), кальций (Ca), стронций(Sr), барий(Ba) образуют ионную связь с типичными неметаллами, в основном с галогенами.
Кроме галогенидов щелочных металлов, ионная связь также образуется в таких соединениях, как щелочи и соли. Например, в гидроксиде натрия(NaOH) и сульфате натрия(Na2 SO4 ) ионные связи существуют только между атомами натрия и кислорода (остальные связи – ковалентные полярные).
Ковалентная неполярная связь.При взаимодействии атомов с одинаковой электроотрица-тельностью образуются молекулы с ковалентной неполярной связью. Такая связь существует в молекулах следующих простых веществ: H2 , F2 , Cl2 , O2 , N2 . Химические связи в этих газах образованы посредством общих электронных пар, т.е. при перекрывании соответствующих электронных облаков, обусловленном электронно-ядерным взаимодей-ствием, которые осуществляет при сближении атомов.
Составляя электронные формулы веществ, следует помнить, что каждая общая электронная пара – это условное изображение повышенной электронной плотности, возникающей в результате перекрывания соответствующих электронных облаков.
Ковалентная полярная связь.При взаимодействии атомов, значение электроотрецательностей которых отличаются, но не резко, происходит смещение общей электронной пары к более электроотрицательному атому. Это наиболее распространенный тип химической связи, которой встречается как в неорганических, так и органических соединениях.
К ковалентным связям в полной мере относятся и те связи, которые образованы по донорно-акцепторному механизму, например в ионах гидроксония и амония.
Металлическая связь.
Связь, которая образуется в результате взаимодействия относите-льно свободных электронов с ионами металлов, называются металлической связью. Этот тип связи характерен для простых веществ- металлов.
Сущность процесса образования металлической связи состоит в следующем: атомы металлов легко отдают валентные электроны и превращаются в положительные заряженные ионы. Относительно свобо-дные электроны, оторвавшиеся от атома, перемещаются между положи-тельными ионами металлов. Между ними возникает металлическая связь, т. е. Электроны как бы цементируют положительные ионы кристал-лической решетки металлов.
Водородная связь.
Связь, которая образуется между атомов водорода одной молекулы и атомом сильно электроотрицательного элемента (O, N, F) другой молекулы, называется водородной связью.
Может возникнуть вопрос: почему именно водород образует такую специфическую химическую связь?
Это объясняется тем, что атомный радиус водорода очень мал. Кроме того, при смещении или полной отдаче своего единственного электрона водород приобретает сравнительно высокий положительный заряд, за счет которого водород одной молекулы взаимодействует с атомами электроотрицательных элементов, имеющих частичный отрицательный заряд, выходящий в состав других молекул (HF, H2 O, NH3 ).
Рассмотрим некоторые примеры. Обычно мы изображаем состав воды химической формулой H2 O. Однако это не совсем точно. Правильнее было бы состав воды обозначать формулой (H2 O)n, где n = 2,3,4 и т. д. Это объясняется тем, что отдельные молекулы воды связаны между собой посредством водородных связей.
Водородную связь принято обозначать точками. Она гораздо более слабая, чем ионная или ковалентная связь, но более сильная, чем обычное межмолекулярное взаимодействие.
Наличие водородных связей объясняет увеличения объема воды при понижении температуры. Это связано с тем, что при понижении температуры происходит укрепление молекул и поэтому уменьшается плотность их «упаковки».
При изучении органической химии возникал и такой вопрос: почему температуры кипения спиртов гораздо выше, чем соответствующих углеводородов? Объясняется это тем, что между молекулами спиртов тоже образуются водородные связи.
Повышение температуры кипения спиртов происходит также всле-дствие укрупнения их молекул.
Водородная связь характерна и для многих других органических соединений (фенолов, карбоновых кислот и др.). Из курсов органической химии и общей биологии вам известно, что наличием водородной связи объясняется вторичная структура белков, строение двойной спирали ДНК, т. е. явление комплиментарности.
mirznanii.com
Типы химических связей между атомами, влияние типа связи на свойства материалов
Ковалентная связь образуется между атомами одного или нескольких химических элементов с близкими ионизационными потенциалами. В чистом виде ковалентная связь реализуется при взаимодействии элементов с наполовину заполненными электронными оболочками. h3 ,C, Si, Ge, Sn. Соседние атомы обмениваются электронами.
Появление между положительно заряженными ионами пары отрицательно заряженных электронов приводит к тому, что оба иона притягиваются к обобществленным электронам и, тем самым, притягиваются друг к другу. Каждый атом взаимодействует с ограниченным числом соседей, причем число соседей равно числу валентных электронов атома. Следовательно, ковалентная связь насыщенна. Кроме того, атом взаимодействует только с теми соседями, с которыми он обменялся электронами, то есть ковалентная связь имеет направление.
Ионная связь образуется при взаимодействии атомов с малым количеством валентных электронов и атомов с большим количеством электронов на валентных оболочках. При этом наружные электроны атомов с низкими потенциалами ионизации переходят на валентные оболочки атомов с высокими ионизационными потенциалами. Ионная связь ненасыщенна, поскольку каждый из отрицательно заряженных ионов притягивает к себе положительно заряженные, а каждый из положительно заряженных ионов притягивает к себе все отрицательно заряженные. Однако ионная связь направлена, поскольку ион притягивает к себе разноименно заряженные ионы и отталкивает одноименно заряженные.
Уменьшение размера иона и увеличение его заряда ведет к росту энергии связи, а следовательно, к росту температуру плавления материала, уменьшению коэффициента теплового расширения и к увеличению модуля упругости.
Металлическая связь образуется между атомами одного или нескольких химических элементов, у которых валентные электронные оболочки застроены меньше чем на половину. Поскольку энергия иона минимальна при полностью заполненной внешней оболочке, атомы отдают внешние валентные электроны и превращаются в положительно заряженные ионы, между которыми находятся свободные электроны (электронный газ).
Металлическая связь не имеет направления и ненасыщенна. Кристаллические решетки металлов упакованы плотно.
Связь Ван-дер-Ваальса образуется при сближении молекул или атомов инертных газов и заключается в их связи между собой за счет постоянных или взаимно созданных дипольных моментов.
2. Поляризация диэлектриков, виды поляризации, механизмы поляризации. Влияние внешних условий на поляризацию диэлектриков.
Поляризацией называется такое состояние диэлектрика, когда суммарный электрический момент отличен от нуля. Появление поляризации является следствием воздействия различных факторов: электрического поля, температуры, механических напряжений и др. В большинстве диэлектриков поляризация возникает под действием электрического поля.
Виды поляризации.
Упругая поляризация не связана с тепловым движением молекул.
Заряженные частицы под действием поля смещаются на очень малые расстояния в пределах поля упругих сил, связывающих эти частицы с другими. Поэтому поляризацией упругого ядерного смещения в промышленных материалах можно пренебречь.
а) упругого электронного смещения. Cвязана со смещением электронных оболочек атомов относительно ядер и имеет место во всех без исключения диэлектриках, за исключением абсолютного вакуума.
б) ионного упругого смещения. Вызвана упругим смешением ионов из равновесных положений под действием внешнего электрического поля. Хар-на для ионных кристаллов (мрамор, соль, слюда, кварц и др.). В таких материалах присутствует ещё и пол-я упругого электронного смещения.
в) дипольно-упругая. Заключается в повороте на малый угол диполей и имеет место в полярных твердых диэлектриках, где диполи прочно связаны связями с другими молекулами.
г) упругого ядерного смещения. Этот вид поляризации наблюдается в газах со сложными молекулами. Вклад этой поляризации в диэлектрическую проницаемость пренебрежимо мал.
Релаксационная поляризация:
а) Дипольно-релаксационная. Наблюдается во многих твердых и жидких диэлектриках с полярными группами: компаунды, бакелит, аминопласты и др. При такой поляризации происходит смещение полярных молекул или смещение радикалов, входящих в состав крупных молекул. Cопровождается необратимыми потерями энергии при нахождении диэлектриков в переменном электрическом поле.
б) Ионно-релаксационная. Связана с перебросом из одного равновесного положения в другое слабосвязанных ионов или полярных групп.
в) Электронно-релаксационная. При приложении электрического поля дефекты кристаллической решетки могут перебрасываться из одного положения в другое.
г) Резонансная. При совпадении собственной частоты колебания структурной единицы вещества с частотой внешнего поля наблюдается резонансная поляризация. В этом случае в узком интервале частот резко возрастает диэлектрическая проницаемость.
Существуют 4 основных мех-ма поляризации:
Электронный, ионный, дипольный, спантанный.
1. Электронный – упругое смещение
электронов в атомах и ионах
Такая поляризация есть во всех материалах, а поляризации других видов добавляются к электонной. Она происходит быстро (t=10-14 – 10-15) и поэтому не зависит от частоты изменения электрического поля до тех пор, пока время поляризации не соизмерима с периодом изменения электрического поля (f = 10-14 – 10-15Гц)
При нагревании плотность падает, уменьшается число атомов в единице объема в следствии чего поляризация ослабевает.
2. Ионный – смещение ионов в
узлах кристаллической решетки электрическим полем за время t=10-12 – 10-13 (ионы тяжелее электронов). Она не зависит от частоты до f=1012-1013Гц. С ростом температуры расстояние м/у ионами увеличивается из-за теплового расширения, хмимические связи ослабляются. Ионы легче смешиваются, поэтому поляризация ионных диэлектриков растет вместе с температурой.
К диэлектрикам с ионной поляризацией относят слюду.
3. Дипольный–
поворот диполей, находящихся в хаотическом тепловом движении электрическим полем за время 10-6-10-8 сек. Дипольную поляризацию, ноаборот, наблюдают в полярных диэлектриках (в воде, канифоле и др) Она сопровождается потерями энергии на преодоление трения при повороте диполей, что приводит к нагреву диэлектрика
При частоте 106-108 Гц диполи не успевают ориентироваться по полю и остается только электронная поляризация.
При низких темпераурах вязкость вещества велика. Диполи неподвижны и электрическая прницаемость обусловлена электронной поляризацией. С увеличением температуры вязкости уменьшается, и диполи начинают поворачиваться, приводя к росту E. При темперауре выше температуры плавления тепловое движение мешает ориентации диполей и E снижается.
4. Спонтанный наблюдают в
веществах, называемых сигнетоэлектриками, например в титанате бария и титанате стронция.Как правило, в кристаллах сигнетиков, как и в кристаллах магнетиков есть домены. В одном домене все диполи ориентированы одинаково и создают электр. момент домена. В силу этого электрические моменты различных доменов не совпадают по направлению. При воздействии внешнего электрического поля эл. Моменты доменов постепенно ориентруются в направлении поля, что создает поляризацию до 100тыс.
cool4student.ru

