1.Основные типы хим связи: ковалентная, ионная, металлическая, водородная.
Химическая связь — это взаимодействие атомов, обусловливающее устойчивость молекулы или кристалла как целого. Хим связь определяется взаимодействием между заряженными частицами (ядрами и электронами).
Ковалентная связь — хим связь, образованная перекрытием пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Сущ три вида ковалентной хим связи, отличающихся механизмом образования:
Простая ковалентная связь. Для её образования каждый из атомов предоставляет по одному неспаренному электрону. формальные заряды атомов остаются неизменными.
Ковалентная неполярная связь – связь между одинаковыми атомами элементов (О2, N2, Cl2 ) или между элементами, имеющими равное значение ЭО (Ph4).
Ковалентная
полярная связь – связь между атомами, имеющими разное
значение ЭО.
Донорно-акцепторная связь. Для обр этого вида связи оба электрона предоставляет один из атомов — донор. Второй из атомов называется акцептором. Соед с донорно-акцепторной связью — аммония Nh5+, тетрафторборат анион BF4
Семиполярная связь. Её можно рассматривать как полярную донорно-акцепторную связь. Этот вид ков связи образуется между атомом, обладающим неподелённой парой электронов (азот, фосфор, сера, галогены и т. п.) и атомом с двумя неспаренными электронами (кислород, сера). Соединения с семиполярной связью — закись азота N2O, O−-PCl3+(что это)
Металлическая связь —В узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно движутся валентные электроны, происходящие из атомов металлов от атомов при образовании ионов.
Ионная связь —
очень прочная, образующаяся между
атомами с большой разностью ЭО, при
которой общая электронная пара полностью
переходит к атому с большей ЭО. Примеры:
все соли, щёлочи, гидроксиды металлов,
основные оксиды.
Примеры:
все соли, щёлочи, гидроксиды металлов,
основные оксиды.
Водородная связь — форма ассоциации между ЭОным атомом и атомом водорода H, связанным ковалентно с другим ЭОным атомом. В качестве ЭОных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными. Энергия водородной связи значительно меньше энергии обычной ковалентной связи. Однако ее достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры.
Кремний — элемент главной подгруппы четвёртой группы третьего периода, с атомным номером 14. СО: +4, +2, 0, −4

Химические св-ва Для атомов кремния является характерным состояние sp3-гибридизации орбиталей. В соед кремний обычно также проявляет себя как четырёхвалентный элемент с СО +4 или −4. Встречаются двухвалентные соед кремния, напр — SiO.
При н. у. кремний химически малоактивен и активно реаг только с газообразным фтором, при этом обр летучий тетрафторид кремния SiF4.
Прия нагр до темп свыше 400—500 °C кремний реагирует с кислородом с обр диоксида SiO2.
При нагр до темп свыше 400—500 °C кремний реагирует с хлором, бромом и йодом — с обр соотв легко летучих тетрагалогенидов SiHal4 и, возможно, галогенидов более сложного состава.С водородом кремний непосредственно не реаг, соед кремния с водородом — силаны с общей формулой Sinh3n+2 — получают косвенным путем. Моносилан Sih5 выделяется при взаим-ии силицидов металлов с р-рами к-т, например: Ca2Si+4HCl=2CaCl2+Sih5
С
азотом кремний при темп около 1000 °C обр нитрид Si3N4,
с бором — термически и химически стойкие бориды SiB3,
SiB6 и SiB12.
При темп свыше 1000 °C можно получить соед кремния и углерода — карбид кремния SiC (карборунд), который характеризуется высокой твёрдостью и низкой химической активностью.
Оксид кремния (IV) — бесцветные кристаллы, обладают высокой твёрдостью и прочностью.
Хим св-ва: SiO2 — кислотный оксид, не реагирующий с водой. Реагирует с фтороводородом: SiO2+4HF=SiF4+2h3O и плавиковой кислотой: SiO2+6HF=h3[SiF4]+2h3O
При сплавл SiO2 с щелочами и основными оксидами, а также с карбонатами активных металлов образуются силикаты — соли не имеющих постоянного состава очень слабых, нер-римых в воде кремниевых кислот общей формулы xh3O·ySiO2 Напр, может быть получен ортосиликат натрия: SiO2+4NaOH=Na4SiO4+2h3O
метасиликат кальция: SiO2+CaO=CaSiO3
или смешанный силикат кальция и натрия: Na2CO3+CaCO3+6SiO2=Na2CaSi6O14+2CO2
Кремниевые к-ты — очень слабые, малор-римые в воде к-ты. Известны
соли метакремниевой
кислоты Н2SiO3 (SiO2•h3О) — силикаты, ортокремниевой
кислоты h5SiO4 (SiO2•2h3O)
— ортосиликаты и других кислот с
различным числом SiO2•nh3О.
Известны
соли метакремниевой
кислоты Н2SiO3 (SiO2•h3О) — силикаты, ортокремниевой
кислоты h5SiO4 (SiO2•2h3O)
— ортосиликаты и других кислот с
различным числом SiO2•nh3О.Строение
Н2SiO3 кислота состоит из структурных звеньев, имеющих тетраэдрическое строение. Звенья соединяются в цепи, образуя поликремниевые кислоты (Н2SiO3)n
Получение метакремниевую к-ту получают действием сильных к-т на соли метакремниевой к-ты: Na2SiO3 + 2HCl = h3SiO3 + 2NaCl.
При высокой температуре вода выпаривается: h3SiO3 = SiO2 + h3O
Соли кремниевых кислот – силикаты в большинстве своем нер-римы в воде; растворимы лишь силикаты натрия и калия
SiO2+2NaOH=Na2SiO3+h3O
SiO2+K2CO3=K2SiO3+CO2
Благодаря
внешнему сходству со стеклом и р-римости
в воде силикаты натрия и калия получили
название р-римого стекла.
Билет 24
Химическая связь, степень окисления, кристаллические решётки, расчётная задача. Контрольная работа №1
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
Контрольная работа №1
степень окисления,
кристаллические решётки,
расчётная задача.
Изобразите при помощи схем образование химических
связей в соединениях: CO2 и Rb2Se. Назовите тип связи.
C – элемент IV группы, на внешнем уровне 4 электрона все
неспаренные.
О – элемент VI группы, на внешнем уровне 6 электронов, два
неспаренные.

C
+
2 О
О
=
—
+
—
О=C = О
C
О
Ковалентная
полярная связь
Изобразите при помощи схем образование химических
связей в соединениях: CO2 и Rb2Se. Назовите тип связи.
Rb – элемент I группы, на внешнем уровне 1 неспаренный
электрон
Se – элемент VI группы, на внешнем уровне 6 электронов, два
неспаренные.
2-
2 Rb
+
Se
=
+
Rb
Se
+
Rb
Ионная связь
Степень окисления.
Условный заряд элемента, рассчитанный исходя из условия, что все
Величину С.О. определяет число электронов, смещённых от менее
электроотрицательного элемента к более электроотрицательному.
+ H Cl
+
H
Cl
+ +6 -2
h3 S O4
+ -2
h3O
-2
+
O
+
H
+
H
-2
H
O
+
-2
H
O
+6
S
O
-2
O -2
Сумма всех С.О. атомов в молекуле = 0
+ +6 -2
h3 S O4
(+1)∙2 + (+6)∙1 + (-2)∙4 = 0
Сумма всех С.
 О. в ионе равна его заряду.
О. в ионе равна его заряду.+4 -2
[С O3]2-
(+4)∙1 + (-2)∙3 = -2
С.О. атомов в простом веществе = 0
0
К
0
Fe
P
0
0
S
0
h3
0
O2
0
Cl2
С.О. фтора в соединениях всегда «-1»
С.О. кислорода в соединениях обычно «– 2»
Кроме: перекиси «-1», соединение с фтором «+1»
С.О. водорода в соединениях с неметаллами «+1», в соединениях с
металлами «-1»
У металлов С.О. всегда «+»
Постоянную степень окисления имеют атомы: щелочных металлов (+1),
щелочноземельных металлов (+2), водорода (+1)
Для элементов положительная степень окисления не может превышать величину,
равную номеру группы периодической системы.
Na+2S+6O-24
K+Mn+7O-24
K+2Si+4O-23
Решение задач
Растворенное вещество, масса осадка.
К 132,5г раствора карбоната натрия с массовой
долей растворённого вещества 40%, добавили
избыток хлорида кальция.
Рассчитайте массу выпавшего осадка.
Mр-ра=132,5г
Na2CO3+CaCl2= CaCO3 + 2NaCl
ωNa CO =40%(0,4) mNa CO = 132,5г ∙ 0,4 = 53г
Mосадка=?
MNa CO = 23∙2 + 12 + 16∙3 = 106г/моль
MСaCO = 40+ 12 + 16∙3 = 100г/моль
2
3
2
2
3
3
3
νNa CO =53г/106г/моль = 0,5 моль
2
3
νNa CO = νСaCO
mСaCO = νСaCO ∙ MСaCO = 0,5моль∙100г/моль = 50г
2
3
3
3
3
3
К 83,2г раствора хлорида бария с массовой
избыток серной кислоты.

Рассчитайте массу выпавшего осадка.
Mр-ра=83,2г
BaCl2+h3SO4= BaSO4 + 2HCl
ωBaCl =25%(0,25) mBaCl = 83,2г ∙ 0,25 = 20,8г
MBaCl = 208г/моль MBaSO = 233г/моль
Mосадка=?
2
2
2
4
νBaCl =20,8г/208г/моль = 0,1 моль
2
νBaCl = νBaSO
2
4
mBaSO = νBaSO ∙ MBaSO = 0,1моль∙233г/моль = 23,3г
4
4
4
К 265г раствора фосфата калия с массовой
долей растворённого вещества 20%, добавили
избыток нитрата бария.
Рассчитайте массу выпавшего осадка.
2K3PO4+3Ba(NO3)2= Ba3(PO4)2 + 6KNO3
Mр-ра=265г
ωK PO =20%(0,2)
mK PO = 265г ∙ 0,2 = 53г
3
4
3
4
MK PO = 212г/моль MBa (PO ) = 601г/моль
Mосадка=?
3
4
3
4 2
νK PO =53г/212г/моль = 0,25 моль
3
4
2νK PO = νBa (PO )
3
4
3
4 2
νBa (PO ) =0,125
3
4 2
m Ba (PO ) = ν Ba (PO ) ∙ M Ba (PO ) = 0,125моль∙601г/моль= 75,125г
3
4 2
3
4 2
3
4 2
English Русский Правила
Влияние стрессов NaCl и Na2CO3 на фотосинтетическую способность Chlamydomonas reinhardtii
Ключевые слова: спектр поглощения; фотосинтетическая способность; фотосинтетический пигмент; активные формы кислорода; солевой стресс
[1] Affenzeller M. J., Darehshouri A., Andosch A., Lütz C. & Lütz-Meindl U. 2009. Индуцированная солевым стрессом гибель клеток одноклеточной зеленой водоросли Micrasterias denticulate. Дж. Эксп. Бот. 60: 939–954. http://dx.doi.org/10.1093/jxb/ern34810.1093/jxb/ern348Поиск в Google Scholar
J., Darehshouri A., Andosch A., Lütz C. & Lütz-Meindl U. 2009. Индуцированная солевым стрессом гибель клеток одноклеточной зеленой водоросли Micrasterias denticulate. Дж. Эксп. Бот. 60: 939–954. http://dx.doi.org/10.1093/jxb/ern34810.1093/jxb/ern348Поиск в Google Scholar
[2] Агирре-Гомес Р., Уикс А.Р. и Боксалл С.Р. 2001. Идентификация пигментов фитопланктона по спектрам поглощения. Междунар. J. Remote Sens. 22: 315–338. http://dx.doi.org/10.1080/01431160144995210.1080/014311601449952Search in Google Scholar
[3] Аллахвердиев С.И., Сакамото А., Нишияма Ю., Инаба М. и Мурата Н. 2000. Ионные и осмотические эффекты NaCl индуцировала инактивацию фотосистем I и II у Synechococcus sp. Завод Физиол. 123: 1047–1056. http://dx.doi.org/10.1104/pp.123.3.104710.1104/pp.123.3.1047Поиск в Google Scholar
[4] Axelsson L., Larsson C. & Ryberg H. 1999. Сродство, емкость и чувствительность к кислороду двух различных механизмов утилизации бикарбоната у Ulva lactuca L. (Chlorophyta).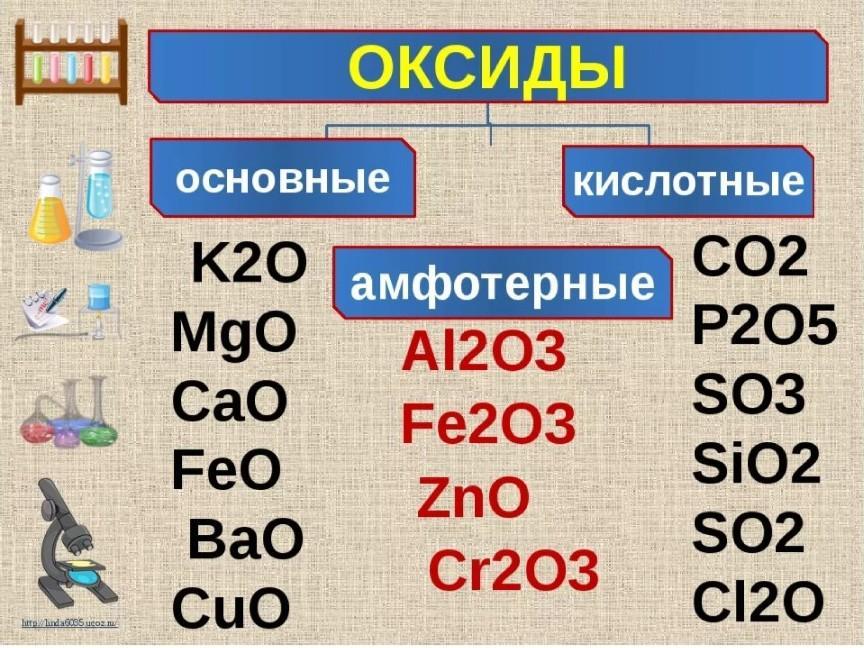 Окружающая среда растительной клетки. 22: 969–978. http://dx.doi.org/10.1046/j.1365-3040.1999.00470.x10.1046/j.1365-3040.1999.00470.xПоиск в Google Scholar
Окружающая среда растительной клетки. 22: 969–978. http://dx.doi.org/10.1046/j.1365-3040.1999.00470.x10.1046/j.1365-3040.1999.00470.xПоиск в Google Scholar
[5] Берубе К.А., Додж Дж.Д. и Форд Т.В. 1999. Влияние хронического солевого стресса на ультраструктуру Dunaliella bioculata (Chlorophyta, Volvocales): механизмы реагирования и восстановления. Евро. Дж. Фикол. 34: 117–123. http://dx.doi.org/10.1080/0967026991000173617210.1080/09670269910001736172Поиск в Google Scholar
[6] Бхатти С. и Колман Б. 2011. Доказательства возникновения фотодыхания у синурофитных водорослей. Фотосинтез Рез. 109: 251–256. http://dx.doi.org/10.1007/s11120-011-9639-z10.1007/s11120-011-9639-zSearch in Google Scholar
[7] Bilger W. & Björkman O. 1991. Температурная зависимость виолаксантина. глубокое окисление и нефотохимическое тушение флуоресценции в интактных листьях Hedera canariensis и Malva parviflora L. Planta 184: 226–234. http://dx.doi.org/10.1007/BF0110242210.1007/BF00197951Search in Google Scholar
[8] Bors W.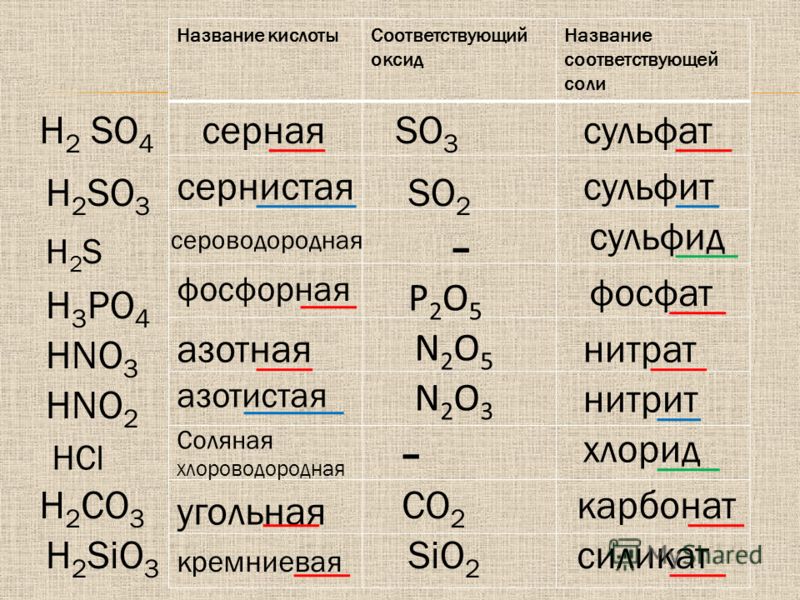 , Lengfelder E. & Saran M. 1977. Окисление гидроксиламина до нитрита как анализ совместного присутствия супероксидных анионов и гидроксильных радикалов. Биохим. Биоф. Рез. Ко 75: 973–979. http://dx.doi.org/10.1016/0006-291X(77)91477-210.1016/0006-291X(77)91477-2Поиск в Google Scholar
, Lengfelder E. & Saran M. 1977. Окисление гидроксиламина до нитрита как анализ совместного присутствия супероксидных анионов и гидроксильных радикалов. Биохим. Биоф. Рез. Ко 75: 973–979. http://dx.doi.org/10.1016/0006-291X(77)91477-210.1016/0006-291X(77)91477-2Поиск в Google Scholar
[9] Brookes P.S., Yoon Y., Robotham J.L., Anders MW & Sheu SS 2004. Кальций, АТФ и АФК: митохондриальный треугольник любви и ненависти. Являюсь. Дж. Физиол. Клеточная физиол. 287: 817–833. http://dx.doi.org/10.1152/ajpcell.00139.200410.1152/ajpcell.00139.2004Поиск в Google Scholar пабмед
[10] Chen W.C., Cui P.J., Sun H.Y., Guo W.Q., Yang C.W., Jin H., Fang B. & Shi D.C. 2009. Сравнительное влияние солевого и щелочного стресса на накопление органических кислот и ионный баланс облепихи (Hippophae рамноидес Л.). Индивидуальное растениеводство 30: 351–358. http://dx.doi.org/10.1016/j.indcrop.2009.06.00710.1016/j.indcrop.2009.06.007Search in Google Scholar
[11] Darehshouri A. & Lütz-Meindl U. 2010. Локализация h3O2 в зеленая водоросль Micrasterias после солевого и осмотического стресса с помощью спектроскопии потерь энергии электронов, связанных с ТЕМ. Протоплазма 239: 49–56. http://dx.doi.org/10.1007/s00709-009-0081-410.1007/s00709-009-0081-4Поиск в Google Scholar
& Lütz-Meindl U. 2010. Локализация h3O2 в зеленая водоросль Micrasterias после солевого и осмотического стресса с помощью спектроскопии потерь энергии электронов, связанных с ТЕМ. Протоплазма 239: 49–56. http://dx.doi.org/10.1007/s00709-009-0081-410.1007/s00709-009-0081-4Поиск в Google Scholar
[12] Деметриу Г., Неонаки К., Навакудис Э. и Котзабасис К. 2007. Влияние солевого стресса на молекулярную структуру и функцию фотосинтетического аппарата: защитная роль полиаминов. Биохим. Биофиз. Акта 1767: 272–280. http://dx.doi.org/10.1016/j.bbabio.2007.02.02010.1016/j.bbabio.2007.02.020Поиск в Google Scholar
[13] Дос Сантоса Дж.С., де Оливейраб Э., Брунск Р.Э. и Дженнари Р.Ф. 2004. Оценка процесса накопления солей во время наводнения в водном ресурсе бассейна реки Контас (Баия-Бразилия) с применением анализа главных компонентов. Вода Res. 38: 1579–1585. http://dx.doi.org/10.1016/j.watres.2003.12.00610.1016/j.watres.2003.12.006Поиск в Google Scholar
[14] Дойл С.М., Даймонд М. и МакКейб П.Ф. 2010. Участие хлоропластов и активных форм кислорода в апоптотической запрограммированной гибели клеток в суспензионных культурах арабидопсиса. Дж. Эксп. Бот. 61: 473–482. http://dx.doi.org/10.1093/jxb/erp32010.1093/jxb/erp320Search in Google Scholar
и МакКейб П.Ф. 2010. Участие хлоропластов и активных форм кислорода в апоптотической запрограммированной гибели клеток в суспензионных культурах арабидопсиса. Дж. Эксп. Бот. 61: 473–482. http://dx.doi.org/10.1093/jxb/erp32010.1093/jxb/erp320Search in Google Scholar
[15] Ehleringer J. 1981. Поглощающая способность листьев растений пустыни Мохаве и Сонора. Экология 49: 366–370. http://dx.doi.org/10.1007/BF0034760010.1007/BF00347600Поиск в Google Scholar
[16] Федина И.С., Григорова И.Д. и Георгиева К.М. 2003. Реакция проростков ячменя на УФ-излучение при воздействии NaCl. J. Физиол растений. 160: 205–208. http://dx.doi.org/10.1078/0176-1617-0076010.1078/0176-1617-00760Поиск в Google Scholar
[17] Foyer C.H. & Noctor G. 2005. Окислительно-восстановительный гомеостаз и антиоксидантная сигнализация: метаболический интерфейс между восприятием стресса и физиологическими реакциями. Заводская ячейка 17: 1866–1875 гг. http://dx.doi.org/10.1105/tpc.105.03358910.1105/tpc.105. 033589Search in Google Scholar
033589Search in Google Scholar
[18] Garnier F., Dubacq JP & Thomas JC 1994. Доказательства временной ассоциации новых белков с фикобилисомами Spirulina maxima в зависимости от интенсивности света. Завод Физиол. 106: 747–754. 10.1104/pp.106.2.747Поиск в Google Scholar
[19] Genty B., Briantais J.M. & Baker N.R. 1989. Взаимосвязь между квантовым выходом фотосинтетического транспорта электронов и тушением флуоресценции хлорофилла. Биохим. Биофиз. Акта 990: 87–92. http://dx.doi.org/10.1016/S0304-4165(89)80016-910.1016/S0304-4165(89)80016-9Search in Google Scholar
[20] Горман Д.С. и Левин Р.П. 1965. Цитохром f и пластоцианин : их последовательность в фотосинтетической электрон-транспортной цепи Chlamydomonas reinhardii. проц. Натл. акад. науч. США 54: 1665–1669. http://dx.doi.org/10.1073/pnas.54.6.166510.1073/pnas.54.6.1665Поиск в Google Scholar пабмед ПабМед Центральный
[21] Гоял А. 2007. Осморегуляция у Dunaliella. II. Фотосинтез и крахмал вносят углерод для синтеза глицерина во время солевого стресса у Dunaliella tertiolecta. Завод Физиол. Биохим. 45: 705–710. http://dx.doi.org/10.1016/j.plaphy.2007.05.00910.1016/j.plaphy.2007.05.009Search in Google Scholar
II. Фотосинтез и крахмал вносят углерод для синтеза глицерина во время солевого стресса у Dunaliella tertiolecta. Завод Физиол. Биохим. 45: 705–710. http://dx.doi.org/10.1016/j.plaphy.2007.05.00910.1016/j.plaphy.2007.05.009Search in Google Scholar
[22] Guan B., Zhou D., Zhang H., Tian Y., Japhet W. & Wang P. 2009. Реакция прорастания семян Medicago ruthenica на засоление , щелочность и температура. J Засушливая среда. 73: 135–138. http://dx.doi.org/10.1016/j.jaridenv.2008.08.00910.1016/j.jaridenv.2008.08.009Поиск в Google Scholar
[23] Huege J., Goetze J., Schwarz D., Bauwe H. , Хагеманн М. и Копка Дж. 2011. Модуляция основных путей углерода у фотодыхательных мутантов Synechocystis. PLoS One 6: e16278. http://dx.doi.org/10.1371/journal.pone.001627810.1371/journal.pone.0016278Поиск в Google Scholar
[24] Иванов А.Г., Спешка В., Сане П.В., Эквист Г. и Хунер Н.П.А. 2008. Тушение реакционного центра избыточной световой энергии и фотозащита фотосистемы II. J. Биология растений. 51: 85–96. http://dx.doi.org/10.1007/BF0303071610.1007/BF03030716Поиск в Google Scholar
51: 85–96. http://dx.doi.org/10.1007/BF0303071610.1007/BF03030716Поиск в Google Scholar
[25] Jianga Z.Y., Woollarda A.C.S. & Wolff S.P. 1990. Производство перекиси водорода во время экспериментального гликирования белков. ФЭБС лат. 268: 69–71. http://dx.doi.org/10.1016/0014-5793(90)80974-N10.1016/0014-5793(90)80974-NSSearch в Google Scholar
[26] Kahn N.A. 2003. NaCl ингибирует синтез хлорофилла и связанные с этим изменения в выделении этилена и активности антиоксидантных ферментов в пшенице. биол. Растение. 47: 437–444. http://dx.doi.org/10.1023/B:BIOP.0000023890.01126.4310.1023/B:BIOP.0000023890.01126.43Поиск в Google Scholar
[27] Krall J.P. & Edwards GE. 1992. Связь между активностью фотосистемы II и фиксацией СО2. Физиол. Завод 86: 180–187. http://dx.doi.org/10.1111/j.1399-3054.1992.tb01328.x10.1111/j.1399-3054.1992.tb01328.xПоиск в Google Scholar
[28] Liu X.D. и Шен Ю.Г. 2006. Солевой шок вызывает переход фотосинтетического аппарата в состояние II в адаптированных к темноте клетках Dunaliella salina. Окружающая среда. Эксп. Бот. 57: 19–24. http://dx.doi.org/10.1016/j.envexpbot.2005.04.00110.1016/j.envexpbot.2005.04.001Search in Google Scholar
Окружающая среда. Эксп. Бот. 57: 19–24. http://dx.doi.org/10.1016/j.envexpbot.2005.04.00110.1016/j.envexpbot.2005.04.001Search in Google Scholar
[29] Lutts S., Kinet J.M. & Bouharmont J. 1996. Индуцированный NaCl старение листьев сортов риса (Oryza sativa L.), отличающихся солеустойчивостью. Анна. Бот. 78: 389–398. http://dx.doi.org/10.1006/anbo.1996.013410.1006/anbo.1996.0134Search in Google Scholar
[30] Маниваннан П., Джалил К.А., Санкар Б., Кишорекумар А., Мурали П.В., Сомасундарам Р. . & Panneerselvam R. 2008. Поглощение минералов и биохимические изменения Helianthus annuus при обработке различными солями натрия. Коллоид. Поверхность. Б Биоинтерфейсы 62: 58–63. http://dx.doi.org/10.1016/j.colsurfb.2007.09.01910.1016/j.colsurfb.2007.09.019Поиск в Google Scholar пабмед
[31] Максвелл К. и Джонсон Г.Н. 2000. Флуоресценция хлорофилла – практическое руководство. Дж. Эксп. Бот. 51: 659–668. http://dx.doi.org/10.1093/jexbot/51.345.65910.1093/jexbot/51. 345.659Поиск в Google Scholar
345.659Поиск в Google Scholar
[32] Недельку А.М. 2006. Доказательства p53-подобных стрессовых реакций у зеленых водорослей. ФЭБС лат. 580: 3013–3017. http://dx.doi.org/10.1016/j.febslet.2006.04.04410.1016/j.febslet.2006.04.044Поиск в Google Scholar пабмед
[33] Olischläger M., Bartsch I., Gutow L. & Wiencke C. 2013. Влияние подкисления океана на рост и физиологию Ulva lactuca (Chlorophyta) в сценарии с каменным водоемом. Фикол. Рез. 61: 180–190. http://dx.doi.org/10.1111/pre.1200610.1111/pre.12006Search in Google Scholar
[34] Orosa M., Valero J.F., Herrero C. & Abalde J. 2001. Сравнение накопления астаксантин в Haematococcus pluvialis и других зеленых микроводорослях в условиях азотного голодания и яркого освещения. Биотехнолог. лат. 23: 1079–1085. http://dx.doi.org/10.1023/A:101051050838410.1023/A:1010510508384Search in Google Scholar
[35] Пирс Г., Труонг Т.Б., Остендорф Э., Буш А., Эльрад Д., Гроссман А.Р., Хипплер М. и Нийоги К. К. 2009 г.. Древний светособирающий белок имеет решающее значение для регуляции фотосинтеза водорослей. Природа 462: 518–522. http://dx.doi.org/10.1038/nature0858710.1038/nature08587Поиск в Google Scholar
пабмед
К. 2009 г.. Древний светособирающий белок имеет решающее значение для регуляции фотосинтеза водорослей. Природа 462: 518–522. http://dx.doi.org/10.1038/nature0858710.1038/nature08587Поиск в Google Scholar
пабмед
[36] Пелах Д., Синтов А. и Коэн Э. 2004. Влияние солевого стресса на выработку кантаксантина и астаксантина Chlorella zofingiensis, выращенной при ограниченной интенсивности света. Мир Дж. Микроб. Биот. 20: 483–486. http://dx.doi.org/10.1023/B:WIBI.0000040398.93103.2110.1023/B:WIBI.0000040398.93103.21Search in Google Scholar
[37] Pérez-Pérez M.E., Couso I. & Crespo JL 2012. Дефицит каротиноидов вызывает аутофагию в модельной зеленой водоросли Chlamydomonas reinhardtii. Автофагия 8: 376–388. http://dx.doi.org/10.4161/auto.1886410.4161/auto.18864Поиск в Google Scholar пабмед
[38] Поспишил П. 2009. Производство активных форм кислорода фотосистемой II. Биохим. Биофиз. Акта 1787: 1151–1160. http://dx.doi.org/10.1016/j. bbabio.2009.05.00510.1016/j.bbabio.2009.05.005Поиск в Google Scholar
пабмед
bbabio.2009.05.00510.1016/j.bbabio.2009.05.005Поиск в Google Scholar
пабмед
[39] Позняковский А.И., Дмитрий А., Кнорре Д.А., Маркова О.В., Хайман А.А., Скулачев В.П. и Северин Ф.Ф. 2005. Роль митохондрий в запрограммированной гибели дрожжей, индуцированной феромонами и амиодаронами. Дж. Клеточная биология. 168: 257–269. http://dx.doi.org/10.1083/jcb.20040814510.1083/jcb.200408145Поиск в Google Scholar пабмед ПабМед Центральный
[40] Ребейс К.А. 2002. Анализ промежуточных и конечных продуктов пути биосинтеза хлорофилла, стр. 111–155. В: Witty M., (ed.), Heme Chlorophyll and Bilins, Methods and Protocols, Humana Press, Totowa NJ. 10.1385/1-59259-243-0:111Поиск в Google Scholar
[41] Rohácek K. 2002. Параметры флуоресценции хлорофилла: определения, фотосинтетическое значение и естественные отношения. Фотосинтетика 40: 13–29. http://dx.doi.org/10.1023/A:102012571938610.1023/A:1020125719386Поиск в Google Scholar
[42] Сайед О. Х. 2003. Флуоресценция хлорофилла как инструмент исследования зерновых культур. Фотосинтетика 41: 321–330. http://dx.doi.org/10.1023/B:PHOT.0000015454.36367.e210.1023/B:PHOT.0000015454.36367.e2Поиск в Google Scholar
Х. 2003. Флуоресценция хлорофилла как инструмент исследования зерновых культур. Фотосинтетика 41: 321–330. http://dx.doi.org/10.1023/B:PHOT.0000015454.36367.e210.1023/B:PHOT.0000015454.36367.e2Поиск в Google Scholar
[43] Schreiber U., Schliwa U. & Bilger W. 1986. Непрерывная регистрация фотохимического и нефотохимического тушения флуоресценции с помощью модуляционного флуорометра нового типа. Фотосинтез. Рез. 10: 51–62. http://dx.doi.org/10.1007/BF0002418510.1007/BF00024185Поиск в Google Scholar
[44] Середа Дж., Богард М., Хадсон Дж., Хелпс Д. и Дессуки Т. 2011. Потепление климата и начало засоления: быстрые изменения в лимнологии двух северных равнинных озер. Лимнологика 4: 1–9. http://dx.doi.org/10.1016/j.limno.2010.03.00210.1016/j.limno.2010.03.002Поиск в Google Scholar
[45] Shannon M.C., Grieve C.M. и Франсуа Л.Э. 1994. Реакция всего растения на засоление, стр. 199–224. In: Уилкинсон Р.Э. (ред.), Взаимодействие растений и окружающей среды. Марсель Деккер, Нью-Йорк.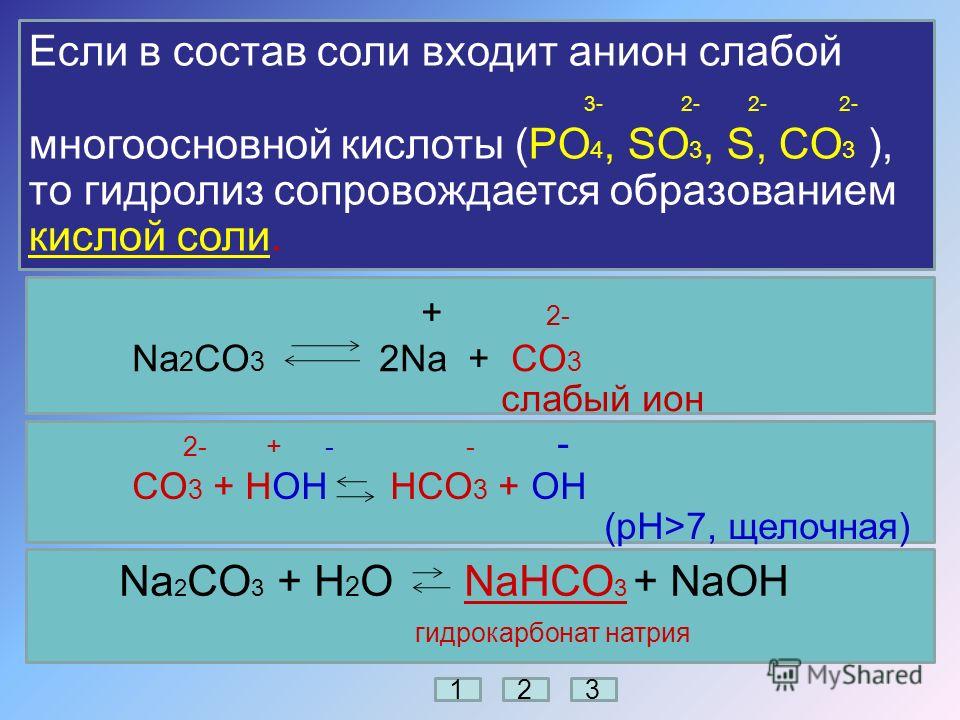 Поиск в Google Scholar
Поиск в Google Scholar
[46] Shao N., Beck C.F., Lemaire S.D. и Лишкай А.К. 2008. Фотосинтетический поток электронов влияет на передачу сигналов h3O2 за счет инактивации каталазы у Chlamydomonas reinhardtii. Планта 228: 1055–1066. http://dx.doi.org/10.1007/s00425-008-0807-010.1007/s00425-008-0807-0Поиск в Google Scholar
[47] Ши Д.К. и Шэн Ю.М. 2005. Влияние различных соляно-щелочных смешанных стрессовых условий на проростки подсолнечника и анализ их стрессовых факторов. Окружающая среда. Эксп. Бот. 54: 8–21. http://dx.doi.org/10.1016/j.envexpbot.2004.05.00310.1016/j.envexpbot.2004.05.003Поиск в Google Scholar
[48] Smith C.M. и Альберте Р.С. 1994. Характеристика особенностей поглощения in vivo хлорофитных, феофитных и родофитных водорослей. Мар биол. 118: 511–521. http://dx.doi.org/10.1007/BF0035030810.1007/BF00350308Поиск в Google Scholar
[49] Судхир П.Р., Погорелов Д., Ковач Л., Гараб Г. и Мурти С.Д.С. 2005. Влияние солевого стресса на фотосинтетический транспорт электронов и тилакоидные мембранные белки у цианобактерий Spirulina platensis. Дж. Биохим. Мол. биол. 38: 481–485. http://dx.doi.org/10.5483/BMBRep.2005.38.4.48110.5483/BMBRep.2005.38.4.481Поиск в Google Scholar
Дж. Биохим. Мол. биол. 38: 481–485. http://dx.doi.org/10.5483/BMBRep.2005.38.4.48110.5483/BMBRep.2005.38.4.481Поиск в Google Scholar
[50] Султанаа Н., Икеда Т. и Итох Р. 1999. Влияние NaCl засоления на фотосинтез и накопление сухого вещества в развивающихся зернах риса. Окружающая среда. Эксп. Бот. 42: 211–220. http://dx.doi.org/10.1016/S0098-8472(99)00035-010.1016/S0098-8472(99)00035-0Поиск в Google Scholar
[51] Сюльтемейер Д., Билер К. и Фок Х.П. 1993. Доказательства вклада псевдоциклического фотофосфорилирования в потребность в энергии механизма концентрации неорганического углерода у Chlamydomonas. Планта 189: 235–242. http://dx.doi.org/10.1007/BF0019508210.1007/BF00195082Search in Google Scholar
[52] Tang D., Shi S., Li D., Hu C. & Liu Y. 2007. Physiological and biochemical responses. Scytonema javanicum (цианобактерии) к солевому стрессу. J. Засушливая среда. 71: 312–320. http://dx.doi.org/10.1016/j.jaridenv.2007.05.00410.1016/j.jaridenv.2007.05.004Поиск в Google Scholar
[53] Tarchoune I. , Sgherri C., Izzo R., Lachaal M., Ouerghi Z. & Izzo F.N. 2010. Антиоксидантные реакции Ocimum basilicum на засоление хлоридом натрия или сульфатом натрия. Завод Физиол. Биохим. 48: 772–777. http://dx.doi.org/10.1016/j.plaphy.2010.05.00610.1016/j.plaphy.2010.05.006Search in Google Scholar
, Sgherri C., Izzo R., Lachaal M., Ouerghi Z. & Izzo F.N. 2010. Антиоксидантные реакции Ocimum basilicum на засоление хлоридом натрия или сульфатом натрия. Завод Физиол. Биохим. 48: 772–777. http://dx.doi.org/10.1016/j.plaphy.2010.05.00610.1016/j.plaphy.2010.05.006Search in Google Scholar
[54] Telma E., Scarpeci T.E., Zanor M.I., Carrillo N., Mueller -Roeber B. & Valle EM 2008. Генерация супероксидного аниона в хлоропластах Arabidopsis thaliana во время активного фотосинтеза: акцент на быстро индуцируемых генах. Завод Мол. биол. 66: 361–378. http://dx.doi.org/10.1007/s11103-007-9274-410.1007/s11103-007-9274-4Поиск в Google Scholar
[55] Варди А., Берман-Франк И., Розенберг Т., Хадас О., Каплан А. и Левин А. 1999. Запрограммированная гибель клеток динофлагеллята Peridinium gatunense опосредуется ограничением CO2 и окислительным стрессом. Курс. биол. 9: 1061–1064. http://dx.doi.org/10.1016/S0960-9822(99)80459-X10.1016/S0960-9822(99)80459-XПоиск в Google Scholar
[56] Yang C. W., Jianaer A., Li C.Y. , Ши Д.К. и Ван Д.Л. 2008. Сравнение влияния солевого и щелочного стресса на фотосинтез и запасание энергии щелочеустойчивым галофитом Chloris virgata. Фотосинтетика 46: 273–278. http://dx.doi.org/10.1007/s11099-008-0047-310.1007/s11099-008-0047-3Поиск в Google Scholar
W., Jianaer A., Li C.Y. , Ши Д.К. и Ван Д.Л. 2008. Сравнение влияния солевого и щелочного стресса на фотосинтез и запасание энергии щелочеустойчивым галофитом Chloris virgata. Фотосинтетика 46: 273–278. http://dx.doi.org/10.1007/s11099-008-0047-310.1007/s11099-008-0047-3Поиск в Google Scholar
[57] Yang C.W., Xu H.H., Wang L.L., Liu J., Shi D.C. & Wang D.L. 2009. Сравнительное влияние солевого и щелочного стресса на рост, фотосинтез, накопление растворенных веществ и ионный баланс растений ячменя. Фотосинтетика 47: 79–86. http://dx.doi.org/10.1007/s11099-009-0013-810.1007/s11099-009-0013-8Поиск в Google Scholar
[58] Ёсида К., Игараши Э., Вакацуки Э., Миямото К. и Хирата К. 2004. Смягчение осмотического и солевого стресса с помощью абсцизовой кислоты путем снижения вызванного стрессом окислительного повреждения у Chlamydomonas reinhardtii. Растениевод. 167: 1335–1341. http://dx.doi.org/10.1016/j.plantsci.2004.07.00210.1016/j.plantsci.2004.07.002Поиск в Google Scholar
[59] Yu R. , Liu T., Xu Y., Zhu C., Zhang Q., Qu Z., Liu X. & Li C. 2010. Анализ динамики засоления с помощью дистанционного зондирования в ирригационном районе Хэтао Северный Китай. Управление сельскохозяйственной водой. 97: 1952–1960. http://dx.doi.org/10.1016/j.agwat.2010.03.00910.1016/j.agwat.2010.03.009Search in Google Scholar
, Liu T., Xu Y., Zhu C., Zhang Q., Qu Z., Liu X. & Li C. 2010. Анализ динамики засоления с помощью дистанционного зондирования в ирригационном районе Хэтао Северный Китай. Управление сельскохозяйственной водой. 97: 1952–1960. http://dx.doi.org/10.1016/j.agwat.2010.03.00910.1016/j.agwat.2010.03.009Search in Google Scholar
[60] Залидис Г. 1998. Управление речной водой для орошения для смягчения засоления почвы на прибрежном заболоченном участке. Дж. Окружающая среда. Управлять. 54: 161–167. http://dx.doi.org/10.1006/jema.1998.022610.1006/jema.1998.0226Search in Google Scholar
[61] Zhang Y., Xu Q. & Xi B. 2013. Влияние солености NaCl на рост, метаболиты и антиоксидантную систему Microcystis aeruginosa. Дж. Фрешуот. Экол. 28: 477–487. http://dx.doi.org/10.1080/02705060.2013.78257910.1080/02705060.2013.782579Search in Google Scholar
[62] Zolla L. & Rinalducci S. 2002. Участие активных форм кислорода в деградации светособирающих белков под действием света стрессы. Биохимия 41: 14391–14402. http://dx.doi.org/10.1021/bi026577610.1021/bi0265776Поиск в Google Scholar
пабмед
http://dx.doi.org/10.1021/bi026577610.1021/bi0265776Поиск в Google Scholar
пабмед
[63] Цзо З.Дж., Чжу Ю.Р., Бай Ю.Л. и Ван Ю. 2012a. Летучие связи между клетками Chlamydomonas reinhardtii в условиях солевого стресса. Биохим. Сист. Экол. 40: 19–24. http://dx.doi.org/10.1016/j.bse.2011.09.00710.1016/j.bse.2011.09.007Поиск в Google Scholar
[64] Zuo Z., Zhu Y., Bai Y. & Wang Y. 2012б. Вызванная уксусной кислотой запрограммированная гибель клеток и высвобождение летучих органических соединений у Chlamydomonas reinhardtii. Завод Физиол. Биохим. 51: 175–184. http://dx.doi.org/10.1016/j.plaphy.2011.11.00310.1016/j.plaphy.2011.11.003Поиск в Google Scholar пабмед
Эта работа находится под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 3.0 License.
Концентрат карбоната натрия | 38170
для 1 л стандартного раствора, 0,05 М Na2CO3 (0,1 н.)
Синоним(ы)
Раствор карбоната натрия
- Обзор 909145 Документы
- Информация о безопасности
- 6 145 Свойства
Размер упаковки
Выберите вариант.
