Физические свойства магния: плотность, теплоемкость, теплопроводность
Представлены физические свойства магния Mg при различных температурах — в интервале от -223 до 1123°С. В таблице даны следующие свойства магния в твердом и расплавленном состояниях:
- плотность магния ρ;
- удельная теплоемкость Cp;
- коэффициент температуропроводности a;
- коэффициент теплопроводности λ.
Температура плавления магния составляет 650°С. Процесс плавления сопровождается значительным изменением физических свойств магния — в особенности таких, как плотность и удельная теплоемкость. Плотность расплава магния становиться значительно ниже. Удельная массовая теплоемкость магния при дальнейшем нагревании расплава слабо снижается.
Магний — легкий металл с низкой плотностью. Плотность магния при комнатной температуре равна 1737 кг/м3 или 1,73 г/см3. Этот металл намного легче железа и алюминия, но в 2-3 раза тяжелее щелочных металлов — таких, как литий, калий и натрий.
Плотность магния ρ уменьшается при нагревании. При увеличении температуры, например на 600°С, она снижается на 6% до значения 1635 кг/м3. Плотность жидкого магния значительно ниже, чем твердого. При температуре плавления плотность магния имеет величину 1580 кг/м3.
Удельная теплоемкость магния при росте температуры увеличивается во всем интервале до температуры плавления. Магний в жидком состоянии имеет обратную зависимость удельной теплоемкости от температуры — теплоемкость жидкого магния при нагревании снижается.
Теплопроводность магния λ достаточно высока. При температуре 27°С она имеет значение 156 Вт/(м·град), что в два раза больше теплопроводности железа. Теплопроводность магния схожа по величине с коэффициентом теплопроводности таких металлов, как бериллий и вольфрам. Зависимость теплопроводности магния от температуры подобна таковой у других металлов — при нагревании происходит снижение ее величины.
| Температура, °C | ρ, кг/м3 | Cp, Дж/(кг·град) | a·106, м2/с | λ, Вт/(м·град) |
|---|---|---|---|---|
| -223 | — | 418 | — | 465 |
| -173 | — | 648 | 148 | 169 |
| -72 | — | 934 | 97,1 | 159 |
| 27 | 1737 | 1025 | 87,4 | 156 |
| 127 | 1719 | 1072 | 82,8 | 153 |
| 227 | 1702 | 1118 | 79,2 | 151 |
| 327 | 1685 | 1164 | 75,6 | 149 |
| 427 | 1209 | 72,2 | 147 | |
| 527 | 1651 | 1255 | 68,9 | 146 |
| 627 | 1635 | 1301 | 65,6 | 145 |
| 650 | 1580 | 1410 | — | — |
| 723 | 1576 | 1372 | — | — |
| 923 | 1550 | 1295 | — | — |
| 1123 | — | 1251 | — | — |
Температуропроводность магния при комнатной температуре имеет значение 87,4·10-6 м2/с. Она значительно снижается с повышением температуры. Например, по данным таблицы, при температуре 527°С значение коэффициента температуропроводности этого металла будет равно 68,9·10-6 м2/с.
Примечание: допускается интерполяция значений физических свойств магния в таблице.
Источники:
- В.Е. Зиновьев. Теплофизические свойства металлов при высоких температурах.
- Лариков Л.Н., Юрченко Ю.Ф. Тепловые свойства металлов и сплавов.
thermalinfo.ru
Электролитическое получение магния — Знаешь как
Содержание статьи
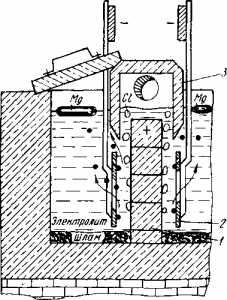 Магний получают электролизом расплавленных хлоридов магния, калия, натрия и кальция. На рис. показана схема ячейки электролизера. Анодами служат графитовые плиты 1, катодами — стальные пластины 2. Так как плотность расплавленного электролита больше, чем плотность магния в одинаковых температурных условиях, то выделяющийся на катоде жидкий магний, не растворяясь в электролите, в виде капель всплывает на его поверхность. На аноде выделяется газообразный хлор, который поднимается вверх и удаляется из электролита.
Магний получают электролизом расплавленных хлоридов магния, калия, натрия и кальция. На рис. показана схема ячейки электролизера. Анодами служат графитовые плиты 1, катодами — стальные пластины 2. Так как плотность расплавленного электролита больше, чем плотность магния в одинаковых температурных условиях, то выделяющийся на катоде жидкий магний, не растворяясь в электролите, в виде капель всплывает на его поверхность. На аноде выделяется газообразный хлор, который поднимается вверх и удаляется из электролита.
Во избежание взаимодействия хлора и магния и короткого замыкания анода и катода расплавленным магнием вверху устанавливают перегородку
Рис. Схема ячейки электролизера для получения магния
Собирающийся на поверхности катодного пространства магний периодически удаляют. Выделяющийся в анодном пространстве хлор отсасывают через трубу и используют, например, для хлорирования окиси магния.
Магний можно получить электролизом чистого расплавленного безводного хлористого магния, однако высокая температура плавления, низкая электропроводность и другие неблагоприятные свойства хлористого магния вынуждают прибегать к более сложным электролитам. Практически удобнее всего использовать карналлит, который обычно содержит в виде примеси хлористый натрий. Такой электролит обладает более низкой температурой плавления, более высокой электропроводнестью и меньше растворяет магний. Поэтому при работе с ним достигается более высокий выход по току и меньший расход электроэнергии.
Ниже приводятся сведения об основных свойствах электролитов.
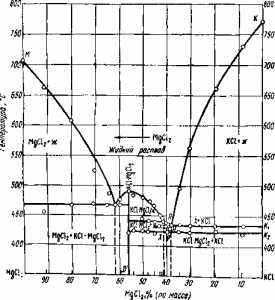
Рис. 2. Диаграмма плавкости системы MgCl2—KCl
Плавкость магния
Температура плавления компонентов электролита следующая: 718° С — MgCl2; 768° С — КСl; 800° С — NaCl; 774° С — СаСl2.
Смеси этих солей плавятся при значительно более низких температурах, что иллюстрируется, например, двойной диаграммой плавкости системы КСl—MgCl2 (рис.2). Возможности широко варьировать состав электролита особенно наглядно иллюстрирует диаграмма (рис.3).
Плотность магния
Плотность магния и карналлита находятся в пределах 1,6—1,7 г/см3, особенно они близки при температуре 700°С, наиболее удобной для электролиза. Аналогичная картина наблюдается и в тройных электролитах, содержащих MgCl
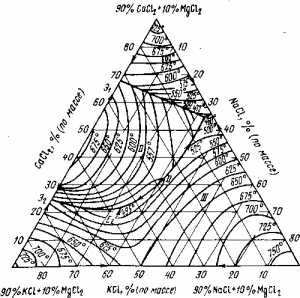
Рис. 3. Диаграмма плавкости системы хлоридов калия, натрия, магния и кальция при постоянном содержании хлористого магния (10%)
Электропроводность электролита магния
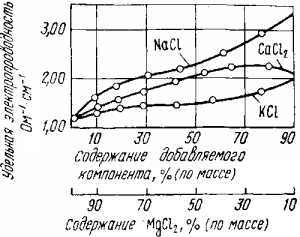
Зависит от его состава. Наименьшей удельной электропроводностью обладает MgCl2(при 800°С она равна 1,17 Ом•см-1). При этих же условиях
удельная электропроводность СаСl2 составляет 2,02, КCl — 2,42 и NaCl — 3,57 Ом -1•см-1.
На рис. 4 показано изменение удельной электропроводности хлористого магния при добавлении к нему хлористых солей натрия, калия, кальция. Из графика следует, что добавки хлоридов щелочных металлов, а также хлористого кальция значительно увеличивают электропроводность электролита.
Следует отметить, что изменение электропроводности хлористого магния при введении нескольких солей имеет сложный характер.
Напряжение разложения компонентов электролита
В температурных условиях электролиза все компоненты электролита MgCl2, КСl, NaCl и СаСl2ионизируются по следующим схемам:
MgCl2⇄ Mg2+ + 2Сl—СаСl2 ⇄ Са2+ + 2Сl—NaCl ⇄ Na+ + Сl—,
КСl ⇄ K+ + Сl—.
Рис. 4. Изменение удельной электропроводности хлористого магния при добавке к нему других хлоридов
Однако исследования показывают, что наличие в расплаве КО способствует образованию комплексных ионов:
KMgCl3 ⇄ К+ + MgCl3—
Наряду с этими ионами в электролите могут присутствовать и другие ионы, например ионы Mg+. На аноде в этих условиях возможен разряд только ионов хлора, на катоде могут выделяться ионы Mg2+, Са2+ Na+ и К+..
С целью выяснения возможности выделения на катоде наряду с магнием натрия, калия и кальция В. М. Гуськов и другие советские ученые провели обстоятельные исследования и расчеты. Установлено, что в температурных условиях промышленного электролиза (750° С) напряжение разложения MgCl2 равно 2,6В; NaCl 3,15 В; КCl 3,29 В и CaCl2 3,24 В. Так как напряжение разложения хлористого магния значительно меньше, чем других хлоридов, преимущественное выделение магния на катоде при равных концентрациях (вернее активностях катионов) сомнений не вызывает.
Однако в условиях промышленного электролиза возможны значительные колебания температуры электролита и концентрации (точнее активности) отдельных ионов. В этом случае равновесный обратимый потенциал выделения Е равен, как известно:
Е = E0 + ((RT):nF)lnC
где Е— электродный потенциал при концентрации ионов С и температуре Т;мЕ°—потенциал при концентрации ионов, равной 1 г-ионум в 1 л и температуре 298 К.
Следовательно, при нарушений условий электролиза—уменьшении концентрации в электролите ионов магния и повышении концентрации других ионов — наряду с магнием на катоде может начаться выделение и других металлов, в первую очередь натрия. Поэтому концентрация хлористого магния в электролите не должна быть ниже 5%.
Вязкость и поверхностное натяжение магния
Вязкость чистого расплавленного хлористого магния почти в три раза выше, чем вязкость расплавленных хлоридов натрия и калия. Уменьшение ее благоприятно сказывается на процессе электролиза. Хлориды калия и натрия, кроме вязкости, значительно снижают и поверхностное натяжение хлористого магния на границе с газовой фазой.
По практическим соображениям нежелательно иметь чрезмерно большое поверхностное натяжение электролита, которое затрудняет соединение отдельных капель металла, выделившихся на катоде. Однако нежелательно иметь и чрезмерно малое поверхностное натяжение на границе с газовой фазой, так как в этом случае магний, всплывающий на поверхность, разрывает поверхностную пленку электролита и может окислиться кислородом воздуха.
Чрезмерное снижение поверхностного натяжения электролита при уменьшении количества MgCl2 компенсируется наличием в электролите СаСl2, который, как и все хлориды щелочноземельных металлов, увеличивает поверхностное натяжение.
Температура электролиза магния
Температура плавления четырехкомпонентного электролита оптимального состава лежит в пределах 500° С и не лимитирует процесс электролиза так, как при электролитическом получении алюминия.
Нижний предел температуры процесса ограничивается точкой плавления магния, равной 651° С. Электролиз при температуре 650—660° С приводит к выделению магния в виде твердых мелких корольков, которые плохо всплывают и не могут сливаться в общую массу.
С повышением температуры уменьшается вязкость электролита, увеличиваются конвекционное и диффузионное проникновение растворенного в электролите магния и его мелких капель в анодное пространство, а также выброс хлора в катодную часть ванны, что ведет к большим потерям уже полученного металла и, следовательно, к бесполезным затратам электроэнергии. Одновременно увеличивается окисление и испарение магния, плавающего на поверхности электролита, в связи с повышением упругости его пара.
Наряду с этим повышение температуры электролита увеличивает его электропроводность, а следовательно, снижает напряжение на ванне. С учетом всех этих факторов электролиз ведут в температурном интервале 690—720° С.
Растворимость магния в электролите
В объяснении механизма растворения магния в электролите нет единой точки зрения. Одни исследователи считают, что магний образует в расплаве истинный и коллоидный раствор (так называемый «металлический туман»). Другие считают, что имеет место химическое взаимодействие магния с электролитом, ведущее к образованию субсоединений (соединений низшей валентности). Так или иначе растворение магния в электролите имеет место и приводит к бесполезным потерям электроэнергии из-за того, что растворенный металл, попадая в анодное пространство, вновь хлорируется.
По данным А. И. Журина, максимальной растворяющей способностью среди компонентов электролита обладает расплавленный хлористый магний (0,3%). Добавка к нему хлоридов натрия, калия и кальция снижает растворимость магния, т. е. и в этом случае влияет благоприятно.
Состав электролита магния
Практика работы заводов показала, что для получения магния целесообразно применять четырехкомпонентный электролит, содержащий MgCl2, СаСl2, NaCl и КCl, либо трехкомпонентный (без КCl). Кроме этих основных солей, входящих в состав электролита, на некоторых заводах вводят в электролит еще ряд добавок для улучшения показателей процесса.
Наибольший интерес представляет введение в электролит небольших количеств NaF и CaF2. Положительное влияние этих добавок на электролиз хлористых солей магния было подробно изучено П. П. Федотьевым и убедительно объяснено А. И. Беляевым и Е. А. Жемчужиной. Основываясь на обширном экспериментальном материале, они пришли к выводу, что введение в расплавленные хлористые сели небольших добавок фторйдов приводит к повышению поверхностного натяжения на границе с расплавленным магнием и твердым катодом, что способствует задержанию капель магния на катоде и тем самым их росту.
Практика показала, что целесообразнее вводить NaF, чем CaF2, так как он значительно лучше растворяется в электролите.
Есть ряд веществ, отрицательно влияющих на электролиз.
К таким веществам (примесям) надо в первую очередь отнести влагу, сульфаты, соли железа, окислы магния и бора.
Исследования П. П. Федотьева и других советских ученых показали, что каждая десятая доля процента влаги, содержащаяся в электролите, приводит к снижению выхода по току на 1 %. Под действием электрического тока влага разлагается с выделением на катоде водорода. Ряд исследователей считает, что влага взаимодействует с уже выделенным магнием по реакции
Н2О + Mg = MgO + Н2
что ведет не только к химическим потерям магния, но и способствует увеличению его физических потерь, так как окись магния, образующаяся на поверхности мелких корольков магния, затрудняет их слияние, а иногда и увлекает их в шлам.
Сульфат магния, попав в электролит, сильно снижает выход по току за счет реакций:
MgSО4 + 3Mg = 4MgO + S,
MgSО4 + Mg = 2MgO + SО2
что приводит к так называемому «кипению» электролита, которое возникает при заливке в ванну расплава даже с незначительным содержанием сульфатов.
На процесс электролиза очень сильно влияют соли железа. При содержании в электролите всего около 0,1% Fе на катоде некоторое время совсем не наблюдается выделения магния и затем значительно снижается выход по току, то же происходит при появлении в электролите титана. Предполагают, что в результате электролиза хлористых солей железа и титана на катоде выделяются их губчатые осадки, адсорбирующие окись магния и пассивирующие катод.
Окись магния непосредственно не влияет на электрохимический процесс получения магния. Она оседает на дно ванны, образуя шлам, увлекающий за собой мелкие корольки магния. Этот шлам приходится периодически вычерпывать, что является тяжелой работой. Кроме того, окись магния оседает на катоде, а это приводит к выделению магния в дисперсной форме. Мелкие капли магния всплывают медленнее крупных и поэтому больше уносятся в анодное пространство, где вновь хлорируются. Аналогичное, но более сильное влияние оказывают и соединения бора (B2O3).
В связи с изложенным, соли, поступающие на электролиз, должны содержать не более: 0,1% Н2O; 0,03% SO3; 0,04% FeCl3; 0,5% MgO; 0,002% В2O3и 0,008% Ті.
В результате изложенного выше сложного влияния различных факторов на свойства электролита магниевая промышленность различных стран применяет электролиты различных составов.
Наиболее широко применяют четыре типа электролитов, основной состав и свойства которых приведены в табл.
Таблица. Состав и свойства электролитов, применяемых для получения магния
| Содержание, % | Основные cвойства | ||||||
| Электролит | MgCl2 | KCl | NaCl | СаСl2 | температура кристаллизации, °С | плотность при 700 °С, г/см3 | удельная электропроводность при 700 °С Ом-1 • см |
| Калиевый (карналлитовый) | 5—12 | 70—78 | 12—16 | 0—2 | 650 | 1,60 | 1,83 |
| Калиево-натриевый | 8—16 | 38—44 | 38—44 | 4—6 | 625 | 1,63 | 2,10 |
| Натриево-кальциевый Натриевый | 8—16 ~ 25 | 0—10 — | 35—45 45—60 | 30—40 15—25 | 575 650 | 1,78 1,66 | 2,00 2,23 |
На отечественных заводах вошла в практику добавка к основным составляющим электролита небольших количеств (до 1%) фтористых солей натрия и кальция.
Показатели электролиза магния
Для выделения 12,16 г Mg (1 г-экв) надо затратить 26,8 А•ч, отсюда следует, что 1 А•ч выделяет 0,454 г Mg.
Расход электроэнергии при этом составит
Влияние состава электролита и температуры электролиза на выход по току (Кт) было рассмотрено выше.
Влияние температуры электролита на показатели процесса электролиза приведено на графике (рис.5), из которого следует, что наиболее экономичным является температурный интервал 715—725° С. Однако, учитывая, что повышение температуры приводит к загрязнению магния примесями (см. ниже) и большому шламообразованию, оптимальным температурным интервалом следует считать 700—720° С.
Рис.5. Изменение выхода по току и удельного расхода электроэнергии в зависимости от температуры при электролитическом получении магния. Работа на натриево-калиевом электролите (по данным Н. М. Зуева, В. В. Вуколова, А. Б. Иванова)
Увеличение плотности тока и межполюсного расстояния при прочих равных условиях несколько повышает выход по току,
однако приводит к увеличению напряжения на ванне (U) и, следовательно, к повышению расхода электроэнергии.
Кроме того, на показатели электролиза влияют глубина ванны, ее конструкция, а также качество обслуживания ванн и умение вести его в оптимальном режиме рабочими и инженерно-техническим персоналом.
Статья на тему Электролитическое получение магния
znaesh-kak.com
Электропроводность растворов магния — Справочник химика 21
Для электролиза раствора хлорида калия используют те же самые электролизеры, что и для электролиза хлорида натрия. Раствор, используемый для электролиза, содержит хлорида калия 345—370 кг/м , ионов кальция и магния в сумме не более 7-10 3 кг/м (больше, чем в растворе хлорида натрия из-за более высокой растворимости солей кальция в растворе КС1). В электролизерах получают электрощелока, содержащие 140— 175 кг/м гидроксида калия и до 0,35 кг/м хлората калия КСЮз. Хлор и водород по составу близки к газам, получаемым при электролизе раствора хлорида натрия. Выход по току гидроксида калия составляет 94,5—95%. Напряжение электролиза несколько ниже из-за более высокой электропроводности раствора хлорида калия. Так как молекулярная масса гидроксида калия больше, чем у гидроксида натрия, то соответственно ниже расход электроэнергии на тонну продукта. [c.82]
Чтобы расположить в ряд по уменьшению электропроводности растворы приведенных веществ, нужно перейти от процентной концентрации к молярной и учесть количество ионов, образующихся при диссоциации сильных электролитов (хлористый магний, сернокислая медь, азотнокислый цинк), и степень диссоциации слабых электролитов (муравьиная кислота). Глицерин — не электролит. [c.210]
Сернокислый магний и сернокислый натрий предназначаются для повышения электропроводности раствора, хлористый натрий — для повышения растворимости никелевого электрода, а борная кислота способствует поддержанию постоянной величины pH. Все компоненты растворяют в горячей воде, и затем раствор фильтруют. [c.245]
Активирование водой основано на том, что при разряде образуется хорошо растворимый хлорид магния, который обогащает электролит и повышает его электропроводность. В кислых растворах магний настолько легко растворяется, что потери его становятся слишком большими. В щелочных растворах он пассивируется. Использовать магний можно в нейтральных или слабощелочных растворах в присутствии ионов хлора. В нейтральных солевых растворах при хранении без отбора тока коррозия магния протекает медленно, но под нагрузкой при поляризации скорость коррозии растет, происходит выделение водорода тем большее, чем выше плотность тока разряда (это явление называется отрицательным дифференц-эффектом). Вследствие саморазряда теряется до 50% магния. Резервные элементы с магниевым электродом при работе разогреваются, что позволяет применять их при низких температу- [c.347]
Таблицы проверенных значений осмотических коэффициентов и коэффициентов активности перхлората магния опубликованы Стоксом в 1948 г. Была измерена электропроводность растворов перхлората магния в н-пропиловом и изопропиловом спиртах , в системе метанол—ацетон , в воде и в ацетоне, метиловом спирте и в нитрометане . Определена также электропроводность растворов перхлората кальция в ацетоне . [c.50]
Так, например, при титровании солей цинка и магния раствором Ва(0Н)2 наблюдается адсорбция ионов Ва2+ на образующихся осадках малорастворимых соединений, что приводит к изменению величины электропроводности раствора во времени [6]. В результате вблизи точки эквивалентности не наблюдается резкого излома кривой титрования. [c.25]
Методы, описанные выше, можно использовать также для анализа данных, полученных для одного комплекса ВА при нескольких значениях ионной силы. Пара значений a и С, которые, будучи подставлены в уравнение (2-8), дают постоянное значение Ki во всей концентрационной области, можно иногда найти методом подбора [3, 4]. Однако равноценно подходящими могут быть другие значения а и G Если экстраполяции проведены за пределы узкой области концентрации или если нет измерений при очень низких значениях ионной силы, то полученные значения зависят от выбранных значений a и G [19, 32, 47, 48, 92, 95, 99]. Например, данные по электропроводности раствора сульфата магния при концентрациях от 8- 10 до 8- 10 5 М и температуре 25°, использованные в уравнении (2-8), приводят к значению lg /(i = 2,21 для d=10 А и б =0 и к значению lg / i = 2,28 для й=14 А и 6=0 [95]. [c.48]
Он нашел, что растворы тех кислот, которые энергичнее реагируют с магнием, проводят лучше электрический ток. Что же касается растворов каждой из кислот в отдельности, то налицо сходство между концентрационными кривыми электропроводности и кривыми скорости реакции. Безводные кислоты не растворяют магний и не проводят тока. Наибольшей химической активностью обладают частицы кислот в наиболее разбавленных растворах. Молярная электропроводность растворов кислот также увеличивается при разбавлении раствора. Природа растворителя оказывает сходное влияние на химическую энергию тел и электропроводность их растворов. [c.50]
Физические свойства. По
www.chem21.info
Магний, окись электропроводность — Справочник химика 21
С повышением содержания полевого шпата увеличивается прочность на электропробой, а одновременное введение в шихту полевого шпата и кварца увеличивает механическую прочность. Увеличение содержания окиси магния уменьшает электропроводность и улучшает термоустойчивость керамики и ее стойкость к воздействию оснований. Окись бария придает изделиям щелочестойкость и повышает прочность их на изгиб, удар и электрическую прочность на пробой. Повышенное содержание фосфорного ангидрида (РзО ) придает изделиям повышенную кислотоупорность (даже против плавиковой кислоты) и понижает точку плавления массы. Окись цинка повышает кислотоупорность. Двуокись циркония увеличивает, кроме того, механическую и термическую стойкость. Окись хрома повышает щелочность без ущерба для кислотостойкости. Окись алюминия повышает термическую стойкость изделия. [c.375]Лучшей тепловой изоляцией для этих печей служит древесный уголь в виде крупки (1—3 мм). Имея малую тепло- и электропроводность, он защищает нагреватель от выгорания. Для внешней тепловой изоляции пригодна окись магния, которая мало реагирует с углем при температурах ниже 2000°, резко отличаясь от окиси кальция, которая с углем реагирует легко. [c.70]
Трубчатый нагреватель представляет собой спираль, свитую из тонкой нихромовой проволоки диаметром 0,5—1,5 мм и помещенную в защитную трубку из стали, меди или жаростойкого сплава. В пространство между спиралью и внутренней стенкой трубки запрессовывается тонко размолотая кристаллическая окись магния или порошкообразный кварц. Окись магния и кварц, обладая малой электропроводностью и высокой теплопроводностью, надежно изолируют спираль от трубки и вместе с тем достаточно хорошо проводят тепло. [c.72]
Приводились [177, 178] и более низкие величины энергии активации, близкие к 10—12 ккал/моль. Обычно считают, что углекислота, образующаяся одновременно с окисью этилена, частично получается в результате окисления последней, а частично независимым путем из этилена [177]. Это подтверждается при использовании в этилене [179]. Имеется сообщение [180], что углекислота может уменьшать скорость образования окиси этилена, тогда как ацетальдегид или хлорированные этилены [174, 181] увеличивают ее выход. На окисях меди и хрома окись этилена окисляется очень быстро подобные же результаты получены [182] для смеси окись магния — окись хрома. Куммер нашел [183], что на различных гранях монокристаллов серебра реакция протекает с различными начальными скоростями, однако спустя некоторое время эти скорости на различных гранях снова уравниваются, так как наблюдается некоторый процесс спекания (синтеринг). Кроме того, оказывается, что скорость реакции одинакова и на пленках, на поверхности которых первоначально находились различные грани [184]. Твигг [177] исследовал хемосорбцию реагентов на серебре и нашел, что этилен едва ли хемосорбируется, а хемосорбция кислорода — медленная и активированная. Он изучил также скорость реакции между этиленом и хемосорбированным кислородом и показал, что скорость образования окиси этилена пропорциональна доле 0о поверхности, покрытой кислородом, а скорость образования углекислоты пропорциональна 0 он считает, что скорость реакции определяется взаимодействием между хемосорбированным кислородом и молекулой этилена из физически адсорбированного слоя. Как и другие, Твигг полагает, что при нормальном окислении смеси этилена с кислородом скорость реакции лимитируется скоростью хемосорбцин кислорода. Любарский [185] измерил электропроводность пленок серебра на стеклянных нитях и показал, что хемосорбция кислорода вызывает переход электронов от серебра к хемосорбированным частицам, так что электропроводность пленки уменьшается. Однако в условиях реакции, приводящей к образованию окиси этилена, электропроводность близка к наблюдаемой для восстановленной пленки это подтверждает, что хемосорбция кислорода является медленной стадией. Наконец, некоторые изме- [c.334]
Как известно из практики, качество керамиковых изделий может быть улучшено путем введения различных добавок в основную сырьевую массу. Так, например, с повышением содержания глинозема увеличиваются механическая прочность, термическая стойкость, но при этом возрастает коэ( х )ициент расширения. С повышением содержания полевого шпата увеличивается прочность на электропробой, а одновременное введение в шихту полевого шпата и кварца увеличивает механическую прочность. Увеличение содержания окиси магния уменьшает электропроводность и улучшает термоустойчивость керамики и ее стойкость к воздействию оснований. Окись бария придает изделиям щелочестойкость и повышает прочность их на изгиб, удар и электрическую прочность на пробой. Повышенное содержание фосфорного ангидрида (Р2О5) придает изделиям повышенную кислотоупорность (даже против плавиковой кислоты) и понижает точку плавления массы. Окись цинка повышает кислотоупорность. Двуокись циркония увеличивает, кроме того, механическую и термическую стойкость. Окись хрома повышает щелочестойкость без ущерба для кислотостойкости. Окись алюминия (А1гОз) повышает термическую стойкость изделий. Кремнезем повышает кислотоупорность, но одновременно ухудшает механические свойства. Керамиковые изделия с улучшенными качествами могут быть получены на основе пирофиллита (естественного, природного водного алюмосиликата состава А12О3 45102 Н2О). [c.13]
Приборы и реактивы. (Полумикрометод.) Прибор для определения электропроводности растворов. Стаканы на 50 мл. Сахар (порошок). Поваренная соль кристаллическая. Ацетат натрия. Хлорид аммония. Цинк гранулированный. Индикаторы лакмусовая бумага, спиртоной раствор фенолфталеина, метиловый оранжевый. Спирт метиловый. Глюкоза. Окись кальция. Полупятиокись фосфора. Растворы соляной кислоты (2 и 0,1 н.), серной кислоты (2 и 4 н., 1 1), уксусной кислоты (2 и 0,1 н., концентрированный), едкого натра (2 и 4 н.), трихлорида железа (0,5 н.), сульфата меди (II) (0,5 н.), дихлорида магния (0,5 н.), сульфата натрия (0,5 н.), силиката натрия (0,5 н.), хлорида бария (0,5 н.), хлорида кальция (0,5 н.), нитрата серебра (0,1 н.), иодида калия (0,1 н.), карбоната натрия (0,5 н.), хлорида аммония (0,5 н.), перманганата калия (0,5 н.), сульфата калия (0,5 н,), трихлорида алюминия (0,5 н.), хлорида цинка (0,5 н.), аммиака (0,1 н.), ацетата натрия (2 н.). [c.55]
Исследование влияния добавок на вязкость и электропроводность жидкой фазы проводилось с помощью вибрационного вискозиметра-кондуктометра [15]. Для исследования была синтезирована смесь, соответствующая четверной эвтектике в системе СаО—SiOa—АЬОз—РегОз, т. е. первичной жидкой фазе клинкера. В исходной смеси от 0,6 до 15% СаО замещалась на эквимоляр-ную долю ВаО или SrO. Окись магния вводилась в щихту в количестве до 5% без уменьшения содержания извести. [c.336]
Ленпицкий [27], а также Мэнсфилд [28] считают окись магния
www.chem21.info
Электропроводность — алюминий — Большая Энциклопедия Нефти и Газа, статья, страница 4
Электропроводность — алюминий
Cтраница 4
Более важным свойством покрытий при использовании их как электрических контактов, является высокая твердость и способность оставаться без окисных пленок и тусклого налета. Таким образом, несмотря на то, что электропроводность алюминия в четыре раза выше электропроводности олова, его часто покрывают слоем олова, чтобы улучшить электроконтактные свойства. Другими металлическими покрытиями, обычно применяемыми для низковольтной аппаратуры, являются золото, олово — свинец, серебро, палладий, медь, родий и никель. [46]
Медные жилы для повышения электропроводности изготовляются из отожженной проволоки. Алюминиевые жилы не нуждаются в отжиге, так как электропроводность алюминия не изменяется от степени отжига. [47]
Токопроводящие жилы силовых кабелей изготовляются из медной или алюминиевой проволоки. Так как электропроводность меди примерно в 1 65 раза выше электропроводности алюминия, то для одной и той же нагрузки сечение алюминиевых жил должно быть соответственно больше сечения медных жил. Медные токо проводящие жилы имеют более высокую механическую прочность, чем алюминиевые. Преимущества алюминия как материала для токопроводящих жил заключается в том, что удельный вес алюминия в 3 3 меньше удельного веса меди, и поэтому при одной и той же электропроводности жил вес их примерно в 2 раза меньше веса медных жил. Кроме того, преимуществом алюминиевых жил являются дешевизна и меньшая дефицитность ( по сравнению с медью) алюминия. [48]
Литий в сплавах способствует возрастанию их модуля упругости. Вместе с тем магний и марганец снижают тепло — и электропроводность алюминия, а железо — его коррозионную стойкость. [49]
Магний отличается средней твердостью и довольно тягуч, так что при вальцевании из него удается получать тонкие листы и проволоку; однако эти его свойства значительно изменяются под влиянием очень небольших примесей. Электропроводность магния составляет 9 / 25 электропроводности меди и 12 / 19 электропроводности алюминия, а теплопроводность равна 5 / 13 теплопроводности меди и 7 / д соответствующей величины для алюминия. Холодная вода действует на магний крайне медленно; тем не менее при действии воды на обезжиренные стружки магния ( промытые в эфире) по поднимающимся пузырькам газа можно судить о выделении водорода. С кипящей водой эта реакция протекает гораздо энергичнее. [50]
Страницы: 1 2 3 4
www.ngpedia.ru
Ответы@Mail.Ru: сравнить медь и алюминий
Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности среди металлов после серебра) . Удельная электропроводность при 20 °C: 55,5-58 МСм/м [Из-за низкого удельного сопротивления (уступает лишь серебру, удельное сопротивление при 20 °C: 0,01724-0,0180 мкОм·м [5]), медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 % Алюминий Металл серебристо-белого цвета, лёгкий плотность — 2,7 г/см³ температура плавления у технического алюминия — 658 °CШироко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость (на воздухе алюминий мгновенно покрывается прочной плёнкой Al2O3, которая препятствует его дальнейшему окислению) , высокая теплопроводность, неядовитость его соединений. В частности, эти свойства сделали алюминий чрезвычайно популярным при производстве кухонной посуды, алюминиевой фольги в пищевой промышленности и для упаковки. Первые же три свойства сделали алюминий основным сырьем в авиационной и авиакосмической промышленности (в последнее время медленно вытесняется композитными материалами, в первую очередь, углеволокном) . Основной недостаток алюминия как конструкционного материала — малая прочность, поэтому для упрочнения его обычно сплавляют с небольшим количеством меди и магния (сплав называется дюралюминий) . Электропроводность алюминия всего в 1,7 раза меньше, чем у меди, при этом алюминий приблизительно в 4 раза дешевле [12] за килограмм, но, за счёт в 3,3 раза меньшей плотности, для получения равного сопротивления его нужно приблизительно в 2 раза меньше по весу. Поэтому он широко применяется в электротехнике для изготовления проводов, их экранирования и даже в микроэлектронике при изготовлении проводников в чипах. Меньшую электропроводность алюминия (37 1/ом) по сравнению с медью (63 1/ом) компенсируют увеличением сечения алюминиевых проводников. Недостатком алюминия как электротехнического материала является наличие прочной оксидной плёнки, затрудняющей пайку.
touch.otvet.mail.ru
