Кислород. O2 балонный. по ГОСТ 5583-78. Основные физические и химические свойства. Чистота. Опасность.
| ГОСТы, СНиПы Карта сайта TehTab.ru Поиск по сайту TehTab.ru | Навигация по справочнику TehTab.ru: главная страница / / Техническая информация/ / Свойства рабочих сред/ / Кислород O2 (хладагент R732) / / Кислород. O2 балонный. по ГОСТ 5583-78. Основные физические и химические свойства. Чистота. Опасность.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Нашли ошибку? Есть дополнения? Напишите нам об этом, указав ссылку на страницу. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
TehTab.ru Реклама на сайте | Обращаем ваше внимание на то, что данный интернет-сайт носит исключительно информационный характер. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Все риски за использование информаци с сайта посетители берут на себя. Проект TehTab.ru является некоммерческим, не поддерживается никакими политическими партиями и иностранными организациями. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Все риски за использование информаци с сайта посетители берут на себя. Проект TehTab.ru является некоммерческим, не поддерживается никакими политическими партиями и иностранными организациями. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Кислород газообразный технологический компримированный (в баллонах)
Для хранения и перевозки кислорода под избыточным давлением 150 кгс/см2 применяют баллоны.
Окрашивают баллоны с кислородом в голубой цвет, а на наружной поверхности наносится черной краской надпись «Кислород».
Во избежание ошибочного наполнения кислородом баллонов из-под горючих газов и наоборот вентили баллонов для горючих газов снабжают левой резьбой.
Арматура на баллонах со сжатым кислородом должна быть исправной и обеспечивать герметичность.
Перевозить наполненные кислородом баллоны нужно на рессорном транспорте или на автокарах в горизонтальном положении с обязательными прокладками между ними.
Допускается перевозка баллонов в вертикальном положении в специальных приспособлениях, исключающих удары и падения. На баллонах при перевозках должны быть предохранительные колпаки.
Баллоны, наполненные кислородом, хранят в специальных складских помещениях или на открытых площадках под навесом, защищающим баллоны от атмосферных осадков и прямых солнечных лучей.
Кислород газообразный технологический компримированный по физико-химическим свойствам соответствует ТУ 113-03-452-92:
|
Наименование показателя |
Норма |
|
1 Объемная доля кислорода, %, не менее |
95 |
|
2 Объемная доля водорода, %, не менее |
0,7 |
|
3 Массовая концентрация водяных паров в г/м3 при н. |
0,07 |
Химические и физические свойства
Кислород обладает высокой химической активностью и образует оксиды со всеми химическими элементами, кроме инертных газов.
Кислород при нормальных условиях является бесцветным газом; он не имеет запаха, вкуса и несколько тяжелее воздуха.
При охлаждении кислорода под атмосферным давлением до температуры минус 183 0С он превращается в прозрачную голубоватую легкоподвижную жидкость, быстро испаряющуюся при комнатной температуре.
Горючие газы (водород, ацетилен, метан и др.) образуют с кислородом сильно взрывчатые смеси. Смазочные масла, а также их пары, при соприкосновении с чистым кислородом способны окисляться, а при определенных условиях и самовоспламеняться со взрывом.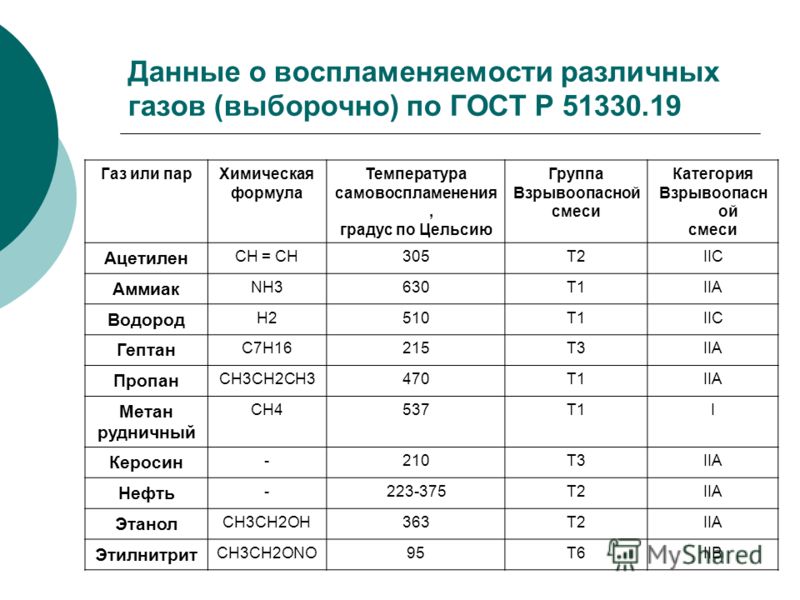 Если кислород находится под повышенным давлением, то опасность самовоспламенения горючих веществ и взрыва увеличивается.
Если кислород находится под повышенным давлением, то опасность самовоспламенения горючих веществ и взрыва увеличивается.
Производство
Сырьем для промышленного получения кислорода методом криогенной ректификации является атмосферный воздух.
Сферы применения
Кислород завоевал популярность и нашел применение в различных производственных направлениях, таких как:
- металлургическая промышленность – при конвертерной обработке металла, для отделения золота от руды, выплавки цветных металлов, газопламенной сварки и резки металла; выплавка чугуна и стали
- в теплоэнергетике для розжига твердого топлива и прессования водно-угольной смеси;
- химическая промышленность – при производстве различных кислот и веществ;
- для бурения твердых пород в горнодобывающем производстве;
- военное дело – для приведения в работу дизельных двигателей на подводных лодках, а также в ракетных двигателях в качестве окислителя для ракетного топлива;
- сельскохозяйственное производство – для насыщения кислородом водоемов при разведении рыбы, обогащение кислородом пищи для животных.

Токсичность/Опасность
Кислород — нетоксичное вещество, не оказывающее вредного влияния на окружающую среду.
Он не воспламеняется и не взрывоопасен, но являясь сильным окислителем, резко увеличивает способность других материалов к горению.
В атмосфере, обогащенной кислородом, горючие вещества становятся более опасными: легче загораются, имеют более низкую температуру самовоспламенения, более широкий диапазон концентрационных пределов распространения пламени паров в результате значительного возрастания верхнего предела распространения пламени, большую скорость выгорания и полноту сгорания.
Для обеспечения безопасности при работе с кислородом необходимо исключить присутствие на поверхностях, контактирующих с кислородсодержащими средами, жиро-масляных отложений.
При работе с кислородом запрещается носить спецодежду из синтетических материалов, могущих вызвать накопление зарядов статического электричества.
Поскольку кислород тяжелее воздуха, он имеет свойство накапливаться в приямках, канавах. Поэтому все помещения должны быть оборудованы вентиляцией. После работы желательно проветрить одежду в течение получаса, так как ткани и волосы могут насыщаться кислородом.
Поэтому все помещения должны быть оборудованы вентиляцией. После работы желательно проветрить одежду в течение получаса, так как ткани и волосы могут насыщаться кислородом.
Нахождение в природе
Кислород – наиболее распространенный в природе химический элемент. Он входит в состав многих органических веществ и присутствует во всех живых клетках.
На его долю (в составе различных соединений), приходится около 47,4 % массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 88,8 % (масс.), в атмосфере содержание свободного кислорода составляет 21 % (об.). Элемент кислород входит в состав более 1 500 соединений земной коры.
Кислород способствует большинству органических жизненных процессов, главный из которых – дыхание.
Обратите внимание на другие сферы деятельности ОХК «Щекиноазот»:
- спанбонд (нетканое полотно)
- сухой лёд (гранулированный)
- гидроизоляционные мембраны, не подверженные гниению и плесени.

Просмотреть прайс-лист
Горячее пламя: Все ли языки пламени имеют одинаковую температуру?
Все ли языки пламени имеют одинаковую температуру? Если нет, то что заставляет их температуру различаться?
Элизабет Бромэм , Каллиста, Виктория, Австралия
Пламя возникает, когда два газа вступают в реакцию с выделением тепла и света. Различные реакции производят разное количество тепла, поэтому нет, не все языки пламени имеют одинаковую температуру. Кто невредимым провел пальцами по желтому пламени свечи, но обжегся голубым пламенем газовой плиты, поймет это.
Роб Леа , Лондон, Великобритания
Реклама
Пламя может иметь температуру от 600°C до более чем 3000°C. Одним из факторов является энергия, выделяемая при сгорании топлива. Ацетилен, например, горит очень сильно из-за тройной связи между атомами углерода в нем.
Другие факторы, повышающие температуру пламени, включают использование чистого кислорода, а не воздуха, наличие необходимого количества кислорода для обеспечения полного сгорания топлива и низкое тепловое излучение в окружающую среду. Голубое пламя обычно более горячее, чем светящееся пламя, такое как свеча, потому что в светящемся пламени частицы углерода, образующиеся при неполном сгорании, излучают энергию в виде инфракрасного излучения и видимого света.
Голубое пламя обычно более горячее, чем светящееся пламя, такое как свеча, потому что в светящемся пламени частицы углерода, образующиеся при неполном сгорании, излучают энергию в виде инфракрасного излучения и видимого света.
Все это объясняет, почему кислородно-ацетиленовое пламя используется в горелках для сварки и резки: пламя, образующееся при сжигании ацетилена в чистом кислороде, достаточно горячее, чтобы расплавить сталь.
John Rowland , Дерби, Великобритания
Пламя существует потому, что атомы или молекулы, содержащие высокоэнергетические внешние электроны, реагируют друг с другом. Это означает, что они обмениваются электронами и оседают как стабильные молекулы. Электроны освобождаются от химических связей, и хотя образующиеся молекулы могут быть стабильными, они движутся с большими скоростями, поэтому они горячие.
Обычное бытовое пламя для обогрева и освещения достигает температуры примерно от 800°C до 1000°C. Ацетилен, сожженный в кислороде, может нагреваться почти до 3500°C благодаря концентрации очень активных электронов, которые удерживают тройную углеродную связь вместе. Атомы углерода соединяются с поступающими атомами кислорода на очень высоких скоростях, высвобождая сверхзвуковые молекулы окиси углерода, которые, в свою очередь, образуют двуокись углерода. Вся эта скорость приводит к большому количеству тепла в очень маленьком объеме.
Атомы углерода соединяются с поступающими атомами кислорода на очень высоких скоростях, высвобождая сверхзвуковые молекулы окиси углерода, которые, в свою очередь, образуют двуокись углерода. Вся эта скорость приводит к большому количеству тепла в очень маленьком объеме.
Чтобы ответить на этот вопрос или задать новый, напишите по адресу lastword@newscientist.com.
Вопросы должны представлять собой научные исследования о повседневных явлениях, а вопросы и ответы должны быть краткими. Мы оставляем за собой право редактировать элементы для ясности и стиля. Пожалуйста, укажите почтовый адрес, номер телефона для работы в дневное время и адрес электронной почты.
New Scientist Ltd сохраняет за собой полный редакционный контроль над опубликованным контентом и оставляет за собой все права на повторное использование материалов вопросов и ответов, которые были отправлены читателями на любом носителе или в любом формате.
Вы также можете отправить ответы по почте: The Last Word, New Scientist, 25 Bedford Street, London WC2E 9ES.
Применяются положения и условия.

 1
1 Использовать углекислотные огнетушители, воду и др.
Использовать углекислотные огнетушители, воду и др. у., не более (что соответствует температуре насыщения кислорода при давлении 760 мм рт.ст. в 0С не выше минус 43)
у., не более (что соответствует температуре насыщения кислорода при давлении 760 мм рт.ст. в 0С не выше минус 43)

 Адиабатическая температура пламени при постоянном давлении – это температура, возникающая в результате полного процесса горения, происходящего без передачи тепла или изменения кинетической или потенциальной энергии. Его температура ниже, чем в процессе постоянного объема, поскольку часть энергии используется для изменения объема системы (т. е. для создания работы).
Адиабатическая температура пламени при постоянном давлении – это температура, возникающая в результате полного процесса горения, происходящего без передачи тепла или изменения кинетической или потенциальной энергии. Его температура ниже, чем в процессе постоянного объема, поскольку часть энергии используется для изменения объема системы (т. е. для создания работы). Это связано с тем, что с точки зрения стехиометрии при сгорании органического соединения с n атомов углерода разрывается примерно 2 n связей C–H, n связей C–C и 1,5 n O 2 связей. с образованием примерно n молекул CO 2 и n H 2 молекул O.
Это связано с тем, что с точки зрения стехиометрии при сгорании органического соединения с n атомов углерода разрывается примерно 2 n связей C–H, n связей C–C и 1,5 n O 2 связей. с образованием примерно n молекул CO 2 и n H 2 молекул O. 0010 P − U R
0010 P − U R 
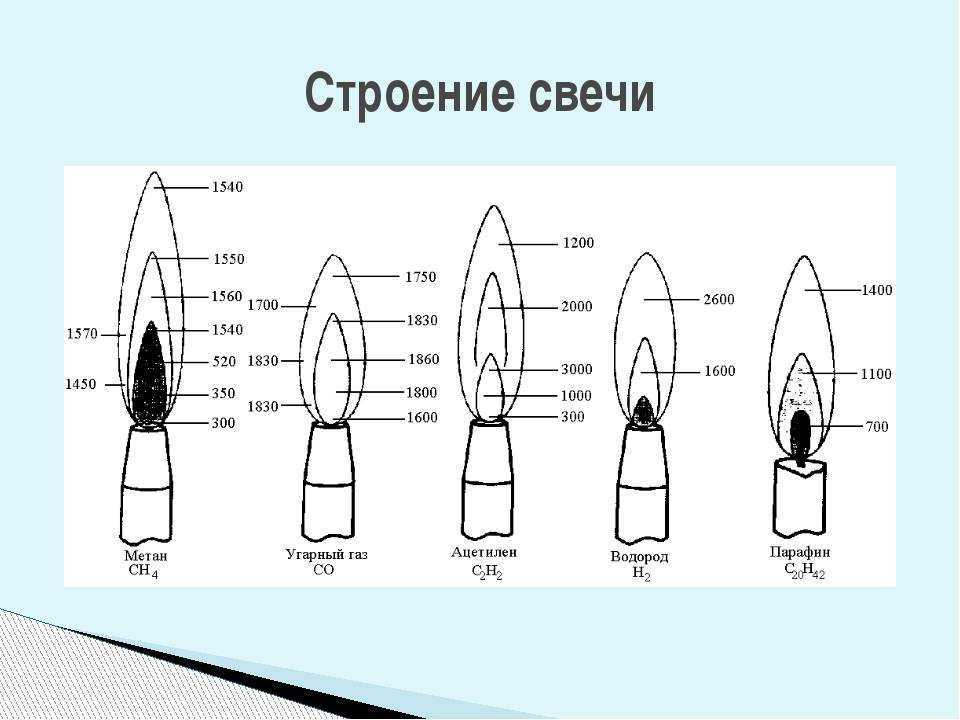 Для адиабатического процесса с постоянным давлением, когда происходит сгорание, поршень движется, чтобы поддерживать постоянное давление (дизельный цикл или цикл постоянного давления).
Для адиабатического процесса с постоянным давлением, когда происходит сгорание, поршень движется, чтобы поддерживать постоянное давление (дизельный цикл или цикл постоянного давления).
