Стекло температура — Справочник химика 21
Для придания стеклу тех или иных физико-химических свойств (прозрачности, химической, термической и механической прочности и пр.) вводятся соответствующие добавки, изменяющие состав и структуру стекол. Так, у стекла, содержащего вместо натрия калий (калиевое стекло), температура размягчения выше, чем у обычного натриевого стекла. Поэтому оно используется для изготовления специальных лабораторных приборов. Замена кальция на свинец, а натрия на калий придает стеклу повышенный показатель преломления, большую плотность. Из свинцового стекла (хрусталя) изготовляют вазы, фужеры и пр. Добавление к стеклу соединений кобальта придает им синюю окраску, СгаОз — изумрудно-зеленую, соединений марганца — фиолетовую окраску и т.д. Существенно изменяются свойства стекол, содержащих ВаОз (см. стр. 522). [c.478]Марка стекла Температура размягчения по методу ИФП. °с Гс, °с Гт. °С Продолжительность термообработки. ч Гп. С Гд. С Дефекты
Увеличение переохлаждения приводит к росту вязкости жидкой фазы. В расплавах веществ, в которых скорости образования зародышей и роста кристаллов очень малы, а вязкость жидкости при охлаждении резко увеличивается, кристаллизация вообще может не начаться — плав превращается в твердую аморфную массу (стекло). Температура, ниже которой кристаллизация не происходит, называется температурой стеклования. [c.261]
Плавление кремнезема начинается при температуре около 1720° С, однако при этой температуре расплав обладает большой вязкостью и поэтому при получении кварцевого стекла температура расплава поддерживается в пределах 1810—1850° С. При дальнейшем перегреве расплава начинается интенсивное испарение кремнезема, так как температура кипения его около 2100° С. При продолжительном нагреве свыше 1200° С стекло самопроизвольно расстекловывается , т. е. переходит в одну из кристаллических модификаций кварца, что сопровождается изменением объема. Степень кристаллизации зависит как от температуры, так и от наличия газовых включений и содержания примесей. [c.185]
Марка стекла Температура 1 спекания, °С Марка стекла Температура 11 спекания, С Марка стекла Температур 1 спекания, С [c.340]
Использование стекла в качестве материала в химических лабораториях обусловлено в основном следующими его свойствами прозрачностью, химической и термической устойчивостью, легкоплавкостью, пластичностью в жидком состоянии, а также стабильностью стекловидного состояния. В табл. Е.1. указаны свойства и области применения наиболее употребительных сортов лабораторного стекла температурой стеклования (Тст) называют температуру, при которой вязкость стекла равна пуаз. Ниже температуры стеклования стёкла находятся в твердом состоянии, при нанесении на них царапин образуются трещины выще температуры перехода стёкла существуют в пластичном состоянии.
Приборы, требующие максимальной термостойкости, готовят из кварцевого стекла, температура размягчения которого 1400° С. При такой термостойкости оно обладает очень высокой устойчивостью к изменению температуры, так как имеет очень малый коэффициент расширения (6-10 см/° С). В отличие от обычного кварцевое стекло прозрачно для ультрафиолетовых лучей. Поэтому, когда реакции проводят под воздействием ультрафиолетового облучении, отдельные части прибора готовят из кварцевого стекла. [c.6]
Газопроницаемость стекол зависит от рода газа, состава стекла, температуры нагрева и толщины стенок. Чем плотнее структура стекла и чем больше молекула газа, тем меньше газопроницаемость. [c.18]
Бак 7 для приготовления рабочего раствора силиката натрия вместимостью 7 заполняют водой менее чем на V2 высоты нижнего водомерного стекла. Температура воды в баке должна быть не выше 40 °С, [c.156]
Этот метод рассматривается в ряде работ, там же приводятся его модифицированные варианты [87, 88, 90, 93, 94]. Как выяснилось, структура образованного-на внутренней поверхности стеклянного капилляра слоя карбоната бария в значительной степени зависит от ряда факторов, например от структуры поверхности стекла, температуры кристаллизации, концентрации гидроксида бария и т. д. [90, 93]. Кристаллики карбоната-, бария могут образовываться на любом типе стекла, но структура и состав стекла влияют на размер, форму и расположение кристалликов [90]. [c.75]
Марка стекла Температура, «С [c.328]
Известно, что диффузия воды в низкомолекулярных стеклах идет чрезвычайно медленно. Поэтому но всей области температур и влажностей, в которой сохраняется стеклообразное состояние сорбента, сорбция идет только на поверхности кусочков сахарного стекла и значения ее очень малы. Эта картина сохраняется до тех пор, пока содержание воды в поверхностном слое не достигает тех величин, которые соответствуют условиям илавления сахарного стекла. Температура плавления этих стекол зависит от содержания в них воды и понижается по мере увеличения влажности. При этом температура плавления может снизиться до той температуры, нри которой ведется сорбционный опыт, и тогда мы будем наблюдать плавление сахара в результате сорбции воды.
Мы пользуемся суспензией сперматозоидов, полученной при продольном разрезании придатка семенника крысы и дозированном (2 минуты) перемешивании его в 2 мл физиологического раствора на часовом стекле (температура раствора +20″). [c.253]
Сублимация — испарение твердых тел — происходит в результате того, что некоторые атомы с поверхности кристалла отрываются от своих соседей и уносятся Б окружающее пространство. Для подавляющей части минералов этот процесс при нормальной температуре практически равен нулю, только символически мож.чо говорить о давлении насыщенного пара 8102, находящегося в равновесии с любой из твердых модификаций кремнезема. Однако при получении кварцевого стекла температура выше 1500 °С приводит к значительным потерям шихты в результате испарения ЗЮг. Из природных минералов, вероятно, только лед при температурах ниже нуля испаряется в заметных количествах, все остальные твердые минералы при стандартных условиях (Т—25°С р= =760 мм рт. ст.) практически не сублимируют. [c.75]
Иногда катализаторы на основе сплавов используют в виде непрерывных напыленных пленок значительной толщины. По сравнению с катализаторами в виде фольги или проволоки пленки сплавов имеют более чистую поверхность, особенно если их получают в условиях СВВ. Кроме того, можно приготовить пленки с достаточно большой поверхностью. Однако эти преимущества достигаются за счет довольно большой неопределенности равновесного состава сплава вследствие ограничений, связанных с термостойкостью аппаратуры. Для подложки из стекла температура обработки пленки не превышает 670 К.
Бромирование этилена на поверх- ности стекла температура 16° 3553 [c.388]
Расплавленные образцы выливали в виде растворов полимера в декалине на слюду или на покрытое угольной пленкой стекло, температура которых составляла 120—125°. Затем испаряли растворитель и на подложке оставалась тонкая пленка расплава смеси полиэтилена с парафином. Сдвиговые деформации в расплаве создавали путем непрерывного перемещения покровного стекла, накладываемого на образец, или металлического скребка. Направление сдвига на всех микрофотографиях указано стрелкой. Затем парафин удаляли вымыванием ксилолом по методике, описанной в работе [7]. Структуры, наблюдаемые в электронном микроскопе, соответствуют промежуточным стадиям процесса кристаллизации. По своей морфологии эти структуры вполне аналогичны наблюдаемым при травлении полированных поверхностей металлических отливок [1]. [c.123]
Температура стеклования стекл) Температура, при которой полимер приобретает эластичные свойства (переход второго рода) [c.228]
Весьма ценны ми свойствами металлов являются их пластичность, упругость, прочность. Они способны под давлением изменять свою форму, не разрушаясь. Это свойство металлов позволяет прокатывать их в листы или вытягивать в проволоку. Прочность и пластичность металлов зависят от температуры с повышением температуры прочность понижается, а пластичность возрастает. По степени твердости металлы значительно отличаются друг от друга. Так, калий, натрий — металлы мягкие (их можно резать ножом) хром по твердости близок к алмазу — царапает стекло. Температура плавления и плотность металлов также изменяются в широких интервалах. Самый легкоплавкий металл — ртуть (температура плавления — 38,87 °С) самый тугоплавкий—вольфрам (температура плавления 3370 С). Плотность лития — 0,59 г/см , а осмия — 22,48 г/см . Металлы отличаются также своим отношением к магнитным полям. По этому свойству онн делятся на 3 группы.
В местах, где возможны поломки стекол, могущие повлечь за собой взрыв, для застекления коробов следует применять небьющееся стекло. Температура поверхностей всех частей светильника, соприкасающихся со взрывоопасной средой, не должна превыщать величин, обеспечивающих безопасность в отношении взрыва. [c.840]
Атермический механизм четко наблюдается в неорганических стеклах, температура хрупкости которых находится при очень высоких температурах. Процессы разрушения в стеклах обстоятельно исследованы Керкгофом [11.20]. [c.310]
Для придания стеклу тех или иных физико-химических свойств (прозрачности, химической, термической и механической прочности и пр.) вводятся соответствующие добавки, изменяющие состав и структуру стекол. Так, у стекла, содержащего вместо натрия калий (калиевое стекло), температура размягчения выше, чем у обычного натрйе- [c.451]
Основной частью аппаратуры является сожигательная трубка из тугоплавкого стекла (температура размягчения >850° С), кварца или фарфора. Все эти трубки могут выдерживать максимальную температуру, необходимую при сжигании топлива. Недостатками кварцевых трубок являются нх доро-гоеизна и хрупкость, а фарфоровых — непрозрачность. Кроме того, у этих трубок практически невозможно оттягивать концы их для непосредственного соединения. с поглотительным прибором при помощи резиновой трубки. Поэтому соединения приходится делать посредством вставленной в трубку пробки с проходящим через нее отрезком стеклянной трубочки, что менее удобно. [c.144]
Константа обмена этого процесса (Кови) зависит от сорта стекла, температуры, состава раствора и определяется выражением [c.186]
Термооптические исследования проводились на термостолике Boetius РНМК 81/3007 с электрическим нагревателем и реостатным регулятором. Образец н-парафина предварительно расплавлялся между двумя покровными стеклами. Температура измерялась ртутным термометром со шкалой от О до 50 °С и ценой деления 0.1 °С. Погрешность поддержания и определения температуры 0.5 °С. Остывание препарата не регулировалось и происходило за счет разницы температуры препарата и окружающей среды. Погрешность определения температуры в этом случае оценена в 3 °С. Часть экспериментов проведена с использованием дополнительного термостата с устройством для автоматического регулирования температуры погрешность поддержания и определения температуры в этом случае составляла 0.5 °С.
Гилло [707] описал метод очистки сероуглерода, а также предложил критерии чистоты при использовании его в качестве стандартного органического вещества. Сероуглерод был эффективно очищен пУтем трех перегонок в аппарате, целиком изготовленном из стекла. Температура его кипения составляла 46,25°, плотность была равна 1,29268. Чистый сероуглерод обладает слабым запахом и хорошо сохраняется в темноте. [c.437]
Марка етекла Температура спекания, С Марка стекла а я л ш ш Л у Ш Температура спекания, С Марка стекла Температура спекания, °С [c.340]
Навеску вещества весом 5—20 мг помещали в тигель, который был приблизительно на 10 мм ниже электронного нучка. За процессом исиарения в тигле можно было наблюдать через плоское окно из иирексового стекла. Температуру тигля измеряли оптическим пирометром. Подставка для тигля служила одновременно заглушкой для отверстия в ионном источнике. Для уплотнения использовали серебряную прокладку. Чтобы свести к минимуму линии,, обусловленные остаточпыми газами и вторичными реакциями [14], давление в камере анализатора, измеряемое ионизационным манометром, поддерживали ииже 5-10″ мм рт. ст. После измерения интенсивности этих линий тигель с навеской исследуемого вещества устанавливали в оптимальное положение и начинали медленно его нагревать. Для того чтобы не допустить конденсации на стенках элементов V и VI групп, которые являются непроводниками, ионный источни) также нагревали до температуры около 180°. При магнитной развертке масс-спектра ионов с массой от 10 до 300 использовали ускоряющее напряжение 2000 в. Для того чтобы снять снектр в области масс до 600, ускоряющее напряжение снижали до 1000 в. Величина ионизирующего наиряже-яия составляла 70 в. [c.523]
Гидроперекись индана (III) [2]. 500 г (около 5 молей) свежеперегнанного индана встряхивают в присутствии сухого кислорода в течение 24 час, одновременно облучая его светом ртутной лампы (500 вт) и лампы накаливания (240 вт), служащей в качестве источника тепла. Ртутная лампа находится на расстоянии 40 см, а лампа накаливания — 8 см от реакционного сосуда — круглодонной колбы из молибденового увиолевого иенского стекла. Температура содержимого колбы во время опыта 60° поглощается 4,7 л (около 0,2 моля) кислорода. После этого индан, содержащий перекись, охлаждают до —5° и тонкой струей при перемешивании добавляют 40 г 25%-ного раствора едкого натра. Выделяю- [c.85]
Интенсификация процесса обезжиривания в щелочах достигается применением катодной поляризации или комбинированпем катодной, а затем анодной обработки. В качестве дополнительного электрода применяют стальные или никелевые пластины. Состав раствора при этом следующий 40—50 г/л каустической соды, 20—40 г л кальцинированной соды, 10—20 г л фосфата натрия, 35 г/л жидкого стекла. Температура электролита 60—85 С, плотность тока 3—10 а дм , напряжение 3—12 в. Расстояние между электродами 5—15 см время обработки на катоде — 4—Ъмин на аноде — 0,5—1,0 мин. [c.86]
Плавленные флюсы представляют собой сложные силикаты, близкие по своим свойствам к стеклу. Температура их плавления — около 1200 °С. Эти флюсы, как правило, слабые раскислители. На ремонтных предприятиях наибольшее распространение получили плавленные флюсы марок АН-348А, ОСЦ-45 и АН-15, содержащие 35-43% оксида марганца. Эти флюсы способствуют устойчивому горению дуги, высокому качеству наплавки и меньшему выделению вредных примесей. [c.147]
chem21.info
Температура плавления | Virtual Laboratory Wiki
Файл:Melting icecubes.gifТемперату́ра плавле́ния и отвердева́ния — температура, при которой твёрдое кристаллическое тело совершает переход в жидкое состояние и наоборот. При температуре плавления вещество может находиться как в жидком, так и в твёрдом состоянии. При подведении дополнительного тепла вещество перейдёт в жидкое состояние, а температура не будет меняться, пока всё вещество в рассматриваемой системе не расплавится. При отведении лишнего тепла (охлаждении) вещество будет переходить в твёрдое состояние (застывать) и, пока оно не застынет полностью, температура не изменится.
Температура плавления/отвердевания и температура кипения/конденсации считаются важными физическими свойствами вещества. Температура отвердевания совпадает с температурой плавления только для чистого вещества.
На этом свойстве основаны специальные калибраторы термометров для высоких температур. Так как температура застывания чистого вещества, например, олова, стабильна, достаточно расплавить и ждать, пока расплав не начнёт кристаллизоваться. В это время, при условии хорошей теплоизоляции, температура застывающего слитка не меняется и в точности совпадает с эталонной температурой, указанной в справочниках.
Смеси веществ не имеют температуры плавления/отвердевания вовсе, и совершают переход в некотором диапазоне температур (температура появления жидкой фазы называется точкой солидуса, температура полного плавления — точкой ликвидуса). Поскольку точно измерить температуру плавления такого рода веществ нельзя, применяют специальные методы(ГОСТ 20287 и ASTM D 97). Но некоторые смеси (эвтектического состава) обладают определенной температурой плавления, как чистые вещества.
Аморфные (некристаллические) вещества, как правило, не обладают чёткой температурой плавления, с ростом температуры снижается вязкость таких веществ, и чем ниже вязкость, тем более жидким становится материал.
К примеру, обычное оконное стекло — это переохлаждённая жидкость. За несколько столетий становится видно, что при комнатной температуре стекло на окне сползает вниз под действием гравитации и становится внизу толще. При температуре 500-600 этот же эффект можно наблюдать уже в течение нескольких суток.
Поскольку при плавлении объём тела меняется незначительно, давление мало влияет на температуру плавления. Зависимость температуры фазового перехода (в том числе и плавления, и кипения) от давления для однокомпонентной системы даётся уравнением Клапейрона-Клаузиуса. Температуру плавления при нормальном атмосферном давлении (1013,25 гПа, или 760 мм ртутного столба) называют точкой плавления.
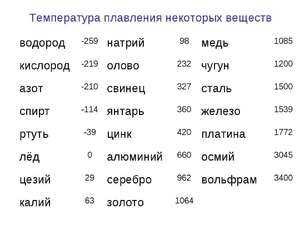
Температуры плавления некоторых важных веществ:
| температура плавления | °C |
|---|---|
| гелия(при 2,5 МПа) | -272,2 |
| водорода | <TT> −259,2 |
| кислорода | <TT> −218,8 |
| азота | <TT> −210,0 |
| этилового спирта | <TT> −114,5 |
| аммиака | <TT> −77,7 |
| ртути | <TT> −38,87 |
| льда (воды) | <TT> +0 |
| бензола | <TT> +5,53 |
| цезия | <TT> +28,64 |
| сахарозы | <TT> +185 |
| сахаринa | <TT> +225 |
| олова | <TT> +231,93 |
| свинца | <TT> +327,5 |
| алюминия | <TT> +660,1 |
| серебра | <TT> +960,8 |
| золота | <TT> +1063 |
| железа | <TT> +1535 |
| платины | <TT> +1769,3 |
| корунда | <TT> +2050 |
| вольфрама | <TT> +3410 |
Эта страница использует содержимое раздела Википедии на русском языке. Оригинальная статья находится по адресу: Температура плавления. Список первоначальных авторов статьи можно посмотреть в истории правок. Эта статья так же, как и статья, размещённая в Википедии, доступна на условиях CC-BY-SA .
ru.vlab.wikia.com
Температура плавления — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии

Температура плавления и кристаллизации — температура, при которой твёрдое кристаллическое тело совершает переход в жидкое состояние и наоборот. При температуре плавления вещество может находиться как в жидком, так и в твёрдом состоянии. При подведении дополнительного тепла вещество перейдёт в жидкое состояние, а температура не будет изменяться, пока всё вещество в рассматриваемой системе не расплавится. При отведении лишнего тепла (охлаждении) вещество будет переходить в твёрдое состояние (застывать) и, пока оно не застынет полностью, температура не изменится.
Температура плавления/отвердевания и температура кипения/конденсации считаются важными физическими свойствами вещества. Температура отвердевания совпадает с температурой плавления только для чистого вещества. На этом свойстве основаны специальные калибраторы термометров для высоких температур. Так как температура застывания чистого вещества, например олова, стабильна, достаточно расплавить и ждать, пока расплав не начнёт кристаллизоваться. В это время, при условии хорошей теплоизоляции, температура застывающего слитка не изменяется и в точности совпадает с эталонной температурой, указанной в справочниках.
Смеси веществ не имеют температуры плавления/отвердевания вовсе и совершают переход в некотором диапазоне температур (температура появления жидкой фазы называется точкой солидуса, температура полного плавления — точкой ликвидуса). Поскольку точно измерить температуру плавления такого рода веществ нельзя, применяют специальные методы (ГОСТ 20287 и ASTM D 97). Но некоторые смеси (эвтектического состава) обладают определенной температурой плавления, как чистые вещества.
Аморфные (некристаллические) вещества, как правило, не обладают чёткой температурой плавления. С ростом температуры вязкость таких веществ снижается и материал становится более жидким.
Существует распространенное заблуждение, согласно которому оконные стёкла медленно «сползают» вниз под действием гравитации. В качестве примера приводятся средневековые витражи, стёкла которых были толще в нижней части. Истинная же причина неравномерной толщины связана со старинной технологией изготовления оконных стёкол. Стеклодув выдувал большой пузырь из размягченного стекла и расплющивал его. Из получившегося диска от центра к краям нарезали узкие стекла для витражей. Такие стекла были толще со стороны, соответствующей краю диска, и при установке в переплёт размещались толстой частью вниз.[1]
Поскольку при плавлении объём тела изменяется незначительно, давление мало влияет на температуру плавления. Зависимость температуры фазового перехода (в том числе и плавления, и кипения) от давления для однокомпонентной системы даётся уравнением Клапейрона-Клаузиуса. Температуру плавления при нормальном атмосферном давлении (101 325 Па, или 760 мм ртутного столба) называют точкой плавления.
Предсказание температуры плавления (критерий Линдемана)
Попытка предсказать точку плавления кристаллических материалов была предпринята в 1910 году Фредериком Линдеманом (англ.). Идея заключалась в наблюдении того, что средняя амплитуда тепловых колебаний увеличивается с увеличением температуры. Плавление начинается тогда, когда амплитуда колебаний становится достаточно большой для того, чтобы соседние атомы начали частично занимать одно и то же пространство. Критерий Линдемана утверждает, что плавление ожидается, когда среднеквадратическое значение амплитуды колебаний превышает пороговую величину.
Температура плавления кристаллов достаточно хорошо описывается формулой Линдемана[2]:
- <math>T_\lambda=\frac{x^2_m}{9\hbar^2}M k_B \theta r^2_s</math>
где <math>r_s</math> — средний радиус элементарной ячейки, <math>\theta</math> — температура Дебая, а параметр <math>x_m</math> для большинства материалов меняется в интервале 0,15-0,3.
Температуры плавления некоторых веществ[3]
| вещество | температура плавления (°C) |
|---|---|
| гелий (при 2,5 МПа) | −272,2 |
| водород | −259,2 |
| кислород | −218,8 |
| азот | −210,0 |
| метан | −182,5 |
| этиловый спирт | −114,5 |
| хлор | −101 |
| аммиак | −77,7 |
| ртуть | −38,87 |
| водяной лёд | 0 |
| бензол | +5,53 |
| цезий | +28,64 |
| галлий | +29,8 |
| сахароза | +185 |
| сахарин | +225 |
| олово | +231,93 |
| свинец | +327,5 |
| алюминий | +660,1 |
| серебро | +960,8 |
| золото | +1063 |
| медь | +1083,4 |
| кремний | +1415 |
| железо | +1539 |
| титан | +1668 |
| платина | +1772 |
| цирконий | +1852 |
| корунд | +2050 |
| рутений | +2334 |
| молибден | +2622 |
| карбид кремния | +2730 |
| карбид вольфрама | +2870 |
| осмий | +3054 |
| оксид тория | +3350 |
| вольфрам | +3422 |
| углерод (сублимация) | +3547 |
| карбид гафния | +3890 |
| карбид тантала-гафния | +3942 |
Напишите отзыв о статье «Температура плавления»
Примечания
- ↑ [murzim.ru/nauka/himiya/19737-tekut-li-okonnye-stekla.html Текут ли оконные стёкла?] (рус.). [www.webcitation.org/6G0CtG1Dt Архивировано из первоисточника 19 апреля 2013].
- ↑ Жирифалько Л. Статистическая физика твердого тела. — М.: Мир, 1975. — С. 15.
- ↑ Дрица М. Е., Будберг П. Б., Бурханов Г. С., Дриц А. М., Пановко В. М. Свойства элементов. — Металлургия, 1985. — С. 672.
Отрывок, характеризующий Температура плавления
Ростов видел, что всё это было хорошо придумано ими. Соня и вчера поразила его своей красотой. Нынче, увидав ее мельком, она ему показалась еще лучше. Она была прелестная 16 тилетняя девочка, очевидно страстно его любящая (в этом он не сомневался ни на минуту). Отчего же ему было не любить ее теперь, и не жениться даже, думал Ростов, но теперь столько еще других радостей и занятий! «Да, они это прекрасно придумали», подумал он, «надо оставаться свободным».– Ну и прекрасно, – сказал он, – после поговорим. Ах как я тебе рад! – прибавил он.
– Ну, а что же ты, Борису не изменила? – спросил брат.
– Вот глупости! – смеясь крикнула Наташа. – Ни об нем и ни о ком я не думаю и знать не хочу.
– Вот как! Так ты что же?
– Я? – переспросила Наташа, и счастливая улыбка осветила ее лицо. – Ты видел Duport’a?
– Нет.
– Знаменитого Дюпора, танцовщика не видал? Ну так ты не поймешь. Я вот что такое. – Наташа взяла, округлив руки, свою юбку, как танцуют, отбежала несколько шагов, перевернулась, сделала антраша, побила ножкой об ножку и, став на самые кончики носков, прошла несколько шагов.
– Ведь стою? ведь вот, – говорила она; но не удержалась на цыпочках. – Так вот я что такое! Никогда ни за кого не пойду замуж, а пойду в танцовщицы. Только никому не говори.
Ростов так громко и весело захохотал, что Денисову из своей комнаты стало завидно, и Наташа не могла удержаться, засмеялась с ним вместе. – Нет, ведь хорошо? – всё говорила она.
– Хорошо, за Бориса уже не хочешь выходить замуж?
Наташа вспыхнула. – Я не хочу ни за кого замуж итти. Я ему то же самое скажу, когда увижу.
– Вот как! – сказал Ростов.
– Ну, да, это всё пустяки, – продолжала болтать Наташа. – А что Денисов хороший? – спросила она.
– Хороший.
– Ну и прощай, одевайся. Он страшный, Денисов?
– Отчего страшный? – спросил Nicolas. – Нет. Васька славный.
– Ты его Васькой зовешь – странно. А, что он очень хорош?
– Очень хорош.
– Ну, приходи скорей чай пить. Все вместе.
И Наташа встала на цыпочках и прошлась из комнаты так, как делают танцовщицы, но улыбаясь так, как только улыбаются счастливые 15 летние девочки. Встретившись в гостиной с Соней, Ростов покраснел. Он не знал, как обойтись с ней. Вчера они поцеловались в первую минуту радости свидания, но нынче они чувствовали, что нельзя было этого сделать; он чувствовал, что все, и мать и сестры, смотрели на него вопросительно и от него ожидали, как он поведет себя с нею. Он поцеловал ее руку и назвал ее вы – Соня . Но глаза их, встретившись, сказали друг другу «ты» и нежно поцеловались. Она просила своим взглядом у него прощения за то, что в посольстве Наташи она смела напомнить ему о его обещании и благодарила его за его любовь. Он своим взглядом благодарил ее за предложение свободы и говорил, что так ли, иначе ли, он никогда не перестанет любить ее, потому что нельзя не любить ее.
– Как однако странно, – сказала Вера, выбрав общую минуту молчания, – что Соня с Николенькой теперь встретились на вы и как чужие. – Замечание Веры было справедливо, как и все ее замечания; но как и от большей части ее замечаний всем сделалось неловко, и не только Соня, Николай и Наташа, но и старая графиня, которая боялась этой любви сына к Соне, могущей лишить его блестящей партии, тоже покраснела, как девочка. Денисов, к удивлению Ростова, в новом мундире, напомаженный и надушенный, явился в гостиную таким же щеголем, каким он был в сражениях, и таким любезным с дамами и кавалерами, каким Ростов никак не ожидал его видеть.
Вернувшись в Москву из армии, Николай Ростов был принят домашними как лучший сын, герой и ненаглядный Николушка; родными – как милый, приятный и почтительный молодой человек; знакомыми – как красивый гусарский поручик, ловкий танцор и один из лучших женихов Москвы.
Знакомство у Ростовых была вся Москва; денег в нынешний год у старого графа было достаточно, потому что были перезаложены все имения, и потому Николушка, заведя своего собственного рысака и самые модные рейтузы, особенные, каких ни у кого еще в Москве не было, и сапоги, самые модные, с самыми острыми носками и маленькими серебряными шпорами, проводил время очень весело. Ростов, вернувшись домой, испытал приятное чувство после некоторого промежутка времени примеривания себя к старым условиям жизни. Ему казалось, что он очень возмужал и вырос. Отчаяние за невыдержанный из закона Божьего экзамен, занимание денег у Гаврилы на извозчика, тайные поцелуи с Соней, он про всё это вспоминал, как про ребячество, от которого он неизмеримо был далек теперь. Теперь он – гусарский поручик в серебряном ментике, с солдатским Георгием, готовит своего рысака на бег, вместе с известными охотниками, пожилыми, почтенными. У него знакомая дама на бульваре, к которой он ездит вечером. Он дирижировал мазурку на бале у Архаровых, разговаривал о войне с фельдмаршалом Каменским, бывал в английском клубе, и был на ты с одним сорокалетним полковником, с которым познакомил его Денисов.
Страсть его к государю несколько ослабела в Москве, так как он за это время не видал его. Но он часто рассказывал о государе, о своей любви к нему, давая чувствовать, что он еще не всё рассказывает, что что то еще есть в его чувстве к государю, что не может быть всем понятно; и от всей души разделял общее в то время в Москве чувство обожания к императору Александру Павловичу, которому в Москве в то время было дано наименование ангела во плоти.
В это короткое пребывание Ростова в Москве, до отъезда в армию, он не сблизился, а напротив разошелся с Соней. Она была очень хороша, мила, и, очевидно, страстно влюблена в него; но он был в той поре молодости, когда кажется так много дела, что некогда этим заниматься, и молодой человек боится связываться – дорожит своей свободой, которая ему нужна на многое другое. Когда он думал о Соне в это новое пребывание в Москве, он говорил себе: Э! еще много, много таких будет и есть там, где то, мне еще неизвестных. Еще успею, когда захочу, заняться и любовью, а теперь некогда. Кроме того, ему казалось что то унизительное для своего мужества в женском обществе. Он ездил на балы и в женское общество, притворяясь, что делал это против воли. Бега, английский клуб, кутеж с Денисовым, поездка туда – это было другое дело: это было прилично молодцу гусару.
wiki-org.ru
13.9. Определение температур плавления и кипения
Определение температур плавления вещества под микроскопом происходит с применением специальных блоков нагревания. Рассмотрим схемы наиболее типичных из них.
Самый простой блок {нагревательный столик) применяют для определения температуры плавления вещества в интервале 30 -200 °С. Электронагревателем служит медное кольцо 6 (рис. 323,а), на котором расположен плоский стеклянный сосуд 3 с прозрачным силиконовым маслом. В центре верхней поверхности сосуда находится углубление для размещения нескольких кристалликов вещества, закрытое сверху покровным стеклом 2. В сосуд введена термопара 4, откалиброванная в данном блоке по реперным веществам . Медное кольцо теплоизолировано от столика микроскопа 7 асбестовой прокладкой 5.
Температуру плавления вещества отмечают в тот момент, когда грани и углы кристаллов, рассматриваемые в микроскоп 1, начинают расплываться и появляются первые микрокапли жидкой фазы.
Блок с теплоизоляционной камерой 3 (рис. 323,6) имеет два покровных стекла 6, между которыми располагают кристаллы вешества 7 и спай термопары 5, изготовленной из тонкой проволоки диаметром 0,10-0,15 мм. Место спая и вещество находятся в поле зрения исследователя (микроскоп 1). Зазор между покровными стеклами составляет всего 0,2 мм.
Рис. 323. Блоки для определения температур плавления веществ под микроскопом (а — в). Капилляр Эмиха (г) и капилляр для определения плотности вещества (д)
Сверху и снизу покровных стекол располагают электронагреватели 4 либо в виде медных колец, имеющих по бокам отростки с нихромовой спиралью, либо в виде кольцевой кварцевой трубки с такой же спиралью. В интервале предполагаемой температуры плавления вещества скорость нагрева снижают до 4 — 6 °С/мин.
Температуру плавления веществ ниже О °С определяют под микроскопом 1, предметный столик 6 которого оборудован медным плоским блоком 2 (рис. 323,в), соединенным толстым медным стержнем 7 с сосудом Дьюара 8 с жидким азотом. Запотевание предметных стекол 3 устраняют смазыванием их глицерином или нанесением тонкого слоя желатина. Зазор между предметными стеклами герметизируют смесью вазелина с парафином или другими замазками . Нижнее предметное стекло нагревают медным кольцом 5, снабженным электронагревательной спиралью, а температуру контролируют термопарой 4.
Температуру кипения жидкости (0,1 — 2,0 мл) определяют при помощи капилляра Эмиха (рис. 323,г). Конец трубки 3 диаметром 0,5 — 1,0 мм вытягивают в капилляр диаметром около 0,1 мм и длиной 10-15 мм. Обрезают его конец, полученной таким способом микропипеткой касаются капли жидкости, которая тотчас же заполняет капилляр. Конец капилляра быстро запаивают в пламени микрогорелки так, чтобы под жидкостью 2 остался маленький пузырек воздуха /. Приготовленный капилляр прикрепляют к термометру и погружают вместе с ним в жидкостную баню. В качестве бани удобно использовать химический стакан полностью обернутый асбестом, в котором с противоположных сторон прорезаны два окошка для наблюдения за пузырьком воздуха при помощи лупы или микроскопа.
При медленном нагревании бани пузырек поднимается и достигает уровня жидкости в бане в тот момент, когда термометр показывает температуру кипения жидкости, находящейся в капилляре. При первых признаках движения пузырька или столбика жидкости вверх нагревание бани прекращают. Для проверки полученного значения температуры кипения баню охлаждают на 10 — 15 °С и снова медленно нагревают. В полученное значение температуры кипения вводят поправку на атмосферное давление .
Гарсиа предложил обходиться без пузырька воздуха. По его методу жидкость в капилляр вносят баллончиком и переводят ее в запаянную часть капилляра центрифугированием. Затем капилляр, прикрепленный к термометру, погружают в баню, которую медленно нагревают до тех пор, пока на открытом конце капилляра не образуется капля жидкости, после чего нагревание прекращают, чтобы капля затянулась в капилляр.
Температура, при которой мениск жидкости в капилляре совпадает с уровнем жидкости в бане, принимают за температуру кипения жидкости, введенной в капилляр. В этом методе пространство ниже капли полностью заполнено паром жидкости, что более приближается к условиям равновесия между паром и жидкостью, чем в присутствии воздуха.
К оглавлению
www.himikatus.ru
Температура плавления — это… Что такое Температура плавления?
Температу́ра плавле́ния и отвердева́ния — температура, при которой твёрдое кристаллическое тело совершает переход в жидкое состояние и наоборот. При температуре плавления вещество может находиться как в жидком, так и в твёрдом состоянии. При подведении дополнительного тепла вещество перейдёт в жидкое состояние, а температура не будет меняться, пока всё вещество в рассматриваемой системе не расплавится. При отведении лишнего тепла (охлаждении) вещество будет переходить в твёрдое состояние (застывать) и, пока оно не застынет полностью, температура не изменится.
Температура плавления/отвердевания и температура кипения/конденсации считаются важными физическими свойствами вещества. Температура отвердевания совпадает с температурой плавления только для чистого вещества.
На этом свойстве основаны специальные калибраторы термометров для высоких температур. Так как температура застывания чистого вещества, например, олова, стабильна, достаточно расплавить и ждать, пока расплав не начнёт кристаллизоваться. В это время, при условии хорошей теплоизоляции, температура застывающего слитка не меняется и в точности совпадает с эталонной температурой, указанной в справочниках.
Смеси веществ не имеют температуры плавления/отвердевания вовсе, и совершают переход в некотором диапазоне температур (температура появления жидкой фазы называется точкой солидуса, температура полного плавления — точкой ликвидуса). Поскольку точно измерить температуру плавления такого рода веществ нельзя, применяют специальные методы (ГОСТ 20287 и ASTM D 97). Но некоторые смеси (эвтектического состава) обладают определенной температурой плавления, как чистые вещества.
Аморфные (некристаллические) вещества, как правило, не обладают чёткой температурой плавления, с ростом температуры снижается вязкость таких веществ, и чем ниже вязкость, тем более жидким становится материал.
К примеру, обычное оконное стекло — это переохлаждённая жидкость. За несколько столетий становится видно, что при комнатной температуре стекло на окне сползает вниз под действием гравитации и становится внизу толще. При температуре 500—600 этот же эффект можно наблюдать уже в течение нескольких суток.
Поскольку при плавлении объём тела меняется незначительно, давление мало влияет на температуру плавления. Зависимость температуры фазового перехода (в том числе и плавления, и кипения) от давления для однокомпонентной системы даётся уравнением Клапейрона-Клаузиуса. Температуру плавления при нормальном атмосферном давлении (101 325 Па, или 760 мм ртутного столба) называют точкой плавления.
Температуры плавления некоторых важных веществ[1]:
| вещество | температура плавления (°C) |
|---|---|
| гелий (при 2,5 МПа) | −272,2 |
| водород | −259,2 |
| кислород | −218,8 |
| азот | −210,0 |
| метан | −182,5 |
| этиловый спирт | −114,5 |
| хлор | −101 |
| аммиак | −77,7 |
| ртуть | −38,87 |
| водяной лёд | 0 |
| бензол | +5,53 |
| цезий | +28,64 |
| сахароза | +185 |
| сахарин | +225 |
| олово | +231,93 |
| свинец | +327,5 |
| алюминий | +660,1 |
| серебро | +960,8 |
| золото | +1063 |
| кремний | +1415 |
| железо | +1539 |
| титан | +1668 |
| платина | +1772 |
| цирконий | +1852 |
| корунд | +2050 |
| рутений | +2334 |
| молибден | +2622 |
| карбид кремния | +2730 |
| осмий | +3054 |
| оксид тория | +3350 |
| вольфрам | +3410 |
| углерод | +3547 |
| карбид гафния | +3960 |
| карбид тантала-гафния | +4216 |
Примечания
- ↑ Дрица М. Е., Будберг П. Б., Бурханов Г. С., Дриц А. М., Пановко В. М. Свойства элементов. — Металлургия, 1985. — С. 672 с.
dic.academic.ru
химический элемент, температура плавления и кипения, пошаговая инструкция
 Медь входит в семёрку самых древних металлов, с которыми люди познакомились на самом начальном этапе своего существования. Период с 4 по 3 тысячелетие до нашей эры так и называется медный век в истории развития человечества. Древние люди изготавливали из неё предметы быта, орудия труда и боевое оружие. Это стало возможным благодаря относительно невысокой температуре плавления меди.
Медь входит в семёрку самых древних металлов, с которыми люди познакомились на самом начальном этапе своего существования. Период с 4 по 3 тысячелетие до нашей эры так и называется медный век в истории развития человечества. Древние люди изготавливали из неё предметы быта, орудия труда и боевое оружие. Это стало возможным благодаря относительно невысокой температуре плавления меди.
Купрум: характеристика элемента
 Научное наименование меди Cuprum (Купрум) происходит от названия греческого острова Кипр, где медь начали добывать ещё в середине третьего тысячелетия до нашей эры. В периодической таблице Менделеева химический элемент медь имеет 29 атомный (порядковый) номер, находится в 11 группе четвёртого периода. Принадлежит к пластичным переходным металлам. В чистом виде имеет характерный золотисто-розовый цвет. Чистую медь легко окислить, поэтому в естественных условиях она всегда образует на своей поверхности тонкую оксидную плёнку, которая придаёт ей красноватый оттенок.
Научное наименование меди Cuprum (Купрум) происходит от названия греческого острова Кипр, где медь начали добывать ещё в середине третьего тысячелетия до нашей эры. В периодической таблице Менделеева химический элемент медь имеет 29 атомный (порядковый) номер, находится в 11 группе четвёртого периода. Принадлежит к пластичным переходным металлам. В чистом виде имеет характерный золотисто-розовый цвет. Чистую медь легко окислить, поэтому в естественных условиях она всегда образует на своей поверхности тонкую оксидную плёнку, которая придаёт ей красноватый оттенок.
Физические свойства
Это второй металл после серебра по уровню электропроводности, что делает её крайне востребованной в современной электронике. Второе ценное качество — высокая теплопроводность, это позволяет её широко применять во всевозможных теплообменниках и в холодильной аппаратуре.
- Температура плавления 1083 градуса.
- Температура кипения 2567 градусов.
- Удельное сопротивление при 20 градусах составляет 1,68·10 -3 Ом·м.
- Плотность 8,92 г/см.
Нахождение в природе
В природе встречается в самородном виде и в виде соединений.
 Самые крупные месторождения самородной меди находятся в США в районе озера Верхнего. Именно в этом районе был найден самый крупный медный самородок весом 3560 килограмм. А также много самородной меди встречается в рудных горах Германии.
Самые крупные месторождения самородной меди находятся в США в районе озера Верхнего. Именно в этом районе был найден самый крупный медный самородок весом 3560 килограмм. А также много самородной меди встречается в рудных горах Германии.
В России и на постсоветском пространстве добыча меди происходит путём извлечения из сульфидной руды. Её можно добыть, извлекая из медного колчедана или халькопирита CuFeS2. Наиболее известны такие месторождения, как Удокан в Забайкалье и Джезказган в Казахстане.
Сульфиты меди чаще всего образуются в так называемых среднетемпературных гидротермальных жилах. Могут образовываться и в осадочных породах в виде медистых песчаников и сланцев.
Как правило, медная руда всегда добывается открытым способом. Процентное содержание чистой меди в руде составляет от 0,2 до 1,0 процента в зависимости от месторождения.
Медные сплавы
Являются самыми первыми металлическими сплавами, получение которых человечество освоило ещё на самой заре своего развития. При какой температуре плавится медь, зависит от того, в каком сплаве она находится. В настоящее время наиболее известны и востребованы такие сплавы, как:
- Латунь. Сплав с добавление цинка, содержание которого может доходить до 40%. Цинк повышает пластичность и прочность металла. Температура, при которой латунь плавится, составляет 880 — 950 градусов.
- Бронза. Сплав с оловом, с добавлением некоторых других компонентов, таких как кремний, бериллий, свинец. Получать бронзу из меди человек научился ещё в самом начале бронзового века. Бронза не утратила своей актуальности даже с наступлением века железа, например, ещё в начале 20 века стволы пушек изготавливали из так называемой орудийной бронзы. Температура, при которой бронза начинает плавиться, составляет 930 — 1140 градусов.
-
 Мельхиор. Кроме меди, содержит в своём составе 5−30% никеля. Никель увеличивает прочность медного сплава и повышает его электрическое сопротивление. Кроме того, сильно повышается коррозионная стойкость. Температура плавления — 1170 градусов. По своим внешним характеристикам мельхиор очень похож на серебро, раньше его называли белой медью. Но он обладает более высокой механической прочностью, чем обычное серебро.
Мельхиор. Кроме меди, содержит в своём составе 5−30% никеля. Никель увеличивает прочность медного сплава и повышает его электрическое сопротивление. Кроме того, сильно повышается коррозионная стойкость. Температура плавления — 1170 градусов. По своим внешним характеристикам мельхиор очень похож на серебро, раньше его называли белой медью. Но он обладает более высокой механической прочностью, чем обычное серебро. - Дюраль, или дюралюминий. Основную массу сплава составляет алюминий 93%, на медь приходится 5%, оставшиеся 2% занимают марганец, железо и магний. Название происходит от названия немецкого города Дюрен, где в 1906 году был впервые получен этот высокопрочный сплав алюминия. Одной из его особенностей является тот факт, что его прочностные характеристики с течением времени имеют тенденцию к увеличению. Поэтому он не теряет своей прочности после нескольких лет эксплуатации, как другие металлы. В настоящее время этот сплав является основой самолётостроения.
- Ювелирные сплавы. Сплавы меди с золотом. Тем самым увеличивается устойчивость драгметалла к механическим воздействиям и истиранию.
Переплавка меди дома
Этот металл обладает целым набором полезных свойств, которые делают её весьма желанным металлом в домашнем хозяйстве. А относительно невысокая температура при плавлении и изрядное количество медного лома, которое можно обнаружить на ближайшей свалке, позволяют задавать вопрос о том, как расплавить медь в домашних условиях, не как риторический, а вполне реальный и практический.
График плавления меди
Расплавление любого металла заключается в том, что под воздействием высоких температур разрушается кристаллическая решётка и металл переходит из твёрдого состояния в жидкое. Можно выделить некоторые закономерности, свойственные любому металлу в процессе расплавления:
-
 Во время нагревания температура внутри металла повышается, но кристаллическая решётка не подвергается разрушению. Металл сохраняет своё твёрдое состояние.
Во время нагревания температура внутри металла повышается, но кристаллическая решётка не подвергается разрушению. Металл сохраняет своё твёрдое состояние. - При достижении температуры плавления, для меди это 1083 градуса, температура внутри металла перестаёт повышаться, несмотря на то что общий нагрев и передача тепла продолжаются.
- После того как вся масса метала переходит в расплавленное состояние, температура внутри металла снова начинает резко повышаться.
В случае процесса охлаждения расплавленного металла происходит всё то же самое, но в обратной последовательности. Сначала происходит резкое снижение температуры внутри металла, затем на значении 1080 градусов падение температуры прекращается до тех пор, пока вся масса метала не перейдёт в твёрдое состояние. После этого температура снова начинает резко падать, пока не сравняется с температурой окружающего воздуха и кристаллизация не завершится окончательно.
Температура кипения
Медь начинает активно выделять углерод в виде пузырьков газа при температуре 2560 градусов. Внешне это очень напоминает кипение воды. На самом деле это процесс активного окисления меди, в результате которого металл теряет практически все свои уникальные свойства. Детали, отлитые из кипящей меди, имеют в своей структуре большое количество пор, которые будут уменьшать механическую прочность материала и ухудшать его декоративные свойства. Потому в процессе плавки необходимо внимательно следить за температурой и не допускать закипания меди.
Способы плавки
Медный лом можно переплавить в домашних условиях разными способами в зависимости от технического оснащения домашней мастерской. При этом нужно иметь в виду, что придётся нагревать медь не до её температуры плавления, а чуть выше — примерно до 1100−1200 градусов.
Для этих целей годятся следующие приспособления:
-
 Муфельная печь. Наиболее рациональное решение проблемы расплавления меди, так как такая печь позволяет регулировать температуру во время процесса плавки, что очень удобно. Подобные лабораторные печи оснащены специальным окном из жаропрочного стекла, что позволяет постоянно осуществлять визуальный контроль всего процесса.
Муфельная печь. Наиболее рациональное решение проблемы расплавления меди, так как такая печь позволяет регулировать температуру во время процесса плавки, что очень удобно. Подобные лабораторные печи оснащены специальным окном из жаропрочного стекла, что позволяет постоянно осуществлять визуальный контроль всего процесса. - Газовая горелка. Ручная газовая горелка размещается под дном ёмкости из тугоплавкого материала, в которой непосредственно будет размещаться медный лом. Этот способ предполагает наличие тесного контакта расплавляемой массы металла с воздухом, что будет способствовать усилению процесса окисления расплавляемого металла. Чтобы этому как-то противостоять, на расплавляемую массу сверху насыпают слой древесного угля.
- Паяльная лампа. Способ практически ничем не отличается от плавки с помощью газовой горелки. Но в этом случае невозможно достигнуть относительно высоких температур, поэтому он годится для переплавки сплавов меди, которые обладают меньшей температурой плавления, чем чистая медь.
- Кузнечный горн. На раскалённые древесные угли специального костра помещается тугоплавкий тигель с измельчённым металлом. Для ускорения процесса расплавления задействуют обычный бытовой пылесос, включённый в режиме выдувания. Труба пылесоса должна быть небольшого диаметра и иметь металлический наконечник, в противном случае она расплавится. Данный способ подходит для тех, кто занимается плавкой меди дома регулярно и имеет дело с большими объёмами исходного материала, который необходимо отжечь.
- Микроволновая печь. Бытовая мощная микроволновка с небольшими изменениями конструкции может легко плавить довольно большие объёмы медного лома. Для этого необходимо убрать из микроволновки вращающуюся тарелку, а вместо неё поместить соответствующих размеров тигель, который необходимо сделать из тугоплавкого материала, например, из шамотного кирпича.
Пошаговая инструкция
Процесс плавления любого металла происходит поэтапно и подчиняется определённому алгоритму, который одинаков как для промышленного производства, так и для кустарного. Для тех, кто озадачен вопросом плавки меди в домашних условиях, пошаговая инструкция будет выглядеть следующим образом:
-
 Необходимо взять тугоплавкий тигель. Металл в измельчённом состоянии насыпается в тигель. После этого тигель помещается в предварительно прогретую муфельную печь. С помощью специального окошка наблюдают за процессом расплавления.
Необходимо взять тугоплавкий тигель. Металл в измельчённом состоянии насыпается в тигель. После этого тигель помещается в предварительно прогретую муфельную печь. С помощью специального окошка наблюдают за процессом расплавления. - После полного расплавления всего объёма медного лома тигель с помощью специальных длинных щипцов извлекается из печи.
- На поверхности расплавленного металла образуется плёнка его оксида. Эту плёнку необходимо аккуратно сдвинуть в сторону к одной из стенок тигля. Для этих целей используют специальный крючок, изготовленный из тугоплавкого металла.
- После того как металл освобождён от оксидной плёнки, необходимо его очень быстро разлить в предварительно подготовленные формы.
Практические рекомендации
Температура плавления меди в домашних условиях зависит от того, в каком сплаве она содержится.
Техническая чистая медь содержится в проводах и кабелях, а также в обмотках трансформаторов, электродвигателей и генераторов. При этом нужно иметь в виду, что химически чистая медь содержится только в столовых приборах и в прочей кухонной утвари. Во всех остальных случаях в ней присутствуют те или иные вредные компоненты.
В чистом виде обладает повышенной вязкостью в расплавленном состоянии, поэтому отливать из неё изделия сложной конфигурации и небольших размеров очень сложно. Гораздо легче для этих целей использовать латунь.
В сплавах бронзы, изготовленных вначале и середине прошлого века, использовали в качестве компонентов мышьяк и сурьму. Поэтому следует избегать расплавления так называемой старинной бронзы, так как пары мышьяка могут привести к отравлению организма.
Оцените статью: Поделитесь с друзьями!chebo.pro
Температура кипения — Справочник химика 21
из «Практикум по органическому синтезу Издание 5»
Для идентификации органических веществ и доказательства чистоты того или иного вещества используют методы определения физических констант органических соединений, важнейшими из которых являются температуры плавления и кипения, плотность, показатель преломления и другие. [c.82]Перечисленные свойства вещества являются его константами. Вещество можно считать достаточно чистым, если его константы не меняются после повторной очистки. [c.82]
Температурой плавления соединения называют температуру, при которой его твердая фаза находится в равновесии с собственным расплавом. Разность между температурой, при которой появляется жидкая фаза, и температурой полного расплавления вещества для чистых соединений не должна превышать 0,5 °С. [c.82]
Незначительные загрязнения вещества иногда сильно понижают температуру его плавления, и плавление происходит в более широком интервале температур. Такое явление используют для установления идентичности двух веществ с одинаковой температурой плавления. Для этого тщательно смешивают равные количества двух веществ. Если температура плавления этой смешанной пробы остается неизменной, то делают заключение об идентичности обоих веществ. Понижение же температуры плавления пробы служит признаком неидентичности этих веществ. Однако изоморфные соединения, даже разные по химическому составу, не обнаруживают понижения температуры. Оценка идентичности исследуемого вещества по температуре плавления смешанной пробы является первоначальной, а затем уже для идентификации используют спектроскопические методы. [c.82]
Многие органические вещества плавятся с разложением, которое обнаруживается обычно по окрашиванию расплава или выделению газов. Разложение является химическим процессом, и температура, при которой оно происходит, зависит, в первую очередь, от продолжительности и скорости нагревания, а также от плотности набивки вещества в капилляре, диаметра капилляра и т. п. Нередко в качестве характеристики веществ, которые плавятся с разложением, в справочной литературе приводится величина температуры плавления с дополнением разл. . [c.83]
Между температурой плавления вещества и его строением существует зависимость. Так, симметрично построенные молекулы плавятся при более высокой температуре, чем их изомеры. [c.83]
Температуру плавления возгоняющихся веществ определяют в капиллярах, запаянных с обоих концов. [c.84]
По сравнению с описанным прибором гораздо лучше проводить определение температуры плавления в приборе Тиля (рис. 55), в котором перенос тепла более равномерный. [c.84]
В качестве теплопередающей среды жидкости используют воду, если известно, что температура плавления исследуемого вещества ниже 100°С, или концентрированную серную кислоту, которая дает возможность определить температуру плавления до 250°С. При длительном пользовании серная кислота темнеет для обесцвечивания вносят в нее кристаллик селитры. Определение температуры плавления в приборах с серной кислотой требует осторожности, так как в случае поломки прибора горячая серная кислота представляет опасность. Поэтому при работе с серной кислотой следует надевать защитные очки. [c.84]
Кроме воды и серной кислоты употребляют глицерин, парафиновое масло (температура разложения 220 °С). Однако парафиновое масло по сравнению с серной кислотой обладает меньшей теплопроводностью, вследствие чего прибор может нагреваться неравномерно. Лучше всего пользоваться силиконовым маслом. При работе с веществом, плавящимся выше 300°С, нельзя применять масло, так как оно довольно быстро темнеет. В этом случае пользуются смесью 54,5 % нитрата калия и 45,5 % нитрата натрия. Такая смесь плавится при 218 °С и допускает нагревание до 600°С. [c.84]
Для определения температуры плавления веществ, плавящихся выше 300°С, желательно употреблять металлический блок (рис. 56), изготовленный из латуни или меди. Нижняя часть блока нагревается горелкой. В цилиндрический канал помещается термометр, а в пазы — два капилляра с веществом. Наблюдение за плавлением в капиллярах ведут через смотровые окошки, закрытые стеклами. [c.85]
Температура кипения в значительной степени зависит от молекулярной массы вещества, его строения, состава, межмолеку-лярного взаимодействия и давления. [c.85]
Самый простой прибор для определения температуры кипения — это обычный прибор для перегонки, состоящий из круглодонной колбы, термометра, холодильника, алонжа и приемника. В круглодонную колбу наливают до Д объема колбы нсидкость, температуру кипения которой нужно определить. Шарик термометра находится на небольшом расстоянии от поверхности жидкости. Если же определяют температуру кипения раствора, то шарик термометра опускают в жидкость. Чтобы избежать сильного перегрева жидкости, для нагревания при определении температуры кипения применяют соответствующие бани. Разность температур начала и конца кипения для чистых веществ не должна превышать 0,5 °С. Кипение жидкости в широком интервале говорит о смеси жидкостей. [c.85]
При определении температуры кипения следует помнить о поправке на отклонение от нормального давления. Для многих веществ в справочной литературе есть таблицы поправок температур кипения при разных давлениях для приведения их к 0,1 МПа. Если же таблиц нет, то можно вычислить поправку на отклонение от атмосферного давления исходя из того, что температура кипения многих веществ при 0,1 МПа изменяется приблизительно на /ео с изменением давления на 133,3 Па. [c.85]
При работе с малыми количествами вещества используют метод Сиволобова. По этому методу 0,5 мл исследуемой жидкости наливают в стеклянную трубку диаметром ж 6 мм, в которую погружают незапаянным концом вниз капилляр для определения температуры плавления. Трубку прикрепляют к термометру, как показано на рис. 57. Термометр помещают в прибор для определения температуры плавления. При медленном нагревании сначала наблюдается слабое, а затем и бурное выделение пузырьков пара из капилляра. Температурой кипения считают показания термометра в тот момент, когда начинается бурное образование пузырьков. Ошибки этого метода могут составлять 5°С. [c.86]
Точное определение температуры кипения возможно с помощью эбулиоскопов (рис. 58). Принцип их действия основан на том, что жидкость нагревают с обратным холодильником до кипения и измеряют температуру при соответствующей конструкции исключаются тепловые потери и перегрев паров. Однако эти приборы требуют обычно больших количеств вещества (несколько миллилитров). [c.86]
Вернуться к основной статье
chem21.info

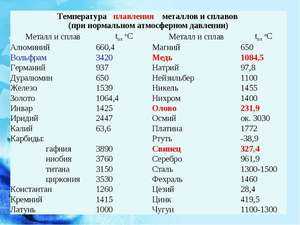
 Мельхиор. Кроме меди, содержит в своём составе 5−30% никеля. Никель увеличивает прочность медного сплава и повышает его электрическое сопротивление. Кроме того, сильно повышается коррозионная стойкость. Температура плавления — 1170 градусов. По своим внешним характеристикам мельхиор очень похож на серебро, раньше его называли белой медью. Но он обладает более высокой механической прочностью, чем обычное серебро.
Мельхиор. Кроме меди, содержит в своём составе 5−30% никеля. Никель увеличивает прочность медного сплава и повышает его электрическое сопротивление. Кроме того, сильно повышается коррозионная стойкость. Температура плавления — 1170 градусов. По своим внешним характеристикам мельхиор очень похож на серебро, раньше его называли белой медью. Но он обладает более высокой механической прочностью, чем обычное серебро.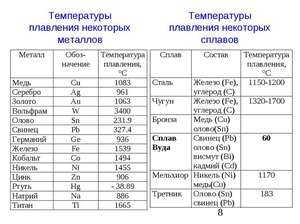 Во время нагревания температура внутри металла повышается, но кристаллическая решётка не подвергается разрушению. Металл сохраняет своё твёрдое состояние.
Во время нагревания температура внутри металла повышается, но кристаллическая решётка не подвергается разрушению. Металл сохраняет своё твёрдое состояние.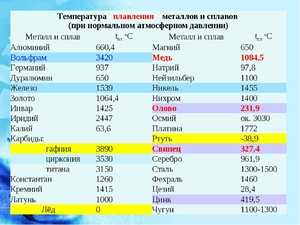 Муфельная печь. Наиболее рациональное решение проблемы расплавления меди, так как такая печь позволяет регулировать температуру во время процесса плавки, что очень удобно. Подобные лабораторные печи оснащены специальным окном из жаропрочного стекла, что позволяет постоянно осуществлять визуальный контроль всего процесса.
Муфельная печь. Наиболее рациональное решение проблемы расплавления меди, так как такая печь позволяет регулировать температуру во время процесса плавки, что очень удобно. Подобные лабораторные печи оснащены специальным окном из жаропрочного стекла, что позволяет постоянно осуществлять визуальный контроль всего процесса. Необходимо взять тугоплавкий тигель. Металл в измельчённом состоянии насыпается в тигель. После этого тигель помещается в предварительно прогретую муфельную печь. С помощью специального окошка наблюдают за процессом расплавления.
Необходимо взять тугоплавкий тигель. Металл в измельчённом состоянии насыпается в тигель. После этого тигель помещается в предварительно прогретую муфельную печь. С помощью специального окошка наблюдают за процессом расплавления.