Изопропиловый спирт | это… Что такое Изопропиловый спирт?
Изопропиловый спирт, пропанол-2 (2-пропанол), изопропанол, диметилкарбинол, ИПС — простейший вторичный одноатомный спирт алифатического ряда. Существует изомер изопропанола — 1-пропанол. Принадлежит к веществам 3-го класса опасности (умеренно опасные вещества) по степени воздействия на организм, обладает наркотическим действием. Граница ПДК для паров изопропанола в воздухе составляет 10 мг/м3. Отравление изопропиловым спиртом возникает в результате вдыхания паров, содержащих концентрацию, превышающую ПДК, кумулятивными свойствами не обладает[1]. Потребление внутрь уже в небольших дозах вызывает отравление. Широко используется как технический спирт в средствах для чистки стёкол, оргтехники и т. п. и как растворитель в промышленности (где растворители необходимы).
Содержание
|
Свойства
Химические свойства
Химическая формула (рациональная) изопропилового спирта: CH3CH(OH)CH3.
Изопропанол обладает свойствами вторичных спиртов жирного ряда, в том числе образует простые и сложные эфиры. Гидроксильная группа может быть вытеснена представителями ряда галогенов. С ароматическими соединениями изопропиловый спирт конденсируется с образованием производных, таких как изопропилбензол и изопропилтолуол. В изопропаноле хорошо растворяются многие эфирные масла, алкалоиды, некоторые синтетические смолы и другие химические соединения. При дегидрировании превращается в ацетон.[2]
Реагирует с сильными окислителями. Агрессивен в отношении некоторых видов пластика и резины.
Физические свойства
Бесцветная жидкость с характерным спиртовым запахом, более резковатым по сравнению с этанолом (по чему их можно в некоторых случаях отличить), tплавления −89,5 °C, tкипения 82,4 °C, плотность 0,7851 г/см³ (при 20 °C), tвспышки 11,7 °C. Нижний предел взрываемости в воздухе 2,5 % по объёму (при 25 °C). Температура самовоспламенения 456 °C. Коэффициент преломления 1,3776 (в жидком состоянии, при 20 °C). Динамическая вязкость при стандартных условиях 2,43 мПа·с. Молярная теплоёмкость (ст. усл.) — 155,2 Дж/(моль·К).
Нижний предел взрываемости в воздухе 2,5 % по объёму (при 25 °C). Температура самовоспламенения 456 °C. Коэффициент преломления 1,3776 (в жидком состоянии, при 20 °C). Динамическая вязкость при стандартных условиях 2,43 мПа·с. Молярная теплоёмкость (ст. усл.) — 155,2 Дж/(моль·К).
Пар хорошо смешивается с воздухом, легко образует взрывчатые смеси. Давление паров — 4,4 кПа (при 20 °C). Относительная плотность пара — 2,1, относительная плотность смеси пар/воздух — 1,05 (при 20 °C).
Растворим в ацетоне, хорошо растворим в бензоле, с остальными растворителями (вода, органические) смешивается в любых соотношениях. С водой образует азеотропную смесь (87,9 % изопропилового спирта, tкипения 83,38 °C).
Зависимость температуры замерзания смеси изопропилового спирта с водой от концентрации изопропилового спирта в смеси представлена в таблице[3]:
спирта об % | спирта вес % | замерзания °C |
(*Наблюдается переохлаждение)
Получение
Существует два метода промышленного производства изопропанола — гидрирование ацетона и гидратация пропилена.
Основным способом получения изопропанола в Российской промышленности является сернокислотная гидратация пропилена
- CH3CH=CH2 + H2SO4 → (CH3)2CHOSO3H + H2O → (CH3)2CHOH.
Сырьем может служить пропан-пропиленовая фракция с содержанием пропилена 30-90 % (фракция пиролиза и крекинга нефти). Однако наблюдается тенденция к использованию чистого пропилена, так как в этом случае процесс можно вести при невысоких давлениях, резко снижается образование побочных продуктов реакции — полимеров и ацетона. На первой стадии процесса образуется сернокислотный экстракт, содержащий равновесную смесь изопропилового спирта, изопропилсульфата (Ch4)2CHOSO2OH, H2SO4 и Н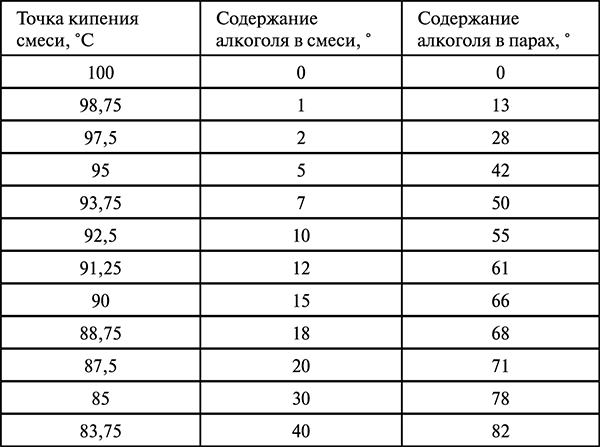 Изопропиловый спирт получают также окислением парафинов воздухом и другими способами.[2]
Изопропиловый спирт получают также окислением парафинов воздухом и другими способами.[2]
Современный способ:
Гидрирование ацетона водородом (в фазе пара) в присутствии стационарного медно-никельхромитного катализатора.[6][7]
В России изопропанол производят из пропилена на ЗАО «Завод синтетического спирта» (г. Орск)[8] и методом гидрирования ацетона водородом — ООО «Синтез Ацетон», (г. Дзержинск)[9][7]
Применение
Изопропиловый спирт используют для получения:- ацетона (дегидрированием или неполным окислением)
- пероксида водорода
- метилизобутилкетона
- изопропилацетата
- изопропиламина.
По причине особого государственного регулирования этанола, изопропиловый спирт часто является его заменителем во многих областях его применения. Так, изопропанол входит в состав:
- косметики
- парфюмерии
- бытовой химии
- дезинфицирующих средств
- средства для автомобилей (антифриз, растворитель в зимних стеклоомывателях)
- репеллентов
- промывок печатных плат после пайки с флюсом, продается под названием «Очиститель универсальный».

Изопропиловый спирт применяется в промышленности, при резании алюминия, токарных, фрезерных и прочих работах. В смеси с маслом позволяет значительно повысить производительность работы. Изопропиловый спирт применяется как референс-стандарт в газовой хроматографии (например, при испытании лекарственных средств на остаточные органические растворители).
Медицина
70 % изопропиловый спирт применяется вместо этилового спирта как антисептик для пропитки медицинских салфеток.
Влияние на человека
Оказывает раздражающее воздействие на глаза и дыхательные пути, при кратком воздействии больших концентраций паров вызывает головную боль. Может оказывать угнетающее действие на центральную нервную систему. Воздействие на уровне, значительно превышающем ПДК, может вызвать потерю сознания. Изопропанол при приеме внутрь метаболизируется в печени под действием алкогольдегидрогеназы в ацетон, что обуславливает его токсическое действие. Небольшие дозы изопропанола, как правило, не вызывают значительных расстройств. Серьёзное токсическое воздействие на здорового взрослого человека при пероральном употреблении может быть достигнуто уже при дозах порядка 50 мл и более.
Серьёзное токсическое воздействие на здорового взрослого человека при пероральном употреблении может быть достигнуто уже при дозах порядка 50 мл и более.
Предельно допустимая концентрация изопропанола в воздухе равна 10 миллиграммов на кубический метр.
Изопропанол органолептически заметно отличается от этанола и не может быть ошибочно принят за этанол. Имеет отличный от этанола запах, более «грубый». При приеме внутрь вызывает опьянение, сходное с алкогольным. Изопропанол окисляется в организме при участии альдегиддегидрогеназы до ацетона. Скорость окисления в среднем в 2 — 2,5 раза ниже, чем у этанола, поэтому опьянение изопропанолом очень стойкое. При частом употреблении к изопропанолу быстро развивается непереносимость, а в отдельных случаях — гиперчувствительность и аллергия. Хотя токсичность изопропанола примерно в 3,5 раза больше, чем у этанола, но при этом опьяняющее действие его также выше в 10 раз[источник не указан 546 дней]. По этой причине смертельных отравлений изопропанолом не зафиксировано, так как человек впадает в алкогольный транс гораздо раньше, чем сможет самостоятельно принять смертельную дозу изопропанола.
Наркотические свойства
Изопропиловый спирт обладает наркотическим действием.[1] Наркотический эффект изопропанола почти в 2 раза превышает аналогичный эффект этанола.[10] Концентрация 1,2 %, воздействующая в течение 4 часов оказывает наркотический эффект. При аналогичном воздействии в течение 8 часов — в половине случаев наблюдается смертельный исход.[11]
Примечания
- ↑ 1 2 ГОСТ 9805-84. Спирт изопропиловый. Технические условия[1]
- ↑ 1 2 ХиМиК.Ру — Изопропиловый спирт
- ↑ Ссылка один (англ.),Ссылка два
- ↑ «Isopropyl Alcohol, by John E. Logsdon and Richard A. Loke», Kirk‑Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, Inc, Article Online Posting Date: December 4, 2000
- ↑ A. J. Papa (2005), «Propanols», Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.
 1002/14356007.a22_173
1002/14356007.a22_173 - ↑ СПОСОБ ПОЛУЧЕНИЯ ПРОПАНОЛА-2 — Патент РФ 2047590
- ↑ 1 2 ООО Синтез Ацетон
- ↑ О заводе | Завод синтетического спирта
- ↑ ПРОИЗВОДСТВО ИЗОПРОПИЛОВОГО СПИРТА В РОССИИ
- ↑ «Достоинства и недостатки современных кожных антисептиков» С. В. Волкова, Е. В. Клементенок
- ↑ Review of Inhalants: Euphoria to Dysfunction Charles Wm. Sharp, Ph.D., Mary Lee Brehm, Ph.D.,National Institute on Drug Abuse
Изопропиловый спирт | это… Что такое Изопропиловый спирт?
Изопропиловый спирт, пропанол-2 (2-пропанол), изопропанол, диметилкарбинол, ИПС — простейший вторичный одноатомный спирт алифатического ряда. Существует изомер изопропанола — 1-пропанол. Принадлежит к веществам 3-го класса опасности (умеренно опасные вещества) по степени воздействия на организм, обладает наркотическим действием.
Содержание
|
Свойства
Химические свойства
Химическая формула (рациональная) изопропилового спирта: CH3CH(OH)CH3.
Изопропанол обладает свойствами вторичных спиртов жирного ряда, в том числе образует простые и сложные эфиры. Гидроксильная группа может быть вытеснена представителями ряда галогенов. С ароматическими соединениями изопропиловый спирт конденсируется с образованием производных, таких как изопропилбензол и изопропилтолуол. В изопропаноле хорошо растворяются многие эфирные масла, алкалоиды, некоторые синтетические смолы и другие химические соединения. При дегидрировании превращается в ацетон.[2]
Гидроксильная группа может быть вытеснена представителями ряда галогенов. С ароматическими соединениями изопропиловый спирт конденсируется с образованием производных, таких как изопропилбензол и изопропилтолуол. В изопропаноле хорошо растворяются многие эфирные масла, алкалоиды, некоторые синтетические смолы и другие химические соединения. При дегидрировании превращается в ацетон.[2]
Реагирует с сильными окислителями. Агрессивен в отношении некоторых видов пластика и резины.
Физические свойства
Бесцветная жидкость с характерным спиртовым запахом, более резковатым по сравнению с этанолом (по чему их можно в некоторых случаях отличить), tплавления
−89,5 °C, tкипения 82,4 °C, плотность 0,7851 г/см³ (при 20 °C), tвспышки 11,7 °C. Нижний предел взрываемости в воздухе 2,5 % по объёму (при 25 °C). Температура самовоспламенения 456 °C. Коэффициент преломления 1,3776 (в жидком состоянии, при 20 °C). Динамическая вязкость при стандартных условиях 2,43 мПа·с. Молярная теплоёмкость (ст. усл.) — 155,2 Дж/(моль·К).
Молярная теплоёмкость (ст. усл.) — 155,2 Дж/(моль·К).Пар хорошо смешивается с воздухом, легко образует взрывчатые смеси. Давление паров — 4,4 кПа (при 20 °C). Относительная плотность пара — 2,1, относительная плотность смеси пар/воздух — 1,05 (при 20 °C).
Растворим в ацетоне, хорошо растворим в бензоле, с остальными растворителями (вода, органические) смешивается в любых соотношениях. С водой образует азеотропную смесь (87,9 % изопропилового спирта, tкипения 83,38 °C).
Зависимость температуры замерзания смеси изопропилового спирта с водой от концентрации изопропилового спирта в смеси представлена в таблице
спирта об % | спирта вес % | замерзания °C |
(*Наблюдается переохлаждение)
Получение
Существует два метода промышленного производства изопропанола — гидрирование ацетона и гидратация пропилена. [4][5]
[4][5]
Основным способом получения изопропанола в Российской промышленности является сернокислотная гидратация пропилена
- CH3CH=CH2 + H2SO4 → (CH3)2CHOSO3H + H2O → (CH3)2CHOH.
Сырьем может служить пропан-пропиленовая фракция с содержанием пропилена 30-90 % (фракция пиролиза и крекинга нефти). Однако наблюдается тенденция к использованию чистого пропилена, так как в этом случае процесс можно вести при невысоких давлениях, резко снижается образование побочных продуктов реакции — полимеров и ацетона. На первой стадии процесса образуется сернокислотный экстракт, содержащий равновесную смесь изопропилового спирта, изопропилсульфата (Ch4)2CHOSO2OH, H2SO4 и Н2О, на второй — сернокислотный экстракт нагревается с водой и удаляется образующийся изопропиловый спирт. Прямую гидратацию пропилена осуществляют в основном в присутствии твердого катализатора (в скобках указаны условия процессов): Н3РО4 на носителе (240—260°С; 2,5-6,5 МПа) или катионообменной смолы (130—160°С; 8,0-10,0 МПа). Изопропиловый спирт получают также окислением парафинов воздухом и другими способами.[2]
Изопропиловый спирт получают также окислением парафинов воздухом и другими способами.[2]
Современный способ:
Гидрирование ацетона водородом (в фазе пара) в присутствии стационарного медно-никельхромитного катализатора.[6][7]
В России изопропанол производят из пропилена на ЗАО «Завод синтетического спирта» (г. Орск)[8] и методом гидрирования ацетона водородом — ООО «Синтез Ацетон», (г. Дзержинск)[9][7]
Применение
Изопропиловый спирт используют для получения:
- ацетона (дегидрированием или неполным окислением)
- пероксида водорода
- метилизобутилкетона
- изопропилацетата
- изопропиламина.
По причине особого государственного регулирования этанола, изопропиловый спирт часто является его заменителем во многих областях его применения. Так, изопропанол входит в состав:
- косметики
- парфюмерии
- бытовой химии
- дезинфицирующих средств
- средства для автомобилей (антифриз, растворитель в зимних стеклоомывателях)
- репеллентов
- промывок печатных плат после пайки с флюсом, продается под названием «Очиститель универсальный».

Изопропиловый спирт применяется в промышленности, при резании алюминия, токарных, фрезерных и прочих работах. В смеси с маслом позволяет значительно повысить производительность работы. Изопропиловый спирт применяется как референс-стандарт в газовой хроматографии (например, при испытании лекарственных средств на остаточные органические растворители).
Медицина
70 % изопропиловый спирт применяется вместо этилового спирта как антисептик для пропитки медицинских салфеток.
Влияние на человека
Оказывает раздражающее воздействие на глаза и дыхательные пути, при кратком воздействии больших концентраций паров вызывает головную боль. Может оказывать угнетающее действие на центральную нервную систему. Воздействие на уровне, значительно превышающем ПДК, может вызвать потерю сознания. Изопропанол при приеме внутрь метаболизируется в печени под действием алкогольдегидрогеназы в ацетон, что обуславливает его токсическое действие. Небольшие дозы изопропанола, как правило, не вызывают значительных расстройств.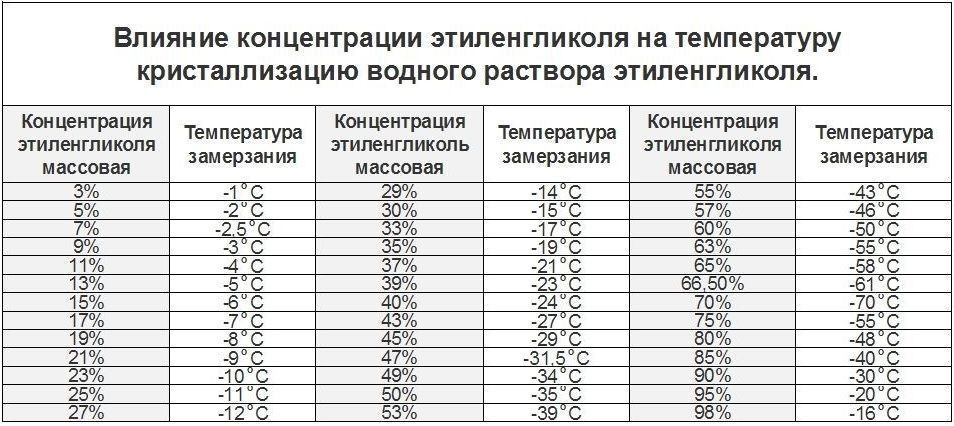 Серьёзное токсическое воздействие на здорового взрослого человека при пероральном употреблении может быть достигнуто уже при дозах порядка 50 мл и более.
Серьёзное токсическое воздействие на здорового взрослого человека при пероральном употреблении может быть достигнуто уже при дозах порядка 50 мл и более.
Предельно допустимая концентрация изопропанола в воздухе равна 10 миллиграммов на кубический метр.
Изопропанол органолептически заметно отличается от этанола и не может быть ошибочно принят за этанол. Имеет отличный от этанола запах, более «грубый». При приеме внутрь вызывает опьянение, сходное с алкогольным. Изопропанол окисляется в организме при участии альдегиддегидрогеназы до ацетона. Скорость окисления в среднем в 2 — 2,5 раза ниже, чем у этанола, поэтому опьянение изопропанолом очень стойкое. При частом употреблении к изопропанолу быстро развивается непереносимость, а в отдельных случаях — гиперчувствительность и аллергия. Хотя токсичность изопропанола примерно в 3,5 раза больше, чем у этанола, но при этом опьяняющее действие его также выше в 10 раз[источник не указан 546 дней]. По этой причине смертельных отравлений изопропанолом не зафиксировано, так как человек впадает в алкогольный транс гораздо раньше, чем сможет самостоятельно принять смертельную дозу изопропанола.
Наркотические свойства
Изопропиловый спирт обладает наркотическим действием.[1] Наркотический эффект изопропанола почти в 2 раза превышает аналогичный эффект этанола.[10] Концентрация 1,2 %, воздействующая в течение 4 часов оказывает наркотический эффект. При аналогичном воздействии в течение 8 часов — в половине случаев наблюдается смертельный исход.[11]
Примечания
- ↑ 1 2 ГОСТ 9805-84. Спирт изопропиловый. Технические условия[1]
- ↑ 1 2 ХиМиК.Ру — Изопропиловый спирт
- ↑ Ссылка один (англ.),Ссылка два
- ↑ «Isopropyl Alcohol, by John E. Logsdon and Richard A. Loke», Kirk‑Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, Inc, Article Online Posting Date: December 4, 2000
- ↑ A. J. Papa (2005), «Propanols», Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.
 1002/14356007.a22_173
1002/14356007.a22_173 - ↑ СПОСОБ ПОЛУЧЕНИЯ ПРОПАНОЛА-2 — Патент РФ 2047590
- ↑ 1 2 ООО Синтез Ацетон
- ↑ О заводе | Завод синтетического спирта
- ↑ ПРОИЗВОДСТВО ИЗОПРОПИЛОВОГО СПИРТА В РОССИИ
- ↑ «Достоинства и недостатки современных кожных антисептиков» С. В. Волкова, Е. В. Клементенок
- ↑ Review of Inhalants: Euphoria to Dysfunction Charles Wm. Sharp, Ph.D., Mary Lee Brehm, Ph.D.,National Institute on Drug Abuse
1.2: Состояние вещества — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 401158
Цели обучения
- Описывать твердую, жидкую и газообразную фазы вещества.
 9\text{o} \text{C}\), вода — это газ (пар). Состояние воды зависит от температуры. Каждое состояние (твердое, жидкое и газообразное) имеет свой уникальный набор физических свойств. Рисунок \(\PageIndex{1}\): Материю обычно делят на три классических состояния. Слева направо: кварц (твердое), вода (жидкое), диоксид азота (газ).
9\text{o} \text{C}\), вода — это газ (пар). Состояние воды зависит от температуры. Каждое состояние (твердое, жидкое и газообразное) имеет свой уникальный набор физических свойств. Рисунок \(\PageIndex{1}\): Материю обычно делят на три классических состояния. Слева направо: кварц (твердое), вода (жидкое), диоксид азота (газ).Материя обычно существует в одном из трех состояний: твердое , жидкое или газообразное , и эти различные состояния материи имеют разные свойства (таблица \(\PageIndex{1}\)):
- Газ — это состояние вещества, в котором атомы или молекулы обладают достаточной энергией для свободного движения. Молекулы вступают в контакт друг с другом только тогда, когда они случайным образом сталкиваются. Силы между атомами или молекулами недостаточно сильны, чтобы удерживать их вместе.
- Жидкость — это состояние вещества, в котором атомы или молекулы постоянно находятся в контакте, но имеют достаточную энергию, чтобы постоянно менять положение относительно друг друга.
 Силы между атомами или молекулами достаточно сильны, чтобы удерживать молекулы относительно близко друг к другу, но недостаточно сильны, чтобы предотвратить их движение мимо друг друга.
Силы между атомами или молекулами достаточно сильны, чтобы удерживать молекулы относительно близко друг к другу, но недостаточно сильны, чтобы предотвратить их движение мимо друг друга. - Твердое тело — это состояние вещества, в котором атомы или молекулы не имеют достаточно энергии для движения. Они постоянно соприкасаются и находятся в фиксированных положениях друг относительно друга. Силы между атомами или молекулами достаточно сильны, чтобы удерживать молекулы вместе и препятствовать их перемещению друг относительно друга.
Состояние, которое проявляет данное вещество, является физическим свойством. Некоторые вещества существуют в виде газов при комнатной температуре (кислород и углекислый газ), а другие, например вода и металлическая ртуть, существуют в виде жидкостей. Большинство металлов существует в твердом состоянии при комнатной температуре. Все вещества могут находиться в любом из этих трех состояний. На рисунке \(\PageIndex{2}\) показаны различия между твердыми телами, жидкостями и газами на молекулярном уровне.
Рисунок \(\PageIndex{2}\): Три наиболее распространенных состояния или фазы вещества: твердое, жидкое и газообразное. (CC BY-4.0; OpenStax) Твердое тело, помеченное как стакан, содержит куб красного вещества и имеет фиксированную форму и объем. Жидкость с этикеткой в стакане содержит жидкость коричневато-красного цвета. Этот стакан, как говорят, принимает форму сосуда, образует горизонтальные поверхности, имеет фиксированный объем. Стакан с меченым газом наполнен светло-коричневым газом. На этом стакане написано, что он расширяется, чтобы заполнить контейнер. Твердое тело имеет определенный объем и форму, жидкость имеет определенный объем, но не имеет определенной формы, а газ не имеет ни определенного объема, ни формы (таблица \(\PageIndex{1}\)).
Твердое тело имеет определенный объем и форму, жидкость имеет определенный объем, но не имеет определенной формы, а газ не имеет ни определенного объема, ни формы (таблица \(\PageIndex{1}\)).Каждое из этих трех описаний подразумевает, что в этих состояниях материя обладает определенными физическими свойствами. Твердое тело имеет определенную форму и определенный объем. Жидкости обычно имеют определенный объем, но не определенную форму; они принимают форму своих контейнеров.
 Газы не имеют ни определенной формы, ни определенного объема, и они расширяются, чтобы заполнить свои сосуды. Мы сталкиваемся с материей в каждой фазе каждый день; на самом деле мы регулярно встречаемся с водой во всех трех фазах: лед (твердое тело), вода (жидкость) и пар (газ).
Газы не имеют ни определенной формы, ни определенного объема, и они расширяются, чтобы заполнить свои сосуды. Мы сталкиваемся с материей в каждой фазе каждый день; на самом деле мы регулярно встречаемся с водой во всех трех фазах: лед (твердое тело), вода (жидкость) и пар (газ).Таблица \(\PageIndex{1}\): Характеристики каждой фазы материи Газ Жидкость Твердый Форма
не имеет определенной формы (принимает форму контейнера)
не имеет определенной формы (принимает форму контейнера)
определенная форма (жесткая)
Том
частицы движутся случайным образом практически без притяжения друг к другу
имеет определенный объем
определенный объем
Мобильность
частицы движутся случайным образом практически без притяжения друг к другу
частицы могут свободно перемещаться друг над другом, но по-прежнему притягиваются друг к другу
частицы колеблются вокруг неподвижных осей
Сжимаемость
сильно сжимаемый
слабо сжимаемый
слабо сжимаемый
Добавление энергии к материи дает ее атомам или молекулам способность сопротивляться некоторым силам, удерживающим их вместе.
 Например, подогрев льда до точка плавления дает его молекулам достаточно энергии для движения. Лед тает и становится жидкой водой. Точно так же нагревание жидкой воды до ее точки кипения дает ее молекулам достаточно энергии, чтобы отделиться друг от друга, чтобы они больше не контактировали. Жидкая вода испаряется и становится водяным паром.
Например, подогрев льда до точка плавления дает его молекулам достаточно энергии для движения. Лед тает и становится жидкой водой. Точно так же нагревание жидкой воды до ее точки кипения дает ее молекулам достаточно энергии, чтобы отделиться друг от друга, чтобы они больше не контактировали. Жидкая вода испаряется и становится водяным паром.Температуры плавления и точки кипения зависят от идентичности вещества и атмосферного давления. Каждое вещество имеет свои температуры кипения и плавления, которые зависят от свойств вещества. Например, значения для воды приведены в таблице \(\PageIndex{2}\). Обратите внимание, что температура кипения воды сильно зависит от давления.
Таблица \(\PageIndex{1}\): Температура кипения воды в зависимости от давления Высота над уровнем моря (футы) Давление (атм) Точка кипения ( o С) -500 1,05 100,5 0 1,00 100 4000 0,892 96 7000 0,797 93 Пример \(\PageIndex{1}\)
Изопропиловый спирт представляет собой бесцветное легковоспламеняющееся химическое соединение с сильным запахом.
 Его температура плавления составляет -89°С, а температура кипения составляет 82,5°С. Является ли изопропиловый спирт твердым, жидким или газообразным при комнатной температуре (25°C).
Его температура плавления составляет -89°С, а температура кипения составляет 82,5°С. Является ли изопропиловый спирт твердым, жидким или газообразным при комнатной температуре (25°C).Раствор
Поскольку комнатная температура (25°C) выше точки плавления изопропилового спирта (-89°C), но ниже его точки кипения (82,5°C), он является жидкостью при комнатной температуре.
Упражнение \(\PageIndex{1}\)
Фреон-12 используется в качестве хладагента и пропеллента для аэрозольных распылителей. Температура плавления -157,7°С, температура кипения -29,8°С. Является ли изопропиловый спирт твердым, жидким или газообразным при комнатной температуре (25°C).
- Ответить
Фреон-12 представляет собой газ при комнатной температуре
Авторы и авторство
1.2: States of Matter распространяется под лицензией CC BY-NC-SA 3.0, автором, ремиксом и/или куратором является LibreTexts.

- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.
- Включено
- да
- Теги
- изменение фазы
- источник[1]-chem-86182
органическая химия — Причина снижения температуры кипения гексафторизопропанола?
Задай вопрос
спросил
Изменено 6 лет, 2 месяца назад
Просмотрено 523 раза
$\begingroup$
Этанол и изопропиловый спирт имеют точки кипения 78,37 °C и 82,6 °C соответственно.
 Повышение температуры кипения очевидно из-за увеличения длины углеродной цепи, что привело к повышению температуры кипения изопропилового спирта.
Повышение температуры кипения очевидно из-за увеличения длины углеродной цепи, что привело к повышению температуры кипения изопропилового спирта.Но недавно я столкнулся с фторированным этанолом и изопропанолом, и тенденция температуры кипения обратная. Трифторэтанол имеет температуру кипения 78 ° C, тогда как гексафторизопропанол имеет температуру кипения 58,2 ° C.
В чем причина снижения температуры кипения гексафторизопропанола? Связано ли это с увеличением числа атомов фтора, если да, то почему это привело к снижению температуры кипения?
- органическая химия
- периодические тренды
- галогениды
$\endgroup$
1
$\begingroup$
Поскольку фтор намного более электроотрицательный, чем водород, его электроны значительно менее поляризуемы. Это уменьшает степень, в которой могут образовываться индуцированные диполи (дисперсионные силы Лондона), что, в свою очередь, снижает энергию, необходимую для разрушения внутримолекулярных сил.


 2 Физические свойства
2 Физические свойства
 1002/14356007.a22_173
1002/14356007.a22_173
 1002/14356007.a22_173
1002/14356007.a22_173 9\text{o} \text{C}\), вода — это газ (пар). Состояние воды зависит от температуры. Каждое состояние (твердое, жидкое и газообразное) имеет свой уникальный набор физических свойств. Рисунок \(\PageIndex{1}\): Материю обычно делят на три классических состояния. Слева направо: кварц (твердое), вода (жидкое), диоксид азота (газ).
9\text{o} \text{C}\), вода — это газ (пар). Состояние воды зависит от температуры. Каждое состояние (твердое, жидкое и газообразное) имеет свой уникальный набор физических свойств. Рисунок \(\PageIndex{1}\): Материю обычно делят на три классических состояния. Слева направо: кварц (твердое), вода (жидкое), диоксид азота (газ). Силы между атомами или молекулами достаточно сильны, чтобы удерживать молекулы относительно близко друг к другу, но недостаточно сильны, чтобы предотвратить их движение мимо друг друга.
Силы между атомами или молекулами достаточно сильны, чтобы удерживать молекулы относительно близко друг к другу, но недостаточно сильны, чтобы предотвратить их движение мимо друг друга.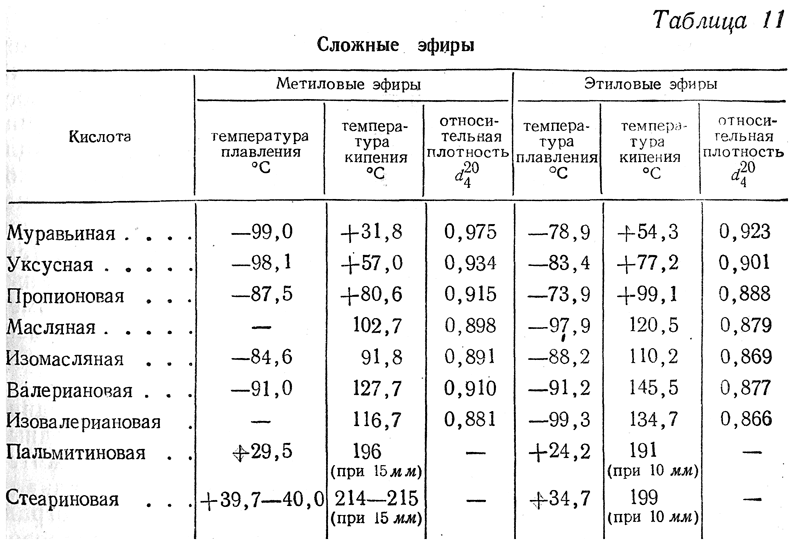 Твердое тело имеет определенный объем и форму, жидкость имеет определенный объем, но не имеет определенной формы, а газ не имеет ни определенного объема, ни формы (таблица \(\PageIndex{1}\)).
Твердое тело имеет определенный объем и форму, жидкость имеет определенный объем, но не имеет определенной формы, а газ не имеет ни определенного объема, ни формы (таблица \(\PageIndex{1}\)). Газы не имеют ни определенной формы, ни определенного объема, и они расширяются, чтобы заполнить свои сосуды. Мы сталкиваемся с материей в каждой фазе каждый день; на самом деле мы регулярно встречаемся с водой во всех трех фазах: лед (твердое тело), вода (жидкость) и пар (газ).
Газы не имеют ни определенной формы, ни определенного объема, и они расширяются, чтобы заполнить свои сосуды. Мы сталкиваемся с материей в каждой фазе каждый день; на самом деле мы регулярно встречаемся с водой во всех трех фазах: лед (твердое тело), вода (жидкость) и пар (газ). Например, подогрев льда до точка плавления дает его молекулам достаточно энергии для движения. Лед тает и становится жидкой водой. Точно так же нагревание жидкой воды до ее точки кипения дает ее молекулам достаточно энергии, чтобы отделиться друг от друга, чтобы они больше не контактировали. Жидкая вода испаряется и становится водяным паром.
Например, подогрев льда до точка плавления дает его молекулам достаточно энергии для движения. Лед тает и становится жидкой водой. Точно так же нагревание жидкой воды до ее точки кипения дает ее молекулам достаточно энергии, чтобы отделиться друг от друга, чтобы они больше не контактировали. Жидкая вода испаряется и становится водяным паром. Его температура плавления составляет -89°С, а температура кипения составляет 82,5°С. Является ли изопропиловый спирт твердым, жидким или газообразным при комнатной температуре (25°C).
Его температура плавления составляет -89°С, а температура кипения составляет 82,5°С. Является ли изопропиловый спирт твердым, жидким или газообразным при комнатной температуре (25°C).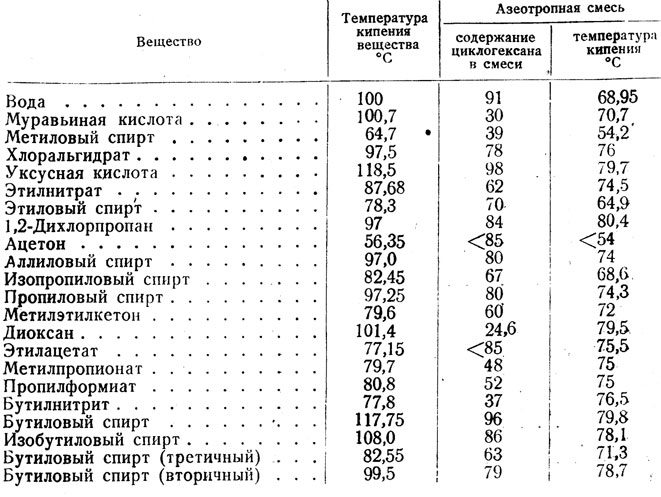
 Повышение температуры кипения очевидно из-за увеличения длины углеродной цепи, что привело к повышению температуры кипения изопропилового спирта.
Повышение температуры кипения очевидно из-за увеличения длины углеродной цепи, что привело к повышению температуры кипения изопропилового спирта.