Дихлорметан — это… Что такое Дихлорметан?
Дихлормета́н (хлористый метилен, ДХМ, CH2Cl2) — прозрачная легкоподвижная и легколетучая жидкость с характерным для галогенпроизводных сладковатым запахом. Впервые был синтезирован в 1840 году выдерживанием смеси хлора с хлористым метилом на свету. В целом наиболее безопасен среди галогеналканов.
Получение
Получают прямым хлорированием метана хлором в условиях радикального механизма при 400—500 °C при соотношении равном 5:1
- CH4 + Cl2 → CH3Cl + HCl
- CH3Cl + Cl2 → CH2Cl2 + HCl
- CH2Cl2 + Cl2 → CHCl3 + HCl
- CHCl3 + Cl2 → CCl4 + HCl
В результате получается смесь всех возможных хлоридов: хлорметан, дихлорметан, хлороформ и четырёххлористый углерод, которые потом разделяются дистилляцией. После чего он имеет чистоту не менее 99,7 % В 1995 году годовое производство оценивалось в 500 миллионов тонн.
Свойства
Растворимость в воде 2% по массе (13 г/л), смешивается с большинством органических растворителей. Легколетуч (40 °C), образует азеотропную смесь с водой (т.кип. 38,1 °C, 98,5 % дихлорметана). Метиленхлорид (дихлорметан) реагирует с хлором с образованием хлороформа и четырёххлористого углерода. С йодом при 200 °C дает СН2l2, с бромом при 25-30 °C в присутствии алюминия — бромхлорметан. При нагревании с водой гидролизуется до СН2О и НСl. При нагревании со спиртовым раствором NH3 до 100—125 °C образует гексаметилентетрамин. Реакция с водным раствором NH3 при 200 °C приводит к метиламину,муравьиной кислоте и НСl. С ароматическими соединениями в присутствии АlСl3 метиленхлорид вступает в реакцию Фриделя — Крафтса, например с бензолом образует дифенилметан. [1]
Применение
Дешевизна, высокая способность растворять многие органические вещества, легкость удаления, относительно малая токсичность привела к широкому применению его как растворителя для проведения реакций, экстракций в том числе и в лабораториях. Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Для растворения смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов.
Также используется в хроматографии.
В промышленности в смеси с полимерами используют для создания формы, которая быстро застывает за счёт испарения дихлорметана. Он также используется для склеивания пластмасс: полистирола, поликарбонатов, полиэтилентерефталата, АБС-пластиков, но не для полиэтилена и полипропилена.
Очистка в лаборатории
- Промывают концентрированной серной кислотой, нейтрализуют щелочью и промывают водой. Сушат над поташом или безводным сульфатом магния и перегоняют. Для дополнительного обезвоживания используют молекулярные сита 4А
- Кипятят с фосфорным ангидридом с последующей перегонкой. Хранят над молекулярными ситами 3А.
Специализированные применения
Дихлорметан используется в составах для склеивания пластиков. В смеси с метанолом используют как пропеллент, в качестве хладагента.
Безопасность
Хотя он и является наименее ядовитым среди галогеналканов, но нужно быть осторожным при обращении, так как он очень летуч и может вызвать острое отравление. Работы следует проводить при работающей вытяжной вентиляции.
В организме дихлорметан метаболизируется до монооксида углерода, что может вызвать отравление им. Длительный покровный контакт с дихлорметаном может вызвать его накопление в жировых тканях и привести к ожогу. Также при длительной работе с ним возможно поражение печени и нейропатия.
На крысах показано, что он может вызывать рак лёгких, печени и поджелудочной железы. В то же время не было отмечено какого-либо влияния на развития эмбрионов у женщин, имевших контакт с дихлорметаном [источник не указан 175 дней].
В Евросоюзе запрещены краски с дихлорметаном как для личного пользования, так и для профессонального применения.
Для регулярной работы с дихлорметаном не подходят перчатки из латекса или нитриловые.
Контакт дихлорметана с щелочными металлами приводит к взрыву.
ПДК в рабочей зоне 50мг/м³, в воде водоёмов не более 7.5 мг/л. КПВ 12-22 %
Примечания
- ↑ Химическая энциклопедия Т3, М 1988, стр 60-61
- ↑ Органикум Т2, М 1992, стр 411
dic.academic.ru
Дихлорметан — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
К:Википедия:Статьи без источников (тип: не указан)Дихлормета́н (метиленхлорид, хлористый метилен, ДХМ, CH2Cl2) — прозрачная легкоподвижная и легколетучая жидкость с характерным для галогенпроизводных запахом. Впервые был синтезирован в 1840 году выдерживанием смеси хлора с хлористым метилом на свету.
Получение
Получают прямым хлорированием метана хлором в условиях радикального механизма при 400—500 °C при соотношении равном 5:1
- <math>\mathsf{CH_4 + Cl_2\longrightarrow \ CH_3Cl + HCl}</math>
- <math>\mathsf{CH_3Cl + Cl_2\longrightarrow \ CH_2Cl_2 + HCl}</math>
- <math>\mathsf{CH_2Cl_2 + Cl_2\longrightarrow \ CHCl_3 + HCl}</math>
- <math>\mathsf{CHCl_3 + Cl_2\longrightarrow \ CCl_4 + HCl}</math>
В результате получается смесь всех возможных хлоридов: хлорметан, дихлорметан, хлороформ и четырёххлористый углерод, которые потом разделяются дистилляцией.
Свойства
Растворимость в воде 2 % по массе (20 г/л), смешивается с большинством органических растворителей. Легколетуч (40 °C), образует азеотропную смесь с водой (т.кип. 38,1 °C, 98,5 % дихлорметана). Метиленхлорид (дихлорметан) реагирует с хлором с образованием хлороформа и четырёххлористого углерода. С йодом при 200 °C дает СН 2l2, с бромом при 25-30 °C в присутствии алюминия — бромхлорметан. При нагревании с водой гидролизуется до СН2О и НСl. При нагревании со спиртовым раствором NH3 до 100—125 °C образует гексаметилентетрамин. Реакция с водным раствором NH3 при 200 °C приводит к метиламину, муравьиной кислоте и НСl. С ароматическими соединениями в присутствии АlCl3 метиленхлорид вступает в реакцию Фриделя — Крафтса, например с бензолом образует дифенилметан.[1]
Применение
Дешевизна, высокая способность растворять многие органические вещества, лёгкость удаления, относительно малая токсичность привела к широкому применению его как растворителя для проведения реакций, экстракций в том числе и в лабораториях. Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Для растворения смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов.
Также используется в хроматографии.
В промышленности в смеси с полимерами используют для создания формы, которая быстро застывает за счёт испарения дихлорметана. Он также используется для склеивания пластмасс: полистирола, поликарбонатов, полиэтилентерефталата, АБС-пластиков, но не для полиэтилена и полипропилена.
Очистка в лаборатории
Специализированные применения
Дихлорметан используется в составах для склеивания пластиков. В смеси с метанолом используют как пропеллент, в качестве хладагента.
Безопасность
Контакт дихлорметана с щелочными металлами приводит к взрыву. Работы с дихлорметаном следует проводить при работающей вытяжной вентиляции.
Дихлорметан способен вызвать наркоз. Он также токсичен: воздействует на печень, почки и селезёнку, способен проникать через кожу, гематоэнцефалитический и плацентарный барьеры.
При остром отравлении при вдыхании дихлорметана наблюдаются раздражение слизистых оболочек глаз и верхних дыхательных путей, головокружение, головные боли, помрачение сознания, рвота и понос. В случае тяжёлого отравления происходит потеря сознания вследствие наркоза вплоть до остановки дыхания. При хронических отравлениях наблюдаются постоянные головные боли, головокружение, потеря аппетита, поражение внутренних органов. Длительный покровный контакт с дихлорметаном может вызвать его накопление в жировых тканях и привести к ожогу. Также при длительной работе с ним возможно поражение печени и возникновение диабетической нейропатии.
В организме дихлорметан метаболизируется до монооксида углерода, что может вызвать отравление им.К:Википедия:Статьи без источников (тип: не указан)[источник не указан 785 дней]
На крысах показано, что он может вызывать рак лёгких, печени и поджелудочной железы.
В Евросоюзе запрещены краски с дихлорметаном как для личного пользования, так и для профессионального применения.
Для регулярной работы с дихлорметаном не подходят перчатки из латекса или нитриловые.
ПДК в рабочей зоне 50 мг/м³, в воде водоёмов не более 7.5 мг/л. Концентрационный предел воспламенения 12-22 %
Напишите отзыв о статье «Дихлорметан»
Примечания
- ↑ Химическая энциклопедия Т3, М 1988, стр 60-61
- ↑ Органикум Т2, М 1992, стр 411
Литература
- Новый справочник химика и технолога. Радиоактивные вещества. Вредные вещества. Гигиенические нормативы / Редкол.: Москвин А. В. и др.. — СПб.: АНО НПО «Профессионал», 2004. — 1142 с. — ISBN 5-98371-025-7.
- Ошин Л. А. Промышленные хлорорганические продукты. — М.: Химия, 1978. — 656 с. — 8400 экз.
Отрывок, характеризующий Дихлорметан
– Да уж… что делать! – с досадой проговорил офицер и взялся за калитку, как бы намереваясь уйти. Он опять остановился в нерешительности.– Видите ли? – вдруг сказал он. – Я родственник графу, и он всегда очень добр был ко мне. Так вот, видите ли (он с доброй и веселой улыбкой посмотрел на свой плащ и сапоги), и обносился, и денег ничего нет; так я хотел попросить графа…
Мавра Кузминишна не дала договорить ему.
– Вы минуточку бы повременили, батюшка. Одною минуточку, – сказала она. И как только офицер отпустил руку от калитки, Мавра Кузминишна повернулась и быстрым старушечьим шагом пошла на задний двор к своему флигелю.
В то время как Мавра Кузминишна бегала к себе, офицер, опустив голову и глядя на свои прорванные сапоги, слегка улыбаясь, прохаживался по двору. «Как жалко, что я не застал дядюшку. А славная старушка! Куда она побежала? И как бы мне узнать, какими улицами мне ближе догнать полк, который теперь должен подходить к Рогожской?» – думал в это время молодой офицер. Мавра Кузминишна с испуганным и вместе решительным лицом, неся в руках свернутый клетчатый платочек, вышла из за угла. Не доходя несколько шагов, она, развернув платок, вынула из него белую двадцатипятирублевую ассигнацию и поспешно отдала ее офицеру.
А Мавра Кузминишна еще долго с мокрыми глазами стояла перед затворенной калиткой, задумчиво покачивая головой и чувствуя неожиданный прилив материнской нежности и жалости к неизвестному ей офицерику.
В недостроенном доме на Варварке, внизу которого был питейный дом, слышались пьяные крики и песни. На лавках у столов в небольшой грязной комнате сидело человек десять фабричных. Все они, пьяные, потные, с мутными глазами, напруживаясь и широко разевая рты, пели какую то песню. Они пели врозь, с трудом, с усилием, очевидно, не для того, что им хотелось петь, но для того только, чтобы доказать, что они пьяны и гуляют. Один из них, высокий белокурый малый в чистой синей чуйке, стоял над ними. Лицо его с тонким прямым носом было бы красиво, ежели бы не тонкие, поджатые, беспрестанно двигающиеся губы и мутные и нахмуренные, неподвижные глаза. Он стоял над теми, которые пели, и, видимо воображая себе что то, торжественно и угловато размахивал над их головами засученной по локоть белой рукой, грязные пальцы которой он неестественно старался растопыривать. Рукав его чуйки беспрестанно спускался, и малый старательно левой рукой опять засучивал его, как будто что то было особенно важное в том, чтобы эта белая жилистая махавшая рука была непременно голая. В середине песни в сенях и на крыльце послышались крики драки и удары. Высокий малый махнул рукой.
– Шабаш! – крикнул он повелительно. – Драка, ребята! – И он, не переставая засучивать рукав, вышел на крыльцо.
Фабричные пошли за ним. Фабричные, пившие в кабаке в это утро под предводительством высокого малого, принесли целовальнику кожи с фабрики, и за это им было дано вино. Кузнецы из соседних кузень, услыхав гульбу в кабаке и полагая, что кабак разбит, силой хотели ворваться в него. На крыльце завязалась драка.
Целовальник в дверях дрался с кузнецом, и в то время как выходили фабричные, кузнец оторвался от целовальника и упал лицом на мостовую.
Другой кузнец рвался в дверь, грудью наваливаясь на целовальника.
Малый с засученным рукавом на ходу еще ударил в лицо рвавшегося в дверь кузнеца и дико закричал:
– Ребята! наших бьют!
В это время первый кузнец поднялся с земли и, расцарапывая кровь на разбитом лице, закричал плачущим голосом:
– Караул! Убили!.. Человека убили! Братцы!..
– Ой, батюшки, убили до смерти, убили человека! – завизжала баба, вышедшая из соседних ворот. Толпа народа собралась около окровавленного кузнеца.
– Мало ты народ то грабил, рубахи снимал, – сказал чей то голос, обращаясь к целовальнику, – что ж ты человека убил? Разбойник!
Высокий малый, стоя на крыльце, мутными глазами водил то на целовальника, то на кузнецов, как бы соображая, с кем теперь следует драться.
– Душегуб! – вдруг крикнул он на целовальника. – Вяжи его, ребята!
– Как же, связал одного такого то! – крикнул целовальник, отмахнувшись от набросившихся на него людей, и, сорвав с себя шапку, он бросил ее на землю. Как будто действие это имело какое то таинственно угрожающее значение, фабричные, обступившие целовальника, остановились в нерешительности.
– Порядок то я, брат, знаю очень прекрасно. Я до частного дойду. Ты думаешь, не дойду? Разбойничать то нонче никому не велят! – прокричал целовальник, поднимая шапку.
– И пойдем, ишь ты! И пойдем… ишь ты! – повторяли друг за другом целовальник и высокий малый, и оба вместе двинулись вперед по улице. Окровавленный кузнец шел рядом с ними. Фабричные и посторонний народ с говором и криком шли за ними.
У угла Маросейки, против большого с запертыми ставнями дома, на котором была вывеска сапожного мастера, стояли с унылыми лицами человек двадцать сапожников, худых, истомленных людей в халатах и оборванных чуйках.
– Он народ разочти как следует! – говорил худой мастеровой с жидкой бородйой и нахмуренными бровями. – А что ж, он нашу кровь сосал – да и квит. Он нас водил, водил – всю неделю. А теперь довел до последнего конца, а сам уехал.
Увидав народ и окровавленного человека, говоривший мастеровой замолчал, и все сапожники с поспешным любопытством присоединились к двигавшейся толпе.
– Куда идет народ то?
– Известно куда, к начальству идет.
– Что ж, али взаправду наша не взяла сила?
– А ты думал как! Гляди ко, что народ говорит.
wiki-org.ru
Дихлорметан ⌬ органические растворители на Chemical Region
Синонимы:
Дихлорметан, хлористый метиленT замерзания:
-96.70 °СВ промышленности дихлорметан получают хлорированием метана или, реже, хлорметана. При этом образуются всевозможные хлорзамещенные продукты. Чистота метана определяет количество примесей хлорированных соединений, содержащих два или более атомов углерода, в сыром продукте.
Обычно в продажу поступают реактивы двух степеней чистоты; оба они не являются очень чистыми, однако вполне могут быть использованы в качестве растворителей для обычных целей.
Дихлорметан, по-видимому, устойчив по отношению к обычным реактивам, применяемым в лаборатории. Он медленно реагирует с кислородом, и его следует хранить в темном сосуде, защищающем от прямого света (см. раздел, посвященный хлороформу). Заметного гидролиза дихлорметана под действием растворенной в нем воды не происходит, однако избыток воды может привести к гидролизу, скорость которого при умеренных температурах довольно высока. Дихлорметан образует при низкой температуре гидрат, который устойчив до 2°.
Трещанович и Баковский описали метод и аппаратуру, применяемые для непрерывного получения дихлорметана из метана и хлора, а также из хлорметана и хлора.
Метьюз очищал дихлорметан, промывая его водой и раствором карбоната натрия, осушая над хлористым кальцием и подвергая фракционированной перегонке. С целью получения препарата для измерений диэлектрической постоянной, Морган и Лоури многократно фракционировали продажный препарат, до тех пор пока удельная электропроводность средней фракции не становилась неизменной. Мариотт, Хоббс и Гросс промывали продажный реактив сначала концентрированной серной кислотой, затем разбавленным раствором едкого натра и, наконец, водой. Промытый дихлорметан оставляли стоять в течение ночи над едким натром и хлористым кальцием, после чего подвергали фракционированной перегонке на колонке Вид-мера высотой 60 см. Температура кипения составляла 39.93-40.12°, а показатель преломления пв был равен 1.4249.
Фогель фракционировал продажный дихлорметан и собирал фракцию, кипящую между 40 и 41°. После промывки 5%-ным раствором бикарбоната натрия, а затем водой препарат сушили и перегоняли на колонке Видмера.
Критерии чистоты. Мариотт, Хоббс и Гросс характеризовали степень чистоты температурой кипения и показателем преломления. Морган и Лоури подвергали препарат дихлорметана фракционированной перегонке до тех пор, пока удельная электропроводность не становилась минимальной. Массол и Фокон использовали в качестве критерия чистоты опти-ческую прозрачность.
Токсикология. Высокая упругость пара дихлорметана может приводить к значительным концентрациям его в воздухе. В опытах над мышами 1%-ная концентрация паров при двухчасовой экспозиции вызывала глубокий наркоз. При концентрации 0>72% через 8 мин. у людей начинают наблюдаться первые неприятные ощущения; при концентрации 0.23% через 30 мин. наступает тошнота; концентрация 0.0865-0.115% при экспозиции 30 мин. вызывает головокружение. Запах дихлорметана начинает ощущаться при концентрации 0.0317%. Предполагаемая максимально допустимая концентрация в воздухе равна 0.05%.
По данным Кирка и Осмера, дихлорметан является одним из наименее токсичных хлорпроизводных углеводородов. Работами, проведенными в лаборатории авторов, было установлено, что он практически не воспламеняется при обычных температурах.
Данные взяты из справочника А.Вайсбергер, Э.Проскауэр, Дж.Риддик, Э.Тупс
Органические растворители.- М.:Издатинлит, 1958.
Дипольный момент:
1.55Диэлектрическая проницаемость:
9.08 при 20 °СПлотность:
1.33479 при 15 °СПоказатель преломления:
1.42456 при 20 °Сwww.chemistry.org.ua
Дихлорметан — Википедия
Дихлормета́н (метиленхлорид, хлористый метилен, ДХМ, CH2Cl2) — прозрачная легкоподвижная и легколетучая жидкость с характерным для галогенпроизводных запахом. Впервые был синтезирован в 1840 году выдерживанием смеси хлора с хлористым метилом на свету.
Получение
Получают прямым хлорированием метана хлором в условиях радикального механизма при 400—500 °C при соотношении равном 5:1
- Ch5+Cl2⟶ Ch4Cl+HCl{\displaystyle {\mathsf {CH_{4}+Cl_{2}\longrightarrow \ CH_{3}Cl+HCl}}}
- Ch4Cl+Cl2⟶ Ch3Cl2+HCl{\displaystyle {\mathsf {CH_{3}Cl+Cl_{2}\longrightarrow \ CH_{2}Cl_{2}+HCl}}}
- Ch3Cl2+Cl2⟶ CHCl3+HCl{\displaystyle {\mathsf {CH_{2}Cl_{2}+Cl_{2}\longrightarrow \ CHCl_{3}+HCl}}}
- CHCl3+Cl2⟶ CCl4+HCl{\displaystyle {\mathsf {CHCl_{3}+Cl_{2}\longrightarrow \ CCl_{4}+HCl}}}
В результате получается смесь всех возможных хлоридов: хлорметан, дихлорметан, хлороформ и четырёххлористый углерод, которые потом разделяются ректификацией.
Видео по теме
Свойства
Растворимость в воде 2 % по массе (20 г/л), смешивается с большинством органических растворителей. Легколетуч (40 °C), образует азеотропную смесь с водой (т.кип. 38,1 °C, 98,5 % дихлорметана). Метиленхлорид (дихлорметан) реагирует с хлором с образованием хлороформа и четырёххлористого углерода. С йодом при 200 °C дает СН2l2, с бромом при 25-30 °C в присутствии алюминия — бромхлорметан. При нагревании с водой гидролизуется до СН2О и НСl. При нагревании со спиртовым раствором NH3 до 100—125 °C образует гексаметилентетрамин. Реакция с водным раствором NH3 при 200 °C приводит к метиламину, муравьиной кислоте и НСl. С ароматическими соединениями в присутствии АlCl3 метиленхлорид вступает в реакцию Фриделя — Крафтса, например с бензолом образует дифенилметан.[2]
Применение
Дешевизна, высокая способность растворять многие органические вещества, лёгкость удаления, относительно малая токсичность привела к широкому применению его как растворителя для проведения реакций, экстракций в том числе и в лабораториях. Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Для растворения смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов.
Также используется в хроматографии.
В промышленности в смеси с полимерами используют для создания формы, которая быстро застывает за счёт испарения дихлорметана. Он также используется для склеивания пластмасс: полистирола, поликарбонатов, полиэтилентерефталата, АБС-пластиков, но не для полиэтилена и полипропилена.
Очистка в лаборатории
Специализированные применения
Дихлорметан используется в составах для склеивания пластиков. В смеси с метанолом используют как пропеллент, в качестве хладагента.
Безопасность
Контакт дихлорметана с щелочными металлами приводит к взрыву. Работы с дихлорметаном следует проводить при работающей вытяжной вентиляции.
Дихлорметан способен вызвать наркоз. Он также токсичен: воздействует на печень, почки и селезёнку, способен проникать через кожу, гематоэнцефалитический и плацентарный барьеры.
При остром отравлении при вдыхании дихлорметана наблюдаются раздражение слизистых оболочек глаз и верхних дыхательных путей, головокружение, головные боли, помрачение сознания, рвота и понос. В случае тяжёлого отравления происходит потеря сознания вследствие наркоза вплоть до остановки дыхания. При хронических отравлениях наблюдаются постоянные головные боли, головокружение, потеря аппетита, поражение внутренних органов. Длительный покровный контакт с дихлорметаном может вызвать его накопление в жировых тканях и привести к ожогу. Также при длительной работе с ним возможно поражение печени и возникновение диабетической нейропатии.
В организме дихлорметан метаболизируется до монооксида углерода, что может вызвать отравление им.[4]
На крысах показано, что он может вызывать рак лёгких, печени и поджелудочной железы.
В Евросоюзе запрещены краски с дихлорметаном как для личного пользования, так и для профессионального применения.
Для регулярной работы с дихлорметаном не подходят перчатки из латекса или нитриловые.
ПДК в рабочей зоне 50 мг/м³, в воде водоёмов не более 7.5 мг/л. Концентрационный предел воспламенения 12-22 %. Не горюч, но поддерживает горение, от огня дает вспышку, но не горит сам, горит в смеси с другими горящими материалами внося свой вклад при пожаре, однако пролить на стол около спиртовки его не так опасно как горючие растворители, скорее как масло[источник не указан 343 дня].
Примечания
Литература
- Новый справочник химика и технолога. Радиоактивные вещества. Вредные вещества. Гигиенические нормативы / Редкол.: Москвин А. В. и др.. — СПб.: АНО НПО «Профессионал», 2004. — 1142 с. — ISBN 5-98371-025-7.
- Ошин Л. А. Промышленные хлорорганические продукты. — М.: Химия, 1978. — 656 с. — 8400 экз.
wiki2.red
Дихлорметан — WiKi
Получают прямым хлорированием метана хлором в условиях радикального механизма при 400—500 °C при соотношении равном 5:1
- Ch5+Cl2⟶ Ch4Cl+HCl{\displaystyle {\mathsf {CH_{4}+Cl_{2}\longrightarrow \ CH_{3}Cl+HCl}}}
- Ch4Cl+Cl2⟶ Ch3Cl2+HCl{\displaystyle {\mathsf {CH_{3}Cl+Cl_{2}\longrightarrow \ CH_{2}Cl_{2}+HCl}}}
- Ch3Cl2+Cl2⟶ CHCl3+HCl{\displaystyle {\mathsf {CH_{2}Cl_{2}+Cl_{2}\longrightarrow \ CHCl_{3}+HCl}}}
- CHCl3+Cl2⟶ CCl4+HCl{\displaystyle {\mathsf {CHCl_{3}+Cl_{2}\longrightarrow \ CCl_{4}+HCl}}}
В результате получается смесь всех возможных хлоридов: хлорметан, дихлорметан, хлороформ и четырёххлористый углерод, которые потом разделяются ректификацией.
Растворимость в воде 2 % по массе (20 г/л), смешивается с большинством органических растворителей. Легколетуч (40 °C), образует азеотропную смесь с водой (т.кип. 38,1 °C, 98,5 % дихлорметана). Метиленхлорид (дихлорметан) реагирует с хлором с образованием хлороформа и четырёххлористого углерода. С йодом при 200 °C дает СН2l2, с бромом при 25-30 °C в присутствии алюминия — бромхлорметан. При нагревании с водой гидролизуется до СН2О и НСl. При нагревании со спиртовым раствором NH3 до 100—125 °C образует гексаметилентетрамин. Реакция с водным раствором NH3 при 200 °C приводит к метиламину, муравьиной кислоте и НСl. С ароматическими соединениями в присутствии АlCl3 метиленхлорид вступает в реакцию Фриделя — Крафтса, например с бензолом образует дифенилметан.[2]
Дешевизна, высокая способность растворять многие органические вещества, лёгкость удаления, относительно малая токсичность привела к широкому применению его как растворителя для проведения реакций, экстракций в том числе и в лабораториях. Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Для растворения смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов.
Также используется в хроматографии.
В промышленности в смеси с полимерами используют для создания формы, которая быстро застывает за счёт испарения дихлорметана. Он также используется для склеивания пластмасс: полистирола, поликарбонатов, полиэтилентерефталата, АБС-пластиков, но не для полиэтилена и полипропилена.
Очистка в лаборатории
Специализированные применения
Дихлорметан используется в составах для склеивания пластиков. В смеси с метанолом используют как пропеллент, в качестве хладагента.
Контакт дихлорметана с щелочными металлами приводит к взрыву. Работы с дихлорметаном следует проводить при работающей вытяжной вентиляции.
Дихлорметан способен вызвать наркоз. Он также токсичен: воздействует на печень, почки и селезёнку, способен проникать через кожу, гематоэнцефалитический и плацентарный барьеры.
При остром отравлении при вдыхании дихлорметана наблюдаются раздражение слизистых оболочек глаз и верхних дыхательных путей, головокружение, головные боли, помрачение сознания, рвота и понос. В случае тяжёлого отравления происходит потеря сознания вследствие наркоза вплоть до остановки дыхания. При хронических отравлениях наблюдаются постоянные головные боли, головокружение, потеря аппетита, поражение внутренних органов. Длительный покровный контакт с дихлорметаном может вызвать его накопление в жировых тканях и привести к ожогу. Также при длительной работе с ним возможно поражение печени и возникновение диабетической нейропатии.
В организме дихлорметан метаболизируется до монооксида углерода, что может вызвать отравление им.[4]
На крысах показано, что он может вызывать рак лёгких, печени и поджелудочной железы.
В Евросоюзе запрещены краски с дихлорметаном как для личного пользования, так и для профессионального применения.
Для регулярной работы с дихлорметаном не подходят перчатки из латекса или нитриловые.
ПДК в рабочей зоне 50 мг/м³, в воде водоёмов не более 7.5 мг/л. Концентрационный предел воспламенения 12-22 %. Не горюч, но поддерживает горение, от огня дает вспышку, но не горит сам, горит в смеси с другими горящими материалами внося свой вклад при пожаре, однако пролить на стол около спиртовки его не так опасно как горючие растворители, скорее как масло[источник не указан 343 дня].
ru-wiki.org
Дихлорметан
Дихлорметан – это синтетическое химическое вещество, которое создано руками человека. Оно не встречается в природе. На внешний вид представляет прозрачную жидкость. Отличительной особенностью этого вещества считается наличие сладковатого запаха, напоминающего хлороформ.
Химическая формула дихлорметана Ch3Cl2. В химической промышленности это вещество имеет несколько названий: метилен хлористый, метиленхлорид или дихлорметан. Производится согласно ГОСТу 9968-86 «Метилен хлористый технический. Технические условия».
Физико-химические особенности
Дихлорметан производится в виде органического вещества, которое способно воспламенятся и взрываться. Это химическое соединение не вступает в реакции с водной средой, но способно растворять множество других органических веществ. Плотность дихлорметана составляет 1,33 г/см³.
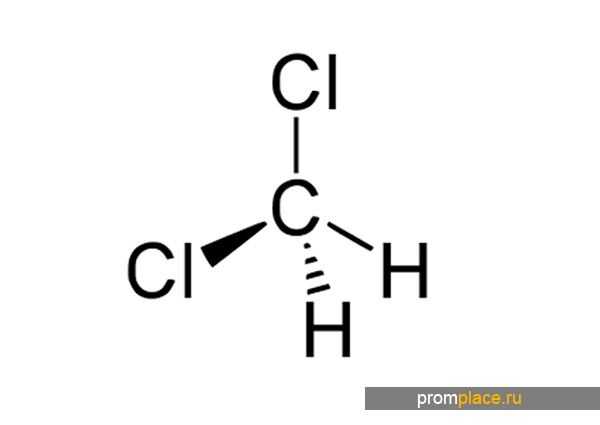
Класс органических соединений дихлорметана – алифатические галогеносодержащие вещества. Из-за своей жидкой консистенции он считается весьма летучим и подвижным веществом, в котором полностью отсутствуют любые механические включения или примеси. Характерная черта– это едкий приторно-сладкий запах.
Хлористый метилен или дихлорметан впервые был открыт в 1840 году. В то время его получили в результате выдержки смеси из хлора и метила. Современные производственные химические компании изготовляют дихлорметан путем хлорирования метана хлором. В результате этой реакции химики получают большое количество различных хлорсодержащих веществ, среди которых в чистом виде присутствует и метиленхлорид.

Существует цепочка реакций, которая наглядно демонстрирует превращение метана в хлорметан и дихлорметан.
Сh5+Cl2->Ch4Cl+HCl
Ch4Cl+Cl2->Ch3Cl2+HCl
Ch3Cl2+Cl2->CHCl3+HCl
Хлорметан считается производной дихлорметана. Это вещество представляет едкий газ, который отличается сильным токсическим действием.
В процессе гидролиза дихлорметан может образовывать формалин и соляную кислоту.
Ch3Cl2+h3O -> 2HCl + HCHO
Сферы применения
Применение дихлорметана обусловлено его способностью растворять различные органические вещества. Его также вводят в составы пинополиуретанов в качестве пенообразующего вещества. Дихлорметан в качестве растворителя используют в:
- • производстве различных полимеров,
- • строительной сфере,
- • текстильной промышленности,
- • производстве красок и лаков,
- • пищевой промышленности.
Метиленхлорид является незаменимым химическим веществом, которое помогает в процессе экстрагирования. Дихлорметан применяют в процессе изготовления чая и кофе, в пивоварении. Также это химическое соединение принимает участие в процессе производства различных ароматизаторов, которые используют для мороженого, напитков, конфет, различных фруктовых джемов и наполнителей. Дихлорметан применяют в качестве растворителя жировых соединений в процессе обработки экзотических фруктов.
Метиленхлорид или дихлорметан используют в процессе отбора проб воды. С его помощью проводят анализ воды на наличие токсических веществ, нитритов и нитратов, кислот, тяжелых металлов и т.д.
В строительной сфере дихлорметан помогает удалить жировую пленку с бетона, керамики, битума. Он растворяет смолы и обезжиривает металлические конструкции. Также свойства дихлорметана нашли свое применение в процессе производства поролоновых материалов. Это хиическое вещество применяют в процессе вспенивания низкоплотных поролонов.
Метилен хлористый не только растворяет жиросодержащие вещества, но и способен к склеиванию различных пластиков:
- • полистирола,
- • оргстекла,
- • поликарбонатов,
- • АБС-полимеров.
Дихлорметан начали применять в фармацевтической сфере. С его помощью производят синтез аскорбиновой кислоты.

Это вещество используют в процессе производства кинопленок. Дихлорметан способствует моментальному застыванию различных пластмассовых смесей. С недавнего времени это вещество стали использовать в процессе производства духов.
В сельском хозяйстве дихлорметан входит в составы некоторых пестицидов и фумигантов. Его добавляют в некоторые пленки.
Широкое применение дихлорметана обусловлено его доступной ценой и простотой производства. Его ценят в различных сферах производства за способность к растворению различных жиров и кислот, простое применение и удаление с обрабатываемых поверхностей.
Безопасность вещества
Класс опасности дихлорметана 4. Это означает, что данное вещество относится к малоопасным и безопасным химическим соединениям. Но во время работы и хранения дихлорметана нужно быть максимально осторожным, так как это соединение способно быстро улетучиваться, что может привести к взрыву.
При непосредственном контакте с этим веществом нужно надевать защитную одежду, респиратор, защитные очки и перчатки. При длительном воздействии на организм дихлорметан способен вызвать наркоз. Он пагубно влияет на состояние нервной системы, может вызывать зрительные и слуховые галлюцинации. Дихдлорметан способен влиять на работу ЖКТ, почек и печени.
Первые симптомы отравления дихлорметаном:
- • головная боль,
- • головокружение.
- • тошнота,
- • отсутствие аппетита.
Если это вещество попало на кожу человека, то на месте контакта может появиться ожог. Допустимая норма концентрации дихлорметана в воздухе составляет 50 мг/м³. Средняя цена дихлорметана в Российской Федерации составляет 50-60 рулей за 1 кг.
promplace.ru
Метилен хлористый температура кипения — Справочник химика 21
Для улавливания паров с температурой кипения ниже 60 °С (метанол, хлористый метилен, ацетон и др.) [c.148]Хлористый метил применяют в качестве охлаждающего агента в холодильных установках и как метилирующее средство. В химической промышленности его используют как полупродукт для получения силиконов, а также для других процессов. Хлористый метилен, несмотря на его низкую температуру кипения (40,1°), приобретает все большее и большее значение как растворитель, например, в производстве ацетата целлюлозы и бутил ка у чу ка. [c.80]
Наиболее распространенные экстрагирующие растворители а)лег-че воды — диэтиловый эфир (низкая температура кипения, легко воспламеняется, несколько — примерно до 6% — растворим в воде), бензол (огнеопасен), петролейный эфир (огнеопасен) б) тяжелее воды— хлористый метилен (низкая температура кипения +41° С), хлороформ, четыреххлористый углерод. [c.39]
При выборе экстрагента для очистки дифенилолпропана необходимо учитывать, что он должен обладать следующими свойствами хорошо растворять примеси и плохо — дифенилолпропан иметь низкую температуру кипения, что позволит осушать дифенилолпропан при низкой температуре (это особенно важно ввиду невысокой термостойкости дифенилолпропана) быть доступным и недорогим. Кислородсодержащие растворители (этанол, ацетон, уксусная кислота и др.) непригодны для этой цели вследствие высокой растворимости в них дифенилолпропана. Наиболее подходящими растворителями являются парафиновые углеводороды (гептан) » , низкокипящие хлорзамещенные алифатические углеводороды (хлористый метилен, дихлорэтилен) 31 ароматические углеводороды (бензол, толуол, ксилол) и их хлорпроизводные а также ароматические углеводороды с добавкой фенола или крезола » . [c.166]
Следует заметить, что при определении суперэкотоксикантов в следовых количествах упариванию должны подвергаться только низкокипя-щие растворители (дихлорэтан, хлористый метилен, метанол, гексан и др ) Иногда к ним добавляют растворители с более высокой температурой кипения (0,5-1%), которые смачивают стенки перегонной колбы и способствуют удерживанию следового компонента в растворе благодаря предотвращению его необратимой сорбции на ее стенках. Так, при упаривании 100 мл метанольного раствора, содержащего от 1 до 50 мг/л ДДТ, до объема 1 мл к нему добавляют 0,5 мл полиэтиленгликоля. В этом случае удается снизить потери до величины менее 1%. [c.229]
В качестве растворителей нефтепродуктов применяют также некоторые галондпроизводные хлористый метилен, дихлорэтан [14], смесь хлористого метилена и дихлорэтана и др. Достоинство хлористого метилена — низкая температура кипения, что обеспечивает при быстром его испарении снятие тепла комплексообразования и регулирование в необходимых пределах температуры в зоне реакции. Однако хлористый метилен вызывает коррозию оборудования. [c.72]
Отдельные опыты проводились также на чистом хлористом метилене. Подпитка осуществлялась жидкостью, имевшей температуру, близкую к температуре кипения хлористого метилена (40°С). Кажущиеся полные температурные напоры изменялись от 8,5 до 41,5°С. [c.116]
Наибольшее применение имеет экстракция вещества из водного раствора органическим растворителем В качестве экстрагентов в этом случае наиболее часто применяют диэтиловый эфир, бензол, хлороформ, дихлорэтан, четыреххлористый углерод, петролейный эфир, этил-ацетат, хлористый метилен и др. Растворитель должен мало растворяться в другой фазе Растворимость в нем извлекаемого вещества должна быть значительно выше, чем в экстрагируемом растворе. Растворитель должен иметь невысокую температуру кипения, при выделении чистого вещества легко отгоняться при достаточно низкой температуре Раствор и экстрагент должны значительно отличаться по плотности. Целесообразно экстрагировать раствор несколько раз небольшими порциями растворителя [c.27]
Для осушки растворителя можно использовать различные методы. При относительно низком содержании воды эффективна прямая перегонка с использованием достаточно хорошей колонки. С помощью стеклянного сосуда, в котором в течение нескольких месяцев хранился ацетонитрил, мы обнаружили, что продукт, полученный при помощи описанной выше процедуры, содержал около 1 мМ воды без какой-либо дополнительной обработки. Для удаления больших количеств воды азеотропная смесь ацетонитрила с водой не пригодна из-за низкого содержания воды. К тому же температура ее кипения приближается к температуре кипения ацетонитрила. Более эффективна перегонка с хлористым метиленом, так как и это вещество (т. к. 41,5°С), и его азеотропная смесь с водой (т. к. 38,1°С при 1,5%) П2О) легко отделяются от ацетонитрила при малых потерях последнего. Молекулярные сита (тип ЗА) можно эффективно использовать для осушки ацетонитрила, однако их нельзя применять для осушки соответствующих растворов с фоновым электролитом, поскольку калий, содержащийся в молекулярных ситах, обменивается с катионом электролита и осаждается на поверхности молекулярных сит, что приводит к уменьшению проводимости раствора. Для очистки ацето нитрильных растворов Na 104, БТЭА и ПТПА в нашей лаборатории с успехом был применен следующий метод предварительно взвешенная соль в течение нескольких часов прокаливалась в вакууме при температуре 150 °С. Соответствующий сосуд был снабжен притертым шлифом, который позволял непосредственно соединять его с колонкой с молекулярным ситом (тип Linde ЗА 25,4 мм х 1,2 м) через колонку раствор просачивался со скоростью 1 мл/мин. Электролизер высушивался в вакуумной печи и снабжался шлифами, при помощи которых его можно было соединять с вакуумной линией и сосудом с растворителем так, что, используя давление чистого азота, можно было обеспечить перекачку растворителя без j oHW Электролизер также снабжался перегородками для до- [c.10]
Одним из эффективных методов повышения пожарной безопасности в химическом производстве является замена огнеопасных легколетучих жидкостей, часто применяемых в качестве растворителей, менее опасными жидкостями с температурой кипения выше 110°С (амилацетат, этиленгликоль, хлорбензол, ксилол, амиловый спирт и др.) или негорючими растворителями. К таким растворителям относятся четыреххлористый углерод, хлористый метилен, трихлорэтилен и другие хлорированные углеводороды. [c.522]
Получение масла из мякоти плодов. Процесс сводится к сушке жома (жмыха), измельчению и извлечению из него масла. Для этой цели жмых измельчают в дробилке и подвергают сушке на паровой конвейерной сушилке типа ПКС-10 при 75° в течение 1—1,5 ч до влажности 6—7%. Выход сухого жмыха составляет 7,5—9,0% к массе свежего сырья. Состав сухого жмыха (в %) масла е плодовой мякоти — 15—27, каротина — 12—16 мг%, семян — 45—55%, влажность 4,0—7,0. Процесс экстракции масла из жмыха осуществляют в настоящее время по методу В. Казанцева и А. Охина в батарее из 22 диффузоров подсолнечным или кунжутным маслом при 50— 65° С. Полный оборот батареи 24 ч. Отбор масла из головного диффузора происходит каждые 1,0—1,5 ч. Из хвостового диффузора соответственно выгружают жмых с масличностью 45—50%. В специальном шнековом прессе (экспеллере) отжимают масло из жмыха. Недостатками данного метода диффузии являются потери каротина достигают 20—22%, получаемое масло содержит 15—20% подсолнечного, высокое кислотное число масла, достигающее 10,0—15,0. В связи с этим возник вопрос о применении органического растворителя для экстракции липидов облепихи. В результате проведенных исследований процесса экстракций с различными растворителями (петролейный эфир, дихлорэтан, бензол и хлористый метилен) наиболее эффективным является хлористый метилен (дихлорметан, СН2С12). Последний имеет низкую температуру кипения (41—42°), плотность при 20° С 1336 кг/м , малотоксичен. При экстракции этим растворителем может быть получен высокий выход масла (95%) и каротина (97%) [21]. По-видимому, Экстракция масла из жмыха хлористым метиленом будет наиболее эффективна. Необходимо лишь отработать вопрос полного удаления растворителя из готового продукта. [c.376]
Второй метод отличается лишь тем, что в нем применяют растворитель. Лучшим растворителем является этилацетат, содержащий 0,5% воды [257] он много лучше, чем другие применявшиеся растворители, такие, как диэтиловый эфир, хлороформ, хлористый метилен, диметилформамид, диоксан, нитрометан и этиловый спирт [265, 266]. В некоторых случаях хорошим растворителем служит ацетонитрил. Безводный этил-ацетат требует более продолжительного нагревания, чем влажный этилацетат, и продукты реакции получаются менее чистыми. Реакционную смесь кипятят с обратным холодильником до полного растворения, но не более 3 час. В некоторых случаях для проведения реакции применялись герметические сосуды, учитывая низкую температуру кипения ацетиленового эфира. [c.236]
Чаще всего вещество извлекают из водного раствора органическим растворителем (диэтиловый эфир, бензол, хлороформ, дихлорэтан, четыреххлористый углерод, хлористый метилен, петролейный эфир, этилацетат и др.). При подборе растворителя для экстракции учитывают несколько факторов а) растворитель не должен смешиваться с водной фазой б) растворимость извлекаемого вещества в экстрагенте должна быть значительно выше, чем в исходном растворе в) плотность веществ разная г) растворитель должен иметь невысокую температуру кипения. [c.21]
Применение указанных растворителей связано с взрыво- и пожароопасностью. Огнеопасные растворители иногда заменяют негорючими растворителями—хлорированными углеводородами со сравнительно низкой температурой кипения (табл. 5). С помощью этих растворителей можно обрабатывать изделия как в жидкой, так и в паровой фазах. В промышленности применяют трихлорэтилен (ТХЭ), перхлорэтилен (ПХЭ) и хлористый метилен (метиленхлорид), наиболее часто — трихлорэтилен. [c.235]
Хлористый метил применяют в качестве охлаждающего агента в холодильных установках и как метилирующее средство. Хлористый метилен, несмотря на его низкую температуру кипения (40, Г С), приобретает все большее и большее значение как растворитель ацетата целлюлозы. [c.65]
Однако при использовании растворителей со сравнительно высокой температурой кипения при температурах ниже —100° С возможно выделение из раствора твердой фазы, что небезопасно. Поэтому для приготовления растворов ацетилена рекомендуют применять растворители или азеотропные смеси растворителей с невысокой температурой кипения, например метиловый спирт, метилформиат, диэтиловый эфир, хлористый метилен, ацетальдегид и др. В состав азеотропных смесей могут входить ацетон, этиловый спирт, этилацетат и др. [c.196]
Кристаллизованную соль гидролизовали кипячением с разбавленной соляной кислотой и затем экстрагировали хлористым метиленом. После разгонки экстракта в вакууме получали светло-желтую жидкость с температурой кипения 100—110° при 2,5 мм рт. ст. Она быстро полимеризовалась в приемнике с образованием каучукоподобного полимера, вероятно линейного полимерного дисульфида [c.426]
Система метанол — хлористый метилен — ацетон, показанная на рис. IX-9, имеет три таких участка MDE, DEA и ЕАС. Точка 1 на участке МОЕ отвечает составу исходной смеси. Самая нижняя точка иа поверхности температуры для такой трехкомпонентной системы приходится на бинарный азеотроп метанол — хлористый метилен (точка Е). К этой точке можно подойти из точки 1 (если, вообще, практически можно ее достигнуть). В данном случае первым верхним продуктом будет азеотроп метанол — хлористый метилен, как это видно из кривой периодической разгонки для точки 1 на рис. IX-10. Состав кубового продукта (остатка) будет отходить от состава верхнего продукта, как показывают стрелки (см. рис. IX-9) до тех пор, пока не исчерпается хлористый метилен и останется только бинарная система метанол — ацетон. Когда состав кубового продукта достигает основания концентрационного треугольника, минимальная температура кипения смеси соответствует бинарному азеотропу метанол — ацетон, который и будет вторым верхним цродуктом. Состав кубового продукта [c.223]
Метиленхлорид (хлористый метилен, дихлорметан СНаСТа) бесцветная жидкость с температурой кипения 40° С. Основные свойства метиленхлорида приведены в табл. 2. Он растворяется в спиртах и эфирах и сам является хорошим растворителем. В производстве аэрозолей он широко используется в смесях с пропеллентами, имеющими высокое давление насыщенного нара, в качестве вспомогательного пропеллента. Он дешевле фреона-11, и поэтому может употребляться вместо него. Нанример, метиленхлорид включают в инсектицидные составы в количестве около 25% от всей рецептуры. В этом случае оп служит для двух целей 1) как растворитель, заменяющий дорогостоящие ароматические растворители, 2) как заменитель фреона-11. В патентной литературе [38] встречаются указания на возможность ирименения метиленхлорида в составах пропеллентов в лаках для волос (без увеличения их токсичности). [c.46]
Выпариванием водного раствора получили 50 г предполагаемого дифторацетата аммония. Эта. соль растворялась в горячем водном растворе едкого натра с выделением аммиака. Водный раствор этой соли подкисляли концентрированной серной кислотой и экстрагировали хлористым — метиленом. Экстракт перегоняли и получали жидкость, идентичную по температуре кипения (132°) и по эквиваленту нейтрализации (94) дифторуксусной кислоте. [c.99]
Были проведены опыты для сравнения этих кетонов, успешно применяемых в других процессах депарафинизации, с хлористым метиленом. Как видно из рис. 9, скорость образования аддуктов в присутствии кетонов выше, чем в присутствии хлористого метилена, очевидно, вследствие более сильного солюбилизирующего действия кетонов. При применении метилизобутилкетона температура текучести депарафинированного масла также ниже. Однако в присутствии кетонов образуются аддукты микрокристаллической структуры, фильтрация и промывка которых осуществляется значительно труднее, чем крупнозернистых а,ддуктов, получаемых в присутствии хлористого метилена. Недостатком кетонов является и высокая температура кипения, которая вызывает необходимость в оборудовании реакторов специальными охлаждающими устройствами. [c.284]
Метиленгалогениды (дигалогениды). — Хлористый метилен СНгСЬ является прекрасным растворителем для органических соединений он нерастворим в воде, тяжелее ее, имеет низкую температуру кипения (40,8 °С) и не воспламеняется. Благодаря этим свойствам метиленхлорид находит применение в качестве растворителя для экстракции и кристаллизации в последнем случае он применяется как в индивидуальном виде, так и в смеси с другими растворителями, [c.403]
Около десяти лет тому назад я получил хлористый метилен СНаС , в малом количестве, действуя хлором на иодистый метилен. Сделанное мною тогда определение хлора не вполне отвечало теории, хотя и не оста вило сомнения, что тело действительно обладало составом СН,С12. Оно кипело при 40—42° и, казалось, не было совершенно чисто. Я тогда же обратил внимание на различие температур кинения моего хлористого метилена и охлоренного хлористого метила СНзС , для которого Реньо, его приготовивший, дает точку кипения 30,5°. Различие это заставляло тогда предполагать здесь изомерию, но понятия о химическом строении, выработавшиеся впоследствии, представили изомерию частицы СН2С12 невозможной. Ближайшее изучение хлористого метилена сделалось интересным, и я принялся за него снова. Я имел сначала в виду сравнить хлористый метилен, получаемый из иодистого метилена, с соединением Реньо, но в продолжение моей работы появилась заметка Перкина о хлористом метилене, получаемом восстановлением хлороформа. Перкин нашел для него, как и я для своего, точку кипения 40—42°, а потом, на вопрос мой, уведомил меня письмом, что хлористый метилен, приготовленный по способу Реньо (охлоренный хлористый метил), также исследован им и оказался имеющим ту же температуру кипения, 40—42°, и тождественным с приготовленным из хлороформа. Мне пришлось, таким образом, ограничиться ближайшим изучением хлористого метилена, получаемого из иодистого метилена. [c.229]
Хлорпроизводные ацетилена устойчивы, не склонны к образованию кис-,чых продуктов II являются очень ценными растворителями, применяемыми в промышленности. Так, сил.и-дихлорэтилен, близкий по температуре кипения к хлористому метилену СН2С1г, является растворителем каучука. Он, правда, горюч, но пламя его очень легко погасить. Т етрахлорэтан обладает коррозионным действием и токсичен (вызывает атрофию печени) и потому не может применяться в качестве растворителя для лаков и других веществ. Однако он является прекрасным растворителем, используемым в синтезах, проводимых в присутствии хлористого алюминия, так как не разрушается безводным AI I3. Т р и X л о р э т и л е н негорюч и устойчив даже к действию [c.187]
При приготовлении насадки рекомендуется также использовать для растворения неподвижной фазы относительно высококипяшие растворители, а не хлористый метилен, метанол и ацетон. Растворители с более низкой температурой кипения часто улетучиваются чрезмерно быстро и при использовании подогрева частицы носителя могут растрескиваться. Особенно важна летучесть растворителя, если используется метод фильтрации, поскольку более летучий растворитель часто испаряется с верхней поверхности слоя насадки и не проходит вглубь. Это приводит к локальному покрытию носителя чрезвычайно большим количеством неподвижной фазы или даже высаждению самой неподвижной [c.146]
В настоящее время начинают применяться водные растворы этиленгликоля С2Н4(ОН)2 и пропиленгликоля СзН,.,(ОН). (наиболее низкая температура замерзания соответственно —73°С и —оО°С). Характерной особенностью этих гликолей является низкая летучесть, поскольку их нормальная температура кипения (при 1 ата) около 2(iO . В зарубежных промыш енных установках используют в качестве хладоносителей некоторые чистые вещества (не растворы), которые в иных условиях используются и как рабочие тела холодильных машин, К ним относятся, например, трихлорэтилен ( 2H I3 и хлористый метилен (дихлорметан) Hg Ia, замерзающие при температуре около —90 С. Недостатками этих веществ является то, что они не безвредны, а также их повышенная лет) честь, особенно [c.323]
Для сульфатировання целлюлозы в мягких условиях (например, при 5° С в хлористом метилене [208] или при —10° С в жидком SOo [141]) была предложена сама серная кислота, но обычно бывает необходимо перевести ее в менее реакционноспособную форму. Один из таких способов состоит в применении h3SO4— . -дихлор-диэтилового эфира в среде 1,2-дихлорэтана как растворителя при температуре ниже 0° С [38]. Способ, наиболее приемлемый для промышленного воплош ения, заключается в действии па целлюлозу серной кислоты в присутствии алифатического спирта с тремя илп более атомами углерода в молекуле [136, 207, 244, 276, 410] (например, пропилового, к-бутилового, амилового) при температуре О—20° С возможно проведение процесса в ирисутствии вспомогательного растворителя, такого, как жидкий SOg, при температуре кипения SO 2 (—10° С) [245]. Серная кислота частично переходит в алкилсерную кислоту, и реакция сульфатировання, возможно, представ.ияет собой обмен сульфатными группами между алкилсерной кислотой и целлюлозой [c.312]
Применяя поли-(оксибензил)-амины и поли-(оксибензил)-ами-ды, синтезированные Пакеном , из этих новых исходных продуктов Пэйн и Смит — получили глицидный эфир. Вводя в реакцию с эппхлоргидрином смеси из замещенных или незамещенных фенолов с аминами или полиаминами, а также с амидами или полиамидами кислот, различными производными мочевины, гуанидином, уретанами и циклическими иминосоединениями, можно получать глицидные эфиры с разнообразными свойствами, необходимыми для технических целей. Определение эпоксидных групп ведут по методу, разработанному Гринли с раствором солянокислого пиридина в пиридине. При этом, однако, возникло предположение, что у высокомолекулярных полиэпоксидных соединений многоатомных спиртов при температуре кипения пиридина хлористый водород может расходоваться не только на присоединение к эпоксидным группам, но и к другим группам с образованием ковалентно-связанного хлора, поэтому определение стали вести, нагревая пробу при 70—80° до тех пор, пока оттитровывание НС1 не давало постоянных результатов. По этому способу было получено соединение с более низким значением числа эпоксидных групп (стр. 922). Чтобы улучшить способ синтеза и сделать возможной лучшую промывку сырой смолы, в реакционную массу до или после реакции стали добавлять несмешивающийся с водой растворитель, в котором получающаяся смола легко растворялась. Для этого наиболее пригодными оказались хлористый метилен и хлороформ. Указанный прием имеет то преимущество, что часть продукта с высокой степенью полимеризации отделяется, так как она нерастворима в указанных растворителях (этот прием работы позднее был описан в патенте ). Среди 20 примеров, описывающих этот способ синтеза с использованием различных исходных веществ, приведены — следующие [c.497]
Извлечение гербицида из измельченного растительного материала лучше всего проводить экстракцией в аппарате Сокслета хлористым метиленом, который имеет низкую температуру кипения и достаточно удобен в обращении. В хлористом метилене хорошо растворимы все применяемые в настоящее время эфиры арилкарбаминовых кислот. Возможно проведение экстракции и без использования аппарата Сокслета. Ниже приводится описание способов определения ИФК и барбана. Таким способом могут быть определены и друпие вещества этого класса. [c.482]
Метиленхлорид (хлористый метилен) СН2С12 — бесцветная жидкость, температура кипения 40° С, плотность 1,33 г/см . Хорошо растворяется в органических растворителях и плохо в воде. Используется- как растворитель для дифенилолпропана. [c.267]
Хлористый метилен ОН2С12 До температуры кипения применима сталь У2А. Хлористый этилен СгН С [c.62]
Так как иодистый метилен при отнятии от него иода производит этилен, то можно было предполагать, что эквивалентная смесь иодистого метилена с галоидным соединением этилена, например G2h5J2 = GH,J— HoJ, даст при подобных условиях пропилен строения Gh4 — GHg—Gh3 = = (0Н2)з . Я пробовал употреблять бромистый, иодистый и хлористый этилен, разлагая смесь этих галоидных соединений и иодистого метилена или медью в присутствии воды, или натрием, амальгамой натрия, зерненым цинком, или, наконец, цинковой пылью, сухой или с водою. Во всех случаях получался только один этилен пропилена не образовалось. Опыт с хлористым этиленом, иодистым метиленом и сухой цинковой пылью веден был таким образом, что вещества нагревались в колбе, снабженной обратно поставленным холодильником, и отделявшийся газ, промытый сначала спиртом, потом водой, собирался в газометре. При этих условиях, сначала, при температуре кипения хлорюра, действие происходит медленно, но потом нижний слой цинковой пыли высыхает, и тогда реакция ускоряется. Она имеет место, вероятно, в том слое массы, где жидкость встречается с цинком, нагретым выше точки ее кипения. Газа получается довольно много, и значительная его часть поглощается бромом, причем образуется масло, которое по точке кипения и другим свойствам легко было признать за бромистый этилен. [c.256]
К стр. 51). Современные данные о зависимости температуры кипения дихлор-производных углеводородов алифатического ряда от строения приводят к выводу, что расположение атомов галоида сильно влияет на температуру кипения. Так, 1,2-дихлорэтан кипит при 84° 1,1-д1хлорэтан — при 58° 1,3-дихлорпропан кипит при 120° 1,2-дихлорпропан — при 97° 2,2-дихлорпропан — при 69,7°. Таким образом, сближение атомов хлора в молекуле вызывает понижение температуры кипения самой низкой температурой кипе шя обладают изомеры, у которых оба атома хлора стоят у одного атома углерода. Естественно, что хлористый метилен должен иметь низкую температуру кипения, во всяком случае, более низкую, чем 1,1-дихлорэтан (хлористый этилиден). [c.556]
chem21.info
