Кислород не оказывает вредного влияния на окружающую среду. Он также является нетоксичным, невзрывоопасным и негорючим, но поддерживающим горение газом. На первый взгляд он кажется полностью безопасным, но необходимо помнить, что O2 — сильный окислитель, который увеличивает способность материалов к горению и его активность возрастает с ростом давления и температуры.
В чистом кислороде горение происходит гораздо интенсивнее, чем в воздухе, и чем выше давление, тем быстрее горение. Негорючие или трудно поддающиеся возгоранию, в обычных условиях, материалы моментально загораются в атмосфере чистого O2.
При контакте с маслами, жирами, горючими пластмассами, угольной пылью, ворсинками органических веществ и т.п. чистый кислород способен окислять их с большими скоростями, в результате чего они самовоспламеняются или взрываются. И в дальнейшем может послужить причиной пожара.
Источником воспламенения может служить теплота, выделяющаяся при быстром сжатии кислорода (поскольку реакция носит экзотермический характер и протекает с выделением большого количества теплоты), трение или удар твердых частиц о металл, а также электростатический искровой разряд в струе O2 и другие явлениями. Имели место случаи взрыва наполненного баллона в результате резкого удара о металлические предметы при низкой температуре.
По этой причине цилиндры кислородного компрессора смазывают дистиллированной водой, в которую добавляют 10% глицерина. Кроме того, поршневые кольца компрессоров для накачивания изготавливают из графита или другого антифрикционного материала работающего без смазки и не загрязняющего кислород органическими примесями.
Горючие газы и пары образуют с кислородом смеси, обладающие весьма широкими пределами взрываемости при воспламенении. Взрывная волна распространяется в таких смесях с очень большой скоростью (3000 м/с и выше), когда взрыв сопровождается детонацией.
Различные пористые органические вещества, такие, как угольная мелочь и пыль, сажа, торф, шерсть, ткани из хлопка и шерсти и т. п. будучи пропитаны жидким кислородом, образуют так называемые оксиликвиты, при воспламенении которых вследствие детонации происходит сильный взрыв.
В кислороде могут загораться и углеродистые стали при достаточном количестве тепла в месте соприкосновения и незначительной массе металла (например, при трении тонких пластин о массивные детали машин, наличии частиц окалины, стружки или железного порошка).
Для предотвращения возможности возникновения пожара необходимо строго следить, чтобы объемная доля O2 в рабочих помещениях не превышала 23%.
Несмотря на то, что человеку жизненно необходим кислород, но при его длительном вдыхании происходит поражение органов дыхания и легких с возможным последующим летальным исходом.
Жидкий кислород имеет низкую температуру, поэтому при попадании на кожу или в глаза он вызываем моментальное обморожение.
Опасен ли кислород в баллоне?
Если в кислороде присутствует избыток влаги, внутренняя стенка баллона начинает подвергаться коррозии. В результате образуются рыхлые массы гидратов оксида железа (Fe(OH), Fe(OH)2, Fe(OH)3) в которые свободно проникает кислород, что содействует распространению коррозии вглубь стенки.
Если баллоны наполнены сухим газом, то происходит очень медленное окисление железа в тонком поверхностном слое. В результате образующиеся окислы покрывают стенку сплошной пленкой препятствующей дальнейшему процессу окисления.
Практика показывает, что при отсутствии влаги в баллоне даже после 20 лет эксплуатации не наблюдается заметной коррозии металла на внутренней стенке.
В процессе газовой сварки или газовой резки в конце опорожнения баллона из-за низкого давления O2 возможно перетекание горючего газа (ацетилена, пропана, метана) находящегося в баллоне под более высоким давлением, что приводит к образованию взрывоопасной смеси взрывающейся при обратном ударе. Поэтому при заправке баллоны очень тщательно проверяют на наличие в них посторонних газов.
Симптомы у человека при недостатке кислорода в воздухе
Нормальное содержание O2 в воздухе находится в пределах 21%. При понижении его количества в результате сгорания или вымещения инертными газами (аргон, гелий) возникает недостаток кислорода, последствия, и симптомы которого указаны в таблице ниже.
| Содержание O2 (% по объему) | Последствия и симптомы (при атмосферном давлении) |
|---|---|
| 15-19% | Снижение работоспособности. Может произойти нарушение координации. Первые симптомы могут проявиться у людей с нарушением коронарного кровообращения, общего кровообращения или работы легких |
| 12-14% | Затруднение дыхания, учащение пульса, нарушение координации и восприятия. |
| 10-12% | Еще более глубокое и учащенное дыхание, потеря здравомыслия, посинение губ. При нахождении в атмосфере, содержащем 12% и менее O2, потеря сознания происходит внезапно и так быстро, что у человека не остается времени на то, чтобы предпринять какие-то меры. |
| 8-10% | Нарушение мыслительной деятельности, обморок, потеря сознания, мертвенно-бледное лицо, синие губы, рвота. |
| 6-8% | 8 мин — 100% летальный исход; 6 мин — 50%; 4-5 мин — возможно спасение жизни с медицинской помощью. |
| 4-6%. | Через 40 секунд — кома, конвульсии, прекращение дыхания, смерть от нехватки кислорода. |
При наличии вышеуказанных симптомов пострадавшего следует быстро вынести на свежий воздух и дать ему подышать кислородом или сделать искусственное дыхание. Необходима немедленная медицинская помощь.
Ингаляция насыщенного кислородом воздуха должна проводиться под наблюдением врача.
Правила безопасности при использовании, хранении и транспортировке кислорода
- Необходимо внимательно следить за тем, чтобы кислород не находился в контакте с горючими легковоспламеняющимися веществами.
- Следить за тем, чтобы не было утечки, поскольку даже при незначительном увеличении количества кислорода в воздухе может произойти самовозгорание горючих материалов или волос на теле, одежде и т.п.
- Все лица, в том числе и сварщики, работающие с кислородом никогда не должны надевать рабочую одежду, на которых присутствуют следы смазки или масла.
- Запрещено применение O2 вместо воздуха для запуска дизельного двигателя.
- Запрещено его использование с целью удаления пыли с рабочей одежды. При случайном попадание избыточного объема кислорода на одежду потребуется много времени для выветривания, вплоть до нескольких часов.
- Запрещено применение для освежения воздуха.
- Вся кислородная аппаратура, кислородопроводы и баллоны необходимо тщательно обезжиривать. В процессе эксплуатации исключить возможность попадания и накопления масел и жиров на поверхности деталей, работающих в контакте с O2.
- Оборудование, работающее в непосредственном контакте с кислородом не должно содержать пыль и металлические частицы во избежание самовозгорания.
- Перед проведением ремонтных работ или освидетельствованием трубопроводов, баллонов, стационарных и передвижных реципиентов или другого оборудования, используемого для хранения и транспортирования газа, необходимо продуть все внутренние объемы воздухом. Разрешается начинать работы только после снижения объемной доли O2 во внутренних объемах оборудования до 23%.
- Запрещается баллоны, автореципиенты и трубопроводы, предназначенные для транспортирования кислорода, использовать для хранения и транспортирования других газов, а также производить какие-либо операции, которые могут загрязнить их внутреннюю поверхность.
- При погрузке, разгрузке, транспортировании и хранении баллонов должны применяться меры, предотвращающие их падение, удары друг о друга, повреждение и загрязнение баллонов маслом. Баллоны должны быть защищены от атмосферных осадков и нагрева солнечными лучами и другими источниками теплоты.
- На всех кислородных вентилях должна находится табличка «кислород маслоопасно».
Все вышеуказанные свойства и особенности кислорода нужно принимать во внимание при его использовании, хранении и транспортировке.
В уроке 18 «Физические и химические свойства кислорода» из курса «Химия для чайников» выясним, какие физические и химические свойства имеет кислород и узнаем о реакциях горения.


Как у любого химического вещества, у кислорода есть свой набор физических и химических свойств, по которым его можно отличить от других веществ.
Физические свойства
По своим физическим свойствам простое вещество кислород относится к неметаллам. При нормальных условиях он находится в газообразном агрегатном состоянии. Кислород не имеет цвета, запаха и вкуса. Масса кислорода объемом 1 дм3 при н. у. равна примерно 1,43 г.
При температуре ниже −183 °С кислород превращается в голубую жидкость, а при −219 °С эта жидкость переходит в твердое вещество. Это означает, что температура кипения кислорода равна: t кип.= −183 °С, а температура плавления составляет: t пл.= −219 °С. Кислород плохо растворяется в воде.
Химические свойства
Кислород является химически активным веществом. Он способен вступать в реакции с множеством других веществ, однако для протекания большинства этих реакций необходима более высокая, чем комнатная, температура. При нагревании кислород реагирует с неметаллами и металлами.
Если стеклянную колбу наполнить кислородом и внести в нее ложечку с горящей серой, то сера вспыхивает с образованием яркого пламени и быстро сгорает (рис. 80).


Химическую реакцию, протекающую в этом случае, можно описать следующим уравнением:
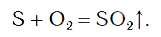
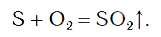
В результате реакции образуется вещество SO2, которое называется сернистым газом. Сернистый газ имеет резкий запах, который вы ощущаете при зажигании обычной спички. Это говорит о том, что в состав головки спички входит сера, при горении которой и образуется сернистый газ.
Подожженный красный фосфор в колбе с кислородом вспыхивает еще ярче и быстро сгорает, образуя густой белый дым (рис. 81).


При этом протекает химическая реакция:
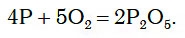
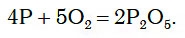
Белый дым состоит из маленьких твердых частиц продукта реакции — P2O5.
Если в колбу с кислородом внести тлеющий уголек, состоящий в основном из углерода, то он также вспыхивает и сгорает ярким пламенем (рис. 82).


Протекающую химическую реакцию можно представить следующим уравнением:


Продуктом реакции является CO2, или углекислый газ, с которым вы уже знакомы. Доказать образование углекислого газа можно, добавив в колбу немного известковой воды. Помутнение свидетельствует о присутствии CO2 в колбе.
Возгорание уголька можно использовать для отличия кислорода от других газов. Если в сосуд (колбу, пробирку) с газом внести тлеющий уголек и он вспыхнет, то это указывает на наличие в сосуде кислорода.
Кроме неметаллов, с кислородом реагируют и многие металлы. Внесем в колбу с кислородом раскаленную стальную проволоку, состоящую в основном из железа. Проволока начинает ярко светиться и разбрасывать в разные стороны раскаленные искры, как при горении бенгальского огня (рис. 83).


При этом протекает следующая химическая реакция:
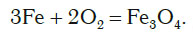
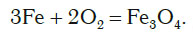
В результате реакции образуется вещество Fe3O4 (железная окалина). В состав формульной единицы этого вещества входят три атома железа, причем один из них имеет валентность II, а два других атома имеют валентность III. Поэтому формулу этого вещества можно представить в виде FeO * Fe2O3.
На заметку: Реакцию железа с кислородом используют для резки стальных изделий. Для этого определенный участок детали сначала нагревают с помощью кислородногазовой горелки. Затем направляют на нагретое место струю чистого кислорода, для чего перекрывают кран поступления горючего газа в горелку. Нагретое до высокой температуры железо вступает в химическую реакцию с кислородом и превращается в окалину. Так можно разрезать очень толстые железные детали.
Реакции горения
Общим для рассмотренных нами реакций является то, что при их протекании выделяется много света и теплоты. Очень многие вещества именно так взаимодействуют между собой.
Рассмотренные выше реакции простых веществ серы, фосфора, углерода и железа с кислородом являются реакциями горения.
Реакциями горения называются химические реакции, протекающие с выделением большого количества теплоты и света.
Кроме простых веществ, в кислороде горят и многие сложные вещества, например метан CH4. При горении метана образуются углекислый газ и вода:
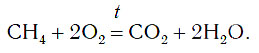
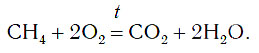
В результате этой реакции выделяется очень много теплоты. Вот почему ко многим домам подведен природный газ, основным компонентом которого является метан. Теплота, выделяющаяся при горении метана, используется для приготовления пищи и других целей.
На заметку: Некоторые химические реакции протекают очень быстро. Такие реакции называют взрывными или просто взрывами. Например, взаимодействие кислорода с водородом может протекать в форме взрыва.
Горение может протекать не только в кислороде, но и в других газах. Об этих процессах вы узнаете при дальнейшем изучении химии.
Горение веществ на воздухе и в кислороде
Вы уже знаете, что в состав окружающего нас воздуха входит кислород. Поэтому многие вещества горят не только в чистом кислороде, но и на воздухе.
Горение на воздухе протекает чаще всего гораздо медленнее, чем в чистом кислороде. Происходит это потому, что в воздухе лишь одна пятая часть по объему приходится на кислород. Если уменьшить доступ воздуха к горящему предмету (а следовательно, уменьшить доступ кислорода), горение замедляется или прекращается. Отсюда понятно, почему для тушения загоревшегося предмета на него следует набросить, например, одеяло или плотную тряпку.
На заметку: При пожарах для тушения горящих предметов часто используют пену (рис. 84). Она обволакивает горящий предмет и прекращает доступ к нему кислорода. Горение сначала замедляется, а затем прекращается совсем.
Некоторые вещества, быстро сгорающие в кислороде, на воздухе не горят вообще. Так, если нагреть железную проволоку на воздухе даже до белого каления, она все равно не станет гореть, тогда как в чистом кислороде быстро сгорает с образованием раскаленных искр.
Краткие выводы урока:
- При обычных условиях кислород — газ, не имеющий цвета, запаха и вкуса, плохо растворимый в воде.
- Кислород обладает высокой химической активностью. Он вступает в химические реакции со многими простыми и сложными веществами.
- Химические реакции, протекающие с выделением большого количества теплоты и света, называют реакциями горения.
- В чистом кислороде вещества горят намного быстрее, чем на воздухе.
Надеюсь урок 18 «Физические и химические свойства кислорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
FAS — Глава 8. Характеристики горения газов
Глава 8. Характеристики горения газов
8.1. РЕАКЦИИ ГОРЕНИЯ
Г о р е н и е — быстропротекающая химическая реакция соединения горючих компонентов с кислородом, сопровождающаяся интенсивным выделением теплоты и резким повышением температуры продуктов сгорания. Реакции горения описываются т.н. стехиометрическими уравнениями, характеризующими качественно и количественно вступающие в реакцию и образующиеся в результате ее вещества (Стехиометрический состав горючей смеси (от греч. stoicheion — основа, элемент и греч. metreo — измеряю) — состав смеси, в которой окислителя ровно столько, сколько необходимо для полного окисления топлива). Общее уравнение реакции горения любого углеводорода
CmHn + (m + n/4) O2 = mCO2 + (n/2) Н2O + Q(8.1)
где m, n — число атомов углерода и водорода в молекуле; Q — тепловой эффект реакции, или теплота сгорания.
Реакции горения некоторых газов приведены в табл. 8.1. Эти уравнения являются балансовыми, и по ним нельзя судить ни о скорости реакций, ни о механизме химических превращений.
Таблица 8.1. Реакции горения и теплота сгорания сухих газов (при 0°С и 101,3 кПа)
| Газ | Реакция горения | Теплота сгорания | |||||
|---|---|---|---|---|---|---|---|
| Молярная, кДж/кмоль | Массовая, кДж/кг | Объемная, кДж/м3 | |||||
| высшая | низшая | высшая | низшая | высшая | низшая | ||
| Водород | H2 |
286,06 | 242,90 | 141 900 | 120 080 | 12 750 | 10 790 |
| Оксид углерода | CO + 0,5O2 = CO2 | 283,17 | 283,17 | 10 090 | 10 090 | 12 640 | 12 640 |
| Метан | CH4 + 2O2 = CO2 + 2H2O | 880,90 | 800,90 | 55 546 | 49 933 | 39 820 | 35 880 |
| Этан | C2H6 + 0,5O2 = 2CO2 + 3H2O | 1560,90 | 1425,70 | 52 019 | 47 415 | 70 310 | 64 360 |
| Пропан | C3H8 + 5H2O = 3CO2 +4H2O | 2221,40 | 2041,40 | 50 385 | 46 302 | 101 210 | 93 180 |
| н-бутан | C4H10 + 6,5O2 = 4CO2 + 5H2O | 2880,40 | 2655,00 | 51 344 | 47 327 | 133 800 | 123 570 |
| Изобутан | C4H10 + 6,5O2 = 4CO2 + 5H2O | 2873,50 | 2648,30 | 51 222 | 47 208 | 132 960 | 122 780 |
| н-Пентан | C5H12 + 😯2 = 5CO2 + 6H2O | 3539,10 | 3274,40 | 49 052 | 45 383 | 169 270 | 156 630 |
| Этилен | C2H4 + 3O2 = 2CO2 + 2H2O | 1412,00 | 1333,50 | 50 341 | 47 540 | 63 039 | 59 532 |
| Пропилен | C3H6 + 4,5O2 = 3CO2 + 3H2O | 2059,50 | 1937,40 | 48 944 | 46 042 | 91 945 | 88 493 |
| Бутилен | C4H8 + 6O2 = 4CO2 + 4H2O | 2720,00 | 2549,70 | 48 487 | 45 450 | 121 434 | 113 830 |
Т е п л о в о й э ф ф е к т (теплота сгорания) Q — количество теплоты, выделяющееся при полном сгорании 1 кмоля, 1 кг или 1 м3 газа при нормальных физических условиях. Различают высшую Qв и низшую Qн теплоту сгорания: высшая теплота сгорания включает в себя теплоту конденсации водяных паров в процессе горения (в реальности при сжигании газа водяные пары не конденсируются, а удаляются вместе с другими продуктами сгорания). Обычно технические расчеты обычно ведут по низшей теплоте сгорания, без учета теплоты конденсации водяных паров (≈2400 кДж/кг).
КПД, рассчитанный по низшей теплоте сгорания, формально выше, но теплота конденсации водяных паров достаточно велика, и ее использование более чем целесообразно. Подтверждение этому — активное применение в отопительной технике контактных теплообменников, весьма разнообразных по конструкции.
Для смеси горючих газов высшая (и низшая) теплота сгорания газов определяется по соотношению
Q = r1Q1 + r2Q2 + … + rnQn(8.2)
где r1, r2, …, rn — объемные (молярные, массовые) доли компонентов, входящих в смесь; Q1, Q2, …, Qn — теплота сгорания компонентов.
Воспользовавшись табл. 8.1, высшую и низшую теплоту сгорания, кДж/м3, сложного газа можно определять по следующим формулам:
Qв = 127,5 Н2 + 126,4 СО + 398 СН4 + 703 С2Н6 + 1012 С8Н8 + 1338 C4H10 + 1329 C4H10 +
+ 1693 С5Н12 + 630 С2Н4 + 919 С3Н6 +1214 C4H8(8.3)
Qн = 107,9 H2 + 126,4 CO + 358,8 CH4 + 643 C2H6 + 931,8 C8H8 + 1235 C4H10 + 1227 C4H10 +
+ 1566 C5H12 + 595 C2H4 + 884 C8H6 + 1138 C4H8(8.4)
где H2, CO, CH4 и т.д. — содержание отдельных составляющих в газовом топливе, об. %.
Процесс горения протекает гораздо сложнее, чем по формуле (8.1), так как наряду с разветвлением цепей происходит их обрыв за счет образования промежуточных стабильных соединений, которые при высокой температуре претерпевают дальнейшие преобразования. При достаточной концентрации кислорода образуются конечные продукты: водяной пар Н2О и двуокись углерода СО2. При недостатке окислителя, а также при охлаждении зоны реакции, промежуточные соединения могут стабилизироваться и попадать в окружающую среду.
Интенсивность тепловыделения и рост температуры приводят к увеличению в реагирующей системе активных частиц. Такая взаимосвязь цепного реагирования и температуры, свойственная практически всем процессам горения, привела к введению понятия цепочечно-теплового взрыва — сами химические реакции горения имеют цепной характер, а их ускорение происходит за счет выделения теплоты и роста температуры в реагирующей системе.
Скорость химической реакции в однородной смеси пропорциональна произведению концентраций реагирующих веществ:
w = kС1С2(8.5)
где С1 и С2 — концентрации реагирующих компонентов, кмоль/м3; k — константа скорости реакции, зависящая от природы реагирующих веществ и температуры.
При сжигании газа концентрации реагирующих веществ можно условно считать неизменными, так как в зоне горения происходит непрерывный приток свежих компонентов однозначного состава.
Константа скорости реакции (по уравнению Аррениуса):
К = К0е-Е/RT(8.6)
где К0 — предэкспоненциальный множитель, принимаемый для биометрически
Химические свойства кислорода
Кислород вступает в соединения почти со всеми элементами периодической системы Менделеева.
Реакция соединения любого вещества с кислородом называется окислением.
Большинство таких реакций идет с выделением тепла. Если при реакции окисления одновременно с теплом выделяется свет, ее называют горением. Однако не всегда удается заметить выделяющиеся тепло и свет, так как в некоторых случаях окисление идет чрезвычайно медленно. Заметить тепловыделение удается тогда, когда реакция окисления происходит быстро.
В результате любого окисления — быстрого или медленного — в большинстве случаев образуются окислы: соединения металлов, углерода, серы, фосфора и других элементов с кислородом.
Вам, вероятно, не раз приходилось видеть, как перекрывают железные крыши. Перед тем как покрыть их новым железом, старое сбрасывают вниз. На землю вместе с железом падает бурая чешуя — ржавчина. Это гидрат окиси железа, который медленно, в течение нескольких лет, образовывался на железе под действием кислорода, влаги и углекислого газа.
Ржавчину можно рассматривать как соединение окиси железа с молекулой воды. Она имеет рыхлую структуру и не предохраняет железо от разрушения.
Для предохранения железа от разрушения — коррозии — его обычно покрывают краской или другими коррозионно устойчивыми материалами: цинком, хромом, никелем и другими металлами. Предохранительные свойства этих металлов, как и алюминия, основаны на том, что они покрываются тонкой устойчивой пленкой своих окислов, предохраняющих покрытие от дальнейшего разрушения.
Предохранительные покрытия значительно замедляют процесс окисления металла.
В природе постоянно происходят процессы медленного окисления, сходные с горением.
При гниении дерева, соломы, листьев и других органических веществ происходят процессы окисления углерода, входящего в состав этих веществ. Тепло при этом выделяется чрезвычайно медленно, и поэтому обычно оно остается незамеченным.
Но иногда такого рода окислительные процессы сами по себе ускоряются и переходят в горение.
Самовозгорание можно наблюдать в стоге мокрого сена.
Быстрое окисление с выделением большого количества тепла и света можно наблюдать не только при горении дерева, керосина, свечи, масла и других горючих материалов, содержащих углерод, но и при горении железа.
Налейте в банку немного воды и наполните ее кислородом. Затем внесите в банку железную спираль, на конце которой укреплена тлеющая лучинка. Лучинка, а за ней и спираль загорятся ярким пламенем, разбрасывая во все стороны звездообразные искры.
Это идет процесс быстрого окисления железа кислородом. Он начался при высокой температуре, которую дала горящая лучинка, и продолжается до полного сгорания спирали за счет тепла, выделяющегося при горении железа.
Тепла этого так много, что образующиеся при горении частицы окисленног
|
|||||||||
описание и условия реакции, применение в технике
Одной из актуальных проблем является загрязнение окружающей среды и ограниченность энергетических ресурсов органического происхождения. Многообещающим способом решения этих проблем является использование водорода в качестве источника энергии. В статье рассмотрим вопрос горения водорода, температуру и химию этого процесса.
Что такое водород?

Прежде чем рассматривать вопрос, какая температура сгорания водорода, необходимо вспомнить, что собой представляет это вещество.
Водород — это самый легкий химический элемент, состоящий всего из одного протона и одного электрона. При нормальных условиях (давление 1 атм., температура 0 oC) он присутствует в газообразном состоянии. Его молекула (H2) образована 2 атомами этого химического элемента. Водород является 3-м по распространенности элементом на нашей планете, и 1-м во Вселенной (около 90 % всей материи).
Водородный газ (H2) не имеет запаха, вкуса и цвета. Он не токсичен, однако, когда содержание его в атмосферном воздухе составляет несколько процентов, то человек может испытывать удушье, по причине недостатка кислорода.
Любопытно отметить, что хотя с химической точки зрения все молекула H2 идентичны, физические свойства их несколько отличаются. Дело все в ориентации спинов электронов (они ответственны за появление магнитного момента), которые могут быть параллельными и антипараллельными, такую молекулу называют орто- и параводородом, соответственно.
Химическая реакция горения

Рассматривая вопрос, температуры горения водорода с кислородом, приведем химическую реакцию, которая описывает этот процесс: 2H2 + O2 => 2H2O. То есть в реакции участвуют 3 молекулы (две водорода и одна кислорода), а продуктом являются две молекулы воды. Эта реакция описывает горение с химической точки зрения, и по ней можно судить, что после ее прохождения остается только чистая вода, которая не загрязняет окружающую среду, как это происходит при сгорании органического топлива (бензина, спирта).
С другой стороны, эта реакция является экзотермической, то есть помимо воды она выделяет некоторое количества тепла, которое можно использовать для приведения в движение машин и ракет, а также для его перевода в другие источники энергии, например, в электричество.
Механизм процесса горения водорода
Описанная в предыдущем пункте химическая реакция известна любому школьнику старших классов, однако она является очень грубым описанием того процесса, который происходит в действительности. Отметим, что до середины прошлого века человечество не знало, как происходит горение водорода в воздухе, а в 1956 году за ее изучение была присуждена Нобелевская премия по химии.
В действительности, если столкнуть молекулы O2 и H2, то никакой реакции не произойдет. Обе молекулы являются достаточно устойчивыми. Чтобы горение происходило, и образовывалась вода, необходимо существование свободных радикалов. В частности, атомов H, O и групп OH. Ниже приводится последовательность реакций, которые происходят в действительности при горении водорода:
- H + O2 => OH + O;
- OH + H2 => H2O + H;
- O + H2 = OH + H.
Что видно из этих реакций? При горении водорода образуется вода, да, верно, но происходит это только, когда группа из двух атомов OH встречается с молекулой H2. Кроме того, все реакции происходят с образованием свободных радикалов, это означает, что запускается процесс самоподдержания горения.
Таким образом, ключевой момент в запуске этой реакции заключается в образовании радикалов. Они появляются, если поднести к кислород-водородной смеси горящую спичку, либо если нагреть эту смесь выше определенной температуры.
Инициация реакции
Как было отмечено, сделать это можно двумя способами:
- С помощью искры, которая должна предоставить всего 0,02 мДж теплоты. Это очень маленькое значение энергии, для сравнения скажем, что аналогичное значение для бензиновой смеси составляет 0,24 мДж, а для метановой — 0,29 мДж. С уменьшением давления энергия инициации реакции растет. Так, при 2 кПа она составляет уже 0,56 мДж. В любом случае, это очень маленькие значения, поэтому водород-кислородная смесь считается легко воспламеняющейся.
- С помощью температуры. То есть кислород-водородную смесь можно просто нагревать, и выше некоторой температуры она сама воспламенится. Когда это произойдет, зависит от давления и процентного соотношения газов. В широком интервале концентраций при атмосферном давлении реакция самовозгорания происходит при температурах выше 773-850 К, то есть выше 500-577 oC. Это достаточно высокие значения по сравнению с бензиновой смесью, которая начинает самовоспламеняться уже при температурах ниже 300 oC.
Процентное содержание газов в горючей смеси

Говоря о температуре горения водорода в воздухе, следует отметить, что не всякая смесь этих газов будет вступать в рассматриваемый процесс. Экспериментально установлено, что если количество кислорода меньше 6% по объему, либо если количество водорода меньше 4% по объему, то никакой реакции не будет. Тем не менее, пределы существования горючей смеси являются достаточно широкими. Для воздуха процентное содержание водорода может составлять от 4,1 % до 74,8 %. Отметим, что верхнее значение как раз соответствует необходимому минимуму по кислороду.
Если же рассматривается чистая кислород-водородная смесь, то здесь пределы еще шире: 4,1-94 %.
Уменьшение давления газов приводит к сокращению указанных пределов (нижняя граница поднимается, верхняя — опускается).
Также важно понимать, что в процессе горения водорода в воздухе (кислороде), возникающие продукты реакции (вода) приводят к уменьшению концентрации реагентов, что может привести к прекращению химического процесса.
Безопасность горения

Это важная характеристика воспламеняющейся смеси, поскольку она позволяет судить о том, происходит реакция спокойно, и можно ее контролировать, либо процесс имеет взрывной характер. От чего зависит скорость горения? Конечно же, от концентрации реагентов, от давления, а также от количества энергии «затравки».
К большому сожалению, водород в широком интервале концентраций способен к взрывному горению. В литературе приводятся следующие цифры: 18,5-59 % водорода в воздушной смеси. Причем на краях этого предела в результате детонации выделяется наибольшее количество энергии на единицу объема.
Отмеченный характер горения представляет большую проблему для использования этой реакции в качестве контролируемого источника энергии.
Температура реакции горения
Теперь мы подошли непосредственно к ответу на вопрос, какая низшая температура сгорания водорода. Она составляет 2321 К или 2048 oC для смеси с 19,6 % H2. То есть температура горения водорода в воздухе выше 2000 oC (для других концентраций она может достигать 2500 oC), и в сравнении с бензиновой смесью — это огромная цифра (для бензина около 800 oC). Если сжигать водород в чистом кислороде, то температура пламени будет еще выше (до 2800 oC).
Столь высокая температура пламени представляет еще одну проблему в использовании этой реакции в качестве источника энергии, поскольку не существует в настоящее время сплавов, которые могли бы работать длительное время в таких экстремальных условиях.
Конечно, эта проблема решается, если использовать хорошо продуманную систему охлаждения камеры, где происходит горение водорода.
Количество выделяемой теплоты
В рамках вопроса температуры горения водорода любопытно также привести данные о количестве энергии, которая выделяется во время этой реакции. Для разных условий и составов горючей смеси получили значения от 119 МДж/кг до 141 МДж/кг. Чтобы понять, насколько это много, отметим, что аналогичное значение для бензиновой смеси составляет около 40 МДж/кг.
Энергетический выход водородной смеси намного выше, чем для бензина, что является огромным плюсом для ее применения в качестве топлива для двигателей внутреннего сгорания. Однако, и здесь не все так просто. Все дело в плотности водорода, она слишком низка при атмосферном давлении. Так, 1 м3 этого газа весит всего 90 грамм. Если сжечь этот 1 м3 H2, то выделится около 10-11 МДж теплоты, что уже в 4 раза меньше, чем при сжигании 1 кг бензина (чуть больше 1 литра).
Приведенные цифры говорят о том, что для использования реакции горения водорода необходимо научиться хранить этот газ в баллонах с высоким давлением, что создает уже дополнительные сложности, как в технологическом вопросе, так и с точки зрения безопасности.
Применение водородной горючей смеси в технике: проблемы
Сразу необходимо сказать, что в настоящее время водородная горючая смесь уже используется в некоторых сферах человеческой деятельности. Например, в качестве дополнительного топлива для космических ракет, в качестве источников для выработки электрической энергии, а также в экспериментальных моделях современных автомобилей. Однако масштабы этого применения являются мизерными, по сравнению с таковыми для органического топлива и, как правило, носят экспериментальных характер. Причиной этому являются не только трудности в контроле самой реакции горения, но также в хранении, транспортировке и добыче H2.
Водород на Земле практически не существует в чистом виде, поэтому его необходимо получать из различных соединений. Например, из воды. Это достаточно популярный способ в настоящее время, который осуществляется с помощью пропускания электрического тока через H2O. Вся проблема заключается в том, что при этом расходуется больше энергии, чем потом можно получить путем сжигания H2.
Еще одна важная проблема — транспортировка и хранение водорода. Дело в том, что этот газ, ввиду маленьких размеров его молекул, способен «вылетать» из любых контейнеров. Кроме того, попадая в металлическую решетку сплавов, он вызывает их охрупчивание. Поэтому наиболее эффективным способом хранения H2 является использование атомов углерода, способных прочно связывать «неуловимый» газ.

Таким образом, применение водорода в качестве топлива в более-менее широких масштабах возможно, только если его использовать в качестве «сохранения» электричества (например, переводить ветровую и солнечную энергию в водород с помощью электролиза воды), либо если научиться доставлять H2 из космоса (где его очень много) на Землю.
Горение водорода — Карта знаний
- Водород считается одним из наиболее перспективных топлив как эффективный и экологически чистый энергоноситель. С практической точки зрения горение водорода связано с его использованием в энергетических установках и топливных элементах и безопасностью соответствующих технологических процессов и устройств. Удельная теплота сгорания водорода составляет примерно 140 МДж/кг (верхняя) или 120 МДж/кг (нижняя), что в несколько раз превышает удельную теплоту сгорания углеводородных топлив (для метана — около 50 МДж/кг).
Смеси водорода с кислородом или воздухом взрывоопасны и называются гремучим газом (название происходит от knallgas, нем. knall — громкий хлопок, резкий звук выстрела или взрыва). При зажигании искрой или другим источником смесь водорода с воздухом небольшого объёма сгорает чрезвычайно быстро, с громким хлопком, что субъективно воспринимается как взрыв. В физике горения такой процесс считается медленным горением, или дефлаграцией, однако гремучий газ способен и к детонации, при этом действие взрыва оказывается существенно более сильным.
Наиболее опасны околостехиометрические смеси, где на один моль кислорода приходится два моля водорода, то есть, с учётом того, что в воздухе соотношение кислорода и азота по объёму составляет примерно 1:3,76, объёмное соотношение водорода с воздухом в гремучем газе в стехиометрическом соотношении составляет 2:4,76 ≈ 0,4. Однако гремучий газ способен гореть в широком диапазоне концентраций водорода, от 4 — 9 объёмных процентов в бедных смесях до 75% в богатых смесях, приблизительно в этих же пределах он способен и детонировать.
Гремучий газ самовоспламеняется при атмосферном давлении и температуре 510 °C. При комнатной температуре в отсутствие источников зажигания (искра, открытое пламя) гремучий газ может храниться неограниченно долго, однако он способен взорваться от самого слабого источника, так как для инициирования взрыва достаточно искры с энергией 17 микроджоулей. С учётом того, что водород обладает способностью проникать через стенки сосудов, в которых он хранится, например, диффундировать сквозь металлические стенки газового баллона, и не обладает никаким запахом, при работе с ним следует быть чрезвычайно осторожным.
Источник: Википедия
Связанные понятия
Горе́ние — сложный физико-химический процесс превращения исходных веществ в продукты сгорания в ходе экзотермических реакций, сопровождающийся интенсивным выделением тепла. Химическая энергия, запасённая в компонентах исходной смеси, может выделяться также в виде теплового излучения и света. Светящаяся зона называется фронтом пламени или просто пламенем. «Пентабора́н» — также называемый «нонагидри́д пентабо́ра», «стабильный пентабора́н» и «Пентабора́н(9)» для того, чтобы отличать его от соединения бора B5h21 — химическое соединение, которое рассматривалось военными 1950-х годов в США и СССР, в качестве перспективного ракетного/самолетного топлива, называемого также «экзотическим горючим». Молекула состоит из пяти атомов бора и девяти атомов водорода (B5H9) и является одним из бороводородов. В обычных условиях имеет вид бесцветной жидкости с едким… Водоро́д (H, лат. hydrogenium) — химический элемент периодической системы с обозначением H и атомным номером 1. Обладая 1 а. е. м., водород является самым легким элементом в периодической таблице. Его одноатомная форма (H) — самое распространённое химическое вещество во Вселенной, составляющее примерно 75% всей барионной массы. Звезды, кроме компактных, в основном состоят из водородной плазмы. Самый распространенный изотоп водорода, называемый протием (название редко употребляется; обозначение… Благоро́дные га́зы (также ине́ртные или ре́дкие га́зы) — группа химических элементов со схожими свойствами: при нормальных условиях они представляют собой одноатомные газы без цвета, запаха и вкуса с очень низкой химической реактивностью. К благородным газам относятся гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радиоактивный радон (Rn). Формально к этой группе также причисляют недавно открытый оганесон (Og), однако его химические свойства почти не исследованы. Пла́мя — раскаленная газообразная среда, образующаяся при горении и электроразрядах, состоящая в значительной степени из частично ионизированных частиц, в которой происходят химические взаимодействия и физико-химические превращения составных частиц среды (в т.ч. горючего, окислителя, примесных частиц, продуктов их взаимодействия). Сопровождается интенсивным излучением (в УФ, ИК, видимой части спектра — «свечением») и выделением тепла.Упоминания в литературе
• при горении водорода на воздухе развиваются температуры, достаточные для окисления азота. Поэтому кроме воды среди продуктов горения есть некоторое количество оксидов азота NхОу;Связанные понятия (продолжение)
Кислоро́д (O, лат. oxygenium) — химический элемент 16-й группы, второго периода периодической системы, с атомным номером 8. Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Как простое вещество при нормальных условиях представляет собой газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы… Жи́дкий водоро́д (ЖВ, жh3, жh3, Lh3, Lh3) — жидкое агрегатное состояние водорода, с низкой плотностью − 0,07 г/см³, и криогенными свойствами с точкой замерзания 14,01 K (−259,14 °C) и точкой кипения 20,28 K (−252,87 °C). Является бесцветной жидкостью без запаха, которая при смешивании с воздухом относится к взрывоопасным веществам с диапазоном коэффициента воспламенения 4—75 %. Спиновое соотношение изомеров в жидком водороде составляет: 99,79 % — параводород; 0,21 % — ортоводород. Коэффициент расширения… Жи́дкий кислоро́д (ЖК, жO2, LOX) — жидкость бледно-синего цвета, которая относится к сильным парамагнетикам. Является одним из четырёх агрегатных состояний кислорода. Жидкий кислород обладает плотностью 1,141 г/см³ и имеет умеренно криогенные свойства с точкой замерзания 50,5 K (−222,65 °C) и точкой кипения 90,188 K (−182,96 °C). Азо́т (N, лат. nitrogenium) — химический элемент 15-й группы, второго периода периодической системы с атомным номером 7. Относится к пниктогенам. Как простое вещество представляет собой двухатомный газ без цвета, вкуса и запаха. Один из самых распространённых элементов на Земле. Химически весьма инертен, однако реагирует с комплексными соединениями переходных металлов. Основной компонент воздуха (78,09 % объёма), разделением которого получают промышленный азот (более ¾ идёт на синтез аммиака). Применяется… Твёрдое ракетное топливо — твёрдое вещество или смесь отдельных веществ, способная гореть без доступа воздуха, выделяя при этом большое количество газообразного рабочего тела, нагретого до высокой температуры. Используется в твердотопливных ракетных двигателях для создания реактивной тяги. К пе́рвому пери́оду периоди́ческой систе́мы относятся элементы верхней строки (или периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) химических свойств элементов при увеличении атомного числа: новая строка начинается тогда, когда увеличивается количество энергетических уровней, что означает попадание элементов с аналогичными свойствами в тот же вертикальный столбец. Первый период содержит меньше всего…Подробнее: Первый период периодической системы
Ге́лий (He, лат. helium) — второй химический элемент периодической системы. Относится к 18-й группе, первому периоду системы и возглавляет группу инертных газов. Как простое вещество представляет собой инертный одноатомный газ без цвета, вкуса и запаха. Ацетилендинитрил — иначе субнитрид углерода, дицианоацетилен C4N2, представляет собой бесцветное вещество способное легко растворяться в углеводородах. Тяжёлая вода́ — обычно этот термин применяется для обозначения тяжёловодородной воды, известной также как оксид дейтерия. Тяжёловодородная вода имеет ту же химическую формулу, что и обычная вода, но вместо двух атомов обычного лёгкого изотопа водорода (протия) содержит два атома тяжёлого изотопа водорода — дейтерия, а её кислород по изотопному составу соответствует кислороду воздуха. Формула тяжёловодородной воды обычно записывается как D2O или 2h3O. Внешне тяжёлая вода выглядит как обычная — бесцветная… Металли́ческий водоро́д — совокупность фазовых состояний водорода, находящегося при крайне высоком давлении и претерпевшего фазовый переход. Металлический водород представляет собой вырожденное состояние вещества и, по некоторым предположениям, может обладать некоторыми специфическими свойствами — высокотемпературной сверхпроводимостью и высокой удельной теплотой фазового перехода. Оксиликви́т — бризантное взрывчатое вещество, получаемое пропиткой жидким кислородом горючих пористых материалов (уголь, торф, мох, солома, древесина). Оксиликвит относят к взрывчатым веществам Шпренгеля. Взрывчатые свойства такой смеси были открыты в Германии в 1897 году профессором Карлом фон Линде, создателем установки по сжижению газов. К оксиликвитам могут быть отнесены и взрывчатые вещества на основе жидкого озона или его смеси с жидким кислородом, хотя практического применения такие смеси… Мети́л-трет-бути́ловый эфи́р (трет-бутилметиловый эфир, 2-метил-2-метоксипропан, МТБЭ) — химическое вещество с химической формулой СН3—O—C(СН3)3, один из важнейших представителей простых эфиров.Подробнее: Трет-Бутилметиловый эфир
Бо̀роводоро́ды (также бора́ны, гидри́ды бо́ра) — химические соединения бора с водородом. Отличаются высокой химической активностью и чрезвычайно большой теплотой сгорания. Представляют интерес как ракетное топливо. В органическом синтезе находит применение реакция присоединения борана и некоторых алкилборанов к двойной связи алкенов с вовлечением полученных соединений в дальнейшие превращения. Арго́н — элемент 18-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы VIII группы) третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 18. Обозначается символом Ar (лат. Argon). Третий по распространённости элемент в земной атмосфере (после азота и кислорода) — 0,93 % по объёму. Простое вещество аргон — инертный одноатомный газ без цвета, вкуса и запаха. Шарлье́р (фр. charlière) — аэростат, наполненный водородом, гелием или другими газами легче воздуха. Назван по имени французского учёного и изобретателя Жака Александра Сезара Шарля. Аэростат объёмом 25 м³ совершил свой первый полёт 27 августа 1783 года при стечении 300 тыс. зрителей на Марсовом поле в Париже. Первый полёт «шарльёра» с экипажем (Шарль, Жак Александр Сезар и М. Н. Робер) состоялся 1 декабря 1783 года в Париже. Французский профессор физики Жак Шарль считал, что дымный воздух — это… Экономика метанола — гипотетическая энергетическая экономика будущего, при которой ископаемое топливо будет заменено метанолом. Эта экономика является альтернативой существующих моделей водорода и этанола (Биотопливо). В 2005 году лауреат нобелевской премии Джордж Олах (George Andrew Olah) опубликовал свою книгу Oil and Gas: The Methanol Economy», в которой обсудил шансы и возможности экономики метанола. В книге он предоставляет аргументы против водородной модели и обозначает возможность синтеза… Наноалмаз, ультрадисперсный алмаз — углеродная наноструктура. Имеет кристаллическую решётку типа алмаза: планаксиальный класс кубической сингонии, две гранецентрированных решётки Браве, сдвинутые друг относительно друга на 1/4 главной диагонали. Характерный размер одного нанокристалла 1÷10 нанометров. Наноалмазы, или ультрадисперсные алмазы, можно рассматривать как специфический наноуглеродный материал, входящий в семейство наноуглеродных кластеров вместе с фуллеренами, нанотрубками, нанографитом… Пиро́лиз (от др.-греч. πῦρ «огонь, жар» + λύσις «разложение, распад») — термическое разложение органических и многих неорганических соединений. Метанатор — используемое в газовом хроматографе оборудование, позволяющее детектировать низкие концентрации диоксида и монооксида углерода. Метанатор состоит из пламенно-ионизационного детектора и установленного перед ним каталитического реактора, заполненного мелкодисперсным никелем, где осуществляется гидрирование оксидов углерода в метан. Метан затем детектируется на ПИД. Плуто́ний (обозначается символом Pu; атомное число 94) — тяжёлый хрупкий радиоактивный металл серебристо-белого цвета. В периодической таблице располагается в семействе актиноидов. Каталитическая горелка или беспламенная горелка — разновидность горелки, в которой химические реакции окисления горючего протекают в присутствии катализатора. Такие горелки обычно используются в качестве нагревательных и/или осветительных приборов, а также в химической промышленности. Пар-жидкость-кристалл или ПЖК (в английской литературе — vapor-liquid-solid — VLS)) — механизм роста одномерных структур, таких как нановискеры в процессе химического осаждения из газовой фазы. Рост кристалла вследствие осаждения из газовой фазы обычно протекает очень медленно. Однако возможно введение на поверхность капель катализатора, способного адсорбировать вещество из газа до состояния пересыщенного расплава, из которого и будет происходить его кристаллизация на подложку. Таким образом, физические… Газофазный ядерный реактивный двигатель (ГЯРД) — концептуальный тип реактивного двигателя, в котором реактивная сила создаётся за счёт выброса теплоносителя (рабочего тела) из ядерного реактора, топливо в котором находится в газообразной форме или в виде плазмы. Считается, что подобные двигатели смогут достичь удельной тяги порядка 3000-5000 секунд (до 30-50 кН·с/кг, эффективные скорости истечения реактивной струи — до 30-50 км/с) и тяги, достаточной для относительно быстрых межпланетных полётов… Моноокси́д углеро́да (уга́рный газ, о́кись углеро́да, оксид углерода(II)) — бесцветный чрезвычайно токсичный газ без вкуса и запаха, легче воздуха (при нормальных условиях). Химическая формула — CO. Работа в инертной атмосфере — общее название ряда приемов и методов, используемых в химических лабораториях для работы с веществами, чувствительными к действию воздуха. Работа в инертной атмосфере предотвращает деструкцию веществ компонентами воздуха, чаще всего водой и кислородом; реже — углекислым газом и азотом. Общими свойствами всех приёмов работы в инертной атмосфере являются удаление воздуха из реакционного пространства при помощи вакуума, а также использование инертных газов, таких как аргон… Промышленное производство водорода — неотъемлемая часть водородной энергетики, первое звено в жизненном цикле употребления водорода. Водород практически не встречается в природе в чистой форме и должен извлекаться из других соединений с помощью различных химических методов. Область воспламенения газа, пара или взвеси — интервал концентрации горючего вещества, равномерно распределённого в данной окислительной среде (обычно в воздухе), в пределах которого вещество способно воспламеняться от источника зажигания с последующим распространением самостоятельного горения по смеси. Сжиже́ние га́зов включает в себя несколько стадий, необходимых для перевода газа в жидкое состояние. Эти процессы используются для научных, промышленных и коммерческих целей. Углеро́д (C, лат. carboneum) — химический элемент, символизируемый буквой C и имеющий атомный номер 6. Элемент является четырехвалентным неметаллом, т. е. имеет четыре свободных электрона для формирования ковалентных химических связей. Он располагается в 14 группе периодической системы. Три изотопа данного элемента встречаются в окружающем нас мире. Изотопы 12C и 13C являются стабильными, в то время как 14C- радиоактивный (период полураспада данного изотопа составляет 5,730 лет). Углерод был известен… Гексанитробензол — бризантное взрывчатое вещество (из производимых BB конкурентом по силе является разве что CL-20). Бесцветное или желтовато-зеленое (в зависимости от степени очистки) кристаллическое вещество, почти нерастворимое в воде, растворимое в бензоле, толуоле. В кислородосодержащих растворителях, например ацетоне, спирте, эфире растворяется с разложением. Химически неустойчив. На воздухе в присутствии влаги или при действии водного раствора щёлочи превращается в тринитрофлорглюцин C6(OH)3(NO… Детона́ция (от фр. détoner — «взрываться» и лат. detonare — «греметь») — это режим горения, в котором по веществу распространяется ударная волна, инициирующая химические реакции горения, в свою очередь, поддерживающие движение ударной волны за счёт выделяющегося в экзотермических реакциях тепла. Комплекс, состоящий из ударной волны и зоны экзотермических химических реакций за ней, распространяется по веществу со сверхзвуковой скоростью и называется детонационной волной. Фронт детонационной волны… Процесс Клауса — процесс каталитической окислительной конверсии сероводорода. Источник сероводорода — природные и промышленные газы. Природными источниками являются месторождения нефти и газа, вулканическая деятельность, разложение биомассы и т.д. Промышленные источники — переработка нефти и газа (процессы гидроочистки и гидрокрекинга), металлургия и т.д. Озонатор — устройство для получения озона (O3). Озон является аллотропной модификацией кислорода, содержащей в молекуле три атома кислорода. В большинстве случаев исходным веществом для синтеза озона выступает молекулярный кислород (O2), а сам процесс описывается уравнением 3O2 → 2O3. Эта реакция является эндотермичной и легко обратимой. Поэтому на практике применяются меры, способствующие максимальному смещению её равновесия в сторону целевого продукта. Щелочной топливный элемент — (англ. alkaline fuel cell, AFC), наиболее изученная технология топливных элементов, эти элементы летали с человеком на Луну. Сверхкрити́ческий флюи́д (СКФ), сверхкрити́ческая жи́дкость — состояние вещества, при котором исчезает различие между жидкой и газовой фазой. Любое вещество, находящееся при температуре и давлении выше критической точки, является сверхкритической жидкостью. Свойства вещества в сверхкритическом состоянии промежуточные между его свойствами в газовой и жидкой фазе. Так, СКФ обладает высокой плотностью, близкой к жидкости, низкой вязкостью и при отсутствии межфазных границ поверхностное натяжение также… Холодильный агент (хладагент) — рабочее вещество (может являться жидкостью, газом и даже быть в твердом агрегатном состоянии) холодильной машины, которое при кипении (испарении, плавлении или даже сублимации) отнимает теплоту от охлаждаемого объекта и затем после сжатия передаёт её охлаждающей среде за счёт конденсации или иному фазовому переходу (воде, воздуху и т. п.). Реа́ктор на расплавах солей (жидкосолевой реактор, ЖСР, MSR) — является одним из видов ядерных реакторов деления, в которых основой охлаждающей жидкости является смесь расплавленных солей, которая может работать при высоких температурах (термодинамическая эффективность реактора прямо пропорциональна рабочей температуре), оставаясь при этом при низком давлении. Это уменьшает механические напряжения и повышает безопасность и долговечность. Риформинг — это промышленный процесс переработки бензиновых и лигроиновых фракций нефти с целью получения высококачественных бензинов и ароматических углеводородов. Крипто́н — химический элемент с атомным номером 36. Принадлежит к 18-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VIII группы, или к группе VIIIA), находится в четвёртом периоде таблицы. Атомная масса элемента 83,798(2) а. е. м.. Обозначается символом Kr (от лат. Krypton). Простое вещество криптон — инертный одноатомный газ без цвета, вкуса и запаха. Искусственные источники света — технические устройства различной конструкции и с различными способами преобразования энергии, основным назначением которых является получение светового излучения (как видимого, так и с различной длиной волны, например, инфракрасного). В источниках света используется в основном электроэнергия, но также иногда применяется химическая энергия и другие способы генерации света (например, триболюминесценция, радиолюминесценция и др.). Ударно-волновой синтез или детонационный синтез (англ. shock wave synthesis) — метод механического ударно-волнового воздействия, представляющий собой быстро протекающий процесс, который создает динамические условия для синтеза конечного продукта и его диспергирования до порошка с нанометровым размером частиц. Дейте́рий (лат. deuterium, от греч. δεύτερος «второй»), тяжёлый водород, обозначается символами D и 2H — стабильный изотоп водорода с атомной массой, равной 2. Ядро (дейтрон) состоит из одного протона и одного нейтрона. Вода́ (оксид водорода) — бинарное неорганическое соединение с химической формулой h3O: молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов…% PDF-1.6 % 96 0 объектов > endobj Xref 96 77 0000000016 00000 n 0000002498 00000 n 0000002712 00000 n 0000002845 00000 n 0000002970 00000 n 0000003465 00000 n 0000003579 00000 n 0000003691 00000 n 0000004083 00000 n 0000004355 00000 n 0000004994 00000 n 0000005021 00000 n 0000005369 00000 n 0000005651 00000 n 0000006074 00000 n 0000006343 00000 n 0000006773 00000 n 0000006800 00000 n 0000007217 00000 n 0000007619 00000 n 0000007764 00000 n 0000008069 00000 n 0000008211 00000 n 0000009073 00000 n 0000009772 00000 n 0000010274 00000 n 0000010745 00000 n 0000011024 00000 n 0000011736 00000 n 0000011879 00000 n 0000011906 00000 n 0000012389 00000 n 0000012968 00000 n 0000013797 00000 n 0000014535 00000 n 0000014680 00000 n 0000014824 00000 n 0000014966 00000 n 0000014993 00000 n 0000015412 00000 n 0000016231 00000 n 0000016935 00000 n 0000018880 00000 n 0000019151 00000 n 0000019221 00000 n 0000020748 00000 n 0000021044 00000 n 0000021580 00000 n 0000021650 00000 n 0000021918 00000 n 0000071173 00000 n 0000072341 00000 n 0000073531 00000 n 0000101711 00000 n 0000133151 00000 n 0000133505 00000 n 0000133575 00000 n 0000133844 00000 n 0000137624 00000 n 0000140357 00000 n 0000140641 00000 n 0000140711 00000 n 0000140981 00000 n 0000142609 00000 n 0000142882 00000 n 0000142953 00000 n 0000143218 00000 n 0000143245 00000 n 0000143640 00000 n 0000145652 00000 n 0000145923 00000 n 0000145993 00000 n 0000146263 00000 n 0000146290 00000 n 0000146692 00000 n 0000146914 00000 n 0000001836 00000 n прицеп ] >> startxref 0 %% EOF 172 0 объектов > поток xU 26Ψ ̫ ( } >> G̃q۹2 /) «bQ 8J4- [b) / E (JmX ˩3հ 6 =` `CԘcsD) a1S! / Î @ El =] [N! 2? EC | qZILKG7WEbCrr0: sI_ETL4NP! 4g G [{! YcM͊˜ pN90eQX51wIG_Qen 캿 9C + / _Bn9: nq | y92w64k [Qyh4] | 1
.Эффективность сгорания и избыток воздуха
Для обеспечения полного сгорания топлива используемые камеры сгорания снабжаются избыточным воздухом. Избыток воздуха увеличивает количество кислорода для сгорания и сгорания топлива.
- , когда топливо и кислород из воздуха находятся в идеальном равновесии — говорят, что сгорание является стехиометрическим
Эффективность сгорания увеличивается с увеличением избыточного воздуха — до тех пор, пока потери тепла в избыточном воздухе не будут больше, чем обеспеченное тепло более эффективным сгоранием.
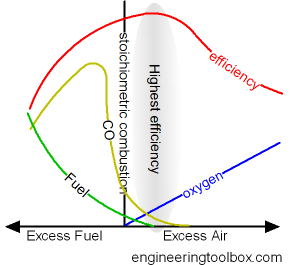
Избыток воздуха для достижения максимально возможной эффективности для некоторых видов топлива:
- 5 — 10% для природного газа
- 5 — 20% для мазута
- 15 — 60% для угля
Двуокись углерода — CO 2 — это продукт сгорания, а содержание CO 2 в дымовых газах является важным показателем эффективности сгорания.

Оптимальное содержание углекислого газа — CO 2 — после сгорания составляет примерно 10% для природного газа и примерно 13% для более легких масел.
Нормальная эффективность сгорания природного газа при различных сочетаниях температур избыточного воздуха и дымовых газов указана ниже:
1) «Чистая температура дымовой трубы» — это разность температур между температурой дымовых газов внутри дымохода и комнатной температурой снаружи горелки.
Потеря дымовых газов при сжигании масла
Соотношение между разностью температур в дымовых газах и приточном воздухе, концентрацией CO 2 в дымовых газах и потерей эффективности при сжигании топочных газов и масел выражается ниже:

Пример — сгорание масла и потеря тепла в топочном газе
Если
- , разница температур между дымовым газом, выходящим из котла, и температурой подачи окружающей среды составляет 300 o C, и
- — углекислый газ измеренное в дымовом газе составляет 10% — тогда,
из диаграммы выше
- потери дымового газа можно оценить приблизительно в 16% .
Глава 11: Горение (Обновлено 5/31/10)
Глава 11: Горение (Обновлено 5/31/10) Глава 11: Горение
(Спасибо
до Дэвид
Bayless за помощь в письменной форме
этот раздел)
Введение — До этого указать тепло Q во всех задачах и примерах было либо дано значение или было получено из отношения первого закона. Однако в различных тепловые двигатели, газовые турбины и паровые электростанции полученные в результате процессов сгорания с использованием любого твердого топлива (например,грамм. уголь или дерево). жидкое топливо (например, бензин, керосин или дизельное топливо), или газообразное топливо (например, природный газ или пропан).
В этой главе мы представляем химию и термодинамика сгорания общих углеводородных топлив — (C x H y ), в котором окислителем является кислород, содержащийся в атмосферном воздухе. Обратите внимание, что мы не будем охватывать сжигание твердого топлива или сложные смеси и смеси углеводородов, которые составляют бензин, керосин или дизельное топливо.
Атмосферный воздух содержит примерно 21% кислорода (O 2 ) по объему. Остальные 79% «других газов» в основном азот (N 2 ), т. мы будем считать, что воздух состоит из 21% кислорода и 79% азота объем. Таким образом, каждый моль кислорода, необходимый для окисления углеводорода, сопровождается 79/21 = 3,76 моль азота. Используя эту комбинацию Молекулярная масса воздуха становится 29 кг / кмоль. Обратите внимание, что это Предполагается, что азот обычно не подвергается каким-либо химическим реакция.
Процесс горения — Основной процесс сгорания может быть описан топливом ( углеводород) плюс окислитель (воздух или кислород), называемый Реактанты , которые подвергаются химическому процессу при выделении тепла для формирования Продукты сгорания так, что масса сохраняется. в самый простой процесс сгорания, известный как стехиометрический Сгорание , весь углерод в топливе образует углекислый газ (CO 2 ) и весь водород образует воду (H 2 O) в продуктах, таким образом, мы можем записать химическую реакцию следующим образом:
где z известен как стехиометрический коэффициент для окислителя (воздуха)
Обратите внимание, что эта реакция дает пять неизвестных: z, a, b, c, d, поэтому нам нужно пять уравнений для решения.стехиометрический сгорание предполагает, что в продуктах нет избыточного кислорода, таким образом, d = 0. Остальные четыре уравнения мы получаем из уравновешивания числа атомов каждого элемента в реагентах (углерод, водород, кислород и азота) с числом атомов этих элементов в товары. Это означает, что ни один атом не разрушен или не потерян в реакция горения
Элемент | Количество в реагентах | = | Количество в товарах | Сокращенное уравнение |
Углерод (C) | x | а | а = х | |
Водород (H) | и | 2b | б = г / 2 | |
Кислород (O) | 2z | 2a + b | z = a + b / 2 | |
Азот (N) | 2 (3.76) z | 2c | с = 3,76z |
Обратите внимание, что образовавшаяся вода может находиться в парах или жидкая фаза, в зависимости от температуры и давления продукты сгорания.
В качестве примера рассмотрим стехиометрическое сгорание метана (CH 4 ) в атмосферном воздухе. Приравнивая моляр Коэффициенты реагентов и продуктов, которые мы получаем:
Теоретическое соотношение воздух и топливо -The минимальное количество воздуха, которое позволит полное сгорание топливо называется Теоретический Air (также называемый Стехиометрический воздух ().В этом случае продукты не содержат кислорода. Если мы поставляем меньше теоретического воздуха, тогда продукты могут включать углерод монооксид (СО), поэтому в нормальных условиях теоретический воздух, чтобы предотвратить это возникновение. Это Избыток Воздух приведет к появлению кислорода в продукты.
Стандартная мера количества воздуха, используемого в Процесс сгорания — Air-Fuel Коэффициент (AF), определенный следующим образом:
При этом учитываются только реагенты метана сгорания с теоретическим воздухом, представленным выше, получаем:
Решенная проблема 11.1 — В По этой проблеме мы хотим разработать уравнение горения и определить воздушно-топливное отношение для полного сгорания н-бутана (C 4 H 10 ) а) теоретический воздух и б) 50% избытка воздуха.
Анализ продуктов сгорания — Горение всегда происходит при повышенных температурах и мы предполагаем, что все продукты сгорания (включая воду пары) ведут себя как идеальные газы. Так как у них разный газ константы, удобно использовать уравнение состояния идеального газа в Условия универсальной газовой постоянной следующие:
При анализе продуктов сгорания существует количество предметов интереса:
1) Что такое процентный объем конкретных продуктов, в частности диоксида углерода (CO 2 ) и углерод моноксид (СО)?
2) Что такое роса точка водяного пара в продуктах сгорания? Это требует оценка парциального давления водяного пара продукты.
3) Существуют экспериментальные методы объемного анализ продуктов сгорания, обычно делается на Dry Основа , в процентах от объема всех компонентов, кроме водяного пара. Это позволяет простой метод определения фактического соотношения воздух-топливо и избытка воздуха в процессе сгорания.
Для идеальных газов мы находим, что мольная доля y i i-го компонента в смеси газов при определенном давлении P
и температура Т равна объемной доле этого компонента.
Так как из молярного соотношения идеального газа: P.V = N.R u .T,
у нас есть:
Кроме того, так как сумма объемов компонентов V и должны равняться общему объему V, имеем:
Используя аналогичный подход, мы определяем частичное давление компонента с использованием закона парциальных давлений Далтона:
Решенная проблема 11.2 — In эта проблема пропана (C 3 H 8 ) сжигается с избытком воздуха 61%, который поступает в камеру сгорания при 25 ° С.Предполагая полное сгорание и общее давление 1 атм (101,32 кПа), определите а) соотношение воздух-топливо [кг-воздух / кг-топливо], б) процентное содержание двуокиси углерода по объему в продуктах и в) температура точки росы продуктов.
Решенная проблема 11,3 — В эта проблема этана (C 2 H 6 ) сжигается атмосферным воздухом, и объемный анализ сухие продукты сгорания дают следующее: 10% CO 2 , 1% CO, 3% O 2 и 86% N 2 .развивать уравнение сгорания и определить а) процент превышения воздух, б) соотношение воздух-топливо и в) точка росы горения товары.
Первый закон анализа горения — Основная цель сгорания состоит в том, чтобы производить тепло посредством изменения энтальпия от реагентов к продуктам. Из Первого Закона уравнение в контрольном объеме, игнорируя кинетическую и потенциальную энергию изменений и при условии, что никакая работа не сделана, мы имеем:
, где суммы взяты по всем продукты (р) и реагенты (г).N относится к числу родинок каждого компонента, а h [кДж / кмоль] относится к молярной энтальпии каждый компонент.
Так как есть ряд различных веществ участие мы должны установить общее эталонное состояние для оценки энтальпия, общий выбор 25 ° C и 1 атм, который обычно обозначается верхним индексом o. Профессор С. Бхаттачарджи из Государственный университет Сан-Диего разработал веб-экспертную систему в < www.thermofluids.net > ТЕСТ ( Т г E xpert S ystem для Т с термодинамикой) в котором он включил набор таблиц свойств идеального газа, основанных на по энтальпии h o = 0 по этой общей ссылке.Мы адаптировали некоторые из этих таблиц специально для этого раздела, и их можно найти в Следующая ссылка:
Сжигание Молярные таблицы энтальпии
В качестве примера рассмотрим снова полное сгорание метана (CH 4 ) с теоретическим воздухом:
Обратите внимание, что в реагентах и продуктах Приведенный выше пример у нас есть основные элементы O 2 и N 2 как а также соединения СН 4 , CO 2 и H 2 O.Когда соединение образуется, тогда изменение энтальпии называется Энтальпия формации , обозначенной h f o , и для нашего примера:
Вещество
Формула
hfo [кДж / кмоль]
Углекислый газ
CO 2 (г)
-393 520
Водяной пар
H 2 O (г)
-241,820
Вода
H 2 O (l)
-285,820
Метан
CH 4 (г)
-74,850
, где (г) относится к газу и (л) относится к жидкость.
Отрицательный знак означает, что процесс экзотермический , то есть тепло выделяется при образовании соединения. Обратите внимание, что энтальпия образования основных элементов O 2 и N 2 нуль.
Рассмотрим сначала случай, в котором достаточно теплопередача, так что реагенты и продукты находятся на 25 ° C и давление 1 атм, и что водный продукт является жидким. поскольку нет заметного изменения энтальпии, уравнение энергии становится:
Это тепло (Qcv) называется энтальпией сгорания или отопление Стоимость топлива.Если продукты содержат жидкую воду, то это высшее Теплотворная способность (как в нашем примере), однако, если продукт содержит водяной пар, то это ниже Теплотворная способность топлива. энтальпия сгорания является наибольшим количеством тепла, которое может быть выпущенный данным топливом.
Температура адиабатического пламени — Противоположная крайность приведенного выше примера, в котором мы оценили энтальпия горения — это случай адиабатического процесса, в котором тепло не выделяется.Это приводит к значительной температуре увеличение продуктов сгорания (обозначается адиабатической Температура пламени ), которая может быть только уменьшается за счет увеличения воздушно-топливного отношения.
Решенная задача 11.4 — Определить адиабатическая температура пламени для полного сгорания Метан (CH 4 ) с 250% теоретического воздуха в адиабатическом контрольном объеме.
Это уравнение может быть решено только с помощью итеративного Метод проб и ошибок с использованием таблиц Sensible Энтальпия против температуры для всех четырех компоненты продукции — СО 2 , Н 2 О, О 2 , и N 2 .Быстрый Приближение к адиабатической температуре пламени может быть получено при условии, что продукты состоят исключительно из воздуха. Этот подход был представленный нам Поттер и Сомертон в их Шаума Схема термодинамики для инженеров , в котором они приняли все продукты, чтобы N 2 . Нам кажется более удобным использовать воздух, принимая репрезентативное значение из конкретных Теплоемкость Воздуха : С р, 1000К = 1,142 [кДж / кг.К].
Таким образом, суммируя все моли продуктов, которые мы имеем:
Использование таблиц Разумный Энтальпия против температуры мы оценили энтальпия всех четырех продуктов при температуре 1280К.это в результате общая энтальпия составила 802 410 [кДж / кмоль топлива], что составляет чрезвычайно близко к требуемому значению, что оправдывает такой подход.
Задача 11.5 — — Определить адиабатическую температуру пламени для полное сгорание пропана (C 3 H 8 ) с 250% теоретического воздуха в адиабатическом контрольном объеме [Т = 1300К].
______________________________________________________________________________________
Инженерная термодинамика, Израиль
Уриэли лицензирован под Creative
Commons Attribution-Noncommercial-Share Alike 3.0 США
Лицензия
Стехиометрическое сгорание
Стехиометрическое или теоретическое сгорание — это идеальный процесс сгорания, при котором топливо сжигается полностью.
Полное сгорание — это процесс сжигания всего углерода (C) до (CO 2 ), всего водорода (H) до (H 2 O) и всей серы (S) до (SO 2 ) ).
При наличии несгоревших компонентов в выхлопных газах, таких как C, H 2 , CO, процесс сгорания является незавершенным и не стехиометрическим.
Процесс сгорания можно выразить:
[C + H (топливо)] + [O 2 + N 2 (воздух)] -> (Процесс сгорания) -> [CO 2 + H 2 O + N 2 (тепло)]
, где
C = углерод
H = водород
O = кислород
N = азот
Чтобы определить избыток воздуха или избытка топлива для системы сгорания , мы начнем со стехиометрического соотношения воздух — топлива .Стехиометрическое соотношение является идеальным идеальным соотношением топлива, при котором пропорция химического смешивания является правильной. При сгорании всего топлива и воздуха расходуется без каких-либо лишних остатков.
Оборудование для технологического нагрева редко работает таким образом. «Соотношение» сгорания , используемое в котлах и высокотемпературных технологических печах, обычно включает умеренное количество избыточного воздуха — примерно на 10-20% больше, чем необходимо для полного сжигания топлива.
Если в горелку подается недостаточное количество воздуха, из котла выбрасывается несгоревшее топливо, сажа, дым и угарный газ, что приводит к загрязнению поверхности теплопередачи, загрязнению, снижению эффективности сгорания, нестабильности пламени и взрывоопасности
Чтобы избежать неэффективных и небезопасных условий, котлы обычно работают при избыточном уровне воздуха. Этот избыточный уровень воздуха также обеспечивает защиту от недостаточного количества кислорода, вызванного изменениями в составе топлива и «эксплуатационными отклонениями» в системе управления топливом-воздухом. Типичные значения избытка воздуха указаны для различных видов топлива в таблице ниже.
- , если содержание воздуха выше стехиометрического отношения — говорят, что смесь бедна топливом
- , если содержание воздуха меньше стехиометрического отношения — смесь богата топливом
Пример — стехиометрическое соотношение Сжигание метана — CH 4
Наиболее распространенным окислителем является воздух.Химическое уравнение для стехиометрического сжигания метана — CH 4 — с воздухом можно выразить как
CH 4 + 2 (O 2 + 3.76 N 2 ) -> CO 2 + 2 H 2 O + 7,52 N 2
Если будет подаваться больше воздуха, часть воздуха не будет участвовать в реакции. Дополнительный воздух называется избыточным воздухом , но термин теоретический воздух также может использоваться. 200% теоретического воздуха — это 100% избытка воздуха.
Химическое уравнение для метана, сжигаемого с избытком воздуха 25%, может быть выражено как
CH 4 + 1,25 x 2 (O 2 + 3,76 N 2 ) -> CO 2 + 2 H 2 O + 0,5 O 2 + 9,4 N 2
Избыточный воздух и O 2 и CO 2 в дымовых газах
Приблизительные значения для CO 2 и O 2 в дымовые газы в результате избытка воздуха оцениваются в приведенной ниже таблице:
| Избыточный воздух % | Углекислый газ — CO 2 — в дымовых газах (% объем ) | Кислород в дымовых газах Газ для всех видов топлива (объем % ) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Природный газ | Пропан Бутан | Мазут | Битумный уголь | Антрацит | |||||||
| 0 | 1201 9 9 9 9 994 9 4 15.5 | 18 | 20 | 0 | |||||||
| 20 | 10,5 | 12 | 13,5 | 15,5 | 16,5 | 3 | |||||
| 40 | 9 | 10 | 12 | 13,5 | 14 | 5 | |||||
| 60 | 8 | 9 | 10 | 12 | 12,5 | 7,5 | |||||
| 80 | 901 9 9 9 995 901 994 994 994 994 994 994 994 994 994 901 994 901 995 901 995 901 995 901 994 994 994 994 994 994 994 994 99459 | ||||||||||
| 100 | 6 | 6 | 8 | 9,5 | 10 | 10 | |||||
