Особенности горения веществ на воздухе
☰
Горение — это химическая реакция, которая протекает с выделением тепла и света. В случае, если среди продуктов горения присутствуют твердые вещества, то горение сопровождается светящимся пламенем. Например, при горении фосфора получается светящееся пламя, а при горении водорода его нет, так как в последнем случае образуется водяной пар.
Метан горит почти бесцветно, голубоватым пламенем. А вот бензин горит достаточно ярко, так как углерод в нем сгорает не полностью и образуется сажа. Именно раскаленная сажа делает пламя ярким. Но если жечь топливо при большом количестве кислорода, то пламя становится почти несветящимся, так как сажа сгорает. Кроме того, такое пламя имеет более высокую температуру.
Горение в чистом кислороде протекает более интенсивно, чем в воздухе, так как в нем содержится большое количество азота, который не поддерживает горение.
Кроме кислорода горение поддерживают хлор (Cl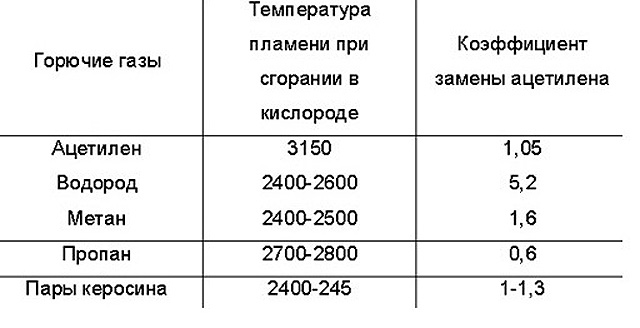
При горении различных веществ в кислороде образуются оксиды, и выделяется тепло.
Различные вещества загораются на воздухе при разной температуре. Так температура воспламенения медицинского эфира 150 °C, бумаги — более 200 °C, магния — 600 °C. Если загоревшееся вещество вынести из пламени, оно все-равно продолжит гореть, так как в процессе горения выделяется теплота и нагревает новые участки вещества.
Горение — это достаточно быстрое взаимодействие вещества с кислородом. Однако вещество может реагировать с кислородом медленно. В этом случае процесс взаимодействия называют не горением, а окислением. Так, например, ржавеет железо. При этом железо реагирует с кислородом с образованием оксида железа.
Чтобы прекратить горение вещества, самым надежным способом является прекращение доступа воздуха и кислорода вместе с ним. Также можно также охладить вещество, облив его водой. Однако этот способ не всегда подходит. Например, некоторые металлы активно взаимодействуют с водой и тушения не происходит.
Вещества, которые легко загораются, называются огнеопасными. К ним относятся эфир, бензин, спирт и др. Их пары могут вспыхнуть даже находясь поодаль от огня.
Egida Ross — Что такое огонь?
Огонь — это химический процесс. Этот процесс известен как «Сгорание». Сгорание — это цепная реакция, химически подобная процессу «обратному» фотосинтезу. Для возникновения возгорания должны всегда присутствовать три элемента.
Эти три элемента:
- Горючий материал (топливо).
- Высокая температура.
- Кислород.
Огонь — это процесс, который требует, чтобы горючий материал (топливо) был подвергнут достаточно высокой температуре и имел доступ к кислороду.
ФАЗЫ ОГНЯ
Процесс горения делится на определенные стадии. Каждая фаза (или стадия) характеризуется различиями в комнатной температуре и атмосферном составе.
Начальная фаза (стадия роста)
В первой фазе значительно увеличивается содержание кислорода в воздухе, и огонь производит водяной пар, углекислый газ, возможно небольшое количество двуокиси серы, угарного газа и других газов. Вырабатывается некоторое количество тепла и это количество увеличится в процессе огня. Огонь может производить температуру пламени намного больше 10000F (5370C), однако температура в комнате на данном этапе может быть небольшая.
Вырабатывается некоторое количество тепла и это количество увеличится в процессе огня. Огонь может производить температуру пламени намного больше 10000F (5370C), однако температура в комнате на данном этапе может быть небольшая.
Свободно горящая фаза (полностью развитая стадия)
Вторая фаза горения охватывает все свободно горящие действия огня. Во время этой фазы богатый кислородом воздух вовлечен в пламя, поскольку конвекция (повышение горячих газов) несет высокую температуру к верхнему слою ограниченного пространства. Горячие газы распространяются сверху вниз, вынуждая более прохладный воздух искать более низкие уровни, и, в конечном счете, зажигают весь горючий материал в верхних уровнях комнаты. На данном этапе температура в верхних слоях может превысить 1,3000F (7000C). В то время как огонь прогрессирует через последние стадии этой фазы, он продолжает потреблять свободный кислород, пока он не достигает точки, где недостаточно кислорода, чтобы реагировать с топливом.
Тлеющая фаза (стадия распада)
В третьей фазе пламя может прекратиться, если область горения достаточно воздухонепроницаема. В этом случае горение уменьшается до тлеющих угольков. Комната становится полностью заполненной плотным дымом и газами до такой степени, что возникает избыточное давление и образуются трещины. Огонь продолжает тлеть, и комната полностью заполнится плотным дымом и газами сгорания при температуре 1,0000F (5370C). Сильный жар выпарит более легкие топливные фракции, такие как водород и метан от горючего материала в комнате. Эти топливные газы будут совместно с производными огня и далее увеличат опасность повторного возгорания и создадут возможность обратной тяги.
Классификация пожара
Огонь класса А — Огонь, включающий в себя обычные горючие материалы, такие как древесина, ткань, бумага, резина и много видов пластмасс.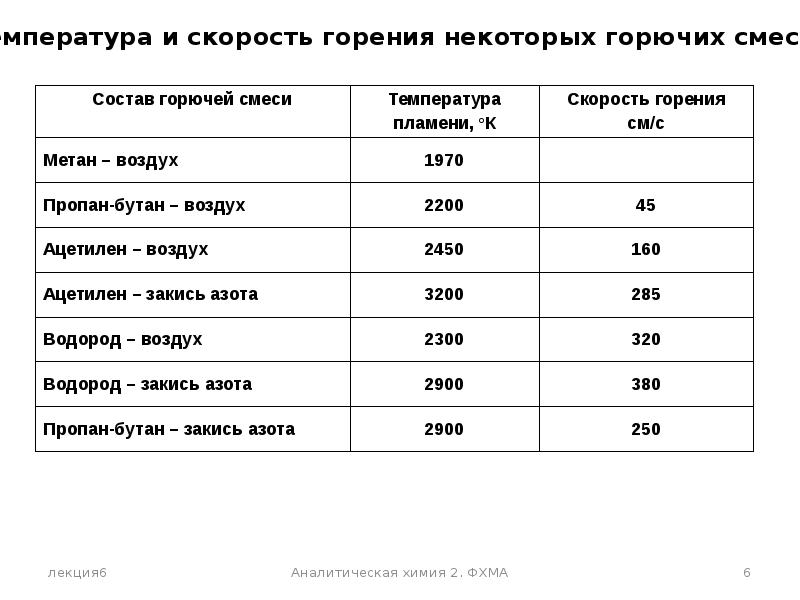
Огонь класса B — Огонь, содержащий огнеопасные жидкости, жиры и газы.
Огонь класса C — Огонь, включающий энерго- и электрооборудование.
Огонь класса D — Огонь, включающий в себя горючие металлы, такие как магний, титан, цирконий, натрий и калий.
Огонь класса F — Класс F — это новая классификация огня с 1998 и здесь имеется ввиду возгорание горючего топлива, случаи возгорания в кулинарии, например растительные или животные жиры.
Природа огня
Огонь БЫСТРЫЙ. Времени крайне мало! Меньше чем за 30 секунд маленькое пламя может полностью выйти из-под контроля и превратиться в основной огонь. Для образования плотного слоя черного дыма требуется лишь несколько минут, чтобы заполнить дом, после чего он полностью будет охвачен огнем. Самые смертельные пожары происходят сами по себе в то время, пока люди спят. Если Вы почувствуете возгорание, то у Вас не будет времени, чтобы захватить какие-либо ценности, потому что огонь распространяется слишком быстро, и дым слишком плотный.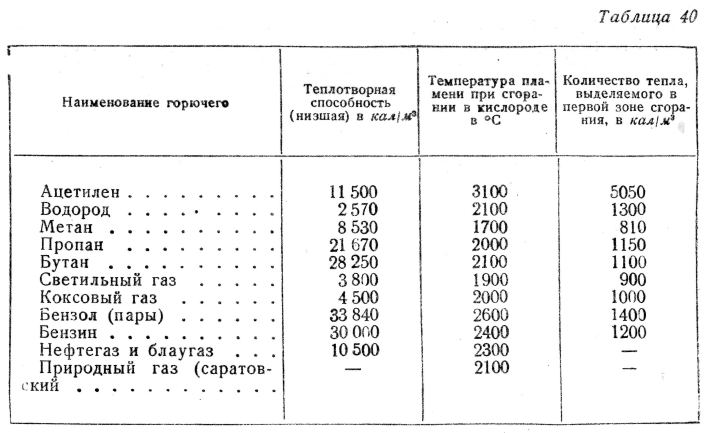 У Вас будет время только на то, чтобы покинуть здание.
У Вас будет время только на то, чтобы покинуть здание.
Пламя ГОРЯЧЕЕ. Высокая температура несет бо’льшую угрозу, чем огонь. Одна только высокая температура пламя может убить. Комнатная температура в огне может быть в 100 раз больше на уровне пола и в 600 раз на уровне глаз. Вдох этого супер-горячего воздуха опалит Ваши легкие. Эта высокая температура может расплавить одежду на Вашей коже. Через пять минут комната может стать такой горячей, что все в ней загорается сразу: это называется общая вспышка.
Огонь ТЕМНЫЙ. Огонь не яркий, он черный как смола. Огонь начинается яркой вспышкой, но быстро производит черный дым и, тем самым, создает полную темноту. Если Вы оказались в огне, Вы можете быть ослеплены, дезориентированы и неспособны найти выход из дома, в котором Вы жили в течение многих лет.
Огонь СМЕРТЕЛЕН. Дым и токсичные газы убивают больше людей, чем огонь. Огонь израсходовал кислород, в котором Вы нуждаетесь, и производит дым и ядовитые газы, которые убивают.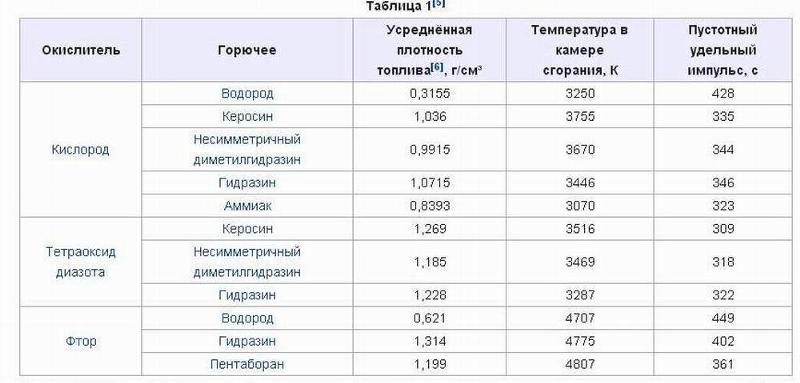 Вдыхание даже небольшого количества дыма и токсичных газов может оказывать на Вас седативное действие, дезориентировать и нарушить дыхание. Бесцветные пары без запаха могут убаюкать Вас в глубокий сон прежде, чем огонь достигнет Вашей двери. Вы не сможете проснуться вовремя, чтобы убежать.
Вдыхание даже небольшого количества дыма и токсичных газов может оказывать на Вас седативное действие, дезориентировать и нарушить дыхание. Бесцветные пары без запаха могут убаюкать Вас в глубокий сон прежде, чем огонь достигнет Вашей двери. Вы не сможете проснуться вовремя, чтобы убежать.
Скорость распространения огня
Огонь распространяется чрезвычайно быстро, у потенциальной жертвы есть крайне мало времени, чтобы выжить. Огонь может удваиваться в размере каждые 30 секунд. Всего через две минуты огонь может стать опасным для жизни. Через пять минут место жительства может быть охвачено огнем.
- Люди могут управлять огнем и потушить пожар в начальной стадии. Если человек находится уже в полностью развитой стадии возгорания, он не способен бороться с огнем. При полностью развитой стадии огня человек должен быстро бежать c места пожара.
- Однако, время начальной стадии слишком коротко. К сожалению, большинство людей не приучено к разыгрыванию надлежащих контрмер при внезапном возникновении огня.

- Все продукты Fire Fighter наоборот, могут использоваться быстро и легко.
Реакция горения
Реакция горения.
Горение топлива есть одна из форм окисления, т.е. соединения вещества с кислородом. Окисление может протекать различно. Медленное соединение вещества с кислородом называется собственно окислением. Примером процесса более быстрого окисления является реакция горения или горение. Наконец в случае мгновенного соединения горючих с кислородом может произойти взрыв.
Окисление сопровождается выделением определенного количества тепла. При медленном окислении это тепло постепенно рассеивается, не создавая заметного повышения температуры. При взрыве теплота реакции горения выделятся практически мгновенно, что приводит к бстрому расширению газов.
Горение углеводородных газов СmHn в кислороде может быть выражено в общем виде уравнением
СmHn + (m+n/4)O2 = mCO2 + (n/2) h3O.
Как известно, чаще всего сжигание газов происходит не в чистом кислороде, а в кислороде воздуха. В воздухе на 21 объем кислорода приходится 79 объемов азота ( если пренебречь незначительным количеством СО2 и редких газов), или на 23,3 массовых частей кислорода приходится 79 : 21 = 3,76 м³ азота, или 1 м³ кислорода содержится в 100 : 21 = 4,76 м³ воздуха.
В связи с указанным приведенное уравнение реакции горения углеводородных газов в атмосфере воздуха можно написать в виде
СmHn + (m+n/4)O2 + 3,76N2) = mCO2 + (n/2) h3O + (m +n/4) 3.76 N2.
Начально и конечное состояние реакций реакций горения распространенных газов представлены уравнениями, приведенными в табл. 1 и табл.2
Таблица 1
Реакция горения горючих газов в кислороде.
|
Газ |
Реакция горения |
|
Метан |
СН4 + 2О2→ СО2 + Н2О |
|
Этилен |
С2Н4 + 3О2 → 2СО2 + 2Н2О |
|
Этан |
С2Н6 + 3,5О2 → 2СО2 + 3Н2О |
|
Пропилен |
С3Н6 + 4,5О2 → 3СО2 + 3Н2О |
|
Пропан |
С3Н8 + 5О2 → 3СО2 + 4Н2О |
|
н-Бутилен и изобутилен |
С4Н8 + 6О2 → 4СО2 + 4Н2О |
|
н-Бутан и изобутан |
С4Н10 + 6,5О2 → 4СО2 + 5Н2О |
|
н-Пентан |
С5Н12 + 8О2 → 5СО2 + 6Н2О |
Таблица 2
Реакция гоения горючих газов в воздухе.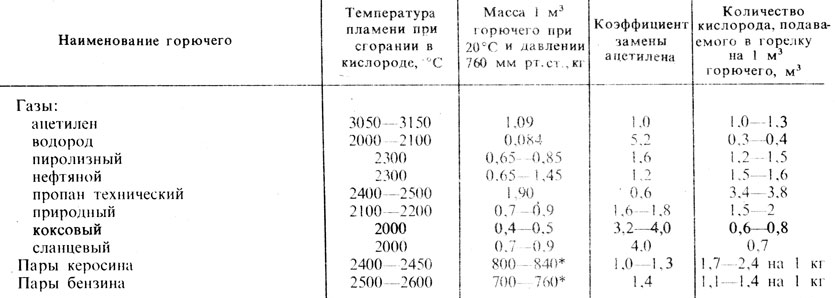
|
Газ |
Реакция горения |
|
Метан |
СН4 + 2О2 + 7,52N2 → СО2 + 2Н2О + 7,52N2 |
|
Этилен |
С2Н4 + 3О2 + 11,28N2 → 2СО2 + 2Н2О + 11,28N2 |
|
Этан |
С2Н6 + 3,5О2 + 13,16N2 → 2СО2 + 3Н2О + 13,16N2 |
|
Пропилен |
С3Н6 + 4,5О2 + 16,92N2 → 3СО2 + 3Н2О + 16,92N2 |
|
Пропан |
С3Н8 + 5О2 + 18,8N2 → 3СО2 + 4Н2О + 18,8N2 |
|
н-Бутилен и изобутилен |
С4Н8 + 6О2 + 22,56N2 → 4СО2 + 4Н2О + 22,56N2 |
|
н-Бутан и изобутан |
С4Н10 + 6,5О2 + 24,44N2 → 4СО2 + 5Н2О + 24,44N2 |
|
н-Пентан |
С5Н12 + 8О2 + 30,08N2 → 5СО2 + 6Н2О + 30,08N2 |
Ацетилен: формула, получение, горение и применение
- Ацетилен
- химическое соединение углерода и водорода.
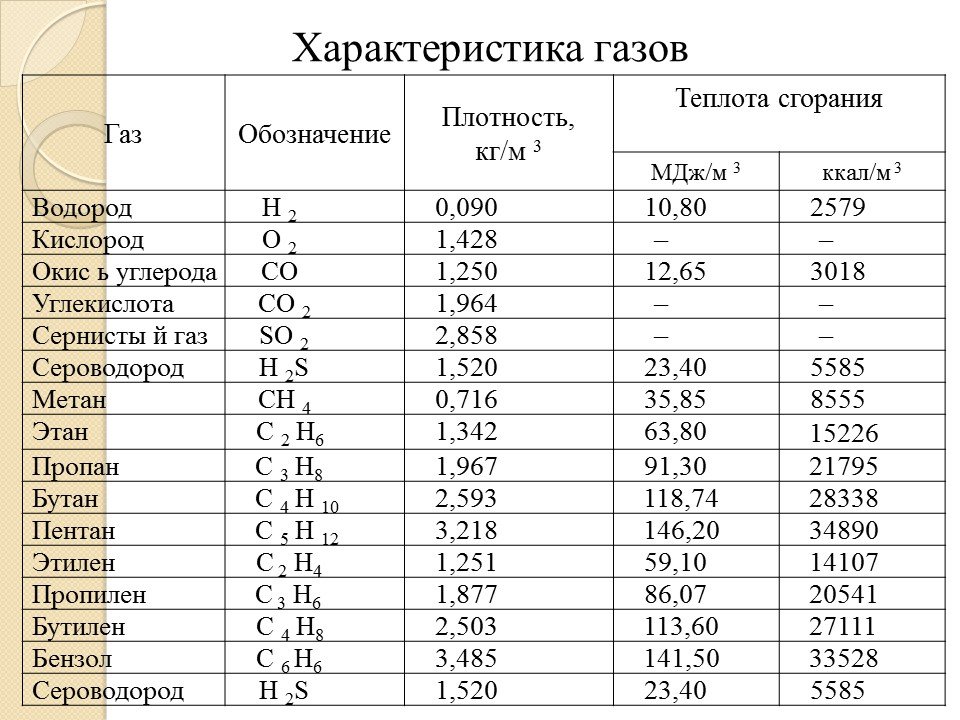
 Ацетилен легче воздуха, 1 м3 при 20°С и 760 мм рт. ст. имеет массу 1,091 кг/м3. Плотность по отношению к воздуху 0,9. Критическая температура 35,9°С и критическое давление 61,6 кгс/см2. При сгорании с кислородом он дает пламя с наиболее высокой температурой, которая достигает 3200°С, что объясняется его эндотермичностью (другие углеводороды экзотермичны, т. е. при распаде поглощают тепло). Химическая формула — C2H2, структурная формула Н-С=С-Н.
Ацетилен легче воздуха, 1 м3 при 20°С и 760 мм рт. ст. имеет массу 1,091 кг/м3. Плотность по отношению к воздуху 0,9. Критическая температура 35,9°С и критическое давление 61,6 кгс/см2. При сгорании с кислородом он дает пламя с наиболее высокой температурой, которая достигает 3200°С, что объясняется его эндотермичностью (другие углеводороды экзотермичны, т. е. при распаде поглощают тепло). Химическая формула — C2H2, структурная формула Н-С=С-Н.
При нормальном давлении и температуре от -82,4°С (190,6 К) до -84,0°С (189 К) переходит в жидкое состояние, а при температуре -85°С (188 К) затвердевает, образуя кристаллы плотностью 0,76 кг/м3. Жидкий и твердый ацетилен легко взрывается от трения, механического или гидравлического удара и действия детонатора. Технический ацетилен при нормальных давлении и температуре представляет собой бесцветный газ с резким специфическим чесночным запахом из-за содержащихся в нем примесей в виде сернистого водорода, аммиака, фосфористого водорода и др.
История получения ацетилена
В 1836 г. в Бристоле на заседании Британской ассоциации Эдмунд Дэви (Edmund Davy), профессор химии Дублинского Королевского общества и двоюродный брат Гемфри Дэви (Humphry Davy), сообщил:
… При попытке получить калий, сильно нагревая смесь прокаленного винного камня с древесным углем в большом железном сосуде, я получил черное вещество, которое легко разлагалось водой и образовывало газ, оказавшийся новым соединением углерода и водорода. Этот газ горит на воздухе ярким пламенем, более густым и светящимся даже сильнее, чем пламя маслородного газа (этилена). Если подача воздуха ограничена, горение сопровождается обильным отложением сажи. В контакте с хлором газ мгновенно взрывается, причем взрыв сопровождается большим красным пламенем и значительными отложениями сажи… Дистиллированная вода поглощает около одного объема нового газа, однако при нагревании раствора газ выделяется, по-видимому, не изменяясь... Для полного сгорания нового газа необходимо 2,5 объема кислорода. При этом образуются два объема углекислого газа и вода, которые являются единственными продуктами горения… Газ содержит столько же углерода, что и маслородный газ, но вдвое меньше водорода… Он удивительно подойдет для целей искусственного освещения, если только его удастся дешево получать.
Дэви получил карбид калия К2С2 и обработал его водой.
В статье о получении карбида кальция мы писали о том, что его «двууглеродистый водород» впервые был назван ацетиленом французским химиком Пьером Эженом Марселеном Бертло (Marcellin Berthelot) в 1860 г. Только через 60 лет после открытия Дэви предсказанное им использование ацетилена для освещения явилось первым толчком для его промышленного получения.
Получение ацетилена
Получение ацетилена производится двумя основными способами:
А вот какой способ сейчас более распространён можно узнать из статьи о получении ацетилена.
Применение ацетилена
Применение ацетилена при газовой сварке обусловлено тем, что у него самая большая температуры горения. Но он также нашел свое применение в химической отрасли для получения пластмасс, синтетического каучука, уксусной кислоты и растворителей. Более подробный ответ по данному вопросу можно найти в статье о применении ацетилена.
Горение ацетилена
Горение ацетилена происходит по реакции: С2Н2 + 2,5O2=2СO2 + Н2O + Q1
Для полного сгорания 1 м3 ацетилена по вышеуказанной реакции теоретически требуется 2,5 м3 кислорода или = 11,905 м3 воздуха. При этом выделяется тепло Q1 ? 312 ккал/моль. Высшая теплотворная способность 1 м3 С2Н2 при 0°C и 760 мм рт. ст., определенная в газовом калориметре, составляет QВ = 14000 ккал/м3 (58660 кДж/м3), что соответствует расчетной:
312?1,1709?1000/26,036 = 14000 ккал/м3
Низшая теплотворная способность при тех же условиях может быть принята QH = 13500 ккал/м3 (55890 кДж/м3).
Практически для горения в горелках при восстановительном пламени в горелку подается не 2,5 м3 кислорода на 1 м3 ацетилена, а всего лишь от 1 до 1,2 м3, что примерно соответствует неполному сгоранию по реакции:
С2H2 + О2 = 2СО + H2 + Q2
где Q2 ? 60 ккал/моль или 2300 ккал/кгС2H2. Остальные 1,5-1,3 м3 кислорода поступают в пламя из окружающего воздуха, в результате чего в наружной оболочке пламени протекает реакция:
2СО + H2 + 1,5О2 = 2СO2 + H2O + Q3
Реакция неполного горения ацетилена протекает на внешней оболочке светящегося внутреннего конуса пламени, причем под влиянием высокой температуры на внутренней поверхности конуса происходит распад С2Н2 на его составляющие по реакции:
С2H2 = 2С + H2 + Q4
где Q4?54 ккал/моль или 2070 ккал/кг С2H2.
Таким образом, общая полезная теплопроизводительность пламени применительно к сварочным процессам представляет собой сумму тепла, выделяемого при распаде С2Н2, и тепла, выделяемого при неполном сгорании, что составляет Q4 + Q2 = 2070 + 2300 = 4370 ккал/кг или 4370?1,1709 ? 5120 ккал/м3.
При содержании С2Н2 в смеси около 45% (т. е. при отношении кислорода к ацетилену, примерно равном 1,25) достигается максимальная температура горения ацетилена, которая составляет 3200°С.
Следовательно, температура пламени изменяется в зависимости от состава смеси.
При содержании 27% С2Н2 достигается максимальная скорость воспламенения ацетилено-кислородной смеси, которая равна 13,5 м/сек.
Следовательно, в зависимости от состава смеси также изменяется и скорость воспламенения.
Данные зависимостей скорости воспламенения и температуры пламени и от содержания в ней ацетилена представлены ниже в таблице.
| Содержание С2Н2 в смеси в объемных процентах | 12 | 15 | 20 | 25 | 27 | 30 | 32 | 35 | 40 | 45 | 50 | 55 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Максимальная температура горения ацетилена, °С | — | 2920 | 2940 | 2960 | 2970 | 2990 | 3010 | 3060 | 3140 | 3200 | 3070 | 2840 |
| Скорость воспламенения смеси, м/сек | 8,0 | 10,0 | 11,8 | 13,3 | 13,5 | 13,1 | 12,5 | 11,3 | 9,3 | 7,8 | 6,7 | — |
Необходимо понимать, что полное сгорание ацетилено-воздушной смеси достигается при наличии в ней не более 1?100/(1+11,905)=7,75% ацетилена (так называемая стехиометрическая смесь). При этом продуктами реакции являются только углекислый газ (СО2) и вода (H2О). При содержании ацетилена более 17,37% в виде сажи выделяется свободный углерод.
При этом продуктами реакции являются только углекислый газ (СО2) и вода (H2О). При содержании ацетилена более 17,37% в виде сажи выделяется свободный углерод.
С увеличение процентного содержание ацетила выделение сажи также возрастает (коптящее пламя), а при 81% С2Н2 — процесс горения прекращается или не возникает.
Хранение и транспортировка ацетилена
Ацетилен выпускают по ГОСТ 5457 растворенным и газообразным. Хранят и транспортируют его в растворенном состоянии в специальных стальных баллонах по ГОСТ 949, заполненных пористой, пропитанной ацетоном массой. Ацетилен, растворенный в ацетоне не склонен к взрывчатому распаду.
Баллоны окрашены в серый цвет и надписью красными буквами «АЦЕТИЛЕН» на верхней цилиндрической части.
Максимальное давление ацетилена при заполнении баллона составляет 2,5 МПа (25 кгс/см2), при отстое и охлаждении баллона до 20°С оно снижается до 1,9 МПа (19 кгс/см2). При этом давлении в 40-литровый баллон вмещается 5-5,8 кг С2Н2 по массе (4,6-5,3 м3 газа при 20°С и 760 мм рт. ст.).
При этом давлении в 40-литровый баллон вмещается 5-5,8 кг С2Н2 по массе (4,6-5,3 м3 газа при 20°С и 760 мм рт. ст.).
Давление ацетилена в полностью наполненном баллоне изменяется при изменении температуры следующим образом:
| Температура, °С | -5 | 0 | 5 | 10 | 15 | 20 | 30 | 40 |
|---|---|---|---|---|---|---|---|---|
| Давление, МПа | 1,3 | 1,4 | 14 | 1,7 | 1,8 | 12 | 2,4 | 3,0 |
Другие требования техники безопасности можно узнать из статьи о классе опасности и мерах безопасности при работе с ацетиленом
Физические свойства ацетилена
Физические свойства ацетилена представлены в таблицах ниже.
Коэффициенты перевода объема и массы С
2Н2 при Т=15°С и Р=0,1 МПа| Масса, кг | Объем газа, м3 |
|---|---|
| 1,109 | 1 |
| 1 | 0,909 |
Коэффициенты перевода объема и массы С
2Н2 при Т=0°С и Р=0,1 МПа| Масса, кг | Объем газа, м3 |
|---|---|
| 1,176 | 1 |
| 1 | 0,850 |
Ацетилен в баллоне
| Наименование | Объем баллона, л | Масса газа в баллоне, кг | Объем газа (м3) при Т=15°С, Р=0,1 МПа |
|---|---|---|---|
| С2Н2 | 40 | 5 | 4,545 |
Благодаря информации в таблице можно дать ответы на часто задаваемые вопросы:
- Сколько ацетилена в одном баллоне?
Ответ: в 40 л баллоне 5 кг или 4,545 м3 ацетилена - Сколько весит баллон ацетилена?
Ответ:
58,5 кг — масса пустого баллона из углеродистой стали согласно ГОСТ 949;
18-20 кг — масса пористого материала, пропитанного ацетоном;
5,0 — кг масса С2Н2 в баллоне;
Итого: 58,5 + 20,0 + 5,0= 83,5 кг вес баллона с ацетиленом.
- Сколько м3 ацетилена в баллоне
Ответ: 4,545 м3
Процесс горения топлива
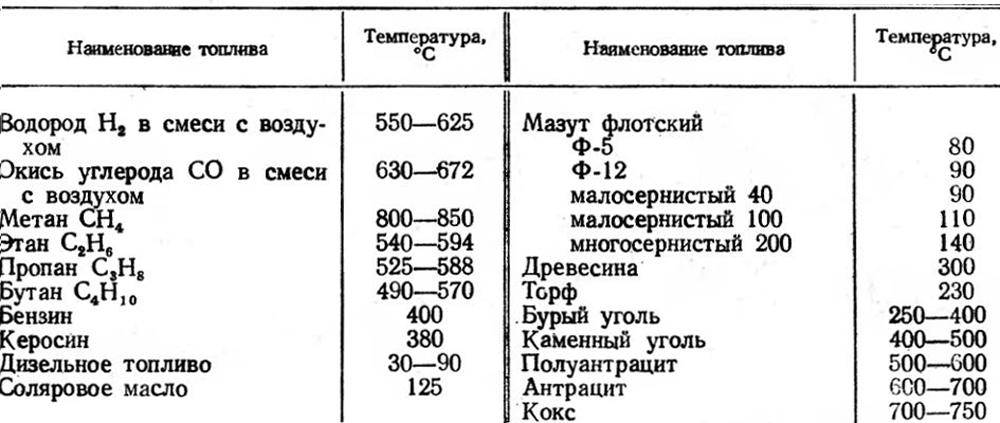
Горением называется взаимодействие горючих веществ с кислородом воздуха. Процесс горения может происходить только при высокой температуре и, как правило, сопровождается выделением определенного количества тепла. Если пламя свечи покрыть стаканом, то она начнет дымить и затем погаснет. Горение прекратится потому, что весь кислород воздуха в стакане израсходовался, а без кислорода горение происходить не может. Если кусок дерева поместить в сосуд с кислородом — он гореть не будет, так как сосуд не нагрет. Горючие части топлива— углерод и водород — могут соединяться с кислородом, только в сильно нагретом состоянии. Следовательно, без высокой температуры топлива горение происходить не может. Для воспламенения дерева, например, нужно, чтобы его температура была не ниже 300°, для каменного угля — 600°.
Как происходит обычная растопка печи? Сложенные в печи дрова окружены кислородом, поступающим в виде потока воздуха через топочную и поддувальную дверцы. Однако даже сухие дрова нельзя зажечь одной спичкой, небольшое пламя которой не в состоянии сильно нагреть полена. Сначала спичкой зажигают растопку (мелкую лучину или бумагу), а от е& пламени нагреваются и загораются дрова. Чтобы горение происходило непрерывно, в печь все время должен поступать кислород (воздух). Если количество воздуха слишком велико, то топливник будет охлаждаться, а горение — ухудшаться, так как для хорошего горения необходима высокая температура. Поэтому нельзя топить печь с широко открытой дверцей.
Однако даже сухие дрова нельзя зажечь одной спичкой, небольшое пламя которой не в состоянии сильно нагреть полена. Сначала спичкой зажигают растопку (мелкую лучину или бумагу), а от е& пламени нагреваются и загораются дрова. Чтобы горение происходило непрерывно, в печь все время должен поступать кислород (воздух). Если количество воздуха слишком велико, то топливник будет охлаждаться, а горение — ухудшаться, так как для хорошего горения необходима высокая температура. Поэтому нельзя топить печь с широко открытой дверцей.
Если же количество воздуха, а следовательно, и кислорода недостаточно, то происходит так называемое неполное горение— дрова тлеют и горят темно-красным пламенем, выделяя большое количество густого черного дыма, в котором уносятся частички топлива, не сгоревшего из-за недостатка кислорода. В дымооборотах печи и в дымовой трубе эти частички осаждаются в виде сажи. Для того чтобы воздух проникал во всю толщу топливного слоя и обеспечивал кислородом всю поверхность горения, печи оборудуют колосниковыми решетками и поддувалами.
Если поддувала нет и воздух попадает через топливную дверцу, то он омывает только передний ряд дров, поднимается кверху и уходит в дымоход, не соприкоснувшись с задними рядами дров. Поэтому дрова полностью не сгорают. Печи без поддувала и колосниковой решетки гораздо хуже используют сгорающее топливо. Внешними признаками полного сгорания топлива являются: соломенно-желтый цвет пламени в топливнике и белый или прозрачный дым. При полном сгорании сажа почти не откладывается на стенках дымооборотов и дымовой трубы. Нормальный процесс горения протекает при высоких температурах: для дров 800—900° и для каменного угля 900— 1200°. Эти температуры обеспечивают непрерывность горения, если кислород в топливники подается также непрерывно.
При полном сгорании углерода 1 весовая часть его соединяется с 2 весовыми частями кислорода воздуха и дает в результате 1 весовую часть нового газа, называемого углекислым газом или углекислотой. Этот газ, не имеющий цвета и запаха, не горит и не поддерживает горение.
При неполном сгорании углерода образуется окись углерода. Этот газ может гореть при высокой температуре. Окись углерода ядовита. Небольшое содержание ее в воздухе помещения может вызвать серьезное отравление и даже смерть людей; в быту окись углерода называют угаром. Внешним признаком выделения окиси углерода служат синенькие короткие огоньки поверх слоя углей. При сгорании водорода 2 весовые части его соединяются с 1 весовой частью кислорода, образуя водяной пар, который уносится в дымовую трубу. Если температура отходящих газов низка или стенки дымовой трубы сильно охлаждены, то и водяные пары охлаждаются и оседают на стенках в виде капель воды (иногда смешанной с несгоревшими частицами топлива). Это явление называется конденсацией водяных паров. Пии постоянной конденсации ухудшается тяга. Стенки трубы отсыревают и она постепенно разрушается.
Из этого следует, что нельзя допускать чрезмерного остывания дымовых газов; температура их не должна быть ниже 125—150°. Дымовые газы представляют собой смесь продуктов сгорания топлива из углекислоты, окиси углерода, водяных паров, остатков несгоревших частиц топлива (сажи) и иногда паров серы.
Что такое хороший камин? — Contura
Негерметичный камин: неправильное горение
Неправильный процесс горения, как правило, вызывается некачественным расчётом воздушных потоков при проектировании и испытаниях камина. В качестве примера, на рисунке показано, как холодный воздух влияет на процесс горения. Неконтролируемый холодный воздух поступает в топочную камеру. Там воздух расширяется и буквально толкает горючие газы вверх в дымоход. Газы не успевают пройти процесс горения и горящие частицы создают высокую температуру в дымоходе (7). Затем при подъеме по дымоходу они остывают и оседают на стенке дымохода.
Эти недостатки могут быть также вызваны неплотным прилеганием дверцы топки (6) или использованием камина, в котором не реализована функция предварительного нагрева воздуха.
Другие негативные последствия отсутствия герметичности в топке камина – что воздух в топке перемешивается неправильно, и температура горения снижается до неблагополучного уровня. Уменьшается теплоотдача, а топливо сгорает не полностью. В дымоход вылетают частицы в виде черного дыма, ядовитого угарного газа и сажи. В результате приходится часто чистить дымоход.
Уменьшается теплоотдача, а топливо сгорает не полностью. В дымоход вылетают частицы в виде черного дыма, ядовитого угарного газа и сажи. В результате приходится часто чистить дымоход.
Неправильное горение имеет и другие последствия: температура газов в дымоходе при неправильном горении значительно выше (400-500°С), что может раскалить сажу, осевшую в дымоходе, и вызвать трубный огонь – очень опасное явление, причину множества страшных пожаров в частных домах.
За 60-летнюю историю компании с камином Contura не было ни одного случая пожара по вине камина.
Чтобы камин был безопасным, чисто горел и потреблял мало топлива, он должен иметь три свойства:
• Достигать высокой рабочей температуры в топке (минимум 650˚С)
• Кислород должен перемешиваться с топливом в камере горения как можно более однородно
• Горючие газы должны подниматься до дымохода медленно, чтобы процесс горения успел завершиться внутри топочной камеры.
Внимание: Только при правильном взаимодействии этих трех условий у нас есть шанс добиться оптимального процесса горения, когда на выходе из топки в составе дымовых газов практически не остается кислорода, сажи и СО – только СО2 и вода, и температура газов не превышает 300˚С.
Чтобы реализовать эти условия, существует ряд технических решений, которые работают только в совокупности, после тщательной настройки:
• Герметичность камеры горения
• Теплоизоляция камеры горения
• Предварительный нагрев воздуха для горения
• Особая геометрия камеры горения
• Вторичный дожиг
• Кроме того, во внимание принимаются еще несколько десятков факторов, влияющих на процесс горения.
Внимание: Все решения работают, только если камин герметичен. Поэтому мы хотим обратить внимание именно на герметичность топочной камеры камина и связь ее с остальными функциями и решениями, отвечающими за хорошее горение
Глава 8. Характеристики горения газов
8.1. Реакции горения
Горение — быстропротекающая химическая реакция соединения горючих компонентов с кислородом, сопровождающаяся интенсивным выделением теплоты и резким повышением температуры продуктов сгорания.
8.2. Расчеты горения
Кислород для горения поступает из воздуха как его составная часть. Для расчетов принимается, что объемный состав сухого воздуха следующий:
Для расчетов принимается, что объемный состав сухого воздуха следующий:
8.3. Температура горения
В теплотехнике различаются следующие температуры горения газов: жаропроизводительность, калориметрическую, теоретическую и действительную (расчетную).
8.4. Температура самовоспламенения
Для инициирования реакций горения нужны условия воспламенения смеси топлива с окислителем. Воспламенение может быть самопроизвольным и вынужденным (зажигание).
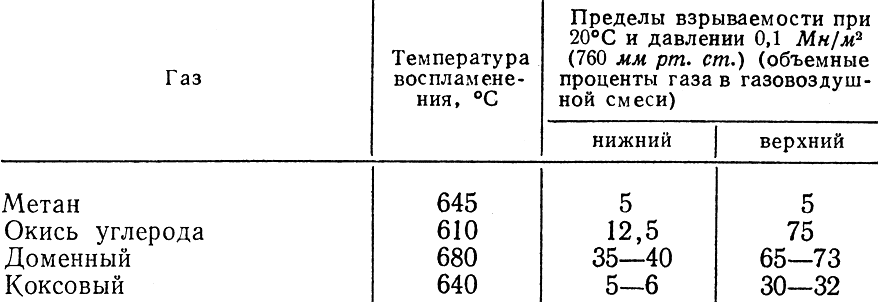
8.5. Пределы воспламеняемости и взрываемости
Газовоздушные смеси могут воспламеняться (взрываться) только тогда, когда содержание газа в смеси находится в определенных (для каждого газа) пределах. В связи с этим различают нижний и верхний концентрационные пределы воспламеняемости.
8.6. Горение в неподвижной среде
Перемещение пламенной зоны — фронта пламени, — области, отделяющей не вступившую в реакцию горючую смесь от продуктов горения, вызвано тем, что холодная горючая смесь перед ним нагревается до температуры воспламенения за счет теплопроводности и диффузии раскаленных продуктов горения в холодную смесь.
8.7. Горение в ламинарном и турбулентном потоках
Фронт пламени может быть остановлен, если создать встречное движение горючей смеси со скоростью, равной нормальной скорости распространения пламени. Наглядный пример — поверхность внутреннего конуса бунзеновской горелки.
8.8. Устойчивость горения
Основные факторы, влияющие на устойчивость горения, — скорости истечения газовоздушной смеси и распространения пламени. При горении газовоздушных смесей в ламинарном потоке устойчивой частью конусного фронта пламени является его нижняя часть.
8.9. Схемы огнепреградителей
Воздух или кислород, попав в газопровод, может образовать взрывчатую смесь, поэтому необходимо обязательно предохранять трубопроводы от проникновения в него воздуха или кислорода. На всех взрывоопасных производствах должны быть созданы условия, исключающие возможность возникновения поджигающих импульсов.
8.10. Принципы сжигания
Принципы сжигания
В основе процессов сжигания газа — принципы, условно называемые кинетическим и диффузионным. При кинетическом принципе до начала горения создается однородная смесь с некоторым избытком воздуха. Сгорание такой смеси происходит в коротком прозрачном факеле без образования в пламени частиц сажи.
Температура адиабатического пламени — обзор
Рассмотрим температуру адиабатического пламени для стехиометрической смеси водорода и кислорода:
h3 + 12O2 → h3O.
Температура адиабатического пламени для этой реакции должна быть наивысшей температурой, достижимой с этими реагентами. Более 2 моль водорода на каждый моль кислорода будет означать, что избыток водорода поглотит часть выделяемого тепла, что снизит конечную температуру. Меньше этой пропорции будет означать наличие избытка кислорода, который снова поглотит часть тепла, выделяющегося при образовании воды.Этот случай упрощен с точки зрения химического состава, поскольку единственным продуктом будет вода. Тогда, если мы предположим, что водород и кислород вводятся в их стандартном состоянии при эталонной температуре, то есть молекулярный водород и кислород вводятся при 298,16 К, уравнение (4.63) принимает вид
Тогда, если мы предположим, что водород и кислород вводятся в их стандартном состоянии при эталонной температуре, то есть молекулярный водород и кислород вводятся при 298,16 К, уравнение (4.63) принимает вид
Qavail = (1 моль) ΔHf, h30 + (12 моль) ΔHf , O20− (1 моль) ΔHf, h3O0.
Поскольку стандартная теплота образования молекулярного водорода и молекулярного кислорода равна нулю,
Qavail = −ΔHf, h3O0.
При T j = T r = 298,16 K и единственной составляющей в продуктах является вода, так что a ″ = 1 моль, уравнение (4.64) принимает вид
Qcomb (T′c ) = ΔHi (T′c) — ΔHi (298,6 К).
Мы ищем значение T′c, которое удовлетворяет следующему уравнению:
(4.66) Qcomb − Qavail = ΔH (T′c) −ΔH (298.16) + ΔHf, h3O0.
Используя табличные термодинамические значения, например, представленные МакБрайдом и его коллегами (1963) или в Приложении G, мы можем составить Таблицу 4.4. Интерполяция приводит к T c = 4920K.
Таблица 4.4. Оценка уравнения (4.66)
| T (K) | Δ H f 0 (H 2 O) (кДж / моль) | a & quot; (H 2 O) (моль) | Δ H ( T ) -Δ H (298,16) (кДж / моль) | Q c — Q a (кДж) |
|---|---|---|---|---|
| 4000 | −241.988 | 1 | 184,7 | −57,3 |
| 4500 | −241.988 | 1 | 214,5 | −27,4 |
| 5000 | −241.988 | 1 | 244.9 | 2.90 |
Адиабатические температуры пламени
Процесс горения без потери или увеличения тепла называется адиабатическим.
Температура адиабатического пламени для водорода, метана, пропана и октана — и других — с кислородом или воздухом в качестве окислителей в адиабатической реакции при постоянном давлении:
| Топливо | Температура адиабатического пламени ( K ) | ||
|---|---|---|---|
| Кислород *) в качестве окислителя | Воздух в качестве окислителя | ||
| Ацетальдегид | 3817 | 2228 | |
| Ацетон | 3705 | 2253 | |
| 3997 | 2607 | ||
| Бензол — C 6 H 6 3) | 3784 | 2363 | |
| n- Бутан — C 4 H 10 1) | 3867 9008 6 | 2248 | |
| изобутан — C 4 H 10 1) | 3861 | 2246 | |
| Бутилен — C 4 H 8 2 ) | 3867 | 2494 | |
| Дисульфид карбина | 2257 | ||
| Цианоген | 4855 | 2596 | |
| Циклогексан | 3865 | ||
| Циклогексан | 3865 | 2250 | Cyclo 39042370 |
| Декан | 3833 | 2286 | |
| Этан — C 2 H 6 1) | 3903 | 2222 | |
| Этанол | 3730 | 2238 | |
| Этилен — C 2 H 9 0016 4 2) | 3932 | 2375 | |
| Гексан | 3855 | 2238 | |
| Водород — H 2 | 3473 | 2483 | |
| 3953 | 2236 | ||
| Метанол | 3656 | 2222 | |
| Неопентан — C 5 H 9006 12 1) 9013 | 3850 | 2511 | |
| н-гексан — C 10 H 8 1) | 3682 | 2494 | |
| Нафталин — C 6 14 4) | 3943 | 2533 | |
| Неогексан — C 6 H 14 1) | 3838 | 2508 | |
| н-гептан — C 7 H 16 1) | 3851 | 2469 | |
| Оксиран | 3796 | 2177 | |
| н-пентан — C 5 H 12 1) | 3848 | 2505 | 3857 | 2508 |
| н-пентен — C 5 H 10 2) | 3865 | 2569 | |
| Пропан — C 3 H 8 1) | 2526 | 90 085 2250||
| Пропилен — C 3 H 6 2) | 3902 | 2528 | |
| Толуол — C 7 H 8 3) 3) | 3786 | 2344 | |
| Триптан — C 7 H 16 1) | 3836 | 2497 | |
| p-ксилол — C H 10 3) | 3788 | 2483 | |
*) Благодаря Maxwell Pisciotta за расчет адиабатических температур пламени с кислородом в качестве окислителя
526 1) 2 Парафины или алканы
2) Олефины или алкены
3) Ароматические углеводороды
9013 5 4) Другие углеводороды
- реагенты входят в процесс горения при 25 o C (77 o F) и 1 атм давление
- продукты выходят из процесса при 1 атм давлении
- сгорание является стехиометрическим без лишнего воздуха
Избыточный воздух снижает адиабатическую температуру пламени и часто вводится, чтобы избежать превышения температур пламени пределов, установленных материалами в системе сгорания.
Метан составляет основную часть природного газа.
График адиабатической температуры пламени
Адиабатическая температура пламени — это температура полного сгорания без потери тепла или поступления тепла в окружающую среду. Для большинства видов топлива это около 2000 градусов по Цельсию или 3500 градусов по Фаренгейту.Это диаграмма адиабатических температур пламени для обычных видов топлива. Температура адиабатического пламени — это теоретическая температура пламени, предполагающая полное сгорание и отсутствие работы или передачи тепла в окружающую среду или из нее.
Адиабатическая температура пламени при постоянном давлении
Обратите внимание, что большинство видов топлива горит на воздухе около 1950 ° C или 3500 ° F. Это связано с тем, что обычное топливо — это все органические соединения, которые сжигают разрывая связи C-H, C-C и O 2 с образованием молекул CO 2 и H 2 O. Горючее с тройными связями углерод-азот горит намного сильнее.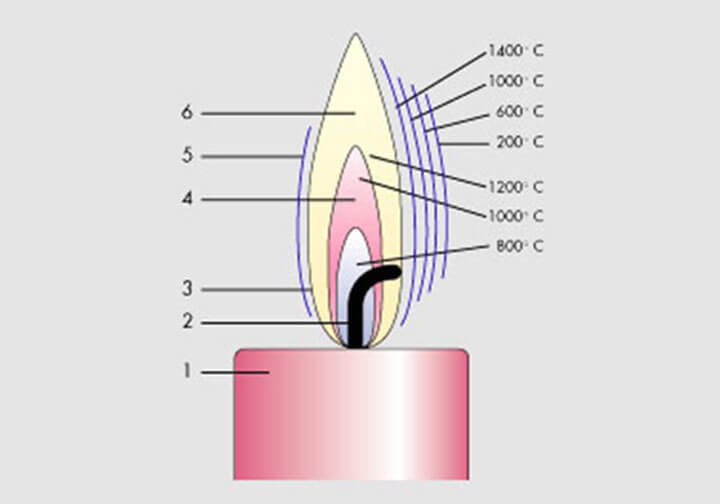 Металлы горят в кислороде, температура пламени выше, чем у большинства видов топлива. Естественно, что температура пламени выше, когда топливо горит в чистом кислороде, а не в воздухе.Также обратите внимание, что в таблице указаны теоретические температуры пламени, полученные при полном сгорании без потери тепла. Реальное пламя горит чуть ниже. Температура также зависит от измеряемой части пламени.
Металлы горят в кислороде, температура пламени выше, чем у большинства видов топлива. Естественно, что температура пламени выше, когда топливо горит в чистом кислороде, а не в воздухе.Также обратите внимание, что в таблице указаны теоретические температуры пламени, полученные при полном сгорании без потери тепла. Реальное пламя горит чуть ниже. Температура также зависит от измеряемой части пламени.
| Топливо | Окислитель | ° C | ° F |
| Дицианоацетилен (C 4 N 2 ) | Кислород | 1090 900 | |
| Цианоген (C 2 N 2 ) | Кислород | 4525 | 8177 |
| Цирконий | Кислород | 4005 | 7241 |
| Алюминий | Кислород | 3732 | 6759|
| Антрацит | Кислород | ~ 3500 | ~ 6332 |
| Ацетилен (C 2 H 2 ) | Кислород | 3480 | 6296 |
| MAPP (C 3 H 4 ) | Кислород | 2927 | 5301 |
| Ацетилен | Воздух 900 86 | 2500 | 4532 |
| Водород (H 2 ) | Воздух | 2254 | 4089 |
| Антрацит | Воздух | 2180 | 3957 |
| Битуминозный уголь | Воздух | 2172 | 3943 |
| Бензин | Воздух | 2139 | 3880 |
| Керосин | Воздух | 2093 | 3801 |
| Этанол (C 2 H 5 OH) | Воздух | 2082 | 3779 |
| MAPP | Воздух | 2010 | 3650 |
| Магний | Воздух | 1982 | 3600 |
| Пропан (C 3 H 8 ) | Воздух | 1980 | 3596 |
| Дерево | Воздух | 1980 9008 6 | 3596 |
| Бутан (C 4 H 10 ) | Воздух | 1970 | 3578 |
| Метан (CH 4 ) | Воздух | 1963 | 3565 |
| Природный газ | Воздух | 1960 | 3562 |
| Свеча | Воздух | ~ 1000 | ~ 1800 |
| Сигарета | Воздух | ~ 400-700 | ~ 750-1300 |
Постоянный объем и постоянное давление
Адиабатическое горение происходит либо при постоянном объеме, либо при постоянном давлении. Большая часть горения в повседневной жизни происходит при постоянном давлении, потому что воздух или кислород свободно поступают в пламя, а продукты горения уходят от него. Костер — это пример горения при постоянном давлении. С другой стороны, горение постоянного объема происходит в замкнутом пространстве. Сгорание внутри цилиндра двигателя является примером ситуации с постоянным объемом. Температура адиабатического пламени при постоянном объеме выше, чем при постоянном давлении. Это потому, что некоторая энергия уходит на изменение объема при постоянном давлении.Например, температура адиабатического пламени для метана составляет около 2326 К при постоянном объеме и 2236 К при постоянном давлении.
Большая часть горения в повседневной жизни происходит при постоянном давлении, потому что воздух или кислород свободно поступают в пламя, а продукты горения уходят от него. Костер — это пример горения при постоянном давлении. С другой стороны, горение постоянного объема происходит в замкнутом пространстве. Сгорание внутри цилиндра двигателя является примером ситуации с постоянным объемом. Температура адиабатического пламени при постоянном объеме выше, чем при постоянном давлении. Это потому, что некоторая энергия уходит на изменение объема при постоянном давлении.Например, температура адиабатического пламени для метана составляет около 2326 К при постоянном объеме и 2236 К при постоянном давлении.
Список литературы
- Бабраускас, Витенис (25.02.2006). «Температура в огне и пожарах». Пожарная наука и технологии, Inc. .
- Хейнс, В. М. (2015) Справочник CRC по химии и физике (96-е изд.). CRC Press. ISBN 978-1482260960.
- Куо, К.
 К. (1986). Принципы горения . John Wiley & Sons, Нью-Йорк.
К. (1986). Принципы горения . John Wiley & Sons, Нью-Йорк.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.

- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Горение | ||||||||||||||||||||||
| Что такое горение? | ||||||||||||||||||||||
Горение происходит, когда топливо, чаще всего ископаемое топливо, реагирует с кислородом воздуха с выделением тепла. Тепло, создаваемое при сжигании ископаемого топлива, используется в работе такого оборудования, как котлы, печи, печи и двигатели. Контролируя и регулируя количество газов в дымовой трубе или выхлопе, легко повысить эффективность сгорания, что позволяет экономить топливо и снижает расходы. Эффективность сгорания — это расчет того, насколько эффективно протекает процесс сгорания. Для достижения наивысшего уровня полноты сгорания должно иметь место полное сгорание.Полное сгорание происходит, когда вся энергия сжигаемого топлива извлекается, и ни одно из соединений углерода и водорода не остается несгоревшим. Полное сгорание произойдет, когда надлежащее количество топлива и воздуха (соотношение топливо / воздух) будет смешано в течение нужного времени при соответствующих условиях турбулентности и температуры. Хотя теоретически стехиометрическое сгорание обеспечивает идеальное соотношение топлива и воздуха, что, таким образом, снижает потери и извлекает всю энергию из топлива; в действительности стехиометрическое горение недостижимо из-за множества различных факторов. На практике, чтобы достичь полного сгорания, необходимо увеличить количество воздуха для процесса сгорания, чтобы обеспечить сгорание всего топлива. Количество воздуха, которое необходимо добавить, чтобы обеспечить извлечение всей энергии, называется избыточным воздухом. В большинстве процессов горения некоторые дополнительные химические вещества образуются во время реакций горения. Некоторые из образовавшихся продуктов, таких как CO (оксид углерода), NO (оксид азота), NO2 (диоксид азота), SO2 (диоксид серы), сажа и зола, должны быть сведены к минимуму и должны быть точно измерены.EPA установило особые стандарты и правила для выбросов некоторых из этих продуктов, поскольку они вредны для окружающей среды. Анализ горения является жизненно важным шагом для правильной работы и управления любым процессом горения с целью достижения наивысшей эффективности сгорания с наименьшими выбросами загрязняющих веществ. | ||||||||||||||||||||||
| Цель горения | ||||||||||||||||||||||
Цель горения — извлечь энергию от сжигания топлива наиболее эффективным способом.Для достижения максимальной эффективности сгорания необходимо сжигать весь топливный материал с наименьшими потерями. Чем эффективнее сжигается топливо и собирается энергия, тем дешевле становится процесс сжигания. | ||||||||||||||||||||||
Полное сгорание Полное сгорание происходит при извлечении 100% энергии топлива. Важно стремиться к полному сгоранию, чтобы сохранить топливо и повысить рентабельность процесса сгорания.Для полного сгорания в камере сгорания должно быть достаточно воздуха. Добавление избыточного воздуха значительно снижает образование CO (монооксида углерода), позволяя CO реагировать с O2. | ||||||||||||||||||||||
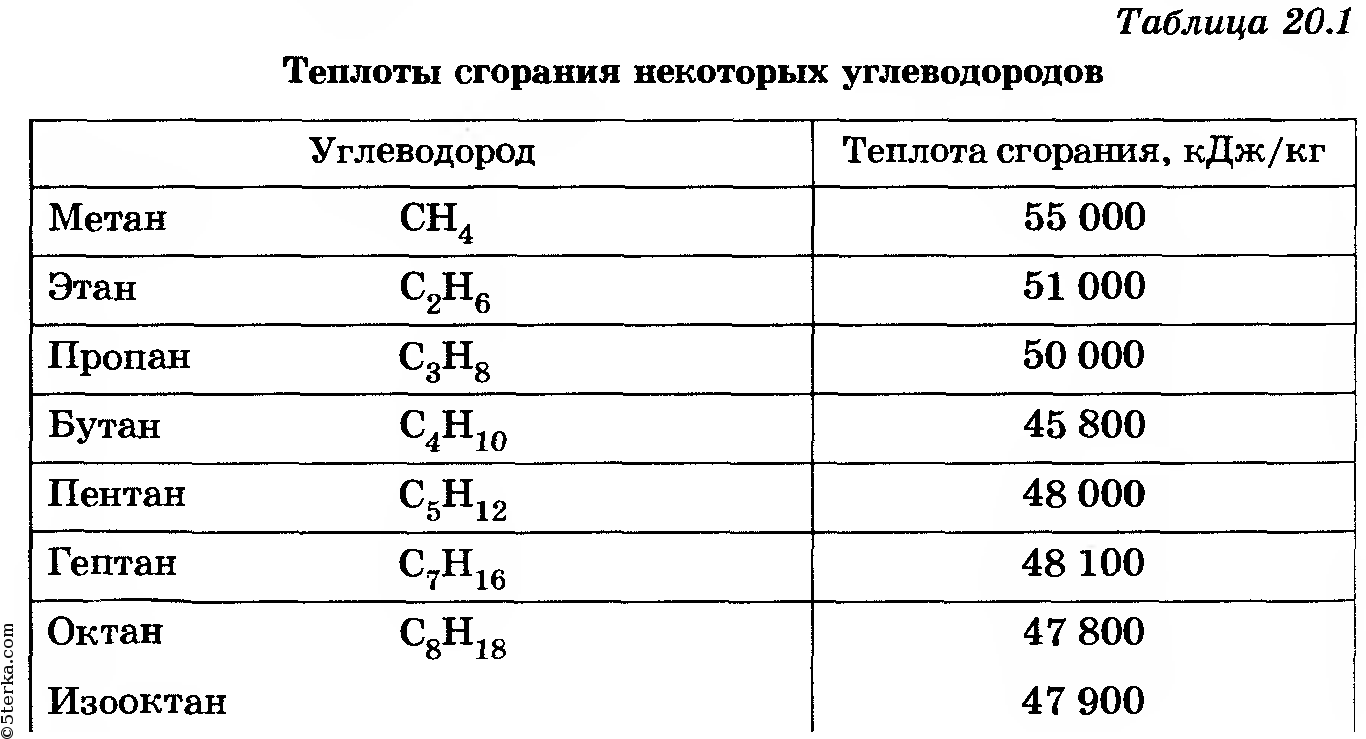
Стехиометрическое горениеСтехиометрическое сгорание — это теоретическая точка, в которой соотношение топлива и воздуха является идеальным, так что происходит полное сгорание с идеальной эффективностью.Хотя стехиометрическое сжигание невозможно, во всех процессах сжигания стремятся к максимальному увеличению прибыли. Топливо В настоящее время во всем мире в процессах сжигания используется множество видов топлива, наиболее распространенными из которых являются: уголь, масла (№2, №4 и №6), дизельное топливо, бензин, природный газ, пропан, коксовый газ и древесина. . Каждое топливо имеет разные химические характеристики, в том числе уникальное соотношение C / h3 и теплотворную способность, среди прочего. | ||||||||||||||||||||||
Эффект от сжигания различных видов топливаУголь Во всем мире в процессах сжигания используется много разновидностей угля; наиболее широко используются антрацит, битуминозный, полубитуминозный и бурый угли.При сжигании угля образуется значительное количество углекислого газа, учитывая чрезвычайно высокий уровень углерода в угле; Поскольку для сжигания углерода требуется больше кислорода, для сжигания угля требуется больше воздуха для горения, чем для других ископаемых видов топлива. Помимо выбросов диоксида углерода, сжигание угля создает некоторые другие загрязнители, включая NOx, диоксид серы (SO2), триоксид серы (SO3) и выбросы твердых частиц. Двуокись серы химически соединяется с водяным паром в воздухе с образованием слабой формы серной кислоты, одной из основных причин кислотных дождей. НефтьНефтяное топливо в основном представляет собой смесь очень тяжелых углеводородов, в которых содержание водорода выше, чем в угле. В то же время масло содержит меньше углерода, чем уголь, и поэтому для полного сгорания требуется меньше воздуха для горения. Следовательно, при сжигании нефти выделяется меньше углекислого газа, чем при сжигании угля, но больше углекислого газа, чем при сжигании природного газа. Большинство загрязняющих веществ, образующихся при сжигании угля, также являются побочными продуктами сжигания нефти. Природный газ Для сжигания природного газа требуется гораздо меньше воздуха из-за относительно низкого содержания углерода и большого количества водорода. При сжигании природного газа образуется меньше парниковых газов, которые считаются одним из основных источников глобального потепления.В эквивалентных количествах при сжигании природного газа образуется примерно на 30% меньше углекислого газа, чем при сжигании нефти, и на 45% меньше углекислого газа, чем при сжигании угля. Помимо выбросов диоксида углерода, сжигание газа создает выбросы NOx, в то время как выбросы диоксида серы (SO2) и твердых частиц незначительны. Другие виды топлива, включая древесину, дизельное топливо, бензин, пропан, бутан, биотопливо, такое как этанол и т. Д., Обладают собственными свойствами сгорания, которые влияют на эффективность сгорания и выбросы в процессе. | ||||||||||||||||||||||
Расход воздуха | ||||||||||||||||||||||
Поддержание надлежащего воздушного потока во время горения является основополагающим для обеспечения безопасного и полного сгорания. Общий воздушный поток включает воздух для горения, воздух для инфильтрации и воздух для разбавления. Воздух для горения Время, температура и турбулентностьПроцесс горения сильно зависит от времени, температуры и турбулентности.Время важно для сгорания, потому что, если топливу не дать достаточно времени для сгорания, в топливе останется значительное количество энергии. С другой стороны, слишком много времени для горения приведет к очень длинному пламени, что может быть следствием плохого перемешивания. Правильный баланс времени и смешивания приведет к полному сгоранию, минимизирует попадание пламени (опасность обслуживания котла) и повысит безопасность сгорания. Кроме того, правильно управляемый процесс сгорания стремится обеспечить максимальную эффективность сгорания при сохранении низкого уровня выбросов вредных газов. Избыточный воздух Для обеспечения полного сгорания в камерах сгорания используется избыточный воздух. Избыточный воздух увеличивает количество кислорода и азота, попадающего в пламя, увеличивая вероятность того, что кислород найдет топливо и вступит в реакцию с ним. Расчет избытка воздуха Как обсуждалось ранее, в стехиометрических (теоретических) условиях количество кислорода в воздухе, используемом для горения, полностью истощается в процессе горения.Следовательно, измеряя количество кислорода в выхлопных газах, покидающих дымовую трубу, мы можем рассчитать процент избыточного воздуха, подаваемого в технологический процесс. Для расчета избытка воздуха обычно используется следующая формула: | ||||||||||||||||||||||
| ||||||||||||||||||||||
Что такое черновик? Давление газов в дымовой трубе должно тщательно контролироваться, чтобы гарантировать, что все газы горения удаляются из зоны горения с правильной скоростью. Контроль тяги важен не только для повышения эффективности сгорания, но и для поддержания безопасных условий. Низкое давление тяги создает скопление высокотоксичных газов, таких как окись углерода и взрывоопасные газы. Эти отложения могут образовываться в камере сгорания или даже вентилироваться в помещении, создавая риск травмы или смерти.И наоборот, чрезвычайно высокое давление тяги может вызвать нежелательные завихрения в системе, препятствующие полному сгоранию. Нежелательное высокое давление тяги имеет тенденцию к повреждению материала камеры сгорания и теплообменника, вызывая столкновение с пламенем | ||||||||||||||||||||||
Котел — это закрытый сосуд, в котором вода нагревается и циркулирует в виде горячей воды, пара или перегретого пара с целью нагрева, питания и / или производства электроэнергии. | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Конденсационные котлы Конденсационный котел сохраняет энергию за счет использования теплообменников, предназначенных для отвода дополнительной энергии от газов сгорания перед тем, как покинуть дымовую трубу. | ||||||||||||||||||||||
Демонстрации — Горение в чистом кислороде
Демонстрации — Горение в чистом кислороде — Горящая шинаГорение в чистом кислороде,
Часть 1:
Горящая шина
Кислород составляет около 20% воздуха, которым мы дышим (и даже воздуха, которым мы дышим).
не дыши).При такой концентрации многие вещества реагируют с кислородом при горении .
реакции , часто с выделением тепла и света. Однако многие из
эти реакции горения протекают гораздо легче в атмосфере чистой
кислород.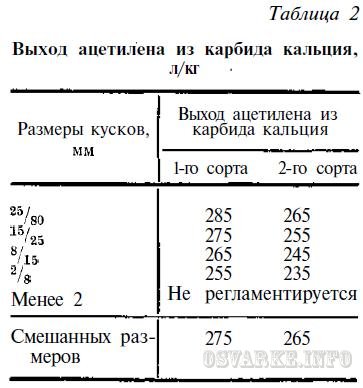
Реакция взаимодействия органических соединений (соединений, содержащих углерод) и кислорода с образованием углекислый газ и вода:
Органическое соединение + O 2 ——> CO 2 (г) + H 2 O (г)
Дерево, конечно, очень хорошо горит на воздухе, выделяя много тепла и света. (и дым).Красновато-желтый цвет пламени — результат неспособность твердой древесины очень хорошо смешиваться с газообразным кислородом в атмосфера; в результате также образуется элементарный углерод, который светится с красновато-желтым цветом. В присутствии чистого кислорода дерево горит еще быстрее.
На следующей демонстрации деревянную шину зажигают в горелке Бунзена, который затем помещается в сосуд с чистым кислородом. Пламя вспыхивает еще ярче, и шина горит гораздо быстрее, чем в нормальный воздух:
Видеоклип: НАСТОЯЩИЙ, 2.68 МБ
!!! Опасности !!!
Поджигание чего-либо сопряжено с риском
курс. Возьмите шину щипцами, а остальные
легковоспламеняющиеся прочь.
Возьмите шину щипцами, а остальные
легковоспламеняющиеся прочь.
Процедуры
н / д
Ссылки
Джон Эмсли, Элементы, 3-е изд. Оксфорд, Clarendon Press, 1998, стр. 148-149.
Дэвид Л. Хейзерман, Исследование химических элементов и их Соединения. Нью-Йорк: TAB Books, 1992, стр. 32-36.
Ацетилен | ILMO Products Company
Ацетилен (C
2 H 2 )Ацетилен — бесцветный и безвкусный газ с запахом чеснока. Он легко воспламеняется и может удушить.
Это один из топливных газов, используемых при кислородно-газовой сварке, представляющей собой любую сварочную процедуру, в которой топливный газ сочетается с кислородом для образования пламени.
Тепло и температура, производимые ацетиленовым пламенем, зависят от количества кислорода, использованного для его сжигания. Воздух-ацетилен дает температуру пламени около 4000 ° F (2200 ° C). Он достаточно горячий, чтобы паять алюминиевое рабочее стекло, ремонтировать радиаторы и паять сантехнику. Для сварки стали недостаточно горячего воздуха.
Воздух-ацетилен дает температуру пламени около 4000 ° F (2200 ° C). Он достаточно горячий, чтобы паять алюминиевое рабочее стекло, ремонтировать радиаторы и паять сантехнику. Для сварки стали недостаточно горячего воздуха.
Когда ацетилен сжигается в чистом кислороде, температура пламени может достигать 5730 ° F (3166 ° C). Однако температура пламени и количество выделяемого тепла (измеряемое как БТЕ или килограмм-калории) зависят от используемого отношения кислорода к ацетилену.Ацетилен может вызвать науглероживание, восстановительное, нейтральное и окислительное пламя.
Технические характеристики ацетилена можно найти в брошюре G-1.1 Ассоциации сжатых газов (CGA). Марка D (98,0%) считается «товарным» ацетиленом. Обычный сорт ацетилена составляет около 98,8%. Это стандартная сварочная марка ацетилена. Также доступен очищенный ацетилен (99,6%).
Внимание! Никогда не используйте ацетилен при давлении регулятора выше 15 фунтов на кв. Дюйм (изб.). Этот топливный газ чувствителен к ударам и может взорваться при более высоком давлении регулятора. Ацетилен не поставляется в виде жидкости по аналогичным причинам безопасности. Газ растворяется в ацетоне и подается в цилиндры с толстыми стенками, заполненные пористым упаковочным материалом.
Ацетилен не поставляется в виде жидкости по аналогичным причинам безопасности. Газ растворяется в ацетоне и подается в цилиндры с толстыми стенками, заполненные пористым упаковочным материалом.
Очищенный ацетилен (степень 26) подготовлен для использования в атомно-абсорбционных спектрофотометрах.
Безопасность
Ацетилен, смешанный с воздухом или кислородом в замкнутом пространстве, взорвется при воспламенении. Ацетилен разлагается со взрывом, если в трубопроводе давление превышает 15 фунтов на кв. Дюйм, и он подвергается механическому удару или источнику воспламенения.Ацетилен образует взрывчатые соединения с медью, серебром и ртутью. Используйте стальные трубы и фитинги, а также манометры со стальными или нержавеющими трубками Бурдона. Если используются медные сплавы, они должны содержать менее 65 процентов меди. Ацетилен имеет очень широкий диапазон воспламеняемости в воздухе от 2,5 до 81 процента по объему. Искры очень малой энергии, такие как статическое электричество, могут вызвать возгорание и взрыв.
Храните баллон с ацетиленом на открытом воздухе или в хорошо вентилируемых помещениях вдали от горячих поверхностей, легковоспламеняющихся материалов и источников воспламенения, таких как пламя или любое оборудование, которое может генерировать искру.Баллоны необходимо хранить в вертикальном положении. Запрещается ронять ацетиленовые баллоны или обращаться с ними так, чтобы повредить фильтр. Используйте только баллоны и оборудование, специально предназначенные для ацетилена. Никогда не пытайтесь заливать ацетилен в какой-либо другой контейнер, оборудование или трубопровод при давлении выше 15 фунтов на кв. Дюйм. Это можно сделать только на заправочных установках с соответствующими коллекторами, пламегасителями и баллонами с ацетоновым растворителем. Убедитесь, что все оборудование изготовлено из стали или латуни с содержанием меди менее 65 процентов.Также не может присутствовать серебро или ртуть там, где ацетилен может реагировать с ними.
Устраните любые утечки. Протекающие цилиндры, которые невозможно остановить, следует вынести на улицу и вернуть для ремонта.
Все электрооборудование должно быть взрывозащищенным. Инструменты, используемые для работы с ацетиленом, должны быть искробезопасными (требуется латунь или алюминиевая бронза). Предметы одежды, которые создают статические заряды, не следует носить там, где происходит объемная работа с ацетиленом и возможна утечка.
Работайте в хорошо вентилируемых помещениях.Ацетилен нетоксичен, но если он вытесняет кислород в воздухе до уровня ниже 19,5 процента, он может вызвать повреждение мозга и даже смерть. Однако ацетилен имеет характерный запах, который легко обнаруживается в низких концентрациях, поэтому появляется предупреждение о возможной опасности.
| Свойства топливного газа | |||||
| Безопасность | Ацетилен | Природный газ | Пропан | Пропилен | |
| Чувствительность к удару | нестабильно | нестабильно | Конюшня | Конюшня | |
| Пределы взрываемости по кислороду,% | 3. 0-93 0-93 | 5,0-59 | 2,4-57 | 2,3-55 | |
| Пределы взрываемости в воздухе,% | 2,5-80 | 5-15 | 2,2-9,5 | 1,9-11 | |
| Максимально допустимое давление регулятора, фунт / кв. Дюйм (кПа) | 15 (103) | Строка | Цилиндр | Цилиндр | |
| Скорость горения в кислороде фут / сек (мм / сек) | 22,7 (6097) | 15,2 (4633) | 12.2 (3718) | 15,4 | |
| Склонность к обратному эффекту | легкая | Значительный | легкая | легкая | |
| Токсичность | Низкий | Низкий | Низкий | Низкий | |
| Реакции с обычными материалами | Избегайте сплавов с содержанием меди более 67% | Несколько ограничений | Несколько ограничений | Несколько ограничений | |
| Удельный вес жидкости, (60/60 ° F) | – | – | 0. 507 507 | 0,5220 | |
| фунт / галлон жидкости при 60 ° F (кг / м 3 при 15,6 ° C) | – | – | 4,22 (506) | 5,0 (600) | |
| Ft 3 / фунт газа при 70 ° F (м 3 / кг при 21,1 ° C) | 14,7 (0,92) | 23,6 (1,4) | 8,6 (0,54) | 9,05 (0,57) | |
| Физические свойства | |||||
| Удельный вес (воздух = 1) @ 60 ° F (15.6 ° С) | 0,906 | 0,554 | 1,55 | 1.476 | |
| Давление пара при 20 ° C, кПа (70 ° F psig) | 635 (4378) | – | 120 (757) | 133 (916) | |
| Диапазон кипения ° F (° C) 1 атм | –84 | -259 | -44 БП | -54 БП | |
| Температура пламени в O 2 ° F (° C) | 5589 (3087) | 4600 (2538) | 4579 (2526) | 5193 (2867) | |
| Скрытая теплота парообразования при 25 ° C, БТЕ / фунт, (кДж / кг) | – | – | 184 (428) | 188 (437) | |
| Общая теплотворная способность (после испарения) БТЕ / фунт (кДж / кг) | 21 500 (50 000) | 23 900 (56 000) | 21 800 (51 000) | 21 100 (49 000) | |
| БТЕ / фут 3 (МДж / м 3 ) | 2404 (90) | 1470 (55) | 900-1000 (34-37) | 2498 (93) | 2371 (88) |


 Ацетилен легче воздуха, 1 м3 при 20°С и 760 мм рт. ст. имеет массу 1,091 кг/м3. Плотность по отношению к воздуху 0,9. Критическая температура 35,9°С и критическое давление 61,6 кгс/см2. При сгорании с кислородом он дает пламя с наиболее высокой температурой, которая достигает 3200°С, что объясняется его эндотермичностью (другие углеводороды экзотермичны, т. е. при распаде поглощают тепло). Химическая формула — C2H2, структурная формула Н-С=С-Н.
Ацетилен легче воздуха, 1 м3 при 20°С и 760 мм рт. ст. имеет массу 1,091 кг/м3. Плотность по отношению к воздуху 0,9. Критическая температура 35,9°С и критическое давление 61,6 кгс/см2. При сгорании с кислородом он дает пламя с наиболее высокой температурой, которая достигает 3200°С, что объясняется его эндотермичностью (другие углеводороды экзотермичны, т. е. при распаде поглощают тепло). Химическая формула — C2H2, структурная формула Н-С=С-Н.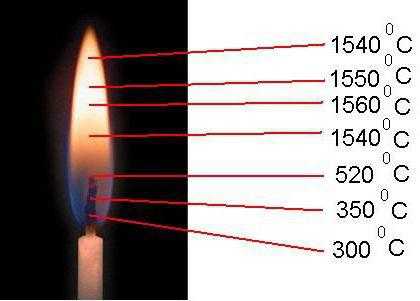 .. Для полного сгорания нового газа необходимо 2,5 объема кислорода. При этом образуются два объема углекислого газа и вода, которые являются единственными продуктами горения… Газ содержит столько же углерода, что и маслородный газ, но вдвое меньше водорода… Он удивительно подойдет для целей искусственного освещения, если только его удастся дешево получать.
.. Для полного сгорания нового газа необходимо 2,5 объема кислорода. При этом образуются два объема углекислого газа и вода, которые являются единственными продуктами горения… Газ содержит столько же углерода, что и маслородный газ, но вдвое меньше водорода… Он удивительно подойдет для целей искусственного освещения, если только его удастся дешево получать.
 К. (1986). Принципы горения . John Wiley & Sons, Нью-Йорк.
К. (1986). Принципы горения . John Wiley & Sons, Нью-Йорк.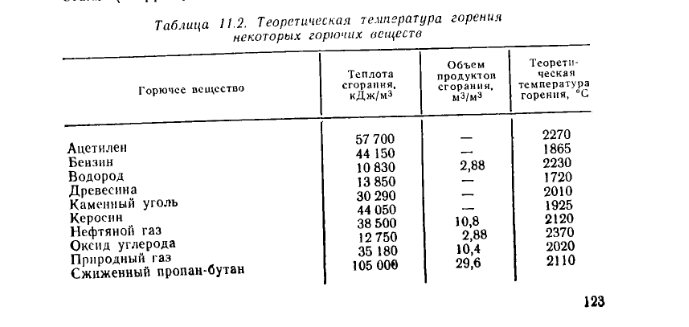
 Наряду с теплом в качестве побочных продуктов экзотермической реакции образуются CO2 (диоксид углерода) и h3O (вода).
Наряду с теплом в качестве побочных продуктов экзотермической реакции образуются CO2 (диоксид углерода) и h3O (вода).  Потери тепла неизбежны, что делает невозможным 100% -ный КПД.
Потери тепла неизбежны, что делает невозможным 100% -ный КПД.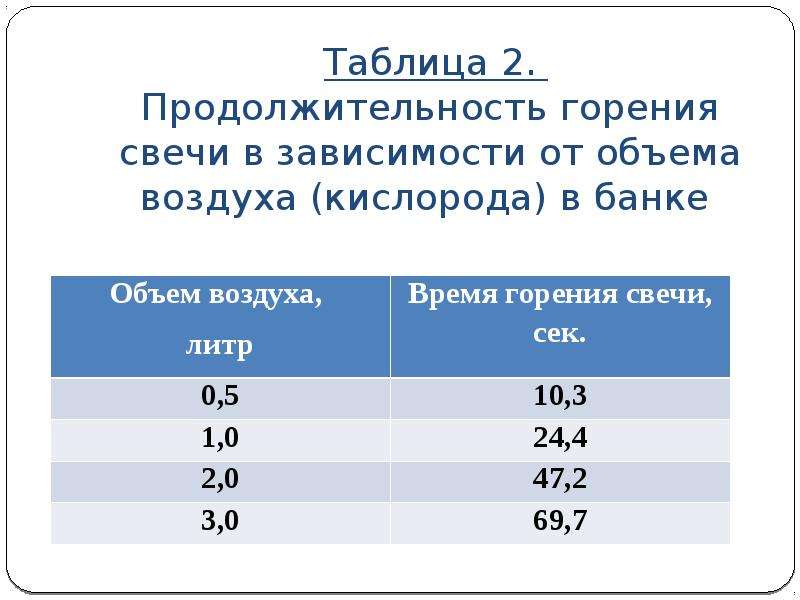
 Чем меньше CO остается в дымовом газе, тем ближе к полному сгоранию становится реакция. Это связано с тем, что токсичный газообразный монооксид углерода (CO) по-прежнему содержит очень значительное количество энергии, которую следует полностью сжечь.
Чем меньше CO остается в дымовом газе, тем ближе к полному сгоранию становится реакция. Это связано с тем, что токсичный газообразный монооксид углерода (CO) по-прежнему содержит очень значительное количество энергии, которую следует полностью сжечь. Количество воздуха для горения, необходимое для полного сжигания конкретного топлива, будет зависеть от этих характеристик, особенно от отношения C / h3.Чем выше содержание углерода в топливе, тем больше воздуха требуется для полного сгорания. При мониторинге эффективности процесса сгорания важно знать, какое топливо сжигается, поскольку эта информация поможет не только определить оптимальные рабочие условия котла, но и максимизировать эффективность котла.
Количество воздуха для горения, необходимое для полного сжигания конкретного топлива, будет зависеть от этих характеристик, особенно от отношения C / h3.Чем выше содержание углерода в топливе, тем больше воздуха требуется для полного сгорания. При мониторинге эффективности процесса сгорания важно знать, какое топливо сжигается, поскольку эта информация поможет не только определить оптимальные рабочие условия котла, но и максимизировать эффективность котла.
 Сжигание природного газа чище, чем сжигание нефти и угля. Когда газ сжигается с недостаточным количеством воздуха для горения, могут образоваться летучие углеводороды, которые могут стать угрозой безопасности; следует соблюдать осторожность, чтобы избежать опасных условий.
Сжигание природного газа чище, чем сжигание нефти и угля. Когда газ сжигается с недостаточным количеством воздуха для горения, могут образоваться летучие углеводороды, которые могут стать угрозой безопасности; следует соблюдать осторожность, чтобы избежать опасных условий.
 Существует два типа разбавляющего воздуха: естественный и искусственно созданный.
Существует два типа разбавляющего воздуха: естественный и искусственно созданный. Добавление избыточного воздуха также увеличивает турбулентность, что увеличивает перемешивание в камере сгорания. Повышенное смешивание воздуха и топлива дополнительно улучшит эффективность сгорания, давая этим компонентам больше шансов вступить в реакцию.Чем больше избыточного воздуха поступает в камеру сгорания, тем больше топлива сжигается, пока, наконец, не дойдет до полного сгорания. Большее количество избыточного воздуха создает меньшее количество CO, но также вызывает большие потери тепла. Поскольку уровни как CO, так и тепловых потерь влияют на эффективность сгорания, важно контролировать и контролировать избыточный воздух и уровни CO, чтобы обеспечить максимально возможную эффективность сгорания.
Добавление избыточного воздуха также увеличивает турбулентность, что увеличивает перемешивание в камере сгорания. Повышенное смешивание воздуха и топлива дополнительно улучшит эффективность сгорания, давая этим компонентам больше шансов вступить в реакцию.Чем больше избыточного воздуха поступает в камеру сгорания, тем больше топлива сжигается, пока, наконец, не дойдет до полного сгорания. Большее количество избыточного воздуха создает меньшее количество CO, но также вызывает большие потери тепла. Поскольку уровни как CO, так и тепловых потерь влияют на эффективность сгорания, важно контролировать и контролировать избыточный воздух и уровни CO, чтобы обеспечить максимально возможную эффективность сгорания. 
 Это давление тяги может быть положительным или отрицательным в зависимости от конструкции котла; Котлы с естественной тягой, уравновешивающей тягой и наддувной тягой являются наиболее распространенными в отрасли.
Это давление тяги может быть положительным или отрицательным в зависимости от конструкции котла; Котлы с естественной тягой, уравновешивающей тягой и наддувной тягой являются наиболее распространенными в отрасли. Топка котла — это место, где топливо и воздух вводятся для сжигания; Топливно-воздушные смеси обычно вводятся в топку с помощью горелок, в которых образуется пламя. Образующиеся горячие газы проходят через ряд теплообменников, где тепло передается воде, протекающей через них. Наконец, дымовые газы выбрасываются в атмосферу через дымовую трубу выхлопной секции котла.
Топка котла — это место, где топливо и воздух вводятся для сжигания; Топливно-воздушные смеси обычно вводятся в топку с помощью горелок, в которых образуется пламя. Образующиеся горячие газы проходят через ряд теплообменников, где тепло передается воде, протекающей через них. Наконец, дымовые газы выбрасываются в атмосферу через дымовую трубу выхлопной секции котла.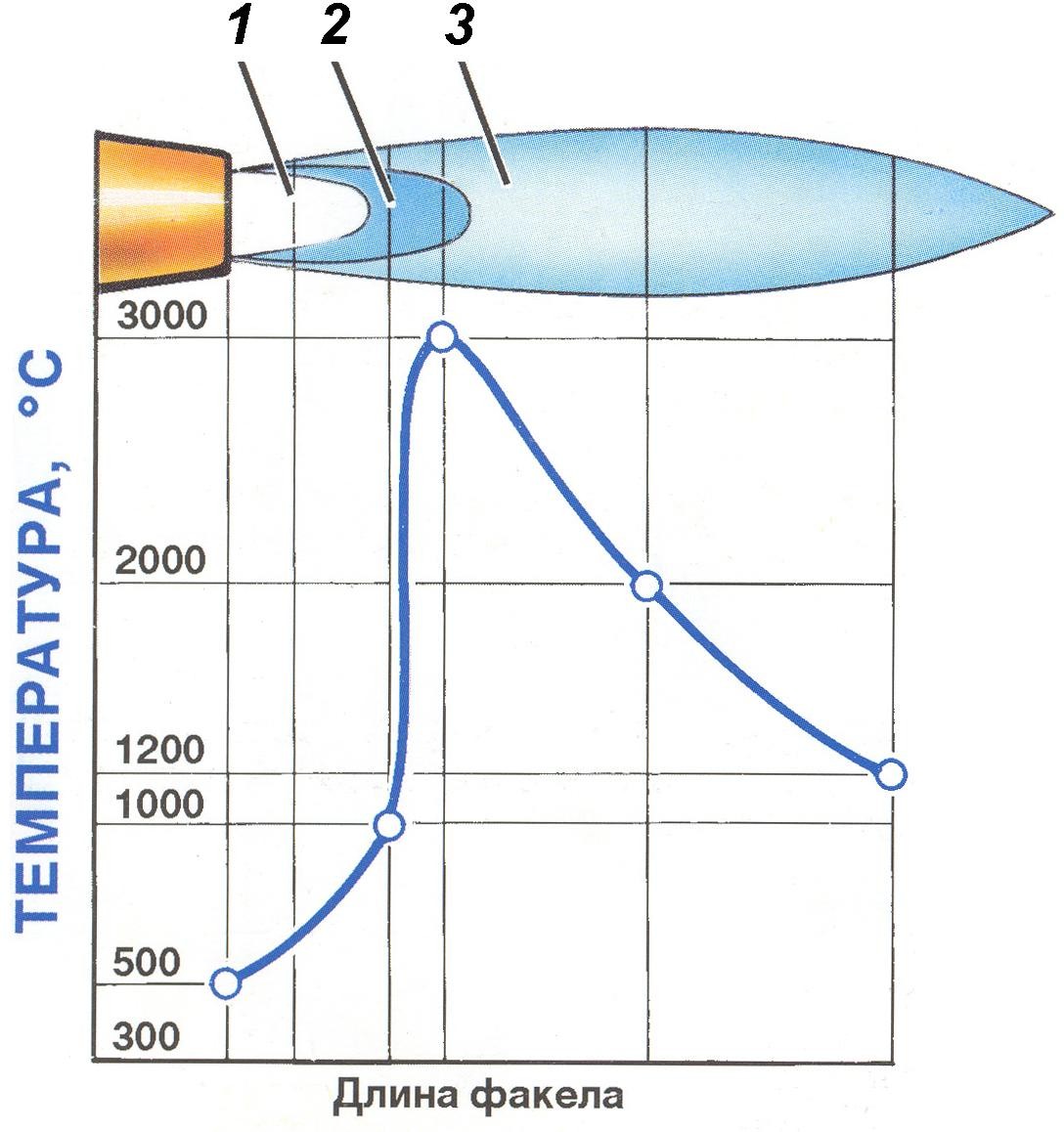 Дымовые газы, производимые конденсационными котлами, имеют гораздо более низкие температуры, чем у неконденсируемых котлов, поскольку водяной пар в дымовых газах конденсируется, высвобождая скрытую теплоту и повышая эффективность котла. Конденсационные котлы имеют КПД 95% или больше по сравнению с обычными 70% -80% для неконденсируемых котлов.
Дымовые газы, производимые конденсационными котлами, имеют гораздо более низкие температуры, чем у неконденсируемых котлов, поскольку водяной пар в дымовых газах конденсируется, высвобождая скрытую теплоту и повышая эффективность котла. Конденсационные котлы имеют КПД 95% или больше по сравнению с обычными 70% -80% для неконденсируемых котлов.