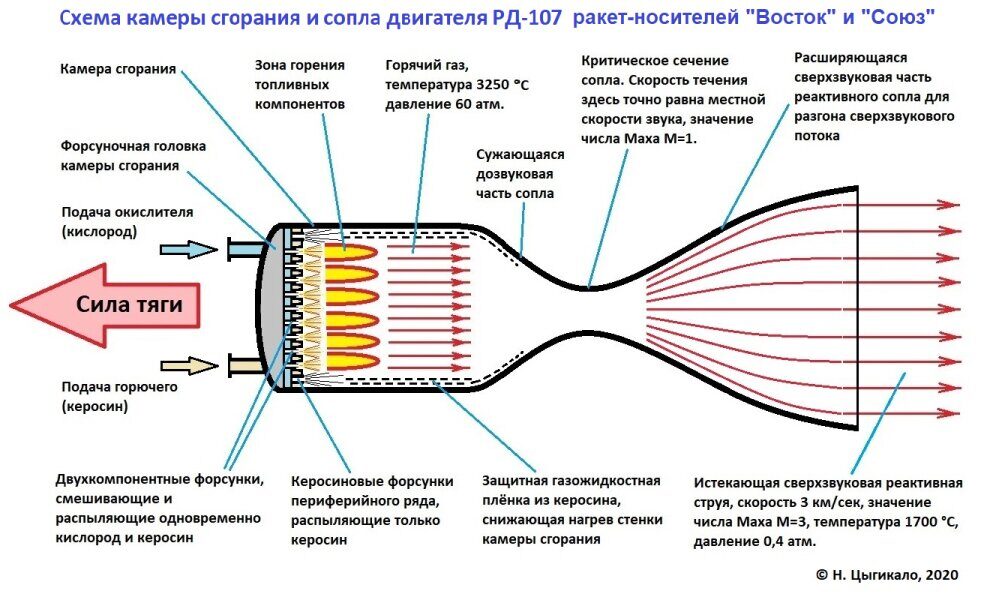
Горение углерода и кислорода
7. ГОРЕНИЕ УГЛЕРОДА И КИСЛОРОДА
На рис. 25 приведен теоретически рассчитанный химический состав звезды с массой 5M в стадии, предшествующей началу горения углерода. По оси x отложена доля от полной массы звезды, отсчитываемая от центра звезды. По оси y — доля массы химических элементов — углерода, гелия и водорода. Различные теоретические модели отличаются в деталях, однако общим для них является следующее:
В достаточно массивных звездах за фазой горения гелия
следуют фазы горения углерода (Z = 6), неона (Z = 10) и кислорода (Z = 8).
Поскольку эти ядра обладают достаточно большими зарядами и роль кулоновского
барьера существенно возрастает, требуются более высокие температуры, достижимые
лишь в массивных звездах. В массивных звездах углерод может гореть в условиях
термодинамического равновесия. На рис. 26 приведены теоретические расчеты
эволюции звезды с M=25M
на стадии горения углерода, неона и кислорода.
(T1/2 = 12.1 c)
Полное сечение реакции 12C + 12C
измерено в лабораторных условиях, начиная с энергии 2.4 МэВ. При этой энергии
сечение составляет ~ 10-8 барн. Температура горения углерода 8·108 K соответствует энергии E0 сталкивающихся частиц ~ 1.7 МэВ. При этой энергии экстраполированная величина
сечения составляет ~ 10
Характерные особенности реакций горения углерода и кислорода следующие:
|
Egida Ross — Что такое огонь?
Огонь — это химический процесс. Этот процесс известен как «Сгорание». Сгорание — это цепная реакция, химически подобная процессу «обратному» фотосинтезу. Для возникновения возгорания должны всегда присутствовать три элемента.
Эти три элемента:
- Горючий материал (топливо).
- Высокая температура.
- Кислород.
Огонь — это процесс, который требует, чтобы горючий материал (топливо) был подвергнут достаточно высокой температуре и имел доступ к кислороду.
ФАЗЫ ОГНЯ
Процесс горения делится на определенные стадии. Каждая фаза (или стадия) характеризуется различиями в комнатной температуре и атмосферном составе.
Начальная фаза (стадия роста)
В первой фазе значительно увеличивается содержание кислорода в воздухе, и огонь производит водяной пар, углекислый газ, возможно небольшое количество двуокиси серы, угарного газа и других газов. Вырабатывается некоторое количество тепла и это количество увеличится в процессе огня. Огонь может производить температуру пламени намного больше 10000F (5370C), однако температура в комнате на данном этапе может быть небольшая.
Свободно горящая фаза (полностью развитая стадия)
Вторая фаза горения охватывает все свободно горящие действия огня. Во время этой фазы богатый кислородом воздух вовлечен в пламя, поскольку конвекция (повышение горячих газов) несет высокую температуру к верхнему слою ограниченного пространства. Горячие газы распространяются сверху вниз, вынуждая более прохладный воздух искать более низкие уровни, и, в конечном счете, зажигают весь горючий материал в верхних уровнях комнаты. На данном этапе температура в верхних слоях может превысить 1,3000F (7000C). В то время как огонь прогрессирует через последние стадии этой фазы, он продолжает потреблять свободный кислород, пока он не достигает точки, где недостаточно кислорода, чтобы реагировать с топливом. Огонь тогда уменьшается до тлеющей фазы и нуждается только в поступлении кислорода, чтобы быстро вспыхнуть или взорваться.
На данном этапе температура в верхних слоях может превысить 1,3000F (7000C). В то время как огонь прогрессирует через последние стадии этой фазы, он продолжает потреблять свободный кислород, пока он не достигает точки, где недостаточно кислорода, чтобы реагировать с топливом. Огонь тогда уменьшается до тлеющей фазы и нуждается только в поступлении кислорода, чтобы быстро вспыхнуть или взорваться.
Тлеющая фаза (стадия распада)
В третьей фазе пламя может прекратиться, если область горения достаточно воздухонепроницаема. В этом случае горение уменьшается до тлеющих угольков. Комната становится полностью заполненной плотным дымом и газами до такой степени, что возникает избыточное давление и образуются трещины. Огонь продолжает тлеть, и комната полностью заполнится плотным дымом и газами сгорания при температуре 1,0000F (5370C). Сильный жар выпарит более легкие топливные фракции, такие как водород и метан от горючего материала в комнате. Эти топливные газы будут совместно с производными огня и далее увеличат опасность повторного возгорания и создадут возможность обратной тяги.
Классификация пожара
Огонь класса А — Огонь, включающий в себя обычные горючие материалы, такие как древесина, ткань, бумага, резина и много видов пластмасс.
Огонь класса B — Огонь, содержащий огнеопасные жидкости, жиры и газы.
Огонь класса C — Огонь, включающий энерго- и электрооборудование.
Огонь класса D — Огонь, включающий в себя горючие металлы, такие как магний, титан, цирконий, натрий и калий.
Огонь класса F — Класс F — это новая классификация огня с 1998 и здесь имеется ввиду возгорание горючего топлива, случаи возгорания в кулинарии, например растительные или животные жиры.
Природа огня
Огонь БЫСТРЫЙ. Времени крайне мало! Меньше чем за 30 секунд маленькое пламя может полностью выйти из-под контроля и превратиться в основной огонь. Для образования плотного слоя черного дыма требуется лишь несколько минут, чтобы заполнить дом, после чего он полностью будет охвачен огнем. Самые смертельные пожары происходят сами по себе в то время, пока люди спят. Если Вы почувствуете возгорание, то у Вас не будет времени, чтобы захватить какие-либо ценности, потому что огонь распространяется слишком быстро, и дым слишком плотный. У Вас будет время только на то, чтобы покинуть здание.
Если Вы почувствуете возгорание, то у Вас не будет времени, чтобы захватить какие-либо ценности, потому что огонь распространяется слишком быстро, и дым слишком плотный. У Вас будет время только на то, чтобы покинуть здание.
Пламя ГОРЯЧЕЕ. Высокая температура несет бо’льшую угрозу, чем огонь. Одна только высокая температура пламя может убить. Комнатная температура в огне может быть в 100 раз больше на уровне пола и в 600 раз на уровне глаз. Вдох этого супер-горячего воздуха опалит Ваши легкие. Эта высокая температура может расплавить одежду на Вашей коже. Через пять минут комната может стать такой горячей, что все в ней загорается сразу: это называется общая вспышка.
Огонь ТЕМНЫЙ. Огонь не яркий, он черный как смола. Огонь начинается яркой вспышкой, но быстро производит черный дым и, тем самым, создает полную темноту. Если Вы оказались в огне, Вы можете быть ослеплены, дезориентированы и неспособны найти выход из дома, в котором Вы жили в течение многих лет.
Огонь СМЕРТЕЛЕН. Дым и токсичные газы убивают больше людей, чем огонь. Огонь израсходовал кислород, в котором Вы нуждаетесь, и производит дым и ядовитые газы, которые убивают. Вдыхание даже небольшого количества дыма и токсичных газов может оказывать на Вас седативное действие, дезориентировать и нарушить дыхание. Бесцветные пары без запаха могут убаюкать Вас в глубокий сон прежде, чем огонь достигнет Вашей двери. Вы не сможете проснуться вовремя, чтобы убежать.
Скорость распространения огня
Огонь распространяется чрезвычайно быстро, у потенциальной жертвы есть крайне мало времени, чтобы выжить. Огонь может удваиваться в размере каждые 30 секунд. Всего через две минуты огонь может стать опасным для жизни. Через пять минут место жительства может быть охвачено огнем.
- Люди могут управлять огнем и потушить пожар в начальной стадии. Если человек находится уже в полностью развитой стадии возгорания, он не способен бороться с огнем. При полностью развитой стадии огня человек должен быстро бежать c места пожара.

- Однако, время начальной стадии слишком коротко. К сожалению, большинство людей не приучено к разыгрыванию надлежащих контрмер при внезапном возникновении огня. Почти все обычные огнетушители тяжелы и неудобны для использования.
- Все продукты Fire Fighter наоборот, могут использоваться быстро и легко.
Температура сгорания чистого кислорода
спросил
Изменено 6 лет, 10 месяцев назад
Просмотрено 32к раз
При какой температуре сжигается чистый кислород? Я думал об этом.
- сжигание
$\endgroup$
3
$\begingroup$
В других ответах подчеркивался тот факт, что кислород является не топливом, а окислителем. Я попытаюсь подчеркнуть еще один момент: нет однозначно определенной «температуры возгорания» для химического соединения . Это не похоже на фазовые переходы, такие как плавление и вскипание, которые происходят при фиксированной температуре и заданном давлении.
Я попытаюсь подчеркнуть еще один момент: нет однозначно определенной «температуры возгорания» для химического соединения . Это не похоже на фазовые переходы, такие как плавление и вскипание, которые происходят при фиксированной температуре и заданном давлении.
Температура процесса горения зависит от многих параметров, включая теплоту сгорания, соотношение воздуха и топлива, теплоемкость того и другого и начальную температуру. Одной из таких температур горения при определенных условиях является адиабатическая температура пламени. С другой стороны, температура самовоспламенения и температура вспышки являются характеристиками данного химического соединения; однако они не являются температурами горения.
$\endgroup$
1
$\begingroup$
Кислород сам по себе не топливо, это всего лишь окислитель. В горении участвуют топливо (например, ацетилен) и окислитель (здесь O 2 ). Итак, если у вас есть без топлива , но весь окислитель , то что остается гореть?
Итак, если у вас есть без топлива , но весь окислитель , то что остается гореть?
Горение — это просто название, которое мы даем некоторым реакциям. Суть в том, что горение и связанная с ним температура зависят от химической природы и стехиометрии реагентов. Когда пламя имеет более высокую температуру, чем другое, это означает, что обе реакции дают продукты с разными энтальпиями образования.
Чем больше разница между энтальпиями продуктов и реагентов, тем выше температура пламени.
$\endgroup$
$\begingroup$
Чистый кислород не горит. Кислород является сторонником горения, а не горючим материалом (топливом) сам по себе.
Реакции горения следующие:
$$\text{горючие вещества} \ce{+ O2 -> } \text{различные оксиды} + \text{тепло}$$
Обратите внимание, что закись азота ($\ce {N2O}$) также является сторонником горения, а это значит, что вы можете использовать его для проведения реакции горения без кислорода — но это только потому, что $\ce{N2O}$ сам генерирует кислород.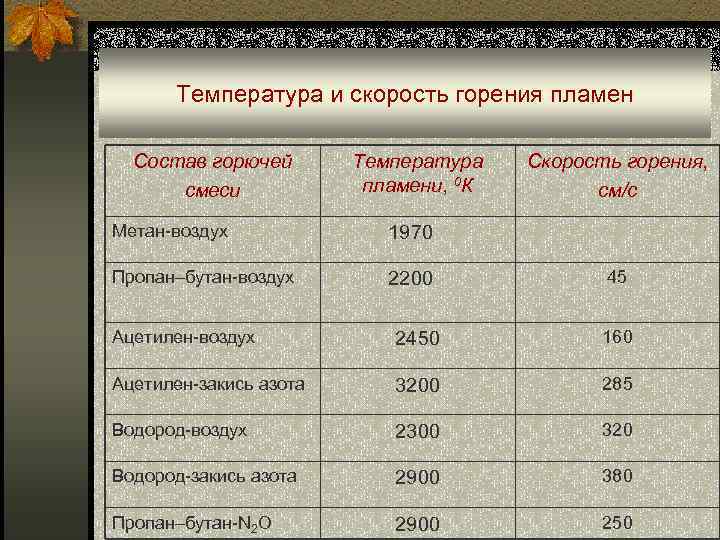


 24 МэВ)
24 МэВ) При дальнейшем росте давления и температуры ядра 20Ne разрушаются в результате реакции фоторасщепления 20Ne + γ→16O
+ α. Это происходит из-за малой энергии связи α-частицы в ядре 20Ne (
Eα(20Ne) ~ 4.73 МэВ ). Для сравнения укажем, что в ядре 16O энергия связи α-частицы составляет 7.2 МэВ.
При дальнейшем росте давления и температуры ядра 20Ne разрушаются в результате реакции фоторасщепления 20Ne + γ→16O
+ α. Это происходит из-за малой энергии связи α-частицы в ядре 20Ne (
Eα(20Ne) ~ 4.73 МэВ ). Для сравнения укажем, что в ядре 16O энергия связи α-частицы составляет 7.2 МэВ.