Сода кальцинированная техническая | компания ГлавХим г.Москва, Тула
Кальцинированная сода техническая (натрий углекислый, карбонат натрия) ГОСТ 5100-85 – выпускается в виде порошка или гранул белого цвета. Продукт с гигроскопичными свойствами, на открытом воздухе поглощает воду и углекислый газ, образуя кислую соль NaHCO3 и слеживаясь. Водные растворы кальцинированной соды обладают имеют сильно щелочной реакцией. Выпускается сода кальцинированная под марками А (гранулированная) и Б (порошкообразная).
Хранение:
Гарантийный срок хранения: марки А – 3 месяца, марки Б – полгода (6 месяцев), упакованной в мягкие специализированные контейнеры – 5 лет с даты изготовления.
Физико-химические показатели
|
Наименование показателя |
|
|||||
|
А |
Б |
|||||
|
Высший |
Первый |
Второй |
Высший |
Первый |
Второй |
|
|
1. |
Гранулы белого цвета |
Порошок белого цвета |
||||
|
2. Массовая доля углекислого натрия, %, не менее |
99.4 |
99.0 |
98.5 |
99.4 |
99.0 |
99.0 |
|
3. Массовая доля углекислого натрия в пересчете на непрокаленный продукт, %, не менее |
98. |
98.2 |
97.0 |
98.9 |
98.2 |
97.5 |
|
4. Массовая доля потери при прокаливании при 270-300°С, %, не более |
0.7 |
0.8 |
1.5 |
0.5 |
0.8 |
1. |
|
5. Массовая доля хлоридов в пересчете на NaCl, %, не более |
0.2 |
0.5 |
0.8 |
0.4 |
0.5 |
0.8 |
|
6. Массовая доля железа в пересчете на Fe2O2, %, не более |
0.003 |
0.005 |
0.008 |
0. |
0.003 |
0.008 |
|
7. Массовая доля не растворимых в воде веществ, %, не более |
0.04 |
0.04 |
0.08 |
0.03 |
0.04 |
0.08 |
|
8. Массовая доля сульфатов в пересчете на Na2SO4, %, не более |
0. |
0.05 |
— |
0.04 |
0.05 |
— |
|
9. Насыпная плотность, г/см³, не менее |
1.1 |
0.9 |
0.9 |
— |
— |
— |
|
10. остаток на сите с сеткой № 2К по ГОСТ 6613-86, %, не более прохождение через сито с сеткой № 1, 25К по ГОСТ 6613-86, %, не более остаток на сите с сеткой № 1К по ГОСТ 6613-86, %, не более прохождение через сито с сеткой № 01К, 25К по ГОСТ 6613-86, %, не более |
—
100
3
7 |
5
—
—
15 |
5
—
—
25 |
—
—
—
— |
—
—
—
— |
—
—
—
— |
|
11. |
Отсут-ствие |
— |
— |
— |
— |
|
Применение:
Сода кальцинированная марок А и Б применятеся в изготовлении стекол всех видов, в том числе:
- хрусталь;
- оптическое и медицинское стекло;
- стеклоблоки;
- пеностекло;
- силикат;
- натрий растворимый;
- керамическая плитка;
- компоненты фритт для глазурей.
Также применяется в черной и цветной металлургии в производстве:
- свинец;
- цинк;
- вольфрам;
- стронций;
- хром;
- десульфуризация и дефосфация чугуна;
- очистка отходящих газов;
- нейтрализация сред.

Сода кальцинированная | Химическая продукция ООО «Таблица Менделеева»
Применение
Сода кальцинированная (натрий углекислый, карбонат натрия) предназначается для химической, стекольной, электронной, целлюлозно-бумажной и других отраслей промышленности и поставки на экспорт.
В зависимости от назначения техническая сода кальцинированная должна изготовляться марок А и Б. Продукт марки А используется для производства электровакуумного стекла и других целей, марки Б — в химической, стекольной и других отраслях промышленности.
Требования безопасности
Сода кальцинированная пожаро- и взрывобезопасна, по степени воздействия на организм относится к веществам 3-го класса опасности.
Упаковка
Техническую кальцинированную соду марки А упаковывают в мягкие специализированные контейнеры разового использования, в четырех-, пятислойные бумажные мешки.
Транспортировка, хранение
Сода кальцинированная, упакованная в мешки, транспортируют всеми видами транспорта в крытых транспортных средствах. Транспортирование упакованного продукта по железной дороге осуществляется повагонными отправками. По согласованию с потребителем продукт марки А транспортируют в специальных вагонах (содовозах, сажевозах, цементовозах). Продукт марки Б насыпью транспортируют в специальных вагонах и автомобилях (содовозах, сажевозах, цементовозах), а также в крытых вагонах. Мягкие специализированные контейнеры по железной дороге транспортируют в полувагонах и крытых вагонах.
Транспортирование упакованного продукта по железной дороге осуществляется повагонными отправками. По согласованию с потребителем продукт марки А транспортируют в специальных вагонах (содовозах, сажевозах, цементовозах). Продукт марки Б насыпью транспортируют в специальных вагонах и автомобилях (содовозах, сажевозах, цементовозах), а также в крытых вагонах. Мягкие специализированные контейнеры по железной дороге транспортируют в полувагонах и крытых вагонах.
Сода кальцинированная хранится в закрытых складских помещениях, силосах, бункерах, предохраняя продукт от попадания влаги.
Гарантийный срок хранения продукта
Продукт марки А — 3 месяца, марки Б — 6 месяцев со дня изготовления, продукт, упакованный в мягкие специализированные контейнеры, — 5 лет со дня изготовления.
| Наименование показателя | Норма для марки и сорта | |||||
| А | Б | |||||
| Высший | Первый | Второй | Высший | Первый | Второй | |
| Внешний вид | Гранулы белого цвета | Порошок белого цвета | ||||
| Массовая доля углекислого натрия, %, не менее | 99,4 | 99,0 | 98,5 | 99,4 | 99,0 | 99,0 |
| Массовая доля углекислого натрия в пересчете на непрокаленный продукт, %, не менее | 98,7 | 98,2 | 97,0 | 98,9 | 98,2 | 97,5 |
| Массовая доля потери при прокаливании при 270–300°С, %, не более | 0,7 | 0,8 | 1,5 | 0,5 | 0,8 | 1,5 |
| Массовая доля хлоридов в пересчете на NaCl, %, не более | 0,2 | 0,5 | 0,8 | 0,4 | 0,5 | 0,8 |
| Массовая доля железа в пересчете на Fe2O2, %, не более | 0,003 | 0,005 | 0,008 | 0,003 | 0,003 | 0,008 |
| Массовая доля не растворимых в воде веществ, %, не более | 0,04 | 0,04 | 0,08 | 0,03 | 0,04 | 0,08 |
| Массовая доля сульфатов в пересчете на Na2SO4, %, не более | 0,04 | 0,05 | — | 0,04 | 0,05 | — |
| Насыпная плотность, г/см3, не менее | 1,1 | 0,9 | 0,9 | — | — | — |
Гранулометрический состав: остаток на сите с сеткой № 2К по ГОСТ 6613–86, %, не более прохождение через сито с сеткой № 1, 25К по ГОСТ 6613–86, %, не более остаток на сите с сеткой № 1К по ГОСТ 6613–86, %, не более прохождение через сито с сеткой № 01К, 25К по ГОСТ 6613–86, %, не более | — 100 3 7 | 5 — — 15 | 5 — — 25 | — — — — | — — — — | — — — — |
| Магнитные включения размером более 0,25 мм | Отсутствие | — | — | — | — | — |
Степень токсичности | — |
Основные свойства и виды опасности | |
Основные свойства | Гранулы или порошок белого цвета, растворимый в воде. |
Взрыво- и пожароопасность | Не взрывается, не горюча. |
Опасность для человека | Вдыхание пыли может вызвать раздражение дыхательных путей, конъюнктивит. При длительной работе с растворами возможны экземы; концентрированный раствор при попадании в глаза может вызвать ожег, невроз, а в последующем — помутнение роговицы. Едкий при увлажнении. |
Средства индивидуальной защиты | Респиратор типа ШБ-1 «Лепесток», ватно-марлевая повязка, защитные очки, защитный костюм. |
Кальцинированная техническая сода: состав, формула, характеристики
Кальцинированная сода (натрия карбонат, натрий углекислый) – вещество белого цвета в виде кристаллов или порошка. Оно знакомо многим домохозяйкам как отличное средство для уборки в доме, особенно на кухне или в ванной. В те времена, когда большого выбора средств бытовой химии не было, этим порошком мыли посуду, проводили дезинфекцию предметов, выводили пятна на одежде, избавлялись от накипи.
В те времена, когда большого выбора средств бытовой химии не было, этим порошком мыли посуду, проводили дезинфекцию предметов, выводили пятна на одежде, избавлялись от накипи.
Карбонат натрия был известен людям с очень давних пор. Еще до нашей эры этот минерал находили в природных источниках и использовали в разных целях. Первые положительные опыты по получению кальцинированной соды при сжигании определенного вида морских водорослей были проведены в 18 веке. Промышленное производство этого вещества началось еще в 1787 году. Затем почти через 100 лет химик Эрнест Сольве в Бельгии открыл новый способ производства, который отличался своей простотой и меньшей затратностью. Этот метод используется для изготовления большей части углекислого натрия и по сей день.
Содержание
- Свойства вещества
- Способы получения
- Виды кальцинированной соды
- Применение в промышленности
- Домашние рецепты
Свойства вещества
Сода кальцинированная представляет собой бесцветный порошок без запаха, хорошо растворимый в воде, но не растворяемый в ацетоне, этиловом спирте. Растворимость в воде сильно зависит от ее температуры, чем она выше, тем большая концентрация образуется. Карбонат натрия характеризуется свойством поглощать водяные пары из воздуха, поэтому при хранении на открытом воздухе слеживается, образуя плотные комки. Именно из-за этого свойства хранить его требуется в плотно укупоренной таре, не пропускающей воздух.
Растворимость в воде сильно зависит от ее температуры, чем она выше, тем большая концентрация образуется. Карбонат натрия характеризуется свойством поглощать водяные пары из воздуха, поэтому при хранении на открытом воздухе слеживается, образуя плотные комки. Именно из-за этого свойства хранить его требуется в плотно укупоренной таре, не пропускающей воздух.
Химическая формула углекислого натрия – Na2CO3. Он легко вступает в реакцию с кислотами с образованием углекислого газа и воды. При растворении в воде ее гидроксильная группа взаимодействует с натрием, в результате чего получается сильное основание – NaOH (едкий натр). Благодаря этому свойству, кристаллическая кальцинированная сода имеет славу хорошего чистящего средства.
При работе с этим средством стоит использовать защитные средства: перчатки, маску, очки. При попадании порошка или жидкости на кожу и слизистые можно получить химический ожог!
Способы получения
В современном мире имеется несколько методов синтеза кальцинированной соды. Самым экологичным из них является разработка минералов, в составе которых она содержится: натрон, трона, нахколит, термонатрит. Значимые месторождения этих веществ находятся в Соединенных Штатах Америки, Мексике, Канаде, африканских странах.
Самым экологичным из них является разработка минералов, в составе которых она содержится: натрон, трона, нахколит, термонатрит. Значимые месторождения этих веществ находятся в Соединенных Штатах Америки, Мексике, Канаде, африканских странах.
Первый промышленный способ получения углекислого натрия был запатентован французом Николя Лебланом. Он заключался в совместном плавлении сульфата натрия, карбоната кальция (мела) с древесным углем. В этой реакции образуются сульфид кальция, карбонат натрия. После завершения реакции полученный состав заливают водой, в котором сульфид кальция выпадает в осадок, а сода растворяется. Последующее выпаривание воды позволяет получить ее кристаллическую форму. На основании этого метода был построен завод, который производил около 100 килограммов кальцинированной соды в день.
Второй способ был предложен в Англии Хеммингом и Гаррисоном. Он заключается в пропускании через очищенную воду аммиака и углекислого газа с образованием гидрокарбоната аммония. К полученному веществу добавляли поваренную соль, что позволяло в реакции замещения получить гидрокарбонат натрия (пищевую соду), который с помощью нагревания превращался в карбонат натрия, воду и углекислый газ. Этот метод отличался некоторой сложностью и через некоторое время практически перестал использоваться.
К полученному веществу добавляли поваренную соль, что позволяло в реакции замещения получить гидрокарбонат натрия (пищевую соду), который с помощью нагревания превращался в карбонат натрия, воду и углекислый газ. Этот метод отличался некоторой сложностью и через некоторое время практически перестал использоваться.
Третий способ, который используется в современной промышленности и в наше время, был предложен и запатентован бельгийским химиком Сольве. Он немного отличается от метода англичан и заключается в пропускании аммиака, а затем углекислого газа через раствор хлорида натрия. В результате гидрокарбонат натрия при холодной температуре выпадает в осадок. Затем он подвергается фильтрованию и кальцинации при температуре 140−160 градусов. Плюсами этого способа является небольшая затрата энергии, достаточная экономичность и использование распространенных в природе веществ, таких как поваренная соль, мел или известняк, аммиак.
Существуют также другие методы получения кальцинированной соды, например, из содопоташных растворов, при переработке нефелинового сырья и в процессе электролиза воды и диоксида углерода с гидроксидом натрия. Эти способы имеют гораздо меньшее распространение из-за своей сложности или необходимости использования не слишком распространенных компонентов.
Небольшое количество карбоната натрия можно получить в домашних условиях. Для этого в нагретый раствор пищевой соды добавляют порошок извести или мела. После фильтрования получится раствор кальцинированной соды, который можно использовать для бытовых нужд.
Виды кальцинированной соды
Согласно технической документации, углекислый натрий выпускается в нашей стране в 2 видах: гранулированный (марка А) и порошкообразный (марка В). Различие этих форм кальцинированной соды прописано в государственных стандартах и зависит от цели ее дальнейшего использования. Кроме того, существует в каждой марке 3 сорта продукта: высший, первый и второй.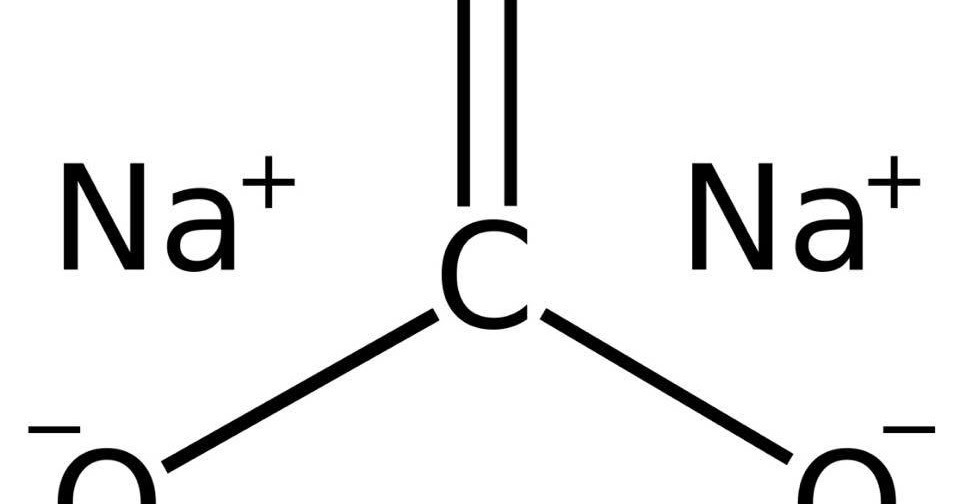 Различие между этими веществами заключается в чистоте состава, его плотности, размере полученных частиц, массовых долях сульфатов, хлоридов, железа и нерастворимых остатков. Продукт категории А имеет срок хранения 3 месяца, категории В – 6 месяцев, кроме случаев упаковки в специальные контейнеры. В таком виде срок хранения карбоната натрия достигает 5 лет.
Различие между этими веществами заключается в чистоте состава, его плотности, размере полученных частиц, массовых долях сульфатов, хлоридов, железа и нерастворимых остатков. Продукт категории А имеет срок хранения 3 месяца, категории В – 6 месяцев, кроме случаев упаковки в специальные контейнеры. В таком виде срок хранения карбоната натрия достигает 5 лет.
Вне зависимости от марки кальцинированной технической соды, согласно регламенту, она относится к 3 классу опасности (малоопасные вещества). Это означает, что воздействие этого вещества на окружающую природу не велико.
Применение в промышленности
Использование кальцинированной соды происходит на производстве большого количества продукции. В стекольной промышленности это вещество в зависимости от марки и сорта в больших количествах требуется для изготовления хрусталя, медицинских и оптических стеклянных изделий, строительных стеклоблоков. В металлургии оно нужно для получения чугуна, свинца, вольфрама, хрома. Химическая промышленность применяет карбонат натрия в изготовлении красок, пенопласта, средств бытовой химии, для пожаротушения. Производство текстиля использует соду для создания хлопчатобумажных тканей и шелка. Кроме того, данное вещество необходимо для производства резины, обработки кожи и изготовления кожзаменителей, мыловарения.
Производство текстиля использует соду для создания хлопчатобумажных тканей и шелка. Кроме того, данное вещество необходимо для производства резины, обработки кожи и изготовления кожзаменителей, мыловарения.
Такое широкое применение кальцинированной соды происходит благодаря ее дешевизне и доступности. Она может быть использована как составляющее вещество для химических реакций, а также в качестве катализатора процессов.
Домашние рецепты
В домашних условиях этот вид соды используется для смягчения жесткой воды. Для этого ее добавляют от 20 до 50 грамм (1,5-3,5 столовых ложки без горки) в расчете на 10 литров воды в зависимости от степени жесткости. В результате химической реакции соли кальция выпадут в виде осадка.
Сода отлично удаляет жирные пятна, краску, старую грязьДля стирки и кипячения белья требуется от 20 до 100 грамм вещества на 10 литров воды. Если стирка происходит в стиральной машине, то соду в количестве примерно 50 грамм можно добавить непосредственно в барабан вместе с бельем. При ручной – ее разводят в воде вместе со стиральным порошком. При этом важно учитывать рекомендации для стирки одежды на бирках (некоторые ткани можно испортить), а также температуру воды. Она должна быть не ниже 50 градусов.
При ручной – ее разводят в воде вместе со стиральным порошком. При этом важно учитывать рекомендации для стирки одежды на бирках (некоторые ткани можно испортить), а также температуру воды. Она должна быть не ниже 50 градусов.
Для очистки сантехники, кафельной плитки и других сильно загрязненных поверхностей 30−50 грамм кальцинированной соды разводят в одном литре воды. Затем с помощью губки, смоченной в этом растворе, протирают нужное место. После смывают водой и протирают насухо. Для такого применения стоит пользоваться резиновыми перчатками, чтобы не получить раздражение кожи.
Для мытья посуды соду растворяют в теплой воде из расчета 30−50 грамм на 1 литр. Такой раствор удаляет загрязнения и жир с поверхности посуды. После него требуется тщательное полоскание всех предметов в проточной воде.
Для избавления от накипи в чайниках столовую ложку соды добавляют в воду, затем полученная жидкость доводится до кипения и выливается в канализацию. Чайник после такой обработки нужно тщательно промыть водой перед использованием по назначению. В стиральных машинах справиться с проявлениями жесткой воды можно 3−4 столовыми ложками кальцинированной соды. Для этого порошок засыпают в барабан и включают режим стирки при 90−95 градусов без белья.
В стиральных машинах справиться с проявлениями жесткой воды можно 3−4 столовыми ложками кальцинированной соды. Для этого порошок засыпают в барабан и включают режим стирки при 90−95 градусов без белья.
При всех своих положительных качествах использование карбоната натрия не рекомендуется для следующих поверхностей:
- Деревянные.
- Кирпичные.
- Алюминиевые.
- Лакированные.
- Окрашенные.
- Стекловолоконные.
Это связано с сильной поверхностной активностью кальцинированной соды. Перечисленные выше поверхности неустойчивы к воздействию щелочной среды и могут быть испорчены.
Смотрите это видео на YouTube
Кальцинированная сода – агрессивное вещество! Ее нужно хранить в недоступных для детей и домашних животных местах. При попадании на кожу или слизистые оболочки порошка или концентрированного раствора нужно промыть пораженное место водой и немедленно обратиться за медицинской помощью.
Кальцинированная сода: формула и состав
Кальцинированная сода, формула которой известна с давних времен, уже давно применяется во многих сферах. Многие хозяйки используют ее в быту. Ведь кальцинированная сода – это моющее средство, натуральное и безопасное.
Многие хозяйки используют ее в быту. Ведь кальцинированная сода – это моющее средство, натуральное и безопасное.
Примерно лет 20 назад в каждом доме имелась упаковка этого удивительного средства. Что же собой представляет кальцинированная сода? Формула данного вещества — Na2CO3. По сути, это натриевая соль угольной кислоты. Это вещество представляет собой смесь мелких и крупных кристаллов белого цвета.
Стоит отметить, что порошок из окружающей среды поглощает влагу. В результате этого кальцинированная сода быстро слеживается. Поэтому рекомендуют хранить это вещество в закрытой емкости, а также в тех помещениях, где не очень высокий уровень влажности.
В промышленности для этого вещества существует ГОСТ. Сода кальцинированная выпускается согласно документу 5100 85, который был принят еще в советское время. Однако ГОСТ действует до сих пор. Согласно данной технологии, вещество делят на несколько марок: А и Б. По массовому содержанию определенных химических элементов эти составы отличаются.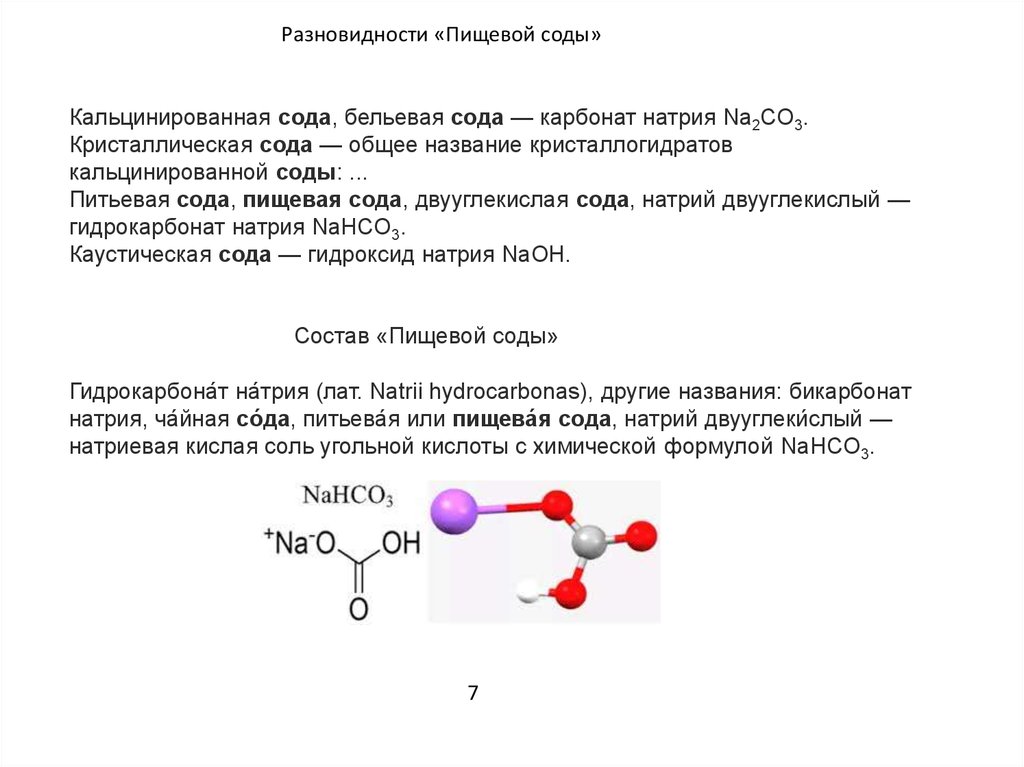 Это позволяет использовать каждую марку в отдельной отрасли промышленности.
Это позволяет использовать каждую марку в отдельной отрасли промышленности.
Как получают это средство?
Производство соды кальцинированной — это сложные химические процессы. Стоит отметить, что в природе в чистом виде это вещество существует, и это открытие было сделано в начале 19 века. Изначально его получали из золы, полученной в результате сожжения прибрежных растений, а также из некоторых водорослей. Конечно, человечество эволюционировало, и вместе с ним развились новые технологии. К тому же было обнаружено крупное место залегания этого вещества.
На данный момент кальцинированная сода, формула которой указана выше, изготавливается несколькими способами, такими как:
- Получение из природного вещества.
- Аммиачный метод.
- Получение из нефелинового сырья.
- Карбонизация натрия гидроксида.
Получение из природного сырья
Этот способ изготовления кальцинированной соды представляет собой новую промышленную отрасль. Она появилась относительно недавно, но стала основным конкурентом для тех, кто добывает это вещество аммиачным способом.
Стоит отметить, что метод был известен уже давно. Однако только в начале 20 века его смогли применить на практике. Началом для бурного развития данного направления стало открытие богатейших залежей соды (троны) в США.
Основан метод получения кальцинированной соды из природного сырья на переработке щелоков и рапы, которые образуются при растворении отложений соды. Стоит отметить, что помимо углекислого натрия в большинстве случаев удается выделить и другие компоненты, которые входят в состав исходных веществ.
Способ Леблана
Это еще один не менее популярный способ, позволяющий получить такое вещество, как сода кальцинированная. Состав данного вещества достаточно прост, и его легко выделить из других веществ. Этот способ основан на сплавлении смеси угля и сульфата натрия во вращающихся печах. Температура в них может достигать 1000°С. В результате этого процесса образуется содовый сплав – это сырая сода. После этого вещество подвергается выщелачиванию водой. Это требуется для извлечения из содового раствора соды.
Полученный раствор должен хорошо отстояться. Затем щелок очищают, выпаривают из него влагу, кальцинируют – прокаливают, а после измельчают в порошок. Как правило, для изготовления соды используют известняк, мел и соль.
Полезные свойства
Гост «Сода кальцинированная» 5100 85 не менялся на протяжении многих десятилетий. Благодаря разработанной технологии производства данное вещество обладает уникальными свойствами. Кальцинированная сода применяется не только в промышленности, но и в быту. Среди всех полезных качеств этого состава стоит выделить:
- Способность хорошо удалять старую грязь, краску, жирные пятна.
- Хорошо очищает раковины, кафель, фарфор, эмаль и керамику.
- Справляется практически с любыми засорами в трубах.
- Смягчает воду.
- Отстирывает даже застаревшие пятна с одежды.
- Позволяет побороть садовых вредителей.
- Хорошо дезинфицирует.
Вред соды
Сода кальцинированная, техническая обладает не только достоинствами. Это вещество имеет и некоторые недостатки. Конечно, нельзя сказать, что состав способен вызвать какой-либо вред. Это будет неправильно. Скорее неправильное применение кальцинированной соды может привести к возникновению каких-либо побочных эффектов. В результате появляются негативные отзывы о средстве.
Это вещество имеет и некоторые недостатки. Конечно, нельзя сказать, что состав способен вызвать какой-либо вред. Это будет неправильно. Скорее неправильное применение кальцинированной соды может привести к возникновению каких-либо побочных эффектов. В результате появляются негативные отзывы о средстве.
Чаще всего отмечается несоблюдение мер предосторожности, а также дозировок. Раствор кальцинированной соды – это агрессивное вещество. Ошибки в дозировках, а также нарушения процесса использования могут нанести здоровью человека вред. Поэтому при работе с веществом следует помнить о правилах безопасности. К тому же не стоит забывать о том, что кальцинированная сода подходит далеко не для всех материалов.
Меры предосторожности
Какими свойствами обладает сода кальцинированная? Состав вещества указывает на его безопасность. Поэтому кальцинированную соду часто используют в быту. Это вещество отличается белым цветом и кристаллической структурой. Раствор соды обладает сильно выраженным щелочным эффектом.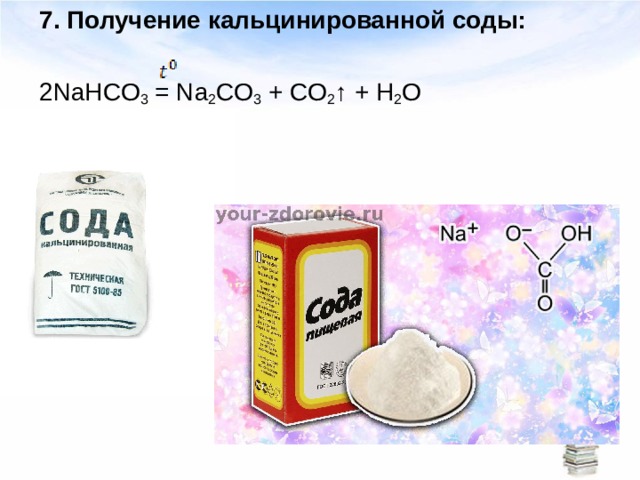 Однако само по себе вещество считается взрыво- и пожаробезопасным. Но из-за деятельности человека его относят к третьему классу.
Однако само по себе вещество считается взрыво- и пожаробезопасным. Но из-за деятельности человека его относят к третьему классу.
Сода кальцинированная, техническая – это химически активный состав. При работе с этим веществом следует соблюдать правила безопасности. Если сода попала на слизистую, то это может вызвать сильнейшее раздражение тканей. В некоторых случаях возникают даже ожоги. Если вещество попало на кожу или же в глаза, то рекомендуется промыть хорошо чистой водой пораженный участок.
Не стоит забывать, что кальцинированная сода поглощает влагу. В результате ее соединения с водой образуется агрессивный раствор. Поэтому не рекомендуется использовать кальцинированную соду в помещениях, где отмечен высокий показатель влажности воздуха.
Применение в промышленности
В промышленности часто используется сода кальцинированная. Характеристика и свойства этого вещества позволяют применять его во многих отраслях. Некоторые производственные процессы очень сложно представить без участия данного компонента. К основным областям применения кальцинированной соды в промышленности стоит отнести:
К основным областям применения кальцинированной соды в промышленности стоит отнести:
- Стекловарение.
- Целлюлозно-бумажное производство.
- Кожевенную и легкую промышленность.
- Черную металлургию.
- Глиноземную металлургию.
- Производство соды каустической.
- Нефтеперерабатывающую и нефтехимическую промышленность.
- Изготовление синтетических кислот.
Это вещество просто незаменимо. Кальцинированная сода применяется даже при производстве медикаментов. Его используют здесь в качестве средства для очистки, элемента для синтеза прочих химических компонентов и так далее.
Можно ли использовать в быту?
Кальцинированная сода используется многими хозяйками и в домашних условиях. Как было указано выше, это вещество представляет собой прекрасное чистящее и моющее средство. Кальцинированная сода способна очистить практически любые поверхности от жира. И все благодаря своим уникальным свойствам. К тому же это относительно дешевый аналог многих современных брендов бытовой химии. Эффективность кальцинированной соды проверена годами. Помимо этого вещество является безопасным и натуральным.
Эффективность кальцинированной соды проверена годами. Помимо этого вещество является безопасным и натуральным.
Этот состав часто используют для стирки, для удаления накипи и жира. Кальцинированная сода просто незаменима в быту. К тому же ее можно добавлять при стирки в стиральные порошок. Это позволит уберечь технику от накипи.
Борьба с вредителями
Используется кальцинированная сода в быту еще и для борьбы с садовыми вредителями. Для этого готовят простой раствор. На ведро чистой воды требуется не более 6 чайных ложечек кальцинированной соды. Готовым составом можно обработать виноградные лозы. Это средство защищает растения от серой гнили. Стоит отметить, что такой раствор подходит для обработки фруктовых растений. Вреда средство не наносит, но позволяет защитить растения от гусениц и прочих вредителей.
Помимо этого, раствор можно использовать для обработки огурцов, кабачков, дынь и капусты. Однако увлекаться кальцинированной содой не стоит. Чрезмерное ее количество вредит почве. Что, в свою очередь, может сильно повлиять на будущий урожай.
Что, в свою очередь, может сильно повлиять на будущий урожай.
В завершение
Кальцинированная сода представляет уникальное химическое соединение, которое используется человечеством на протяжении многих лет не только во многих отраслях промышленности, но и в быту. Если соблюдать все правила безопасности, то применение этого вещества не несет вреда здоровью. Кальцинированная сода не опаснее уксуса. А ведь он тоже при неправильном использовании способен навредить нашему организму.
Вряд ли кто-то задумывался над тем, что в производстве многих вещей, которые нас окружают, применяется кальцинированная сода. К тому же изготавливает ее из природного сырья. Многие чистящие и моющие средства, стиральные порошки и прочая дорогая бытовая химия, которая продается по высоким ценам, – это раствор кальцинированной соды, который был вида изменен и разбавлен определенными добавками.
Сода кальцинированная в МКР марка Б ГОСТ 5100-85 Сода кальцинированная техническая (натрий углекислый) – порошок или гранулы белого цвета.
 Химическая формула – Na2CO3. в Стерлитамаке (Сода кальцинированная)
Химическая формула – Na2CO3. в Стерлитамаке (Сода кальцинированная)- Россия
- Стерлитамак
- Основания (щелочи) и содопродукты
- Сода кальцинированная Сода кальцинированная в МКР марка Б ГОСТ 5100-85 Сода кальцинированная техническая (натрий углекислый) – порошок или гранулы белого цвета. Химическая формула – Na2CO3. в Стерлитамаке
Цена: 20 000 ₽
за 1 ед.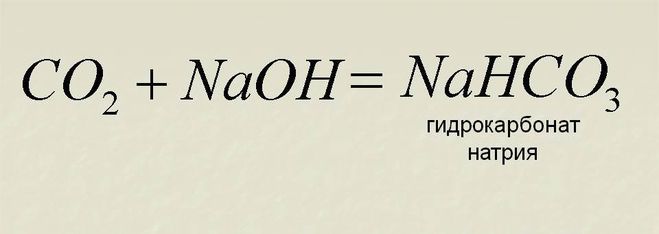
Описание товара
Сода кальцинированная в МКР марка Б
ГОСТ 5100-85 Сода кальцинированная техническая (натрий углекислый) — порошок или гранулы белого цвета. Химическая формула — Na2CO3.
Характеристики соды кальцинированной в МКР марка Б ГОСТ 5100-85 Сода кальцинированная техническая (натрий углекислый) – порошок или гранулы белого цвета. Химическая формула – Na2CO3.
- — Марка соды:: Б
«>Товары, похожие на Сода кальцинированная в МКР марка Б ГОСТ 5100-85 Сода кальцинированная техническая (натрий углекислый) – порошок или гранулы белого цвета. Химическая формула – Na2CO3.
Не надо медлить, закажите «Сода кальцинированная в МКР марка Б ГОСТ 5100-85 Сода кальцинированная техническая (натрий углекислый) – порошок или гранулы белого цвета. Химическая формула – Na2CO3.» от организации «ХимОптТрейд, ООО» на нашем портале БизОрг. Цена составляет 20000 ₽ при минимальном заказе в 1.
Почему следует выбрать «ХимОптТрейд, ООО», ООО»:
- гарантия качества и четкое выполнение взятых обязанностей;
- разнообразные способы оплаты;
- для пользователей торговой площадки BizOrg.Su организация «ХимОптТрейд, ООО» предоставляет выгодные условия;
- фирма «ХимОптТрейд, ООО» работает с известными производителями.
Ответы на популярные вопросы
- Информационное описание указано с неверной ценой, контактный номер телефона не отвечает и т.
 д.
д.Если у вас появились проблемы с «ХимОптТрейд, ООО», то напишите идентификаторы фирмы (852131) и услуги или товара (23321458). Наш отдел технической поддержки займется разрешением данной трудности.
- Как оформить заявку
Хотите «Сода кальцинированная в МКР марка Б ГОСТ 5100-85 Сода кальцинированная техническая (натрий углекислый) – порошок или гранулы белого цвета. Химическая формула – Na2CO3.»? Спишитесь с организацией «ХимОптТрейд, ООО» по контактным данным, которые указаны в правом верхнем углу страницы.
Обязательно укажите, что увидели фирму у нас – на площадке BizOrg.Su. - Где можно получить еще больше сведений о компании «ХимОптТрейд, ООО»
Чтобы узнать еще больше информации о фирме, перейдите в правом верхнем углу на ссылку с названием фирмы, после чего нажмите на нужную ссылку с описанием.
Общие сведения:
- дата размещения объявления: 19.02.2022;
- последнее изменение сведений – 19.02.2022;
- 69 – именно такое число посетителей увидело предложение с момента размещения.
 И ежедневно эта цифра увеличивается;
И ежедневно эта цифра увеличивается; - вы можете найти «Сода кальцинированная в МКР марка Б ГОСТ 5100-85 Сода кальцинированная техническая (натрий углекислый) – порошок или гранулы белого цвета. Химическая формула – Na2CO3.» в категориях «Промышленная химия, нефтехимия», «Неорганические соединения», «Основания (щелочи) и содопродукты», «Сода кальцинированная».
Обращаем ваше внимание на то, что торговая площадка BizOrg.su носит исключительно информационный характер и ни при каких условиях не является публичной офертой.
Заявленная компанией ХимОптТрейд, ООО цена товара «Сода кальцинированная в МКР марка Б ГОСТ 5100-85 Сода кальцинированная техническая (натрий углекислый) – порошок или гранулы белого цвета. Химическая формула – Na2CO3.» (20 000 ₽) может не быть окончательной ценой продажи. Для получения подробной информации о наличии и стоимости указанных товаров и услуг, пожалуйста, свяжитесь с представителями компании ХимОптТрейд, ООО по указанным телефону или адресу электронной почты.
Телефоны:
+7 3473333705
+7 9177921910
Купить соду кальцинированную в МКР марка Б ГОСТ 5100-85 Сода кальцинированная техническая (натрий углекислый) – порошок или гранулы белого цвета. Химическая формула – Na2CO3. в Стерлитамаке:
ул. Западная, д. 18
Сода кальцинированная в МКР марка Б ГОСТ 5100-85 Сода кальцинированная техническая (натрий углекислый) – порошок или гранулы белого цвета. Химическая формула – Na2CO3.Химическая формула соды: пищевой, питьевой, кристаллической, технической
Автор sdprks На чтение 5 мин. Просмотров 4.3k. Опубликовано Обновлено
Словом «сода» называют несколько сложных химических веществ. Пищевая, питьевая, гидрокарбонат натрия, химическая формула NaHCO3, кислая натриевая соль угольной кислоты. Кальцинированная, бельевая, карбонат натрия, химическая формула Na2CO3, натриевая соль угольной кислоты.
Каустическая, гидроксид натрия, химическая формула NaOH. Есть еще некоторые технические виды соды – кристаллогидраты, содержащие карбонат натрия, и различные марки каустика. Вышеперечисленные соединения имеют различные свойства и химические формулы. Но все они хорошо растворяются в воде, а их растворы имеют более или менее выраженную щелочную реакцию. Рассмотрим их подробнее.
Содержание
- Формула пищевой соды
- Растворяется ли пищевая сода в воде?
- Кальцинированная сода и ее кристаллогидраты
- Каустик и его технические марки
Формула пищевой соды
Гидрокарбонат натрия – химическое название белого кристаллического порошка белого цвета со средним размером кристаллов 0,05 — 0,20 мм. Синонимы, часто встречающиеся в научно-популярной литературе и в быту, — пищевая сода, чайная, питьевая, натрий двууглекислый, бикарбонат натрия.
Двууглекислый натрий (бикарбонат) – широко востребованное вещество в разных сферах жизни. Он применяется в химической промышленности и медицине, в легкой, пищевой отраслях, в металлургии. В пищевой промышленности сода включена в состав добавки E500.
Он применяется в химической промышленности и медицине, в легкой, пищевой отраслях, в металлургии. В пищевой промышленности сода включена в состав добавки E500.
Формула питьевой соды в химии NaHCO3 говорит о том, что это кислая натриевая соль угольной кислоты. Ее химические свойства как у соли сильного основания и слабой кислоты.
Гидрокарбонат натрия активно вступает в реакцию с кислотами. В результате образуется соль соответствующей кислоты, угольная кислота, которая в свою очередь распадается на углекислый газ и воду. Сильное образование пузырьков — это углекислый газ, высвобождающийся в процессе реакции.
Вот как происходит реакция с соляной кислотой:
NaHCO3 + HCl → NaCl + h3CO3
h3CO3 → h3O + CO2↑.
Реакция соды пищевой с уксусной кислотой:
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
В результате взаимодействия соды NaHCO3 с уксусной кислотой Ch4COOH образуются: Ch4COONa – ацетат натрия, вода h3O и углекислый газ CO2.
Многими, наверное, замечено, что если залить пищевую соду кипятком, она так же начинает гаситься, что выражается в обильном образовании пузырьков. Это происходит реакция термического разложения.
Гидракарбонат натрия термически малоустойчив. При нагревании порошок соды пищевой разлагается с образованием карбоната натрия (соды кальцинированной) и выделением диоксида углерода, а также воды в газовую фазу.
2NaHCO3↔ Na2CO3 + CO2 + h3O
Аналогично разлагаются и водные растворы бикарбоната натрия.
Растворяется ли пищевая сода в воде?
Есть 2 важные момента в растворении натрия гидрокарбоната в воде. Если мы растворяем соду притемпературе до 50 °С, происходит реакция гидролиза соли. Это обратимое взаимодействие соли с водой. Приводит к образованию слабого электролита.
А если растворяем соду в горячей воде, то уже образуется карбонат натрия, и в этом случае, водный раствор имеет сильнощелочную реакцию. Отсюда вывод: растворимость гидрокарбоната натрия в воде невелика, но при повышении температуры и она повышается.
Отсюда вывод: растворимость гидрокарбоната натрия в воде невелика, но при повышении температуры и она повышается.
При взаимодействии с водой двууглекислый натрий распадается на гидроксид натрия NaOH , который придает щелочность воде, угольную кислоту h3CO3, которая, в свою очередь, сразу же распадается на воду и углекислый газ h3O + CO2.
Химическая формула растворения соды в воде:
NaHCO3 + h3O ↔ h3CO3 (h3O + CO2) + NaOH
Водный раствор соды пищевой на растительные и животные ткани практически не действует.
Кальцинированная сода и ее кристаллогидраты
Карбонат натрия, или соду кальцинированную, натриевая соль угольной кислоты, не следует путать с содой пищевой. Химическая формула соды кальцинированной Na2CO3. Еще ее называют содой бельевой, потому что применяют в изготовлении моющих и чистящих средств бытовой химии. Добывается из природных кристаллогидратов путем термического разложения. Кальцинированная сода, безводный карбонат натрия, представляет собой бесцветный порошок.
Различные кристаллогидраты кальцинированной соды имеют свои названия:
- Натрит, натрон – декагидрат карбоната натрия. Химическая формула: Na2CO3 • 10h3O
- Термонатрит – моногидрат карбоната натрия. Химическая формула: Na2CO3 • h3O
Эти кристаллогидраты еще называют кристаллической содой, технической содой.
Каустическая сода, гидроксид натрия, химическая формула: NaOH. Ее еще называют едким натром, каустиком, едкой щелочью. Сильное основание, молекулы полностью диссоциируют в воде. Даже на воздухе то вещество начинает активно впитывать воду и «расплывается».
Опасная едкая щелочь может оставлять на коже сильные ожоги. Поэтому при работе с каустической содой необходимо соблюдать технику безопасности.
Применяется в быту, в химической, целлюлозно-бумажной промышленности, для производства мыла и био-дизельного топлива.
В России производится несколько видов технической соды – натра едкого:
- РД — раствор диафрагменный, бесцветная или окрашенная жидкость с массовой долей NaOH 44,0 % — 46,0 %;
- РХ — раствор химический с массовой долей NaOH 45,5 %, допускается небольшой осадок;
- РР — раствор ртутный, прозрачная жидкость с массовой долей NaOH 42,0 %;
- ТД — твердый диафрагменный, плавленая масса белого цвета с массовой долей NaOH 94,0 %;
- ТР — твёрдый ртутный, чешуированная масса белого цвета, с массовой долей NaOH 98,5 %.

Как видите, сода соде рознь. Принимать внутрь можно только пищевую, остальные виды — технические. Особенно осторожно необходимо обращаться с каустической содой. Это едкое агрессивное вещество оставляет долго незаживающие ожоги на коже. Поэтому, работать с растворами каустика нужно в защитной одежде, маске и резиновых перчатках.
Сода каустическая, стиральная и пищевая сода – приготовление, химическая формула, свойства
Соль представляет собой минерал, состоящий в основном из хлорида натрия (NaCl), химического компонента, принадлежащего к более широкому классу солей; каменная соль или галит – это соль в виде природного кристаллического минерала. Морская вода содержит большое количество солей. Соленость открытого океана составляет 3,5 % и около 35 граммов (1,2 унции) твердых веществ на литр морской воды. Соль производится путем выпаривания морской воды (морской соли) и богатой минералами родниковой воды в мелких бассейнах, а также из соляных шахт.
Сода каустическая и хлор являются ее основными промышленными продуктами; соль используется в различных промышленных процессах, включая производство поливинилхлорида, полимеров, бумажной массы и множества других изделий. Только около 6% ежегодно производимой в мире соли, составляющей около 200 миллионов тонн, используется для нужд человека.
Только около 6% ежегодно производимой в мире соли, составляющей около 200 миллионов тонн, используется для нужд человека.
Другие области применения включают очистку воды, удаление льда с дорог и использование в сельском хозяйстве. Морская соль и поваренная соль, например, являются пищевыми солями, которые обычно содержат агент, препятствующий слеживанию, и могут быть йодированы для предотвращения нехватки йода. Натрий служит электролитом и осмотическим раствором, что делает его важным питательным веществом для здоровья человека. Чрезмерное потребление соли детьми и взрослыми может повысить риск сердечно-сосудистых заболеваний, таких как гипертония. В результате несколько международных организаций здравоохранения и специалисты в промышленно развитых странах советуют отказаться от соленой пищи. По данным Всемирной организации здравоохранения, взрослые должны принимать менее 2000 миллиграммов натрия в день или 5 граммов соли.
Каустическая сода (гидроксид натрия)
Едкий натр, часто известный как щелочь, представляет собой щелочную соль.
Гидроксид натрия известен под этим термином. Такое название она получила за коррозионное воздействие этой соли на ткани животных и растений. Его можно использовать по-разному. NaOH — это химическая формула гидроксида натрия.
Получение каустической соды:
Гидроксид натрия можно получить различными способами, включая:
- Процесс Кастнера-Келлнера
- Мембранная ячейка Нельсона
- Процесс Лёвига
Процесс Кастнера-Келлнера:
Принцип: Электролиз соляного раствора используется в процессе Кастнера-Келлнера для получения гидроксида натрия.
Ячейка Кастнера-Кельнера: Прямоугольный стальной резервуар из стали. Бак облицован эбонитом. Анод — титан, а катод — слой ртути на дне резервуара.
Реакция, вызывающая ионизацию соляного раствора, следующая:
2NaCl → 2Na + + 2Cl −
Ионизация происходит при контакте соляного раствора с электрическим током. В результате к электродам притягиваются как положительные, так и отрицательные ионы. Амальгама натрия образуется при осаждении ионов натрия на ртутном катоде. Ионы хлора перемещаются от верхней части ячейки к аноду.
В результате к электродам притягиваются как положительные, так и отрицательные ионы. Амальгама натрия образуется при осаждении ионов натрия на ртутном катоде. Ионы хлора перемещаются от верхней части ячейки к аноду.
- Реакция на аноде:
2Cl − → Cl 2 + 2e —
- Реакция на катоде:
2NA + + 2E — → 2NA
Формирование NAOH: АМАЛГАМ затем перемещается в камеру. Он обрабатывается водой в денюдере для получения раствора гидроксида натрия. При испарении раствора образуется твердый гидроксид натрия. Получение чистой каустической соды – очень эффективный метод.
Свойства каустической соды:
- Это белое твердое вещество с температурой плавления 591 градус Цельсия.
- Это долговечное вещество.
- NaOH горький и мыльный на ощупь.
- Обладает высокой растворимостью в воде и умеренной растворимостью в спирте.

- Гидроксид натрия является щелочным веществом.
Использование каустической соды
- Это чистящее средство, которое также используется для производства стиральной соды.
- В некоторых лабораториях в качестве реагента также используется гидроксид натрия.
- Ключевой ингредиент в производстве натронной извести.
- Используется для очистки бокситов с целью получения алюминия.
Сода для стирки (карбонат натрия)
Сода для стирки используется в различных областях, от бытового до промышленного. Это щелочное вещество с сильным щелочным характером, которое может удалить стойкие пятна с текстиля во время стирки. Формула соды для стирки Na 2 CO 3 .10H 2 O. Карбонат натрия — это химический термин, обозначающий соду для стирки. Кальцинированная сода в химическом отношении представляет собой гидратированную соль карбоната натрия.
Получение карбоната натрия:
Для синтеза карбоната натрия требуется метод Solvay, этапы производства карбоната натрия описаны ниже:
Стадия 1: Очистка рассола концентрированный рассол, в то время как осаждение удаляет примеси, такие как кальций, магний и другие минералы. Концентрированный солевой раствор фильтруется перед смешиванием с аммиаком в аммиачной колонне, которая затем охлаждается.
Концентрированный солевой раствор фильтруется перед смешиванием с аммиаком в аммиачной колонне, которая затем охлаждается.
Стадия 2: Образование гидрокарбоната натрия
Углекислый газ транспортируется через аммонизированный соляной раствор в колонне сатурации.
NH 3 + CO 2 + NACL + H 2 O → NAHCO 3 + NH 4 CL
Шаг 3: Формация NAHARATE
The SODIUM BICBANATABONATABEBANTATAB ), который образуется, собирается из колонны и нагревается до 300°C. В результате образуются кристаллы карбоната натрия.
2NaHCO 3 → Na 2 CO 3 + CO 2 + H 2 O
Step 4: Recovery of ammonia
By treating an NH 4 Cl solution with Ca( OH) 2 , аммиак может быть восстановлен. В процессе Solvay снова используется этот аммиак, и в качестве побочного продукта получается CaCl 2 .
2NH 4 Cl + Ca(OH) 2 → 2NH 3 + CaCl 2 + H 2 O
Свойства карбоната натрия:
- Это кристаллическое твердое вещество белого цвета.
- Он поставляется в моногидратированном (NA 2 CO 3 .10H 2 O), Бесволющий (NA 2 CO 3 ), Heptahydrous (NA 2 CO 3 6060606060.7. O) и декагидратные (Na 2 CO 3 .7H 2 O) формы (Na 2 CO 3 .10H 2 O).
- В природе карбонат натрия является основным веществом.
- Температура плавления 851 градус Цельсия.
- Теряет воду при нагревании и образует безводную соль (кальцинированную соду).
Na 2 CO 3 .10H 2 O → Na 2 CO 3 .H 2 O → Na 2 CO 3 (at 373 K)
Uses Стиральная сода:
- В промышленности и быту используется как чистящее средство.

- Он используется, в частности, в производстве бумаги, текстиля, мыла и моющих средств.
- Используется в процессе умягчения воды.
- Материал, используемый в производстве стекла.
- В прачечных это один из наиболее важных агентов.
Пищевая сода (бикарбонат натрия)
Бикарбонат натрия также известен как пищевая сода. Химическая формула пищевой соды: NaHCO 3 .
Бикарбонат натрия — другое название пищевой соды. Натрон, природное месторождение, состоящее в основном из Na 2 CO 3 , был впервые добыт средневековыми египтянами. Его использовали как мыло. Николя Леблан, французский химик, впервые создал NaHCO 3 в 1971 году. В 1846 году Джон Дуайт и Остин Черч основали завод по производству пищевой соды, использующий карбонат натрия и диоксид углерода.
Различные применения химии можно найти в каждой комнате дома, включая ванную, кухню и так далее. Бикарбонат натрия является одним из таких веществ, которое широко используется благодаря своей универсальности, полезности и низкой стоимости.
Бикарбонат натрия является одним из таких веществ, которое широко используется благодаря своей универсальности, полезности и низкой стоимости.
Приготовление пищевой соды:
В промышленном мире процесс Solvay используется для производства бикарбоната натрия и карбоната натрия. В качестве сырья в этом процессе используются углекислый газ, вода, аммиак и концентрированный солевой раствор. Этот метод предпочтительнее, потому что он дешевле и требует меньше сырья для создания необходимых химикатов. Пищевая сода и карбонат натрия производятся в результате химической реакции, которая выглядит следующим образом:
CO 2 + H 2 O + NH 3 + NACL → NAHCO 3 + NH 4 CL
2 NAHCO 3 → NA 2 CO 3 + CO 9999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999. 2 2 . 2 O
Образовавшийся диоксид углерода перерабатывается для производства NaHCO 3 .
Свойства бикарбоната натрия:
- Негорюч.
- Порошковая пыль не так взрывоопасна, как другие виды пыли.
- Температура плавления 50 градусов.
- NaHCO 3 представляет собой белое кристаллическое вещество без запаха.
- Это фундаментальная природа.
Использование пищевой соды:
- Снижает кислотность желудка и действует как антацид, облегчая дискомфорт в желудке и расстройство желудка.
- В качестве смягчителя воды используется в процессе стирки.
- Используется в огнетушителях, так как образует мыльную пену.
- Действует как пестицид, удаляя грязь с материалов, не влияя на их свойства.
- Образуется двуокись углерода (при разложении NaHCO 3 ), которая способствует подъему теста в хлебопекарной промышленности.
- Содержится в ушных каплях, косметике и других предметах личной гигиены.
- Используется для противодействия действию кислоты, действуя как нейтрализатор.

Примеры вопросов
Вопрос 1: Какую роль в процессе промышленной очистки играет каустическая сода?
Ответ:
Каустическая сода используется для очистки технологического оборудования и резервуаров для хранения, поскольку она растворяет жир, белковые отложения, жиры и масла при смешивании с водой и нагревании.
Вопрос 2: Каковы риски для здоровья, связанные с едким натром?
Ответ:
NaOH чрезвычайно едкий и неприятный. Он вызывает сильные ожоги кожи.
Вопрос 3: Напишите любые два основных применения едкого натра.
Ответ:
Ниже приведены некоторые области применения каустической соды:
- В производстве продуктов на основе нефти.
- Используется в целлюлозно-бумажной промышленности.
Вопрос 4: Какие четыре стадии проходят при производстве карбоната натрия?
Ответ:
Следующие четыре этапа используются для получения карбоната натрия:
- Очистка рассола
- Образуется гидрокарбонат натрия.
- Образуется карбонат натрия.
- Аммиак восстановлен.
Вопрос 5: Напишите любые два способа использования стиральной соды.
Ответ:
Стиральная сода используется:
- В промышленности и дома она используется в качестве чистящего средства.
- Он используется, в частности, в производстве бумаги, текстиля, мыла и моющих средств.
Вопрос 6: Каковы свойства бикарбоната натрия?
Ответ:
Ниже приведены свойства бикарбоната натрия:
- Он негорюч.
- Порошковая пыль не так взрывоопасна, как другие виды пыли.
- Температура плавления 50 градусов.
- NaHCO 3 представляет собой белое кристаллическое вещество без запаха.
- Это фундаментальная природа.
Вопрос 7: Как используют пищевую соду?
Ответ:
Ниже приведены области применения пищевой соды:
- Снижает кислотность желудка и действует как антацид, облегчая дискомфорт в желудке и расстройство желудка.
- В качестве смягчителя воды используется в процессе стирки.
- Используется в огнетушителях, так как образует мыльную пену.
- Действует как пестицид, удаляя грязь с материалов, не влияя на их свойства.
- Образуется двуокись углерода (при разложении NaHCO 3 ), которая способствует подъему теста в хлебопекарной промышленности.
- Содержится в ушных каплях, косметике и других предметах личной гигиены.
- Используется для противодействия действию кислоты, действуя как нейтрализатор.
Знакомство с пищевой содой
Бикарбонат натрия (NaHCO 3 ), также называемый пищевой содой, представляет собой кристаллическую соль, встречающуюся в природной минеральной форме в месторождениях нахколита. Наука о пищевой соде имеет долгую и интересную историю. Впервые выделен Николя Лебланом в 179 г.0s, только когда в 1860-х годах был введен процесс Solvay, промышленное производство стало возможным. 1 Сегодня эта химическая электростанция производится по всему миру с расчетным объемом 2 миллиона тонн в год. 2
1 Сегодня эта химическая электростанция производится по всему миру с расчетным объемом 2 миллиона тонн в год. 2
Наука о пищевой соде, этой непритязательной соли, имеет множество применений в быту и промышленности, в том числе в качестве пищевой добавки, лекарства и чистящего средства. Он также находит применение в фейерверках, огнетушителях, фунгицидах и пестицидах и может иметь новую полезность для компаний, стремящихся уменьшить воздействие на окружающую среду.
Jekyll and Hyde Compound
Одним из наиболее распространенных применений пищевой соды является приготовление пищи, часто в качестве разрыхлителя в выпечке. Химическая закваска требует кислотного катализатора в жидком тесте, такого как йогурт или пахта. При контакте с бикарбонатом натрия это вызывает выделение углекислого газа в результате простой кислотно-щелочной реакции. 3 В качестве альтернативы пищевая сода может выделять меньшие объемы двуокиси углерода без кислоты просто в процессе термического разложения при температуре выше 50°C, хотя это обычно оставляет характерный горький привкус. В любом случае выделение газа в смесь во время приготовления меняет плотность и текстуру блюда.
В любом случае выделение газа в смесь во время приготовления меняет плотность и текстуру блюда.
При проглатывании различными путями газообразующее свойство пищевой соды (бикарбоната натрия) может вызывать очень разные эффекты. Для людей с кислотным рефлюксом бикарбонат натрия может действовать как антацид для успокоения желудка. Он также может избавиться от нежелательных тараканов, поскольку кормление их смесью бикарбоната и сахара за холодильником может привести к взрыву их внутренних органов.
—————————————-
Найдите статьи о пищевой соде в ACS Publications
—————————————-
История пищевой соды
В 1927 году Journal of Chemical Education сообщил, что пищевую соду можно использовать для предотвращения простуды путем поддержания щелочного баланса в организме с помощью регулируемых доз бикарбоната натрия вместе с небольшими дозами. количества кальцидина и йода. 4 Сегодня мы знаем, что пищевая сода не только обладает антибактериальными свойствами, но и может изменять восприимчивость бактерий к антибиотикам, воздействуя на протонную движущую силу, что делает ее потенциальным новым оружием в гонке вооружений против устойчивости к антибиотикам, возможно, в качестве вспомогательного средства. к антибактериальной терапии. 5
к антибактериальной терапии. 5
Пищевая сода (бикарбонат натрия) уже давно используется для решения многих домашних дел — от полировки серебра до удаления плесени с занавески для душа. Он также часто используется для нейтрализации неприятных запахов, что может быть очень полезно в библиотеке для поглощения затхлых запахов от старых или сильно использованных книг. Пищевая сода может использоваться даже для консервации старой или хрупкой бумаги с высоким содержанием кислоты, где она может действовать как нейтрализатор и буфер против дальнейшего разложения.
Применение в будущем
Новое исследование пищевой соды сосредоточено на более широком применении чистящих и абсорбирующих свойств пищевой соды. В производстве фруктов он оказался полезным для более эффективного удаления пестицидов с поверхности яблок, чем коммерческие дезинфицирующие средства. 6 Это связано с химическим разложением пестицида при контакте с бикарбонатом натрия. 6 Также может иметься потенциал очистки в промышленных масштабах для угольных электростанций и других промышленных объектов, где бикарбонат натрия может быть использован в качестве экономически эффективного решения для нейтрализации дымовых газов, действуя как для сокращения выбросов в атмосферу, так и для получения товарного продукта. . 7,8
6 Также может иметься потенциал очистки в промышленных масштабах для угольных электростанций и других промышленных объектов, где бикарбонат натрия может быть использован в качестве экономически эффективного решения для нейтрализации дымовых газов, действуя как для сокращения выбросов в атмосферу, так и для получения товарного продукта. . 7,8
30 декабря даже отмечается Национальный день бикарбоната соды. Этот день, посвященный науке о пищевой соде, правильно подобран по времени, учитывая всю выпечку, которую мы потребляем в праздничные дни, и часто неизбежное расстройство желудка, которое приходит с ним. Ясно, что эта скромная соль имеет множество применений, и нет никаких признаков того, что ее полезность в нашем современном мире уменьшается. Как мы видели в этом взгляде на науку о пищевой соде, это трудолюбивое соединение определенно заслужило свой день празднования!
- Кифер, Дэвид М. Кальцинированная сода, стиль Solvay. (по состоянию на 05 февраля 2018 г.
 ).
). - ОЭСР МОРАГ. Бикарбонат натрия (по состоянию на 5 февраля 2018 г.).
- Разработка разрыхлителя: национальная историческая химическая достопримечательность. (по состоянию на 05 февраля 2018 г.).
- Научная служба. J Chem Ed 1927;4 (12):1492.
- Фарха и др. АСУ Infect Dis 2017; DOI: 10.1021/acsinfecdis.7b00194.
- Ян и др. J Agric Food Chem 2017;65:9744−9752
- Питтман. Новости химической инженерии 2010; 88 (24): 34.
- Джонсон. Новости Chem Eng 2014; 92 (46): 26–27.
Загрузите бесплатную периодическую таблицу в высоком разрешении, чтобы распечатать ее и повесить на рабочий стол или на стену в лаборатории.
Подпишитесь на периодическую таблицу здесь
Разница между едким натром и пищевой содой
Как едкий натр, так и пищевая сода являются основными или щелочными неорганическими соединениями, а их водные растворы имеют уровень pH выше 7,0. Несмотря на эти сходства, между ними есть некоторые важные различия.
Слово «газировка» обычно ассоциируется с шипящим сладким напитком. В газированных напитках углекислый газ добавляют к водной смеси и герметизируют под давлением. Углекислый газ реагирует с водой с образованием угольной кислоты, которая затем диссоциирует на ионы карбоната (CO3-2) и ионы бикарбоната (HCO3–).
Пищевая сода также производит ионы бикарбоната, в то время как каустическая сода производит ионы гидроксила. Как следует из названия, каустическая сода вызывает коррозию и способна растворять или разлагать такие вещества, как органические ткани.
В этом сообщении:
Пищевая сода — это то же самое, что и едкий натр?
Хотя пищевая сода и каустическая сода являются щелочными веществами с уровнем pH выше нейтрального, они химически отличаются друг от друга.
Бикарбонат натрия, также известный как пищевая сода, имеет химическую формулу NaHCO₃. Между тем, едкий натр также называют гидроксидом натрия, а его химическая формула — NaOH. Важно отметить, что пищевая сода нетоксична, а каустическая сода токсична.
Что такое едкий натр?
Едкий натр — это общее название гидроксида натрия. Он классифицируется как сильное основание, потому что его молекулы полностью диссоциируют на анионы и катионы при растворении в воде. По сравнению с пищевой содой она очень агрессивна и токсична.
Гидроксид натрия обычно используется в качестве ингредиента в моющих средствах, очистителях канализации и чистящих средствах для духовок. Он также используется в производстве бумаги для изготовления волокнистой массы из древесной целлюлозы. Он может растворять органические материалы и живые ткани, вызывая серьезные травмы.
Гидроксид натрия также очень гигроскопичен, что означает, что он легко поглощает влагу из воздуха.
Что такое пищевая сода?
Пищевая сода или бикарбонат натрия обычно используется для выпечки хлеба, тортов и пирожных. Это помогает тесту подняться, выделяя углекислый газ, который образует пузырьки в смеси. По мере образования пузырьков тесто расширяется, и при выпечке остаются пробелы.
Пищевая сода нетоксична и легко разлагается на более простые химические составляющие. При температуре от 80°C он начинает разлагаться на три более простых соединения – карбонат натрия, воду и углекислый газ. Разложение ускоряется с повышением температуры.
2 NAHCO 3 → NA 2 CO 3 + H 2 + H 2 + H 2 + H . бикарбонат можно использовать для тушения пожаров. Фактически, это основной активный ингредиент в баках для огнетушителей под давлением.
Является ли пищевая сода едкой?
Пищевая сода, независимо от ее концентрации, имеет относительно низкий pH и считается слабым основанием. Как слабое основание, пищевая сода не способна вытеснять ионы водорода (протоны) из других соединений.
Диссоциирует на ионы натрия и бикарбоната при растворении в воде. В отличие от ионов гидроксила, ионы бикарбоната не принимают протоны, что делает пищевую соду неедкой.
Каустическая сода и пищевая сода — одно и то же?
Хотя едкий натр и пищевая сода являются щелочными веществами и имеют схожие названия, это не одно и то же. Во-первых, они имеют разные химические формулы и свойства. Один токсичен, а другой нетоксичен и может использоваться в качестве пищевого ингредиента.
Из-за высокой реакционной способности натрия для разложения или химического изменения едкого натра требуется много энергии (например, энергии электрического тока). Однако для разложения пищевой соды требуется лишь относительно низкая температура. Хотя последний также содержит натрий, одним из продуктов его разложения является вода. Это облегчает взаимодействие натрия со свободными гидроксильными ионами в воде.
Пищевая сода обычно представляет собой порошок белого цвета при комнатной температуре. Напротив, каустическая сода имеет хлопьевидно-белый цвет и имеет тенденцию быть «мокрой» при комнатной температуре, поскольку легко впитывает влагу.
Его гигроскопические свойства делают его менее чем идеальным для использования в стандартных растворах, потому что уровень pH может быть легко искажен присутствием влаги в воздухе. Едкий натр также слишком реакционноспособен, чтобы быть достаточно стабильным в качестве стандартного раствора.
Едкий натр также слишком реакционноспособен, чтобы быть достаточно стабильным в качестве стандартного раствора.
Можно ли использовать пищевую соду вместо едкого натра?
Можно ли использовать пищевую соду в качестве замены каустической соды, зависит от контекста или цели. Например, вы можете использовать пищевую соду для нейтрализации кислот. Вы также можете использовать его в экспериментах по титрованию.
Однако вы не можете использовать пищевую соду в качестве замены каустической соды, если вы хотите производить сильнодействующие моющие и чистящие средства, потому что она не обладает таким же протонирующим эффектом.
В большинстве случаев пищевая сода и едкий натр не взаимозаменяемы. Их химические и физические свойства настолько различны, что одно не может быть эффективной заменой другому.
Компания ReAgent Chemicals продает едкий натр в различных концентрациях. Посетите наш интернет-магазин сегодня до купите едкий натр у одного из ведущих химических производителей Великобритании.
Заявление об отказе от ответственности
Блог на сайтеchemicals.co.uk и все, что в нем публикуется, предоставляется только в качестве информационного ресурса. Блог, его авторы и аффилированные лица не несут ответственности за любые несчастные случаи, травмы или ущерб, вызванные частично или непосредственно в результате использования информации, представленной на этом веб-сайте. Мы не рекомендуем использовать какие-либо химические вещества без предварительного ознакомления с Паспортом безопасности материала, который можно получить у производителя, и следуя советам по безопасности и мерам предосторожности, указанным на этикетке продукта. Если у вас есть какие-либо сомнения по поводу вопросов охраны здоровья и безопасности, обратитесь в Управление по охране труда и технике безопасности (HSE).
Фейерверк с пищевой содой и уксусом
Пришло время праздничного фейерверка! С помощью этого эксперимента с пищевой содой и уксусом мы привносим в наши уроки волнение фейерверка с захватывающей химической реакцией, которая понравится детям всех возрастов. Мы включили простые уроки, а также дополнительные материалы, посвященные увлекательной химии (с небольшим количеством математики), чтобы научиться измерять химические реакции.
Мы включили простые уроки, а также дополнительные материалы, посвященные увлекательной химии (с небольшим количеством математики), чтобы научиться измерять химические реакции.
Summer Science – измерение химической реакции
Отказ от ответственности: эта статья может содержать комиссионные или партнерские ссылки. Как партнер Amazon я зарабатываю на соответствующих покупках.
Не видите наши видео? Отключите все блокировщики рекламы, чтобы наш видеопоток был виден. Или посетите наш канал на YouTube, чтобы узнать, загружено ли туда видео. Мы потихоньку загружаем наши архивы. Спасибо!
Наблюдение за фейерверком — популярное праздничное мероприятие во многих культурах, являющееся кульминацией многих фестивалей и праздников. Сегодня мы воссоздаем это волшебство с небольшим экспериментом с пищевой содой и уксусом.
Легко превратите это в эксперимент, чтобы отпраздновать любое событие, изменив цвета блесток и формы, или просто используйте радугу цветов и празднуйте только потому, что наука — это круто!
Видео эксперимента с фейерверком
Посмотрите видео этого химического эксперимента с фейерверком. Если вы не видите видео, отключите блокировщики рекламы, так как они также блокируют наш видеопоток. Вы также можете посмотреть наши видеоролики на YouTube-канале STEAM Powered Family.
Если вы не видите видео, отключите блокировщики рекламы, так как они также блокируют наш видеопоток. Вы также можете посмотреть наши видеоролики на YouTube-канале STEAM Powered Family.
Пищевая сода и уксус
Это далеко не первый эксперимент с бикарбонатом натрия (он же пищевая сода) и уксусом. Пузырчатая, бурная реакция проста, недорога и очень весела.
Узнайте больше!
Ознакомьтесь с другими реакциями пищевой соды и уксуса здесь
Наука
Всякий раз, когда мы занимаемся любым из этих мероприятий, я люблю говорить о науке и реакции, как мы это делаем. Меня всегда поражают невероятные, любопытные умы детей и вдумчивые и интересные вопросы, которые они задают, когда мы вместе занимаемся наукой.
В этом упражнении исследуется популярная реакция пищевой соды и уксуса, которая представляет собой простую кислотно-щелочную химическую реакцию. Уксус или уксусная кислота имеют химическую формулу Ch4COOH. Пищевая сода представляет собой основание, также известное как бикарбонат натрия, и имеет химическую формулу NaHCO3. Продуктами этой реакции являются ацетат натрия (C2h4NaO2). Ацетат натрия состоит из 1 иона натрия, 2 атомов углерода, 3 атомов водорода и 2 атомов кислорода. Другими продуктами являются вода (h3O) и углекислый газ (CO2). Углекислый газ — это газ, который вызывает пузырение во время реакции.
Продуктами этой реакции являются ацетат натрия (C2h4NaO2). Ацетат натрия состоит из 1 иона натрия, 2 атомов углерода, 3 атомов водорода и 2 атомов кислорода. Другими продуктами являются вода (h3O) и углекислый газ (CO2). Углекислый газ — это газ, который вызывает пузырение во время реакции.
Химическая формула для пищевой соды и уксуса
C 2 H 4 O 2 + NAHCO 3 -> NAC 2 H 3 O 2 + H H 3 O 2 + H 2 3 O 2 + H H 3 O + H H 3 O . 2
уксус + бикарбонат натрия -> ацетат натрия + вода + диоксид углерода
Расходные материалы
Для этого эксперимента вам понадобятся:
Пищевая сода (бикарбонат натрия)
Уксус
Формочки для печенья «Звезда»
Красный, Синий и Серебряный блеск*
Ложка
Маленькая бутылка, шприц или пипетка (для уксуса)
Поднос или большая тарелка
Пластиковое покрытие для стола (дополнительно)
* ПРИМЕЧАНИЕ О БЛЕСКЕ окружающей среде, но я знаю, что многие из вас все еще любят немного блеска в своих проектах! Когда дело доходит до блеска, я считаю, что это всегда необязательно. Ни один из моих проектов не требует этого. Но если вы решите, что хотите немного блеска и сияния в своих творениях, я настоятельно рекомендую использовать биоразлагаемые блестки. Существует множество фантастических вариантов. Ниже приведены ссылки на некоторые отличные варианты.
Ни один из моих проектов не требует этого. Но если вы решите, что хотите немного блеска и сияния в своих творениях, я настоятельно рекомендую использовать биоразлагаемые блестки. Существует множество фантастических вариантов. Ниже приведены ссылки на некоторые отличные варианты.
В зависимости от возраста и способностей ваших детей вы также можете предоставить им средства защиты, такие как защитные очки (никто не хочет, чтобы уксус попал им в глаза!) или перчатки (уксус на висячих ногтях или небольших порезах может причинить боль).
Всегда проводите эти эксперименты под присмотром взрослых.
Указания
При необходимости застелите стол скатертью или пластиковым покрытием, чтобы защитить его, и наденьте все защитные приспособления.
Наполните бутылку уксусом или подготовьте небольшую миску с уксусом, если вы используете шприц или пипетку. Отложите в сторону.
Поместите формочки для печенья в поднос или большое блюдо.
Добавьте примерно одну столовую ложку пищевой соды с горкой в форму для печенья. Немного приплюсните его ложкой.
Немного приплюсните его ложкой.
Посыпьте пищевую соду посыпкой. Или для забавного сюрприза добавьте посыпку, а затем добавьте немного пищевой соды поверх посыпки, чтобы скрыть ее. Таким образом, они будут выявлены по реакции.
Теперь осторожно добавьте несколько капель уксуса. Начните медленно, чтобы вы действительно могли увидеть реакцию. Добавьте больше уксуса по мере необходимости, чтобы продолжить реакцию.
Блеск придает ей классный фейерверк, блестящий эффект!
Слушай внимательно, что ты слышишь? Вы также можете услышать реакцию в нашем видео. Как вы думаете, что издает этот шум?
Профессиональный совет! Добавьте немного средства для мытья посуды внутрь формы для печенья с пищевой содой. Добавление этой дополнительной переменной, мыла, действительно усилит пузыри и извержение. Спросите своих детей, почему, по их мнению, это происходит.
Фейерверк Версия для печати
Добавьте веселья в свою деятельность с помощью этой распечатки Fireworks, бесплатной для подписчиков списка рассылки STEAM Powered Family!
Дополнительное задание по математике
Теперь, когда мы выполнили базовый эксперимент, давайте немного улучшим процесс обучения с помощью дополнительной идеи, которая заставит наших молодых ученых научиться критическому мышлению и навыкам дедуктивного мышления.
Измерение химической реакции
Установите форму для печенья в виде звезды в небольшую миску или блюдо, которое можно поставить на кухонные весы. Взвесьте блюдо и форму для печенья вместе и запишите вес. Теперь добавьте одну столовую ложку пищевой соды и запишите общий окончательный вес. Вам понадобится этот номер через минуту.
Теперь поставьте на весы маленькую чашку. Обратите внимание на вес чашки.
Добавьте в стакан 50 мл уксуса. Обратите внимание на новый вес. Теперь рассчитайте вес уксуса без чашки так же, как мы рассчитали вес пищевой соды в бонусном задании. Запишите это число.
Время для математики! Теперь добавьте вес уксуса без чашки к общему весу тарелки с формочкой для печенья и пищевой содой. Это общая начальная масса вашей химической реакции. Запишите этот номер !
Запустите реакцию, налив уксус на пищевую соду и наблюдая за реакцией.
Когда реакция полностью завершится и пузырьков больше не будет, поставьте чашку на весы и выполните окончательные измерения.
Сравните начальную массу химической реакции с конечной массой. Как изменились цифры? Как вы думаете, чем вызвано такое изменение массы? Куда делась недостающая масса?
Готовы погрузиться в более увлекательные кислотно-щелочные реакции? В том числе очень вкусные? Проверьте эти мероприятия!
ДОПОЛНИТЕЛЬНЫЕ КИСЛОТНО-ОСНОВНЫЕ РЕАКЦИИ
Разница между бикарбонатом натрия и пищевой содой
Основное отличие – бикарбонат натрия и пищевая сода
Кажется, существует много путаницы в отношении разницы между бикарбонатом натрия и пищевой содой. Однако пищевая сода и бикарбонат натрия — это разные термины для одного и того же, поскольку пищевая сода относится к чистому бикарбонату натрия. Однако пищевая сода в основном используется в кулинарии, тогда как бикарбонат натрия в основном используется для химического анализа. Это основное различие между бикарбонатом натрия и пищевой содой. В этой статье давайте подробно рассмотрим разницу между бикарбонатом натрия и пищевой содой с точки зрения их предполагаемого использования.
Что такое бикарбонат натрия
Бикарбонат натрия представляет собой белый кристаллический порошок (NaHCO 3 ), также известный как пищевая сода, бикарбонат соды, гидрокарбонат натрия или кислый карбонат натрия. Его название IUPAC — гидрокарбонат натрия. Он классифицируется как кислая соль, полученная путем объединения кислоты (угольной) и основания (гидроксида натрия), и реагирует на другие химические вещества как слабая щелочь. Имеет слегка солоноватый и щелочной вкус. Нахколит — это природная минеральная форма бикарбоната натрия. При температуре выше 149°C пищевая сода распадается на более стабильное вещество, состоящее из карбоната натрия, воды и углекислого газа.
2NaHCO 3 → Na 2 CO 3 + H 2 O + CO 2
Figure 1: Molecular formula of sodium bicarbonate
NaHCO 3 can be obtained by the reaction of carbon диоксида с водным раствором гидроксида натрия или реакцией хлорида натрия, аммиака и диоксида углерода в воде. Это амфотерное соединение, которое можно использовать для удаления любых кислых примесей из жидкости для получения более чистого образца.
Это амфотерное соединение, которое можно использовать для удаления любых кислых примесей из жидкости для получения более чистого образца.
Пищевая сода, также известная как бикарбонат соды, является чистым разрыхлителем. Его добавляют в выпечку перед приготовлением, чтобы произвести углекислый газ и заставить ее «подняться» или увеличиться в объеме и получить желаемую текстуру. Однако пищевую соду необходимо смешать с влагой, а кислотный компонент необходимо добавить, чтобы произошла необходимая химическая реакция, чтобы продукты поднялись. Поскольку для повышения качества необходима кислота, ее часто используют в рецептах, которые уже содержат кислые ингредиенты, такие как дрожжи, лимонный сок, шоколад, пахта или мед. Пищевая сода входит в состав разрыхлителя. Разрыхлитель получают путем смешивания пищевой соды с сухой сметаной винной кислоты и других солей.
Различия между бикарбонатом натрия и пищевой содой можно разделить на следующие категории. Они есть;
Они есть;
Бикарбонат натрия представляет собой гидрокарбонат натрия.
Пищевая сода — торговое название бикарбоната натрия.
Альтернативные названияБикарбонат натрия также известен как гидрокарбонат натрия или кислый карбонат натрия.
Пищевая сода также известна как бикарбонат соды, хлебная сода или пищевая сода.
Предполагаемые пользователиПредполагаемые пользователи бикарбоната натрия — аналитики, химики и работники фармацевтической промышленности.
Предполагаемыми пользователями пищевой соды являются повара, домохозяйки, пекари и кондитеры .
9 класс0016Бикарбонат натрия относится к чистоте для анализа.
Пищевая сода относится к пищевым продуктам и является пищевой добавкой, кодируемой Европейским Союзом. Его номер E: E-500
Его номер E: E-500
Бикарбонат натрия можно приобрести в аптеках или магазинах химикатов.
Пищевая сода продается в магазинах кулинарных или пищевых ингредиентов.
ПроизводствоБикарбонат натрия производится химической промышленностью как химическое вещество.
Сода пищевая производится пищевой промышленностью в качестве пищевого ингредиента.
ПрименениеВ качестве химического вещества бикарбонат натрия используется для следующих целей.
- Борьба с вредителями: Например, можно ли использовать его для уничтожения тараканов.
- Используется как биопестицид
- Удаление краски и коррозии
- Используется в качестве регулятора pH
- Используется как эффективный фунгицид
- Используется для тушения небольших возгораний, вызванных жиром или электричеством.

- Используется как антацид для лечения кислотного расстройства желудка и изжоги.
- Используется в качестве ингредиента в некоторых ополаскивателях для рта и зубных пастах.
- Используется в качестве стирального порошка для удаления пятен от чая или кофе или удаления запаха с одежды.
В качестве кулинарного ингредиента пищевая сода используется для следующих целей.
- В основном используется как разрыхлитель. Когда пищевая сода смешивается с влагой и кислыми ингредиентами, такими как йогурт, шоколад, пахта, мед, в результате химической реакции образуются пузырьки углекислого газа, которые помогают тесту увеличиваться и расширяться при высоких температурах в духовке, вызывая увеличение объема выпечки. Тепло заставляет пищевую соду действовать как разрыхлитель, выделяя углекислый газ. Однако пищевая сода быстро вступает в реакцию во влажном состоянии, поэтому ее всегда следует добавлять сначала в сухие ингредиенты.
 Пищевая сода является распространенным ингредиентом булочек, пирожных, тортов и печенья. Бикарбонат натрия можно заменить разрыхлителем.
Пищевая сода является распространенным ингредиентом булочек, пирожных, тортов и печенья. Бикарбонат натрия можно заменить разрыхлителем. - Раньше при приготовлении овощей использовали пищевую соду, чтобы сделать их мягче. Но теперь большинство потребителей предпочитают более твердые овощи.
- Тем не менее, он по-прежнему используется в азиатской и латиноамериканской кухне для смягчения мяса.
- Он также используется для панировки/покрытия корочки, например, для жареных блюд, для улучшения хрустящей корочки.
- Используется для мытья фруктов и овощей для удаления следов пестицидов и других загрязнений.
В заключение, бикарбонат натрия, также известный как пищевая сода, в основном используется в выпечке в качестве разрыхлителя.
Ссылки :
А.Дж. Бент, изд. (1997). Технология изготовления тортов (6-е изд.). Спрингер. п. 102 . Проверено 12 августа 2009 г. .
Разрыхлитель. Прекрасная кулинария. Архивировано из оригинала 1 февраля 2009 г. Проверено 06 марта 2009 г.
Прекрасная кулинария. Архивировано из оригинала 1 февраля 2009 г. Проверено 06 марта 2009 г.
Линдси, Роберт С. (1996). Оуэн Р. Феннема, изд. Пищевая химия (3-е изд.). КПР Пресс. п. 772 . Проверено 12 августа 2009 г. .
Мац, Сэмюэл А. (1992). Хлебопекарные технологии и инженерия (3-е изд.). Спрингер. стр. 71–72. Проверено 12 августа 2009 г. .
Мац, Сэмюэл А. (1992). Хлебобулочные технологии и инженерия (3-е изд.). Спрингер. п. 54 . Проверено 12 августа 2009 г. .
Изображение предоставлено:
«Бикарбонат натрия» от TSZRKX — (Общественный домен) через Wikimedia Commons
«Теперь добавьте разрывной порошок ..». через Flickr
Пищевая сода: приготовление, свойства и применение
Намрата Дас
Мастер по подготовке к экзаменам | Обновлено 29 июня 2022 г.
Пищевая сода — это известное химическое название Бикарбонат натрия , это химическое соединение с формулой NaHCO 3 и обозначением IUPAC гидрокарбонат натрия. Процесс перекристаллизации карбоната натрия дает стиральную соду. Из карбоната натрия можно получить пищевую соду. Карбонат натрия декагидрат — это химическое название стиральной соды, а химическая формула — Na 2 CO 3 . Стиральная сода обычно используется в качестве моющего средства для стирки одежды. Давайте узнаем больше по теме и обсудим некоторые важные вопросы.
Процесс перекристаллизации карбоната натрия дает стиральную соду. Из карбоната натрия можно получить пищевую соду. Карбонат натрия декагидрат — это химическое название стиральной соды, а химическая формула — Na 2 CO 3 . Стиральная сода обычно используется в качестве моющего средства для стирки одежды. Давайте узнаем больше по теме и обсудим некоторые важные вопросы.
Содержание
|
Ключевые термины: пищевая сода, стиральная сода, гипс, бикарбонат натрия, процесс Сольвея.
Что такое пищевая сода?
[Нажмите здесь, чтобы просмотреть примеры вопросов]
Белое кристаллическое соединение со слегка соленым вкусом, наиболее часто используемое в домашнем хозяйстве, известно под названием пищевая сода, химическая формула — NaHCO 3 , а химическое название — бикарбонат натрия.
ПРИБОЙНА (Na+) и бикарбонат-анион (BaCO 3 ) (HCO 3 — ). [Нажмите здесь, чтобы просмотреть примеры вопросов] При приготовлении пищевой соды процесс Solvay играет важную роль. Реакция хлорида натрия, аммиака и углекислого газа в воде известна как процесс Сольвея. NACL + H 2 O + CO 2 + NH 3 → NH 4 CL + NAHCO 3 Приготовление пищевой соды
 Углекислый газ, участвующий в приготовлении, получают из карбоната кальция, а оставшийся оксид кальция используют для получения аммиака из хлорида аммония. В результате всех этих реакций в конечном итоге образуется бикарбонат натрия.
Углекислый газ, участвующий в приготовлении, получают из карбоната кальция, а оставшийся оксид кальция используют для получения аммиака из хлорида аммония. В результате всех этих реакций в конечном итоге образуется бикарбонат натрия. Свойства 9006. 9061 2
2 9011. Некоторые важные свойства перечислены ниже:
- Бикарбонат натрия Химическая формула — NaHCO 3
- Плотность бикарбоната натрия в твердом веществе: 2,20 г/см 3 и Порошок: 1,1 – 1,3
- Текстура и внешний вид бикарбоната натрия (NaHCO 3 ) представляет собой белый кристаллический порошок .
- Температура кипения и плавления бикарбоната натрия составляет 851 °C и 50 °C.
- Это соединение NaHCO 3 не растворяется в этаноле, но слабо растворяется в метаноле, ацетоне и воде.

- При нагревании выделяется углекислый газ и образуется карбонат натрия.
Na 2 CO 3 + H 2 O + CO 2 = 2NaHCO 3
- Молекулярный вес/Молярная масса бикарбоната натрия составляет 84,0066 г/моль.
Использование пищевой соды
[Щелкните здесь, чтобы просмотреть примеры вопросов]
Существуют различные области применения пищевой соды. Ниже перечислены некоторые из применений и применений:
- В области медицины он используется в качестве антацида при лечении кислотности и несварения желудка. Его быстрое действие снижает кислотность желудка, обеспечивая кратковременное облегчение. Его щелочной состав помогает уменьшить расстройство желудка, нейтрализуя избыток соляной кислоты в желудке.
- Его можно использовать для приготовления мягкого и пышного хлеба и пирожных из-за образования двуокиси углерода при нагревании или смешивании с водой.

NaHCO 3 + H+ → CO 2 + H 2 O + натриевая соль кислоты
- При производстве косметических средств, косметики и предметов личной гигиены может использоваться.
- Используется для очистки полости рта и зубов, избавления от бактерий и желтизны зубов.
- Применяется при изготовлении содово-кислотных огнетушителей.
- Используется в качестве ингредиента при производстве антацидов.
Стиральная сода
[Нажмите здесь, чтобы просмотреть примеры вопросов]
Стиральная сода также широко известна, как пищевая сода, в домашнем хозяйстве по всему миру. Текстура и внешний вид соды для стирки представляет собой беловатый порошок без запаха, а химическая формула соды для стирки — Na 2 CO 3 .10H 2 O, а химическое название — карбонат натрия. В окружающей среде его природа гигроскопичен, поглощает влагу из воздуха.
Сода для стирки
- Приготовление соды для стирки
Приготовление и производство соды для стирки или карбоната натрия синтезируется с помощью процесса Solvay. В этом процессе происходит реакция хлорида натрия, аммиака и углекислого газа в воде. Когда карбонат кальция и оставшийся оксид кальция используются для извлечения аммиака из хлорида аммония, образуется диоксид углерода.
Поэтапный процесс Solvay представлен ниже:
Этап 1: Углекислый газ пропускают через аммонизированный солевой раствор в колонне для карбонизации. Наконец, в этой реакции обнаруживается бикарбонат натрия.
NH 3 (aq) + CO 2 (g) + NaCl(aq) +H 2 O → NaHCO 3 (s) + NH 4 Cl(водн. )
)
Стадия 2: При нагревании бикарбоната натрия до температуры 300°C. Наконец, карбонат натрия имеет место.
2NaHCO 3 → Na 2 CO 3 + CO 2 + H 2 O
Шаг 3: Наконец, путем перекристаллизации карбоната натрия. производят стиральную соду или декагидрат карбоната натрия.
Na 2CO 3 + 10H 2 O → Na 2 CO 3 .10H 2 O
Штукатурка
[Нажмите здесь, чтобы задать пример вопросов]
Текстура и внешний вид гипса представляет собой белый порошок, который затвердевает под воздействием влаги и после высыхания. Химическая формула гипса – CaSO 9.0059 4 .1/2H 2 O, а химическое название – гемигидрат сульфата кальция.
Химическая формула гипса – CaSO 9.0059 4 .1/2H 2 O, а химическое название – гемигидрат сульфата кальция.
Гипс
- Гипс
Гипс (CaSO 4 .2H) производство основного соединения гипса Oster 2 При температуре 373 К при нагревании Гипс теряет свои молекулы воды и появляется в виде сульфата кальция (гипс).
CaSO 4 . 2H 2 O → CaSO4.1/2H 2 O + 3/2H 2 O
Things to Remember
- The chemical name пищевой соды — бикарбонат натрия.
- Бикарбонат натрия представляет собой смесь четырех соединений углерода, натрия, кислорода и водорода.
- Процесс перекристаллизации карбоната натрия дает стиральную соду
- Гипс можно получить нагреванием гипса
- Химическая формула гипса CaSO 4 .
 1/2H 2 O
1/2H 2 O - Химическая формула стиральной соды Na 2 CO 3 .10H 2 O
- Химическая формула пищевой соды: NaHCO 3
Примеры вопросов
Вопросы: Что произойдет, если карбонат натрия смешать с водой? (3 балла)
Ответ : При смешивании с водой пищевой соды, также известной как бикарбонат натрия (NaHCO 3 ), образуется углекислота. Реакция экзотермическая, то есть выделяется тепло. Бикарбонат натрия — это то, из чего состоит пищевая сода. Поскольку бикарбонат натрия является щелочным, он растворяется в воде, делая ее немного более щелочной.
Вопрос: Каковы условия бикарбоната натрия? (4 балла)
Ответ: Условия бикарбоната натрия указаны ниже:
- Гиперчувствительность, метаболический или респираторный алкалоз, гипокальциемия и чрезмерная потеря хлора (Cl-) при рвоте или желудочно-кишечном отсасывании являются возможными противопоказаниями для бикарбоната натрия.

- Пациенты с риском гипохлоремического алкалоза, вызванного диуретиками.
- Гиперкарбический ацидоз – это состояние, при котором в крови наблюдается избыток углекислого газа.
- Неопределенная боль в животе.
- Бикарбонат натрия указан ниже:
Вопрос: По какой причине для приготовления торта используется разрыхлитель? (4 балла)
Ответ: Разрыхлитель содержит гидрокарбонат натрия, а
- Винная кислота
- Карбонат натрия
- Хлорид кальция
- Уксусная кислота.
Вопрос: Каковы побочные эффекты от использования большего количества бикарбоната натрия? (3 балла)
Ответ : Ниже приведены опасности для здоровья, связанные с бикарбонатом натрия:
- При вдыхании большой концентрации пыли могут возникнуть кашель и чихание.
- При употреблении значительного количества может вызвать раздражение желудочно-кишечного тракта.



 5
5 003
003 04
04 Гранулометрический состав:
Гранулометрический состав: Магнитные включения размером более 0,25 мм
Магнитные включения размером более 0,25 мм

 д.
д.