Урок 9. Щелочные и щёлочноземельные металлы – HIMI4KA
Самоучитель по химии › Неорганическая химия
Содержание
- Щелочные металлы
- Щелочноземельные металлы
- Выводы
Щелочные металлы
Щелочные металлы — это элементы главной подгруппы I группы Периодической системы химических элементов Менделеева (ПСМ) (кроме водорода).
Задание 9.1. Назовите все щелочные металлы. Составьте схемы строения атомов натрия и калия. Укажите распределение их валентных электронов.
На внешнем уровне у атомов таких металлов находится по 1 электрону, но расстояние до ядра, а значит, и притяжение к нему, у этих электронов различно.
Вопрос. У какого элемента (натрия или калия) внешние электроны дальше от ядра?
Чем дальше электроны от ядра, тем слабее они притягиваются к нему, тем легче данный атом отдаёт электроны. А это означает, что металлические свойства выражены тем ярче, чем дальше валентные электроны от ядра (при прочих равных условиях). Поэтому сверху вниз в каждой главной подгруппе увеличивается число энергетических уровней в атомах, растёт металлическая активность элементов, т. е. способность их атомов отдавать электроны.
Поэтому сверху вниз в каждой главной подгруппе увеличивается число энергетических уровней в атомах, растёт металлическая активность элементов, т. е. способность их атомов отдавать электроны.
Вопрос. Какой металл более активный: натрий или калий?
Таким образом, активность щелочных металлов возрастает
Но поскольку на внешнем уровне любого щелочного металла находится один электрон, в любой химической реакции щелочные металлы могут отдать только один электрон. Значит, они имеют постоянную валентность I и образуют оксиды состава
Этот оксид растворяется в воде, реагирует с нею:
Полученное основание — щёлочь.
Вопрос. Что такое щёлочь? (См. урок 2.3.)
В подгруппе сверху вниз увеличивается и сила оснований, т. е. способность диссоциировать в водных растворах на ионы. Самой сильной щёлочью является CsOH.
Растворы щелочей мылкие на ощупь, разъедают кожу и ткани (щёлочи — едкие!), изменяют окраску индикаторов. Поскольку все металлы главной подгруппы I группы образуют щёлочи, — их называют «щелочные металлы».
Рассмотрим свойства щелочных металлов на примере натрия. При этом будем придерживаться схемы, изложенной начале второй части.
Строение атома Nа изображается схемой:
Имея один валентный электрон (…3s1), натрий является активным металлом с постоянной валентностью I:
Простое вещество «натрий» — очень лёгкий (легче воды) серебристо-белый металл, который легко режется ножом. Натрий активно реагирует с кислородом, водородом, неметаллами, водой:
Вопрос. Почему атом серы присоединил 2 электрона?
Задание 9.2. Составьте уравнения реакций натрия с хлором Cl2, азотом N2 и водой (при затруднениях см. пояснения в уроке 7).
Даже небольшие кусочки натрия (величиной с горошину) при попадании в воду вызывают оглушительный взрыв — это взрывается водород (см. урок 12). Тот же эффект будет, если натрий опустить в раствор кислоты или соли. Кроме того, здесь возможны более сложные побочные процессы. Поэтому составлять уравнения реакций для щелочных металлов в качестве примеров процессов
- металл + раствор кислоты →
- металл + раствор соли →
не рекомендуется.
Натрий образует основный оксид Nа2O, который реагирует с водой, с кислотами и кислотными оксидами (см. урок 2.1), например:
Задание 9.3. Составьте уравнения реакций оксида натрия с водой и с серной кислотой.
Гидроксид натрия NaOH (едкий натр, каустическая сода) проявляет все свойства щелочей: реагирует с кислотными оксидами, кислотами, растворами солей (см. урок 2.3), например:
Все соединения натрия окрашивают пламя в жёлтый цвет. Это качественная реакция на соединения натрия.
Это качественная реакция на соединения натрия.
Задание 9.4. Составьте уравнения реакций гидроксида натрия с хлоридом железа III, фосфорной кислотой, оксидом серы IV. (При затруднениях см. урок 2.3.)
Задание 9.5. Опишите по разобранной схеме свойства калия и его соединений.
Многие соединения натрия нашли применение в быту и промышленности. Так, каустическая сода NаОН применяется для получения мыла, в производстве алюминия, искусственных волокон и др. Кальцинированная сода Na2CO3 также применяется при получении мыла, а также при варке стекла, стирке белья и др. Но в пищу эти «соды» не употребляются! При приготовлении пищи используют питьевую соду NaHCO3 и поваренную соль NaCl. Питьевая сода используется при лечении простуды, её кладут в печенье, пирожки. Без соли NaCl почти любая еда покажется невкусной, без неё невозможно законсервировать мясо, овощи, грибы. Эти вещества применяются и в технических целях.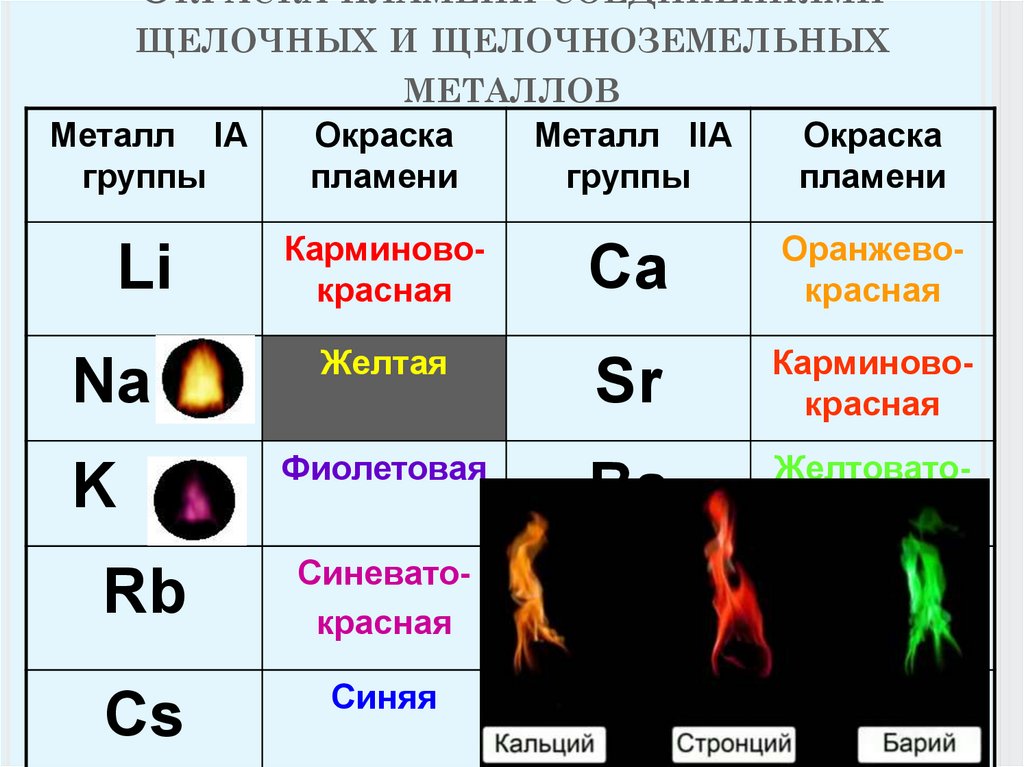
Щелочноземельные металлы
Металлы главной подгруппы II группы в отличие от щелочных металлов имеют довольно разные свойства.
Вопросы
- Сколько электронов на внешнем уровне атомов этих металлов?
- Какой металл более активен: натрий или магний? Почему?
Эти металлы имеют на внешнем уровне по 2 электрона, следовательно, они менее активны, чем их «соседи» — щелочные металлы, так как на отрыв двух электронов нужно затратить больше энергии, чем на отрыв одного электрона.
Вопрос. Как изменяется активность металлов в подгруппе сверху вниз? Почему?
В этой подгруппе, как и у щелочных металлов, сверху вниз увеличивается сила оснований, т. е. способность диссоциировать в водных растворах на ионы. Кроме того, увеличивается заряд иона, а значит, усиливается притяжение группы ОН в гидроксиде металла: ионы Na+ и OH– притягиваются слабее, чем Са2+ и ОН–.
Поэтому первые два элемента этой подгруппы не образуют щелочей:
Кальций уже образует сильное основание — щёлочь, а стронцию и барию соответствуют ещё более сильные основания.
Запомните: Ca, Sr, Ba — щелочноземельные* металлы, так как их оксиды проявляют щелочные свойства.
* «Земли» — устаревшее название оксидов металлов, так как эти оксиды входят в состав земли (почвы).
Несмотря на эти различия, перечисленные элементы имеют много сходного в свойствах.
Вопрос. Какую валентность проявляют эти химические элементы в соединениях?
Главное сходство химических элементов главной подгруппы II группы заключается в том, что они проявляют в соединениях постоянную валентность II, так как на внешнем уровне имеют по два электрона, а на предвнешнем уровне нет незавершённых подуровней.
Рассмотрим свойства химических элементов главной подгруппы II группы на примере кальция. Строение атома кальция изображается схемой:
Имея два валентных электрона: …4s2, кальций является активным металлом, поскольку оба электрона расположены на внешнем уровне. Его постоянная валентность равна двум:
Его постоянная валентность равна двум:
Простое вещество «кальций» — довольно прочный, серебристо-белый умеренно твёрдый металл. Активно реагирует с кислородом, водородом, неметаллами, водой, растворами кислот:
Рассмотрим как происходит взаимодействие кальция с азотом:
Вопрос. Почему атом азота присоединяет три электрона?
Задание 9.6. Составьте уравнения реакций кальция с кислородом, хлором (Cl2), серой, водой, соляной кислотой.
Оксид кальция CaO (негашёная известь) очень активно реагирует с водой с выделением такого большого количества теплоты, что вода закипает:
Этот процесс называется «гашением извести», а систему называют «кипелкой».
Вопрос. С какими ещё веществами может реагировать оксид кальция?
Как основный оксид CaO реагирует с кислотными оксидами и с кислотами:
- CaO + SO2 → СаSO3
- CaO + НNO3 → … (закончить уравнение этой реакции).

Гидроксид кальция Са(ОН)2 (гашёная известь) проявляет все свойства щелочей.
Вопрос. С какими веществами могут реагировать щелочи? (При затруднении см. урок 2.3.)
Задание 9.7. Составить уравнения реакций:
- Са(ОН)2 + СO2 →
- Са(ОН)2 + H3PO4 →
- Са(ОН)2 + Na2CO3 →
Прозрачный раствор гидроксида кальция в воде называется известковой водой. Она мутнеет при пропускании через неё углекислого газа:
Этот эффект реакции считают качественным признаком того, что в данном растворе присутствуют ионы кальция. Убедиться в этом поможет также реакция с пламенем: все соединения кальция окрашивают пламя в кирпично-красный цвет.
Задание 9.8. Опишите по предложенной схеме свойства магния и его соединений.
Многие соединения кальция играют заметную роль в нашей жизни.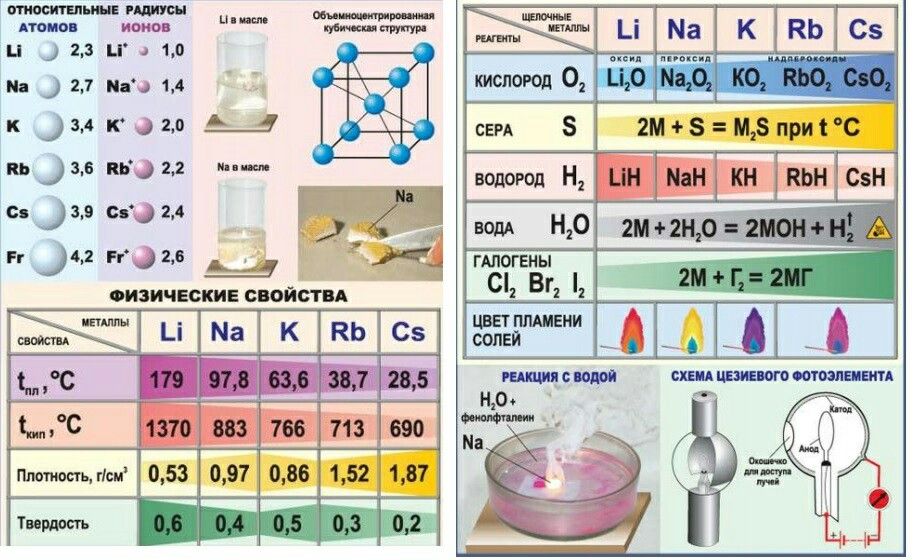 Достаточно сказать, что фосфат кальция, карбонат кальция составляют основу костей, зубов. Без ионов кальция не может свертываться кровь. Без соединений кальция невозможно построить дом, так как известь (гашёная и негашёная) обеспечивает скрепление строительных блоков друг с другом:
Достаточно сказать, что фосфат кальция, карбонат кальция составляют основу костей, зубов. Без ионов кальция не может свертываться кровь. Без соединений кальция невозможно построить дом, так как известь (гашёная и негашёная) обеспечивает скрепление строительных блоков друг с другом:
Образование в результате этих реакций прочных нерастворимых карбонатов и силикатов кальция надёжно скрепляет стены. Аналогичные реакции происходят при схватывании цемента.
Оксид кальция в больших количествах получают обжигом известняка:
Карбонат кальция СаСО3 составляет основу мела, мрамора, известняка. Из него состоят целые горы и пласты земной коры. Под действием воды и углекислого газа из воздуха карбонат кальция переходит в водорастворимое состояние — гидрокарбонат кальция:
Аналогичные процессы происходят и с карбонатами магния. В результате этих и других процессов в природной воде появляются ионы кальция и магния.
Вода, содержащая ионы кальция и магния, называется ЖЁСТКОЙ.
Этот термин возник из-за того, что некоторые овощи и плоды под действием такой воды становятся жёсткими: ионы кальция и магния вступают в реакцию с органическими компонентами плодов и овощей.
Чаще всего жёсткая вода приносит неприятности: долго развариваются продукты, плохо моет мыло (см. урок 24.4), на стенках котлов и труб появляется слой накипи, что может привести к авариям:
Накипь, конечно, можно растворить при помощи соляной кислоты:
Задание 9.10. Можно ли растворить накипь при помощи серной, азотной, фосфорной кислот? Ответ подтвердите ионно-молекулярными уравнениями реакций.
Но лучше всего в случаях, когда жёсткость воды повышена, а это нежелательно, умягчать воду. Для этого ионы кальция и магния нужно перевести в нерастворимое состояние.
Вопрос. Умягчается ли вода при кипячении?
Частично вода умягчается при кипячении, так как при этом растворимые гидрокарбонаты переходят в нерастворимые карбонаты. Но некоторые соли кальция и магния (сульфаты, хлориды) при нагревании не изменяются. В этом случае в воду добавляют вещества, образующие с ионами кальция и магния осадки.
Но некоторые соли кальция и магния (сульфаты, хлориды) при нагревании не изменяются. В этом случае в воду добавляют вещества, образующие с ионами кальция и магния осадки.
Задание 9.11. Какие из солей: кальцинированная сода, фосфат натрия, поваренная соль — устраняют жёсткость воды? Ответ подтвердить ионными уравнениями реакций, считая, что в состав воды входит сульфат кальция.
Чаще всего для умягчения воды используют кальцинированную соду Na2CO3:
Кальцинированная сода входит в состав стиральных порошков, которые также содержат и фосфаты. Эти вещества «автоматически» смягчают воду при стирке.
Выводы
Щелочные металлы — это простые вещества, которые образованы элементами главной подгруппы первой группы. Это очень активные металлы, которые образуют с водой сильные растворимые основания — щёлочи.
Щелочноземельные металлы — это простые вещества, которые образованы некоторыми элементами главной подгруппы второй группы Ca, Sr, Ba.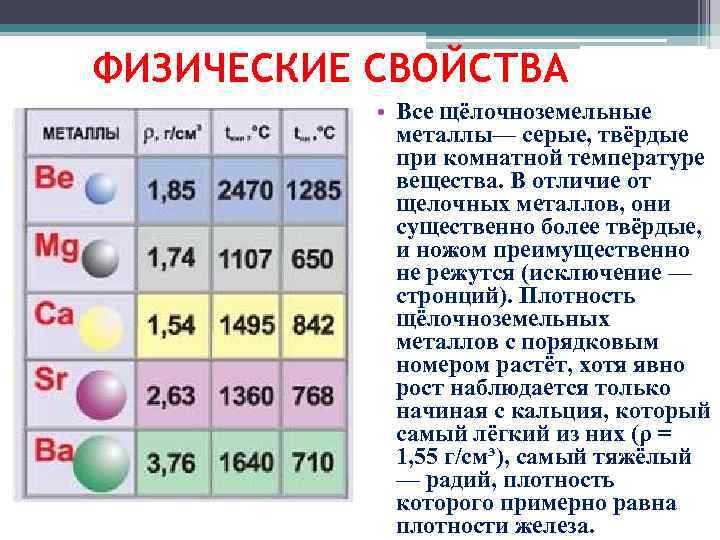 Это очень активные металлы, которые образуют с водой щёлочи. Ионы кальция и магния делают воду жёсткой.
Это очень активные металлы, которые образуют с водой щёлочи. Ионы кальция и магния делают воду жёсткой.
Урок 10. Алюминий →
← Урок 8. Общие свойства металлов
список, свойства, особенности и сферы применения
Этой группе металлов отдан весь второй столбец таблицы Менделеева. И атомщики, и ювелиры используют щелочноземельные металлы. С ними интересно экспериментировать, но требуется осторожность.
Содержание
- Что представляют собой
- История
- Формы нахождения в природе
- Физико-химические характеристики
- Где используются
- Биологическое значение
Что представляют собой
Щелочноземельные металлы – это вся вторая группа таблицы Менделеева.
К щёлочноземельным металлам относятся:
- бериллий,
Бериллий, чистота более 99%, поликристаллический фрагмент
- магний,
Металлический магний
- кальций.
Кальций в атмосфере аргона
Плюс:
- стронций,
- барий,
Барий металлический Ba 99,9%
- радий.

Советский армейский компас. Жёлтая краска содержит радий
То есть «щелочноземельный» список насчитывает шесть позиций, которые обычно располагаются по возрастанию атомного номера – от бериллия к радию.
История
Двойное название группы – отражение природы и характеристик входящих в нее элементов:
- Они способны образовывать щелочи.
- Ряд свойств их оксидов близки окислам алюминия и железа. Такие вещества еще средневековые алхимики именовали «землями».
Сегодняшний состав щелочноземельной группы сформировался не сразу: бериллий и магний отсутствовали.
Это объяснялось отличием свойств данных элементов от остальных:
-50%
Большой выбор украшений из натуральных камней и минералов со скидкой -50%
Show Less
- По большинству характеристик они ближе к алюминию, чем к другим элементам группы.
- Их гидроксиды – не щелочи.
- Магний взаимодействует с водой в замедленном режиме, у бериллия реакция в таком растворе нулевая.
 Та же картина при контакте с неметаллами.
Та же картина при контакте с неметаллами.
Однако специалисты Международного союза теоретической и прикладной химии (IUPAC) решили все-таки причислить бериллий и магний к щелочноземельной группе.
Формы нахождения в природе
Щёлочноземельным металлам присуща чрезмерная активность, поэтому в природе они как самостоятельный элемент отсутствуют.
Почти всегда это составляющая минералов либо руд:
- Самый распространенный элемент щелочноземельной группы – кальций (2,9-12,9% по массе). Его получают из известняков, им насыщены мрамор, гранит.
- Почти три процента забирает магний.
- В сто раз реже в литосфере представлены барий со стронцием.
- Содержание остальных элементов измеряется тысячными долями процента.
Самым редким на планете щёлочноземельным металлом является радий. Но найти его легче других: это обязательный компонент урановых рудников.
Физико-химические характеристики
Элементы группы наделены общими физическими свойствами:
- Серебристый с сероватостью цвет.

- Твердость в стандартных условиях, ножом режется только стронций.
- Металлический блеск.
- Тускнение на воздухе с разной скоростью вследствие образования оксидной пленки.
- Хорошая пропускная способность для тепла и электричества.
- Два электрона на внешнем слое атома у каждого элемента, степень окисления – всегда +2. Это отражают формулы соединений, образованных металлами группы.
Самая тяжелая «щелочная земля» – радий. Кубик вещества с ребром в 1 см весит 5,5 грамма.
Более интересны химические свойства «земель».
Есть общие и оригинальные:
- Покрытый пленкой-оксидом бериллий способен на реакцию только при 600+°С (кроме фтора).
- Окисленный магний при средней температуре не реагирует ни с чем. Получение соединений металла возможно при температуре от 645°C.
- Кальций окисляется неспешно и только если воздух влажный. При незначительном нагреве горит, растворяется водой.
- Осмотрительности требуют барий, стронций, радий.
 На открытом пространстве взаимодействие этих металлов с кислородом и азотом чревато взрывом. Их держат в герметичных контейнерах, залив керосином. Эта особенность объединяет щелочные и щелочноземельные металлы.
На открытом пространстве взаимодействие этих металлов с кислородом и азотом чревато взрывом. Их держат в герметичных контейнерах, залив керосином. Эта особенность объединяет щелочные и щелочноземельные металлы.
Общие свойства щёлочноземельных металлов – растворение в кислотах, образование солей, щелочей при взаимодействии с водой.
Химическая активность щелочноземельных металлов усиливается с увеличением габаритов атома – от бериллия к радию.
Где используются
Свойства металлов щелочноземельной группы обусловили применение каждого во всех сегментах – от авиастроения до медицины и ювелирного дела:
- Бериллий. Исходник при выплавке сплавов, включая «атомные», получения ракетного топлива. Компонент ювелирных минералов первого ряда – аквамарина, гелиодора, изумруда.
- Кальций. Базис большинства огнеупоров, строительных материалов. Металл задействован при производстве топлива, аптечных препаратов.

- Магний. Самый легкий щелочноземельный металл. Как восстановитель нашел применение в металлургии. Без проблем куется, раскатывается. Чаще используется как «ингредиент» сплавов, снижающий их массивность, – материал корпусов и деталей ракет, самолетов, автомобилей, электроники. А также приборов для нужд оборонного комплекса и предприятий приборостроения.
Сегодня на первое место по использованию магниевых сплавов выходят смартфоны, планшеты, другие гаджеты.
- Стронций. Металлургами используется как лигатура сплавов, очиститель сталей, чугуна, меди от серы, других вредных примесей. Сырье закупают производители радиоэлектроники, химических источников тока, атомщики, пиротехники. Продукция «высокого сегмента» из металла – чистый уран, керамика-сверхпроводник, вакуумный инструментарий.
Стронций создает насыщенно-красные оттенки огней салюта. Изотопом вещества лечат онкологию.
- Барий.
 Используются соединения металла. Главный потребитель – атомщики. Ассортимент: вакуумные, пьезоэлектрические приборы, жидкий теплоноситель, линзы, стекло для урановых стержней, керамика-сверхпроводник. Нетоксичный сульфат используется рентгенологами как контрастное вещество.
Используются соединения металла. Главный потребитель – атомщики. Ассортимент: вакуумные, пьезоэлектрические приборы, жидкий теплоноситель, линзы, стекло для урановых стержней, керамика-сверхпроводник. Нетоксичный сульфат используется рентгенологами как контрастное вещество.
На особом счету радий. Это самый редкий щелочноземельный металл: на планете его получено всего полтора килограмма.
Даже микродозы радиоактивного вещества смертельно опасны для человека. Однако это свойство используется исследователями ядерных процессов и для лечения онкологии.
Шкалы, стрелки компасов, бортовых приборов, изготовленных до 1970-х годов, покрыты краской, содержащей радий. Она светится в темноте, но с тех пор не используется как опасная для человека.
Более 8000 видов товара из 500 разновидностей натурального камня. Ежедневное обновление!
Show Less
Биологическое значение
Значение щелочноземельных элементов разнообразно:
- Без кальция не формируется скелет, зубы, не сокращаются мышцы.
 Элемент «курирует» параметры крови.
Элемент «курирует» параметры крови. - Магний – компонент биологических структур (к примеру, хлорофилла у растений). В организме человека содействует синтезу нуклеиновых кислот, работе ферментов, нервной системы.
- Микродозы стронция присутствуют в организме как аналог кальция. Особо важен щелочноземельный элемент для детей младше четырех лет.
Барий, радий, бериллий, их соединения ядовиты. Поэтому для биологических структур опасны.
Щелочные и щелочноземельные металлы
Элементы первой группы периодической таблицы (за исключением водорода — см. ниже) известны как щелочные металлы , потому что они образуют щелочные растворы при взаимодействии с водой. В эту группу входят элементы литий , натрий , калий , рубидий , цезий и франций . Каждый из этих элементов имеет только один валентный электрон, а это означает, что они образуют только слабые металлические связи.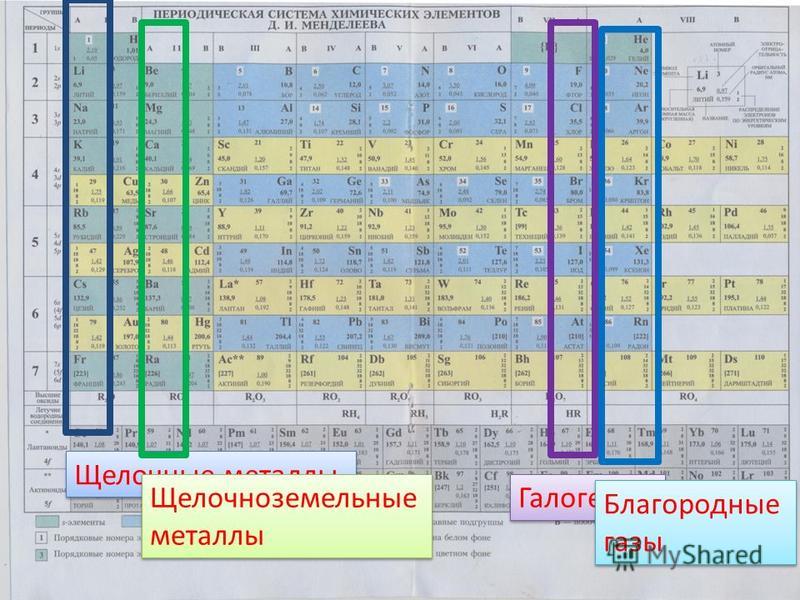 В результате они относительно мягкие и имеют низкую температуру плавления.
В результате они относительно мягкие и имеют низкую температуру плавления.
Единственный валентный электрон легко теряется, что делает эти металлы очень реакционноспособными. Они энергично реагируют как с воздухом, так и с водой — например, когда натрий вступает в контакт с водой, он бурно реагирует с образованием гидроксида натрия и водорода. Тепло реакции фактически воспламеняет водород! Щелочные металлы также легко соединяются с элементами семнадцатой группы (
Щелочные металлы (выделены) занимают первую группу в периодической таблице.
Вторая группа периодической таблицы включает элементы бериллий , магний , кальций , стронций , барий и радий . Элементы этой группы, все блестящие и серебристо-белые на вид, известны как 9. 0003 щелочноземельные металлы . Как и щелочные металлы, они образуют щелочные растворы при взаимодействии с водой. Термин «земля» исторический; это было общее название, используемое алхимиками для оксидов этих элементов (которые когда-то считались самостоятельными элементами).
0003 щелочноземельные металлы . Как и щелочные металлы, они образуют щелочные растворы при взаимодействии с водой. Термин «земля» исторический; это было общее название, используемое алхимиками для оксидов этих элементов (которые когда-то считались самостоятельными элементами).
Все элементы второй группы имеют и два электронов на внешней оболочке. Таким образом, металлические связи в щелочноземельных металлах прочнее, чем в щелочных металлах, что приводит к более высоким температурам плавления, но они все еще достаточно реакционноспособны, поскольку два внешних электрона легко теряются. В результате они не встречаются в природе в их элементарном состоянии.
Все щелочноземельные металлы, кроме одного, реагируют с галогенами (, хлор , фтор, и т. д.) с образованием ионных соединений (исключение составляет хлорид бериллия, поскольку связь ковалентная). Все щелочноземельные металлы, кроме бериллия и магния, также реагируют с водой с образованием газообразного водорода и их соответствующих гидроксидов (однако магний 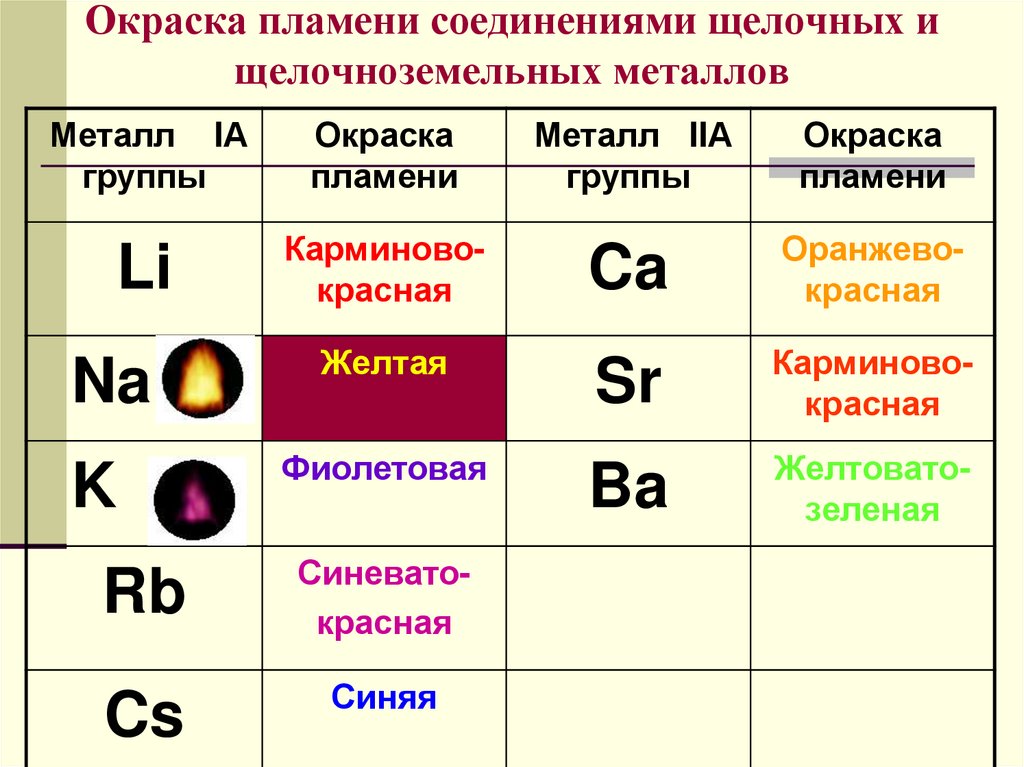 По существу, чем тяжелее щелочноземельный металл, тем энергичнее он будет реагировать с водой.
По существу, чем тяжелее щелочноземельный металл, тем энергичнее он будет реагировать с водой.
Щелочноземельные металлы (выделены) занимают вторую группу в периодической таблице.
Магний является пятым по распространенности элементом на земле, за ним следует кальций на восьмом месте, что тоже хорошо, поскольку и магний, и кальций жизненно важны для всех живых существ, включая людей! Магний участвует в огромном количестве биохимических реакций; среди прочего, он необходим для здоровья костей и зубов. Кальций составляет примерно два процента от общей массы нашего тела, причем большая часть его находится в наших зубах и костях.
Chem4Kids.com: Элементы и периодическая таблица: щелочноземельные металлы
Материя | Атомы | Элементы | Периодическая таблица | Реакции | Биохимия | Все темы
Обзор |
Периодическая таблица |
Список элементов |
Семьи |
Галогены |
Благородные газы
Металлы |
щелочь | Щелочная земля |
Переход |
Лантаниды |
Актинид
Итак, мы только что рассмотрели щелочные металлы в Группе I. Вы найдете щелочноземельных металла по соседству в Группе II. Это второе наиболее реакционноспособное семейство из элементов в периодической таблице. Вы знаете, почему они называются щелочными ? Когда эти соединения смешиваются в растворах, они, вероятно, образуют растворы с pH выше 7. Эти более высокие уровни pH означают, что они определяются как «основные» или «щелочные» растворы.
Вы найдете щелочноземельных металла по соседству в Группе II. Это второе наиболее реакционноспособное семейство из элементов в периодической таблице. Вы знаете, почему они называются щелочными ? Когда эти соединения смешиваются в растворах, они, вероятно, образуют растворы с pH выше 7. Эти более высокие уровни pH означают, что они определяются как «основные» или «щелочные» растворы.
Кто в семье? К щелочноземельным металлам относятся: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Как и во всех семьях, эти элементы имеют общие черты. Хотя это семейство не так реакционноспособно, как щелочные металлы, оно умеет очень легко образовывать связи. Каждый из них имеет два электрона на внешней оболочке. Они готовы отдать эти два электрона в электровалентных/ионных связях . Иногда вы увидите их с двумя атомами галогена, например, с фторидом бериллия (BeF 2 ), а иногда они могут образовывать двойную связь, как с оксидом кальция (CaO). Все дело в том, чтобы отказаться от этих электронов, чтобы иметь полную внешнюю оболочку.
Все дело в том, чтобы отказаться от этих электронов, чтобы иметь полную внешнюю оболочку.
Когда вы дойдете до конца списка, вы найдете радиоактивный радий . Хотя радий больше не встречается в вашем доме, раньше он был ингредиентом светящихся в темноте красок. Первоначально он был смешан с сульфидом цинка (ZnS). Другие элементы встречаются во многих предметах, включая фейерверки, батареи, лампы-вспышки и специальные сплавы. Более легкие щелочноземельные металлы, такие как магний и кальций, очень важны для физиологии животных и растений. Вы все знаете, что кальций помогает строить ваши кости. Магний можно найти в молекул хлорофилла .
► СЛЕДУЮЩАЯ СТРАНИЦА ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ
► ВИКТОРИНА ПО ЭЛЕМЕНТАМ
► ВЕРНУТЬСЯ НА НАЧАЛО СТРАНИЦЫ
► Или выполните поиск на сайтах…
Не такой уж тяжелый металл — бериллий (видео НАСА)
Британская энциклопедия: Щелочноземельные металлы
Википедия: Щелочноземельные металлы
9000 3 Encyclopedia.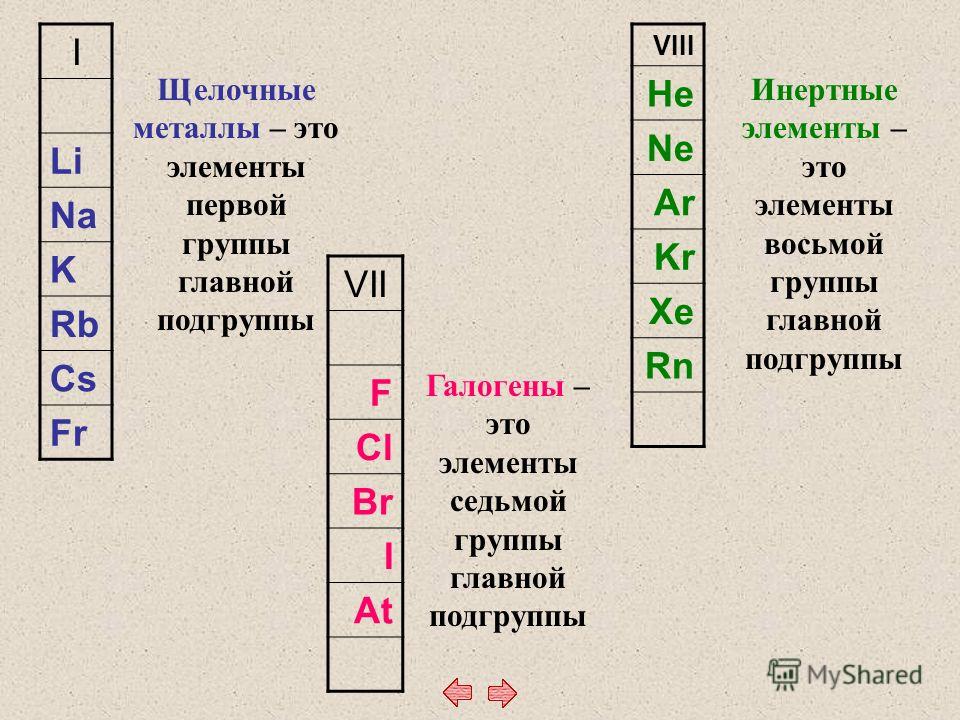



 Та же картина при контакте с неметаллами.
Та же картина при контакте с неметаллами.
 На открытом пространстве взаимодействие этих металлов с кислородом и азотом чревато взрывом. Их держат в герметичных контейнерах, залив керосином. Эта особенность объединяет щелочные и щелочноземельные металлы.
На открытом пространстве взаимодействие этих металлов с кислородом и азотом чревато взрывом. Их держат в герметичных контейнерах, залив керосином. Эта особенность объединяет щелочные и щелочноземельные металлы.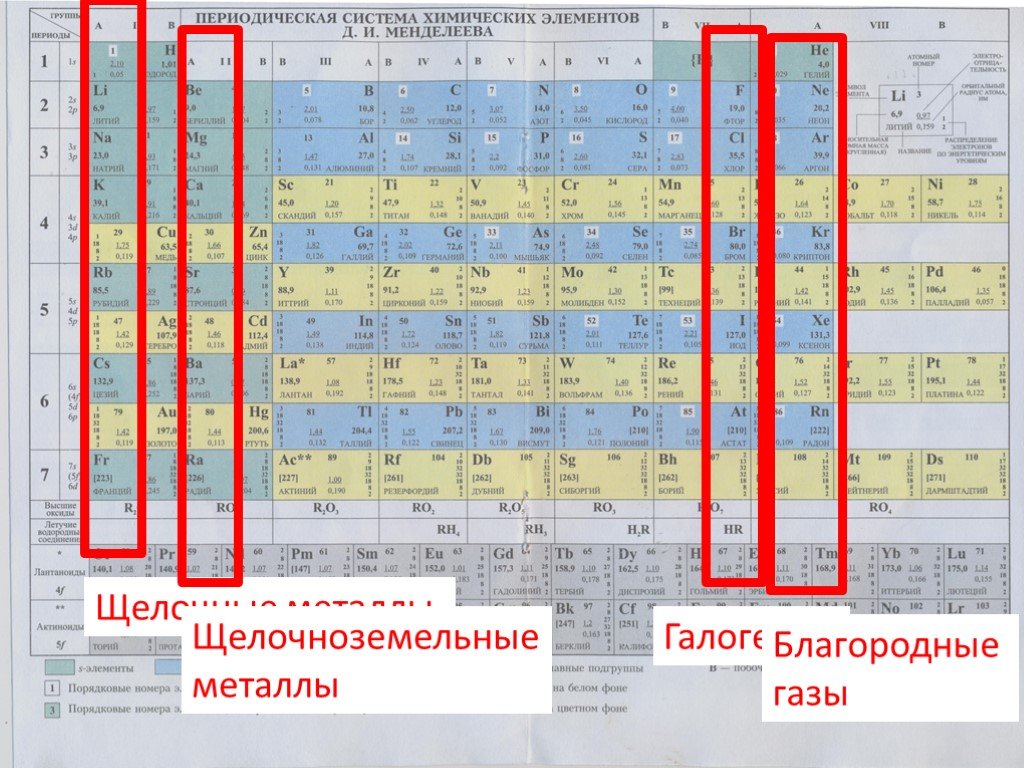
 Используются соединения металла. Главный потребитель – атомщики. Ассортимент: вакуумные, пьезоэлектрические приборы, жидкий теплоноситель, линзы, стекло для урановых стержней, керамика-сверхпроводник. Нетоксичный сульфат используется рентгенологами как контрастное вещество.
Используются соединения металла. Главный потребитель – атомщики. Ассортимент: вакуумные, пьезоэлектрические приборы, жидкий теплоноситель, линзы, стекло для урановых стержней, керамика-сверхпроводник. Нетоксичный сульфат используется рентгенологами как контрастное вещество. Элемент «курирует» параметры крови.
Элемент «курирует» параметры крови.