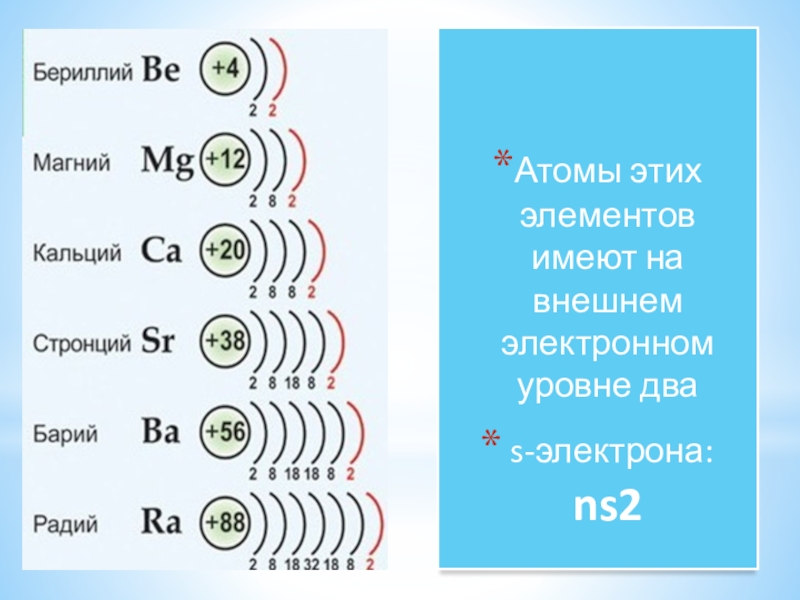
Металлы II группы главной подгруппы (Be, Mg, Ca, Sr, Ba)
В главную подгруппу второй группы периодической системы элементов наряду с семейcтвом щёлочноземельных металлов (оно включает близкие по свойствам кальций, стронций, барий и радий) входят два типических элемента – бериллий и магний.
Если магний по свойствам во многом тяготеет к щёлочноземельным элементам, то бериллий стоит как бы особняком. Кажется, что он попал в эту группу, лишь подчиняясь правилу валентности, поскольку, как и другие элементы группы, в своих соединениях двухвалентен. По свойствам же бериллий гораздо ближе к алюминию, расположенному по диагонали от него в третьей группе. Химики так и говорят: диагональное сходство двух элементов. Причём сходство настолько сильное, что и встречаются эти элементы часто вместе, в одном соединении.
Бериллий (Beryllium)Бериллий
Многие минералы бериллия – берилл 3BeO∙Al2O3∙6SiO2, хризоберилл BeAl2O4 и их разновидности (изумруд, аквамарин, александрит) – известны очень давно; эти драгоценные камни упоминаются в произведениях античных авторов. На Руси берилл называли вируллионом, под таким именем он встречается в Изборнике Святослава (1073 г.). Ученые заинтересовались бериллом лишь в конце XVIII в. Французский химик Луи Никола Воклен установил, что в состав этого минерала входит новая «земля» (так в старину называли некоторые оксиды металлов), отличная от алюмины – оксида алюминия. Он же впервые получил ее соли – соли бериллия. Они оказались сладкими на вкус, поэтому новой земле Воклен дал имя глицина (от греч. «гликис» — «сладкий»), а элементу – глициний. Это название употреблялось во Франции вплоть до XIX в., пока немецкий химик Мартин Генрих Клапрот не добился переименования его в бериллий (Berillium) – в честь минерала берилла.
На Руси берилл называли вируллионом, под таким именем он встречается в Изборнике Святослава (1073 г.). Ученые заинтересовались бериллом лишь в конце XVIII в. Французский химик Луи Никола Воклен установил, что в состав этого минерала входит новая «земля» (так в старину называли некоторые оксиды металлов), отличная от алюмины – оксида алюминия. Он же впервые получил ее соли – соли бериллия. Они оказались сладкими на вкус, поэтому новой земле Воклен дал имя глицина (от греч. «гликис» — «сладкий»), а элементу – глициний. Это название употреблялось во Франции вплоть до XIX в., пока немецкий химик Мартин Генрих Клапрот не добился переименования его в бериллий (Berillium) – в честь минерала берилла.
В виде простого вещества бериллий получили в 1828 г. немецкий ученый Фридрих Вёлер и французский химик Антуан Бюсси. Они действовали калием на безводный хлорид бериллия: BeCl2 + 2K = Be + 2KCl. В настоящее время бериллий получают, восстанавливая его фторид магнием: BeF2 + Mg = Be + MgF2, либо электролизом расплава смеси хлоридов бериллия и натрия.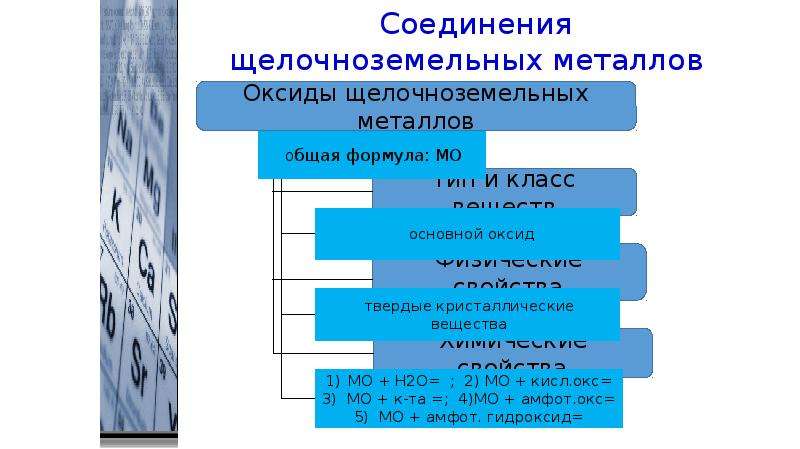 Исходные соли бериллия выделяют при переработке бериллиевой руды.
Исходные соли бериллия выделяют при переработке бериллиевой руды.
Берилл
Бериллий — тугоплавкий металл(tпл= 1287 ̊ С) светло-серого цвета, покрытый тончайшей пленкой оксида, которая защищает его от коррозии. Для него характерно уникальное в мире металлов сочетание легкости с высокой твердостью. Чистый бериллий пластичен, однако даже незначительные примеси делают его хрупким.
Обладая высокой химической активностью, бериллий легко вступает в реакции с галогенами, серой и азотом. Вода на него не действует, зато он легко растворяется как в разбавленных кислотах: Be + 2HCl = BeCl2 + H2↑, так и в растворах щелочей: Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2↑ Образующийся тетрагидроксобериллат натрия долгое время рассматривали как соль бериллиевой кислоты H2BeO2. На самом деле это комплексное соединение. Бериллаты более простого состава образуются при сплавлении оксида бериллия со щелочью или содой: Na2CO3 + BeO = Na2BeO2 + CO2↑. Здесь также проявляется сходство с алюминием.
Здесь также проявляется сходство с алюминием.
Бериллий и его растворимые в воде соли ядовиты. Даже ничтожно малая их примесь в воздухе приводит к тяжелым заболеваниям. Несмотря на это, бериллий находит широкое применение в технике. Ещё в XIX в. обнаружили, что добавка Ве к меди сильно повышает ее твердость, прочность, химическую стойкость, делает ее похожей на сталь. Сплавы на основе меди, содержащие от 0,005 до 3% бериллия, получили название бериллиевых бронз. Из них изготовляют пружины, рессоры, подшипники, наиболее ответственные узлы машин и механизмов. В качестве легирующей добавки, значительно усиливающей прочность, бериллий вводят в состав сталей и некоторых других сплавов.
Основной потребитель бериллия – атомная энергетика, поскольку он обладает способностью отражать и замедлять нейтроны, образующиеся в ядерном реакторе. Отражатели нейтронов из бериллия отличаются высокой прочностью, химической стойкостью и легкостью. Потребность в этом металле и его добыча возрастает с каджым годом.
Магний
Магний весьма распространен в природе. В больших количествах он встречается в виде карбоната магния, образуя минералы магнезит MgCO3 и доломит MgCO3∙CaCO3. Сульфат и хлорид магния входят в состав калийных минералов – каинита KCl∙MgSO4∙3H2O и карналлита KCl∙MgCl2∙6H2O. Ион Mg2+ содержится в морской воде, придавая ей горький вкус. Общее количество магния в земной коре составляет около 2%.
Магний был открыт при анализе воды, взятой из минерального источника вблизи города Эпсом в Англии. Горькая на вкус, она привлекла внимание исследователей в конце XVII в. При упаривании такой воды на стенках сосуда образовалась белая корка вещества, которое назвали горькой, или эпсомской, солью MgSO4∙7H2O. Её использовали в качестве слабительного. Примерно в то же время учёные заинтересовались и белой магнезией – карбонатом магния MgCO3. При его нагревании образуется жженая магнезия – оксид MgO. Это вещество А.Л.Лавуазье ошибочно причислил к простым телам, которые уже не могут быть далее разложены.
При его нагревании образуется жженая магнезия – оксид MgO. Это вещество А.Л.Лавуазье ошибочно причислил к простым телам, которые уже не могут быть далее разложены.
Впервые магний был получен в 1808 г. Г.Дэви при электролизе влажной жжёной магнезии. По его предложению, элемент вначале назвали Magnium – чтобы подчеркнуть связь с магнезией и в то же время отличать его от марганца, который тогда называли Manganesium. Позже магний переименовали в Magnesium, а марганец — в Manganum. Однако в русском языке сохранилось первоначальное название элемента.
Каинит
В некотором смысле магний – противоположность бериллию. Он достаточно мягкий и пластичный, плавится при более низкой температуре (650̊ С). Но, как и бериллий, он обладает заметной химической активностью. На воздухе стружка магния сгорает с ослепительной вспышкой с образованием белого порошка – смеси оксида и нитрида:2Mg + O2 = 2MgO; 3Mg + N2 = Mg3N2. Недаром магниевую ленту фотографы использовали как фотовспышку.
При комнатной температуре магний, покрытый тончайшей пленкой оксида, достаточно инертен и не взаимодействует с водой. Лишь при кипячении он медленно восстанавливает воду с образованием белой взвеси гидроксида магния и выделением водорода: Mg + 2H2O = Mg(OH)2↓ + H2↑.
Магний легко взаимодействует не только с разбавленными кислотами, но и с раствором хлорида аммония, в котором из-за гидролиза этой соли присутствуют ионы Н+: Mg + 2NH4Cl = MgCl2 + 2NH3 + H2. В отличие от бериллия, со щелочами он не реагирует.
Магний — сильный восстановитель. Смеси его со многими окислителями, например пероксидом бария ВаО2, используют в пиротехнике. При поджигании такая смесь сгорает ярким зеленоватым пламенем:BaO2 + Mg = MgO + BaO. Магний присутствует в животных и растительных организмах. В теле человека его в среднем 19 г. Особенно он необходим растениям, так как является составной частью хлорофилла.
В технике магний применяется главным образом в виде сплавов с алюминием – магналия и электрона. Магналий содержит от 5 до 30% магния, а электрон помимо алюминия включает также, цинк, марганец, медь. Эти сплавы очень прочные и намного тверже чистых алюминия и магния, легко обрабатываются и полируются. Их используют в автомобильной промышленности, авиационной и ракетной технике. Некоторые соединения магния нашли применение в медицине: оксид магния служит средством понижения кислотности желудка, а кристаллогидрат сульфата магния – слабительным.
Щелочноземельные элементыКальций
К семейству щелочноземельных элементов относятся кальций, стронций, барий и радий. Д.И.Менделеев включал в это семейство и магний. Щелочноземельными они называются потому, что их гидроксиды, подобно гидроксидам щелочных металлов, растворимы в воде, т.е. являются щелочами.
Название «кальций» происходит от латинского calx – «известь». Так алхимики называли продукты обжига различных веществ.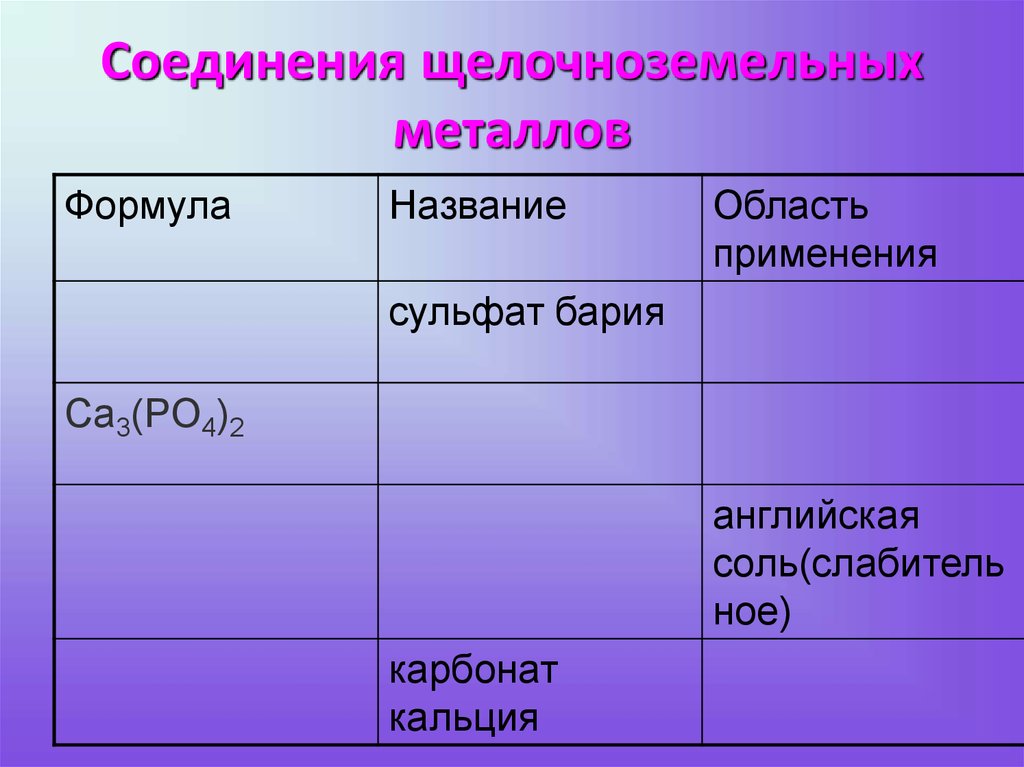 Древние римляне использовали известь для приготовления строительных растворов. Для этого мрамор или известняк подвергали обжигу, получая негашеную известь (оксид кальция). Производство этого вещества описал еще Плиний Старший в «Естественной истории».
Древние римляне использовали известь для приготовления строительных растворов. Для этого мрамор или известняк подвергали обжигу, получая негашеную известь (оксид кальция). Производство этого вещества описал еще Плиний Старший в «Естественной истории».
По распространенности в земной коре кальций занимает пятое место (4,1% по массе), уступая лишь кислороду, кремнию, алюминию и железу. В природе он встречается в виде гипса CaSO4∙2H2O, флюорита CaF2, апатита Ca5(PO4)3(OH) и кальцита CaCO3(карбоната кальция, образующего залежи мела, мрамора и известняка). Кальцит сформировался из панцирей древних простейших и моллюсков (кораллов), поэтому неудивительно, что иногда в известняках находят ракушки или отпечатки животных.
Гипс
В организме человека содержится в среднем около 1 кг кальция, который в форме ортофосфата входит в состав костной ткани. Почти 80% потребности в этом элементе удовлетворяется за счёт молочных продуктов. В них кальций присутствует в виде солей фосфорной и лимонной кислот. В литре молока или кефира как раз и содержится средняя суточная норма – 1,2 г кальция. При его недостатке в организме врачи назначают его препараты, например глюконат кальция.
В них кальций присутствует в виде солей фосфорной и лимонной кислот. В литре молока или кефира как раз и содержится средняя суточная норма – 1,2 г кальция. При его недостатке в организме врачи назначают его препараты, например глюконат кальция.
Металлический кальций был впервые получен Г.Дэви в 1808 г. при электролизе смеси влажной гашенной извести Са(ОН)2 с оксидом ртути HgO.
Стронций и барий распространены в природе значительно меньше, чем кальций. Стронций встречается в виде минерала целестина (от лат. caelestis – «небесный») – сульфата стронция SrSO4, образующего красивые розово-красные или бледно-голубые кристаллы, а барий – в виде барита (тяжелого шпата) BaSO4.
Стронций получил название от шотландской деревни Стронциан, близ которой в конце XVIII в. был найден редкий минерал стронцианит SrCO3.
Стронций
Годом открытия бария можно считать 1774 г., когда шведский химик Карл Вильгельм Шееле и его ученик Юхан Готлиб Ган установили, что в тяжелом шпате содержится новая земля. Она получила название «барит» (от греч. «барис» — «тяжелый»), а образующий ее элемент – «барий». В виде простых веществ барий и стронций были выделены Г.Дэви в 1808 г.
Она получила название «барит» (от греч. «барис» — «тяжелый»), а образующий ее элемент – «барий». В виде простых веществ барий и стронций были выделены Г.Дэви в 1808 г.
С пищей и питьевой водой человек ежедневно получает около 15-20 мг стронция. В большом количестве соединения этого элемента вредны для здоровья. Ионы стронция способны замещать в костях ионы кальция, что приводит к болезням.
Растворимые соединения бария еще более токсичны. Симптомы отравления ими появляются при приёме внутрь примерно 0,2 г растворимой соли. А доза 0,8-0,9 г уже смертельна. В случае отравления надо принимать 10-процентный раствор сульфата натрия или магния. При этом в организме образуется сульфат бария – нерастворимый и потому безопасный.
Кальций (tпл = 839̊ С), стронций (tпл = 768 ̊С) и барий (tпл = 727 ̊С) – пластичные металлы серебристо – белого цвета. Из-за недостаточной твёрдости их невозможно резать ножом, как натрий и калий.
Минерал целестин
Щёлочноземельные металлы по химической активности уступают лишь щелочным. Они взаимодействуют с водой и растворами кислот с выделением водорода.
Они взаимодействуют с водой и растворами кислот с выделением водорода.
Если оксид бария выдерживать в атмосфере кислорода или на воздухе при температуре 500 ̊С то реакция будет протекать дальше:2Ва + О2 = 2ВаО2
Образовавшийся пероксид бария при 700 ̊С отщепляет избыточный кислород, вновь переходя в оксид. Щёлочноземельные металлы выделяют либо алюмотермией: 4CaO + 2Al = CaAl2O4 + 3Ca, либо электролизом расплавов хлоридов. Практическое значение из них имеет в основном кальций – он используется в металлургии в качестве раскислителя. Соединения кальция, стронция и бария применяются в разных отраслях промышленности, в строительстве.
Соединения стронция используются в производстве осветительных ракет, химического и термически устойчивого стекла. Оксид стронция входит в состав эмалей для защиты металлических предметов, а также служит катализатором при переработке нефти.
Барий
Очень полезным веществом оказался сульфат бария. В конце XIX в. им разбавляли дорогие свинцовые белила, а ныне на основе BaSO4 разработана белая краска литопон, обладающая высокой кроющей способностью, что снижает ее расход. Сульфат бария также добавляют в бумагу дорогих сортов (для денежных знаков, документов).
В конце XIX в. им разбавляли дорогие свинцовые белила, а ныне на основе BaSO4 разработана белая краска литопон, обладающая высокой кроющей способностью, что снижает ее расход. Сульфат бария также добавляют в бумагу дорогих сортов (для денежных знаков, документов).
Как и другие элементы с высоким порядковым номером, барий способен поглощать рентгеновское излучение. Поэтому BaSO4 используется при изготовлении защитных материалов для рентгеновских установок и при диагностике заболеваний желудочно-кишечного тракта.
РадийПоследним из щёлочноземельных металлов был открыт радий, для которого ещё Д.И.Менделеев выделил клетку в периодической системе. Радий обнаружили в 1898 г. в урановой смоляной руде. Исследовавшие минерал супруги Пьер и Мария Кюри установили: некоторые образцы руды имеют большую радиоактивность, чем следовало ожидать, судя по количеству содержащегося в них урана. Учёные сделали вывод, что в состав урановой руды входит новый элемент, по радиоактивности превосходящий уран. Вскоре удалось выделить его соединение. Элемент назвали радием, чтобы подчеркнуть его способность к радиоактивному распаду. Переработав почти тонну урановой руды, супруги Кюри выделили около 0,1 г соли радия, а металлический радий был получен в 1910 г. при электролизе раствора хлорида радия с ртутным катодом. Радий представляет собой тяжелый и тугоплавкий металл серебристо-белого цвета. В свободном виде он, как и другие щелочноземельные металлы, обладает высокой химической активностью, энергично реагирует с водой с выделением водорода: Ra + 2H2O = Ra(OH)2 + H2↑.Образующийся при этом гидроксид радия – сильное основание, хорошо растворимое в воде. При действии на него раствором сульфата натрия выпадает белый осадок сульфата радия, нерастворимый в кислотах.
Вскоре удалось выделить его соединение. Элемент назвали радием, чтобы подчеркнуть его способность к радиоактивному распаду. Переработав почти тонну урановой руды, супруги Кюри выделили около 0,1 г соли радия, а металлический радий был получен в 1910 г. при электролизе раствора хлорида радия с ртутным катодом. Радий представляет собой тяжелый и тугоплавкий металл серебристо-белого цвета. В свободном виде он, как и другие щелочноземельные металлы, обладает высокой химической активностью, энергично реагирует с водой с выделением водорода: Ra + 2H2O = Ra(OH)2 + H2↑.Образующийся при этом гидроксид радия – сильное основание, хорошо растворимое в воде. При действии на него раствором сульфата натрия выпадает белый осадок сульфата радия, нерастворимый в кислотах.
По химическим свойствам щелочноземельные металлы очень похожи на щелочные металлы, а магний имеет существенные отличия.
Во всех реакция магний и щелочноземельные металлы играют роль восстановителей и окисляются с образованием различных ионных соединений, содержащих ионы этих металлов с зарядом +2.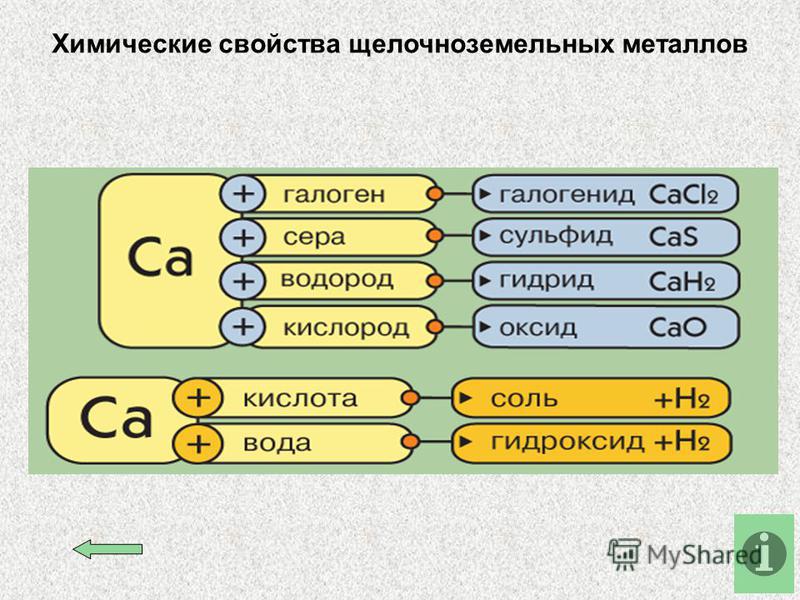
Щелочноземельные металлы уже при обычных условиях окисляются кислородом воздуха, а магний сгорает на воздухе при нагревании до 600 ̊ С; в результате образуются оксиды:
2Ca + O2 = 2CaO; 2Mg + O2 = 2MgO
Все рассматриваемые металлы при определенных условиях взаимодействуют с галогенами, серой, азотом, водородом:
Ca + Cl2 = CaCl2 Mg + Cl2 = MgCl2
Ca + S = CaS Mg + S = MgS
3Ca + N2 = Ca3N2 3Mg + N2 = Mg3N2
Ca + H2 = CaH2 Mg + H2 = MgH2
Щелочноземельные металлы активно реагируют с водой, а магний реагирует только с кипящей водой:
Реакция кальция с водой
Ca + 2H2O = Ca(OH)2 + H2↑
Mg + 2H2O = Mg(OH)2 + H2↑
Щелочноземельные металлы и магний энергично вытесняют водород из кислот:
Ca + 2HCl = CaCl2 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Таблица Менделеева online — Щёлочноземельные металлы
Щёлочноземельные металлы — химические элементы 2-й группы периодической таблицы элементов: бериллий Be, магний Mg, кальций Ca, стронций Sr, барий Ba, радий Ra.
Общая характеристика группы
К щёлочноземельным металлам чаще относят только кальций, стронций, барий и радий, реже магний и бериллий. Однако, согласно номенклатуре ИЮПАК, щёлочно-земельными металлами следует считать все элементы 2-й группы. Первый элемент этой группы, бериллий, по большинству свойств гораздо ближе к алюминию, чем к высшим аналогами группы, в которую он входит (диагональное сходство). Второй элемент этой группы, магний, уже проявляет некоторые общие свойства щелочноземельных металлов, но в остальном заметно отличается от них. Все щёлочноземельные металлы серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций). Рост плотности щёлочноземельных металлов наблюдается только начиная с кальция. Самый тяжёлый — радий, по плотности сравнимый с германием (ρ= 5,5 г/см3).
Некоторые атомные и физические свойства элементов группы
| Атомный номер |
символ |
Число природных изотопов | Атомная масса | Энергия ионизации, кДж·моль−1 | Сродство к электрону, кДж·моль−1 | ЭО | Металл. радиус, нм радиус, нм |
Ионный радиус, нм | tпл, °C |
tкип, °C |
ρ, г/см³ |
ΔHпл, кДж·моль−1 | ΔHкип, кДж·моль−1 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 4 | Бериллий Be | 1+11а | 9,012182 | 898,8 | 0,19 | 1,57 | 0,169 | 0,034 | 1278 | 2970 | 1,848 | 12,21 | 309 |
| 12 | Магний Mg | 3+19а | 24,305 | 737,3 | 0,32 | 1,31 | 0,24513 | 0,066 | 650 | 1105 | 1,737 | 9,2 | 131,8 |
| 20 | Кальций Ca | 5+19а | 40,078 | 589,4 | 0,40 | 1,00 | 0,279 | 0,099 | 839 | 1484 | 1,55 | 9,20 | 153,6 |
| 38 | Стронций Sr | 4+35а | 87,62 | 549,0 | 1,51 | 0,304 | 0,112 | 769 | 1384 | 2,54 | 9,2 | 144 | |
| 56 | Барий Ba | 7+43а | 137,327 | 502,5 | 13,95 | 0,89 | 0,251 | 0,134 | 729 | 1637 | 3,5 | 7,66 | 142 |
| 88 | Радий Ra | 46а | 226,0254 | 509,3 | — | 0,9 | 0,2574 | 0,143 | 700 | 1737 | 5,5 | 8,5 | 113 |
Элементы группы 2: щелочноземельные металлы
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 594
Щелочноземельные металлы группы 2 включают бериллий, магний, кальций, барий, стронций и радий и представляют собой мягкие серебряные металлы, которые по своему характеру менее металлические, чем щелочные металлы группы 1. Хотя многие характеристики являются общими для всей группы, более тяжелые металлы, такие как Ca, Sr, Ba и Ra, почти так же реакционноспособны, как и щелочные металлы группы 1. Все элементы группы 2 имеют по два электрона на своих валентных оболочках, что дает им степень окисления +2.
Хотя многие характеристики являются общими для всей группы, более тяжелые металлы, такие как Ca, Sr, Ba и Ra, почти так же реакционноспособны, как и щелочные металлы группы 1. Все элементы группы 2 имеют по два электрона на своих валентных оболочках, что дает им степень окисления +2.
- Группа 2: Химические свойства щелочноземельных металлов
- Охватывает элементы бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba). Включает тенденции атомных и физических свойств, тенденции реакционной способности, модели растворимости в гидроксидах и сульфатах, тенденции термического разложения нитратов и карбонатов и некоторые нетипичные свойства бериллия.
- Щелочные земли (группа II) Тенденции
- Группа 2: Общие свойства
- Реакции элементов 2 группы с кислотами
- Реакции элементов 2 группы с кислородом
- Реакции элементов 2 группы с водой
- Растворимость гидроксидов, сульфатов и карбонатов 90 010
- Термическая стабильность нитратов и карбонатов
- Группа 2: Физические свойства щелочноземельных металлов
- На этой странице исследуются тенденции изменения некоторых атомных и физических свойств элементов группы 2: бериллий, магний, кальций, стронций и барий .
 Разделы ниже охватывают тенденции изменения атомного радиуса, энергии первой ионизации, электроотрицательности и физических свойств.
Разделы ниже охватывают тенденции изменения атомного радиуса, энергии первой ионизации, электроотрицательности и физических свойств.
- Химия бериллия (Z=4)
- Название бериллий происходит от греческого beryllos, что является названием драгоценного камня берилла. Этот элемент представляет собой тугоплавкий серебристо-белый металл, который является первым представителем щелочноземельных металлов. Он мало распространен в окружающей среде и встречается в основном в минерале берилле с алюминием и кремнием.
- Бериллий фторид
- Некоторые нетипичные свойства соединений бериллия
- Химия магния (Z=12)
- Магний является элементом второй группы и восьмым по распространенности элементом в земной коре. Магний легкий, серебристо-белый и прочный. Как и алюминий, он образует вокруг себя тонкий слой, предотвращающий ржавление при контакте с воздухом.
 Мелкие частицы магния также могут загореться на воздухе.
Мелкие частицы магния также могут загореться на воздухе.
- Химия кальция (Z=20)
- Кальций является 20-м элементом периодической таблицы. Это металл группы 2, также известный как щелочноземельный металл, и у него нет заселенных электронов на d-орбитали. Кальций является пятым наиболее распространенным элементом по массе (3,4%) как в земной коре, так и в морской воде. Все живые организмы (на самом деле, даже мертвые) имеют и нуждаются в кальции для выживания. 9Химия стронция (Z=38)
- Стронций является элементом группы 2, который не встречается в свободном виде из-за реактивность с кислородом и водой. Он встречается в природе только в соединениях с другими элементами, такими как стронцианит. Он мягче кальция и энергичнее разлагает воду. Он имеет серебристый вид, но затем становится желтым с образованием оксида. Стронций назван в честь шотландской деревни на Стронтиане.
- Химия бария (Z=56)
- Барий – мягкий серебристо-белый металл с температурой плавления 1000 К.
 Из-за реакции на воздухе барий не встречается в природе в чистом виде. форме, но может быть извлечен из минерального барита.
Из-за реакции на воздухе барий не встречается в природе в чистом виде. форме, но может быть извлечен из минерального барита. - Бария гидроксид
- Бария сульфат
- Бура
- Химия радия (Z=88)
- Радий получил свое название от латинского слова «радиус» или «луч». Все изотопы радия радиоактивны, многие проявляют люминесценцию, легко реагируя с кислородом и водой. Металл был обнаружен и выделен в 1911 Марии Кюри.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Глава
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
Щелочноземельные металлы – периодическая таблица
Что такое щелочноземельные металлы
Щелочноземельные металлы – это элементы второй группы периодической таблицы, начиная с бериллия и заканчивая радием. Все они представляют собой серебристо-белые блестящие металлы, довольно реакционноспособные, хотя и не такие реакционноспособные, как щелочные металлы. Большинство из них обычно встречаются в природе, но не в их элементарной форме. Название «щелочная земля» происходит от их оксидов, щелочных земель. Ранние ученые называли эти соединения «землями», потому что они остаются твердыми в огне и нерастворимы в воде.
Пять из шести известных щелочноземельных металлов. Радий не показан, а барий и стронций погружены в масло, чтобы предотвратить их реакцию с атмосферой.
Природное происхождение и использование щелочноземельных металлов
Бериллий — очень легкий металл, встречающийся в минералах берилл и изумруд. В реактивных истребителях, внутренних системах наведения и некоторых гоночных автомобилях используется бериллий или его сплавы из-за их низкой плотности.
Металлический магний входит в состав бенгальских огней и продается в различных формах, таких как английская соль (сульфат магния) и магнезиальное молоко (гидроксид магния). Он также играет важную роль во многих биологических процессах, включая фотосинтез (как компонент хлорофилла) и ферментативные реакции в организме человека (как кофактор).
Кальций необходим для крепких костей в организме и содержится в кальците и арагоните, важных минералах, участвующих в круговороте углерода на Земле.
Стронций придает фейерверкам красный цвет. Соотношение его различных изотопов в зубах может рассказать археологам о диете древних людей.
Буровой раствор для нефтяных скважин включает сульфат бария, и геохимики могут использовать хлорид бария для определения концентрации ионов сульфата в пробах воды.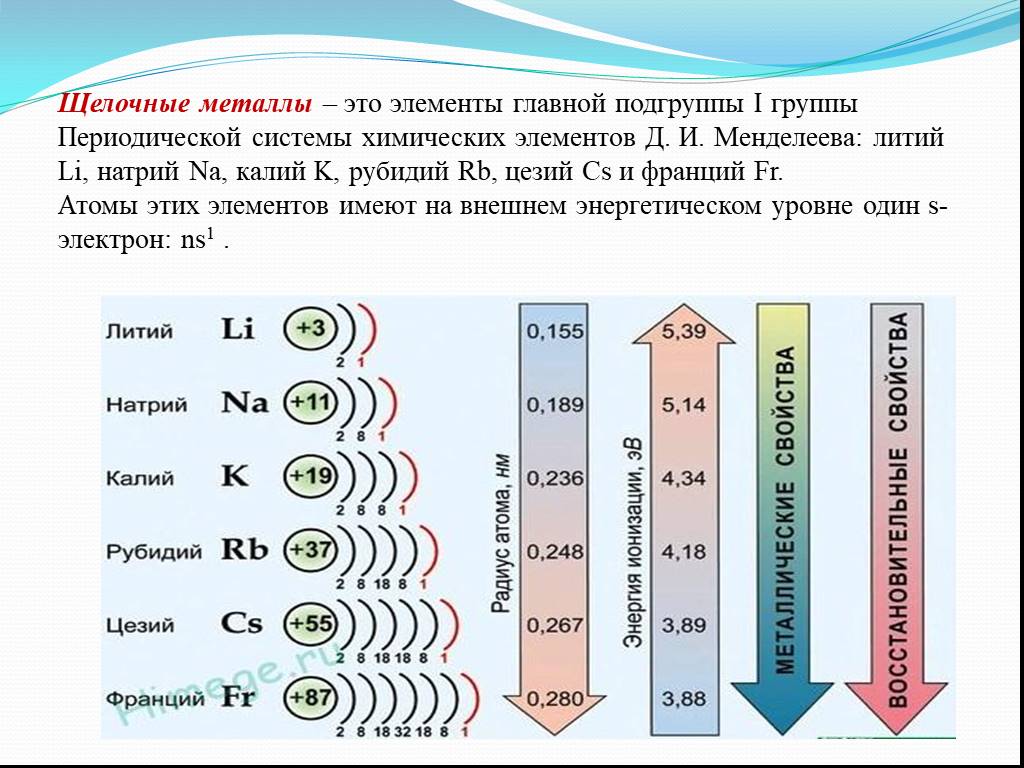
Открытие щелочноземельных металлов
Английский химик по имени сэр Хамфри Дэви выделил магний, кальций, барий и стронций в 1808 году. Он образовал амальгамы металлов с ртутью с помощью электролиза, а затем отогнал большую часть ртути.
Французский ученый Николя-Луи Воклен открыл бериллий в его оксидной форме в 1798 году. Его коллега француз Антуан Бюсси и немецкий химик Фридрих Велер независимо друг от друга выделили металлическую форму в 1828 году.
Мария Кюри и ее муж Пьер сделали открытие Радий намного позже, в 189 г.8. Их исследование радиоактивности радия, а также полония в постпереходном металле принесло Кюри долю Нобелевской премии по физике 1903 года.
Свойства щелочноземельных металлов
Находясь во второй группе, все щелочноземельные элементы имеют 2 электрона на внешней электронной оболочке, на s-орбитали. Все они имеют значительно более высокую температуру плавления, чем щелочные металлы. Обычно они мягче и менее плотные, чем переходные металлы.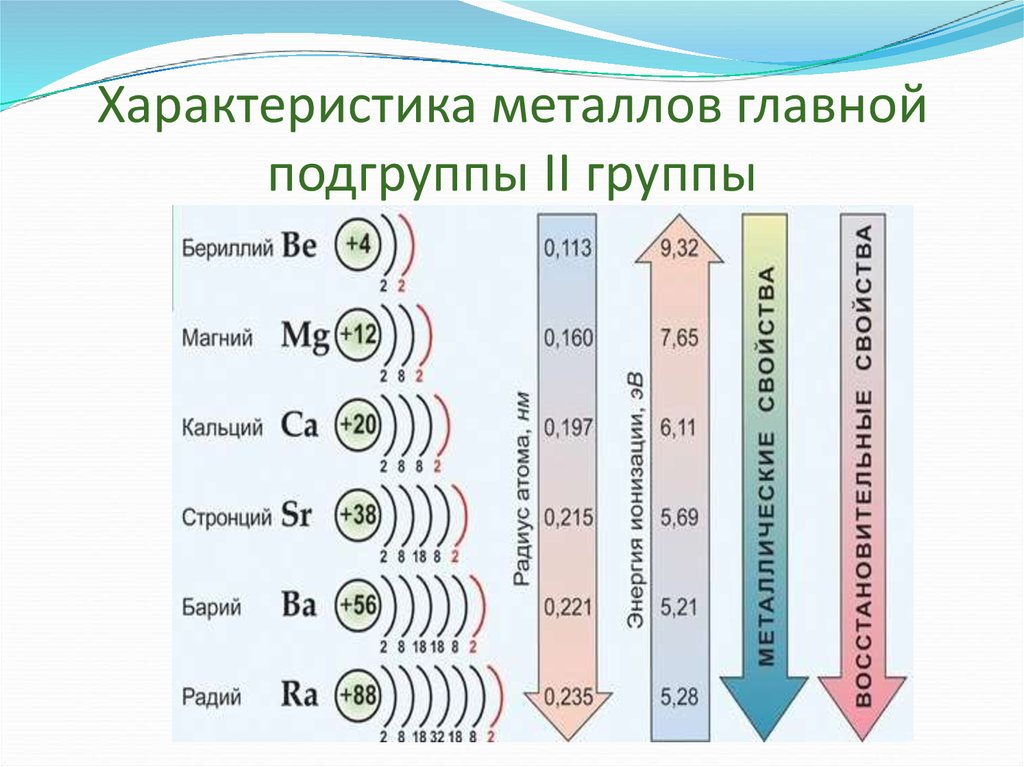 Кальций самый легкий, а радий самый плотный.
Кальций самый легкий, а радий самый плотный.
Магния и кальция достаточно много как в земной коре, так и в морской воде. Бериллий значительно реже встречается в земной коре, чем другие 4 нерадиоактивных металла.
Реакционная способность щелочноземельного металла увеличивается по мере продвижения вниз по колонке. Бериллий не реагирует с водой, магний реагирует с паром, кальций медленно реагирует с холодной водой, а стронций и барий быстрее. Барий более реакционноспособен, чем другие металлы, потому что 2s-орбитальные электроны, которые он теряет, находятся дальше от ядра и, следовательно, легче удаляются.
Список всех щелочноземельных металлов
Бериллий, магний, кальций, стронций, барий и радий.
Химия щелочноземельных металлов
Химический состав этих элементов довольно схож. Они существуют почти исключительно в степени окисления +2. Когда они реагируют с водой, они образуют гидроксид и газообразный водород. Реакция с азотной кислотой или соляной кислотой протекает довольно бурно, а концентрированная азотная кислота может выделять токсичный диоксид азота. Однако эти металлы часто не реагируют в значительной степени с серной кислотой.
Однако эти металлы часто не реагируют в значительной степени с серной кислотой.
Химический состав бериллия отличается от других щелочноземельных металлов. Хлорид бериллия, BeCl 2 , обладает ковалентными свойствами, а гидроксид бериллия, Be(OH) 2 , является амфотерным, что означает, что он может действовать как кислота или основание. Он образует комплексы легче, чем другие металлы. Вы можете прочитать больше об интересной химии бериллия здесь.
Отделить магний от кальция в растворе может быть очень сложно. Однако сульфат кальция имеет очень низкую растворимость в воде, особенно при добавлении избытка сульфата натрия, тогда как сульфат магния хорошо растворим в воде.
Соли щелочноземельных металлов, как правило, бесцветные или белые, но манганат бария, перманганат бария, дихромат бария и хромат бария сильно окрашены.
Забавные факты о щелочноземельных элементах
- Бериллий очень токсичен, как в виде пыли, так и в его соединениях.
 Это канцероген 1 класса.
Это канцероген 1 класса. - Растворимые соединения бария также весьма токсичны, хотя и не так сильно, как соединения бериллия.
- Металлический магний часто продается в виде ленты. Эта лента так ярко горит при поджигании, что смотреть прямо на нее может быть вредно.
- Магний участвует в более чем 300 различных ферментативных реакциях в организме человека.
- Зубные пасты, предназначенные для людей с чувствительными зубами, часто содержат хлорид стронция.
- Соли бария часто используются для получения чистых кислот путем их фиксации серной кислотой. Сульфат бария выпадает в осадок, остается только сопряженная кислота бариевой соли.
- Все изотопы радия радиоактивны, и многие из них люминесцентны.
- Элемент 120 войдет в эту группу, если ученым удастся его синтезировать.
- Точки плавления и плотности щелочноземельных элементов трудно предсказать, исходя из их положения.
- Мария Кюри и ее муж потратили сотни часов на очистку тонн настурана, чтобы выделить 0,1 грамма хлорида радия в 1902 году.