таблица электропроводность, таблица — Справочник химика 21
Пользуясь таблицей предельных подвижностей ионов (табл. ХУП, 2) и законом Кольрауша, можно легко вычислить предельную электропроводность соответствующих растворов [c.430]
| Таблица 61. Влияние присадок различного назначения на электризацию [14, 16] и электропроводность [50] топлива Т-1 (потенциал электризации без присадок 2800 В, электропроводность 3,6 пСм) |
ТАБЛИЦА 81. УДЕЛЬНЫЕ электропроводность и ЭЛЕКТРОСОПРОТИВЛЕНИЕ РАЗЛИЧНЫХ РАСТВОРОВ [c.359]
Во время этих приготовлений следует очень осторожно обращаться с платиновыми электродами не касаться их руками и не нарушать их взаимного расположения во избежание дополнительной проверки емкостного сопротивления сосуда. По истечении 30 мин (время, в течение которого вода принимает температуру термостата) прибор включить в схему мостика Кольрауша для измерения электропроводности. Включить генератор звуковой частоты н в магазине сопротивлений установить сопротивление 1000—2000 ом. Опыт выполняют два экспериментатора одип измеряет электропроводность, другой по секундомеру записывает время и показания реохорда. Секундомер включить в тот момент, когда пробка 4 с укрепленной на ней пластинкой растворяемого вещества будет погружена в воду. Этот момент будет моментом начала опыта. Через 5 мин сделать первое измерение сопротивления раствора и результаты записать в таблицу по образцу [c.437]
Согласно работам советских исследователей, каталитическая активность некоторых простых окислов сильно изменяется при замещении кислорода на металлоиды VI6 подгруппы Периодической системы. Учитывая это, авторы исследовали каталитические свойства различных замещенных хромитов в модельных реакциях изотопного обмена между водородом и тяжелой водой дегидрирования изопропилового спирта и конверсий метанола. Рассмотрены методы получения различных халькогенидов, обладающих достаточно большой поверхностью, чтобы обеспечить значительную активность при низких температурах, и показано, что активность, как правило, снижается в ряду О -> S -> Se. Для производных кобальта и цинка может наблюдаться обратный порядок. Предпринята попытка найти корреляцию между изменением активности и электропроводностью. Таблиц 3. Иллюстраций 4. Библ. 9 назв.
[c.474]Если электропроводность объясняется перезарядкой ионов, зонная теория полупроводников, по-видимому, в простейшем виде неприменима не происходит полного вырождения уровней валентных электронов в отдельных ионах, а сохраняется периодичность в энергетическом спектре валентных электронов кристалла. Катионы решетки находятся в потенциальной яме, так что переход электрона от катиона к катиону требует энергии активации, а длина свободного пробега электрона соответствует междуатомным расстояниям в кристаллической решетке. В таком случае энергия активации определяется не только параметрами атома, образующего катион (т. е. в конечном счете его положением в таблице Менделеева), но и межатомными расстояниями в кристалле, что указывает на значение геометрических параметров кристалла в отношении его каталитической активности.
Когда все приготовлено, пробку опускают в сосуд так, чтобы пластина вещества погрузилась в воду. В этот момент включают секундомер. Через 5 мин производят первое измерение сопротивления (электропроводности) раствора, занося результаты в таблицу. В течение первого часа производят измерение через каждые 5 мин, затем через 10—20 мин и прекращают после того, как электропроводность принимает постоянное значение.
[c.162]Из данных таблицы видно, что полимерные соединения при добавлении их в топливо Т-7 в концентрациях 0,0001—0,025% повышают, по сравнению с солями СЖК, электропроводность топлива в незначительной степени. Содержание азота и молекулярная масса полимерных соединений не влияют на электропроводность топлива. [c.58]
Данные таблицы свидетельствуют о том, что с повышением приложенного напряжения и увеличением продолжительности его приложения (время до замера) абсолютная величина электропроводности уменьшается. Следует отметить, что при более высокой электропроводности она уменьшается во времени быстрее и значительнее. Это может быть объяснено происходящими под действием электрического поля процессами электроочистки заряженных частиц, имеющих в топливе и обусловливающих его электропроводящие свойства [3]. Поэтому наиболее точными следует считать результаты, измерений, полученные в момент подачи напряжения на образец.
Подвижность можно определить из вполне доступных измерений электропроводности х, а также чисел переноса. Если к задана в обычных единицах, в каких единицах получатся значения а) ионной электропроводности, б) ионной подвижности, в) эквивалентной электропроводности Проверьте, в каких единицах (по определению) задается подвижность. В таблицах обычно приводятся значения ионной электропроводности. [c.329]
В табл. 17 приведены значения электропроводности растворов НС1 в разных раствррителях, а также диэлектрические проницаемости этих растворителей. Как следует из таблицы, электропроводность растворов НС1 в метиловом спирте почти в 4 раза меньше, чем в воде, что трудно объяснить уменьшением скорости движения ионов. Низкая электропроводность в неводных средах определяется в основном малой степенью диссоциации [c.120]
Указанный характер изменения электропроводности в процессе титрования объяснить легко. Вводимые со щелочью ионы ОН связывают водородные ионы кислоты, образуя воду. На место водородных ионов в раствор поступает эквивалентное количество ионов Na (в случае применения NaOH). Из таблицы 3 видно, что подвижность иона Н в семь с лишним раз превосходит подвижность иона Na, Понятно, что замена подвижных ионов Н менее
[c.40]В поверхностном слое градиент достигал около 30 ме/км и был направлен по меридиану с севера на юг. На глубине 250 м разность потенциалов между электродами, находившимися в одной горизонтальной плоскости на расстоянии 100 ж друг от друга, вела себя так, как представлено на копии регистрации на рис. 657. Судно, лежавшее в дрейфе, преиму-ш ественно с курсовым углом 163″ , иногда приводилось в меридиан. Это вызывало некоторое увеличение разности потенциалов и показывало, что градиент потенциала тут, также как и на поверхности океана, направлен с севера на юг. Внеся поправку на остаточную собственную разность потенциалов между электродами, можно было считать, что на глубине 250ж градиент потенциала вдоль меридиана равен около 80 мв км. Температура была = 14,7 , соленость 5 = 36,0 /оэ- Значит, по таблицам, электропроводность была
Измерение электропроводности проводится тем чапде, чем выше температура огн .1та. Два-трн измерения произвеспп через 30 сск, четы )е-пять измерений — через 1 мин, два-трн измерения — через 5 мин одно после другого, далее сделать измерения через 10 мин, через 1 ч и еще через 1 ч. Постоянство показаний реохорда указывает иа конец реакции . Результаты измерений записать в таблицу ио образцу. [c.369]
Поверхностная электропроводность (проводимость) стекла вызывается конденсацией влаги в порах поверХност иой пленки, имеющейся на каждом стекле, и растворением некоторых составных ч стей стекла в этой влаге. При помещении стекла во влажную атмосферу вначале наблюдается повышение проводимости, что обусловлено конденсацией влаги в порах пленки и образованием сплоишого жидкого елея. Вследствие сильного разбавления растворов начальные значения поверхностной проводимости мало зависят от состава стекла. Последующие процессы разрушения стекла и диффузия растворимых продуктов в жидкий слой вызывают повышение проводимости. Прн достижении насыщения свойства раствора определяются составом стекла каждый сорт имеет характерную поверхностную проводимость, указанную в таблице для температуры 20 С и относительной влажности воздуха 8в%.
[c.328]Из таблицы вытекает, что наиболее нежелательными являются элементы II группы (Аз, 5Ь и В1), которые распределяются по всем трем продуктам электролиза. Скорости разряда ионов Аз, 5Ь и В на катоде весьма малы, однако они попадают в катодный металл другим путем. Соединения этих элементов склонны к гидролизу, образуя гелеобразные взвеси, например 5Ь(ОН)з, В1(0Н)з,НАз02 ( плавучий шлам). Взвеси катафоретически переносятся к катоду и включаются в катодный осадок. Попадание этих примесей в катод следует исключить, так как даже незначительное количество сурьмы в катодной меди снижает ее пластичность, содержание 0,02% мышьяка уменьшает электропроводность меди на 15%. Лучшим методом борьбы является максимальное удаление этих примесей еще при огневом рафинировании. Включение примесей в катод несколько снижается при повышении кислотности электролита, препятствующей гидролизу солей этих элементов. Свинец и олово практически не растворяются и целиком поступают в шлам в виде РЬ504 и НаЗпОз.
chem21.info
Таблица удельного электросопротивления медных проводников
Одним из самых распространённых металлов для изготовления проводов является медь. Её электросопротивление минимальное из доступных по цене металлов. Оно меньше только у драгоценных металлов (серебра и золота) и зависит от разных факторов.
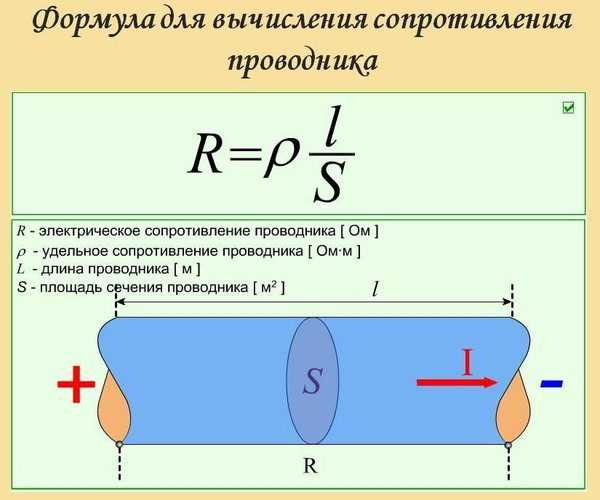
Формула вычисления сопротивления проводника
Что такое электрический ток
На разных полюсах аккумулятора или другого источника тока есть разноимённые носители электрического заряда. Если их соединить с проводником, носители заряда начинают движение от одного полюса источника напряжения к другому. Этими носителями в жидкости являются ионы, а в металлах – свободные электроны.
Определение. Электрический ток – это направленное движение заряженных частиц.
Удельное сопротивление
Удельное электрическое сопротивление – это величина, определяющая электросопротивление эталонного образца материала. Для обозначения этой величины используется греческая буква «р». Формула для расчета:
p=(R*S)/l.
Эта величина измеряется в Ом*м. Найти её можно в справочниках, в таблицах удельного сопротивления или в сети интернет.
Свободные электроны по металлу двигаются внутри кристаллической решётки. На сопротивление этому движению и удельное сопротивление проводника влияют три фактора:
- Материал. У разных металлов различная плотность атомов и количество свободных электронов;
- Примеси. В чистых металлах кристаллическая решётка более упорядоченная, поэтому сопротивление ниже, чем в сплавах;
- Температура. Атомы не находятся на своих местах неподвижно, а колеблются. Чем выше температура, тем больше амплитуда колебаний, создающая помехи движению электронов, и выше сопротивление.
На следующем рисунке можно увидеть таблицу удельного сопротивления металлов.

Удельное сопротивление металлов
Интересно. Есть сплавы, электросопротивление которых падает при нагреве или не меняется.
Проводимость и электросопротивление
Так как размеры кабелей измеряются в метрах (длина) и мм² (сечение), то удельное электрическое сопротивление имеет размерность Ом·мм²/м. Зная размеры кабеля, его сопротивление рассчитывается по формуле:
R=(p*l)/S.
Кроме электросопротивления, в некоторых формулах используется понятие «проводимость». Это величина, обратная сопротивлению. Обозначается она «g» и рассчитывается по формуле:
g=1/R.
Проводимость жидкостей
Проводимость жидкостей отличается от проводимости металлов. Носителями зарядов в них являются ионы. Их количество и электропроводность растут при нагревании, поэтому мощность электродного котла растёт при нагреве от 20 до 100 градусов в несколько раз.
Интересно. Дистиллированная вода является изолятором. Проводимость ей придают растворенные примеси.
Электросопротивление проводов
Самые распространенные металлы для изготовления проводов – медь и алюминий. Сопротивление алюминия выше, но он дешевле меди. Удельное сопротивление меди ниже, поэтому сечение проводов можно выбрать меньше. Кроме того, она прочнее, и из этого металла изготавливаются гибкие многожильные провода.
В следующей таблице показывается удельное электросопротивление металлов при 20 градусах. Для того чтобы определить его при других температурах, значение из таблицы необходимо умножить на поправочный коэффициент, различный для каждого металла. Узнать этот коэффициент можно из соответствующих справочников или при помощи онлайн-калькулятора.
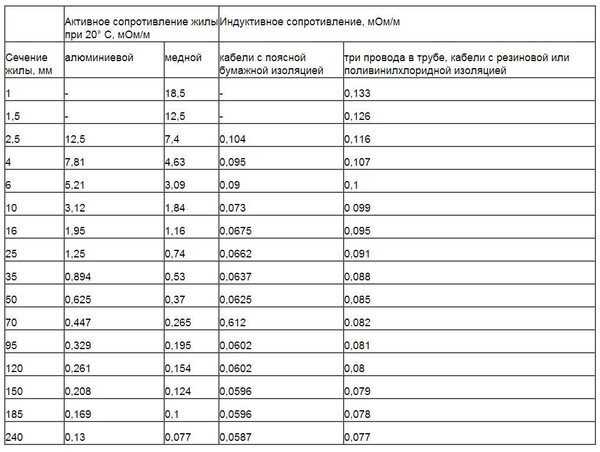
Сопротивление проводов
Выбор сечения кабеля
Поскольку у провода есть сопротивление, при прохождении по нему электрического тока выделяется тепло, и происходит падение напряжения. Оба этих фактора необходимо учитывать при выборе сечения кабелей.
Выбор по допустимому нагреву
При протекании тока в проводе выделяется энергия. Её количество можно рассчитать по формуле электрической мощности:
P=I²*R.
В медном проводе сечением 2,5мм² и длиной 10 метров R=10*0.0074=0.074Ом. При токе 30А Р=30²*0,074=66Вт.
Эта мощность нагревает токопроводящую жилу и сам кабель. Температура, до которой он нагревается, зависит от условий прокладки, числа жил в кабеле и других факторов, а допустимая температура – от материала изоляции. Медь обладает большей проводимостью, поэтому меньше выделяемая мощность и необходимое сечение. Определяется оно по специальным таблицам или при помощи онлайн-калькулятора.

Таблица выбора сечения провода по допустимому нагреву
Допустимые потери напряжения
Кроме нагрева, при прохождении электрического тока по проводам происходит уменьшение напряжения возле нагрузки. Эту величину можно рассчитать по закону Ома:
U=I*R.
Справка. По нормам ПУЭ оно должно составлять не более 5% или в сети 220В – не больше 11В.
Поэтому, чем длиннее кабель, тем больше должно быть его сечение. Определить его можно по таблицам или при помощи онлайн-калькулятора. В отличие от выбора сечения по допустимому нагреву, потери напряжения не зависят от условий прокладки и материала изоляции.
В сети 220В напряжение подаётся по двум проводам: фазному и нулевому, поэтому расчёт производится по двойной длине кабеля. В кабеле из предыдущего примера оно составит U=I*R=30A*2*0.074Ом=4,44В. Это немного, но при длине 25 метров получается 11,1В – предельно допустимая величина, придётся увеличивать сечение.
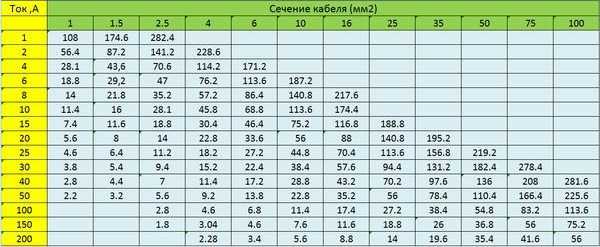
Максимально допустимая длина кабеля данного сечения
Электросопротивление других металлов
Кроме меди и алюминия, в электротехнике используются другие металлы и сплавы:
- Железо. Удельное сопротивление стали выше, но она прочнее, чем медь и алюминий. Стальные жилы вплетаются в кабеля, предназначенные для прокладки по воздуху. Сопротивление железа слишком велико для передачи электроэнергии, поэтому при расчёте сечения жилы не учитываются. Кроме того, оно более тугоплавкое, и из него изготавливаются вывода для подключения нагревателей в электропечах большой мощности;
- Нихром (сплав никеля и хрома) и фехраль (железо, хром и алюминий). Они обладают низкой проводимостью и тугоплавкостью. Из этих сплавов изготавливаются проволочные резисторы и нагреватели;
- Вольфрам. Его электросопротивление велико, но это тугоплавкий металл (3422 °C). Из него изготавливаются нити накала в электролампах и электроды для аргонно-дуговой сварки;
- Константан и манганин (медь, никель и марганец). Удельное сопротивление этих проводников не меняется при изменениях температуры. Применяются в претензионных приборах для изготовления резисторов;
- Драгоценные металлы – золото и серебро. Обладают самой высокой удельной проводимостью, но из-за большой цены их применение ограничено.
Индуктивное сопротивление
Формулы для расчёта проводимости проводов справедливы только в сети постоянного тока или в прямых проводниках при низкой частоте. В катушках и в высокочастотных сетях появляется индуктивное сопротивление, во много раз превышающее обычное. Кроме того, ток высокой частоты распространяется только по поверхности провода. Поэтому его иногда покрывают тонким слоем серебра или используют литцендрат.
Справка. Литцендрат – это многожильный провод, каждая жила в котором изолирована от остальных. Это делается для увеличения поверхности и проводимости в сетях высокой частоты.
Удельное сопротивление меди, гибкость, относительно невысокая цена и механическая прочность делают этот металл, вместе с алюминием, самым распространенным материалом для изготовления проводов.
Видео
Оцените статью:elquanta.ru
Электропроводность в параметры, таблица — Справочник химика 21
Получались стеклообразные сплавы ЗЗе- первоначально эластичными, подобно пластичной сере, затем на воздухе в течение суток стекла затвердевали. В табл. 17 приведены плотность и параметры электропроводности полученных стекол. Для сравнения в таблице приведены данные измерения электропроводности пластической серы [79]. Температура, при которой прЬ-изводились измерения электропроводности стекол, не превышала 40° С. Выше этой температуры стекла размягчались. Электропроводности параллельных образцов различаются в пределах 0,3—0,4 порядка. Величины электропроводности для всех трех составов при комнатной температуре имеют близкие значения (10 —10 см ), для пластической серы получено а— 10 ом см К [c.60]Если электропроводность объясняется перезарядкой ионов, зонная теория полупроводников, по-видимому, в простейшем виде неприменима не происходит полного вырождения уровней валентных электронов в отдельных ионах, а сохраняется периодичность в энергетическом спектре валентных электронов кристалла. Катионы решетки находятся в потенциальной яме, так что переход электрона от катиона к катиону требует энергии активации, а длина свободного пробега электрона соответствует междуатомным расстояниям в кристаллической решетке. В таком случае энергия активации определяется не только параметрами атома, образующего катион (т. е. в конечном счете его положением в таблице Менделеева), но и межатомными расстояниями в кристалле, что указывает на значение геометрических параметров кристалла в отношении его каталитической активности. [c.29]
На основании подлинных экспериментальных данных установлено фазовое состояние каждой системы (температура плавления и состав эвтектических и перитектических смесей, максимумов и минимумов). Для наиболее сложных систем приведены таблицы ликвидуса и солидуса, диаграмма плавкости и материал, характеризующий превращение системы в твердом состоянии. Текст, таблица н рисунок дополняют друг друга. Для простых систем даны лишь характеристики нонвариантных точек. В справочник включены данные о различных физических параметрах, используемых отдельными авторами для характеристики структур вновь образованных промежуточных фаз, такие, как плотность, электропроводность, показатель преломления, и указаны параметры элементарной ячейки. Приведены данные по растворимости фаз в различных органических растворителях, воде и кислотах. [c.14]
В работах по изучению электропроводности результаты обычно приводятся в виде графиков зависимости эквивалентной электропроводности от концентрации и таблиц, содержащих числовые параметры уравнения Фуосса—Онзагера. Однако для практического использования необходимы значения удельной электропроводности. Поэтому в дальнейшем экспериментальные данные будут представлены не только значениями параметров уравнения Фуосса Онзагера, но там, где это возможно, значениями удельных электропроводностей при различных концентрациях. [c.65]
В табл. 39 приведены составы исследованных стекол системы Аз—Ое—5, их плотность, микротвердость, а также параметры электропроводности и lga ). В таблице даны также рас- [c.108]
В табл. 55 проведено сопоставление параметров электропроводности у стеклообразных сплавов системы Bi—Ge—Se с различным содержанием висмута. Содержание германия в сплавах остается постоянным и равным 20 ат. %. Из данных таблицы видно, что при повышении содержания висмута в стеклообразных сплавах от 2,5 до 10 ат. %, как и при изменении содержания германия, параметры электропроводности остаются практически неизменными. В табл. 55 проведено также сопоставление параметров электропроводности у двух одинаковых составов в системах висмут—германий—селен и сурьма—германий—делен. При замене сурьмы на висмут в приведенных стеклообразных сплавах также практически не происходит изменения ни проводимости, ни энергии активации электропроводности. [c.153]
На диаграммной ленте самописца вертикальными отметками отмечаются поочередно величины всех трех измерений (рис. 7), Полученный график дает четкую картину изменения всех трех параметров в течение всего периода выпадения осадков и их взаимную зависимость (например, зависимость изменения электропроводности и pH от температуры поступающей воды). Для систематизации полученного материала может возникнуть необходимость иметь величины измеряемых параметров, приведенные к постоянной температуре. Здесь можно воспользоваться уже известными [10] таблицами и графиками. [c.224]
Справочник содержит обширную сводку сведений по теоретической в прикладной электрохимии. Рассмотрено около 300 уравнений электрохимии. Даны таблицы значений электропроводности, вязкости, чисел переноса и диугих свойств электролитов в водных и расплавленных средах. Приведено более 1000 стандартных электродных потенциалов, около 300 кинетических параметров и более 1500 потенциалов полуволн электрохимических реакций, около 80 значений потенциалов нулевого заряда. Впервые публикуется сводка характеристик пассивного состояния металлов. Представлены основные показатели технологических режимов важнейших электрохимических производств, а также характеристики химических источников электрической энергии. [c.2]
Электрохимия растворов представлена характеристиками переносных и термодинамических свойств электролитов. Объем данных по электропроводности значительно обновлен и увеличен по сравнению с таблицами Справочника химика или Электрохимическими константами Добоша. Характеристики вязкости представлены в форме параметров единого эмпирического уравнения, что позволило охватить широкий интервал концентраций и температур. Таблицы сглаженных значений коэффициентов активности электролитов, осмотических коэффициентов и активности воды в растворах являются к настоящему времени наиболее полными и надежными. [c.7]
Справочник соетоит из двух частей. Первая часть включает тройные системы, соли которых имеют общий анион (А, В, С X), вторая — тройные системы с общим катионом (А X, У, 2). Системы охватывают соли практически всех элементов периодической таблицы Д. И. Менделеева, в том числе многих редких, получивпшх пшрокое распространение в связи с развитием новых отраслей промышленности. Как и в других книгах издайия, системы расположены в алфавитном порядке символов элементов, причем элементы низшей валентности предшествуют тем же элементам более высокой валентности. Для систем, изученных несколькими авторами, экспериментальные данные располагаются в хронологической последовательности их опубликования. Для каждой системы указаны автор, метод исследования, заключение о характере взаимодействия компонентов, литературный источник. В качестве основньГх методов экспериментального исследования использованы визуально-политермический и термографический. Кроме того, при измерении различных физических параметров, служащих для характеристики структур вновь образованных промежуточных фаз, были использованы рентгенофазовый, тензиметрический и кристаллооптический методы, проводилось определение электропроводности, показателя преломления и др. [c.3]
chem21.info
Электрическое сопротивление и проводимость
Дата публикации: .
При замыкании электрической цепи, на зажимах которой имеется разность потенциалов, возникает электрический ток. Свободные электроны под влиянием электрических сил поля перемещаются вдоль проводника. В своем движении электроны наталкиваются на атомы проводника и отдают им запас своей кинетической энергии. Скорость движения электронов непрерывно изменяется: при столкновении электронов с атомами, молекулами и другими электронами она уменьшается, потом под действием электрического поля увеличивается и снова уменьшается при новом столкновении. В результате этого в проводнике устанавливается равномерное движение потока электронов со скоростью нескольких долей сантиметра в секунду. Следовательно, электроны, проходя по проводнику, всегда встречают с его стороны сопротивление своему движению. При прохождении электрического тока через проводник последний нагревается.
Электрическое сопротивление
Электрическим сопротивлением проводника, которое обозначается латинской буквой r, называется свойство тела или среды превращать электрическую энергию в тепловую при прохождении по нему электрического тока.
На схемах электрическое сопротивление обозначается так, как показано на рисунке 1, а.
| Рисунок 1. Условное обозначение электрического сопротивления |
Переменное электрическое сопротивление, служащее для изменения тока в цепи, называется реостатом. На схемах реостаты обозначаются как показано на рисунке 1, б. В общем виде реостат изготовляется из проволоки того или иного сопротивления, намотанной на изолирующем основании. Ползунок или рычаг реостата ставится в определенное положение, в результате чего в цепь вводится нужное сопротивление.
Длинный проводник малого поперечного сечения создает току большое сопротивление. Короткие проводники большого поперечного сечения оказывают току малое сопротивление.
Если взять два проводника из разного материала, но одинаковой длины и сечения, то проводники будут проводить ток по-разному. Это показывает, что сопротивление проводника зависит от материала самого проводника.
Температура проводника также оказывает влияние на его сопротивление. С повышением температуры сопротивление металлов увеличивается, а сопротивление жидкостей и угля уменьшается. Только некоторые специальные металлические сплавы (манганин, констаитан, никелин и другие) с увеличением температуры своего сопротивления почти не меняют.
Итак, мы видим, что электрическое сопротивление проводника зависит от: 1) длины проводника, 2) поперечного сечения проводника, 3) материала проводника, 4) температуры проводника.
За единицу сопротивления принят один Ом. Ом часто обозначается греческой прописной буквой Ω (омега). Поэтому вместо того чтобы писать «Сопротивление проводника равно 15 Ом», можно написать просто: r = 15 Ω.
1 000 Ом называется 1 килоом (1кОм, или 1кΩ),
1 000 000 Ом называется 1 мегаом (1мгОм, или 1МΩ).
При сравнении сопротивления проводников из различных материалов необходимо брать для каждого образца определенную длину и сечение. Тогда мы сможем судить о том, какой материал лучше или хуже проводит электрический ток.
Видео 1. Сопротивление проводников
Удельное электрическое сопротивление
Сопротивление в омах проводника длиной 1 м, сечением 1 мм² называется удельным сопротивлением и обозначается греческой буквой ρ (ро).
В таблице 1 даны удельные сопротивления некоторых проводников.
Таблица 1
Удельные сопротивления различных проводников
| Материал проводника | Удельное сопротивление ρ в |
| Серебро Медь Алюминий Вольфрам Железо Свинец Никелин (сплав меди, никеля и цинка) Манганин (сплав меди, никеля и марганца) Константан (сплав меди, никеля и алюминия) Ртуть Нихром (сплав никеля, хрома, железа и марганца) | 0,016 0,0175 0,03 0,05 0,13 0,2 0,42 0,43 0,5 0,94 1,1 |
Из таблицы видно, что железная проволока длиной 1 м и сечением 1 мм² обладает сопротивлением 0,13 Ом. Чтобы получить 1 Ом сопротивления нужно взять 7,7 м такой проволоки. Наименьшим удельным сопротивлением обладает серебро. 1 Ом сопротивления можно получить, если взять 62,5 м серебряной проволоки сечением 1 мм². Серебро – лучший проводник, но стоимость серебра исключает возможность его массового применения. После серебра в таблице идет медь: 1 м медной проволоки сечением 1 мм² обладает сопротивлением 0,0175 Ом. Чтобы получить сопротивление в 1 Ом, нужно взять 57 м такой проволоки.
Химически чистая, полученная путем рафинирования, медь нашла себе повсеместное применение в электротехнике для изготовления проводов, кабелей, обмоток электрических машин и аппаратов. Широко применяют также в качестве проводников алюминий и железо.
Сопротивление проводника можно определить по формуле:
где r – сопротивление проводника в омах; ρ – удельное сопротивление проводника; l – длина проводника в м; S – сечение проводника в мм².
Пример 1. Определить сопротивление 200 м железной проволоки сечением 5 мм².
Пример 2. Вычислить сопротивление 2 км алюминиевой проволоки сечением 2,5 мм².
Из формулы сопротивления легко можно определить длину, удельное сопротивление и сечение проводника.
Пример 3. Для радиоприемника необходимо намотать сопротивление в 30 Ом из никелиновой проволоки сечением 0,21 мм². Определить необходимую длину проволоки.
Пример 4. Определить сечение 20 м нихромовой проволоки, если сопротивление ее равно 25 Ом.
Пример 5. Проволока сечением 0,5 мм² и длиной 40 м имеет сопротивление 16 Ом. Определить материал проволоки.
Материал проводника характеризует его удельное сопротивление.
По таблице удельных сопротивлений находим, что таким сопротивлением обладает свинец.
Выше было указано, что сопротивление проводников зависит от температуры. Проделаем следующий опыт. Намотаем в виде спирали несколько метров тонкой металлической проволоки и включим эту спираль в цепь аккумулятора. Для измерения тока в цепь включаем амперметр. При нагревании спирали в пламени горелки можно заметить, что показания амперметра будут уменьшаться. Это показывает, что с нагревом сопротивление металлической проволоки увеличивается.
У некоторых металлов при нагревании на 100° сопротивление увеличивается на 40 – 50 %. Имеются сплавы, которые незначительно меняют свое сопротивление с нагревом. Некоторые специальные сплавы практически не меняют сопротивления при изменении температуры. Сопротивление металлических проводников при повышении температуры увеличивается, сопротивление электролитов (жидких проводников), угля и некоторых твердых веществ, наоборот, уменьшается.
Способность металлов менять свое сопротивление с изменением температуры используется для устройства термометров сопротивления. Такой термометр представляет собой платиновую проволоку, намотанную на слюдяной каркас. Помещая термометр, например, в печь и измеряя сопротивление платиновой проволоки до и после нагрева, можно определить температуру в печи.
Изменение сопротивления проводника при его нагревании, приходящееся на 1 Ом первоначального сопротивления и на 1° температуры, называется температурным коэффициентом сопротивления и обозначается буквой α.
Если при температуре t0 сопротивление проводника равно r0, а при температуре t равно rt, то температурный коэффициент сопротивления
Примечание. Расчет по этой формуле можно производить лишь в определенном интервале температур (примерно до 200°C).
Приводим значения температурного коэффициента сопротивления α для некоторых металлов (таблица 2).
Таблица 2
Значения температурного коэффициента для некоторых металлов
| Металл | α |
| Металл | α |
| Серебро Медь Железо Вольфрам Платина | 0,0035 0,0040 0,0066 0,0045 0,0032 | Ртуть Никелин Константан Нихром Манганин | 0,0090 0,0003 0,000005 0,00016 0,00005 |
Из формулы температурного коэффициента сопротивления определим rt:
rt = r0 [1 ± α (t – t0)].
Пример 6. Определить сопротивление железной проволоки, нагретой до 200°C, если сопротивление ее при 0°C было 100 Ом.
rt = r0 [1 ± α (t – t0)] = 100 (1 + 0,0066 × 200) = 232 Ом.
Пример 7. Термометр сопротивления, изготовленный из платиновой проволоки, в помещении с температурой 15°C имел сопротивление 20 Ом. Термометр поместили в печь и через некоторое время было измерено его сопротивление. Оно оказалось равным 29,6 Ом. Определить температуру в печи.
Электрическая проводимость
До сих пор мы рассматривали сопротивление проводника как препятствие, которое оказывает проводник электрическому току. Но все же ток по проводнику проходит. Следовательно, кроме сопротивления (препятствия), проводник обладает также способностью проводить электрический ток, то есть проводимостью.
Чем большим сопротивлением обладает проводник, тем меньшую он имеет проводимость, тем хуже он проводит электрический ток, и, наоборот, чем меньше сопротивление проводника, тем большей проводимостью он обладает, тем легче току пройти по проводнику. Поэтому сопротивление и проводимость проводника есть величины обратные.
Из математики известно, что число, обратное 5, есть 1/5 и, наоборот, число, обратное 1/7, есть 7. Следовательно, если сопротивление проводника обозначается буквой r, то проводимость определяется как 1/r. Обычно проводимость обозначается буквой g.
Электрическая проводимость измеряется в (1/Ом) или в сименсах.
Пример 8. Сопротивление проводника равно 20 Ом. Определить его проводимость.
Если r = 20 Ом, то
Пример 9. Проводимость проводника равна 0,1 (1/Ом). Определить его сопротивление,
Если g = 0,1 (1/Ом), то r = 1 / 0,1 = 10 (Ом)
Источник: Кузнецов М. И., «Основы электротехники» – 9-е издание, исправленное – Москва: Высшая школа, 1964 – 560с.
www.electromechanics.ru
Таблицы электропроводности растворов — Справочник химика 21
Помимо содержания основных компонентов электролита — сульфата меди и серной кислоты, — на удельное сопротивление раствора оказывают заметное влияние также содержащиеся в нем примеси, особенно те, которые накапливаются в электролите до значительных концентраций (электроотрицательные металлы). Эквивалентная электропроводность растворов сульфатов таких наиболее быстро накапливающихся в электролите металлов-примесей, как никель и железо, примерно равна эквивалентной электропроводности раствора сульфата меди той же концентрации. Поэтому для определения удельного сопротивления электролита, содержащего указанные примеси, к действительному содержанию меди в растворе прибавляют такие количества ее, которые эквивалентны содержанию никеля и железа, и по этому общему условному содержанию меди (так называемому медному эквиваленту) по таблицам определяют удельное сопротивление электролита. [c.16]
Определение постоянной электролитической ячейки. В ка честве стандартного раствора для определения постоянной электролитической ячейки используют раствор хлорида калия разной концентрации, насыщенный раствор хлорида натрия или сульфата кальция, приготовленные на бидистилляте. Удельные электропроводности этих растворов при различных температурах определены с большой точностью и приведены в справочных таблицах. Постоянную ячейки типа Х38, предназначенную для определения малой удельной электропроводности растворов, рекомендуется устанавливать по Хст и Rx, -i 0,001 н. раствора КС1. Для ячеек других конструкций стандартный раствор указывается в соответствующей лабораторной работе. [c.102]
Предельная эквивалентная электропроводность пи-крата калия при 25° С 103,97 Ом- -см -г-экв , подвижность иона калия 73,58 Ом -см -г-экв [65]. Вычислите подвижность пикрат-иона и его число переноса при бесконечном разбавлении. Электропроводность иодата калия (КЮз) была измерена при 25° С [66]. Данные приведены ниже в таблице с — концентрация иодата калия (г-экв-л ) Л — эквивалентная электропроводность раствора с поправкой на воду. Определите Ло — предельную эквивалентную электропроводность КЮз. [c.111] Когда все приготовлено, пробку опускают в сосуд так, чтобы пластина вещества погрузилась в воду. В этот момент включают секундомер. Через 5 мин производят первое измерение сопротивления (электропроводности) раствора, занося результаты в таблицу. В течение первого часа производят измерение через каждые 5 мин, затем через 10—20 мин и прекращают после того, как электропроводность принимает постоянное значение. [c.162]Кондуктометрический метод основан на измерении электропроводности растворов или газов. Так, концентрацию серной кислоты в растворе определяют, сравнивая электропроводность этого раствора с данными таблицы, в которой содержатся значения электропроводности растворов серной кис/оты различных концентраций. [c.33]
Из данных таблицы видно, что концентрация хромат-ионов изменяется по сложному закону вначале (по мере замены части фосфата хрома на тетраоксихромат цинка) их концентрация растет и, пройдя через максимум (при соотношении компонентов 70 30), начинает снижаться, несмотря на высокую концентрацию тетраоксихромата цинка, из которого и вымываются хромат-ионы. Из чистого тетраоксихромата цинка в водную вытяжку переходит незначительное количество хромат-ионов. В соответствии с изменением ионного состава электролита изменяется и электропроводность раствора. Замена части фосфата хрома на тетраоксихромат цинка приводит вначале к снижению pH в дальнейшем по мере увеличения содержания тетраоксихромата цинка в смеси концентрация водородных ионов непрерывно снижается. [c.142]
Таблицы проверенных значений осмотических коэффициентов и коэффициентов активности перхлората магния опубликованы Стоксом в 1948 г. Была измерена электропроводность растворов перхлората магния в н-пропиловом и изопропиловом спиртах , в системе метанол—ацетон , в воде и в ацетоне, метиловом спирте и в нитрометане . Определена также электропроводность растворов перхлората кальция в ацетоне . [c.50]
Используя данные таких таблиц, включенных в справочники по электрохимии, а также приведенное выше выражение, можно рассчитать электропроводность любого раствора. Полученная точность в большинстве случаев достаточна для оценки экспериментальных условий, необходимых для проведения измерений. Такие расчеты полезны также для предсказания изменений электропроводности, которые могут наблюдаться в ходе титрования. Электропроводность раствора может заметно изменяться в ходе титрования в связи с добавлением или уда- [c.406]
Значения электропроводности растворов для расчета процессов электролиза обычно берут из таблиц справочников (см. также рис. 44). [c.351]
По результатам титрования составляют таблицу и график зависимости объем прибавленного раствора титранта — удельная электропроводность раствора. Точка перегиба на графике соответствует точке эквивалентности при титровании. По объему раствора титранта, израсходованному для достижения точки эквивалентности, вычисляют концентрацию анализируемого раствора, используя обычные расчетные формулы объемного анализа. [c.222]| Таблица XII-1. АВТОМАТИЧЕСКИЕ ИЗМЕРИТЕЛИ И СИГНАЛИЗАТОРЫ ЭЛЕКТРОПРОВОДНОСТИ РАСТВОРОВ |
В табл. 17 приведены значения электропроводности растворов НС1 в разных раствррителях, а также диэлектрические проницаемости этих растворителей. Как следует из таблицы, электропроводность растворов НС1 в метиловом спирте почти в 4 раза меньше, чем в воде, что трудно объяснить уменьшением скорости движения ионов. Низкая электропроводность в неводных средах определяется в основном малой степенью диссоциации [c.120]
Рассчитывают электропроводность растворителей Ко, растворов X, а также электропроводность растворов за вычетом электропроводности растворителя. По полученному значению находят мольную электрс провод-ность (1. Экспериментальные и рассчитанные данные записывах)т в таблицу (см. табл. 15), в этой же таблице отмечают значение мольной электропроводности ассоциированного электролита при бесконечном разбавлении Хо- [c.93]
Кривую кондуктометрического титрования можно построить теоретически, рассчитав электропроводность в каждой точке титрования. Например, при титровании НС1 раствором NaOH удельную электропроводность раствора можно рассчитать, пренебрегая отличием эквивалентных электропроводностей ионов при данной концентрации от предельных электропроводностей (Л °), которые приводятся в таблицах, [c.198]
Вычисленные по изменению электропроводности раствора ККМ1 з приведены в таблице 3. [c.319]При сравнении этих величин с данными таблицы 2 можно заметить, что с учетом точности метода, ККМс равна ККМ2-3 по электропроводности раствора и этот факт подтверждает начало образования крупных агрегатов именно при этой концентрации. Проведение солюбилизации в 0,1н растворе КС понижает КК Мс в 2 раза и увеличивает солюбилизирующую способность ЧАС на эту же величину. Солюбилизирующая способность четвертичных солей в присутствии различных электролитов приведена в таблице 5. Для сравнения указана определенная таким же методом солюбилизирующая способность лаурилсульфата Na. [c.320]
Далее учащиеся должны освоить приемы кондуктометриче-ского титрования. Для этого удобно использовать не электролитическую ячейку с впаянными электродами, а погружной электрод, смонтированный в обойме с жестким креплением платиновых пластинок. Электрод погружают в стакан для титрования,-снабженный мещалкой, вливают туда анализируемый раствор и добавляют к нему воду в таком количестве, чтобы платиновые пластинки были полностью покрыты жидкостью. Измеряют сопротивление и из бюретки прибавляют небольшими порциями раствор титранта. В ходе титрования периодически измеряют сопротивление. В зависимости от природы титранта и титруемого вещества характер изменения сопротивления (электропроводности) в процессе титрования может быть различен. В начальный лериод титрования сопротивление по мере прибавления титранта может или возрастать, или оставаться практически постоянным, или несколько снижаться, а в дальнейшем, когда прореагирует все находящееся в растворе вещество, сопротивление заметно снижается. После этого прибавляют еще две-три порции титранта и заканчивают титрованиё. По измеренным значениям сопротивления вычисляют удельные электропроводности и составляют таблицу и график зависимости объем прибавленного раствора титранта (V) — удельная электропроводность раствора %). Точка перегиба на графике соответствует эквивалентной точке при титровании. По объему раствора титранта, израсходованному для достижения эквивалентной точки, и по его нормальности вычисляют концентрацию анализируемого раствора. Нужно показать учащимся приемы графического определения эквивалентной точки. [c.196]
Для определения константы прибсра приготовляют 1 н. или 0,1 н. раствор КС1 и наливают его в калибруемый сосуд. Установив сосуд в термостат, тщательно измеряют температуру и мостиком Кольрауша определяют, как описано ниже, электропроводность раствора W. Подставив в формулу определенное значение W и найденное по табл. 27 значение X при температуре опыта (если в таблице нет значения электропроводности для данной температуры, проводят интерполяцию), вычисляют константу сосуда [c.370]
Теоретически и экспериментально доказано, что потенциал полуволны не зависит от концентрации данного вещества в растворе, характерен для каждого вещества и определяется его химической природой. Потенциалы полуволн для различных веществ (ионов) приведены в специальных руководствах (Виноградова Е. Н. и др., 1963] и Справочнике химика , (2-е изд. — М. — Л. Химия, 1965, т. IV). Следует, однако, учесть, что потенциал полуволны существенно зависит от фона (постороннего электролита), который применяется для повышенпя электропроводности раствора, поэтому в справочных таблицах приведены значения потенциала полуволны для вполне определенных условий. [c.60]
Как следует из таблицы, в растворах хлористого натрия, близких к насыщению, с уменьщением концентрации Na l на каждые 10 г/л электропроводность понижается примерно на 0,5%. Для растворов хлористого калия это уменьшение состав- [c.43]
Мы считаем, чхо проще было бы составить таблицу средних значений электропроводностей растворов солей различных концентраций в интервале, напри1 1ер, от 0,5 до 5 мг-экв/л, и представить данные в виде графика, как это и было нами сделано в ранее упомянутой работе (Н. И. Воробьев, 1939). Это в значительной мере увеличило бы точность расчетов, и отпала бы необходимость в разведении исследуемых вод до 0,001 N. [c.20]
chem21.info
Удельная электропроводность таблица — Справочник химика 21
Определение постоянной электролитической ячейки. В ка честве стандартного раствора для определения постоянной электролитической ячейки используют раствор хлорида калия разной концентрации, насыщенный раствор хлорида натрия или сульфата кальция, приготовленные на бидистилляте. Удельные электропроводности этих растворов при различных температурах определены с большой точностью и приведены в справочных таблицах. Постоянную ячейки типа Х38, предназначенную для определения малой удельной электропроводности растворов, рекомендуется устанавливать по Хст и Rx, -i 0,001 н. раствора КС1. Для ячеек других конструкций стандартный раствор указывается в соответствующей лабораторной работе. [c.102]
ТАБЛИЦА 81. УДЕЛЬНЫЕ электропроводность и ЭЛЕКТРОСОПРОТИВЛЕНИЕ РАЗЛИЧНЫХ РАСТВОРОВ [c.359]
Для работы приготовить растворы слабой кислоты (по указанию преподавателя) концентрации 0,1 0,03 0,01 0,003 0,001 М. Измерить удельную электропроводность этих растворов. С учетом удельной электропроводности воды рассчитать эквивалентную электропроводность исследованных растворов. Результаты представить в виде таблицы [c.99]
Исследуемые растворы последовательно наливают в кондуктометрическую ячейку и измеряют их сопротивление R. Рассчитывают удельные электропроводности Хсм, v- И Х2. Определяют аддитивное значение электропроводности X1-I-X2 и отклонение электропроводности смеси от аддитивного значения Лк = (xi+>42) —Хсм. Результаты измерений и рассчитанные данные записывают в таблицу (см. табл. 7). [c.83]Для измерения удельной электропроводности воды используют ячейку, изображенную на рис. 2.6, в. Ячейку тщательно промыть, многократно ополоснуть бидистиллятом. Измерить сопротивления нескольких порций воды при постоянной температуре. Результаты измерений занести в таблицу (см. работу 1), [c.97]
Из таблицы видно, что предельные подвижности ионов аналогично удельной электропроводности электролитов всегда увеличиваются с ростом температуры, в то время как электропро- [c.288]
Для пересчета удельной электропроводности и в oм- м- нужно числа, стоящие в таблице, умножить на 10. [c.113]
ТАБЛИЦА 5.2. Удельные электропроводности водных растворов хлорида калия [c.156]
Решение. Строим графическую зависимость концентрация — удельная электропроводность (рис. 8.5). По графику находим концентрацию уксусной кислоты 2 моль/дм . По таблице справочника определяем, что данной концентрации соответствует 11,7% кислоты. [c.120]
Смеси полимеров с графитом, полученные в процессе поликонденсации, по многим свойствам превосходят смеси, полученные механическим перемешиванием (табл. 10.4). Из данных этой таблицы следует, что «синтетическая» смесь превосходит «механическую» смесь по температуре размягчения, термостойкости, удельной ударной вязкости и удельной электропроводности. Кроме того, исследование антифрикционных свойств показало, что «синтетические» смеси с графитом имеют значительно меньшие коэффициенты трения и износа испытуемого образца и контртела. [c.307]
В таблицах гл. HI приведены следующие электрические свойства удельная электропроводность х, диэлектрическая постоянная е и дипольный момент /л. [c.44]
Эквивалентная электропроводность А, равна удельной электропроводности, умноженной на объем, в котором растворен 1 г экв вещества. В таблице приведены значения Я 10 См у т экв. (См. также рис. 2.37.) [c.129]
В работах по изучению электропроводности результаты обычно приводятся в виде графиков зависимости эквивалентной электропроводности от концентрации и таблиц, содержащих числовые параметры уравнения Фуосса—Онзагера. Однако для практического использования необходимы значения удельной электропроводности. Поэтому в дальнейшем экспериментальные данные будут представлены не только значениями параметров уравнения Фуосса Онзагера, но там, где это возможно, значениями удельных электропроводностей при различных концентрациях. [c.65]
Кривую кондуктометрического титрования можно построить теоретически, рассчитав электропроводность в каждой точке титрования. Например, при титровании НС1 раствором NaOH удельную электропроводность раствора можно рассчитать, пренебрегая отличием эквивалентных электропроводностей ионов при данной концентрации от предельных электропроводностей (Л °), которые приводятся в таблицах, [c.198]
Выполнение работы. 1. Собрать установку для измерения сопротивления объема жидкости (см. рис. 22). 2. Определить постоянную электролитической ячейки типа Х38 по 0,001 н. раствору хлорида калия при 25° С. 3. Получить бидистиллят. Тщательно промыть электроды и измерительный сосуд бидистиллятом. Влить в сосуд отмеренное количество бидистиллята или заполнить им сосуд до метки. Вставить ячейку в термостат, отрегулированный на заданную температуру. Через 15 -20 мин 3—4 раза измерить сопротивление воды при высоком (порядка 10 —10 Ом), введя его в магазин сопротивлений. Рассчитать Ях,п.,о по (VIII.47) и удельную электропроводность бидистиллята по (VIII.15). Результаты измерений и вычислений занести в таблицу по формуле [c.104]
Выполнение работы. Налить в сосуд для измерения электропроводности заданный объем 0,01 М раствора ПАВ. После термостатирования при 25° С не менее 10 мин провести кондуктометрические измерения. Затем сухой пипеткой извлечь из сосуда половину объема раствора. Добавить столько же воды при 25° С, тщательно перемешать и повторить измерение. Полученный раствор разбавить аналогичным образом 6—8 раз. Данные занести в таблицу по форме, указанной в работе 31, и построить график зависимости удельной электропроводности х от с. Для истинных растворов х линейно растет с повышением с. При достижении ККМ кривая образует излом, после которого рост удельной электропроводности с концентрацией уменьшается (см. рис. 55, а). Для большей точности определения можно заранее приготовить 6—8 растворов соответствующих концентраций, чтобы ККМ приходилась примерно в середине изучаемого интервала концентраций. Начинать измерения электроводности следует с раствора наименьшей концентрации. По точке излома определить ККМ. Средняя квадратичная ошибка измерения не должна превышать 2%. [c.248]
Таблица состоит из двух разделов в первом охарактеризованы протоля-тическне, во втором— протонные растворители. Все характеристики относятся к 25 С другие температуры (в «С) указаны верхним индексом, а в графе Удельная электропроводность> (х)—-в скобках после соответствующей величины. [c.293]
Таблица состоит иа двух разделов в первом охарактеризованы протоли таческне, во втором— протонные растворнтелн. Все характеристики относятся ж 25 С другие температуры (в «С) указаны верхним индексом, а в граф Удельная электропроводность (х)—а скобках после соответствующей веля Чины. [c.293]
Сарапетян Ю.Я., Жук Е.Г., Смирнова Л.И. и др. Таблицы рекомендуемых справочных данных. Удельная электропроводность 1 М растворов 1-1 валентных электролитов в органических растворителях. ВНИЦ по материалам и веществам Госстандарта СССР. М., 1987. 13 с. Деп. в ВНИИКИ 03.06.87, N 355-1Ш87. [c.984]
Ячейку заполняют раствором хлористого калия и определяют электропроводность ( ). Из таблиц находят удельную электропроводность (х) раствора хлористого калия (для 0,1М раствора при 15° С х= 1.066 10 2, при 20° С х=1Д6б-10 2). Если нужно определить электропроводность при промежуточной температуре, производят интерполяцию. Найденное значение постоянной ячейки используют при всех дальнейших работах с данной ячейкой. [c.194]
Для этого они готовят серию растворов разной концентрации, разбавляя соответствующим образом более концентрированный раствор с точно установленной коицентрацией. Затем определяют удельные электропроводности этих растворов, составляют таблицу и калибровочную кривую. Калибровочная кривая в данном случае представляет собой графическую зависимость электропроводности от концентрации. Такого рода графики используются и в других физико-химических методах анализа. Их следует вычерчивать тущью на миллиметровой бумаге. [c.195]
Далее учащиеся должны освоить приемы кондуктометриче-ского титрования. Для этого удобно использовать не электролитическую ячейку с впаянными электродами, а погружной электрод, смонтированный в обойме с жестким креплением платиновых пластинок. Электрод погружают в стакан для титрования,-снабженный мещалкой, вливают туда анализируемый раствор и добавляют к нему воду в таком количестве, чтобы платиновые пластинки были полностью покрыты жидкостью. Измеряют сопротивление и из бюретки прибавляют небольшими порциями раствор титранта. В ходе титрования периодически измеряют сопротивление. В зависимости от природы титранта и титруемого вещества характер изменения сопротивления (электропроводности) в процессе титрования может быть различен. В начальный лериод титрования сопротивление по мере прибавления титранта может или возрастать, или оставаться практически постоянным, или несколько снижаться, а в дальнейшем, когда прореагирует все находящееся в растворе вещество, сопротивление заметно снижается. После этого прибавляют еще две-три порции титранта и заканчивают титрованиё. По измеренным значениям сопротивления вычисляют удельные электропроводности и составляют таблицу и график зависимости объем прибавленного раствора титранта (V) — удельная электропроводность раствора %). Точка перегиба на графике соответствует эквивалентной точке при титровании. По объему раствора титранта, израсходованному для достижения эквивалентной точки, и по его нормальности вычисляют концентрацию анализируемого раствора. Нужно показать учащимся приемы графического определения эквивалентной точки. [c.196]
Первой задачей являлось определение концентрации Н+-ионов в чистом золе. Так как АздВз-золь со временем меняет pH, в табл. 1 мы приводим ряд измерений за все время работы. В одной из граф таблицы приведены величины электропроводности золя в различное время и [Н+], высчитанные из электропроводности по формуле Паули [16 [Н+] = 1000х/( /н + г кои), где X — удельная электропроводность коллоидного раствора йи — подвижность Н+-И0Н0В при температуре измерения Укоп — подвижность коллоидных частиц, которая принималась равной 50. [c.38]
Величины удельной электропроводности расплавов труднее сравнивать между собой, чем величины удельных электропроводностей, полученные для водных растворов, ввиду того что температура и вязкость расплавов изменяются в широких пределах. Чтобы в какой-то степени преодолеть это затруднение, сравнивают электропроводность солей при температурах на 10 К выше их температуры плавления (так называемые температуры соответствия ). Величины удельной электропроводности в расплавах типичных солей, таких, как хлориды щелочных металлов, при температуре плавления имеют тот же порядок, что и в водных растворах. Поэтому нет сомнения, что в расплавах они существуют главным образом в виде свободных ионов и являются своего рода новым типом растворителя, в котором силы межионного взаимодействия достаточно велики. Однако данные для расплавов хлоридов щелочных металлов отличаются отданных, полученных для их водных растворов в расплавах электропроводность наиболее высока для солей лития и уменьшается с увеличением кристаллографического радиуса катиона. Это соответствует предположению о том, что в отсутствие растворителя ион, лишенный оболочки, двигается в соответствующем направлении при наложении электрического поля. Расплавы хлоридов щелочноземельных металлов также имеют высокую удельную электропроводность, но здесь порядок их расположения обратный удельная электропроводность Mg l2 вдвое меньше, чем ВаС12, а ВеС1 — очень слабый электролит. Этот эффект можно объяснить образованием ионных пар если двигаться вправо по периодической таблице, то влияние увеличения валентности усиливается, так как усиливается тенденция к образованию ковалентных связей. Таким образом, элементы, которые (в виде хлоридов) об- [c.174]
chem21.info
Удельное сопротивление металлов. Таблица | joyta.ru
Удельное сопротивление металлов является мерой их свойства противодействовать прохождению электрического тока. Эта величина выражается в Ом-метр (Ом⋅м). Символ, обозначающий удельное сопротивление, является греческая буква ρ (ро). Высокое удельное сопротивление означает, что материал плохо проводит электрический заряд.
Удельное сопротивление
Удельное электрическое сопротивление определяется как отношение между напряженностью электрического поля внутри металла к плотности тока в нем:
где:
ρ — удельное сопротивление металла (Ом⋅м),
Е — напряженность электрического поля (В/м),
J — величина плотности электрического тока в металле (А/м2)
Если напряженность электрического поля (Е) в металле очень большая, а плотность тока (J) очень маленькая, это означает, что металл имеет высокое удельное сопротивление.
Обратной величиной удельного сопротивления является удельная электропроводность, указывающая, насколько хорошо материал проводит электрический ток:
где:
σ — проводимость материала, выраженная в сименс на метр (См/м).
Электрическое сопротивление
Электрическое сопротивление, одно из составляющих закона Ома, выражается в омах (Ом). Следует заметить, что электрическое сопротивление и удельное сопротивление — это не одно и то же. Удельное сопротивление является свойством материала, в то время как электрическое сопротивление — это свойство объекта.
Электрическое сопротивление резистора определяется сочетанием формы и удельным сопротивлением материала, из которого он сделан.
Например, проволочный резистор, изготовленный из длинной и тонкой проволоки имеет большее сопротивление, нежели резистор, сделанный из короткой и толстой проволоки того же металла.
В тоже время проволочный резистор, изготовленный из материала с высоким удельным сопротивлением, обладает большим электрическим сопротивлением, чем резистор, сделанный из материала с низким удельным сопротивлением. И все это не смотря на то, что оба резистора сделаны из проволоки одинаковой длины и диаметра.
В качестве наглядности можно провести аналогию с гидравлической системой, где вода прокачивается через трубы.
- Чем длиннее и тоньше труба, тем больше будет оказано сопротивление воде.
- Труба, заполненная песком, будет больше оказывать сопротивление воде, нежели труба без песка
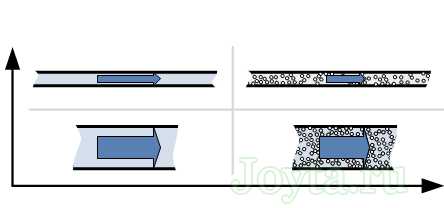
Сопротивление провода
Величина сопротивления провода зависит от трех параметров: удельного сопротивления металла, длины и диаметра самого провода. Формула для расчета сопротивления провода:
где:
R — сопротивление провода (Ом)
ρ — удельное сопротивление металла (Ом.m)
L — длина провода (м)
А — площадь поперечного сечения провода (м2)
В качестве примера рассмотрим проволочный резистор из нихрома с удельным сопротивлением 1.10×10-6 Ом.м. Проволока имеет длину 1500 мм и диаметр 0,5 мм. На основе этих трех параметров рассчитаем сопротивление провода из нихрома:
R=1,1*10-6*(1,5/0,000000196) = 8,4 Ом
Нихром и константан часто используют в качестве материала для сопротивлений. Ниже в таблице вы можете посмотреть удельное сопротивление некоторых наиболее часто используемых металлов.
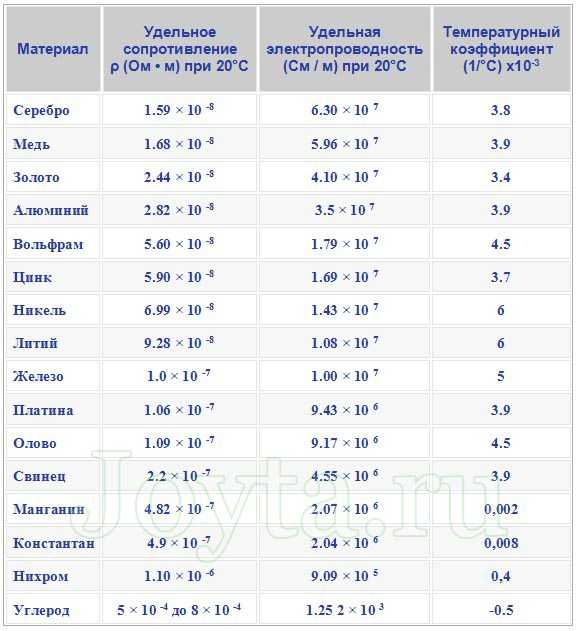
Поверхностное сопротивление
Величина поверхностного сопротивления рассчитывается таким же образом, как и сопротивление провода. В данном случае площадь сечения можно представить в виде произведения w и t:
Для некоторых материалов, таких как тонкие пленки, соотношение между удельным сопротивлением и толщиной пленки называется поверхностное сопротивление слоя RS:
где RS измеряется в омах. При данном расчете толщина пленки должна быть постоянной.
Часто производители резисторов для увеличения сопротивления вырезают в пленке дорожки, чтобы увеличить путь для электрического тока.
Свойства резистивных материалов
Удельное сопротивление металла зависит от температуры. Их значения приводится, как правило, для комнатной температуры (20°С). Изменение удельного сопротивления в результате изменения температуры характеризуется температурным коэффициентом.
Например, в термисторах (терморезисторах) это свойство используется для измерения температуры. С другой стороны, в точной электронике, это довольно нежелательный эффект.
Металлопленочные резисторы имеют отличные свойства температурной стабильности. Это достигается не только за счет низкого удельного сопротивления материала, но и за счет механической конструкции самого резистора.
Много различных материалов и сплавов используются в производстве резисторов. Нихром (сплав никеля и хрома), из-за его высокого удельного сопротивления и устойчивости к окислению при высоких температурах, часто используют в качестве материала для изготовления проволочных резисторов. Недостатком его является то, что его невозможно паять. Константан, еще один популярный материал, легко паяется и имеет более низкий температурный коэффициент.
www.joyta.ru
