Бериллий, магний и щелочноземельные металлы
из «Практикум по общей химии Издание 4»
Строение атомов бериллия, магния и щелочноземельных металлов. Положение металлов в ряду напряжений. Отнощение к воде, кислотам, кислороду и окислителям. Окиси и гидроокиси, их получение и химическая характеристика. Важнейшие растворимые и нерастворимые соли. Соли магния и кальция в природных водах. Жесткость воды и методы ее устранения. [c.189]Барий И стронций обычно хранят под слоем керосина или аналогично радию в запаянных стеклянных трубках, тогда как другие металлы этого ряда, как менее сильные восстановители, можно сохранять просто в закрытых оклянках. [c.190]
Гадроокиси щелочноземельных элементов получаются из окисей взаимодействием последних с водой гидроокиси магния и бериллия получают обменными реакциями солей со щелочами, так как гидроокиси этих металлов плохо растворимы в воде. [c.190]
Щелочной характер окисей и гидроокисей возрастает с увеличением радиуса иона Ме+- для Ве+2—цона с малым радиусам—характерна амф Отерность его гидроокиси. [c.190]
Летучие соли кальция, стронция и бария окрашивают несве-тяшееся пламя газовой горелки соответственно кирпично-красный, карминовый и желто-зеленый цвета. [c.190]
Пример. На титрование 100 мл водопроводной воды было израсходовано 2,65 мл раствора НС1, титр которого равен 0,0032. Определить карбонатную жесткость воды. [c.191]
Пример. К 100 Л1Л водопроводной воды было добавлено 15 мл щелочной смеси. После осаждения и отфильтрования осадка на титрование избытка смеси было израсходовано 9,90 мл 0,1 к. раствора НС1. Определить общую жесткость. [c.192]
Этот объем эквивалентен такому же объему 0,1 н. раствора иона Са . [c.192]
Приготовление щелочной смеси. Смешивают равные объемы 0,1 н. раствора NaOH и 0,1 н. раствора Naj Os. [c.194]
Полученный порошок размешать в фарфоровой чашке с небольшим количеством воды и прибавить каплю спиртового раствора фенолфталеина. Объяснить появление окраски. [c.194]
По полученным результатам титрования вычислить общую жесткость водопроводной воды. Пользуясь данными опытов 4 и 5, вычислить постоянную жесткость. [c.195]
Металлы подгруппы цинка. Строение атомов и их восстановительная характеристика. Положение металлов в ряду напряжений. Отличие ртути от цинка и кадмия. Отношение цинка, кадмия и ртути к различным окислителям. Окиси и гидроокиси этих металлов. Простые и комплексные соли. Амальгамы. [c.196]
Ртуть при обычных условиях не окисляется на воздухе или в кислороде. [c.197]
Вернуться к основной статье
www.chem21.info
Бериллий, магний и щелочноземельные металлы
Взаимодействие с простыми веществами. Бериллий, магний и щелочноземельные металлы легко взаимодействуют с кислородом и серой, образуя оксиды и сульфиды, например [c.234]БЕРИЛЛИЙ, МАГНИЙ И ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ [c.231]
Строение атомов бериллия, магния и щелочноземельных металлов. Положение металлов в ряду напряжений. Отношение к воде, кислотам, кислороду и окислителям. Окиси и гидроокиси, их получение и химическая характеристика. Важнейшие растворимые и нерастворимые соли. Соли магния и кальция в природных водах. Жесткость воды и методы ее устранения. [c.204]
При нагревании бериллий, магний и щелочноземельные металлы реагируют с водородом, азотом, углеродом, кремнием и другими неметаллами, например [c.235]
Взаимодействие с кислотами. Бериллий, магний и щелочноземельные металлы взаимодействуют с хлороводородной и разбавленной серной кислотами с выделением водорода [c.235]
Составить электронные схемы строения атомов бериллия, магния и щелочноземельных металлов. [c.330]
Как бериллий, магний и щелочноземельные металлы относятся к воде, кислороду воздуха, кислотам и щелочам Составить уравнения соответствующих реакций. [c.231]
Особенности солей бериллия, магння и щелочноземельных металлов. Соли щелочноземельных металлов, внесенные в пламя горелки, дают характерное окращивание пламени кальций — кирпично-красное, стронций — карминно-красное, барий — желтовато-зеленое. На этом свойстве солей основано качественное определение этих элементов.
Составить уравнения реакций получения в технике бериллия, магния и щелочноземельных металлов. Указать условия и сущность реакций. [c.231]
II группа. По сравнению с щелочными металлами бериллий, магний и щелочноземельные металлы обладают более сильно выраженными свойствами к комплексообразованию. Особенно выделяется в этом отношении бериллий, что связано с наличием сильного электрического поля его иона. Магний по своей комплексообразующей способности приближается к бериллию. [c.393]
Бериллий, магний и щелочноземельные металлы с водородом образуют гидриды общей формулы К На. [c.242]
Подгруппа бериллия. Эту подгруппу составляют металлы бериллий, магний и щелочноземельные металлы. Их атомы на внещнем энергетическом уровне имеют по два электрона. Отдавая их, проявляют в соединениях степень окисления +2. Все металлы подгруппы — сильные восстановители, однако несколько более слабые, чем щелочные металлы. [c.297]
Распространенность в природе. Массовые доли бериллия, магния и щелочноземельных металлов в земной коре составляют 6-10- % (Ве), 2,10% (М ), 3,60% (Са), 0,04% (5г), 0,05% (Ва), 1-10-> >% (Ка). В свободном состоянии эти металлы в природе не встречаются. [c.234]
Бериллий, магний и щелочноземельные металлы имеют значительно более высокую способность к комплексообразованию с комплексонами, чем щелочные металлы, выражающуюся как в высоких значениях констант устойчивости, так и в большем разнообразии форм образуемых ими комплексонатов [657— 665]. [c.356]
ПРОИЗВОДСТВО БЕРИЛЛИЯ, МАГНИЯ И ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ. ПРИМЕНЕНИЕ МЕТАЛЛОВ И ИХ СОЕДИНЕНИЙ [c.237]
Бериллий, магний и щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы нашли широкое применение в промышленности. Они входят в состав многих сплавов, которые отличаются легкостью, повышенными механическими свойствами и коррозионной стойкостью. Бериллиевые бронзы — сплавы меди с бериллием (0,5—2% Ве) — используются для производства пружин, безыскрового инструмента для работы во взрывоопасных условиях. Сплавы магния с алюминием, цинком, марганцем широко применяются в авиа- и автомобилестроении. Радий используется для получения сплава с бериллием, который служит источником нейтронов в ядерных реакторах. [c.237]
Бериллий, магний и щелочноземельные металлы (кальций, стронций, барий, радий) образуют ПА группу периодической системы. [c.94]
Свойства бериллия, магния и щелочноземельных металлов. Бериллий, магний и щелочноземельные металлы имеют серебристо-белый цвет, легкие (за исключением радия), хотя плотность их значительно выше, чем у щелочных металлов. Бериллий и магний кристаллизуются в гексагональной решетке. Кальций, стронций и барий имеют аналогичные кристаллические решетки (кубическая гранецентрированная). Ионы и атомы бериллия, как имеющие самые малые размеры ионов и атомов элементов данной подгруппы, образуют наиболее прочную кристаллическую решетку. Поэтому бериллий по твердости, температурам плавления и кипения значительно превосходит остальные элементы главной подгруппы И группы. [c.327]
Свойства бериллия, магния и щелочноземельных металлов. Бериллий, магний и щелочноземельные металлы имеют серебристо-белый цвет, легкие (за исключением радия), хотя плотность их значительно выше, чем у щелочных металлов. Бериллий и магний кристал- [c.380]
Эту подгруппу составляют металлы бериллий, магний и щелочноземельные металлы. Щелочноземельные металлы — это кальций, стронций, барий и радий. Свое название они получили потому, что их оксиды ( земли ) дают с водой щелочные растворы.
СУЛЬФИДЫ БЕРИЛЛИЯ, МАГНИЯ И ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ [c.43]
Металлы подгруппы цинка образуют подобно бериллию, магнию и щелочноземельным металлам нитриды состава МедНо и соответственные азиды. При этом в соответствии с электронным строением атомов этих металлов образуются стабильные [c.13]
Нитриды металлов II группы. Нитриды бериллия, магния и щелочноземельных металлов. Нитрид бериллия состава по- [c.25]
Атомы всех рассматриваемых элементов в основном состоянии имеют на внешнем уровне по два спаренных х-электрона (табл. 24). В возбужденном состоянии эти внешние электроны находятся в состоянии в котором атомы могут быть двухвалентными. Радиусы атомов элементов главной подгруппы II группы меньше, чегл у атомов соответствующих щелочн
www.chem21.info
Щелочноземельные металлы, бериллий, магний | Учеба-Легко.РФ
Свойства элементов II A группы.
Свойства | 4Be | 12Mg | 20Ca | 38Sr | 56Ba | 88Ra |
Атомная масса | 9,012 | 24,305 | 40,80 | 87,62 | 137,34 | 226,025 |
Электронная конфигурация* | ||||||
0,113 | 0,160 | 0,190 | 0,213 | 0,225 | 0,235 | |
0,034 | 0,078 | 0,106 | 0,127 | 0,133 | 0,144 | |
Энергия ионизации |
9,32 |
7,644 |
6,111 |
5,692 |
5,21 |
5,28 |
Относительная электро- |
1,5 |
1,2 |
1,0 |
1,0 |
0,9 |
0,9 |
Возможные степени окисления |
+2 |
+2 |
+2 |
+2 |
+2 |
+2 |
кларк, ат.% (распро- |
1*10-3 |
1,4 |
1,5 |
8*10-3 |
5*10-3 |
8*10-12 |
Агрегатное состояние (н. у.). | Т В Е Р Д Ы Е В Е Щ Е С Т В А | |||||
Цвет | Серо- | Сереб- | С Е Р Е Б Р И С Т О – Б Е Л Ы Й | |||
1283 | 649,5 | 850 | 770 | 710 | 700 | |
2970 | 1120 | 1487 | 1367 | 1637 | 1140 | |
Плотность | 1,86 | 1,741 | 1,540 | 2,67 | 3,67 | 6 |
Стандартный электродный потенциал
|
-1,73 |
-2,34 |
-2,83 |
-2,87 |
-2,92 |
— |
*Приведены конфигурации внешних электронных уровней атомов соответствующих элементов. Конфигурации остальных электронных уровней совпадают с таковыми для благородных газов, завершающих предыдущий период и указанных в скобках.
Как следует из данных, приведенных в таблице, элементы IIA группы имеют низкие (но все же не самые низкие: сравни с IA гр.) величины энергии ионизации и относительной электроотрицательности, при чем эти величины уменьшаются от Be к Ba, что позволяет сделать вывод о том, что эти элементы – типичные металлы-восстановители, и Ba – более активен, чем Be.
Ве – проявляет, подобно алюминию, амфотерные свойства. Однако у Ве металлические свойства все же более ярко выражены, чем неметаллические. Бериллий реагирует в отличие от остальных элементов IIA группы со щелочами.
Химические связи в соединениях Ве в основном ковалентные, тогда как связи в соединениях всех остальные элементов (Mg — Ra) носят ионный характер. При этом, как и у элементов IA группы, связи с галогенами и кислородом весьма прочные, а с водородом, углеродом, азотом, фосфором и серой – легко гидролизуются.
Физические свойства. Это металлы серебристо-белого цвета, относительно легкие, мягкие (за исключением бериллия), пластичные, легкоплавкие (все, кроме бериллия), обладают хорошей электро- и теплопроводностью.
Практическое применение. Ве используется в атомной технике как замедлитель и поглотитель нейтронов. Сплавы бериллия с медью – бронзы – очень стойкие, а с никелем – обладают высокой химической устойчивостью, благодаря чему и используются в хирургии.
Mg, Ca – используются как хорошие восстановители в металлотермии.
Ca, Sr, Ba – достаточно легко реагируют с газами и используются как геттеры (поглотители из воздушной среды) в вакуумной технике.
Получение. Будучи высоко химически активными, щелочноземельные металлы не встречаются в природе в свободном состоянии, их получают электролизом расплавов галогенидов или металлотермией. В природе щелочноземельные элементы входят в состав следующих минералов: -берилл; — полевой шпат; — бишофит- используется в медицине и для получения магния путем электролиза. Для получения бериллия в металлургии используются фторбериллаты: .
Химические свойства. Щелочноземельные металлы легко реагируют с кислородом, галогенами, неметаллами, водой и кислотами, особенно при нагревании:
— особенно легко эта реакция протекает для кальция и бария, поэтому их хранят в особых условиях.
— персульфид бария BaS – люминофор.
— при гидролизе ацетиленидов образуется ацетилен:
Получить соединения Be и Mg с водородом прямым взаимодействием простых веществ не удалось: реакция не идет,тогда как идет достаточно легко. Образующиеся гидриды – сильные восстановители.
Металлы IIA группы по-разному взаимодействуют с водой:
реакция не идет, пассивация (сравни с Al).
— в случае с Са эта реакция идет очень бурно.
Взаимодействие с кислотами не окислителями:
Взаимодействие с кислотами окислителями:
пассивация, реакция не идет на холоду в независимости от концентрации кислоты;
продукты взаимодействий остальных металлов с кислотами-окислителями зависят от условий их протекания, так: , а при взаимодействии Mg с концентрированной азотной кислотой возможно образование помимо нитрата магния такжеи др.
Взаимодействие с основаниями: реакция не идет, т. к. эти металлы сильные восстановители;
— проявление амфотерности бериллия;
Оксиды щелочноземельных металлов. Оксиды щелочноземельных элементов находят широкое применение в строительстве. Их получают разложением солей: — СаО – негашеная известь.
В ряду оксидов от BeO до BaO слева направо растет растворимость оксидов в воде, их основные свойства и химическая активность, так: BeO – нерастворим в воде, амфотерен, MgO – мало растворим в воде, а CaO, SrO, BaO – хорошо растворяются в воде с образованием гидроксидов Me(OH): .
Температуры плавления оксидов понижаются в ряду BeO ® BaO. Температуры плавления оксидов BeO и MgO » 2500 ° C, что позволяет использовать их как огнеупорные материалы.
Гидроксиды щелочноземельных металлов. В ряду Be(OH)2 ® Ba(OH)2 растет радиус ионов Ме2+, и, как следствие, увеличивается вероятность проявления основных свойств гидроксидов, их растворимость в воде: Ве(ОН)2 – мало растворим в воде, вследствие своей амфотерности проявляет слабые кислотные и основные свойства, а Ва(ОН)2 – хорошо растворим в воде и по своей силе может сравнится с таким сильным основанием как NaOH.
Амфотерность гидроксида бериллия можно проиллюстрировать следующими реакциями:
Соли щелочноземельных металлов. Растворимые соли Be и Ba – токсичны, ядовиты! СaF2 – малорастворимая соль, встречается в природе как флюорит или плавиковый шпат, находит применение в оптике. СaCl2, MgCl2 – хорошо растворимы в воде, находят применение в медицине и химическом синтезе в качестве осушителей. Карбонаты также находят широкое применение в строительстве: СaCО3Ч MgCО3 – доломит – используется в строительстве и для получения Vg и Ca. СaCО3 – кальцит, мел, мрамор, исландский шпат, MgCО3 – магнезит. Содержание растворимых карбонатов в природной воде определяет ее жесткость: . Сульфаты также являются широко распространенными природными соединениями щелочноземельных металлов: СaSO4Ч 2H2O – гипс – широко используется в строительстве. MgSO4Ч 7H2O – эпсомит, “английская горькая соль”, ВaSO4 – находит применеие с рентгеноскопии. Фосфаты:Са3(РО4)2 – фосфорит, Са(Н2РО4)2, СаНРО4 – преципитат – используются для производства удобрений, Са5(РО4)3Ч (ОН—, F—, Cl—) – аппатит – природный минерал Са, NH4Mg(PО4) – мало растворимое соединение. Известны и другие соли: Са(NО3)2Ч 2Н2O – норвежская селитра,Mg(ClО4)2 – ангидрон – очень хороший осушитель.
uclg.ru
Бериллий, магний и щелочноземельные металлы
Тема урока: Бериллий, магний и щелочноземельные металлы.Цель урока: Дать общую характеристику щелочноземельным металлам в свете общего, особенного и единичного по трем формам существования химических элементов: атомов, простых веществ и сложных веществ.
Задачи урока:
На химии элементов этой группы повторить основные закономерности изменения свойств элементов в ПСХЭ по вертикале (группе).
Рассмотреть характерные свойства простых веществ и соединений, образованных элементами 2 группы главной подгруппы.
Какое практическое значение имеют соединения этих металлов.
Развитие химических способностей учащихся при использовании заданий развивающего обучения.
Дальнейшее формирование умения обобщать, делать выводы.
Оборудование и реактивы: кальций, вода, фенолфталеиновый, пинцет, нож, пробирки.
План урока: 1. Организационный момент.
2. Работа по новой теме.
Слайд 3: Почему бериллий и магний не относят к щелочноземельным металлам, хотя и находятся в одной группе с этими металлами?
Атомы этих элементов содержат на внешнем энергетическом уровне по два электрона, которые они отдают при химических взаимодействиях, и поэтому являются сильнейшими восстановителями. Во всех соединениях они проявляют степень окисления +2.
Слайд 4: Атомы этих элементов лишь немного меньше по размерам, чем атомы соответствующих щелочных металлов, а в связи с этим металлы главной подгруппы 2 группы по химической активности и другим свойствам должны быть с ними сходны.
Слайд 5: Учащиеся выполняют задание №1.
Слайд 6: Бериллий, магний и щелочноземельные металлы – как простые вещества.
Бериллий.
Слайд 7: Магний
Слайд 8: Кальций
Слайд 9: Стронций
Слайд 10: Барий
Слайд 11: Радий
Слайд 12: Плотность их увеличивается от бериллия к барию, а температура плавления наоборот, уменьшается. Окрашивание пламени солей щелочноземельных металлов.
Слайд 13: Химические свойства.
Слайд 14: Взаимодействие металлов с кислородом воздуха.
Щелочноземельные металлы взаимодействуют с кислородом воздуха, покрываясь пленкой оксида (исключение барий, смесь оксида и пероксида), поэтому их хранят под слоем керосина или в запаянных ампулах.
Слайд 15: Взаимодействие с неметаллами.
Реакция идет как правило при нагревании.
Взаимодействие металлов с водой.
Из всех металлов главной подгруппы 2 группы только бериллий не взаимодействует с водой (препятствует защитная пленка на его поверхности), магний реагирует с ней медленно, остальные металлы – бурно.
Демонстрация опыта: Взаимодействие кальция с водой.
Пишем уравнение реакции:
Ca + 2 HOH = Ca (OH)2 + H2
Гашеная известь
Вспомним реакцию взаимодействие щелочных металлов с водой.
Происхождение название щелочноземельные металлы связано с тем, что их гидроксиды являются щелочами, а оксиды по тугоплавкости сходны с оксидами алюминия и железа, носившими ранее общее название «земли».
Слайд 16: Учащиеся выполняют задание №2
Слайд 17: Соединения бериллия, магния и щелочноземельных металлов
Оксиды этих металлов – твердые, белые, тугоплавкие вещества, устойчивые к воздействию высоких температур. Проявляют основные свойства, кроме бериллия, имеющего амфотерный характер
Слайд 18: Взаимодействие оксидов с водой.
Оксид магния малоактивен в реакции с водой, все остальные оксиды очень бурно с ней взаимодействуют. При этом выделяется значительное количество энергии. Поэтому, реакция оксида кальция с водой называется гашением извести, а образующийся гидроксид кальция – гашеной известью. Получают оксиды обжигом карбонатов:
CaCO3 = CaO + CO2
Негашеная известь
Mg CO3 = MgO + CO2
Жженая магнезия
Слайд 19: Взаимодействие гидроксидов с кислотами.
Так как многие соли щелочноземельных металлов нерастворимы, то реакция нейтрализации может сопровождаться выделением осадка.
Слайд 20: Соли.
Слайд 21: Учащиеся выполняют задания № 3, № 4, № 5.
Практическое значение соединений кальция, магния и бария.
Слайд 22: Карбонат кальция. Одно из самых распространенных соединений на Земле. Хорошо известны такие содержащие его минералы, как мел, мрамор, известняк.
Самый важный из этих минералов – известняк. Без него не обходится ни одно строительство. Известняк – сырьё для получения цемента, гашеной и негашеной извести, стекла и дл. Природный мел представляет собой остатки раковин древних животных. Один из примеров его использования вы хорошо знаете – это школьный мел, зубные пасты. Мел применяют в производстве бумаги, резины, а также для побелки. Мрамор – это минерал скульпторов, архитекторов и облицовщиков.
Слайд 23: ОАО «Тургоякское рудоуправление»
Производит известняк флюсовый. Наиболее крупные месторождения мрамора на территории области – это Коелгинское (Еткульский район), Баландинское (Сосновский район), Уфалейское (район г. В.Уфалей).
Слайд 24: Практическое применение карбоната магния.
Слайд 25: Практическое применение сульфата магния.
Слайд 26: Практическое применение фосфата кальция.
Слайд 27: Практическое применение сульфата бария.
Слайд 28: Подведение итогов урока.
Работы учащиеся сдают преподавателю на проверку. Оценка результатов на следующем уроке.
Слайд 29: Домашнее задание.
Домашнее Задание: параграф 12, №3,5,7.
Задания по теме: «Бериллий, магний и щелочноземельные металлы»
*****
Ф.И. учащихся___________________________класс_______________
1.Сравните атомы элементов, поставив знаки или = вместо *
а) заряд ядра: Ca * Mg , Be * Ba , Mg * Al , K * Ca
б) число электронных слоев: Ca * Mg , Be * Ba , Mg * Al
в) число электронов на внешнем уровне: Ca * Mg , Be * Ba , Mg * Al
г) восстановительные свойства: Ca * Mg , Be * Ba
2.Допишите уравнения реакций, уравняйте:
а) Mg + S = ………
б) Be + N2 = ………..
в) Ca + O2 = …………
г) Ca + S = ………….
Назовите продукты реакции.
3.Установите признак, объединяющий указанные объекты:
а) MgО, CaО, SrО, BaО признак______________________
б) Be0 Be2+, Mg0 Mg2+, Ca0 Ca2+ признак__________________________
в) Ca, Sr, Ba, Ra признак______________________________
4.Можно ли кусочки щелочноземельного металла для опыта брать руками:
а) да, можно
б) нет, эти металлы взаимодействуют с водой кожи рук, что может вызвать ожог
в) нет, т.к. это не гигиенично, металл может быть загрязнен
г) нет, т.к. щелочноземельные металлы имеют низкую температуру плавления и в руках могут расплавиться
5.Растворение оксида кальция в воде может сопровождаться:
а) кипением и разбрызгиванием смеси
б) происходит спокойно
в) раздражением верхних дыхательных путей
г) общим отравлением
Задания по теме: «Бериллий, магний и щелочноземельные металлы».
***
Ф.И учащихся__________________________класс_______
1.Какое из утверждений неправильное:
а) к щелочноземельным металлам не относятся бериллий и магний
б) восстановительные свойства сильнее проявляются у бериллия, т.к. заряд ядра атома наименьший, чем у остальных элементов 2 группы главной подгруппы
в) щелочноземельные металлы – это кальций, стронций, барий, радий
2.Вставьте пропущенные формулы веществ в уравнения реакций. Назовите продукты реакции:
а) Са + …. = CaS
б) ….+ C l2 = Mg C l2
в) Be + ….. = Be 3N2
Не забудьте уравнять!
Подберите к цифре названия вещества соответствующую букву формулы:
Гашеная известь
Хлорид бария
Негашеная известь
Жженая магнезия
Сульфид кальция
А. CaS
Б. MgO
В. CaO
Г. Ca (OH)2
Д. BaCl2
4.Можно ли кусочки щелочноземельного металла для опыта брать руками:
а) да, можно
б) нет, эти металлы взаимодействуют с водой кожи рук, что может вызвать ожог
в) нет, т.к. это не гигиенично, металл может быть загрязнен
г) нет, т.к. щелочноземельные металлы имеют низкую температуру плавления и в руках могут расплавиться
5.Растворение оксида кальция в воде может сопровождаться:
а) кипением и разбрызгиванием смеси
б) происходит спокойно
в) раздражением верхних дыхательных путей
г) общим отравлением
Задание ***** — для «сильных учеников»
*** — для «слабых» учеников
Работа предполагается в группах по 2 человека.
Технологическая карта урока
«Бериллий, магний и щелочноземельные металлы».
| Предмет, класс | Химия, 9 класс |
| Тема урока | Бериллий, магний и щелочноземельные металлы. |
| Актуальность использования средств ИКТ | Использование презентации позволяет Реализовать принципы наглядности, доступности и системности изложения материала. Формируются навыки и умения информационно-мыслительной деятельности. |
| Цель урока | Дать общую характеристику щелочноземельным металлам в свете общего, особенного и единичного по трем формам существования химических элементов: атомов, простых веществ и сложных веществ. |
| Задачи урока | Обучающие: 1. На химии элементов этой группы повторить основные закономерности изменения свойств элементов в ПСХЭ по вертикале (группе). 2. Рассмотреть характерные свойства простых веществ и соединений, образованных элементами 2 группы главной подгруппы. Развивающие: Развитие химических способностей учащихся при использовании заданий развивающего обучения. Воспитательные: Воспитывать чувство практической значимости соединений щелочноземельных металлов, магния. |
| Необходимое аппаратное программное обеспечение | АРМ учителя химии, мультимедийный проектор, экран. MS PowerPoint. |
| Методы обучения – по источнику полученных знаний- словесный, наглядный, практический, проблемно-поисковый; по дидактическим целям – актуализация, изучение нового материала. Межпредметные связи – биология, краеведение. Организационная структура урока | |
| Этап 1 | Организационный момент |
| Длительность этапа | 2 минуты |
| Цель | Настроить учащихся на работу на уроке. |
| Форма организации деятельности обучающихся | Проверка готовности к уроку, приветствие учителя. |
| Основные виды деятельности преподавателя | Приветствие учащихся, сообщение темы и целей урока. |
| Этап 2 | Формирование новых знаний |
| Длительность этапа | 3 минут |
| Цель | Выяснить, почему бериллий, магний находятся в одной подгруппе со щелочноземельными металлами, хотя и не относятся к таковым; какими особенностями строения атомов они обладают; |
| Форма организации учебной деятельности обучающихся | Фронтальная |
| Функция преподавателя на данном этапе | Информирующая |
| Основные виды деятельности преподавателя | Рассказ, беседа, демонстрация презентации. |
| Деятельность обучающихся | Работа в тетрадях, запись основных понятий. |
| Этап 3 | Дифференцированная работа в группах. |
| Длительность этапа | 5 минут |
| Цель | Закрепление новых знаний. |
| Форма организации учебной деятельности обучающихся | Групповая. |
| Функция преподавателя на данном этапе | Контролирующая. |
| Основные виды деятельности преподавателя | Осуществляет индивидуальный контроль. |
| Деятельность обучающихся | Работа по карточкам. |
| Этап 4 | Формирование новых знаний. |
| Длительность этапа | 5 минут. |
| Цель | Выяснить, что из себя представляют простые вещества – бериллий, магний, кальций, стронций, барий, радий. Выяснить закономерности изменения плотности и температур плавления и узнать особенности окраски пламени при внесении в него солей этих элементов. Познакомиться с химическими свойствами этих простых веществ. |
| Форма организации учебной деятельности обучающихся | Фронтальная |
| Функция преподавателя на данном этапе | Рассказ, беседа, демонстрация презентации. |
| Основные виды деятельности преподавателя | Информирующая. |
| Деятельность обучающихся | Работа в тетрадях, запись основных понятий. |
| Этап 5 | Дифференцированная работа в группах. |
| Длительность этапа | 5 минут |
| Цель | Закрепление новых знаний. |
| Форма организации учебной деятельности обучающихся | Групповая. |
| Функция преподавателя на данном этапе | Контролирующая. |
| Основные виды деятельности преподавателя | Осуществляет индивидуальный контроль. |
| Деятельность обучающихся | Работа по карточкам. |
| Этап 6 | Формирование новых знаний. |
| Длительность этапа | 10 минут |
| Цель | Выяснить, что из себя представляют соединения этих металлов: оксиды, основания, соли; особенности их химических свойств. |
| Форма организации учебной деятельности обучающихся | Фронтальная. |
| Функция преподавателя на данном этапе | Информирующая. |
| Основные виды деятельности преподавателя | Рассказ, беседа, демонстрация презентации. |
| Деятельность обучающихся | Работа в тетрадях, запись основных понятий. |
| Этап 7 | Дифференцированная работа в группах. |
| Длительность этапа | 5 минут. |
| Цель | Закрепление новых знаний. |
| Форма организации учебной деятельности обучающихся | Групповая. |
| Функция преподавателя на данном этапе | Контролирующая. |
| Основные виды деятельности преподавателя | Осуществляет индивидуальный контроль. |
| Деятельность обучающихся | Работа по карточкам. |
| Этап 8 | Формирование новых знаний |
| Длительность этапа | 5 минут |
| Цель | Познакомиться с практическим применением солей магния и щелочноземельных металлов, рассмотреть на примере г. Миасса применение соединения кальция (Берёзовский карьер). |
| Форма организации учебной деятельности обучающихся | Фронтальная. |
| Функция преподавателя на данном этапе | Рассказ, беседа, демонстрация презентации. |
| Основные виды деятельности преподавателя | Информирующая. |
| Деятельность обучающихся | Работа в тетрадях, запись основных понятий. |
| Этап 9 | Заключительная часть |
| Длительность этапа | 5 минут |
| Цель | Подведение итогов: дать анализ и оценить успешность достижения целей и задач урока. |
| Форма организации учебной деятельности обучающихся | Фронтальная. |
| Функция преподавателя на данном этапе | Информирующая: сообщение результатов работ дифференцированных заданий на следующем уроке. |
| Основные виды деятельности преподавателя | Сообщение о достижении целей, анализ результативности урока, инструктаж по выполнению домашнему заданию. |
| Деятельность обучающихся | Запись домашнего задания. |
Список литературы
Габриелян О. С. «Химия. 9 класс» М.: Дрофа 2009.
Дендебер С.В., Ключникова О.В. « Современные технологии в процессе преподавания химии» М.: ООО 5 за знания, 2008.
Денисова В.Г. «Мастер – класс учителя химии. 8-11 классы» М.: Глобус, 2010
Интернет-ресурсы:
http://www.chem.msu.su/rus/teaching/zagorskii2/lesson0/v008.html
http://experiment.edu.ru/catalog.asp?cat_ob_no=12793&ob_no=12802
http://www.youtube.com/watch?v=enOR6DKQMn4
him.na5bal.ru
Бериллий, магний и щелочноземельные металлы
из «Практикум по общей химии»
Происходит выделение кислорода (испытать тлеющей лучиной). Составить уравнение реакции. [c.177]Испытать действие свежеприготовленного раствора Ре304 на красную ч желтую кровяную соль. С какой из солей получается синее окрашивание Несколько капель раствора желтой кровяной соли прилить к 3—4 мл хлорной воды и сильно прокипятить ргствор (до удаления избытка хлора). К полученному раствору добавить раствор Ре504. Что наблюдается Составить уравнение реакции окисления хлором желтой кровяной соли. [c.177]
Строение атомов бери.ялия, магния и щелочноземельных металлов. Положение металлов в ряду напряжений. Отношение к воде, кислотам, кислороду и окислителям. Окиси и гидроокиси, их получение и химическая характеристика. Важнейшие растворимые и нерастворимые соли. Соли магния и кальция в природных водах. Жесткость воды и методы ее устранения. [c.177]
Барий и стронций обычно хранят под слоем керосина или ана логично радию з запаянных стеклянных трубках, тогда как другие металлы этого ряда как менее сильные восстановители можно сохранять просто в закрытых склянках. [c.177]
Гидроокиси щелочноземельных элементов получаются из окисей взаимодействием последних с водой гидроокиси магния и бериллия получают обменными реакциями солей со щелочами, так как гидроокиси этих металлов плохо растворимы в воде. [c.178]
Химический характер окисей и гидроокисей изменяется с увеличением радиуса Ме+з возрастает щелочность для Ве+2 — иона с малым радиусом — характерна амфотерность его гидроокиси. [c.178]
В лабораторной практике чаще всего применяются раствор Са(ОН)з (известковая вода) или суспензия твердого гидрата окиси кальция в насыщенном растворе (известковое молоко) и раствор Ва(ОН)2 (баритовая вода). [c.178]
Летучие соли кальция, стронция и бария окрашивают несветя-щееся пламя газовой горелки соответственно в кирпично-красный, карминовый и бледнозеленый цвета. [c.178]
Природная вода, содержащая много растворенных кальциевых и магниевых солей, называется жесткой. Мягкая вода содержит сравнительно небольшие количества растворенных солей. Количественно жесткость воды оценивается градусами жесткости. Принятый в СССР градус жесткости отвечает содержанию 1 г окиси кальция в 100 л воды (или 1 мг СаО в 100 мл воды). Вода с жесткостью до 8 градусов называется мягкой, с жесткостью от 8 до 18 градусов — средней и с жесткостью свыше 18 градусов — жесткой. [c.179]
Наличием в природной воде Са(НСОз)г и Mg(H 0s)2 обусловливается временная ( устранимая ) жесткость. Хлориды и сульфаты кальция и магния являются причиной постоянной жесткости воды. Временная и постоянная жесткость составляет общую жесткость воды. [c.179]
На титрование 100 мл водопроводной воды было израсходовано 2,65 мл раствора H I, титр которого равен 0,0032. Выразить жесткость воды в градусах. [c.179]
В 100 мл воды оказалось 6,51. чг окиси кальция, что соответствует временной жесткости в 6,51 градуса. [c.179]
Пример. К 100 мл водопроводной воды было добавлено 15 мл щелочной смеси. После осаждения и отфильтрования осадка на титрование избытка смеси было израсходовано 9,90 мл 0,Ш раствора НС1. Определить общую жесткость в градусах. [c.180]
Этот объем эквивалентен такому же объему О.Ш раствора СаО. [c.180]
Щелочную смесь готовят, смешивая равные объемы 0,liV раствора NaOH и 0,Ш раствора карбоната натрия. [c.181]
Отметить в журнале наблюдаемые изменения и записать уравнения реакций. [c.182]
Рассмотреть внимательно поверхность металлического магния и кальция и с помощью напильника или наждачной бумаги снять верхний слой металла. Что наблюдается Взять щипцами очищенные кусочки металлов и поочередно накалить в пламени горелки. Результаты опыта записать в журнал и выразить их при помощи химических реакций. Продукт окисления магния собрать для следующего опыта. [c.182]
Вернуться к основной статье
www.chem21.info
Проверочная работа по теме «Бериллий, магний и щелочноземельные металлы»
Проверочная работа для текущего контроля знаний по теме «Бериллий, магний и щелочноземельные металлы и их соединения»
Цель работы:
проверка знаний обучающихся по результатам изучения темы «Бериллий, магний и щелочноземельные металлы и их соединения»
контроль за формированием у обучающихся общеучебных и предметных умений;
целенаправленная подготовка обучающихся к сдаче ОГЭ по химии.
Работа составлена из заданий Открытого банка заданий ОГЭ.
Структура работы:
Определять тип химической связи в неорганических веществах1
1 мин
4
базовый
Вычисление массовой доли химического элемента в веществе
Составлять химическую формулу вещества по его названию; вычислять массовые доли химических элементов в веществе
1
3 мин
5
базовый
Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических соединений
Определять простые и сложные вещества, принадлежность сложных веществ к классам неорганических соединений по названию или формуле
1
1 мин
6
базовый
Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях.
Характеризовать признаки протекания химических реакций
1
1 мин
7
базовый
Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей (средних)
Составлять уравнения процесса электролитической диссоциации кислот, щелочей, солей
1
2 мин
8
базовый
Реакции ионного обмена и условия их осуществления
Составлять уравнения и определять признаки протекания реакций ионного обмена с использованием таблицы растворимости соединений
1
3 мин
9
базовый
Химические свойства простых (металлов и неметаллов) и сложных (оксидов, оснований, кислот, солей) веществ
Характеризовать химические свойства щелочноземельных металлов и их соединений
1
2 мин
10
высокий
Степень окисления химических элементов. Окислитель и восстановитель.
Окислительно-восстановительные реакции
Определять степени окисления химических элементов в веществах; составлять уравнения электронного баланса; определять окислитель и восстановитель в окислительно-восстановительных реакциях; расставлять коэффициенты в уравнениях химических реакций в соответствии с законом сохранения массы веществ
3
10 мин
ИТОГО
12
25 мин
Шкала перевода баллов в оценку:
ВАРИАНТ 1.
1. Два электрона во внешнем электронном слое находятся у атома
1) серы 2) кислорода 3) азота 4) магния
2. Металлические свойства магния выражены сильнее, чем металлические свойства
1) кальция 2) натрия 3) алюминия 4) бария
3. Веществом с ионной связью является
1) оксид серы(VI) 2) водород 3) магний 4) фторид кальция
4. На какой диаграмме распределение массовых долей элементов соответствует количественному составу гидроксида бария?
1) 2) 3) 4)
5. Только основные оксиды представлены в ряду
1) Na2O, MgO 2) Li2O, BeO 3) B2O3, Al2O3 4) CO, CuO
6. Выпадением осадка сопровождается взаимодействие ионов
1) Ca2+ и PO43− 2) K+ и SiO32− 3) Zn2+ и NO3− 4) NH4+и SO42−
7. Наибольшее число ионов образуется в растворе при полной диссоциации 1 моль
1) HNO3 2) MgCl2 3) NaOH 4) KMnO4
8. Взаимодействию карбоната магния с бромоводородной кислотой соответствует сокращённое ионное уравнение
1) MgCO3 + 2H+ = Mg2+ + CO2 + H2O
2) CO32– + 2H+ = CO2 + H2O
3) MgCO3 + 2H+ + 2Br– = MgBr2 + H2O + CO2
4) MgCO3 + 2HBr = Mg2+ + 2Br– + H2O + CO2
9. Кальций вступает в реакцию с каждым из двух веществ:
1) магний и соляная кислота 2) вода и гидроксид калия
3) гидроксид натрия и соляная кислота 4) соляная кислота и хлор
10. Используя метод электронного баланса, составьте уравнение реакции
Mg + H2SO4 → MgSO4 + H2S + h3O
Определите окислитель и восстановитель.
ВАРИАНТ 2.
1. Химическому элементу, расположенному в 4-ом периоде, IIA-группе соответствует схема электронного строения атома
1) 2; 3; 2) 2; 8; 2; 3) 2; 8; 8; 2; 4) 2; 8; 3;
2. В каком ряду химические элементы расположены в порядке усиления металлических свойств?
1) Na → Mg → Al 2) Al → Mg → Na
3) Ca → Mg → Be 4) K → Na → Li
3. В оксиде лития химическая связь
1) ковалентная полярная 2) ковалентная неполярная
3) металлическая 4) ионная
4. На какой диаграмме распределение массовых долей элементов соответствует количественному составу фосфата магния?
1) 2) 3) 4)
5. Гидроксид бария и фосфат калия соответственно являются
1) основанием и средней солью 2) амфотерным гидроксидом и средней солью
3) оснόвным оксидом и кислотой 4) основанием и оснόвным оксидом
6. Выпадением осадка сопровождается взаимодействие ионов
1) Ag+ и PO43− 2) Ca2+ и Cl– 3) Н+ и SO42− 4) Na+ и S2–
7. 3 моль хлорид-ионов образуется при полной диссоциации 1 моль
1) хлорида алюминия 2) хлорида магния
3) хлороводородной кислоты 4) хлорида бария
8. Сокращённому ионному уравнению 2H+ + CO32–– = CO2 + H2O соответствует левая часть схемы реакции
1) H2SiO3 + K2CO3 → 2) H2O + CO2 →
3) HCl + Na2CO3 → 4) HNO3 + CaCO3 →
9. Осадок гидроксида магния растворится при взаимодействии с раствором
1) хлорида кальция 2) соляной кислоты
3) фосфата натрия 4) гидроксида калия
10. Используя метод электронного баланса, составьте уравнение реакции
Ca(NO2)2 + (NH4)2SO4 → N2 + CaSO4+ H2O
Определите окислитель и восстановитель.
ВАРИАНТ 3.
1. Одинаковое число электронов во внешнем электронном слое имеют атомы
1) Na и Mg 2) Mg и Al 3) Mg и Ca 4) Ca и K
2. Наиболее слабыми оснóвными свойствами обладает оксид
1) калия 2) магния 3) кальция 4) бария
3. Химическая связь в бромиде натрия
1) ионная 2) ковалентная полярная
3) ковалентная неполярная 4) металлическая
4. На какой диаграмме распределение массовых долей элементов соответствует количественному составу фосфата бария?
1) 2) 3) 4)
5. Формулой соли является
1) NaOH 2) Na2CO3 3) H2CO3 4) Na2O
6. Осадок не образуется в ходе реакции между растворами
1) FeSO4 и KOH 2) Na3PO4 и AgNO3
3) H2SO4 и Ba(OH)2 4) H2SO4 и NaOH
7. Одинаковое количество катионов и анионов образуется при полной диссоциации
1) Ca(NO3)2 2) ZnSO4 3) FeCl3 4) Na3PO4
8. Сокращённое ионное уравнение 2Н+ + CO32– = CO2 + Н2О соответствует взаимодействию веществ
1) H2SiO3 и K2CO3 2) НCl и BaCO3
3) HNO3 и Na2CO3 4) H2S и CaCO3
9. И магний, и натрий при комнатной температуре энергично реагируют с
1) водой 2) соляной кислотой
3) гидроксидом бария 4) карбонатом кальция
10. Используя метод электронного баланса, составьте уравнение реакции
Br2 + Ca3P2 + H2O → Ca3(PO4)2 + HBr
Определите окислитель и восстановитель.
ВАРИАНТ 4.
1. Химическому элементу, расположенному в 3-ем периоде, IIA-группе соответствует схема электронного строения атома
1) 2; 3; 2) 2; 8; 2; 3) 2; 8; 8; 2; 4) 2; 8; 3;
2. Оснóвные свойства оксида магния выражены сильнее, чем оснóвные свойства
1) оксида натрия 2) оксида бериллия
3) оксида кальция 4) оксида калия
3. Химическая связь в хлориде кальция
1) ионная 2) ковалентная полярная
3) ковалентная неполярная 4) металлическая
4. На какой диаграмме распределение массовых долей элементов соответствует количественному составу фосфата кальция?
1) 2) 3) 4)
5. К классу солей относят каждое из двух веществ:
1) HNO3 и BaCl2 2) Na2SO4 и CuS
3) BaCl2 и CaO 4) NaOH и H2O
6. Осадок не образуется при взаимодействии водных растворов
1) Ca(NO3)2 и K3PO4 2) KOH и H2SO4
3) AgNO3 и MgCl2 4) Fe2(SO4)3 и NaOH
7. Одинаковое количество катионов и анионов образуется при полной диссоциации
1) Al2(SO4)3 2) CuCl2 3) MgSO4 4) Na2CO3
8. Взаимодействию карбоната кальция с хлороводородной кислотой соответствует сокращённое ионное уравнение
1) CaCO3 + 2H+ = Ca2+ + CO2 + H2O
2) CO32– + 2H+ = CO2 + H2O
3) CaCO3 + 2H+ + 2Cl– = CaCl2 + H2O + CO2
4) CaCO3 + 2HCl = Ca2+ + 2Cl– + H2O + CO2
9. Сульфат бария можно получить в результате реакции нитрата бария с
1) oксидом серы(IV) 2) сернистой кислотой
3) сероводородом 4) сульфатом калия
10. Используя метод электронного баланса, составьте уравнение реакции
NO + Ва(OH)2 → Ba(NO2)2 + N2 + H2O
Определите окислитель и восстановитель.
infourok.ru
Бериллий магний и щелочноземельные металлы Щелочноземельные металлы-элементы
 Бериллий, магний и щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы
 Щелочноземельные металлы-элементы IIA группы Щелочноземельными являются не все элементы IIА группы, а только начиная с кальция и вниз по группе. Оксиды этих элементов ( «земли» — по старинной терминологии) взаимодействуют с водой, образуя щелочи.
Щелочноземельные металлы-элементы IIA группы Щелочноземельными являются не все элементы IIА группы, а только начиная с кальция и вниз по группе. Оксиды этих элементов ( «земли» — по старинной терминологии) взаимодействуют с водой, образуя щелочи.
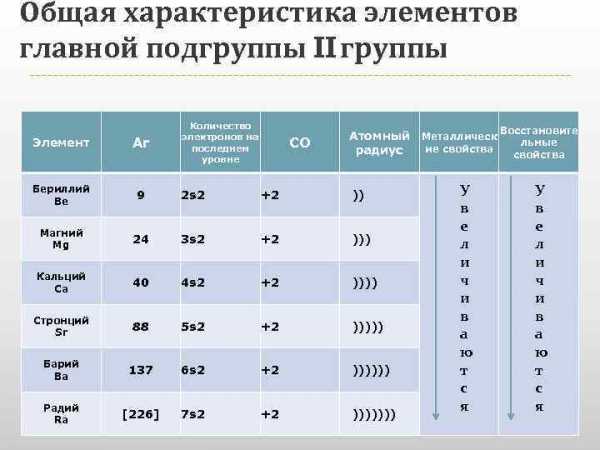 Общая характеристика элементов главной подгруппы II группы Количество электронов на последнем уровне СО Атомный Металлическ Восстановите льные ие свойства радиус свойства Элемент Ar Бериллий Be 9 2 s 2 +2 )) Магний Mg 24 3 s 2 +2 ))) Кальций Ca 40 4 s 2 +2 )))) Стронций Sr 88 5 s 2 +2 ))))) Барий Ba 137 6 s 2 +2 )))))) Радий Ra [226] 7 s 2 +2 ))))))) У в е л и ч и в а ю т с я
Общая характеристика элементов главной подгруппы II группы Количество электронов на последнем уровне СО Атомный Металлическ Восстановите льные ие свойства радиус свойства Элемент Ar Бериллий Be 9 2 s 2 +2 )) Магний Mg 24 3 s 2 +2 ))) Кальций Ca 40 4 s 2 +2 )))) Стронций Sr 88 5 s 2 +2 ))))) Барий Ba 137 6 s 2 +2 )))))) Радий Ra [226] 7 s 2 +2 ))))))) У в е л и ч и в а ю т с я
 Общая характеристика элементов главной подгруппы II группы Одинаковое строение внешнего электронного слоя Элементы проявляют со +2 Атомы элементов являются сильными восстановителями, т. к содержат 2 электрона на внешнем энергетическом уровне, которые отдают при взаимодействиями с другими элементами. С увеличением № элементов увеличивается атомный радиус, увеличивается число электронных слоев, следовательно возрастает легкость отдачи электронов. Восстановительные свойства увеличиваются в группе сверху вниз.
Общая характеристика элементов главной подгруппы II группы Одинаковое строение внешнего электронного слоя Элементы проявляют со +2 Атомы элементов являются сильными восстановителями, т. к содержат 2 электрона на внешнем энергетическом уровне, которые отдают при взаимодействиями с другими элементами. С увеличением № элементов увеличивается атомный радиус, увеличивается число электронных слоев, следовательно возрастает легкость отдачи электронов. Восстановительные свойства увеличиваются в группе сверху вниз.
 Ве — амфотерный металл, Mg – металл, Сa, Sr, Ba — щёлочноземельные металлы Ra –радиоактивный элемент
Ве — амфотерный металл, Mg – металл, Сa, Sr, Ba — щёлочноземельные металлы Ra –радиоактивный элемент
 Физические свойства Бериллий, магний, кальций, барий и радий — металлы серебристо-белого цвета. Стронций имеет золотистый цвет. Эти металлы легкие, особенно низкие плотности имеют кальций, магний, бериллий. Радий является радиоактивным химическим элементом на воздухе элементы достаточно устойчивы, но покрываются оксидной пленкой, Бериллий (Ве) очень твердый материал и способен оставлять царапины на стекле; твердость других элементов подгруппы уменьшается, и барий по твердости близок к свинцу Бериллий магний кальций
Физические свойства Бериллий, магний, кальций, барий и радий — металлы серебристо-белого цвета. Стронций имеет золотистый цвет. Эти металлы легкие, особенно низкие плотности имеют кальций, магний, бериллий. Радий является радиоактивным химическим элементом на воздухе элементы достаточно устойчивы, но покрываются оксидной пленкой, Бериллий (Ве) очень твердый материал и способен оставлять царапины на стекле; твердость других элементов подгруппы уменьшается, и барий по твердости близок к свинцу Бериллий магний кальций
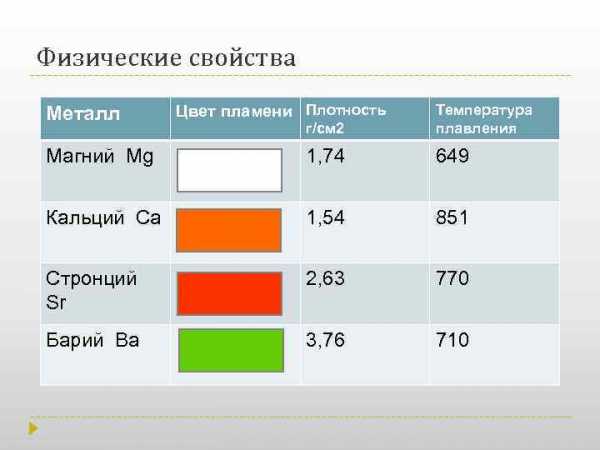 Физические свойства г/см 2 Температура плавления Магний Mg 1, 74 649 Кальций Са 1, 54 851 Стронций Sr 2, 63 770 Барий Ва 3, 76 710 Металл Цвет пламени Плотность
Физические свойства г/см 2 Температура плавления Магний Mg 1, 74 649 Кальций Са 1, 54 851 Стронций Sr 2, 63 770 Барий Ва 3, 76 710 Металл Цвет пламени Плотность
 Химические свойства Щелочноземельные элементы — химически активные металлы. Они являются сильными восстановителями. Из металлов этой подгруппы несколько менее активен бериллий, что обусловлено образованием на поверхности этого металла защитной оксидной пленки. 1. С кислородом 2 M+O 2=2 MO (оксид) 2. С галогенами M+Cl 2=MCl 2 (хлорид) 3. С серой M+S=MS (сульфид) 4. С азотом 3 M+N 2=M 3 N 2 (нитрид) 5. С водородом M+H 2=MH 2 (гидрид) 6. С водой M+2 H 2 O=M(OH)2+H 2
Химические свойства Щелочноземельные элементы — химически активные металлы. Они являются сильными восстановителями. Из металлов этой подгруппы несколько менее активен бериллий, что обусловлено образованием на поверхности этого металла защитной оксидной пленки. 1. С кислородом 2 M+O 2=2 MO (оксид) 2. С галогенами M+Cl 2=MCl 2 (хлорид) 3. С серой M+S=MS (сульфид) 4. С азотом 3 M+N 2=M 3 N 2 (нитрид) 5. С водородом M+H 2=MH 2 (гидрид) 6. С водой M+2 H 2 O=M(OH)2+H 2
 Получение щелочноземельных металлов Электролизом расплавов их хлоридов или термическим восстановлением их соединений: Be. F 2 + Mg = Be + Mg. F 2 Mg. O + C = Mg + CO 3 Ca. O + 2 Al = 2 Ca + Al 2 O 3 3 Ba. O + 2 Al = 3 Ba + Al 2 O 3
Получение щелочноземельных металлов Электролизом расплавов их хлоридов или термическим восстановлением их соединений: Be. F 2 + Mg = Be + Mg. F 2 Mg. O + C = Mg + CO 3 Ca. O + 2 Al = 2 Ca + Al 2 O 3 3 Ba. O + 2 Al = 3 Ba + Al 2 O 3
 Приминение
Приминение

present5.com
