E211 Бензоат натрия — действие на здоровье, польза и вред, описание
Бензоат натрия (Sodium Benzoate, бензойнокислый натрий, E211).
Бензоатом натрия (добавкой Е211) называют вещество, имеющее свойства консерванта. Представляет собой белый порошок без вкуса и запаха.
Общая характеристика и история возникновения
Бензоат натрия является солью бензойной кислоты, полученная во время реакции последней и едкого натра. Был открыт в 1875 году Хьюго Флеком, который проводил опыты с целью получить замену труднодоступной салициловой кислоты.
Консервирующее свойство
Основное свойство бензоата натрия состоит в практически полном подавлении жизнедеятельности дрожжевых грибков и плесневых бактерий. Е211 полностью прекращает способность клеток к выработке ферментов и расщеплению крахмалов и жиров (calorizator). Происходит гибель микробов, потому что бензоат натрия «работает» как антибиотик.
Полезные свойства Бензоата натрия
Главное качество Е211 как консерванта – увеличение срока годности и хранения приготовленных продуктов.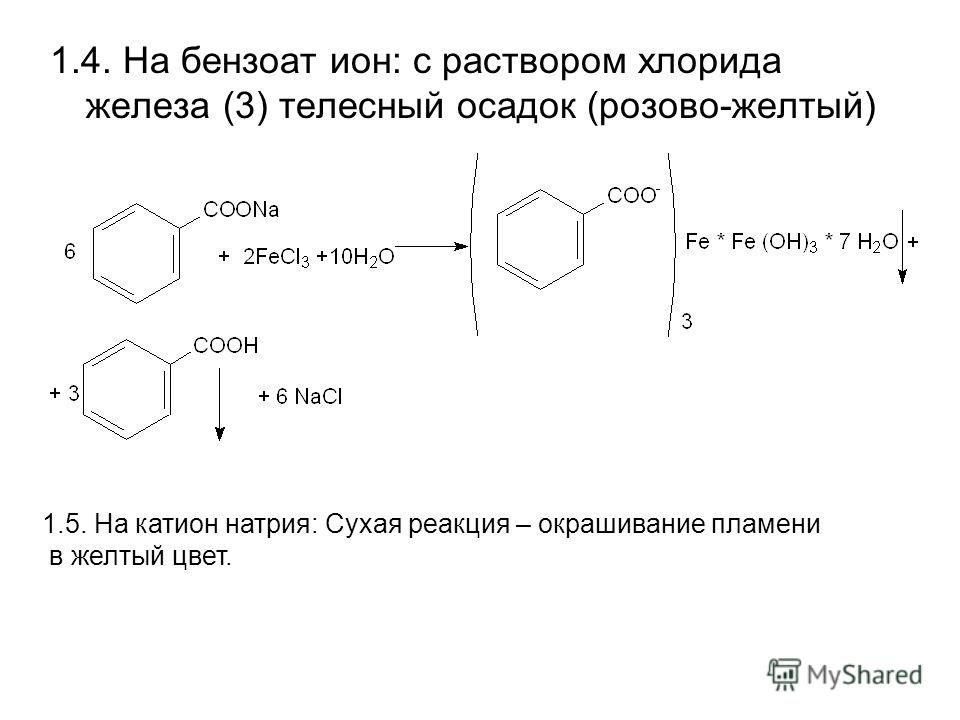 Лёгкий сладковатый привкус способен улучшить вкус продуктов, но здесь имеются подводные камни – возможно, улучшать вкус производители будут испорченным или некондиционным продуктам.
Лёгкий сладковатый привкус способен улучшить вкус продуктов, но здесь имеются подводные камни – возможно, улучшать вкус производители будут испорченным или некондиционным продуктам.
Вред Е211 Бензоата натрия
Подавляя активность всех клеток организма и их способность расщепления крахмалов и жиров, Бензоат натрия, угнетает окислительно-восстановительные процессы в организме, вызывает аллергию, повреждение ДНК, крапивницу, может спровоцировать цирроз печени, болезнь Паркинсона и некоторые нейродегенеративные болезни. Бензоат натрия оказывает сильное угнетающее действие на дрожжи и плесневые грибы, включая афлатоксинообразующие, подавляет в микробных клетках активность ферментов, ответственных за окислительно-восстановительные реакции, а также ферментов, расщепляющих жиры и крахмал (такое же действие бензоат натрия производит и на клетки человеческого организма).
Коварство Е211 в том, что он накапливается в организме и практически не выводится, поэтому консервы и полуфабрикаты, а также другие продукты, содержащие данный консервант, нужно употреблять в умеренных количествах.
Бензоат натрия (Е211) – один из самых дешёвых консервантов, именно поэтому его так часто используют в пищевой промышленности. При попадании в организм человека Е211 входит в реакцию с гликоколом и образуется бензоил-гликокол. У детей она выводится намного медленней, чем у взрослых.
Применение Е211 в пищевой промышленности
В России и некоторых странах Бензоат натрия используют в пищевой промышленности. Е211 полностью растворяется в воде и не теряет своих свойств при кипячении, поэтому спектр его применения в пищевой промышленности практически не имеет границ. Бензоат натрия используют при производстве безалкогольных напитков, колбас, мясопродуктов и сыров, консервов и пресервов, соусов, пряностей и приправ, маринованных овощей и консервированных фруктов, джемов, желе, рыбной консервации и солёной рыбы, конфет и других кондитерских изделий, практически всех полуфабрикатов, особенно – готовых салатов. Также Е211 Бензоат натрия присутствует в некоторых продуктах для снижения веса и детском питании.
Помимо химически полученного, Е211 имеет и природное происхождение, в небольших дозах его содержат чернослив, яблоки, клюква, корица и гвоздика. Однако, чаще всего, Бензоат натрия – это вещество, которое синтезируется химической промышленностью. Его химическая формула – C6H5COONa.
Применение Е211 в производстве
Бензоат натрия присутствует и в некоторых медикаментах (как отхаркивающее средство в составе комбинированных препаратов), в производстве табачной продукции, пиротехники, парфюмерии и как защитное средство для деталей из алюминия.
Сочетание бензоата натрия с другими веществами
При соединении Е211 с некоторыми другими веществами он может принести существенный вред организму, при постоянном использовании в большом количестве. Например, соединение бензоата натрия с аскорбиновой кислотой (Е300) образует бензол. Частое потребление которого приводит к его накоплению в организме и возможности развития раковых опухолей.
При превышении дозы потребления бензола человек чувствует тошноту и головокружение, появляются и другие симптомы интоксикации.
Обычно в продукты добавляют несколько разных добавок, которые взаимодействуя друг с другом могут в некоторых случаях изменять свои свойства или усиливать эффект.
Например, в молочные продукты часто добавляют бензоат натрия вместе с сорбатом калия, для усиления угнетения молочнокислых бактерий, что приводит к усилению консервирующего действия E211.
Вредные свойства усиливаются также в сочетании с Е102 (тартразином).
Использование Е211 Бензоат натрия в России
Нужно помнить, что в большинстве государств Мирового Сообщества Е211 запрещён, потому что ВОЗ признала его безвредным лишь в ничтожно малых количествах. Однако, добавка Е211 разрешена для использования в пищевых продуктах в России, Украине и многих других странах.
Бензоат натрия, структурная формула, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Натрий бензоат
Технические характеристики:
Название: | E-211 (Е-211) Бензоат натрия |
Тип: | Пищевая добавка |
Категория: | Консерванты |
Воздействие на организм: | канцерогенный эффект (вызывает рак) |
Описание группы: | Консерванты |
Описание:
Бензоат натрия (Sodium Benzoate, Е-211 ) — соединение бензойной кислоты. Бензоат натрия зарегистрирован как пищевая добавка с кодом E-211. Широко применяется в пищевой промышленности в качестве консерванта. При увеличенных дозах является сильным канцерогеном.
Применение:
Бензоат натрия обладает свойствами антибиотика и усилителя цвета. Встречается в соусах для барбекью, прессервах, соевых соусах, «фруктовых» драже, леденцах и пр. Вызывает аллергические реакции. Вредные свойства усиливаются в сочетании с Е-102 (тартразином). Запрещен для применения в некоторых странах. Разрешен в странах СНГ и Европы. В европейских странах обсуждают негативное влияние комбинации бензоата натрия и искусственных красителей на поведение и интеллект детей, и рекомендовано постепенно вывести красители E-110, E-104, E-122, E-129, E-102, E-124 из употребления.

Бензоат натрия оказывает сильное угнетающее действие на дрожжи и плесневые грибы, включая афлатоксинообразующие, подавляет в микробных клетках активность ферментов, ответственных за окислительно-восстановительные реакции, а также ферментов, расщепляющих жиры и крахмал. (такое же действие бензоат натрия производит и на клетки человеческого организма).
Химическая формула: C6H5COONa
Упаковка: ПЭТ емкости 25 кг.
Гарантийный срок хранения: 2 года.
ICSC 1536 — БЕНЗОАТ НАТРИЯ
ICSC 1536 — БЕНЗОАТ НАТРИЯ| БЕНЗОАТ НАТРИЯ | ICSC: 1536 |
| Октябрь 2004 |
| CAS #: 532-32-1 | |
| EINECS #: 208-534-8 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Горючее при определенных условиях. При пожаре выделяет раздражающие или токсичные пары (или газы). Мелкодисперсные частицы образуют в воздухе взрывчатые смеси. При пожаре выделяет раздражающие или токсичные пары (или газы). Мелкодисперсные частицы образуют в воздухе взрывчатые смеси. |
НЕ использовать открытый огонь. Замкнутая система, взрывозащищенное (для пыльной среды) электрическое оборудование и освещение. Не допускать оседания пыли. | Использовать распыленную воду, порошок, пену, двуокись углерода. |
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
|---|---|---|---|
| Вдыхание | Кашель. | Избегать вдыхания пыли. | Свежий воздух, покой. |
| Кожа | Сыпь. | Защитные перчатки. Защитная одежда. | Промыть кожу большим количеством воды или принять душ. |
| Глаза | Покраснение. |
Использовать защитные очки. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | Тошнота. Рвота. Боль в животе. | Не принимать пищу, напитки и не курить во время работы. | НЕ вызывать рвоту. Дать выпить один или два стакана воды. Обратиться за медицинской помощью . |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| Индивидуальная защита: Респиратор с сажевым фильтром, подходящий для концентрации вещества в воздухе. Смести просыпанное вещество в закрытые контейнеры. |
Согласно критериям СГС ООН Транспортировка |
| ХРАНЕНИЕ | |
| УПАКОВКА | |
Исходная информация на английском языке подготовлена группой международных экспертов, работающих от имени МОТ и ВОЗ при финансовой поддержке Европейского Союза. |
| БЕНЗОАТ НАТРИЯ | ICSC: 1536 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: C7H5NaO2 / C6H5COONa |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Опасен ли бензоат натрия (Е211)?
Пищевых добавок сотни, и не все они, как говорится, одинаково полезны. А точнее – одинаково безопасны. В рамках рубрики «Ингредиенты» сегодня мы поговорим о бензоате натрия – очень распространенной пищевой добавке, которая несколько лет назад наделала много шума в европейской прессе.
Что такое бензоат натрия и зачем он нужен в пище
Бензоат натрия — натриевая соль бензойной кислоты, химическая формула C6H5CO2Na. Это химическое соединение используется в качестве пищевой добавки Е211, относящейся к группе консервантов. Бензоат натрия используется для борьбы с брожением, плесенью и дрожжами, кисломолочными и уксуснокислыми бактериями, т.к. подавляет в клетках активность ферментов, ответственных за окислительно-восстановительные реакции, и ферментов, расщепляющих жиры и крахмал. Он предотвращает гниение продуктов, тем самым увеличивая срок их хранения. Так что можно с уверенностью сказать, что это один из важных консервантов в пищевой промышленности.
Так что можно с уверенностью сказать, что это один из важных консервантов в пищевой промышленности.
Где используется бензоат натрия
Бензоат натрия (БН) сам по себе не является опасной добавкой – по крайней мере, так принято считать в нашей стране, т.к. в России БН входит в список разрешенных пищевых добавок для использования в продуктах питания – как мы помним, в качестве консерванта. БН также разрешен в США и Японии, но в некоторых других странах запрещен.
Если посмотреть гигиенические регламенты применения консервантов в СанПиН 2.3.2#-03, то количество категорий продуктов, для которых есть такой регламент, а значит, в которых может содержаться данная добавка, будет более тридцати. Заметьте, речь идет о группах товаров, а не об их видах: кремы для тортов, джемы, желе, соусы, безалкогольные напитки (включая безалкогольное пиво), спиртные напитки с содержанием спирта менее 15%, молочные десерты (термически не обработанные), пресервы из рыбы, горчица, маринованные овощи, жевательная резинка, соленая рыба, глазированные фрукты и много других категорий продуктов. Полный список – здесь (Приложение 3, пункт 3.3. Гигиенические регламенты применения консервантов).
Полный список – здесь (Приложение 3, пункт 3.3. Гигиенические регламенты применения консервантов).
Кстати, один из крупнейших «пользователей» бензоата натрия – многомиллиардная индустрия безалкогольных газированных напитков, т.ч. в следующий раз, выпивая баночку Sprite или Dr.Pepper, проверьте состав.
Но и это еще не все. «Антибактериальные качества Е211 применяются в фармацевтической деятельности, а также в производстве различных гигиенических и средств: гели, шампуни, зубные пасты. Бензоат натрия применяют в пиротехнических целях, при создании типичного визга при взлете ракеты. Его также используют в авиационной промышленности, он служит защитой алюминиевых деталей и гальванических покрытий», – читаем на сайте производителя пищевых добавок, в том числе и бензоата натрия, «Американ Фуд Компани» (компания на самом деле российская).
Опасен ли бензоат натрия для человека?
Ну ладно, предположим, тот факт, что бензоат натрия используют для «визга при взлете ракеты», не говорит о его опасности для человека (если не стоять под ракетой). Основные претензии к БН заключаются в другом: его воздействии на организм при реакции с аскорбиновой кислотой и его способности вызывать дисфункции митохондриальных ДНК. Если вы ничего не поняли, не волнуйтесь – мы тоже не сразу разобрались.
Основные претензии к БН заключаются в другом: его воздействии на организм при реакции с аскорбиновой кислотой и его способности вызывать дисфункции митохондриальных ДНК. Если вы ничего не поняли, не волнуйтесь – мы тоже не сразу разобрались.
Бензоат натрия и витамин С
Итак, сначала об аскорбиновой кислоте, т.е. витамине С. Более-менее нейтральный бензоат натрия, вступая с ним в реакцию, может в небольших количествах образовывать бензол, являющийся сильным канцерогеном. Хроническое отравление бензолом в худших случаях ведет к лейкемии и анемии, а острое – к мгновенной потере сознания и смерти в течение нескольких минут (если вам интересны подробности, воспользуйтесь Википедией – мы уже поставили для вас ссылку на страницу “Бензол”). Конечно, в случае с пищей ни то, ни другое вам не грозит, однако при регулярном употреблении продуктов, содержащих бензоат натрия и аскорбиновую кислоту, ничего хорошего тоже ждать не стоит.
Имейте в виду, что витамин С часто «скрывается» в составах продуктов под номером пищевой добавки Е-300. Прекрасная и важная сама по себе, в сочетании с БН аскорбинка становится опасной для здоровья.
Прекрасная и важная сама по себе, в сочетании с БН аскорбинка становится опасной для здоровья.
Бензоат натрия и ДНК
Британский ученый (не смейтесь, пожалуйста), профессор из Шеффилдского Университета Питер Пайпер (Peter Piper) провел исследование по воздействию бензоата натрия на клетки дрожжей. Пайпер выяснил, что БН угнетает часть ДНК, расположенную в митохондриях – частях клетки, ответственных за преобразование поступивших в организм органических соединений в энергию. В этой части клетки расположена т.н. митохондриальная ДНК (в противовес «основной» ДНК, расположенной в ядре клетки). Так вот, бензоат натрия угнетает эту самую митохондриальную ДНК вплоть до полной ее дисфункции. Если повредит митохондрию, то энергия не будет вырабатываться, и сама клетка не сможет полноценно существовать. По утверждению Пайпера, которое приводит британское издание The Independent, такая дисфункция может привести к болезни Альцгеймера, нейро-дегенеративным расстройствам и «усилению» процесса старения.
Пайпер также утверждает, что исследования бензоата натрия, проведенные ВОЗ в 2000 году, не соответствуют требованиям времени, и для подтверждения безопасного статуса БН требуются дальнейшие проверки. Очевидно, пока они не проведены, считать БН безопасным нельзя.
Конечно, у Пайпера есть оппоненты, заявляющие, помимо прочего, что для того, чтобы БН стал опасным для человека, его необходимо съесть целую гору. Тем не менее, ученые также озабочены вопросом о влиянии Е-211 на гиперактивность детей, и ряд зарубежных компаний производителей пищевых продуктов занимается поиском альтернативы бензоата натрия.
Вместо вывода
Мы вообще-то не хотим никого пугать. В мире много пищевых добавок – и вообще вещей – пострашнее бензоата натрия. Но мы голосуем за максимальное сокращение использования химических добавок в пище и считаем, что природа и так создала еду именно такой, какой она нужна человеку (без бензоата натрия). Занавес.
Бензоат натрия
Английское название: Sodium benzoate
Синонимы: Натрия бензоат; E211; бензойнокислый натрий
ГОСТ, CAS, ТУ: CAS 532-32-1
Формула: C₆H₅COONa
Внешний вид: белый кристаллический порошок порошок (или гранулы) без запаха
Применение: Бензоат натрия обладает свойствами антибиотика и усилителя цвета. Встречается в соусах для барбекью, прессервах, соевых соусах, «фруктовых» драже, леденцах и пр. Вызывает аллергические реакции. Вредные свойства усиливаются в сочетании с Е-102 (тартразином). Запрещен для применения в некоторых странах. Разрешен в странах СНГ и Европы. В европейских странах обсуждают негативное влияние комбинации бензоата натрия и искусственных красителей на поведение и интеллект детей, и рекомендовано постепенно вывести красители E-110, E-104, E-122, E-129, E-102, E-124 из употребления. Бензоат натрия оказывает сильное угнетающее действие на дрожжи и плесневые грибы, включая афлатоксинообразующие, подавляет в микробных клетках активность ферментов, ответственных за окислительно-восстановительные реакции, а также ферментов, расщепляющих жиры и крахмал. (такое же действие бензоат натрия производит и на клетки человеческого организма).
Встречается в соусах для барбекью, прессервах, соевых соусах, «фруктовых» драже, леденцах и пр. Вызывает аллергические реакции. Вредные свойства усиливаются в сочетании с Е-102 (тартразином). Запрещен для применения в некоторых странах. Разрешен в странах СНГ и Европы. В европейских странах обсуждают негативное влияние комбинации бензоата натрия и искусственных красителей на поведение и интеллект детей, и рекомендовано постепенно вывести красители E-110, E-104, E-122, E-129, E-102, E-124 из употребления. Бензоат натрия оказывает сильное угнетающее действие на дрожжи и плесневые грибы, включая афлатоксинообразующие, подавляет в микробных клетках активность ферментов, ответственных за окислительно-восстановительные реакции, а также ферментов, расщепляющих жиры и крахмал. (такое же действие бензоат натрия производит и на клетки человеческого организма).
Характеристики продукта:
Внешний вид Белый порошок или гранулы Содержание основного вещества,% 99-100,5 Потери при высушивании, % не более 2,0 Кислотность и щелочность В соотвествии с правилами Хлориды, % не более 0,03 Тяжелые металлы, % не более 0,001 Мышьяк, % не более 0,0003
Условия хранения: хранение в заводской закрытой упаковке в сухом, защищенном от солнечного света месте.
Срок годности: 2 года.
Упаковка: мешки по 25 кг
Бензоат натрия | ООО «ЦИТРОПАР»
Название: Бензоат натрия, Е211
Другие названия: Е211, Е-211, Анг: E211, E-211, Sodium benzoate
Группа: Пищевая добавка
Вид: Консерванты
Характеристика:
Бензоат натрия — это часто применимый консервант, обеспечивающий свежесть продуктов. Угнетает разввитие дрожжевых клеток, грибов, некоторых видов бактерий. В натуральном виде он встречается в яблоках, клюкве, изюме, а также в специях (гвоздике, корице).
Натрий бензойнокислый является водорастворимым веществом. Представляет из себя белые кристаллы, которые обладают легким запахом бензальдегида или не имеют его вовсе, со сладковатым вкусом.
Антимикробное действие бензоата натрия обусловлено влиянием бензойной кислоты на ферментную систему микроорганизмов. Происходит сильное угнетающее воздействие на дрожжевые клетки и плесень, в клетках снижается деятельность энзимов, выполняющих реакции окисления, восстановления и расщепления.
Бензоат натрия устойчив при кипячении, температура плавления составляет 300° C. Чтобы повысить его эффективность, надо создать кислую среду со значениями рН от 3,8 до 4,5.
Применение:
Е211 в пищевой промышленности играет роль консерванта и усилителя цвета для жировых продуктов, майонезов, мяса, рыбы, сладких газированных напитков, кетчупов, маргаринов, плодово-ягодных изделий, соевых соусов, майонеза и деликатесов, содержащих майонез, пресервов и пр.
Надо отметить, что в современном производстве редко используется только один вид пищевых добавок. Так, при совместном применении бензоата натрия с молочной кислотой, они дополняют консервирующие свойства друг друга, а сочетание бензоата натрия и сорбата калия дает эффект синергии, т. е. угнетение молочнокислых бактерий происходит сильнее, чем каждая соль дает в отдельности.
E211 обычно применяется в комплексе с красителями и стабилизаторами. Содержание Е-211 в безалкогольных напитках оранжевого цвета может достигать 25 мкг на 250 мл. Бензоат натрия используется для защиты от плесени различных сортов табака. Благодаря своим антесептическим свойствам бензоат натрия находит применение и в фармацевтике, в качестве отхаркивающего средства — в сиропах от кашля.
Бензоат натрия используется для защиты от плесени различных сортов табака. Благодаря своим антесептическим свойствам бензоат натрия находит применение и в фармацевтике, в качестве отхаркивающего средства — в сиропах от кашля.
В химической промышленности применяется в производстве клеев, красителей, стабилизаторов полимеров, фейерверков. В авиационной промышленности защищает гальванические покрытия и детали из алюминия.
Бензоат натрия | AMERICAN ELEMENTS ®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ
Название продукта: Бензоат натрия
Номер продукта: Все применимые коды продуктов American Elements, например NA-BENZ-02 , NA-BENZ-03 , NA-BENZ-04 , NA-BENZ-05
Номер CAS: 532-32-1
Соответствующие установленные области применения вещества: Научные исследования и разработки
Информация о поставщике:
American Elements
10884 Weyburn Ave.
Лос-Анджелес, Калифорния
Тел .: +1 310-208-0551
Факс: +1 310-208-0351
Телефон экстренной связи:
Внутренний номер, Северная Америка: +1 800-424-9300
Международный: +1 703-527-3887
РАЗДЕЛ 2. ИДЕНТИФИКАЦИЯ ОПАСНОСТЕЙ
2.1 Классификация вещества или смеси
GHS Классификация в соответствии с 29 CFR 1910 (OSHA HCS)
Раздражение глаз (Категория 2A), h419
2.2 GHS Элементы маркировки, включая меры предосторожности
Пиктограмма
Сигнальное слово Осторожно
Краткая характеристика опасности
h419 Вызывает серьезное раздражение глаз.
Меры предосторожности
P264 Тщательно вымыть кожу после работы.
P280 Пользоваться защитными перчатками / средствами защиты глаз / лица.
P305 + P351 + P338 ПРИ ПОПАДАНИИ В ГЛАЗА: осторожно промыть глаза водой в течение нескольких минут. Снимите контактные линзы
, если они есть, и это легко сделать. Продолжайте полоскание.
P337 + P313 Если раздражение глаз не проходит: обратиться к врачу.
2.3 Опасности, не классифицированные иным образом (HNOC) или не охваченные GHS — нет
РАЗДЕЛ 3. СОСТАВ / ИНФОРМАЦИЯ ОБ ИНГРЕДИЕНТАХ
3.1 Вещества
Синонимы: Натриевая соль бензойной кислоты
Формула: C7H5NaO2
Молекулярная масса: 144,10 г / моль
CAS-Номер. : 532-32-1
EC-Номер. : 208-534-8
Опасные компоненты
Классификация компонентов Концентрация
Бензоат натрия
Eye Irrit. 2А; h419 —
РАЗДЕЛ 4. ПЕРВАЯ ПОМОЩЬ
4.1 Описание мер первой помощи
Общие рекомендации
Проконсультироваться с врачом. Покажите этот паспорт безопасности лечащему врачу. Покиньте опасную зону.
При вдыхании
При вдыхании вывести человека на свежий воздух. Если нет дыхания проведите искусственную вентиляцию легких. Проконсультируйтесь с врачом.
При попадании на кожу
Смыть большим количеством воды с мылом. Проконсультируйтесь с врачом.
При попадании в глаза
Тщательно промыть большим количеством воды не менее 15 минут и обратиться к врачу.
При проглатывании
Никогда не давайте ничего через рот человеку, находящемуся без сознания. Прополоскать рот водой. Проконсультируйтесь с врачом.
4.2 Наиболее важные симптомы и воздействия, как острые, так и замедленные
Наиболее важные известные симптомы и воздействия описаны в маркировке (см. Раздел 2.2) и / или в разделе 11
4.3 Указание на необходимость немедленной медицинской помощи и специального лечения
Нет данных
РАЗДЕЛ 5. МЕРЫ ПОЖАРОТУШЕНИЯ
5.1 Средства пожаротушения
Подходящие средства пожаротушения
Используйте водяную струю, спиртоустойчивую пену , сухой химикат или двуокись углерода.
5.2 Особые опасности, исходящие от вещества или смеси
Окиси углерода, Оксиды натрия
5.3 Рекомендации для пожарных
При необходимости надеть автономный дыхательный аппарат для тушения пожара.
5.4 Дополнительная информация
Нет данных
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
6.1 Меры личной безопасности, защитное снаряжение и порядок действий в чрезвычайной ситуации
Используйте средства индивидуальной защиты. Избегайте образования пыли. Избегайте вдыхания паров, тумана или газа. Обеспечьте соответствующую вентиляцию
. Избегайте вдыхания пыли.
Информацию о личной защите см. В разделе 8.
6.2 Меры по защите окружающей среды
Не допускать попадания продукта в канализацию.
6.3 Методы и материалы для локализации и очистки.
Подобрать и организовать утилизацию без образования пыли.Подмести и лопатой. Для утилизации
хранить в подходящих закрытых контейнерах.
6.4 Ссылка на другие разделы
Об утилизации см. Раздел 13.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
7.1 Меры предосторожности для безопасного обращения
Избегать контакта с кожей и глазами. Избегайте образования пыли и аэрозолей.
Обеспечьте соответствующую вытяжную вентиляцию в местах образования пыли.
Меры предосторожности см. В разделе 2.2.
7.2 Условия для безопасного хранения с учетом любых несовместимостей.
Хранить контейнер плотно закрытым в сухом и хорошо вентилируемом месте.
Гигроскопичен. Хранить в сухом месте.
7.3 Специальное конечное использование
За исключением использования, упомянутого в разделе 1.2, другие специальные применения не предусмотрены
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ / ЛИЧНАЯ ЗАЩИТА
8.1 Параметры контроля
Компоненты с параметрами контроля рабочего места
Не содержит веществ с предельные значения профессионального воздействия.
8.2 Средства контроля воздействия
Соответствующие технические средства контроля
Обращаться в соответствии с правилами промышленной гигиены и техники безопасности.Мыть руки перед перерывами и в конце рабочего дня
.
Средства индивидуальной защиты
Защита глаз / лица
Защитные очки с боковыми щитками в соответствии с EN166 Используйте средства защиты глаз, протестированные и утвержденные
в соответствии с соответствующими государственными стандартами, такими как NIOSH (США) или EN 166 (ЕС).
Защита кожи
Работать в перчатках. Перед использованием перчатки необходимо проверить. Используйте надлежащую технику снятия перчаток (не касаясь
внешней поверхности перчатки), чтобы избежать контакта кожи с этим продуктом.Утилизируйте загрязненные перчатки после использования
в соответствии с применимыми законами и надлежащей лабораторной практикой. Вымойте и высушите руки.
Полный контакт
Материал: нитриловый каучук
Минимальная толщина слоя: 0,11 мм
Время прорыва: 480 мин
Испытанный материал: Dermatril® (KCL 740 / Aldrich Z677272, размер M)
Контакт с брызгами
Материал: нитриловый каучук
Минимальная толщина слоя : 0,11 мм
Время прорыва: 480 мин
Испытанный материал: Dermatril® (KCL 740 / Aldrich Z677272, размер M)
Источник данных: KCL GmbH, D-36124 Eichenzell, телефон +49 (0) 6659 87300, электронная почта продажи @ kcl.de, метод испытания:
EN374
При использовании в растворе или в смеси с другими веществами и в условиях, отличных от EN 374, обратитесь к поставщику
перчаток, одобренных CE. Эта рекомендация носит исключительно рекомендательный характер и должна быть оценена специалистом по промышленной гигиене и технике безопасности
, знакомым с конкретной ситуацией предполагаемого использования нашими клиентами. Его
не следует истолковывать как одобрение какого-либо конкретного сценария использования.
Body Protection
Непроницаемая одежда. Тип защитного снаряжения должен выбираться в соответствии с концентрацией и количеством
опасного вещества на конкретном рабочем месте.
Защита органов дыхания
Для вредных воздействий используйте респиратор типа P95 (США) или типа P1 (EU EN 143). Для более высокого уровня защиты
используйте респиратор типа OV / AG / P99 (США) или типа ABEK-P2 (EU EN 143). картриджи. Используйте респираторы и компоненты
, протестированные и одобренные соответствующими государственными стандартами, такими как NIOSH (США) или CEN (ЕС).
Контроль воздействия на окружающую среду
Не допускать попадания продукта в канализацию.
РАЗДЕЛ 9. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
9.1 Информация об основных физических и химических свойствах
a) Внешний вид Форма: порошок
Цвет: белый
b) Запах Нет данных
c) Порог запаха Нет данных
d) pH 7,0 — 8,5 при 144,1 г / л при 25 ° C (77 ° F)
e) Точка плавления / замерзания
точка
Точка плавления / диапазон:> 300 ° C (> 572 ° F) — горит.
f) Начальная точка кипения и интервал кипения
Данные отсутствуют
г) Температура вспышки> 100 ° C (> 212 ° F)
h) Скорость испарения Данные отсутствуют
i) Воспламеняемость (твердое тело, газ) Данные отсутствуют
j) Верхний / нижний предел воспламеняемости
или
пределы взрываемости
Нет данных
k) Давление пара l) Плотность пара Нет данных
m) Относительная плотность 1.440 г / см3
n) Растворимость в воде 556 г / л
o) Коэффициент распределения: ноктанол /
вода
log Pow: -2,13
p) Самовоспламенение
температура
Нет данных
q) Разложение
температура
Нет данных имеется
r) Вязкость Нет данных
s) Взрывоопасные свойства Данные отсутствуют
t) Окисляющие свойства Данные отсутствуют
9.2 Прочие указания по безопасности
Класс взрыва пыли St1
РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
10.1 Реакционная способность
Данные отсутствуют
10.2 Химическая стабильность
Стабилен при рекомендуемых условиях хранения.
10.3 Возможность опасных реакций
Нет данных
10.4 Условия, которых следует избегать
Избегать влажности.
10.5 Несовместимые материалы
Сильные окислители
10.6 Опасные продукты разложения
Другие продукты разложения — данные отсутствуют
В случае пожара: см. Раздел 5
РАЗДЕЛ 11. ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
11.1 Информация о токсикологическом воздействии
Острая токсичность
LD50 Перорально — Крыса — 2100 мг / кг
Вдыхание: Данные отсутствуют
Кожные: данные отсутствуют
Данные отсутствуют
Разъедание / раздражение кожи
Кожа — Кролик
Результат: Нет раздражения кожи
(Указания для тестирования OECD 404)
Серьезное повреждение / раздражение глаз
Глаза — Кролик
Результат: Раздражение глаз
Респираторная или кожная сенсибилизация
Нет данных
Мутагенность зародышевых клеток
Нет данных
Канцерогенность
IARC: компонент этого продукта не присутствует на уровнях больше или равных 0.1% идентифицирован МАИР как
вероятных, возможных или подтвержденных канцерогенов для человека.
ACGIH: Ни один компонент этого продукта, присутствующий в концентрациях, превышающих или равных 0,1%, не определен ACGIH как канцероген
или потенциальный канцероген.
NTP: Ни один компонент этого продукта, присутствующий в концентрациях, превышающих или равных 0,1%, не определен NTP как известный или ожидаемый канцероген
.
OSHA: Никакой компонент этого продукта, присутствующий в концентрациях, превышающих или равных 0,1%, не определен OSHA как канцероген
или потенциальный канцероген.
Репродуктивная токсичность
Нет данных
Нет данных
Специфическая избирательная токсичность, поражающая отдельные органы-мишени при однократном воздействии
Нет данных
Специфическая избирательная токсичность, поражающая отдельные органы-мишени при многократном воздействии
Нет данных
Опасность при аспирации
Нет данных
Дополнительная информация
RTECS: DH6650000
Насколько нам известно,
химические, физические и токсикологические свойства не были тщательно исследованы.
РАЗДЕЛ 12.ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
12.1 Токсичность
Токсичность для рыб LC50 — Pimephales promelas (толстоголовый гольян) — 484 мг / л — 96 ч
12.2 Стойкость и разлагаемость
Биоразлагаемость Результат: 90% — Легко разлагается.
(OECD Test Guideline 301)
12.3 Потенциал биоаккумуляции
Нет данных
12.4 Мобильность в почве
Нет данных
12.5 Результаты оценки PBT и vPvB
Оценка PBT / vPvB недоступна, поскольку оценка химической безопасности не требуется / не проводилась
12 .6 Другие побочные эффекты
Нет данных
РАЗДЕЛ 13. УТИЛИЗАЦИЯ
13.1 Методы обработки отходов
Продукт
Предлагайте излишки и не подлежащие переработке решения лицензированной компании по утилизации. Обратитесь в лицензированную службу утилизации профессиональных отходов
, чтобы утилизировать этот материал.
Загрязненная упаковка
Утилизировать как неиспользованный продукт.
РАЗДЕЛ 14. ТРАНСПОРТНАЯ ИНФОРМАЦИЯ
DOT (США)
Не опасные грузы
IMDG
Не опасные товары
IATA
Не опасные товары
РАЗДЕЛ 15.НОРМАТИВНАЯ ИНФОРМАЦИЯ
SARA 302 Components
Никакие химические вещества в этом материале не подпадают под требования к отчетности SARA Title III, раздел 302.
SARA 313 Components
Этот материал не содержит никаких химических компонентов с известными номерами CAS, превышающими пороговое значение (De
Minimis) уровни отчетности, установленные Разделом 313 SARA, раздел 313.
SARA 311/312 Опасности
Острая опасность для здоровья
Массачусетс Право знать Компоненты
Никакие компоненты не подпадают под действие Закона Массачусетса о праве на информацию.
Пенсильвания Право на информацию Компоненты
Бензоат натрия
Номер CAS.
532-32-1
Дата редакции
Нью-Джерси Право на информацию Компоненты
Бензоат натрия
Номер CAS.
532-32-1
Дата редакции
California Prop.65 Компоненты
Этот продукт не содержит химических веществ, которые, как известно в штате Калифорния, вызывают рак, врожденные дефекты или любой другой вред репродуктивной системе.
РАЗДЕЛ 16. ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) №1907/2006 (REACH). Вышеприведенная информация считается правильной, но не претендует на исчерпывающий характер и должна использоваться только в качестве руководства. Информация в этом документе основана на текущем уровне наших знаний и применима к продукту с учетом соответствующих мер безопасности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. На обратной стороне счета или упаковочного листа.АВТОРСКИЕ ПРАВА 1997-2021 AMERICAN ELEMENTS. ЛИЦЕНЗИОННЫМ ДАННЫМ РАЗРЕШЕНО ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННЫХ КОПИЙ БУМАГИ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Бензоат натрия | Encyclopedia.com
Химические и физические свойства
Производство
Безопасность
Использует
Ресурсы
Бензоат натрия, иногда также называемый бензоатом соды, представляет собой натриевую соль бензойной кислоты. Это ароматическое соединение, обозначаемое химической формулой C 7 H 5 NaO 2 с молекулярной массой 144.11. Бензоат натрия можно получить путем химического соединения гидроксида натрия с бензойной кислотой. В очищенной форме бензоат натрия представляет собой белое соединение без запаха, которое имеет сладкий, вяжущий вкус и растворим в воде. Бензоат натрия обладает антимикробными свойствами и обычно используется в качестве консерванта в пищевых продуктах.
Бензоат натрия имеет плотность 1,44 г / см 3 . Он плавится при температуре выше 570 ° F (300 ° C) и не имеет температуры кипения. Бензоат натрия поставляется в виде белого порошка или хлопьев.Во время использования он смешивается в сухом виде с жидкостями наливом, где быстро растворяется. Примерно 1,75 унции (50 г) легко растворяется в 3 жидких унциях (100 мл) воды. Напротив, бензойная кислота имеет значительно более низкий профиль растворимости в воде. При помещении в воду бензоат натрия диссоциирует с образованием ионов натрия и ионов бензойной кислоты. Бензойная кислота — это слабая органическая кислота, содержащая карбоксильную группу, и естественным образом встречается в некоторых продуктах питания, включая клюкву, чернослив, корицу и гвоздику. Он также образуется у большинства позвоночных в процессе обмена веществ.
Бензоат натрия является антимикробным активным средством против большинства дрожжевых и бактериальных штаммов. Он работает, диссоциируя в системе и производя бензойную кислоту. Бензойная кислота очень токсична для микробов, однако менее эффективна против плесени. В целом, это более эффективно, поскольку pH системы снижается с оптимальным функциональным диапазоном от 2,5 до 4,0. Противомикробный эффект усиливается также за счет хлорида натрия.
Есть три метода коммерческого получения бензоата натрия.В одном методе нафталин окисляют пентоксидом ванадия с образованием фталевого ангидрида. Его декарбоксилируют с получением бензойной кислоты. Во втором методе толуол смешивают с азотной кислотой и окисляют с образованием бензойной кислоты. В третьем методе бензотрихлорид гидролизуют, а затем обрабатывают минеральной кислотой с получением бензойной кислоты. Бензотрихлорид образуется при реакции хлора и толуола. Во всех случаях бензойная кислота подвергается дальнейшей очистке с получением бензоата натрия. Один из способов сделать это — растворить кислоту в растворе гидроксида натрия.В результате химической реакции образуется бензоат натрия и вода. Кристаллы выделяют путем выпаривания воды.
Некоторые тесты на токсичность показали, что бензоат натрия ядовит при определенных концентрациях. Однако
КЛЮЧЕВЫЕ ТЕРМИНЫ
Кислота — вещество, которое выделяет ионы водорода при помещении в водный раствор.
Противомикробный — материал, подавляющий рост микроорганизмов, вызывающих порчу пищи.
Окисление —Процесс, при котором соединение теряет электроны.
Консервант —Соединение, добавляемое в пищевые продукты, чтобы они не портились.
Растворимость — Количество вещества, которое растворяется в растворе при данной температуре.
Исследование, проведенное Министерством сельского хозяйства США (USDA), показало, что бензоат натрия в малых дозах и в смеси с пищей не опасен для здоровья. Аналогичные выводы были сделаны в отношении больших доз, принимаемых с пищей, хотя были отмечены определенные физиологические изменения.Основываясь на этом исследовании и данных о безопасности за последующие годы, правительство США определило, что бензоат натрия общепризнан как безопасный (GRAS). Допускается использование в пищевых продуктах на всех уровнях ниже 0,1%. Другие страны допускают более высокие уровни до 1,25%.
Также были проведены исследования по изучению накопления бензоата натрия в организме. Это привело к открытию естественного метаболического процесса, который сочетает бензоат натрия с глицином с образованием гиппуровой кислоты, вещества, которое затем выводится из организма.Этот механизм выведения составляет почти 95% всего потребляемого бензоата натрия. Считается, что оставшаяся часть детоксифицируется путем конъюгации с гликуроновой кислотой.
Бензоат натрия используется в большом количестве продуктов из-за его антимикробных и вкусовых характеристик. Это наиболее широко используемый в мире консервант для пищевых продуктов, включаемый как в продукты питания, так и в безалкогольные напитки. Он используется в маргарине, сальсе, кленовых сиропах, соленьях, джемах и желе. Почти каждый диетический безалкогольный напиток содержит бензоат натрия, также как и некоторые охладители вина и фруктовые соки.Он также используется в продуктах личной гигиены, таких как зубная паста, средства для чистки зубов и жидкости для полоскания рта. Преимущество бензоата натрия в качестве консерванта — низкая стоимость. Недостатком является его вяжущий вкус, которого можно избежать, используя более низкие уровни с другим консервантом, таким как сорбат калия.
Помимо использования в продуктах питания, он используется в качестве промежуточного продукта при производстве красителей. Это антисептическое средство и ингибитор ржавчины и плесени. Он также используется в табаке и фармацевтических препаратах.В форме свободной кислоты он используется как фунгицид. Бензоат натрия относительно недавно стал использоваться в качестве ингибитора коррозии в системах охлаждающей жидкости двигателя. Бензоат натрия недавно был включен в пластмассы, такие как полипропилен, где, как было обнаружено, он улучшает прозрачность и прочность.
КНИГИ
Бранен, Ларри и др. Пищевые добавки. Нью-Йорк: Марсель Деккер, 2002.
The Merck Index. Станция Уайтхаус, Нью-Джерси: Мерк, 2001.
Фрэнсис, Фредерик Джон. Энциклопедия пищевых наук и технологий Wiley. Нью-Йорк: Wiley, 2000.
Смит, Джим и Лили Хонг-Шум, ред. Справочник по пищевым добавкам . Оксфорд, Великобритания: Blackwell Science, 2003.
Дэвидсон, Майкл, Джон Н. Софос и А.Л. Бранен. Противомикробные препараты в продуктах питания. Бока-Ратон, Флорида: Тейлор и Фрэнсис, 2005.
ДРУГОЕ
Ассоциация пищевых продуктов. «Образовательные программы».
Институт пищевых технологов (IFT. «Домашняя страница IFT.»
Национальная ассоциация переработчиков пищевых продуктов. «Наука. Безопасность»). . Public Policy. »2003.
Perry T. Romanowski
Что такое бензоат натрия? | Sciencing
Бензоат натрия — это продукт питания консервант, который естественным образом содержится в некоторых фруктах. Химическое вещество представляет собой натриевую соль бензойной кислоты и считается безопасным для проглатывания и нанесения на кожу.Его не следует использовать в некоторых кислых продуктах, потому что он может образовывать вредные соединения, но он не токсичен и не раздражает ткани. Он легко растворяется в воде, и его основное применение — подавление роста плесени и бактерий в продуктах питания и косметике.
TL; DR (слишком долго; не читал)
Бензоат натрия — это натриевая соль, NaC 7 H 5 O 2 , бензойной кислоты, C 7 H 6 O 2 . Он образуется, когда безойная кислота реагирует с гидроксидом натрия, NaOH, и ион натрия заменяет один из ионов водорода в кислоте с образованием бензоата натрия и воды.Это химическое вещество естественным образом содержится во фруктах, таких как сливы и клюква, и используется в качестве консерванта в продуктах питания и косметике, поскольку подавляет рост плесени и бактерий.
В некоторых кислых пищевых продуктах бензоат натрия может реагировать с аскорбиновой или лимонной кислотой с образованием бензола, потенциально канцерогенного соединения. Хотя его иногда путают с бурой или боратом натрия, который представляет собой соль борной кислоты, эти два химических вещества совершенно разные.
Химический состав бензоата натрия
Бензоат натрия — это натриевая соль, получаемая при реакции бензойной кислоты с гидроксидом натрия.Это кислотно-основная реакция, в результате которой образуется соль, которая представляет собой бензоат натрия, и воду. Химическая формула:
C 7 H 6 O 2 + NaOH = NaC 7 H 5 O 2 + H 2 O
В воде соединение растворяется и разлагается. в ион натрия и ион бензойной кислоты. В твердом виде это белый, гранулированный или кристаллический порошок, который можно добавлять в пищу или косметику.
Другими соединениями натрия с аналогичными названиями являются борат или бура натрия и карбонат или сода натрия.Иногда их путают с бензоатом натрия, но это совершенно разные химические вещества. Бура представляет собой соль борной кислоты и содержит бор, в то время как сода, в отличие от пищевой соды или бикарбоната натрия, представляет собой соль угольной кислоты. Ни один из них обычно не используется в качестве пищевой добавки, потому что он не так безопасен, как бензоат натрия.
Где находится бензоат натрия?
Бензоат натрия предотвращает рост плесени и бактерий в продуктах питания и косметике. Он содержится во многих морсах, в заправках для салатов и маслах, а также в джемах.Производители косметики используют его в кремах для кожи и другой косметике, чтобы они оставались свежими. Он естественным образом содержится во фруктах, таких как сливы и клюква, и в специях, таких как корица. Это химическое вещество широко распространено, потому что оно недорогое и потому, что эффективны небольшие концентрации, обычно 0,05–0,1 процента.
В растворе ион бензойной кислоты является активным ингредиентом и действует непосредственно на микроорганизмы, ограничивая их активность. При использовании в определенных пищевых продуктах, таких как кислые цитрусовые напитки, бензоат натрия может реагировать с другими кислотами, такими как лимонная или аскорбиновая кислоты, с образованием бензола, потенциально канцерогенного соединения.Поскольку уровень бензоата натрия в большинстве пищевых продуктов настолько низок, соответствующая концентрация бензола также будет ниже опасного уровня. В общем, бензоат натрия — это безопасная, распространенная, недорогая и эффективная пищевая добавка с возможно некоторыми ограничениями из-за высокого потребления определенных кислых продуктов.
Справочник по химическому бензоату натрия
Благодаря консервирующим и противогрибковым свойствам бензоат натрия часто используется в обычных и даже некоторых экологически чистых полиролях для мебели, средствах для чистки унитазов, гелях для мытья посуды, средствах для чистки ковров, средствах для чистки обивки и средствах для чистки посудомоечных машин.
Что такое бензоат натрия?
Бензоат натрия — это натриевая соль бензойной кислоты, которая часто используется в качестве консерванта в косметике, детских салфетках и зубной пасте. Он также используется для предотвращения коррозии охлаждающих жидкостей автомобильных двигателей.
Другие имена
Как указано в базе данных ChemIDPlusAdvanced Медицинской библиотеки США, некоторыми синонимами бензоата натрия являются бензойная кислота, натриевая соль, антимол, бензоат натрия, бензоат соды, бензоат натрия, бензоат натрия (на-сальц), натриум бензоикум и собенат.
Номер CAS: 532-32-1
Химическая формула: C 7 H 5 NaO 2
Другое применение
Бензоат натрия также можно найти во множестве других отраслей:
- Уход за автомобилем: антифриз
- Декоративно-прикладное искусство: красители жидкое мыло
- Продукты питания: газированные напитки, другие газированные напитки, фруктовые соки, заправки для салатов, приправы и т. Д.
- Прачечная: крахмалов
- Медицина : IV (e.g., когда кофеин вводится в соответствии с требованиями Института безопасной медицинской практики) и лекарствами (например, жидкими сиропами от кашля, жидким парацетамолом, амоксициллин и лечебными кремами)
- Личная гигиена: волос (например, шампуни, красители, кондиционеры и лаки для волос), зубов (например, жидкости для полоскания рта и зубная паста), кожи (например, средства для мытья тела и лица, солнцезащитные кремы и дезодоранты) и товары для ухода за детьми (например, , детские влажные салфетки)
- Уход за домашними животными: стоматологические товары
Бренды продуктов, содержащие бензоат натрия
Чтобы узнать, содержат ли определенные продукты, которые вы используете, бензоат натрия, попробуйте выполнить поиск в этих базах данных, используя химическое название, номер CAS или один из его синонимов (указано в разделе выше):
- Руководство экологической рабочей группы (EWG) по здоровой очистке
- База данных косметических средств EWG’s Skin Deep Cosmetic
- База данных этикеток пищевых добавок Национального института здравоохранения
- U.Ежедневный Med Национальной медицинской библиотеки S.
- Банк данных по опасным веществам Национальной медицинской библиотеки США
- База данных по товарам для дома Министерства здравоохранения и социальных служб США
Когда химическое вещество используется в фармацевтических препаратах, товарах личной гигиены или в качестве пищевой добавки, оно контролируется Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). Для очистки и промышленного использования он контролируется Агентством по охране окружающей среды США (EPA).
Здоровье и безопасность
Бензоат натрия считается FDA в целом безопасной пищевой добавкой (GRAS). Тем не менее, это было связано с расстройством гиперактивности, как отмечено в статье сотрудников клиники Мэйо: «Диета с СДВГ: вызывают ли пищевые добавки гиперактивность?» Кроме того, когда бензоат сочетается с аскорбиновой кислотой в газированных безалкогольных напитках, бензоат натрия образует мощный канцерогенный бензол. При рассмотрении этой проблемы FDA в 2007 году было обнаружено, что многие уровни бензола ниже допустимых пределов, но в некоторых случаях это не так, и в этом случае производители напитков были обязаны изменить рецептуру своих продуктов.Бензоат натрия также может быть проблемой при использовании в медицинских целях для младенцев с низкой массой тела при рождении, как указано в статье Фармакопейной конвенции США 1992 года, цитируемой в Базе данных по опасным веществам (HSDB).
Что касается его использования в качестве пестицида, включая бытовые чистящие средства, бензоат натрия считается EPA пестицидом минимального риска, поскольку он «очевидно безопасен для предполагаемого использования». Тем не менее Scorecard, справочник по загрязнению окружающей среды, который является частью Good Guide, отмечает, что бензоат натрия может быть подозреваемым в сердечно-сосудистых, кровеносных, желудочно-кишечных, печеночных, почечных, нейротоксических, а также кожных или чувствительных органах, но эти токсикологические данные отсутствуют.
Предупреждение
Согласно Международной карте химической безопасности Национального института охраны труда и здоровья по бензоату натрия, вдыхание бензоата натрия может вызвать респираторные симптомы, такие как кашель. Попадание в глаза может вызвать покраснение, а контакт с кожей может вызвать обратимую сыпь. Кроме того, прием внутрь бензоата натрия может вызвать тошноту, рвоту и боль в животе. Из-за этих опасений используйте превентивные меры, такие как защита кожи и глаз и избегание вдыхания пыли.
Воздействие на окружающую среду
Бензоат натрия, как ожидается, не будет сохраняться или накапливаться в окружающей среде, и, согласно EPA, он считается «пестицидом минимального риска». Так что это можно было считать довольно экологичным.
Банкноты
Согласно Scorecard, только в Соединенных Штатах ежегодно производится более миллиона фунтов бензоата натрия.
Альтернативы
Бензоат натрия — широко используемое химическое вещество, которого трудно избежать, но — это продуктов, которые не содержат этот синтетический консервант.Вместо этого они используют натуральные консерванты, извлеченные из растений, таких как розмарин, тимьян и камелия китайская (растение, из которого делают зеленый чай). Консерванты, извлеченные из других природных источников, таких как микроорганизмы и животные, являются еще одной возможностью, как отмечает Food Safety Watch. Итак, если вы хотите исключить воздействие этого химического вещества, созданного руками человека, определенно существуют более экологичные альтернативы.
Бензоат натрия — Sciencemadness Wiki
Бензоат натрия — это органическое химическое соединение, используемое в качестве пищевого консерванта.
Недвижимость
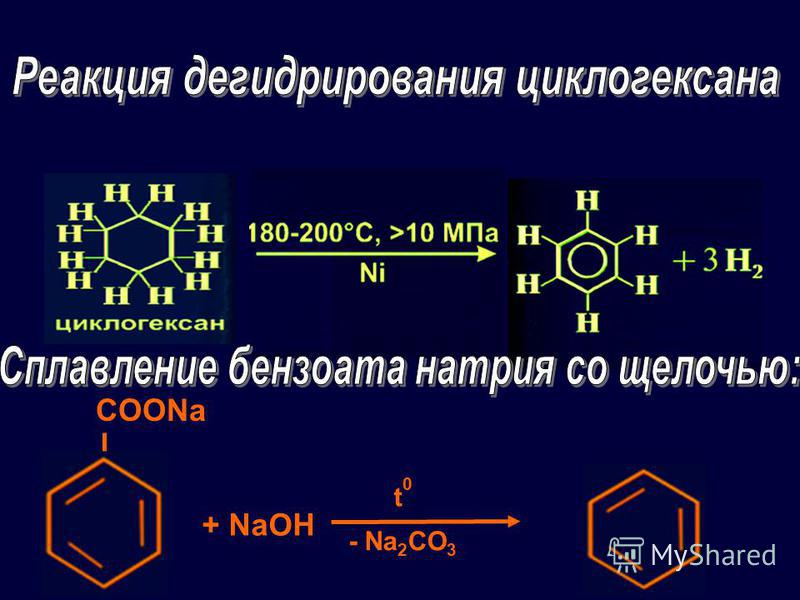
Химическая промышленность
Бензоат натрия реагирует с гидроксидом натрия с образованием бензола:
- C 6 H 5 COONa + NaOH → C 6 H 6 + Na 2 CO 3
В качестве побочных продуктов будут также производиться небольшие количества бифенила и бензофенона.
Аскорбиновая кислота также восстанавливает соль до бензола при определенных условиях.
Физический
Бензоат натрия — белое гигроскопичное соединение с характерным запахом.Его растворимость в воде при стандартных условиях составляет 62,7 г / 100 мл. Бензоат натрия также растворим в жидком аммиаке и пиридине. Он плохо растворяется в большинстве спиртов, таких как метанол и этанол.
Наличие
Бензоат натрия доступен в качестве пищевого консерванта и продается в запечатанных пакетах.
Препарат
Бензоат натрия можно получить реакцией бензойной кислоты и гидроксида, бикарбоната или карбоната натрия.
Проектов
- Синтез бензола
- Получите бензойную кислоту
- Получение сложных эфиров бензойной кислоты
- Свисток микс
- Пищевой консервант
Обращение
Безопасность
Бензоат натрия имеет низкую токсичность для человека, и недавние исследования показали, что он обладает некоторыми полезными эффектами в предотвращении болезней Альцгеймера и Паркинсона, хотя результаты пока не являются окончательными.Однако кошки имеют значительно более низкую толерантность к бензойной кислоте и ее солям, чем крысы и мыши.
При употреблении с аскорбиновой кислотой может образовываться бензол, который является канцерогеном. Это явление наблюдается в напитках, содержащих бензоат натрия в качестве консерванта. Однако полученные уровни бензола чрезвычайно малы, и исследования показали, что концентрация бензола значительно ниже безопасного предела.
Хранилище
Бензоат натрия следует хранить в закрытых флаконах, так как он немного гигроскопичен, но достаточно хранить его в сухой камере.
Выбытие
Бензоат натрия малотоксичен и не требует специальной утилизации. Откажитесь от него, как хотите.
Список литературы
Соответствующие темы Sciencemadness
Пиридин— Sciencemadness Wiki
Образец пиридина и флакон. | |
| Имена | |
|---|---|
| Название ИЮПАК Пиридин | |
| Другие названия Азабензол | |
| Идентификаторы | |
| Jmol-3D изображения | Изображение |
| Недвижимость | |
| C 5 H 5 N | |
| Молярная масса | 79.10 г / моль |
| Внешний вид | Бесцветная жидкость |
| Запах | Тошнота, тухлая рыба |
| Плотность | 0,9819 г / мл (при 20 ° С) |
| Температура плавления | -41,6 ° С (-42,9 ° F, 231,6 К) |
| Температура кипения | 115,2 ° С (239,4 ° F, 388,3 К) |
| смешиваемый | |
| Растворимость | Смешивается с этанолом, диэтиловым эфиром, этилацетатом, ДМСО, изопропанолом, метанолом, петролейным эфиром. |
| Давление пара | 16 мм рт. Ст. (20 ° C) |
| Кислотность (p K a ) | 5.25 (для конъюгированной кислоты) |
| Вязкость | 0,88 сП |
| Опасности | |
| Паспорт безопасности | ScienceLab |
| Температура вспышки | 21 ° С |
| Смертельная доза или концентрация ( LD , LC ): | |
| 891 мг / кг (крыса, перорально) 1500 мг / кг (мышь, перорально) 1580 мг / кг (крыса, перорально) | |
| 9000 частей на миллион (крыса, 1 час) | |
| Родственные соединения | |
Родственные соединения | Анилин Пиперидин |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобокс | |
Пиридин , также известный как азин , представляет собой органическое соединение, состоящее из бензольного кольца с одной = CH- группой, замещенной атомом азота, что дает химическую формулу C 5 H 5 № .
Недвижимость
Химическая промышленность
Пиридин является слабоосновным из-за неподеленной пары на его атоме азота и образует стабильную гидрохлоридную соль при взаимодействии с соляной кислотой.Он легко образует многие координационные комплексы с ионами переходных металлов, как и его производные, 2,2′-бипиридин и терпиридин. Эти лиганды могут быть заменены более сильными основаниями Льюиса, что делает эти комплексы полезными предшественниками.
Пиридин является полезным основанием Льюиса в органической химии. Это предшественник пиперидина, еще одного органического строительного блока, который можно получить путем гидрирования в присутствии катализатора. Кроме того, пиридин может действовать как полярный растворитель, в котором могут происходить реакции.Хлорхромат пиридиния, полученный из пиридина, хромовой и соляной кислот, можно использовать для окисления первичных спиртов до альдегидов и вторичных спиртов до кетонов.
Физический
Пиридин представляет собой прозрачную жидкость комнатной температуры с неприятным «рыбным» запахом, который некоторые называют «тухлой рыбой». Пиридин исторически добавлялся к этанолу для его денатурирования из-за его очень горького вкуса. Смешивается с водой и полярными растворителями. Он также легко воспламеняется, его температура вспышки составляет всего 17 ° C, но температура самовоспламенения далеко выходит за пределы обычно встречающихся значений.
Приобретение
Пиридинможно купить, хотя и недешево, у нескольких онлайн-поставщиков химии почти в чистом виде.
Препарат
Пиридин может быть получен одним способом, полезным для домашнего химика, путем каталитического декарбоокслирования ниацина (никтотиновой кислоты) при температуре кипения пиридина (115,2 ° C) с использованием хромита меди, при котором пары пиридина отгоняются и могут конденсироваться. Используемый хромит меди легко получить из хромата меди-аммония (полученного из сульфата меди и дихромата аммония) путем сильного нагревания, вызывающего разложение.Такой же синтез можно осуществить при температурах выше 300 ° C, используя вместо этого оксид кальция. Он также создается катализированной парофазной реакцией между аммиаком, формальдегидом и ацетальдегидом.
Пиридин также может быть получен перегонкой из каменноугольной смолы или, исторически, костного масла, продукта деструктивной перегонки костей, который при надлежащем разделении содержит несколько полезных реагентов. Однако вам понадобится большое количество масла и, как следствие, много костей.Для очистки соединения требуется фракционная перегонка.
Проектов
- Синтез пиперидина
- Общий растворитель
Обращение
Безопасность
Пиридин токсичен и, возможно, канцерогенен, вызывая множество проблем со здоровьем при высоком воздействии. Поскольку его легко обнаружить по сильному неприятному запаху и маловероятно, что он будет употреблен из-за его очень горького вкуса, вероятность серьезного или летального воздействия невелика. Пиридин также очень легко воспламеняется, его температура воспламенения составляет всего 17 градусов.Таким образом, любые реакции или использование пиридина следует проводить вдали от источников возгорания и с использованием надлежащего пожарного оборудования.
Часто говорят, что пиридин может вызвать мгновенное мужское бесплодие при приеме внутрь, но эти утверждения трудно обосновать.
Хранилище
Пиридин следует хранить в закрытых флаконах вдали от реагентов, в специальном шкафу для хранения химикатов.
Выбытие
При сжигании пиридина образуется много окиси углерода, сажи, летучих органических соединений и несгоревшего пиридина.Образующийся дым будет иметь гнилостный запах, поэтому, если вы хотите это сделать, никогда не делайте этого внутри, а если вы делаете это снаружи, избегайте населенных пунктов! Разбавление более легковоспламеняющимся растворителем и сжигание таким образом уменьшит запах дыма, хотя для этого лучше использовать печь для сжигания отходов.
Пиридин можно разрушить, добавляя его по каплям в свежий раствор реактива Фентона. Поскольку в результате окисления небольшое количество пиридина образуется в виде аэрозоля, это лучше проводить на открытом воздухе.Так как пиридин имеет сильный и неприятный запах, не делайте этого в помещении!
Добавление воды или кислоты к пиридину приведет к образованию большого количества белого тумана, который состоит из очень мелкой соли пиридина в результате реакции паров пиридина и кислоты. Он будет прилипать к предметам, одежде, мебели и выделяет пиридин при контакте с более прочным основанием.
Список литературы
Соответствующие темы Sciencemadness
ICSC 1536 — БЕНЗОАТ НАТРИЯ
ICSC 1536 — БЕНЗОАТ НАТРИЯ| БЕНЗОАТ НАТРИЯ | ICSC: 1536 |
| Бензойная кислота, натриевая соль | Октябрь 2004 г. |
| Номер CAS: 532-32-1 | |
| Номер ЕС: 208-534-8 |
| ОСТРАЯ ОПАСНОСТЬ | ПРОФИЛАКТИКА | ПОЖАРНАЯ СИСТЕМА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Горючее при определенных условиях.При пожаре выделяет раздражающие или токсичные пары (или газы). Мелкодисперсные частицы образуют в воздухе взрывоопасные смеси. | НЕТ открытого огня. Замкнутая система, пылевзрывобезопасное электрооборудование и освещение. Предотвратить осаждение пыли. | Используйте водяную пыль, порошок, пену, двуокись углерода. |
| СИМПТОМЫ | ПРОФИЛАКТИКА | ПЕРВАЯ ПОМОЩЬ | |
|---|---|---|---|
| Вдыхание | Кашель. | Избегать вдыхания пыли. | Свежий воздух, отдых. |
| Кожа | Сыпь. | Защитные перчатки. Защитная одежда. | Промыть кожу большим количеством воды или принять душ. |
| Глаза | Покраснение. | Надевайте защитные очки. | Сначала промойте большим количеством воды в течение нескольких минут (снимите контактные линзы, если это легко возможно), затем обратитесь за медицинской помощью. |
| Проглатывание | Тошнота. Рвота. Боль в животе. | Не ешьте, не пейте и не курите во время работы. | НЕ вызывать рвоту. Дайте выпить один-два стакана воды. Обратитесь за медицинской помощью. |
| УТИЛИЗАЦИЯ РАЗЛИВОВ | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| Индивидуальная защита: респиратор с фильтром твердых частиц, адаптированный к концентрации вещества в воздухе.Смести просыпанное вещество в закрытые контейнеры. | Согласно критериям СГС ООН Транспорт |
| ХРАНЕНИЕ | |
| УПАКОВКА | |
Подготовлено международной группой экспертов от имени МОТ и ВОЗ,
при финансовой поддержке Европейской комиссии. |
| БЕНЗОАТ НАТРИЯ | ICSC: 1536 |
| ФИЗИЧЕСКАЯ И ХИМИЧЕСКАЯ ИНФОРМАЦИЯ | |
|---|---|
Физическое состояние; Внешний вид Физическая опасность Химическая опасность | Формула: C 7 H 5 NaO 2 / C 6 H 5 COONa |

 Химические стерилизующие добавки для остановки созревания вин, дезинфектанты.
Химические стерилизующие добавки для остановки созревания вин, дезинфектанты.
 11
11