Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
Структурная формула всех изомеров С7Н16
учитывая значения электроотрицательности элементов составьте химические формулы и укажите сдвиг общих связывающих электронных пар в соединениях:а)кальция с водородом;б)Лития с азотом;в)углерода с алюм
Решено
Составьте формулы средних и кислых.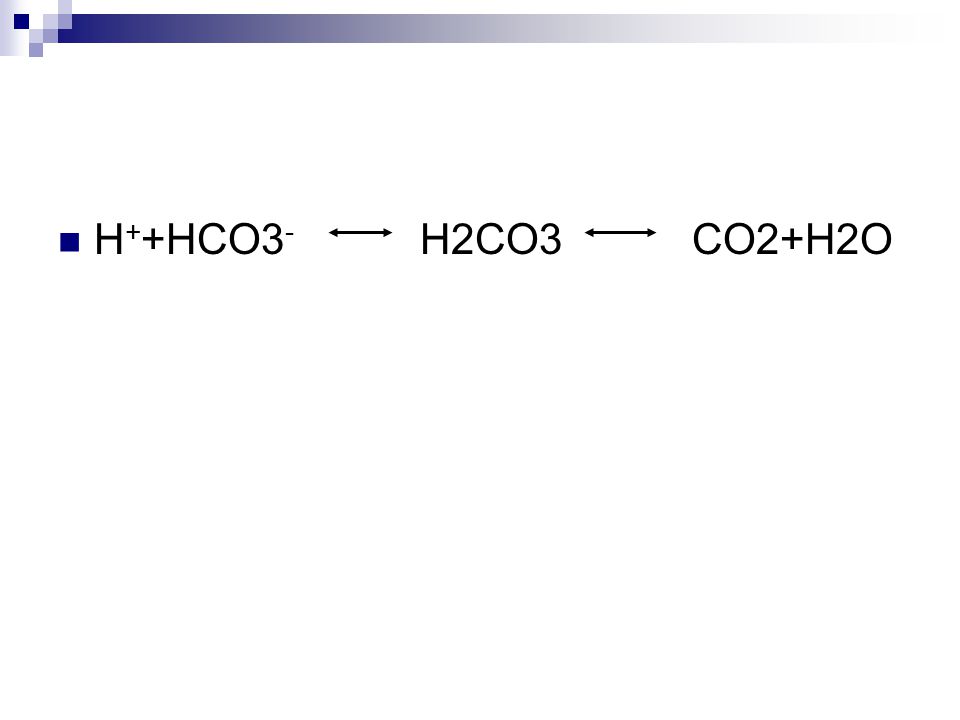 ..
..
sio2-si-sio2-na2sio3-h3sio3-sio2
Пользуйтесь нашим приложением
Угольная кислота h3CO3 презентация, доклад
ThePresentationru
- Регистрация |
- Вход
- Загрузить
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Страхование
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация на тему Презентация на тему Угольная кислота h3CO3, предмет презентации: Химия. Этот материал содержит 5 слайдов. Красочные слайды и илюстрации помогут Вам заинтересовать свою аудиторию. Для просмотра воспользуйтесь проигрывателем, если материал оказался полезным для Вас — поделитесь им с друзьями с помощью социальных кнопок и добавьте наш сайт презентаций ThePresentation.ru в закладки!
Этот материал содержит 5 слайдов. Красочные слайды и илюстрации помогут Вам заинтересовать свою аудиторию. Для просмотра воспользуйтесь проигрывателем, если материал оказался полезным для Вас — поделитесь им с друзьями с помощью социальных кнопок и добавьте наш сайт презентаций ThePresentation.ru в закладки!
УГОЛЬНАЯ КИСЛОТА
h3CO3
ХИМИЧЕСКИЕ СВОЙСТВА
Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие смещается в сторону разложения угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью
Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли
ПОЛУЧЕНИЕ
Угольная кислота образуется при растворении в воде диоксида углерода. Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа. Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода.
Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа. Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода.
ПРИМЕНЕНИЕ
Угольная кислота всегда присутствует в водных растворах углекислого газа. В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора.
СПАСИБО ЗА ВНИМАНИЕ!
Поляков Максим
9П-11
Скачать презентацию
Обратная связь
Если не удалось найти и скачать презентацию, Вы можете заказать его на нашем сайте.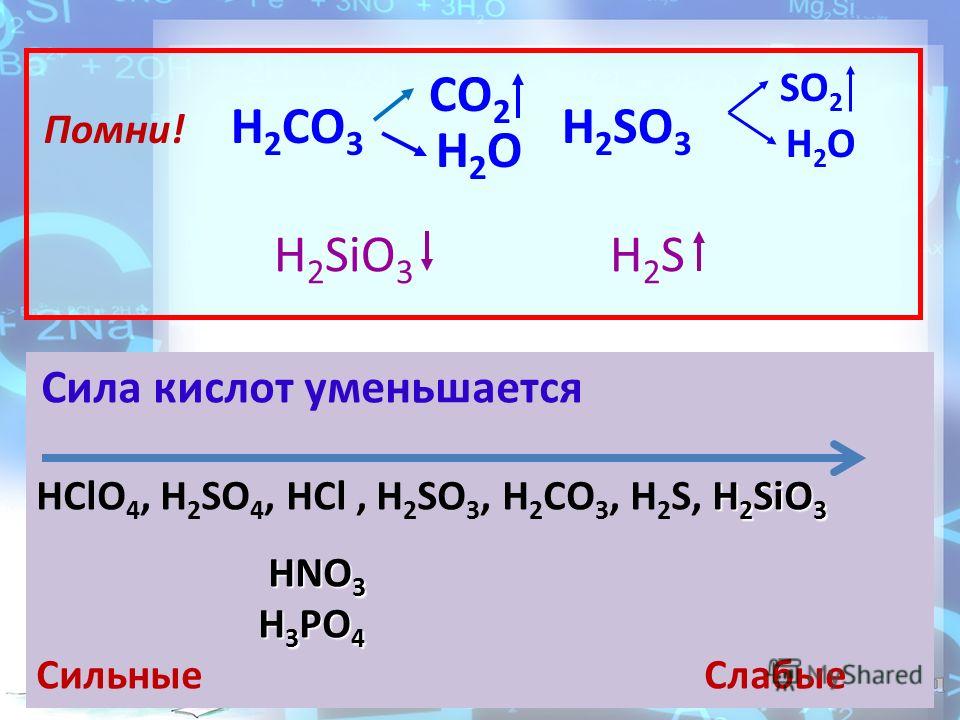 Мы постараемся найти нужный Вам материал и отправим по электронной почте. Не стесняйтесь обращаться к нам, если у вас возникли вопросы или пожелания:
Мы постараемся найти нужный Вам материал и отправим по электронной почте. Не стесняйтесь обращаться к нам, если у вас возникли вопросы или пожелания:
Email: Нажмите что бы посмотреть
Что такое ThePresentation.ru?
Это сайт презентаций, докладов, проектов, шаблонов в формате PowerPoint. Мы помогаем школьникам, студентам, учителям, преподавателям хранить и обмениваться учебными материалами с другими пользователями.
Для правообладателей
Угольная кислота (h3CO3): свойства, применение и значение
He угольная кислота , ранее называвшаяся воздушной кислотой или воздушной кислотой, является единственной неорганической кислотой углерода и имеет формулу h3CO3.
Соли угольных кислот называются бикарбонатами (или гидрокарбонатами) и карбонатами (База данных метаболизма человека, 2017). Его структура представлена на рисунке 1 (EMBL-EBI, 2016).
Рисунок 1: Структура угольной кислоты.
Говорят, что угольная кислота образуется из углекислого газа и воды. Угольная кислота встречается только через соли (карбонаты), кислые соли (гидрокарбонаты), амины (карбаминовая кислота) и хлорангидриды (карбонилхлорид) (MeSH, 1991).
Угольная кислота встречается только через соли (карбонаты), кислые соли (гидрокарбонаты), амины (карбаминовая кислота) и хлорангидриды (карбонилхлорид) (MeSH, 1991).
Соединение не может быть выделено в виде чистой или твердой жидкости, так как продукты его разложения, углекислый газ и вода, намного стабильнее кислоты (Royal Society of Chemistry, 2015).
Углекислый газ содержится в организме человека, CO2, присутствующий в крови, соединяется с водой с образованием угольной кислоты, которая затем выдыхается в виде газа через легкие.
Он также встречается в скалах и пещерах, где известняки могут растворяться. h3CO3 также можно найти в угле, метеоритах, вулканах, кислотных дождях, грунтовых водах, океанах и растениях (формула угольной кислоты, S.F.).
Угольная кислота образуется в небольших количествах при растворении ее ангидрида, двуокиси углерода (CO2), в воде.
CO2 + h3O ⇌ h3CO3
Преобладающими видами являются просто гидратированные молекулы CO2. Угольную кислоту можно рассматривать как двухосновную кислоту, из которой могут быть образованы два ряда солей, а именно гидрокарбонаты или бикарбонаты, содержащие HCO 3 — и CO 2 -содержащие карбонаты.
Угольную кислоту можно рассматривать как двухосновную кислоту, из которой могут быть образованы два ряда солей, а именно гидрокарбонаты или бикарбонаты, содержащие HCO 3 — и CO 2 -содержащие карбонаты.
h3CO3 + h3O ⇌ h4O + + HCO3-
HCO3- + h3O ⇌ h4O + + CO32-
Однако кислотно-основное поведение угольной кислоты зависит от различных скоростей некоторых участвующих реакций, а также от ее зависимость от рН системы. Например, при pH ниже 8 основные реакции и их относительная скорость следующие:
- CO2 + h3O ⇌ h3CO3 (медленно)
- h3CO3 + OH- ⇌ HCO3- + h3O (быстро)
Выше pH 10 важны следующие реакции:
- CO2 + OH- ⇌ HCO3- (медленно)
- HCO3- + OH- ⇌ CO32- + h3O (быстро)
При значениях pH 8 и 10 все предыдущие равновесные реакции значимы (Zumdahl, 2008).
«Гипотетическая» кислота из углекислого газа и воды До относительно недавнего времени ученые были убеждены, что угольная кислота не существует в виде стабильной молекулы.
В журнале Angewandte Chemie немецкие исследователи представили простой пиролитический метод производства угольной кислоты в газовой фазе, который позволил провести спектроскопическую характеристику угольной кислоты в газовой фазе и ее монометилового эфира (Angewandte Chemie International Edition, 2014 г.) .
Угольная кислота существует лишь небольшую долю секунды, когда углекислый газ растворяется в воде, прежде чем превратиться в смесь протонов и анионов бикарбоната.
Однако, несмотря на короткий срок службы, углекислота оказывает продолжительное воздействие на атмосферу и геологию Земли, а также на организм человека.
Из-за короткого срока годности подробный химический состав угольной кислоты был покрыт тайной. Такие исследователи, как Berkeley Lab. И Калифорнийский университет (UC) в Беркли помогает приподнять эту завесу с помощью серии уникальных экспериментов.
В своем последнем исследовании они продемонстрировали, как молекулы газообразного диоксида углерода сольватируются водой, чтобы инициировать химию переноса протона, которая производит угольную кислоту и бикарбонат (Yarris, 2015).
В 1991 году ученым Центра космических полетов имени Годдарда НАСА (США) удалось получить твердые образцы h3CO3. Они сделали это, подвергнув замороженную смесь воды и углекислого газа высокоэнергетическому протонному излучению, а затем нагрев ее для удаления лишней воды.
Оставшаяся угольная кислота была охарактеризована с помощью инфракрасной спектроскопии. Тот факт, что угольная кислота была получена путем облучения твердой смеси Н3О + СО2 или даже путем облучения только сухим льдом.
Это привело к предположению, что h3CO3 можно найти в открытом космосе или на Марсе, где обнаружены льды h3O и CO2, а также космические лучи (Khanna, 1991).
Физические и химические свойстваУгольная кислота существует только в водном растворе. Чистое соединение выделить не удалось. Упомянутый раствор легко узнать, поскольку он демонстрирует вскипание газообразного диоксида углерода, выходящего из водной среды.
Имеет молекулярную массу 62,024 г/моль и плотность 1,668 г/мл. Угольная кислота — слабая и нестойкая кислота, частично диссоциирующая в воде на ионы водорода (H+) и бикарбонат-ионы (HCO3-), рКа которых составляет 3,6.
Угольная кислота — слабая и нестойкая кислота, частично диссоциирующая в воде на ионы водорода (H+) и бикарбонат-ионы (HCO3-), рКа которых составляет 3,6.
Будучи двухосновной кислотой, она может образовывать два типа солей, карбонаты и бикарбонаты. Добавление основания к избытку угольной кислоты дает бикарбонатные соли, а добавление избытка основания к угольной кислоте дает карбонатные соли (Национальный центр биотехнологической информации, 2017).
Углекислота не считается токсичной или опасной и присутствует в организме человека. Однако воздействие высоких концентраций может вызвать раздражение глаз и дыхательных путей.
ПриложенияСогласно Мишель Макгуайр Науки о питании и Углекислота содержится в ферментированных пищевых продуктах в виде отходов, образующихся бактериями, которые питаются разлагающейся пищей.
Пузырьки газа, образующиеся в пищевых продуктах, как правило, представляют собой двуокись углерода угольной кислоты и являются признаком брожения пищевых продуктов. Примерами часто употребляемых ферментированных продуктов являются соевый соус, суп мисо, квашеная капуста, кимчи по-корейски, темпе, кефир и йогурт.
Примерами часто употребляемых ферментированных продуктов являются соевый соус, суп мисо, квашеная капуста, кимчи по-корейски, темпе, кефир и йогурт.
Ферментированные злаки и овощи также содержат полезные бактерии, которые могут контролировать потенциально патогенные микроорганизмы в кишечнике и улучшать выработку витаминов B-12 Y K .
Углекислота, раствор двуокиси углерода или дигидрокарбонат образуются в процессе карбонизации воды. Он отвечает за шипучий аспект безалкогольных напитков и газированных напитков, как указано в Словаре пищевых наук и технологий.
Угольная кислота способствует высокой кислотности газированных напитков, но в основном за эту кислотность ответственны содержание рафинированного сахара и фосфорной кислоты (DUBOIS, 2016).
Угольная кислота также используется во многих других областях, таких как фармацевтика, косметика, удобрения, пищевая промышленность, анестетики и т. д.
Значение Углекислота обычно содержится в воде океанов, морей, озер, рек и дождях, поскольку она образуется при контакте с водой двуокиси углерода, широко распространенной в атмосфере.
Он присутствует даже в ледниковом льду, хотя и в меньших количествах. Углекислота — очень слабая кислота, хотя со временем она может способствовать эрозии.
Увеличение содержания углекислого газа в атмосфере привело к образованию большего количества угольной кислоты в океанах и в некоторой степени является причиной небольшого повышения кислотности океанов за последние сто лет.
Углекислый газ, побочный продукт клеточного метаболизма, находится в относительно высокой концентрации в тканях. Он диффундирует в кровь и попадает в легкие для удаления с выдыхаемым воздухом.
Углекислый газ намного лучше растворим, чем кислород, и легко диффундирует в эритроциты. Он реагирует с водой с образованием угольной кислоты, которая при щелочном pH крови проявляется в основном в виде бикарбоната (Robert S. Schwartz, 2016).
Углекислый газ поступает в кровь и ткани, потому что его местное парциальное давление больше, чем его парциальное давление в крови, протекающей через ткани. Попадая в кровь, углекислый газ соединяется с водой с образованием угольной кислоты, которая диссоциирует на ионы водорода (H+) и ионы бикарбоната (HCO3-).
Попадая в кровь, углекислый газ соединяется с водой с образованием угольной кислоты, которая диссоциирует на ионы водорода (H+) и ионы бикарбоната (HCO3-).
Естественная конверсия диоксида углерода в угольную кислоту является относительно медленным процессом. Однако карбоангидраза, белковый фермент, присутствующий внутри эритроцитов, катализирует эту реакцию достаточно быстро, поэтому она достигается всего за доли секунды.
CO2 + h3O ⇌ h3CO3
Поскольку фермент присутствует только внутри эритроцитов, бикарбонат накапливается в эритроцитах в гораздо большей степени, чем в плазме.
Способность крови транспортировать двуокись углерода в виде бикарбоната усиливается системой переноса ионов в мембране эритроцитов, которая одновременно перемещает ион бикарбоната из клетки в плазму в обмен на ион хлорида.
Одновременный обмен этих двух ионов, известный как обмен хлоридов, позволяет использовать плазму в качестве хранилища бикарбонатов без изменения электрического заряда плазмы или эритроцитов.
Только 26 процентов общего содержания углекислого газа в крови находится в виде бикарбоната внутри эритроцитов, а 62 процента находится в виде бикарбоната в плазме; Однако большинство ионов бикарбоната сначала возникают внутри клетки, а затем транспортируются в плазму.
Обратная последовательность реакций возникает при попадании крови в легкие, где парциальное давление углекислого газа ниже, чем в крови. Реакция, катализируемая карбоангидразой, обратима в легких, где она превращает бикарбонат в CO2 и обеспечивает его изгнание (Neil S. Cherniack, 2015).
Каталожные номера- Международное издание Angewandte Chemie. (2014, 23 сентября). Углекислота — и все же она существует! Получено с сайта chemistryviews.org.
- Формула угольной кислоты. (С.Ф.). Взято с softschools.com.
- ДЮБУА, С. (2016, 11 января). Углекислота в пищевых продуктах. Получено с livestrong.com.
- ЭМБЛ-ЭБИ. (2016, 27 января). Угольная кислота.
 Получено с ebi.ac.uk.
Получено с ebi.ac.uk. - База данных метаболизма человека. (2017, 2 марта). Угольная кислота. Получено с hmdb.ca.
- Ханна, М. М. (1991). Инфракрасные и масс-спектральные исследования протонно-облученного льда h3O + CO2: доказательства существования угольной кислоты. Spectrochimica Acta Часть A: Молекулярная спектроскопия, том 47, выпуск 2, 255-262. Получено с сайта science.gsfc.nasa.gov.
- (1991). Угольная кислота. Получено с ncbi.nlm.nih.
- Национальный центр биотехнологической информации. . (2017, 11 марта). База данных соединений PubChem; CID = 767. Получено с сайта pubchem.ncbi.nlm.nih.gov.
- Нил С. Черняк, e. к. (2015, 20 марта). Дыхание человека. Получено с britannica.com.
- Роберт С. Шварц, C.L. (2016, 29 апреля). Кровь. Получено с britannica.com.
- Королевское химическое общество. (2015). Угольная кислота. Получено с: chemspider.com.
- Яррис, Л. (2015, 16 июня). Разгадка тайны углекислоты. Получено с: newscenter.
 lbl.gov.
lbl.gov. - Зумдал, С. С. (2008 г., 15 августа). Оксикислота. Получено с: britannica.com.
Загрузка ..
Свойства углекислоты (23 факта, которые вы должны знать) – Lambda Geeks
Угольная кислота представляет собой минеральную кислоту, содержащую углерод, двойной кислород и одинарную связь углерод-гидроксильная группа. Поясним физические и химические свойства угольной кислоты.
Угольная кислота – слабая и нестабильная кислота, образующая карбонатные и бикарбонатные соли. Он быстро диссоциирует на CO 2 и H 2 O. В водном растворе он ведет себя как двухосновная кислота, которая теряет два иона H + . Взаимопревращение CO 2 в углекислоту происходит в процессе дыхания в легких человека или животных.
Давайте сосредоточимся на связях, точках плавления, точках кипения, реакциях, полярности, плотности и физическом состоянии, а также на многих других важных темах в деталях.
Название IUPAC (Международный союз теоретической и прикладной химии) угольной кислоты — это сама угольная кислота.
Химическая формула угольной кислотыХимическая формула угольной кислоты H 2 СО 3 . В этой формуле атом углерода является центральным атомом и связан с двумя гидроксильными группами (ОН) через две одинарные связи, а остальная часть атома кислорода — через одну двойную связь.
Углеродная кислота Номер CASРегистрационный номер CAS (аутентичный числовой идентификатор, который может содержать до 10 цифр) углекислоты: 463-79-6.
Carbonic Acid Chem Spider ID Угольная кислота имеет идентификатор Chem Spider ID (ChemSpider — бесплатная база данных химической структуры) 747.
- 9003 классифицируется как минеральная кислота неорганическая кислота.
- Угольная кислота также является слабой кислотой, поскольку константа диссоциации H 2 CO 3 относительно низка, и она не может полностью ионизироваться с образованием карбоната (CO 3 2- ) и ионы водорода. H 2 CO 3 = 2H + + CO 3 2- (K a = 4,5 × 10 -7 ).
Масса 1 моля угольной кислоты составляет 62,03 г.
Углекислота ЦветУглекислота проявляет зеленый цвет с неправильным пятном, когда углекислый газ реагирует с водой.
Вязкость углекислоты Вязкость чистой углекислоты нельзя измерить, поскольку ее нельзя получить в жидком чистом виде. Он представлен либо в водном растворе, либо в газообразной форме.
Он представлен либо в водном растворе, либо в газообразной форме.
Молярная плотность угольной кислоты составляет 0,01612 моль/см 3 , поскольку она имеет плотность 1,0 г/см 7 7 3 9.
Carbonic Acid Melting PointCarbonic acid has a melting point of -80 0 C or -112 0 F.
Carbonic Acid Boiling PointThe boiling point of угольная кислота 333,6 0 C или 606,6 0 F. Но при нагревании H 2 CO 3 она разлагается на воду и диоксид углерода (CO 2 )
9008 Кислотное состояние при комнатной температуре
Углекислота представляет собой тяжелый газ при температуре окружающей среды. Кристаллическая твердая форма может быть получена только при -80 0 C)
Ковалентная связь угольной кислоты Всего в угольной кислоте присутствует шесть ковалентных связей. Одна двойная связь присутствует между серой и одним атомом кислорода, а две другие одинарные ковалентные связи присутствуют между углеродом и двумя ОН-группами.
Одна двойная связь присутствует между серой и одним атомом кислорода, а две другие одинарные ковалентные связи присутствуют между углеродом и двумя ОН-группами.
Ковалентный или ионный радиус угольной кислоты или любого соединения невозможно измерить, поскольку ковалентный или ионный радиус можно определить только для любого отдельного атома, а не соединения.
Углекислота Электронные конфигурацииЭлектронная конфигурация определяется как расположение электронов на различных электронных оболочках или орбиталях. Обсудим электронную конфигурацию угольной кислоты.
Углерод и кислород различаются числом электронов: [He] 2s 2 2p 2 и [He] 2s 2 2p 4 соответственно. Водород имеет электронную конфигурацию 1s 1 . Электронная конфигурация имеет значение только для любого атома, который не присоединен ни к каким другим атомам или группам.
Электронная конфигурация имеет значение только для любого атома, который не присоединен ни к каким другим атомам или группам.
Степень окисления H 2 CO 3 равно нулю, потому что это нейтральное соединение, не имеющее заряда. Центральный атом углерода находится в степени окисления +4 в угольной кислоте. Каждый из двух атомов кислорода группы ОН находится в -1, а кислород, присоединенный двойной связью, находится в степени окисления -2.
Угольная кислота Кислотность/щелочнаяУгольная кислота представляет собой слабую неорганическую кислоту со значениями pk a , равными 6,77 (pk a1 7 7 9 9 9 1 7 3 ) и 9 .
Угольная кислота не имеет запаха? Углекислота представляет собой газообразное соединение без запаха, но имеет щелочной вкус.
- Углекислота – это не что иное, как гидратированные молекулы углекислого газа. Кристалл этой слабой кислоты содержит молекулы воды (известные как кристаллическая вода) и образует гидраты H 2 CO 3 .nH 2 O, в которых n может принимать значения 1, 2, 3 и 4.
- Атомы кислорода угольной кислоты также могут действовать как акцепторы водородных связей, а атомы водорода — как доноры водородных связей. Таким образом, угольная кислота образует гидраты в водном растворе.
Твердая угольная кислота имеет моноклинную кристаллическую структуру. Пространственная группа кристалла серной кислоты — p21/c , имеющая формульные единицы 4 в ячейке с размерами a = 5,39.2 A 0 , b = 6,661 A 0 , c = 5,690 A 0 , α = 90 0 β = 92,66 0 γ = 7 92,66 09017
Угольная кислота Полярность и проводимость- Угольная кислота является полярным соединением из-за ее полярных связей и относительного расположения полярных связей.
 Следовательно, он имеет постоянный дипольный момент 0,10491 Дебая.
Следовательно, он имеет постоянный дипольный момент 0,10491 Дебая. - Поскольку Углекислота диссоциирует на карбонат и ионы водорода, она проводит электричество в водном растворе. 910004 H 2 CO 3 = 2H + + CO 3 2-
Углекислота реагирует с основанием (имеющим группу ОН) с образованием соли и воды.
- 2NaOH + H 2 CO 3 = Na 2 CO 3 + H 2 O
- 2KOH + H 2 CO 3 = K 2 CO 3 + H 2 O
Угольная кислота реагирует с оксидом металла (ZnO) и образует карбонат металла (ZnCO 3 ).

 04.16
04.16 Получено с ebi.ac.uk.
Получено с ebi.ac.uk. lbl.gov.
lbl.gov. Следовательно, он имеет постоянный дипольный момент 0,10491 Дебая.
Следовательно, он имеет постоянный дипольный момент 0,10491 Дебая.