Гипохлорит натрия в водоочистке: Практика применения, транспортирования, хранения
Хлорирование воды
Хлорирование используется на водоочистительных сооружениях, в бассейнах, при очистке сточных воды для окисления и дезинфекции воды наравне с озонированием. В связи с этим хлорирование становится преградой для увеличения количества микроорганизмов в воде, таким образом, она подойдет даже для употребления.
Когда на вредные примеси оказывает влияние хлор или озон, первые неизбежно окисляются, а продукты, которые образовались в следствии такой реакции, устраняются посредством сорбентов разного рода и механической фильтрации.
Обычно хлорирование совмещается с остальными методами обеззараживания, например уф-излучение или озонирование с целью получения максимального эффекта и сбережения денежных средств. Потому как «иные способы» не обладают бактерицидным влиянием, т.н. пролонгированного действия, тогда в роли оригинального средства обеззараживания воды особенно пригодится исключительно хлорирование (вплоть до добавления реагентов, содержащих хлор) .
Главная функция хлорсодержащих веществ – формирование гипохлорит-ионы и/или хлорноватистую кислоты. Заметьте тот факт, что среди всех реагентов, содержащих хлор, в бытовом водоснабжении применяется только небольшая их часть, которая дозволена нормами.
В роли дезинфекторов водоочистке используются следующие вещества:
- соли гипохлорита кальция
- гипохлорит натрия, образовывающийся при электролизе на месте применения
- хлорамин 0,5 %
- ниртан 3%
Гипохлорит натрия в водоочистке: Практика применения, транспортирования, хранения
Вопрос о качестве воды постоянно обсуждается в газетах и журналах. Согласно информации Всемирной организации здравоохранения, каждый год по всему миру низкое качество воды становится причиной смерти для порядка 5 млн. человек. Инфекции, распространяемые благодаря водоснабжению, приводят к заболеваниям около 500млн.человек ежегодно. Эти данные указывают на необходимость разрешения вопроса о качественном водоснабжении. По этой причине нужно обеспечить население обеззараженной водой, имеющей высокое качество. Вопрос о качестве воды из системы водоснабжения является первоочередным и нуждается в комплексном и эффективном решении. Анализируя ранее используемые метода обеззараживания воды для питья в странах с высоким уровнем развития, можно увидеть, что, к примеру, в Соединенных Штатах Америки 98,6% воды для питья обрабатывается при помощи хлорирования. Озонирование занимает лишь 0,37%, другие способы — 0,25%.
По этой причине нужно обеспечить население обеззараженной водой, имеющей высокое качество. Вопрос о качестве воды из системы водоснабжения является первоочередным и нуждается в комплексном и эффективном решении. Анализируя ранее используемые метода обеззараживания воды для питья в странах с высоким уровнем развития, можно увидеть, что, к примеру, в Соединенных Штатах Америки 98,6% воды для питья обрабатывается при помощи хлорирования. Озонирование занимает лишь 0,37%, другие способы — 0,25%.
Причина подбора именно таких методов заключается в том, что хлорирование является самым эффективным и экономически выгодным способом дезинфекции оды для питья, если сравнивать с другими способами. Тем не менее, этот метод имеет свои недостатки. Согласно с последними данными, ввиду ухудшение качества воды в источниках природного происхождения и роста протяженности труб водоснабжения, которые очищают воду посредством хлорирования, а именно жидкого хлора, увеличивается возможность несчастных случаев, которые приводят к отравлению хлором населения, а также обслуживающего персонала во время его перевозки, хранения, дозирования. Для больших водопроводных станций норма месячного запаса хлора составляет десятки тонн и его сбережения, в частности на станциях, расположенных в черте города, очень небезопасно; причем и на малых водопроводах сбережение даже пары баллонов с хлором может стать опасностью и нуждается в высококвалифицированном обслуживающем персонале. Стоит заметить, что траты на эксплуатацию емкости для сжиженного хлора, как правило, пропорциональны расходам на получение хлора.
Для больших водопроводных станций норма месячного запаса хлора составляет десятки тонн и его сбережения, в частности на станциях, расположенных в черте города, очень небезопасно; причем и на малых водопроводах сбережение даже пары баллонов с хлором может стать опасностью и нуждается в высококвалифицированном обслуживающем персонале. Стоит заметить, что траты на эксплуатацию емкости для сжиженного хлора, как правило, пропорциональны расходам на получение хлора.
Данный вопрос можно решить заменив жидкий хлор на другие хлорсодержащие вещества – гипохлорит натрия (ГПХН). Метод дезинфекции воды посредством водного раствора гипохлорита натрия сохраняет все положительные стороны хлорирования и дает возможность не использовать в работе высокотоксичный газ. Хранение и использование этого вещества является полностью безопасным. Он эффективно удаляет множество микроорганизмов, которые приводят к разного рода заболеваниям, окисляет марганец и железо, а также во время его применения водоросли и биообрастиния прекращают свой рост. Его свойством также можно назвать консервирование обеззараживающего эффекта во время продолжительного срока транспортирования воды в системе водоснабжения. Хлораторные станции были переоборудованы специально на гипохлорит натрия, поэтому инспектирующие органы их не контролируют. Следовательно, гипохлорит натрия (марки «А») – это самое лучшее вещество на стадии предварительного окисления, также предназначен для дезинфекции воды под конец обработки перед подачей в систему водоснабжения.
Его свойством также можно назвать консервирование обеззараживающего эффекта во время продолжительного срока транспортирования воды в системе водоснабжения. Хлораторные станции были переоборудованы специально на гипохлорит натрия, поэтому инспектирующие органы их не контролируют. Следовательно, гипохлорит натрия (марки «А») – это самое лучшее вещество на стадии предварительного окисления, также предназначен для дезинфекции воды под конец обработки перед подачей в систему водоснабжения.
Гипохлорит натрия, используемый вместо жидкого хлора для обеззараживания воды для питья, должен соответствовать определенным нормам содержания щелочи, тяжелых металлов, к примеру, железа, цветности, стабильности раствора, концентрации активного хлора. Для системы снабжения питьевой водой данные требования исполняются гипохлоритом натрия марки “А”, произведенного на ОАО “ДнепрАЗОТ” г. Днепродзержинска.
Как правило, в систему очистки воды гипохлорит натрия поступает после того, как он предварительно был разбавлен водой. После того, как вещество разбавлено в 100 раз снижается уровень рН и содержание активного хлора до 0,125. Если система использует неразбавленный гипохлорит, тогда в подающих трубах появляется осадок, который состоит из диоксида кремния и гидроксида магния, которые препятствуют работе водных каналов. Именно по этой причине, содержание щелочи в гипохлорите должна соответствовать нормам, чтобы не образовывался осадок. Если вода обработана гипохлоритом натрия, тогда вещества, которые входят в состав протоплазмы клеток бактерий, окисляются, что приводит к их гибели. Тем не менее, только небольшая часть хлора, который вводится в воду, применяется для уничтожения бактериальных клеток.
После того, как вещество разбавлено в 100 раз снижается уровень рН и содержание активного хлора до 0,125. Если система использует неразбавленный гипохлорит, тогда в подающих трубах появляется осадок, который состоит из диоксида кремния и гидроксида магния, которые препятствуют работе водных каналов. Именно по этой причине, содержание щелочи в гипохлорите должна соответствовать нормам, чтобы не образовывался осадок. Если вода обработана гипохлоритом натрия, тогда вещества, которые входят в состав протоплазмы клеток бактерий, окисляются, что приводит к их гибели. Тем не менее, только небольшая часть хлора, который вводится в воду, применяется для уничтожения бактериальных клеток.
Большая часть данного вещества используется для взаимодействия с органическими и неорганическими веществами, которые присутствуют в воде. По этой причине, что сэкономить гипохлорит (в 4-5 раз), лучше всего для дезинфекции воды использовать его исключительно в фильтрованную воду, другими словами, в резервуары чистой воды (РЧВ). В общем, расход гипохлорита для окисления микроорганизмов, органических и минеральных примесей является характеристикой хлорпоглощаемости воды. Поэтому определить дозы ГПХН, нужно для того, чтобы эффективно вести процесс дезинфекции, которые является прямо пропорциональным величине и скорости хлорпоглощения. Стоит заметить, что доза вводимого хлора (ГПХН) должна превышать хлорпоглощаемость на величину остаточного хлора. Это гарантирует то, что окисление бактерий и органических веществ почти завершено.
В общем, расход гипохлорита для окисления микроорганизмов, органических и минеральных примесей является характеристикой хлорпоглощаемости воды. Поэтому определить дозы ГПХН, нужно для того, чтобы эффективно вести процесс дезинфекции, которые является прямо пропорциональным величине и скорости хлорпоглощения. Стоит заметить, что доза вводимого хлора (ГПХН) должна превышать хлорпоглощаемость на величину остаточного хлора. Это гарантирует то, что окисление бактерий и органических веществ почти завершено.
Обработка бытовых и промышленных сточных вод
Гипохлорит натрия (ГПХН) c успехом используется для очистки воды, используемой в бытовых и промышленных целях. Во время данного процесса уничтожаются животные и растительные микроорганизмы. Удаляется запах, которые появляется из-за серосодержащих веществ. ГПХН делает безопасными промышленные стоки, к примеру, защищает от цианистых соединений. Это вещество используется для обработки воды, в составе которой есть ион аммония. Реакция проходит при температуре больше 700С в щелочной среде, при этом добавляется СаСl2 и СаСl3 для разложения соединений аммиака.
Реакция проходит при температуре больше 700С в щелочной среде, при этом добавляется СаСl2 и СаСl3 для разложения соединений аммиака.
С целью очистки фенолов применяют 10-11% раствор гипохлорита натрия, количество которого составляет 3-9 мг/л. Уровень очистки достигает отметки 99,99%. Гуминовые вещества в обрабатываемой сточной воде, превращаются в хлороформы, дихлоруксусную кислоту, трихлоруксусную кислоту, хлоральдегиды и прочие вещества, содержание которых в воде существенно ниже исходной.
Дезинфекция воды плавательных бассейнов и прудов
Плавательные бассейны – это объекты, которые предназначены для использования множеством людей, поэтому вода в них должна соответствовать нормам воды для питья.
Выполнить эти правила можно при помощи глубокой очистки и дезинфекции циркулирующей воды. Зачастую, для этого безупречно подходят растворы гипохлорита натрия (ГПХН). Цена этих веществ достаточно приемлема, они эффективно выполняют свои функции относительно бактерий и водорослей, а самое важное – это то, что они не наносят вреда обслуживающему персоналу и посетителям бассейна. Вышеперечисленные свойства позволяют использовать эти растворы для очистки воды в быту. Технический ГПХН дает возможность использовать очищенную, прозрачную воду. Он служит гарантией полной дезинфекции воды и защищает ее от загрязнений бактериями..
Вышеперечисленные свойства позволяют использовать эти растворы для очистки воды в быту. Технический ГПХН дает возможность использовать очищенную, прозрачную воду. Он служит гарантией полной дезинфекции воды и защищает ее от загрязнений бактериями..
Очистная конструкция бассейнов, как правило, предусматривает: коагуляционную обработку воды, фильтрацию при помощи песчано-антрацитовых фильтров, нагрев, ее подкисливание и хлорирование. Подкисление воды во время хлорирования используется с целью поддержания оптимального уровня рН в пределах 7,2 — 7,8, при которой можно достигнуть наибольшего обеззараживающего эффекта. Обеззараживания высшей степени длительностью 30 минут можно достигнуть во время использования растворов, содержащих 0,1 — 0,2% ГПХН. Уровень остаточного хлора в воде сохраняется на отметке 0,3 — 0,5 мг/л. Концентрация хлора в зоне дыхания не должно быть больше 0,1 мг/м3 в плавательных бассейнах, предназначенного для использования множеством людей 0,03 мг/м3 в спортивных бассейнах. Если заменить газообразный хлор на гипохлорит натрия, снизиться выделения хлора в воздухе и, более того, проще будет поддерживать остаточное количество активного хлора в воде.
Если заменить газообразный хлор на гипохлорит натрия, снизиться выделения хлора в воздухе и, более того, проще будет поддерживать остаточное количество активного хлора в воде.
Применение гипохлорита натрия в пищевой и молочной промышленности
Сейчас из всех средств для дезинфекции, применимых в молочной и пищевой индустриях, гипохлорит натрия (ГПХН) был оценен (среди этих веществ) по первому классу, т.к. является самым подходящий для данных целей и самый выгодный. Ему свойственна высокая эффективность относительно практически всех растительных клеток, разных бактерий и спор. Он используется для удаления ракообразных и моллюсков; для промывок разного рода, для уничтожения бактериофагов в сыроваренной отрасли промышленности, для обеззараживания емкостей. Он также используется в области пивоварения. Как правило, используют раствор ГПХН, в котором концентрация активного хлора достигает 30-40 мг/л.
Используется ГПХН также в рыбоводстве. Если разбавить данное вещество, возможно его применять для уничтожения разных видов патогенных агентов и использования с целью обеззараживания водных объектов с твердым дном и берегами. Данное вещество также используется для очистки рыболовных сачков, емкостей для хранения рыбы, сетей.
Данное вещество также используется для очистки рыболовных сачков, емкостей для хранения рыбы, сетей.
Нередко гипохлорит натрия используется также в быту и здравоохранении.
Транспортировка и хранение раствора гипохлорита натрия
Обеззараживающие характеристики растворов гипохлорита натрия (ГПХН) можн объяснить присутствием в них активного хлора и кислорода. В водных растворах ГПХН в первую очередь распадается на ионы СlО— и Nа+, первый из них способен диссоциировать с выделением активного кислорода или хлора. По этой причине, диссоциация гипохлорита натрия во время его сбережения – это вполне предсказуемое явление. Процесс сбережения растворов ГПХН постоянно предусматривает выпадение осадка, т.е. мелких хлопьев.
Появление осадка приводит к осветлению растворов ГПХН, что отражается в увеличению светопропускаемости данных растворов. Ознакомившись с литературой можно прийти к выводу, ГПХН может выкристаллизовываться из растворов в роли кристаллогидратов NaOCl х 5 Н2O, NaOCl х 2,5 Н2О, NaOCl х Н2О. При комнатной температуре в осадок выпадет в основном кристаллогидрат NaOCL х 5 Н2О, т.е. избежать данного процесса не получится. Во время применения ГПХН и его хранении нужно конкретизировать его главные параметры, а именно, концентрация активного хлора и быть в курсе скорости разложения ГПХН.
При комнатной температуре в осадок выпадет в основном кристаллогидрат NaOCL х 5 Н2О, т.е. избежать данного процесса не получится. Во время применения ГПХН и его хранении нужно конкретизировать его главные параметры, а именно, концентрация активного хлора и быть в курсе скорости разложения ГПХН.
Нормы ГОСТа допускают потерю активного хлора в период завершения 10 суток со дня отгрузки не больше 30%. исходного содержания. Однако если соблюдены все требования доставки и хранения, снижение активного хлора в растворе ГПХН может достигать не более 15% в течение месяца.
Клиенты обязуются знать главные нормы относительно транспортировки и хранения гипохлорита натрия.
1. Гипохлорит натрия доставляется железнодорожным и автомобильным транспортом согласно правилам перевозки опасных грузов.
2. ГПХН транспортируется в гуммированных железнодорожных цистернах, в емкостях, выполненных из стеклопластика или полиэтилена.
3. Крышки люков резервуаров должны быть оснащены воздушником для того, чтобы сбрасывать выделяющейся во время распада кислорода.
4. Цистерны, контейнера, бочки должны быть наполнены на 90% объема.
5. Наливные люки нужно уплотнить при помощи резиновых прокладок.
6. Контейнеры и бочки перед заполнением нужно в обязательном порядке промыть, т.к. оставшийся осадок существенно уменьшает содержание активного хлора в растворе, часть из которого используется для окисления вещества осадка.
7. Сберегать растворы гипохлорита натрия возможно исключительно в затемненных или окрашенной темной краской стеклянных бутылях или полиэтиленовых канистрах, бочках.
Общеизвестно, что ионы металлов – это катализаторы процесса диссоциации (распада) ГПХН. По этой причине, стальная тара для транспортировки и сбережения в обязательном порядке должна быть гуммирована. Было зафиксировано сильное воздействие температуры на длительность разложения. В случае если температура возрастает, период распада гипохлорита натрия заметно увеличивается. Именно это стало причиной хранения вещества в закрытых складских помещениях, которые не отапливаются.
Практика использования гипохлорита натрия в Украине
Гипохлорит натрия (жавелевая вода) признан и используется в медицине по всему миру с 1785 года. Гипохлорит натрия используется в роли обеззараживающего средства почти во всех областях жизнедеятельности людей. Сегодня гипохлорит натрия – это самый эффективный и быстродействующий обеззараживающий продукт, который имеет превосходные свойства для борьбы со всеми микроорганизмами. Гипохлорит натрия – это один из самых недовогих дезинфектантов.
Всемирная организация здравоохранения относит гипохлоритсодержащий отбеливатель в перечень дезинфектантов “высокого уровня”, т.к. он имеет высокую эффективность уничтожения целого списка высоко инфекционных бактерий и вирусов, в частности, вирус иммунодефицита человека, который провоцирует развитие СПИДа.
Использование этого вещества в течение более ста лет дает основания полагать, что применение гипохлоритов в соответствии с рекомендациями – это безопасно и не провоцирует вредное воздействие на здоровье человека.
Сейчас в Украине гипохлорит натрия с успехом применяется для дезинфекции воды для питья в г.г. Евпатория, Ивано-Франковск, Бахчисарай. Главное положительное свойство, которое отмечают единогласно все руководители этих горводоканалов, является экологическая безопасность его использования для жителей и обслуживающего персонала станций. Применяя гипохлорит натрия вместо хлора, учреждения водоподготовки оставляют показатели качества воды прежними, при этом больше не относятся к разряду особо опасных объектов” и теперь не трудно выполнить ПБХ-93, заключать договора с МСЧ и т.д.
В г. Днепродзержинске, ЛОК “Химик”, кроме дезинфекции воды для питья, есть опыт использования гипохлорита натрия для понижения в артезианской воде концентрации марганца, сероводорода, железа. В течение нескольких лет гипохлорит натрия применяется для дезинфекции воды в бассейнах здравниц Крыма, спортивных сооружений и школ Днепропетровской, Николаевской и Донецкой областей.
Нейтральный гипохлорит кальция: применение | Минералтрейд
С помощью гипохлорита кальция Ca(ClO)2 осуществляется отбеливание материалов, например, ткани и бумаги, а также в случае необходимости проводится обеззараживание воды. Стоимость этого вещества невысока, но сфера использования его ограничена, так как при контакте с углекислым газом утрачиваются способности к окислению. Вместе с тем Ca(ClO)2 применяется для создания другой разновидности гипохлорита натрия, которое стоит дороже и характеризуется большей стойкостью.
Стоимость этого вещества невысока, но сфера использования его ограничена, так как при контакте с углекислым газом утрачиваются способности к окислению. Вместе с тем Ca(ClO)2 применяется для создания другой разновидности гипохлорита натрия, которое стоит дороже и характеризуется большей стойкостью.
Физико-химические свойства гипохлорита кальция
Соль кальция и хлорноватистой кислоты выглядит как порошок белого цвета. Иногда оттенок вещества может быть немного другим, если его подвергли окрашиванию.
Отличительная особенность порошка — явный хлорный запах. В состав Ca(ClO)2 входит в среднем половина активного хлора, а показатели нерастворимого остатка составляют 10–15%. Во время хранения, срок которого обозначен производителем, количество активного хлора может снижаться до 35%. Количество воды должно быть не более 4%, а коэффициент сохранения стабильности при изменении температуры равен 0,8.
В результате химической реакции хлорирования гидроксида кальция появляются кристаллы, содержащие молекулы воды — кристаллогидраты нейтральной соли кальция и хлорноватистой кислоты, которые впоследствии высушиваются.
Сферы применения гипохлорита кальция
Использовать это обеззараживающее и отбеливающее средство можно в различных областях: медицина, производство, промышленность. Даже в быту применение состава позволяет обеспечить отсутствие инфекций. Раствором гипохлорита кальция можно обрабатывать различные поверхности, агрегаты, детские игрушки. Составом выполняется отбеливание материалов. В медицинских учреждениях вещество используется для обеззараживания физических отходов и крови, являющихся источником или рассадником серьезных инфекций, которые приводят к неизлечимым или трудно вылечиваемым заболеваниям.
Инструкция по гипохлориту кальция
Гипохлорит кальция Ca(ClO)2 — химическое вещество, требующее соблюдения правил безопасности при транспортировке, хранении и использовании. Следование инструкции позволяет обезопасить людей и окружающую природу. Гипохлорит кальция является взрывобезопасным и негорючим веществом, однако, он может стать причиной возгорания, если произошел контакт с некоторыми другими веществами.
Степени опасности Ca(ClO)2:
- вторая, если на организм воздействуют концентрированные пары, попавшие ингаляционным способом.
- третья, если вещество попало в рот, то воздействует на весь организм;
- четвертая, если было соприкосновение с кожными покровами.
Производители реализуют гипохлорит кальция, используемый для обеззараживания, в стальных бочках, которые изготовлены из оцинкованной или углеродистой стали. Данные емкости характеризуются наличием специальных полиэтиленовых мешков. Покупатель может хранить состав либо в таре производителя, либо в контейнерах из стали. Важно помнить, что тара для хранения должна соответствовать требованиям безопасности при работе с гипохлоритом кальция.
Хранение солей кальция и хлорноватистой кислоты с сохранением первоначальных характеристик допускается в течение 1 года с момента производства. При дальнейшем хранении вероятно выделение активного хлора. Принять решение о возможности дальнейшего использования дезинфицирующего средства позволят показатели уровня активного хлора в составе.
Перевозка и хранение
Перевозка гипохлорит кальция осуществляется в транспортных средствах крытого типа в вертикальном положении с соблюдением мер безопасности. Перемещать вещество воздушным способом нельзя. Если Ca(ClO)2 транспортируется железной дорогой, допускается двухрядное расположение бочек. Отгружать вещество можно в универсальной таре.
Хранение состава осуществляется в упаковке завода-производителя на складах. Помещение должно хорошо вентилироваться, не подвергаться воздействию осадков и солнечного света. Можно использовать систему хранения штабелями с шириной конструкции (до 2 метров) и расстоянием между штабелями в 1 метр.
Сильные окислительные характеристики гипохлорита кальция не допускают его расположения рядом с жидкими органическими составами с маслами. Несоблюдение мер предосторожности может привести к возгоранию.
В чем опасность гипохлорита кальция?
Данное химическое вещество — сильный окислитель, поэтому допускается его смешивание с водой. Использование емкостей из низколегированной стали, а также бронзовой, медной или чугунной тары способствует быстрому разложению хлорноватистокислого кальция, потому что эти материалы являются катализаторами. При работе с веществом стоит помнить, что тара может нагреваться в ходе реакции.
Использование емкостей из низколегированной стали, а также бронзовой, медной или чугунной тары способствует быстрому разложению хлорноватистокислого кальция, потому что эти материалы являются катализаторами. При работе с веществом стоит помнить, что тара может нагреваться в ходе реакции.
Больше всего вредному воздействию гипохлорита кальция подвержены кожный покров и слизистые оболочки. Если появилось першение в горле, кашель или дискомфорт в носоглотке, следует обратиться к врачу. Если вещество попало на слизистые, то возможно появление ожогов и повреждение кожных покровов. Сильное отравление веществом может проявляться в отдышке, кашле, тахикардии.
Меры безопасности
Для снижения уровня воздействия химического вещества на человека следует использовать средства химической защиты: костюмы, маски, перчатки, очки. Химкостюмы позволяют надежно защитить весь организм (кожу, слизистые) от попадания гипохлорита кальция и являются самым эффективным способом защиты.
Первичная помощь человеку, подвергшемуся воздействию вещества, заключается в обеспечении свежего воздуха, покоя и прогревания. Оперативную помощь можно оказать с помощью промывания пораженных участков водой, а также употребления молока, средств от кашля или болей в сердце — список зависит от типа повреждения организма. Кожные покровы следует как можно быстрее и тщательнее промыть большим количеством воды, также как и глаза. При проглатывании состава надо выпить воды и принять активированный уголь. После оказания первой помощи необходимо обратиться за квалифицированной врачебной помощью.
Оперативную помощь можно оказать с помощью промывания пораженных участков водой, а также употребления молока, средств от кашля или болей в сердце — список зависит от типа повреждения организма. Кожные покровы следует как можно быстрее и тщательнее промыть большим количеством воды, также как и глаза. При проглатывании состава надо выпить воды и принять активированный уголь. После оказания первой помощи необходимо обратиться за квалифицированной врачебной помощью.
Что делать в случае аварии?
- Если аварийная ситуация произошла во время транспортировки, необходимо организовать безопасное место.
- Требуется установка опасной зоны, в которую входит само транспортное средство, перевозящее гипохлорит кальция, и участок, куда мог попасть состав.
- После химического исследования места аварии следует скорректировать ограничительную зону.
- Важно убрать всех посторонних из зоны поражения и оказать помощь пострадавшим.
- Нахождение в радиусе аварии допускается только в средствах химической защиты.

- Для предотвращения возгорания следует исключить очаги огня любого типа.
Общая рекомендация по удалению последствий аварии с гипохлоритом кальция заключается в промывании места большим количеством воды. Предварительно рассыпавшиеся соли кальция и хлорноватистой кислоты следует собрать. Место аварии также следует обработать солью натрия и тиосерной кислоты. Если случилось возгорание, тушение осуществляется с максимального расстояния с использованием порошковых или газовых составов.
Гипохлорит натрия, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t° кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Гипохлорит натрия — что это
Дата публикации: 23.11.2020
Неорганическое вещество, содержащее в составе около 95% хлора, носит название натрия гипохлорит. Устаревшие термины – «жавелевая вода» и «лабарракова вода». В химии ингредиент фигурирует под наименованием «натриевая соль хлорноватистой кислоты», его формула – NaOCl. В РФ выпуск вещества регулируется положениями ГОСТ 11086-76.
Химические свойства и применение
Из-за нестабильности вещества в свободном состоянии его чаще используют в форме раствора или пентагидрата, обладающих резким специфическим запахом. Безводная форма имеет вид прозрачных кристаллов, хорошо растворимых в воде. Пентагридрат отличатся желто-зеленым цветом, а его кристаллы имеют четко выраженную ромбическую форму. При производстве вещества используют две технологии: электролитическую и химическую.
Это экологически чистое вещество, в природе разлагающееся до кислорода, воды и поваренной соли. По химической активности оно относится к 1-му классу, по опасности для здоровья – к 3-му.
По химической активности оно относится к 1-му классу, по опасности для здоровья – к 3-му.
Гипохлорит натрия – мощный окислитель, вызывающий коррозию металлических предметов. Он востребован в различных сферах, но основное применение нашел в медицине, бытовой химии, промышленности.
Диапазон использования химического соединения:
- эффективное отбеливание древесины, ткани и других материалов;
- выпуск хлорпикрина, крахмала, антраниловой кислоты, аскорбиновой кислоты;
- санитарно-гигиеническая и промышленная обработка трубопроводов, зерна, емкостей в пивоварении и виноделии;
- производство фармацевтических и пищевых веществ;
- очистка воды в системах водоснабжения, обеззараживание бытовых и промышленных стоков;
- дегазация опасных отравляющих веществ в военном деле;
- изготовление дезинфицирующих и чистящих средств бытовой химии.
В медицине NaOCl нередко применяется как противогрибковое и противовирусное средство, а в ограниченных дозах используется в гинекологии, хирургии, стоматологии.
Нужно помнить, что входящий в состав соединения хлор может вызывать химические ожоги вплоть до отмирания тканей или потери зрения. После приема внутрь возможна перфорация органов пищеварения. Но он остается безопасным для здоровья, если соблюдать правила использования.
Использование в фармакологии
Комплекс химических свойств позволяет применять гипохлорид натрия как детоксицирующее, дезинфицирующее, антисептическое средство. Это одно из наиболее эффективных антибактериальных веществ. Оно даже в низкой концентрации производит активное действие по отношению к различным категориям микроорганизмов.
Максимальной активности NaOCl можно добиться при нейтральном показании рН. В результате реакции окисляющие частицы действуют на биополимеры вредных агентов вплоть до разрушения молекулярной структуры органических субстратов.
Средства, изготовленные на основе натрия гипохлорита, эффективно воздействуют на вирусы, патогенные грибы, грамотрицательные/грамположительные бактерии, синегнойную и кишечную палочку, но бесполезны против лямблиоза и криптоспоридиоза. Мутагенными, канцерогенными и тератогенными характеристиками соединение не обладает.
Мутагенными, канцерогенными и тератогенными характеристиками соединение не обладает.
Условия применения и противопоказания
Раствор NaOCl успешно используют для введения инъекций при отравлениях различной степени тяжести, экзо- и эндотоксикозах, болезнях почек и печени, ожогах, сепсисе. Внутриполостные инъекции проводятся в концентрации 0,06%, наружно – в виде обработок, примочек.
Применение натрия гипохлорита при профилактике и лечении заболеваний:
- операции на брюшной или плевральной полости, грудной клетке;
- диализ брюшной полости;
- открытые раны, абцессы;
- пред- и послеоперационная обработка влагалища;
- эндометриоз, хламидиоз, кольпит, аднексит, бартолинит, трихомониаз;
- остеомиелит, распространенный перитонит;
- профилактика и лечение после кесарева сечения;
- гнойный отит, насморк, фарингит;
- постоперационная обработка после простэктомии, операций на почках и мочевых путях;
- дифтерия, микозы, экзема, герпес, угри.

Раствором или гелем с содержанием NaOCl дезинфицируют поверхности во время эпидемий и пандемий, протирают оборудование в пищевой промышленности.
Применения вещества противопоказано, если пациент страдает аллергическими реакциями, гиповолемическим синдромом, гипогликемией. Его не используют для инъекционного введения женщинам в период беременности и лактации.
Вследствие нарушения дозировки или индивидуальных особенностей организма раствор может вызвать аллергию, снижение сахара в крови, снижение артериального давления, жжение или сухость на обработанном участок. Возможны экстравазация или флебит, если внутривенное введение произвести слишком быстро.
Вещество не рекомендуют смешивать с мылом или другими антисептическими растворами. Для этого обрабатываемый участок перед применением следующего лекарственно средства аккуратно промывают водой. NaOCl не предназначен для обработки хирургических материалов и инструмента.
При внутривенном введении и наружном применении, а также при использовании вещества в качестве дезинфицирующего раствора для обеззараживания поверхностей необходимо соблюдать инструкцию. Нарушать дозировку и пренебрегать рекомендациями запрещено.
Нарушать дозировку и пренебрегать рекомендациями запрещено.
Гипохлорит натрия: характеристика и свойства, ГОСТ и технические условия
Наши предложения
Продукция
- Viscosuper
- Бензоат натрия
- Бура техническая
- Винная кислота
- Гидроксид алюминия
- Гидросульфид натрия
- Гипохлорит натрия
- Глицерин
- Дифениламин
- Диэтилентриамин
- Изопропиловый спирт
- Калия пирофосфат
- Касторовое масло
- Лимонная кислота
- Малеиновый ангидрид
- Молочная кислота
- Муравьиная кислота
- Ортофосфорная кислота
- Пропиленгликоль
- Пропионовая кислота
- Сорбат калия
- Стеариновая кислота
- Сульфид натрия
- Уксусная кислота, ледяная
- Формиат калия
- Формиат кальция
- Формиат натрия
- Фумаровая кислота
- Холин хлорид 60%
- Щавелевая кислота
- Яблочная кислота
Услуги
Полезная информация
- Характеристика и свойства уксусной кислоты
- Применение уксусной кислоты
- Уксусная кислота как пищевая добавка Е260
- Сферы применения лимонной кислоты
- Пищевая добавка Е330
Позвоните или отправьте нам сообщение
+7 (812) 448-47-55
- 2789
- Публикации
Содержание
Общие характеристики и свойства
Сильно неустойчивое соединение в чистом виде, гипохлорит натрия используется в виде NaOCl · 5h3O или водного раствора.
Гипохлорит натрия хорошо известное средство, применяемое в быту и производстве. В бытовом назначении используется как очиститель санитарных комнат и сантехнических предметов, бытовой отбеливатель. В промышленности часто используется для очистки оборудования контактирующего с продуктами питания, очистки воды в бассейнах, дезинфектор. Применяется в стоматологии, при производстве и отбеливании обоев и многих других сферах.
Физические свойства
- Вид: кристаллический порошок
- Цвет: бесцветный
- Запах: сильно выраженный резкий
- Состав: Натрий — 30,9 %, хлор — 47,6 %, кислород — 21,5 %
- Молекулярная масса по классификации Международным атомным масса 1971 года: 74,443 г/моль
- Растворим: в воде
- Плотность пентагидрата: 1,574 г/см³
- Основная форма использования: в растворах
- Плотность растворов: от 1005,3 до 1328,5 г/л
- Температура замерзания растворов: от −1,0 до −29,7 °C
Публикация по теме: «Сферы применения гипохлорита натрия»
История открытия
Говорить об открытии гипохлорита натрия следует после упоминания открытия такого элемента как хлор. Хлор был открыт на два года позже хлороводорода в 1774 году шведским химиком Карлом Вильгельмом Шееле. Шееле описал данный элемент в своем трактате посвященном пиролюзите. Химик тогда же отметил основное качество хлора – отбеливание, и резкий (сравнимый с водкой) запах. Свойство отбеливать подтвердил и Член парижской Академии наук французский химик Клод Луи Бертолле на этот раз у водного раствора газа.
Хлор был открыт на два года позже хлороводорода в 1774 году шведским химиком Карлом Вильгельмом Шееле. Шееле описал данный элемент в своем трактате посвященном пиролюзите. Химик тогда же отметил основное качество хлора – отбеливание, и резкий (сравнимый с водкой) запах. Свойство отбеливать подтвердил и Член парижской Академии наук французский химик Клод Луи Бертолле на этот раз у водного раствора газа.
Уникальные свойства не могли остаться незамеченными. Однако соединение было настолько неустойчивым, что его промышленное использование было под большим вопросом. Продолжающиеся опыты дали положительный результат тогда, когда хлор пропущен через водный раствор карбоната калия. Названная «жавелевой водой» жидкость (по месту изобретения) была «детищем» того же Бертолле, была изобретена в 1792 году. Однако у этого метода был один недостаток, относительная дороговизна карбоната калия.
И в 1820 году уже французский аптекарь Антуан Лабаррак заменил карбонат калия на более дешевый гидроксид натрия. На рынок такая жидкость поступила с названием «лабарракова вода» (по имени создателя).
На рынок такая жидкость поступила с названием «лабарракова вода» (по имени создателя).
Несмотря на уже появившийся гипохлорит натрия его основные свойства (очищать и дезинфицировать) были использованы не сразу. Опыты ведись вплоть до начала ХХ века, когда его стали применять для дезинфекции воды.
Технические условия гипохлорита натрия
ГОСТ
Гипохлорит натрия подчинен ГОСТу «Гипохлорит натрия. Технические условия. Sodium hypochlorite. Specifications» разработанному 1 июля 1977 года. Данный стандарт распространяется на натрий хлорноватистокислый получаемый путем добавления в раствор едкого натра хлора.
Данный ТУ выделяет две марки натрия гипохлорита.
Марка стандарта А. Применяется в химической промышленности как обеззараживатель питьевой воды, воды в бассейнах, дезинфектор.
Марка стандарта Б. Применяется в фармацевтической промышленности, при производстве витаминных комплексов, а также для промышленного отбеливания тканей.
Безопасность
Негорючий и невзрывоопасный гипохлорит натрия может вызывать раздражение и ожоги, так как является окислителем. Недопустимо попадание в глаза, может приводить к слепоте.
Продукция, места хранения и производственные помещения в обязательном порядке должны иметь соответствующие маркировки и условия работы:
- Помещения должны иметь вытяжки и вентиляции.
- Персонал должен соблюдать меры личной безопасности и иметь защитную одежду (очки, резиновую обувь, перчатки, фартук, костюм, противогаз).
- Недопустимо хранения с продуктами питания.
- Разрешена перевозка всеми видами транспорта. Цистерны, бочки – стальные, полиэтиленовые, стеклопластиковые. Заполнение не более чем на 90%.
- Помещения для хранения должны быть сухими, защищенными от прямых солнечных лучей. Помещения не подлежат отапливанию.
ООО «Эверест» осуществляет оптовые поставки гипохлорит натрия, со склада и под заказ.
Для получения выгодного ценового предложения, оставьте заявку на сайте или позвоните по телефону: +7 (812) 448-47-55.
Рейтинг: 5/5 — 1 голосов
Характеристика и свойства уксусной кислоты
Общая характеристика ортофосфорной кислоты
Сферы применения гипохлорита натрия
Электролиз водного раствора | ЯртехсервисЯртехсервис
Хлорирование
Применение гипохлорита натрия (NaClO) обусловлено его химической способностью к нейтрализации целого ряда вредных микроорганизмов. Его бактерицидные свойства направлены на уничтожение целого ряда опасных грибков и бактерий.
Чтобы получить гипохлорит натрия необходимо провести процесс хлорирования едкого натра (NaOH) с помощью молекулярного хлора (Cl).
Принцип действия гипохлорита натрия (NaClO) достаточно простой, так как это вещество имеет высокие биоцидные (биоцид — химические средства, предназначенные для борьбы с вредными или болезнетворными микроорганизмами) свойства. Когда гипохлорит натрия (NaClO) попадает в воду, он начинает активно разлагаться, образовывая при этом активные частицы в виде радикалов и кислорода.Радикалы гипохлорита натрия (NaClO) направлены против вредных микроорганизмов. Активные частицы гипохлорита натрия (NaClO) начинают разрушать внешнюю оболочку или биопленку микроорганизма, таким образом, это приводит к окончательной гибели различных патогенных грибков, вирусов и бактерий.Химический состав гипохлорита натрия направлен на обеззараживание и дезинфекцию воды. Поэтому это вещество занимает важное место во многих сферах человеческой жизни. Мировые исследования показывают, что гипохлорит натрия (NaClO) для дезинфекции применяют в 91% случаев, остальные 9% включают гипохлорит калия или лития. Но чтобы это вещество дало результат и пользу в быту, необходимо внимательно следить за концентрацией раствора.
Когда гипохлорит натрия (NaClO) попадает в воду, он начинает активно разлагаться, образовывая при этом активные частицы в виде радикалов и кислорода.Радикалы гипохлорита натрия (NaClO) направлены против вредных микроорганизмов. Активные частицы гипохлорита натрия (NaClO) начинают разрушать внешнюю оболочку или биопленку микроорганизма, таким образом, это приводит к окончательной гибели различных патогенных грибков, вирусов и бактерий.Химический состав гипохлорита натрия направлен на обеззараживание и дезинфекцию воды. Поэтому это вещество занимает важное место во многих сферах человеческой жизни. Мировые исследования показывают, что гипохлорит натрия (NaClO) для дезинфекции применяют в 91% случаев, остальные 9% включают гипохлорит калия или лития. Но чтобы это вещество дало результат и пользу в быту, необходимо внимательно следить за концентрацией раствора.
Хлорирование оказалось самым простым и дешевым способом обеззараживания воды, поэтому быстро распространилось по миру. Сейчас можно сказать, что традиционным методом обеззараживания питьевой воды, принятым во всем мире (в 99 случаев из 100), является именно хлорирование, и сегодня для хлорирования воды ежегодно расходуют сотни тысяч тонн хлора.Например, в России хлорированию подвергается более 99% воды и для этих целей используют в среднем в год около 100 тыс. тонн хлора.
Сейчас можно сказать, что традиционным методом обеззараживания питьевой воды, принятым во всем мире (в 99 случаев из 100), является именно хлорирование, и сегодня для хлорирования воды ежегодно расходуют сотни тысяч тонн хлора.Например, в России хлорированию подвергается более 99% воды и для этих целей используют в среднем в год около 100 тыс. тонн хлора.
В существующей практике обеззараживания питьевой воды хлорирование используется наиболее часто как наиболее экономичный и эффективный метод в сравнении с любыми другими известными методами, поскольку это единственный способ, обеспечивающий микробиологическую безопасность воды в любой точке распределительной сети в любой момент времени благодаря эффекту последействия хлора.
Хорошо известно, что хлор (Cl), реагируя с водой, образует не «хлорную воду» (как считалось ранее), а хлорноватистую кислоту (HClO) – первое вещество, полученное химиками, которое содержало активный хлор.
Из уравнения реакции:HClO + HCl ↔ Cl2 + H2O, следует, что теоретически из 52,5 г. чистой HClO можно получить 71 г Cl2, то есть хлорноватистая кислота содержит 135,2% активного хлора. Но эта кислота неустойчива: максимально возможная ее концентрация в растворе – не более 30%.
чистой HClO можно получить 71 г Cl2, то есть хлорноватистая кислота содержит 135,2% активного хлора. Но эта кислота неустойчива: максимально возможная ее концентрация в растворе – не более 30%.
Хлор легко растворяется в воде, убивая в ней все живое. Как было установлено после смешения газообразного хлора с водой в водном растворе устанавливается равновесие:
Cl2 + H2O ↔ HClO + HCl
Далее происходит диссоциация (диссоциация это распад частицы(молекулы, радикала, иона), на несколько более простых частиц) образовавшейся хлорноватистой кислоты НОСl ↔ Н+ + ОСl –
Наличие хлорноватистой кислоты в водных растворах хлора и получающиеся в результате ее диссоциации анионыОСl – обладают сильными бактерицидными свойствами (это способность уничтожать микроорганизмы). При этом выяснилось, что свободная хлорноватистая кислота почти в 300 раз более активна, чем гипохлорит-ионы ClO –. Объясняется это уникальной способностью HClO проникать в бактерии через их мембраны. Кроме того, как мы уже указывали, хлорноватистая кислота подвержена разложению на свету:
Объясняется это уникальной способностью HClO проникать в бактерии через их мембраны. Кроме того, как мы уже указывали, хлорноватистая кислота подвержена разложению на свету:
2HClO → 2 1O2 + 2HCl → О2 + HCl
с образованием хлористоводородной кислоты и атомарного (синглетного) кислорода (в качестве промежуточного вещества), который является сильнейшим окислителем.
Процесс хлорирования.
На станции водоподготовки хлор поставляется в сжиженном состоянии в специализированных контейнерах различной вместимостью, баллонах малого и среднего объема. Но для обеззараживания воды применяется хлор в газообразном состоянии. Газообразный хлор получают из жидкого путем его испарения в змеевиковых испарителях, представляющих собой вертикальные цилиндрические аппараты с размещенными внутри змеевиками, по которым проходит жидкий хлор. Дозирование полученного газообразного хлора в воду производится через специальные устройства – вакуумные хлораторы.
После введения хлора в обрабатываемую воду должны быть обеспечено хорошее смешение его с водой и достаточная продолжительность его контакта с водой (не менее 30 мин) до подачи воды потребителю. Следует отметить, что вода перед хлорированием должна быть уже подготовленной и, как правило, хлорирование обычно производят перед поступлением осветленной воды в резервуар чистой воды, где и обеспечивается необходимое время контакта.
Основными преимуществами применения для обеззараживания воды газообразным хлором
являются:
- низкая себестоимость процесса обеззараживания воды;
- простота проведения процесса хлорирования;
- высокая дезинфицирующая способность газообразного хлора;
- хлор воздействует не только на микроорганизмы, но и окисляет органические и неорганические вещества;
- хлор устраняет привкусы и запахи воды, ее цветность, не способствует увеличению мутности.
Однако хлор является сильно действующим ядовитым веществом, относящимся ко второму классу опасности. Газообразный хлор – сильный окислитель, поддерживает горение многих органических веществ, пожароопасен при контакте с горючими веществами. Скипидар, титан и порошки металлов в атмосфере хлора способны самовозгораться при комнатной температуре. С водородом хлор образует взрывоопасные смеси.
Газообразный хлор – сильный окислитель, поддерживает горение многих органических веществ, пожароопасен при контакте с горючими веществами. Скипидар, титан и порошки металлов в атмосфере хлора способны самовозгораться при комнатной температуре. С водородом хлор образует взрывоопасные смеси.
Подчас затраты на обеспечение безопасности при хлорировании превосходят затраты на собственно хлорирование воды.
В этом плане применение гипохлорита натрия в качестве хлор агента при хлорировании воды является хорошей альтернативой газообразному хлору.
Электролиз
Наиболее дешевым, простым и безопасным является способ получения дезинфицирующих растворов гипохлорита натрия путем электролиза водного раствора хлорида натрия (NaCl) и его взаимодействия со щелочью в одном и том же аппарате – электролизере.
На фотографиях показан электролизёр. Насос дозатор Seko для дозирования гипохлорита натрия и герметичный насос Argal для перекачивания рассола NaCl
Сохраняя все достоинства метода хлорирования с применением жидкого хлора, обеззараживание электролитическим гипохлоритом натрия позволяет избежать основных трудностей транспортирования и хранения токсичного газа.
Использование низко концентрированных растворов гипохлорита натрия повышает безопасность производственного процесса обеззараживания воды по сравнению с жидким хлором и высококонцентрированным раствором гипохлорита натрия.
Сырьем для производства гипохлорита натрия служит поваренная соль. Поскольку реагент используется непосредственно на месте получения, отпадает необходимость транспортировки.
Технологический процесс производства гипохлорита натрия включает следующие операции:
- Приготовление насыщенного раствора поваренной соли.
- Основной процесс получения гипохлорита натрия электролизом.
При электролизе раствора хлорида натрия происходят следующие реакции:
на катоде: 2Na+ + 2е→2Na;
2Na + 2h3O→2NaOH (гидроксид натрия) + H2↑;
на аноде: 2Cl — – 2е→Cl2;
Cl2 + 2H2O →2HClO (хлорноватистая кислота) + HCl.
Суммарная реакция может быть представлена в виде:
NaCl + H2O→NaClO + H2↑.
Поскольку процесс окисления гипохлорита натрия с последующим образованием хлоритов и хлоратов замедляется при понижении температуры, электролиз проводят при относительно низких температурах рабочего раствора соли (20–25 С°).
В специальные емкости – сатураторы через загрузочное устройство засыпается соль. Сырьем для производства низкоконцентрированных растворов гипохлорита натрия служит пищевая поваренная соль высшего сорта или «Экстра». Залитая вода, проходя через солевой слой, образует насыщенный раствор поваренной соли.
Для очистки концентрированного раствора соли используются фильтры грубой очистки и сменные полипропиленовые картриджные фильтры тонкой очистки с пропускной способностью 5 мкм.
Насыщенный раствор поваренной соли насосом подается в смеситель, где происходит разбавление водопроводной водой до рабочей концентрации (по СанПиН 2.1.4.1074-01), и далее – в электролизёр.
Основной процесс получения гипохлорита натрия электролизом проводится в установках, состоящих из электролизной ванны и теплообменника. В теплообменниках летом охлаждают электролит (водопроводной водой), а зимой предварительно нагревают рабочий раствор соли.
В теплообменниках летом охлаждают электролит (водопроводной водой), а зимой предварительно нагревают рабочий раствор соли.
В электролизных ваннах титановые электроды покрыты диоксидами рутения и иридия. В процессе электролиза на электродах происходит отложение кальция и магния, поэтому периодически, по мере образования этих отложений, производится промывка электролизеров в закрытом контуре 4-процентным раствором соляной кислоты (HCl).
В электролизере происходит непрерывный электролиз рабочего раствора соли, в результате чего получают гипохлорит натрия. Трехпроцентный раствор NaCl с постоянным объемным расходом 2,5 м3/ч протекает через установку электролиза до достижения желаемой концентрации NaClO (0,8%). Образующийся в электролизерах гипохлорит натрия хранится в специальных резервуарах, для обеспечения запаса для нужд очистных сооружений.
Гипохлорит натрия с концентрацией не менее 8 г/л по активному хлору поступает в резервуар накопитель, откуда насосами подается к узлам дозирования, расположенным вблизи точек ввода реагента. Из емкостей гипохлорит натрия по системе трубопроводов подаётся насосами дозаторами на автоматическую станцию дозирования в обрабатываемую воду.
Из емкостей гипохлорит натрия по системе трубопроводов подаётся насосами дозаторами на автоматическую станцию дозирования в обрабатываемую воду.
Вывод
Использование низко концентрированных растворов гипохлорита натрия позволяет повысить безопасность технологических процессов очистки воды на водопроводных станциях.
Сочетание обеззараживания обрабатываемой воды низко концентрированным гипохлоритом натрия (первая ступень) с ультрафиолетовым облучением перед подачей в городскую водопроводную сеть (вторая ступень) гарантирует полное соответствие качества воды по микробиологическим показателям действующим нормативам и ее высокую эпидемиологическую безопасность.
Гипохлорит натрия | 7681-52-9
Химические свойства
Гипохлорит натрия, NaOCl, представляет собой неустойчивое на воздухе бледно-зеленое кристаллическое твердое вещество, растворимое в холодной воде, разлагается в горячей воде и имеет сладкий аромат. Обычно он доступен в одной из двух сильных сторон. Бытовой жидкий отбеливатель содержит примерно 5,25 мас.% NaCIO. Коммерческий продукт (иногда называемый 15% отбеливателем) содержит 150 г/л доступного хлора. Это эквивалентно примерно 13 мас.% гипохлорита натрия. Гипохлорит натрия используется в качестве отбеливателя для бумажной массы и текстиля, в качестве окисляющего реагента, в качестве дезинфицирующего средства, в качестве промежуточного химического вещества и в лекарствах.
Обычно он доступен в одной из двух сильных сторон. Бытовой жидкий отбеливатель содержит примерно 5,25 мас.% NaCIO. Коммерческий продукт (иногда называемый 15% отбеливателем) содержит 150 г/л доступного хлора. Это эквивалентно примерно 13 мас.% гипохлорита натрия. Гипохлорит натрия используется в качестве отбеливателя для бумажной массы и текстиля, в качестве окисляющего реагента, в качестве дезинфицирующего средства, в качестве промежуточного химического вещества и в лекарствах.
Ион гипохлорита (OCI-) похож на влажный газообразный хлор по своему воздействию на материалы. Не многие металлы проявляют хорошую стойкость даже при низких температурах и концентрациях. Поскольку растворы гипохлорита нестабильны при нейтральных и более низких pH, они обычно содержат избыток щелочи, что несколько изменяет агрессивность.
Физические свойства
Безводный гипохлорит натрия взрывается; пентагидрат представляет собой бледно-зеленое кристаллическое твердое вещество; орторомбическая структура; плотность 1,6 г/см 3 ; плавится при 18°С; разлагается CO2 в воздухе; растворим в воде 29,3 г/100 мл при 0°С; водный раствор очень стабилен.
История
Гипохлорит натрия существует в виде водного раствора 5-15% NaOCl и обычно называется отбеливателем. Бытовой отбеливатель обычно представляет собой 5,25% раствор, а промышленный отбеливатель продается в виде 12% раствора. Когда в этой записи используется гипохлорит натрия, предполагается, что это водный раствор, прозрачный, слегка желтоватый, вызывающий коррозию и имеющий характерный запах хлора. Газообразный хлор был открыт Карлом Вильгельмом Шееле (1742–1786) в 1774 году и первоначально назывался дефолгизированным соляным спиртом. В 1787 году французский химик Клод Луи Бертолле (1749 г.1822) экспериментировал с водным раствором газообразного хлора в качестве отбеливателя. Основываясь на работе Бертолле, компания Javel, расположенная на окраине Парижа, начала производить отбеливатели в 1788 году. Газообразный хлор растворяли в растворе калийной соды (карбоната калия) для получения продукта, называемого ликером де Жавель, который представлял собой гипохлорит калия. Поташ, обработанный газообразным хлором, также использовался для производства отбеливающих порошков. В 1820 году аптекарь Антуан Жермен Лабаррак (1777–1850) заменил поташ на более дешевую кальцинированную соду (карбонат натрия), чтобы получить Eau de Labarraque или раствор Labarraque, который представлял собой гипохлорит натрия. Eau de Labarraque использовали в качестве дезинфицирующего средства и для отбеливания бумаги. Отбеливающие порошки, бура, щелочь и синька использовались в качестве отбеливателей на протяжении 19 века.век.
Поташ, обработанный газообразным хлором, также использовался для производства отбеливающих порошков. В 1820 году аптекарь Антуан Жермен Лабаррак (1777–1850) заменил поташ на более дешевую кальцинированную соду (карбонат натрия), чтобы получить Eau de Labarraque или раствор Labarraque, который представлял собой гипохлорит натрия. Eau de Labarraque использовали в качестве дезинфицирующего средства и для отбеливания бумаги. Отбеливающие порошки, бура, щелочь и синька использовались в качестве отбеливателей на протяжении 19 века.век.
Гипохлорит натрия является основным гипохлоритом, используемым в качестве отбеливателя и дезинфицирующего средства.
приходится 83% мирового использования гипохлорита, при этом на гипохлорит кальция приходится
остальные 17%. Во всем мире было использовано около 1 миллиона тонн гипохлорита натрия.
в 2005 году, причем примерно половина этого количества использовалась в домашних хозяйствах для отбеливания белья и
дезинфекция. Другая половина использовалась в основном для очистки сточных вод и питьевой воды;
другие виды использования включают санитарную обработку бассейнов, отбеливание целлюлозы, бумаги и текстиля, а также промышленное использование. хим.
хим.
Использование
NaOCl — сильный окислитель, используемый в плавательных бассейнах, а при разбавлении до 5,25%, он известен как отбеливатель для белья Clorox.
Использование
Гипохлорит натрия продается только в виде водного раствора, поскольку безводное твердое вещество очень нестабильно и может взорваться. Твердый пентагидрат также нестабилен на воздухе, разлагается реакцией с углекислым газом из воздуха. Водные растворы очень стабильны. Их используют для отбеливания тканей. и бумажная масса; в чистящих растворах; в очистке воды; как дезинфицирующее средство для бассейнов; и как гермицид и местное противоинфекционное средство. гипохлорит также используется в качестве окислителя во многих препаративных реакциях. Он входит в состав коммерческих отбеливающих средств, таких как Clorox и Ослепление.
Подготовка
Раствор гипохлорита натрия получают пропусканием хлора в
раствор гидроксида натрия. Пентагидрат получают кристаллизацией.
Пентагидрат получают кристаллизацией.
Определение
ЧЭБИ: неорганическая натриевая соль, в которой гипохлорит является противоионом.
Общее описание
Водянистая жидкость от зеленого до желтого цвета с запахом хлорной жидкости. Тонет и смешивается с водой.
Реакции воздуха и воды
Водорастворимый. В горячей воде разлагается на газообразный хлор и кислород.
Профиль реактивности
Соли хлорноватистой кислоты, HClO. Как правило, токсичны, раздражители и сильные окислители, особенно в присутствии воды при более высокой температуре, поскольку они разлагаются с выделением кислорода и газообразного хлора. При контакте с мочевиной они образуют взрывоопасный NCl3. При нагревании или контакте с кислотами они выделяют высокотоксичные пары газообразного хлора [Sax, 9изд. , 1996, с. 1905]. Может реагировать с серной кислотой с выделением тепла и газообразного хлора.
, 1996, с. 1905]. Может реагировать с серной кислотой с выделением тепла и газообразного хлора.
Опасность
Опасность возгорания при контакте с органическими материалами. Токсичен при приеме внутрь, сильно раздражает ткани.
Опасность для здоровья
Жидкость может вызывать раздражение кожи и глаз при постоянном контакте.
Пожароопасность
Поведение в огне: Может разлагаться с образованием раздражающего газообразного хлора.
Побочные эффекты
Гипохлорит натрия, широко известный как отбеливатель, может использоваться в качестве дезинфицирующего раствора. Это сильный раздражитель; однако существуют отдельные сообщения о CoU для гипохлорита натрия. Механизм Cou неясен.
Хостинек и др. опишите 36-летнюю женщину, у которой развилась сильно зудящая пятнисто-папулезная сыпь на чистящее средство, содержащее гипохлорит, которое она пролила на ногу. Сыпь распространилась на туловище и конечности и сопровождалась слезотечением, одышкой и отеком лица. В анамнезе был предыдущий случай сенсибилизации, и открытое тестирование с 1% гипохлоритом натрия вызвало немедленную крапивницу. Авторы предполагают, что это может быть связано с иммунологическим механизмом, учитывая генерализованные симптомы; тем не менее, подтверждающие тесты не проводились, и потенциал гипохлорита натрия вызывать неиммунологический Cou был очевиден: у четырех из 10 контрольных пациентов наблюдалась реакция в виде волдырей и покраснений на открытое применение 6% гипохлорита натрия.
Сыпь распространилась на туловище и конечности и сопровождалась слезотечением, одышкой и отеком лица. В анамнезе был предыдущий случай сенсибилизации, и открытое тестирование с 1% гипохлоритом натрия вызвало немедленную крапивницу. Авторы предполагают, что это может быть связано с иммунологическим механизмом, учитывая генерализованные симптомы; тем не менее, подтверждающие тесты не проводились, и потенциал гипохлорита натрия вызывать неиммунологический Cou был очевиден: у четырех из 10 контрольных пациентов наблюдалась реакция в виде волдырей и покраснений на открытое применение 6% гипохлорита натрия.
Калискан и др. описал 32-летнюю женщину, у которой развился сильный отек губ и затрудненное дыхание после использования ирригации гипохлоритом натрия во время эндодонтического лечения. Царапина с гипохлоритом натрия привела к немедленной эритеме и отеку, которые начали распространяться вверх по руке пациента. У нее также были проблемы с дыханием, и у нее развился дерматит от рук до локтей из-за использования бытовых чистящих средств.
Ниринг сообщил о пациенте, у которого наблюдались периодические приступы Коу к хлорированным бассейнам и контакту с очищающим средством, содержащим гипохлорит натрия. Скретч-тест на хлорированную воду у этого пациента был строго положительным, но отрицательным у пяти человек из контрольной группы, а закрытая кожная проба с гипохлоритом натрия была резко положительной через три часа.
Профиль безопасности
Слабо токсичен при проглатывании. Системные воздействия на человека при проглатывании: сонливость, снижение артериального давления, разъедающее действие на кожу, тошнота или рвота. Представлены данные о мутациях человека. Раздражение глаз. Разъедает и раздражает при проглатывании и вдыхании. Безводная соль очень взрывоопасна и чувствительна к теплу или трению. Взрывная реакция с муравьиной кислотой (при So), фенилацетонитрилом. Реагирует с образованием взрывоопасных продуктов с аминами, солями аммония (например, ацетатом аммония, (Nh5)2CO3, нитратом аммония, оксалатом аммония, (Nh5)3P04), азиридом, метанолом. Бурная реакция с фенилацетонитрилом, целлюлозой, этиленимином. Растворы в воде представляют опасность при хранении из-за выделения кислорода. При нагревании до разложения выделяет токсичные пары NaaO и Cl-. Используется как отбеливатель.
Бурная реакция с фенилацетонитрилом, целлюлозой, этиленимином. Растворы в воде представляют опасность при хранении из-за выделения кислорода. При нагревании до разложения выделяет токсичные пары NaaO и Cl-. Используется как отбеливатель.
Гипохлорит натрия
Портал органической химии
Химические вещества >> Окислители
Гипохлорит натрия – недорогой сильный окислитель, который используется как дезинфицирующее и отбеливающее средство. Он нестабилен в твердом состоянии, но коммерчески доступны растворы до 40%, содержащие NaOH и NaCl как побочные продукты приготовления:
2 NaOH + Cl 2 → NaCl + NaOCl + H 2 О
Растворы гипохлорита выделяют токсичные газы, такие как хлор, при подкислении. или с подогревом. Реакция с аммиаком или с веществами, которые могут генерировать аммиак может образовывать хлорамины, которые также токсичны и взрывоопасны. потенциал.
Название Реакции
Якобсен Эпоксидирование
Последняя литература
Реагенты, полученные из TEMPO, помечены несколькими перфторалкильными цепями и
триазольные фрагменты способствуют окислению спиртов в альдегиды в органических соединениях. смеси растворитель/вода со скоростью реакции, сравнимой со скоростью гомогенного TEMPO
реагентов, но могут быть легко извлечены фильтрацией жидкости/эмульсии.
смеси растворитель/вода со скоростью реакции, сравнимой со скоростью гомогенного TEMPO
реагентов, но могут быть легко извлечены фильтрацией жидкости/эмульсии.
А. Георге, Т. Чиннусами, Э. Куэвас-Яез, П. Хильгерс, О. Райзер, Org. лат. , 2008 , 10 , 4171-4174.
Кристаллы пентагидрата гипохлорита натрия с очень низким содержанием NaOH и NaCl.
окисляют первичные и вторичные спирты до соответствующих альдегидов и
кетоны в присутствии TEMPO/Bu 4 NHSO 4 без pH
корректирование. Этот новый метод окисления также применим к стерически затрудненным
вторичные спирты.
Т. Окада, Т. Асава, Ю. Сугияма, М. Кирихара, Т. Иваи, Ю. Кимура, Synlett , 2014 , 25 ,
596-598.
Стабильный нитроксильный радикал класса катализаторов, 2-азаадамантан N-оксил (AZADO) и
1-Me-AZADO демонстрирует превосходную каталитическую способность по сравнению с TEMPO, превращая различные
стерически затрудненные спирты в соответствующие карбонильные соединения в
отличные урожаи.
М. Сибуя, М. Томидзава, И. Судзуки, Ю. Ивабути, Дж. Ам. хим. соц. , 2006 , 128 , 8412-8413.
Использование NaClO/TEMPO/Co(OAc) 2 сделало возможным бензильное окисление алкила
арены с получением различных ароматических альдегидов и кетонов с очень хорошими выходами.
были исследованы реакционная способность, селективность и объем реакции.
К. Джин, Л. Чжан, В. Су, Synlett , 2011 ,
1435-1438 гг.
Эффективный и практичный метод позволяет синтезировать несимметричные бензилы.
из легкодоступных β-кетоальдегидов путем окисления гипохлоритом натрия,
декарбоксилирование и хлорирование Cl 2 полученный из натрия
гипохлорит. Различные несимметричные 1,2-диарилдикетоны, несущие функциональные группы
были получены с очень хорошими выходами в мягких условиях реакции.
Л. Руан, М. Ши, Н. Ли, С. Дин, Ф. Ян, Дж. Тан, Org. лат. , 2014 , 16 , 733-735.
Общая методика катализируемого осмием дигидроксилирования различных
терминальные и внутренние олефины с использованием отбеливателя в качестве дешевого окислителя дает
соответствующие цис -1,2-диолы в присутствии дигидрохинина или
производные дигидрохинидина (лиганды Шарплеса) с хорошими и превосходными химико-
и энантиоселективность в условиях оптимизированного pH.
Г. М. Мелтреттер, С. Бхор, М. Клавонн, К. Дблер, У. Сандермайер, М. Эккерт,
Х.-К. Милитцер, М. Беллер, Синтез, 2003 , 295-301.
Многообещающие двойные хиральные катализаторы для высокоэнантиоселективных
эпоксидирование α,β-ненасыщенных кетонов дало эпоксидные халконы в отличном состоянии.
выходом и высокой энантиоселективностью при использовании 13% NaOCl в качестве окислителя в
толуол в условиях мягкого межфазного переноса.
Т. Оои, Д. Охара, М. Тамура, К. Маруока, J. Am. хим. соц. , 2004 , 126 , 6844-6845.
Легкодоступные комплексы Mn(III) катализируют эпоксидирование алкенов отбеливателем в
хорошие урожаи. Разработан высокоэнантиоселективный катализатор эпоксидирования.
через логическую последовательность модификаций лиганда.
Э. Н. Якобсен, В. Чжан, А. Р. Муци, Дж. Р. Экер, Л. Денг, J. Am. хим.
соц. , 1991 , 113 , 7063-7064.
Йод катализирует стереоспецифическое 1,2-диаминирование неактивированных алкенов. В зависимости от источника азота и конфигурации алкенов, два
методы обеспечивают доступ ко всем катазомерным формам 1,2-диаминов.
В зависимости от источника азота и конфигурации алкенов, два
методы обеспечивают доступ ко всем катазомерным формам 1,2-диаминов.
С. Минаката, Х. Мива, К. Ямамото, А. Хираяма, С. Окумура, J. Am. хим. соц. , 2021 , 143 , 4112-4118.
Безкаталитическое окисление сульфидов пентагидратом гипохлорита натрия.
кристаллов в водном растворе ацетонитрила избирательно производит
соответствующие сульфоксиды с высокими выходами безвредным для окружающей среды способом.
Т. Окада, Х. Мацумуро, С. Китагава, Т. Иваи, К. Ямадзаки, Ю. Киношита, Ю.
Кимура, М. Кирихара, Synlett , 2015 , 26 , 2547-2552.
Чистый и экономичный синтез алкансульфонила
хлориды через окислительное хлорсульфонирование с участием отбеливателя S -алкилизотиомочевина
соли прост, экологичен и безопасен для рабочих. В процедуре используются легкодоступные реагенты,
предлагает сейф
операции и легкая очистка без хроматографии, и дает высокие выходы.
З. Ян, Б. Чжоу, Дж. Сюй, Синтез , 2014 , 46 ,
225-229.
Катализируемое Pd сочетание арилиодидов и заменителя диоксида серы DABSO
обеспечивает ариламмонийсульфинаты, которые могут быть преобразованы в однореакторном процессе
к различным функционализированным сульфонамидам простой обработкой водным раствором
раствор соответствующего амина и гипохлорита натрия (хлорная известь). Широкий ассортимент
аминов, включая анилины, и производные аминокислот.
Э. Флего, Дж. М. Харрисон, М. К. Уиллис, Synlett , 2016 , 27 , 101-105.
Пентагидрат гипохлорита натрия (NaClO5H 2 O) позволяет
недорогое, безопасное и быстрое окисление йодоаренов для получения синтетических
полезные (диацетоксииод)арены в качестве предшественников различных органо-λ 3 -йоданов, таких как гидроксил(тозилокси)иодбензол, йодозилбензол, йодонийилид и т.д.
А. Ватанабэ, К. Миямото, Т. Окада, Т. Асава, М. Утияма, Дж. Орг. хим. , 2018 , 83 ,
14262-14268.
Асава, М. Утияма, Дж. Орг. хим. , 2018 , 83 ,
14262-14268.
Использование дешевых и безвредных реагентов, таких как NaClO 2 , NaOCl,
и каталитическое количество TEMPO обеспечивает экологически чистый C (sp 3 )-H
окисление пиперазинов и морфолинов до 2,3-дикетопиперазинов и
3-морфолиноны соответственно. Кроме того, при использовании стехиометрического количества
TEMPO, 2-алкоксиамино-3-морфолиноны могут быть получены из производных морфолина.
Д. Чаморро-Аренас, У. Осорио-Ньето, Л. Кинтеро, Л. Эрндес-Гарка, Ф.
Sartillo-Piscil, J. Org. хим. , 2018 , 83 ,
15333-15346.
Краткое и практичное протодеборирование арилборных кислот работает в мягких условиях в водном растворе NaClO при 100°C. Стратегия
недорогой, не содержит переходных металлов и оснований.
М. Ли, Ю. Тан, Дж. Гао, Г. Рао, З. Мао, Synlett , 2020 , 31 ,
2039-2042 гг.
Дивергентный и региоселективный синтез либо 3-замещенных бензизоксазолов
или 2-замещенные бензоксазолы из легкодоступного орто- -гидроксиарила
NH кетимины действуют двумя различными путями через общий N-Cl имин.
промежуточное соединение: (а) образование связи NO с образованием бензизоксазола в безводной
условия и (b) опосредованная NaOCl перегруппировка типа Бекмана с образованием
бензоксазола соответственно.
C.-y Chen, T. Andreani, H. Li, Org. лат. , 2011 , 13 , 6300-6303.
Отбеливатель окисляет триметилсилилцианид с образованием электрофильного цианирования.
реагент, который легко реагирует с аминовым нуклеофилом. Это окислительное N -цианирование
реакция позволяет синтезировать дизамещенные цианамиды без использования
токсичные галогениды циана.
К. Чжу, Ж.-Б. Ся, К. Чен, Org. лат. , 2014 , 16 , 247-249.
T3DB: Sodium hypochlorite
| Record Information | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Version | 2. 0 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Creation Date | 2014-10-02 22:26:52 UTC | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Update Date | 2014- 12–24 20:27:00 UTC | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Регистрационный номер | T3D4970 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификация | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Общее название | Гипохлорит натрия | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Класс | Низкомолекулярный | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Описание | Гипохлорит натрия представляет собой натриевую соль хлорноватистой кислоты. При растворении в воде он широко известен как отбеливатель или жидкий отбеливатель и часто используется в качестве дезинфицирующего или отбеливающего средства. Бытовой отбеливатель обычно представляет собой раствор, содержащий 3-8% гипохлорита натрия и 0,01-0,05% гидроксида натрия. Гидроксид натрия используется для замедления разложения гипохлорита натрия на хлорид натрия и хлорат натрия. В быту гипохлорит натрия используется для удаления пятен с белья. Он особенно эффективен для хлопкового волокна, которое легко окрашивается, но хорошо отбеливается.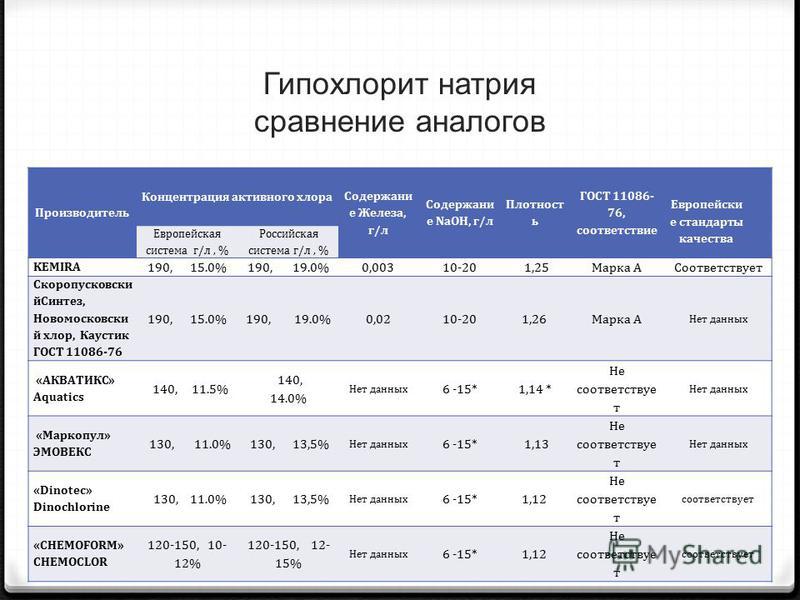 Большая часть гипохлорита натрия продается в виде водных растворов различной концентрации. Большая часть гипохлорита натрия продается в виде водных растворов различной концентрации. | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Тип соединения |
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemical Structure | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonyms |
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemical Formula | ClNaO | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Average Molecular Mass | 74.442 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Monoisotopic Mass | 73.954 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Регистрационный номер CAS | 7681-52-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Название IUPAC | гипохлорит натрия | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Традиционное название | гипохлорит натрия | ||||||||||||||||||||||||||||||||||||||||||||||||||
| SMILES | [Na+]. [O-]Cl [O-]Cl | ||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI Identifier | InChI=1S/ClO.Na/c1-2;/q-1;+1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI Key | InChIKey=SUKJFIGYRHOWBL-UHFFFAOYSA-N | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Химическая таксономия | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Описание | принадлежит к классу неорганических соединений, известных как гипохлориты щелочных металлов. Это неорганические соединения, в которых самым большим оксоанионом является гипохлорит, а самым тяжелым атомом, не входящим в оксоанион, является щелочной металл. | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Kingdom | Inorganic compounds | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Super Class | Mixed metal/non-metal compounds | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Class | Alkali metal oxoanionic compounds | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Sub Class | Alkali metal hypochlorites | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Прямое исходное вещество | Гипохлориты щелочных металлов | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Альтернативные исходные вещества |
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Заместители |
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Molecular Framework | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||||
| External Descriptors |
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Biological Properties | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Status | Detected and Not Quantified | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Origin | Exogenous | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Cellular Locations |
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Biofluid Locations | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Tissue Locations | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Пути |
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Applications | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Биологические роли | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Химические роли | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Состояние | Твердое вещество | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешний вид | Зеленовато-желтое твердое вещество (пентагидрат) или желтая жидкость (как отбеливатель).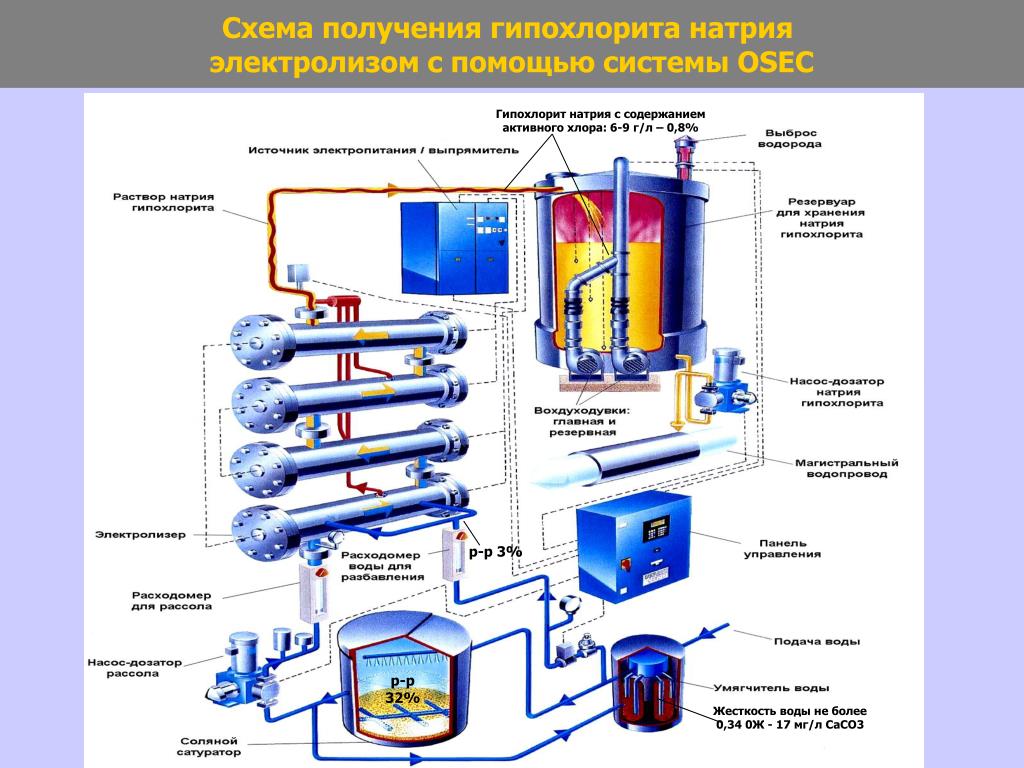 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Experimental Properties |
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Predicted Properties |
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Spectra | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Spectra |
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Toxicity Profile | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Путь воздействия | Кожный | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Механизм токсичности | Гипохлорит натрия является сильным окислителем. Реакции окисления вызывают коррозию, растворы обжигают кожу и вызывают повреждение глаз, особенно при использовании в концентрированных формах. В частности, известно, что гипохорит (HOCl) вызывает посттрансляционные модификации аминокислот в белках, наиболее заметными из которых являются окисление цистеина и метионина. Эти реакции окисления могут привести к широко распространенной агрегации и денатурации белков, что приводит к гибели клеток и повреждению тканей. По оценкам, ежегодно в британских домах происходит около 3300 несчастных случаев, требующих стационарного лечения, вызванных растворами гипохлорита натрия. Недавнее европейское исследование показало, что гипохлорит натрия и органические химические вещества (например, поверхностно-активные вещества, ароматизаторы), содержащиеся в некоторых бытовых чистящих средствах, могут реагировать с образованием хлорированных летучих органических соединений (ЛОС). Некоторые из этих летучих органических соединений являются токсичными и вероятными канцерогенами для человека. Реакции окисления вызывают коррозию, растворы обжигают кожу и вызывают повреждение глаз, особенно при использовании в концентрированных формах. В частности, известно, что гипохорит (HOCl) вызывает посттрансляционные модификации аминокислот в белках, наиболее заметными из которых являются окисление цистеина и метионина. Эти реакции окисления могут привести к широко распространенной агрегации и денатурации белков, что приводит к гибели клеток и повреждению тканей. По оценкам, ежегодно в британских домах происходит около 3300 несчастных случаев, требующих стационарного лечения, вызванных растворами гипохлорита натрия. Недавнее европейское исследование показало, что гипохлорит натрия и органические химические вещества (например, поверхностно-активные вещества, ароматизаторы), содержащиеся в некоторых бытовых чистящих средствах, могут реагировать с образованием хлорированных летучих органических соединений (ЛОС). Некоторые из этих летучих органических соединений являются токсичными и вероятными канцерогенами для человека. Исследование показало, что концентрации в воздухе помещений значительно увеличиваются (в 8-52 раза для хлороформа и в 1-1170 раз для четыреххлористого углерода, соответственно, выше базовых количеств в домашнем хозяйстве) при использовании продуктов, содержащих отбеливатели. Гипохлорит натрия бурно реагирует с аминами и солями аммония. Растворы вступают в реакцию с обычными чистящими средствами, такими как чистящие средства для унитазов, средства для удаления ржавчины, уксус, кислоты, органические вещества и аммиак, с образованием опасных газов, таких как хлор и другие хлорсодержащие вещества. Исследование показало, что концентрации в воздухе помещений значительно увеличиваются (в 8-52 раза для хлороформа и в 1-1170 раз для четыреххлористого углерода, соответственно, выше базовых количеств в домашнем хозяйстве) при использовании продуктов, содержащих отбеливатели. Гипохлорит натрия бурно реагирует с аминами и солями аммония. Растворы вступают в реакцию с обычными чистящими средствами, такими как чистящие средства для унитазов, средства для удаления ржавчины, уксус, кислоты, органические вещества и аммиак, с образованием опасных газов, таких как хлор и другие хлорсодержащие вещества. | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Metabolism | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Toxicity Values | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Lethal Dose | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Carcinogenicity (IARC Classification) | 3, not classifiable as to its carcinogenicity to humans . (1) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Использование/Источники | Гипохлорит натрия часто используется в качестве дезинфицирующего или отбеливающего средства.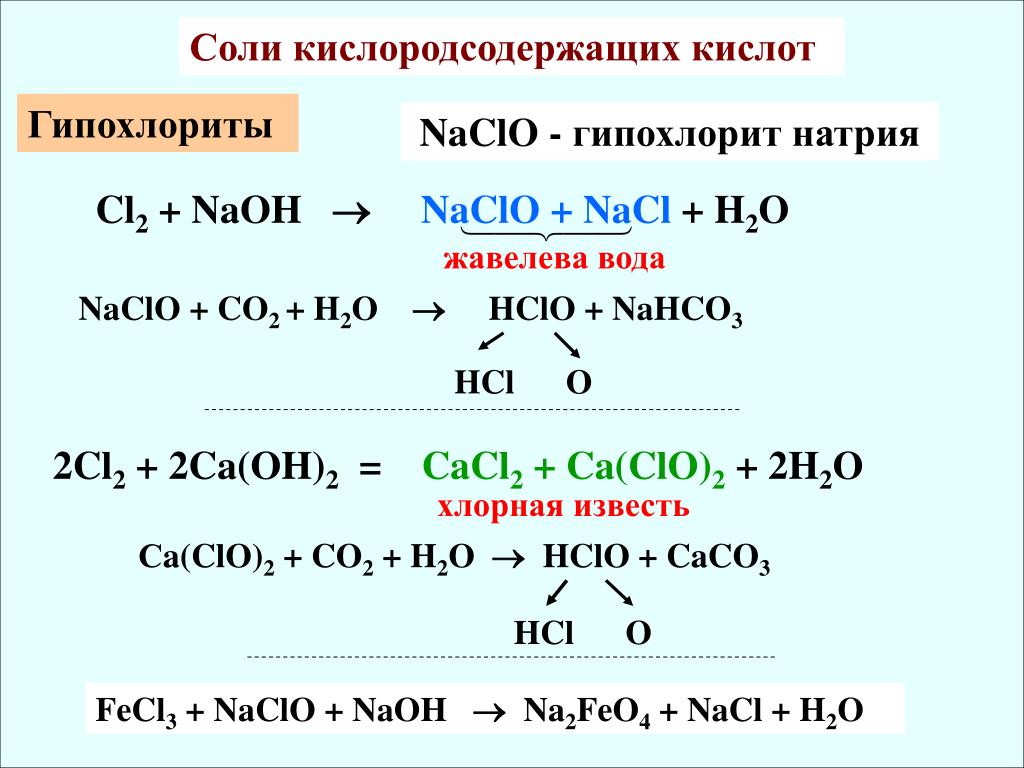 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Минимальный уровень риска | Отсутствует | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Воздействие на здоровье | Хлорный отбеливатель — сильное коррозионное вещество. Растворы гипохлорита натрия часто выделяют небольшое количество газообразного хлора. При вдыхании хлор может вызвать кашель, боль за грудиной, респираторный дистресс, одышку и свистящее дыхание. Симптомы могут проявиться позже. Тошнота и рвота имеют рефлекторное происхождение, а головная боль и потеря сознания, вероятно, обусловлены гипоксией, вызванной отеком легких. Кожный контакт может привести к покраснению, боли и покраснению открытой поверхности. Попадание в глаза может привести к слезотечению. Проглатывание может вызвать отек легких, рвоту или кому. Воздействие на кожу может вызвать сенсибилизацию или другие аллергические реакции. Если глаз не промыть сразу после того, как он подвергся воздействию, может произойти необратимое повреждение глаз. Токсичность, описанная у животных при однократном попадании низких доз (1% раствор) при приеме внутрь, включает мышечную слабость и гипоактивность. Длительное введение соединения в питьевую воду крыс вызывало угнетение иммунной системы. Никаких неблагоприятных изменений не наблюдалось в ходе восьминедельного кожного исследования 1% раствора на морских свинках. Испытания на животных не выявили канцерогенной активности ни при пероральном, ни при кожном путях. Длительное введение соединения в питьевую воду крыс вызывало угнетение иммунной системы. Никаких неблагоприятных изменений не наблюдалось в ходе восьминедельного кожного исследования 1% раствора на морских свинках. Испытания на животных не выявили канцерогенной активности ни при пероральном, ни при кожном путях. | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Симптомы | Нет в наличии | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Лечение | ГЛАЗА: промывать открытые глаза в течение нескольких минут под проточной водой. ПРОГЛАТЫВАНИЕ: не вызывать рвоту. Прополоскать рот водой (никогда ничего не давать в рот человеку, находящемуся без сознания). Немедленно обратитесь за медицинской помощью. КОЖА: следует немедленно обработать путем промывания пораженных участков холодной проточной водой в течение не менее 15 минут с последующим тщательным мытьем водой с мылом. При необходимости человек должен принять душ и сменить загрязненную одежду и обувь, а затем обратиться за медицинской помощью. ВДЫХАНИЕ: приток свежего воздуха. При необходимости обеспечить искусственное дыхание. | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Normal Concentrations | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Not Available | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Abnormal Concentrations | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Not Available | |||||||||||||||||||||||||||||||||||||||||||||||||||
| External Links | |||||||||||||||||||||||||||||||||||||||||||||||||||
| DrugBank ID | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||||
| HMDB ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификатор соединения PubChem | 23665760 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификатор CheMBL | CHEMBL1334078 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ChemSpider ID | 22756 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| KEGG ID | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||||
| UniProt ID | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||||
| OMIM ID | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI ID | 32146 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| BioCyc ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||
| CTD ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ID стежка | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||
| PDB ID | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ACToR ID | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikipedia Link | Sodium hypochlorite | ||||||||||||||||||||||||||||||||||||||||||||||||||
| References | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Synthesis Reference | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||||
| MSDS | Not Доступно | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Общие ссылки |
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Gene Regulation | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Up-Regulated Genes | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Down-Regulated Genes | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||||
Sodium Hypochlorite: Formula, Where It Is Found, Uses and Properties
He Гипохлорит натрия Трехкомпонентная неорганическая соль натрия. Коммерчески это достигается в виде водных растворов и является активным агентом этих бытовых и промышленных продуктов. Эти растворы известны под названиями хлорный отбеливатель, содовый отбеливатель, жидкий отбеливатель или даже более очищенный ликер Жавель.
В воде гипохлорит натрия проявляет те же окислительные свойства, что и газообразный хлор, поэтому раствор этой соли эквивалентен ношению указанного соединения в пластиковой бутылке. Фактически доступный хлор в этих контейнерах является показателем концентрации и отбеливающей способности раствора гипохлорита натрия.
Эта тройная соль в воде вполне может рассматриваться как простой водный раствор хлора; однако существуют и другие доступные формы, такие как твердая форма в случае гипохлорита кальция и жидкий хлор. Все три обладают одинаковой окислительной способностью, и их использование зависит от таких переменных, как комфорт, производительность или время.
Индекс
- 1 Формула
- 2 Где она?
- 3 Как это делается?
- 4 Применение
- 5 Свойства
- 5,1 Водный баланс
- 5,2 Дипропорция
- 5,3 Окислительный агент
- 6 Ссылки

В формуле указана доля ионов в ангидридном состоянии, которая равна 1:1. Однако это касается только ангидрида.
В случае гидратированного гипохлорита натрия — одной из наиболее стабильных форм этой соли — его химическая формула NaClO · 5H 2 ИЛИ.
Где это?NaClO является синтетическим продуктом и из-за своей реакционной способности встречается только в тех регионах, где он используется, особенно в сточных водах, почве или даже в выделениях питьевой воды.
В человеческом организме много ионов хлора, которые могут участвовать в окислительно-восстановительных реакциях с образованием гипохлорита натрия в организме.
Как это делается? На протяжении всей истории NaClO получали несколькими способами. Самый простой состоит из раствора хлора в воде или в растворах Na 2 CO 3 , выделяющие CO 2 под действием хлорноватистой кислоты (HClO).
В других методах в качестве сырья используется морская вода посредством электролитического процесса. При эффективном механическом перемешивании Cl 2 и NaOH, образованный NaCl и водой, реагируют и превращаются в NaClO:
Cl 2 (г) + 2NaOH (водн.) => NaClO + NaCl + H 2 O + QUE ( тепло)
В настоящее время процесс Хукера производит это соединение в больших масштабах, который представляет собой улучшенную версию описанного ранее метода.
Приложения— Гипохлорит натрия используется в качестве отбеливателя в текстиле, в моющих средствах, которые его содержат, и в бумажной промышленности.
— Его применение в качестве бактерицидного и дезинфицирующего средства очень широко, он используется для очистки воды и очистки сточных вод.
— Его полезность для дезинфекции оборудования, используемого при приготовлении пищи и переработке фруктов и овощей, известна. Точно так же он используется с той же дезинфицирующей функцией при производстве грибов, крупного рогатого скота, свиней и птицы.
— Гипохлорит натрия используется в нефтяной промышленности на стадии переработки.
— В быту отбеливающую способность гипохлорита натрия используют при стирке белья, а дезинфицирующее действие — при мытье ванных комнат, полов и т.п.
— Гипохлорит натрия применяют в эндодонтической терапии, конкретно при лечении корневой канал зуба. При этом лечении используется раствор Дакина (0,5% ClONa), который сохраняет живую ткань зуба за счет растворения некротизированной ткани.
НедвижимостьРастворы гипохлорита натрия при комнатной температуре бесцветны и имеют сладкий запах хлора. Физические свойства изменяются в зависимости от концентрации соли, растворенной в воде. Все имеют желтую окраску.
Используя методы кристаллизации, эти растворы дают твердый NaClO · 5H 2 Or, чьи кристаллы бледно-зеленые. Эта гидратированная соль имеет приблизительную молекулярную массу 164 г/моль, плотность 1,11 г/мл, хорошо растворима в воде и разлагается при 101°С. NaClO · 5H 2 Или также чувствителен к тем же реакциям ангидрида.
NaClO · 5H 2 Или также чувствителен к тем же реакциям ангидрида.
Почему пентагидрат соли? Когда NaClO кристаллизуется в водной среде, молекулы воды окружают ионы в водной сфере. Можно предположить, что три из этих молекул взаимодействуют с неподеленными электронными парами Cl: одна образует водородную связь с OÂ, а последняя притягивается Na.
Однако верный ответ на этот вопрос дают исследования кристаллической структуры этого твердого тела.
Водный балансАнион ClO — участвует в следующем балансе гидролиза:
HClO (а.с.) + H 2 O (ж) ClO — (а.с.) + 1 H )
Если кислотность раствора увеличивается, равновесие смещается влево с образованием HClO.
Эта кислота еще более нестабильна, чем гипохлорит, поэтому при разложении снижается концентрация действующего вещества. Если рН щелочной (больше 11), это гарантирует наличие ClO — и срок службы продукта.
Однако чрезмерная щелочность вызывает другие проблемы при его применении. Например, очень простой раствор NaClO повреждает одежду, а не просто отбеливает ее.
Аналогично, в водной среде HClO также превращается в хлор, что объясняет желтую окраску этих растворов:
HClO (ак) Cl 2 (г) + H 2 O (л)
ДиспропорцияАтом хлора в гипохлорите натрия имеет степень окисления +1, и для завершения его валентного октета требуется всего два электрона.
С другой стороны, его электронная конфигурация [Ne] 3s 2 3p 5 также способна освободить все электроны своих «p»-орбиталей, более энергичных.
Это приводит к тому, что гипохлорит подвергается реакциям диспропорционирования в ионах со степенями окисления +1 и +5:
3ClO — (а.с.) 2Cl — (а.с.) + ClO 3 — (а.с.)
Эта реакция в водном растворе ускоряется при повышении температуры и концентрации гипохлорита. Точно так же реакция протекает по другому механизму, катализируемому легкими и оксидами металлов меди, никеля и кобальта:
Точно так же реакция протекает по другому механизму, катализируемому легкими и оксидами металлов меди, никеля и кобальта:
2NaOCl (водн.) => O 2 (г) + 2NaCl (водн.)
Безводный NaClO диспропорционирует при намного быстрее, даже взрываясь.
ОкислительАтом хлора может принимать электроны от отрицательных (нуклеофильных) частиц. Ангидрид — сильный окислитель, восстанавливающий хлорид-анионы (Cl —).
В случае NaClO · 5H 2 Или, считается, что молекулы воды частично предотвращают ClO — они подвергаются нуклеофильным атакам.
Однако, учитывая структурную линейность ClO — , эти молекулы воды недостаточно замедляют «атаки» на атом Cl. Именно по этой причине гипохлорит натрия является сильным окислителем.
Ссылки- Википедия. (2018). Гипохлорит натрия. Получено 7 апреля 2018 г. с сайта: en.wikipedia.org
- Франсиско Дж.
 Арнаис. (2016). Эксперименты для Зеленой лаборатории неорганической химии. Химический факультет Университета Бургоса, Испания.
Арнаис. (2016). Эксперименты для Зеленой лаборатории неорганической химии. Химический факультет Университета Бургоса, Испания. - Химическая книга. (2017). Гипохлорит натрия. Получено 7 апреля 2018 г. с сайта:chemicalbook.com
- Брайан Клегг. (9 марта 2016 г.). Гипохлорит натрия. Получено 7 апреля 2018 г. с сайта: chemistryworld.com
- Оксихим. (декабрь 2014 г.). Справочник по гипохлориту натрия. Получено 7 апреля 2018 г. с сайта oxy.com
- Azchemistry (18 апреля 2017 г.). 10 Использование гипохлорита натрия в повседневной жизни — Лаборатория — Больница. Получено 7 апреля 2018 г. с сайта azchemistry.com
- PubChem. (2018). Гипохлорит натрия. Получено 7 апреля 2018 г. с сайта: pubchem.ncbi.nlm.nih.gov.
Загрузка ..
Опасен ли гипохлорит натрия
Дэвид
Здоровый образ жизни
Гипохлорит натрия – неорганическое соединение, натриевая соль хлорноватистой кислоты, относящаяся к категории производных щелочи и хлора. Его химическое название – гипохлорит натрия (I). Формула гипохлорита натрия представлена в виде NaOCl. Его получают насыщением водного раствора едкого натра, т. е. NaOH и щелочных металлов, хлором. В чистом виде соединение очень нестабильно, поэтому его используют в виде водного раствора и только такой имеется в продаже.
Его химическое название – гипохлорит натрия (I). Формула гипохлорита натрия представлена в виде NaOCl. Его получают насыщением водного раствора едкого натра, т. е. NaOH и щелочных металлов, хлором. В чистом виде соединение очень нестабильно, поэтому его используют в виде водного раствора и только такой имеется в продаже.
- Раствор гипохлорита натрия
- Гипохлорит натрия — применение
- Гипохлорит натрия для обеззараживания воды
- Гипохлорит натрия в пищевых производствах
- Гипохлорит натрия — вреден ли он?
Раствор гипохлорита натрия
Водный раствор гипохлорита натрия имеет соломенный или желто-зеленый цвет и резкий, легко узнаваемый запах хлора. Свойства гипохлорита натрия включают коррозионные, окисляющие, бактерицидные и антисептические свойства. Действует как отбеливающее, моющее и биоцидное средство, входит в состав дезинфицирующих препаратов, сырья и промежуточного продукта для химического синтеза. Гипохлорит натрия является опасным веществом. Концентрат обладает коррозионным действием и опасен для окружающей среды. Это соединение можно купить в магазинах промышленной химии, но продается оно только специализированным компаниям.
Гипохлорит натрия является опасным веществом. Концентрат обладает коррозионным действием и опасен для окружающей среды. Это соединение можно купить в магазинах промышленной химии, но продается оно только специализированным компаниям.
Гипохлорит натрия в основном используется там, где требуется отбеливающий, антисептический и дезинфицирующий эффект. Используется в
- производстве бытовой химии
- отбеливатели в текстильно-бумажной промышленности
- дезинфекция питьевой воды
- уборка бытовых и промышленных отходов
- дезинфекция систем, трубопроводов и резервуаров в молочной промышленности
- уборка предприятий по производству пива и вина 903:50
- фунгицидная и бактерицидная обработка зерна, фруктов и овощей
- дезинфекция технических помещений
- производство модифицированного крахмала
- промышленный органический синтез
Очистка технической воды и обеззараживание питьевой воды гипохлоритом натрия является одним из его основных применений. Биоцидное действие гипохлорита натрия позволяет удалять грибки и болезнетворные бактерии, в том числе Escherichia coli , которая при определенных условиях вызывает отравление пищеварительного тракта.
Биоцидное действие гипохлорита натрия позволяет удалять грибки и болезнетворные бактерии, в том числе Escherichia coli , которая при определенных условиях вызывает отравление пищеварительного тракта.
Дезинфекция воды гипохлоритом натрия очень распространена. Запах хлора, столь характерный для бассейнов и аквапарков, исходит от гипохлорита натрия, используемого там для дезинфекции воды. Вещество используется как в аквапарках, спортивных бассейнах, так и в СПА-салонах.
Гипохлорит натрия в производстве продуктов питанияГипохлорит натрия в садоводстве обычно используется при выращивании фруктовых деревьев и виноградников. Применяется для профилактики болезней плодовых деревьев. Как использовать гипохлорит натрия в качестве фунгицида? Опрыскивают 3% раствором весной, когда деревья еще не покрыты листвой. Это очень эффективный метод профилактики и лечения рака плодовых деревьев.
Гипохлорит натрия – вреден ли он? Гипохлорит натрия, используемый в виде концентрированного раствора, очень опасен, поскольку обладает коррозионным действием. Вызывает поражение тканей, с которыми соприкасается – кожи, глаз, слизистых оболочек, внутренних органов. При использовании раствора необходимо носить защитную одежду, перчатки и очки. Пары гипохлорита натрия также обладают раздражающим действием.
Вызывает поражение тканей, с которыми соприкасается – кожи, глаз, слизистых оболочек, внутренних органов. При использовании раствора необходимо носить защитную одежду, перчатки и очки. Пары гипохлорита натрия также обладают раздражающим действием.
Гипохлорит натрия в пищевых продуктах может быть вреден для людей с аллергией или повышенной чувствительностью к хлору. Побочные эффекты, связанные с его применением на коже, включают покраснение, зуд и жжение. Дозировка гипохлорита натрия для мытья овощей и фруктов подобрана таким образом, чтобы полностью предотвратить отравление. Последствия проглатывания и контакта с гипохлоритом натрия во время беременности и кормления грудью не изучались. Беременным и кормящим женщинам следует избегать этого вещества любой ценой.
Теги: химия, гипохлорит, натрий, Гипохлорит натрия
Автор Дэвид
Я выпускник курса физического воспитания Западного университета медицинских наук. Большой личный опыт диетологии и занятий прекрасно дополняет мои школьные знания. Я тренер второго класса по гребле на каноэ. Инструктор по плаванию, гимнастике, легкой атлетике и пилатесу. 16 лет занимаюсь греблей на каноэ — завоевал много медалей на международных соревнованиях.
Я тренер второго класса по гребле на каноэ. Инструктор по плаванию, гимнастике, легкой атлетике и пилатесу. 16 лет занимаюсь греблей на каноэ — завоевал много медалей на международных соревнованиях.
гипохлорит натрия
| Гипохлорит натрия | |
|---|---|
| Другие названия | Хлорат натрия(I) |
| Идентификаторы | |
| CAS-номер | 7681-52-9 |
| Недвижимость | |
| Молекулярная формула | NaOCl |
| Молярная масса | 74,44 г/моль |
| Температура плавления | 18°C Пентагидрат |
| Точка кипения | 101°C Разлагается |
| Растворимость в воде | Полностью смешивается |
| Опасности | |
| Классификация ЕС | Едкий ( C ) Опасный для окружающей среды ( N ) |
| Фразы риска | Р31, Р34, Р50 |
| S-фразы | С1/2, С28, С45, С50, С61 |
| Родственные соединения | |
| Прочие анионы | Хлорид натрия Хлорит натрия Хлорат натрия Перхлорат натрия |
| Прочие катионы | Гипохлорит лития Гипохлорит кальция |
| Родственные соединения | Хлорноватистая кислота |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 °C, 100 кПа) Заявление об отказе от ответственности и ссылки на информационные блоки | |
Гипохлорит натрия представляет собой химическое соединение с формулой NaOCl. Раствор гипохлорита натрия, широко известный как отбеливатель, часто используется в качестве дезинфицирующего средства и отбеливателя.
Раствор гипохлорита натрия, широко известный как отбеливатель, часто используется в качестве дезинфицирующего средства и отбеливателя.
Дополнительные рекомендуемые знания
Содержание
|
Производство
Гипохлорит натрия может быть получен путем поглощения газообразного хлора холодным раствором гидроксида натрия:
- 2NaOH + Cl 2 → NaCl + NaClO + H 2 О
Гидроксид натрия и хлор в промышленных масштабах производятся хлорно-щелочным процессом, и нет необходимости их выделения для получения гипохлорита натрия. Следовательно, NaClO получают в промышленных масштабах путем электролиза раствора хлорида натрия с минимальным разделением между анодом и катодом. Раствор должен поддерживаться при температуре ниже 40 °C (с помощью охлаждающих змеевиков), чтобы предотвратить образование хлората натрия.
Раствор должен поддерживаться при температуре ниже 40 °C (с помощью охлаждающих змеевиков), чтобы предотвратить образование хлората натрия.
Коммерческие растворы всегда содержат значительное количество хлорида натрия (поваренной соли) в качестве основного побочного продукта, как видно из приведенного выше уравнения.
Упаковка и продажа
Бытовой отбеливатель, продаваемый для стирки одежды, на момент производства представляет собой 3-6% раствор гипохлорита натрия. Прочность варьируется от одной рецептуры к другой и постепенно снижается при длительном хранении.
12% раствор широко [ нужна ссылка ] используется в системах водоснабжения для хлорирования воды. Высокоактивный гипохлорит (HTH) продается для хлорирования плавательных бассейнов и содержит примерно 30% гипохлорита кальция. Кристаллическая соль также продается для тех же целей; эта соль обычно содержит менее 50% гипохлорита кальция. Однако уровень «активного хлора» может быть намного выше.
Его также можно найти на прилавках магазинов в составе «Ежедневных дезинфицирующих спреев» в качестве единственного активного ингредиента в концентрации 0,0095%.
Использование
В форме бытового отбеливателя гипохлорит натрия используется для удаления пятен с белья. Он особенно эффективен для хлопкового волокна, которое легко окрашивается, но хорошо отбеливается. Для стиральной машины стандартного размера обычно рекомендуется от 50 до 250 мл на загрузку. Свойства бытового отбеливателя, которые делают его эффективным для удаления пятен, также приводят к кумулятивному повреждению органических волокон, таких как хлопок, и срок службы этих материалов будет сокращен при регулярном отбеливании. Гидроксид натрия (NaOH), который также содержится в бытовых отбеливателях (как будет отмечено ниже), также вызывает деградацию волокна. Он не является летучим, и остаточные количества NaOH, не вымытые, будут продолжать медленно разлагать органические волокна в присутствии влаги. По этим причинам, если пятна локализованы, по возможности следует рассматривать точечную обработку. С соблюдением мер предосторожности последующая обработка слабыми органическими кислотами, такими как уксусная кислота (уксус), нейтрализует NaOH и улетучивает хлор из остаточного гипохлорита. Старые футболки и хлопчатобумажные простыни, которые легко рвутся, демонстрируют затраты на стирку с бытовым отбеливателем. Горячая вода увеличивает активность отбеливателя из-за термического разложения гипохлорита, что в конечном итоге приводит к образованию нежелательных для окружающей среды хлоратов.
По этим причинам, если пятна локализованы, по возможности следует рассматривать точечную обработку. С соблюдением мер предосторожности последующая обработка слабыми органическими кислотами, такими как уксусная кислота (уксус), нейтрализует NaOH и улетучивает хлор из остаточного гипохлорита. Старые футболки и хлопчатобумажные простыни, которые легко рвутся, демонстрируют затраты на стирку с бытовым отбеливателем. Горячая вода увеличивает активность отбеливателя из-за термического разложения гипохлорита, что в конечном итоге приводит к образованию нежелательных для окружающей среды хлоратов.
Слабый раствор 1% бытового отбеливателя в теплой воде используется для дезинфекции гладких поверхностей перед приготовлением пива или вина. Поверхности необходимо промыть, чтобы избежать придания аромата напитку; эти хлорированные побочные продукты дезинфекции поверхностей также вредны.
Постановления правительства США (21 CFR, часть 178) разрешают дезинфицировать оборудование для обработки пищевых продуктов и поверхности, контактирующие с пищевыми продуктами, с помощью растворов, содержащих отбеливатель, при условии, что раствор достаточно стечет перед контактом с пищевыми продуктами, и растворы не превышают 200 частей на миллион ( частей на миллион) доступного хлора (например, одна столовая ложка обычного бытового отбеливателя, содержащего 5,25% гипохлорита натрия, на галлон воды). При использовании более высоких концентраций поверхность необходимо промыть питьевой водой после дезинфекции.
При использовании более высоких концентраций поверхность необходимо промыть питьевой водой после дезинфекции.
Разведение бытового отбеливателя с водой в пропорции 1 к 5 (1 часть отбеливателя на 4 части воды) эффективен против многих бактерий и некоторых вирусов и часто является предпочтительным дезинфицирующим средством при очистке поверхностей в больницах (преимущественно в США). Раствор вызывает коррозию, и после этого его необходимо тщательно удалить, поэтому за дезинфекцией отбеливателем иногда следует дезинфекция этанолом.
Для шокового хлорирования колодцев или водопроводных систем применяют 2% раствор хлорной извести. Для более крупных систем более практичным является HTH, поскольку можно использовать более низкие скорости. Щелочность раствора гипохлорита натрия также вызывает осаждение минералов, таких как карбонат кальция, так что ударное хлорирование часто сопровождается эффектом засорения. Осадок также сохраняет бактерии, что делает эту практику несколько менее эффективной.
Гипохлорит натрия использовался для дезинфекции питьевой воды в концентрации, эквивалентной примерно 1 литру бытового отбеливателя на 4000 литров воды. Точное требуемое количество зависит от химического состава воды, температуры, времени контакта и наличия или отсутствия осадка. В крупномасштабных применениях измеряется остаточный хлор для титрования надлежащей скорости дозирования. Для экстренной дезинфекции Агентство по охране окружающей среды США рекомендует использовать 2 капли бытового отбеливателя с концентрацией 5% переменного тока на литр воды. Если обработанная вода не пахнет хлоркой, необходимо добавить еще 2 капли.
Использование дезинфицирующих средств на основе хлора в бытовой воде, хотя и широко распространено, вызвало некоторые споры из-за образования небольшого количества вредных побочных продуктов, таких как хлороформ.
Также используется в стоматологии при лечении корневых каналов, дезинфекции канала и растворении оставшейся ткани пульпы. Исторически использовался раствор Генри Дрисдейла Дакина (0,5%).
В настоящее время применяют 2,5-5,25% растворы.
Исторически использовался раствор Генри Дрисдейла Дакина (0,5%).
В настоящее время применяют 2,5-5,25% растворы.
Щелочной раствор (pH 11,0) гипохлорита натрия используется для обработки разбавленных (
Механизм действия
См. Хлорноватистая кислота
Предостережения
Гипохлорит натрия является сильным окислителем. Продукты окислительных реакций вызывают коррозию. Растворы обжигают кожу и вызывают повреждение глаз, особенно при использовании в концентрированных формах. Однако, как признано NFPA, только растворы, содержащие более 40% гипохлорита натрия по весу, считаются опасными окислителями. Растворы менее 40% классифицируются как умеренно опасные окислители (NFPA 430, 2000).
Бытовые отбеливатели и растворы хлораторов для бассейнов обычно стабилизируются щелочью (каустической содой, NaOH) в значительной концентрации в ходе производственной реакции. Попадание на кожу вызывает едкое раздражение или ожоги из-за обезжиривания и омыления кожных масел и разрушения тканей. Скользкое ощущение отбеливателя на коже связано с этим процессом.
Скользкое ощущение отбеливателя на коже связано с этим процессом.
Тиосульфат натрия (гипо) является эффективным нейтрализатором хлора. Ополаскивание раствором 5 мг/л с последующим мытьем водой с мылом быстро устраняет запах хлора с рук.
Хлорирование питьевой воды может окислять органические загрязнители с образованием тригалометанов (также называемых галоформами), которые являются канцерогенными. Степень создаваемой таким образом опасности является предметом разногласий.
Смешивание отбеливателя с некоторыми бытовыми чистящими средствами может быть опасным. Например, при смешивании кислотного очистителя с отбеливателем на основе гипохлорита натрия образуется газообразный хлор. При смешивании с растворами аммиака (включая мочу) образуются хлорамины. И газообразный хлор, и газообразный хлорамин токсичны. Отбеливатель может бурно реагировать с перекисью водорода и выделять газообразный кислород: [1]
- H 2 O 2 (aqueous) + NaClO (aqueous) → NaCl (aqueous) + H 2 O (liquid) + O 2 (gas)
It По оценкам, ежегодно в британских домах происходит около 3300 несчастных случаев, требующих стационарного лечения, вызванных растворами гипохлорита натрия (RoSPA, 2002).


 Для получения выгодного ценового предложения, оставьте заявку на сайте или позвоните по телефону: +7 (812) 448-47-55.
Для получения выгодного ценового предложения, оставьте заявку на сайте или позвоните по телефону: +7 (812) 448-47-55. 58 m³·mol⁻¹
58 m³·mol⁻¹ Монографии IARC по оценке канцерогенных рисков для человека. [ссылка]
Монографии IARC по оценке канцерогенных рисков для человека. [ссылка] Арнаис. (2016). Эксперименты для Зеленой лаборатории неорганической химии. Химический факультет Университета Бургоса, Испания.
Арнаис. (2016). Эксперименты для Зеленой лаборатории неорганической химии. Химический факультет Университета Бургоса, Испания.